'ÿçêè ç
äåê³ëüêîìà
ñåãìåíòàìè
쳺ë³íó ê³ëüêîõ
àêñîí³â; ïðè
öüîìó äî
àêñîíà
ïðèºäíóºòüñÿ
â³äðîñòîê
îë³ãîäåíäðîãë³îöèòó,
ðîçòàøîâàíîãî
íà äåÿê³é
â³äñòàí³ â³ä
àêñîíà, à
çîâí³øíÿ
ïîâåðõíÿ
쳺ë³íó
êîíòàêòóº ç
ïîçàêë³òèííèì
ïðîñòîðîì. Øâàí³âñüêà
êë³òèíà ïðè
óòâîðåíí³
쳺ë³íó ÏÍÑ
ôîðìóº
ñï³ðàëüí³
ïëàñòèíêè
쳺ë³íó òà
â³äïîâ³äàº
ëèøå çà
îêðåìó
ä³ëÿíêó îáîëîíêè
ì³æ перехватами
<#"877695.files/image002.jpg">
Рис. 2.1.
Хронічна ішемія головного мозку
Виділяють
декілька груп патогенетичних факторів, в результаті яких розвивається ішемія
мозку:
А) морфологічні
зміни судин, які забезпечують кров'ю тканину мозку - аномалії великих
церебральних судин, оклюзуючі ураження (атеросклеротичні бляшки (рис. 2.2),
тривалий спазм судини, підвищене тромбоутворення), порушення конфігурації та
форми судин (аневризми, вроджені вади судинної стінки та судинні мальформації);
Б) зміни
фізико-біохімічних показників крові та систему гомеостазу - підвищене згортання
крові та збільшення агрегації формених елементів зі схильністю до
тромбоутворення, зміна вмісту білкових фракцій (диспротеїнемії), зміни
електролітного складу крові (при патології нирок чи ендокринних захворюваннях);
В) розлади
загальної та церебральної гемодинаміки, які сприяють зниженню інтенсивності
мозкового кровообігу - серцево-судинні захворювання в стадії декомпенсації,
тяжкі анемії, токсичні ураження;
Г) вікові та
індивідуальні особливості метаболізму нейронів з різною реакцією на локальне
обмеження мозкового кровотоку [17].
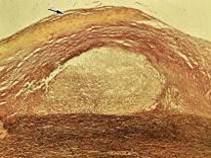
Рис. 2.2. Атеросклеротична
бляшка у серединній мозковій артерії (у центрі)
.2 Види ішемічних мозкових
ушкоджень
Незалежно від
причини ішемічного ушкодження нейронів результатом є виникнення осередку
фокальної (точкової) ішемії - ішемічного інсульту або прогресуючої дисфункції
головного мозку. Хронічна ішемія формується при тривалій недостатності
кровообігу тканини мозку внаслідок ушкодження нейронів [18].
Ішемія мозку
буває глобальною чи осередковою (локальною). У свою чергу, глобальна ішемія
може бути незворотньою, наростаючою й транзиторною (перехідною). Так, глобальна та незворотня ішемія мозку характерні для
передлетального стану мозга. Глобальна наростаюча ішемія спостерігається за
умов агонії. У результаті цих двох типів глобальної ішемії у мозковій тканині
розвиваются аутолітичні процеси [19].
Виділяють також
транзиторні (перехідні) порушення мозгового кровообігу, прояви яких лежать в
основі передінсультних станів і виникають раптово. До них відносять: сильний
головний біль, запаморочення, порушення зору (при цьому втрачається половина
зорового поля чи може має місце повна втрата зору), розлади другої сигнальної
системи (мовлення), порушення орієнтувальних рефлексів, зниження пам'яті тощо.
Основним
етіологічним фактором розвитком хронічної ішемії мозку є поєднання артеріальної
гіпертензії з атеросклеротичним ураженням церебральних судин. За умов
атеросклерозу холестеринові бляшки трансформуються в тромби. Останні -
облітеруючий фактор для судин. При відриві частини бляшки спостерігається оклюзія
судини, що, у свою чергу, призводить до ішемізації певної ділянки мозку з
наступним формуванням патологічного осередку загиблих внаслідок острої гіпоксії
клітин [20].
У результаті
повільного прогресування хронічної ішемії формуються зони ураження дрібних
артерій та/або великих артеріальних стовбурів. При ураженні артеріол
розвивається осередкове чи дифузне пошкодження тканини мозку у вигляді
мікроінфарктів. Патологічні зміни великих артерій - причина територіальних
(генералізованих) мозкових інфарктів [21] (рис. 2. 3 та рис. 2.4).
.3 Вплив
гіпоксія-індукованого фактору на стан мієліну
Як було зазначено вище, мієлінові
мембрани - обов'язкова складова нервової тканини, ключовою функцією яких є
інтеграція передачі нервового збудження. По-перше, так досягається сальтаторна
(прискорена) трансдукція сигналу від нейрону до виконавчої (ефекторної) клітини
(нейро-ефекторна комунікація). По-друге, завдяки наявності специфічних
гідрофобних білків мієлінова оболонка стабілізує аксони, регулюючи поширення
потенціалу дії за колатеральним (аксон одного нейрону → колатеральний
(лінкерний) відросток → аксон другого нейрону) та ортодромним (дендрит →
сома нейрону → аксон → клітина-ефектор) механізмами.
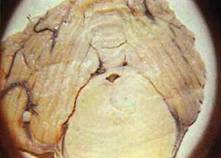
Рис. 2.3. Фронтальний зріз на рівні передньої третини варолієвого мосту.
Джерело ішемічного інфаркту мосту, що розвинувся в результаті травматизації
скроневої долі головного мозку
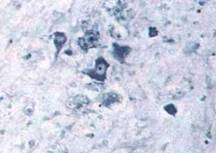
Рис. 2.4. Некроз нейронів у периферичних ділянках інфаркту мозку, х200
(забарвлення за Нісслем)
За умов фокальної ішемії,
коли тільки формується осередок ураження, метаболізм ендотелію та астроглії
змінюється. Ендотеліоцити починають синтезувати у високих концентраціях
гіпоксія-індукований факор HIF-1α (hypoxia-inducible
factor 1-alpha, фактор,
індукований гіпоксією) (рис. 2.5).
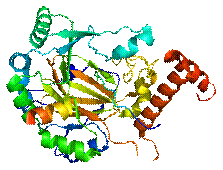
Рис. 2.5. Структура фактору,
індукованого гіпоксією (HIF-1α)
За допомогою полімеразної
ланцюгової реакції (ПЦР) встановлено, що за експресію HIF-1α відповідає
ген hif1A, який у людей міститься на 14-й, у
мишовидних гризунів - на 12-й хромосомі. Експресія гену hif1A регулюється ядерним транскрипційним фактором NF-κB [22, 23].
Для HIF-1α властива
пара- та аутокринна дія. Показано, що він за допомогою спеціальних транспортних
білків може переноситися на клітини, які тісно межують з ендотелієм.
Продемонстровано, що астроглія та інші типи гліоцитів також здатні продукувати
HIF-1α.
Гіпоксія-індукований
фактор у невеликих концентраціях підвищує резистентність клітин до кисневого
голодування, проте його надлишок знижує метаболічний потенціал останніх, що
може призвести до некрозу ішемізованих тканин.
HIF-1α - це
транскрипційний регуляторний фактор, який є гетеродимером і складається з двох
субодиниць: α
і
β.
Субодиниця
β
є
спеціальним рецепторним комплексом Arnt
<#"877695.files/image007.jpg">
Рис. 2.6. мРНК основного
білка мієліну (третинна структура)
Дослідженнями [29] та [30]
вперше продемонстровано різке зниження рівня ОБМ та білкової мРНК, характерне
для початкових етапів ішемічного ушкодження мозку мишей (церебральної ішемії),
викликаного високими концентраціями адреналіну (при підшкірному або
внутрішньочеревному введенні) чи механічним шляхом (при оклюзії серединної
мозкової артерії). Ішемічно-гіпоксичний стан мозку індукує загибель
олігодендрогліальних клітин з наступною демієлінізацією аксонів. При цьому
порушується структура гемато-енцефалічного бар'єру, що, у свою чергу,
призводить до вивільнення ОБМ у кров [31].
Мінімальні показники протеїну
виявлені на першу-другу ішемічну добу впродовж терміну ішемічної експозиції.
Так, показано, що експресія ОБМ мРНК та самого білка суттєво зменшується на
23-24-ту годину церебрального ішемічного ушкодження в ішемізованих ділянках,
проте підсилюється в периішемічних зонах (зонах, розташованих поряд з
ішемізованою ділянкою) [32]. На 7-му добу спостерігається стійке підвищення
вмісту ОБМ практично у всіх відділах мозку, що свідчить про поступову
регенерацію мієлінових оболонок. Доведено, що підвищення експресії протеїну
можна викликати штучним шляхом - введенням речовин-нейропротекторів -
доксицикліну, корвітину (рис. 2.7), енцефаболу [33], α-кетоглутарату
та пікрозиду II [34, 35].

Рис. 2.7. Нейропротекторні
препарати: А - доксициклін; Б - корвітин (кверцетин)
.5 ОБМ - важливий діагностичний
показник ішемічного ушкодження мозку
Першими дослідженнями,
пов'язаними з вивченням ролі ОБМ як маркера ушкодження мієліну при ішемічному
інсульті, були роботи В.І. Скворцової та Т.П. Клюшник (1999) [36]. У 2000-2007
р.р. аналогічні експерименти були проведені російським фізіологом Є.І. Гусєвим
[37-45].
Вивчаючи рівень білка у
сироватці крові та лікворі хворих на ішемічний інсульт, Гусєв та його
послідовники виявили наступні закономірності:
. При дослідженні змісту
основного білка мієліну (ОБМ) і аутоантитіл до нього в цереброспинальній рідини
і сироватці крові 25 хворих з ішемічним інсультом показана значна
варіабельність величин концентрації білка в 1-у добу інсульту. За виявленими
результатами усі пацієнти були розділені на 3 групи [38].
. У пацієнтів першої
групи вміст ОБМ на початкових етапах захворювання коливався у межах норми,
однак до 3-ї доби з моменту вступу до стаціонару зростав в середньому на 238%.
Для хворих другої групи були характерні нормальний рівень ОБМ в 1-у добу і
різке (на 130%) його наростання до 3-ї доби. У пацієнтів третьої групи вміст
ОБМ значно (в 15-20 разів) перевищував норму і продовжував збільшуватися до 3-ї
доби [38].
. Порівняння отриманих
показників встановило залежність ступеня підвищення вмісту ОБМ від локалізації
та поширеності вогнища ішемії. У всіх хворих першої групи при
магнітно-резонансній томографії (МРТ) головного мозку були виявлені зони
обмежених (локальних) коркових інфарктів (об'єм ушкодженої зони склав менше 5
см3). У хворих
другої групи виявлялися поширені корково-підкіркові вогнища (більше 25 см3)
або інфаркти в білій речовині мозку невеликих розмірів (до 5 см3)
[38, 39].
Високий вміст ОБМ при
надходженні до стаціонару спостерігався у пацієнтів з генералізованими (більше
15 см3) підкірковими вогнищами ішемії. При цьому кореляційний
зв'язку між концентрацією білка і тяжкістю інсульту, варіантом його
патогенетичного розвитку не виявлено [38].
Таким чином, лише до 3-ї
доби інсульту у всіх хворих відзначалося підвищення вмісту ОБМ в
цереброспинальній рідини (лікворі), тоді як збільшення концентрації іншого
маркеру - астроцитспецифічного кальційзв'язуючого білка S100β - реєструвалося
вже в перші години після ішемії. Така відмінність, можливо, відображає особливості
метаболізму досліджуваних білків [38, 40].
Чутливий до змін
кальцієвого гомеостазу білок S100β одним з перших реагує на гостру ішемію мозку. Наростання його
концентрації в цереброспінальній рідині за термінами приблизно відповідає
розгортанню реакцій глутамат-кальцієвого каскаду. На відміну від S100β, ОБМ потрапляє в
ліквор вже при генералізованій деструкції тканини мозку і є маркером
морфологічного ушкодження білої речовини. Цим пояснюється його виоске
накопичення [41].
. З перших годин
інсульту у всіх хворих виявлялося підвищення титру аутоантитіл до ОБМ в
сироватці крові. Співвідношення високих і помірно підвищених титрів було
аналогічним встановленому титру для білка S100β. Рівні підвищення
титру аутоантитіл до S100β і ОБМ тісно корелювали між собою, відображаючи наявність
апріорної сенсибілізації організму хворих з інсультом до різних структурних
білків мозку [38]. Повторне дослідження на третю добу захворювання не виявило
значимої динаміки титру антитіл до ОБМ. Не було встановлено кореляції між концентрацією
білка в цереброспинальной рідини і титром аутоантитіл до нього в сироватці
крові.
.6 Нейротропний вплив препарату
енцефабол за умов ішемії мозку
Відомо, що у хворих з
хронічною ішемією і гіпоксією як судинного, так і токсичного генезу,
порушується біомеханіка потоку крові. У нормі потік крові в макро- і
мікроциркуляторному судинному руслі є відносно ламінарним. Вплив ішемізуючих
факторів, що виникають на тлі хронічної судинно-мозкової недостатності, хронічної
гіпоксії і хронічних метаболічних інтрацеребральних розладів, формує
турбулентний кровотік, що збільшують ішемію. В основі патоморфогенеза хронічної
ішемії головного мозку лежить ураження церебральних артерій, що приводить до
патології білої речовини мозку (демієлінізація, ураження клітин
олігодендрогліі, апоптоз, атрофія кори великих півкуль) [33].
Препарат енцефабол
(Піритинол) належить до групи нейротрофічних засобів, що поліпшують метаболізм
головного мозку і особливо підсилюють анаболічні процеси. За своїм хімічним
складом він близький до піридоксину, добре проникає через гематоенцефалічний
бар’єр, зменшує обмін форфату між кров’ю і нервової тканиною, посилює транспорт
глюкози і натрію. Енцефабол, таким чином, нормалізує психічну і моторну
діяльність людини внаслідок підвищення метаболічної активності в синапсах ЦНС
[42].
Виражений тонізуючий
ефект препарату пов’язують з безпосередньою дією на нейрональну активність. Ряд
авторів пов’язують даний механізм дії енцефаболу з посиленням активності
нейронів лімбічної системи і ретикулярної формації, а також з посиленням обміну
глюкози в енерговитратних областях головного мозку [33, 42].
Роботами інших авторів
показано, що у хворих з системним і церебральним атероклерозом,
посттравматичною енцефалопатією, хронічним алкоголізмом, хронічною ішемією
головного мозку препарат нормалізує обмінні процеси головного мозку, активує
утилізацію глюкози, знижує утворення молочної кислоти, посилює швидкість
окислення глюкози. При цьому у пацієнтів з явищами недостатності мозкового
кровообігу під дією препарату виявлено зниження явища загальної слабкості,
дратівливості, головних болей, запаморочення, емоційної лабільності, підвищення
працездатності, поліпшення когнітивних функцій, перш за все пам’яті, уваги,
покращення психоемоційного фону [42].
Енцефабол - позитивний
модулятор ремієлінізації аксонів головного мозку, активує відновлення
молекулярних компонентів мембран. Впливає проліферацію олігодендробластів,
посилює утворення ліпідних компонентів мієліну, сприяє агрегації білкових
комплексів у межах фосфоліпідного бішару. Модулює підвищення сальтаторної
(прискореної) передачі нервового збудження мієлінізованими нервовими волокнами
[43].
Пікринол підвищує
функціональну активність астроцитів, у результаті якої останні продукують
нейротрофічні фактори - BDNF, NGF, GDNF, які сприяють відновленню ішемізованих
ділянок головного мозку. При цьому BDNF стимулює проліферацію стовбурових
клітин мозку, а GDNF відіграє ключову роль у диференціації гліальних клітин,
особливо прекурсорів олігодендроглії. Це сприяє відновленню цілісності
мієлінової оболонки.
Відмічено позитивний
вплив пікринолу на відновлення мієліну ПНС, однак механізм цього процесу
залишається недостатньо вивченим. Відомо, що препарат сприяє проліферації
нейролеммоцитів - попередників шванівських клітин. Вони відповідають за
утворення мієліну ПНС, сприяючи агрегації периферичного білка мієліну (myelin
peripheral protein або myelin protein zero) з фосфоліпідами в ліпідні рафти
[33, 44] (рис. 2.8).
Рис. 2.8 Енцефабол
сприяє агрегації ліпідних рафтів у межах мієлінових мембран:
А - вигляд
мієлінізованого аксону збоку, Б - поперечний розріз аксону
2.7 Ішемія мозку та енергетичний
дефіцит олігодендроцитів
гçí³
ôîðìè öåðåáðàëüíî¿
³øå쳿 êîðåëþþòü
ç ôàçíèìè çì³íàìè
âì³ñòó ATÔ
<#"877695.files/image012.jpg">
Ðèñ. 2.9. Ñêóï÷åííÿ
îë³ãîäåíäðîöèò³â,
ÿê³ ïðîäóêóþòü
ôàêòîð Olig-2 (âèÿâëåíèé
çà äîïîìîãîþ
ñïåöèô³÷íèõ
ìîíîêëîíàëüíèõ
àíòèò³ë ç ³ìóíîôëóîðåñöåíòíîþ
ì³òêîþ)
Åíåðãåòè÷íèé
äåô³öèò ³ ëàêòàòàöèäîç
º òðèãåðàìè êàñêàäó
ïàòîá³îõ³ì³÷íèõ
ðåàêö³é, ùî ïðîò³êàþòü
ó âñ³õ îñíîâíèõ
êë³òèííèõ ïóëàõ
ÖÍÑ ³ ïðèçâîäÿòü
äî ôîðìóâàííÿ
³íôàðêòó ìîçêó
çà äâîìà îñíîâíèìè
ìåõàí³çìàìè:
íåêðîçó òà àïîïòîçó
[48].
.8 Äåãåíåðàö³ÿ
îë³ãîäåíäðîöèò³â
òà ¿õ â³äíîâëåííÿ
ï³ñëÿ ôîêàëüíî¿
³øå쳿 ìîçêó
Âïåðøå
âèâ÷åííÿì ïðîáëåìè
çàãèáåë³ îë³ãîäåíäðîã볿
çà óìîâ ôîêàëüíî¿
³øå쳿 òà ðîçðîáêîþ
ìåòîä³â â³äíîâëåííÿ
¿¿ êë³òèí çàéíÿëèñÿ
êîìàíäà àìåðèêàíñüêèõ
äîñë³äíèê³â ç
Washington University School of Medicine, î÷îëþâàíà
ïðîôåñîðîì Ñàëë³
ÌàéÀéâåð (Sally R. McIver). Äîñë³äæåííÿ
ïðîâîäèëèñÿ ç
âèêîðèñòàííÿì
äîðîñëèõ ùóð³â-ñàìö³â
ë³í³¿ Sprague Dawley âàãîþ
200-250 ã (Charles Rivers Laboratories, Wilmington, Massachusetts). [50]
Ïðè âèêîíàíí³
ðîáîòè àâòîðàìè
áóëè âèêîðèñòàí³
íàñòóïí³ òåðì³íè
òà ïîçíà÷åííÿ:
BrdU - áðîìîäåîêñèóðèäèí,
CBF - ìîçêîâèé êðîâîò³ê,
eGFP - enhanced green fluorescent protein (çåëåíèé
ôëóîðåñöåíòíèé
á³ëîê), LFB - áàðâíèê
Luxol Fast Blue, LV - ëåíò³â³ðóñíèé
âåêòîð, MBP (ÎÁÌ) - îñíîâíèé
á³ëîê 쳺ë³íó,
MCAÎ - îêëþç³ÿ ñåðåäèííî¿
ìîçêîâî¿ àðòåð³¿,
OPC - êë³òèíè-ïîïåðåäíèêè
îë³ãîäåíäðîöèò³â,
SVZ - ñóáâåíòðèêóëÿðíà
çîíà ìîçêó, TTC - òðèôåí³ë
òåòðàçîë³óì
õëîðèä, TUNEL - òðàíñôåðàçà
òåðì³íàëüíîãî
ïðèºäíàííÿ äåçîêñèóðèäèíòðèôîñôàòó
(ìàðêåð çàãèáëèõ
îë³ãîäåíäðîöèò³â).
Â÷åíèìè
ïîêàçàíî, ùî âðàçëèâ³ñòü
îë³ãîäåíäðîöèò³â
çà óìîâ öåðåáðàëüíî¿
³øå쳿 ñïðèÿº
âòðàò³ ôóíêö³îíàëüíî
ïîâíîö³ííèõ
쳺ë³íîâèõ îáîëîíîê.
Öå ìîæå ïðèçâîäèòè
äî ðóéíóâàííÿ
á³ëî¿ ðå÷îâèíè
ìîçêó. Ñó÷àñí³
³ììóíîöèòîõ³ì³÷í³
ìåòîäè âèÿâëåííÿ
óøêîäæåíü îë³ãîäåíäðîöèò³â
â åêñïåðèìåíòàëüíèõ
ìîäåëÿõ áàçóþòüñÿ
íà âèêîðèñòàíí³
àíòèò³ë äî ñïåöèô³÷íèõ
åï³òîï³â, íàÿâíèõ
ó ñòðóêòóð³ ÎÁÌ.
Ïðè öüîìó ö³ ìåòîäè
íå äèñêðèì³íóþòü
ñòðóêòóðíèõ
çì³í â îë³ãîäåíäðîöèòàðí³é
ìîðôîëî㳿 [50].
 ïîïåðåäí³õ
ðîáîòàõ äîñë³äíèêè
îïèñóâàëè âèêîðèñòàííÿ
ëåíò³â³ðóñíîãî
âåêòîðó (LV), ùî íåñå
ñåíñèá³ë³çîâàíèé
ãåí åGFP, ðîçòàøîâàíèé
ïîðÿä ç ïðîìîòîðîì
ãåíó ÎÁÌ [51]. Öå âèêîðèñòàíî
äëÿ ñåëåêòèâíî¿
â³çóàë³çàö³¿
óøêîäæåíèõ ³øå쳺þ,
à òàêîæ äîçâîëÿº
îö³íèòè ñòóï³íü
óðàæåííÿ òêàíèíè
ìîçêó. Ó öüîìó
äîñë³äæåíí³
[50] â÷åíèìè âèêîðèñòàíî
LV-MBP-åGFP äëÿ âèçíà÷åííÿ
îë³ãîäåíäðîöèò³â
ó á³ë³é ðå÷îâèí³
ãîëîâíîãî ìîçêó
ùóð³â çà óìîâ
ïåðåõ³äíî¿ ôîêàëüíî¿
öåðåáðàëüíî¿
³øå쳿 òà âñòàíîâëåíî
ñòóï³íü óøêîäæåííÿ
îë³ãîäåíäðîã볿
÷åðåç 24 ãîäèí,
48 ãîäèí ³ îäèí òèæäåíü
ï³ñëÿ ðåïåðôó糿
øëÿõîì îö³íêè
ê³ëüê³ñíîãî âèæèâàííÿ
êë³òèí ³ àíàë³çó
ïðîöåñ³â 쳺ë³í³çàö³¿.
³ðóñíèé âåêòîð
LV ïðîíèêàâ ó êë³òèíè
îë³ãîäåíäðîã볿
òà âáóäîâóâàâñÿ
â ¿õ ãåíîì. Ïðè
öüîìó, ÿê áóëî
çàçíà÷åíî âèùå,
âåêòîð ì³ñòèâ
ó ñâîºìó ñêëàä³
ñåíñèá³ë³çîâàíèé
åGFP òà ãåí ÎÁÌ
[50].
 çàãèáëèõ
ó ðåçóëüòàò³
öåðåáðàëüíî¿
³øå쳿 îë³ãîäåíäðîöèòàõ
ñïîñòåð³ãàºòüñÿ
íåâèñîêà ðåïë³êàòèâíà
àêòèâí³ñòü â³ðóñó,
ïðè÷îìó áóëî
â³äì³÷åíî ïðîãðåñóþ÷ó
âòðàòó GFP(+)-êë³òèí
÷åðåç 24 òà 48 ãîäèí
ï³ñëÿ ³íäóêö³¿
³øåì³÷íîãî óðàæåííÿ
ìîçêó. GFP(+)-êë³òèíè,
ÿê³ âèæèëè, ìàëè
çì³íåíó ìîðôîëîã³þ
ÿäðà, ÿêà íàãàäóâàëà
àíàëîã³÷íó ìîðôîëîã³þ
ï³êíîòè÷íîãî
ÿäðà ïðè íåêðîç³.
Ïðîòå ¿õ ÿäðî íå
ï³ääàâàëîñÿ íåêðîòè÷íèì
óðàæåííÿì. Òàê³
êë³òèíè íå ìàëè
ó ñâîºìó ñêëàä³
ôåðìåíòó TUNEL, òîáòî
áóëè TUNEL-íåãàòèâíèìè.
Ó òàêèõ êë³òèí
ïîêàçàíî ïîðóøåííÿ
ïðîöåñ³â 쳺ë³í³çàö³¿,
â ðåçóëüòàò³ ÷îãî
ôðàãìåíòîâàíà
쳺ë³íîâà îáîëîíêà
íà ïî÷àòêó 24-¿
ãîäèíè ï³ñëÿ ³øå쳿
íå â³äíîâëþâàëàñÿ.
×åðåç òèæäåíü
ï³ñëÿ ³øå쳿, äîñë³äíèêè
ñïîñòåð³ãàëè
â³äíîâëåííÿ ïîïóëÿö³é
GFP(+)-îë³ãîäåíäðîöèò³â,
ùî áóëî äîáðèì
ïðîãíîñòè÷íèì
ïîêàçíèêîì ïðè
â³äíîâëåíí³ ì³ºë³íîãåíåçó.
Ïðîòå, çà äîïîìîãîþ
BrdU- âêëþ÷åíü ïîêàçàíî,
ùî ïðîë³ôåðóþ÷³
êë³òèíè-ïîïåðåäíèêè
îë³ãîäåíäðîã볿
íå áóëè îñíîâíèì
äæåðåëîì GFP(+)-îë³ãîäåíäðîöèò³â.
Ö³ ñïîñòåðåæåííÿ
³äåíòèô³êóâàëè
íàÿâí³ñòü íîâèõ
ïåðåõ³äíèõ êë³òèííèõ
ôîðì ì³æ ïîïåðåäíèêàìè
³ çð³ëèìè îë³ãîäåíäðîöèòàìè.
Ïîäàëüøå âèâ÷åííÿ
òàêèõ íîâèõ ïîïåðåäíèê³â
äîçâîëèòü â³äêðèòè
íåç'ÿñîâàí³ ìåõàí³çìè
ñòðóêòóðíèõ
çì³í 쳺ë³íó
ïðè ³øåì³÷í³é
ïàòîëî㳿 ìîçêó
[50].
Âèæèâàííÿ
³ çáåðåæåííÿ ö³ë³ñíîñò³
쳺ë³íîïðîäóêóþ÷èõ
îë³ãîäåíäðîöèò³â
ìຠâèð³øàëüíå
çíà÷åííÿ äëÿ
íîðìàëüíî¿ ôóíêö³¿
àêñîí³â á³ëî¿
ðå÷îâèíè ìîçêó.
²ñíóº âñå á³ëüøå
äîêàç³â íà ìîäåëÿõ
õâîðîáè ³ â òðàíñãåííèõ
íîêàóò-ìèøåé,
ïîçáàâëåíèõ
åêñïðåñ³¿ á³ëê³â
쳺ë³íó, ùî ïåðâèííà
äèñôóíêö³ÿ â îë³ãîäåíäðîöèòàõ
ìîæå ïðèçâåñòè
äî âòîðèííîãî
ïîøêîäæåííÿ àêñîí³â.
Öå ñïîñòåð³ãàºòüñÿ
ïðè ð³çíîìàí³òíèõ
íåâðîëîã³÷íèõ
ïîðóøåííÿõ, çîêðåìà
ðîçñ³ÿíîìó ñêëåðîç³,
³íñóëüò³, ïåðèíàòàëüí³é
òðàâì³ ãîëîâíîãî
ìîçêó òîùî [52].
Óðàçëèâ³ñòü
îë³ãîäåíäðîöèò³â
çà óìîâ ³øåì³÷íî¿
ïîøêîäæåííÿ ìîçêó
ïðîäåìîíñòðîâàíà
â ÷èñëåííèõ ìîäåëÿõ
â ïðîá³ðö³ ³ îïîñåðåäêîâóºòüñÿ
ÿê îêèñíèìè, òàê
³ åêñàéòîòîêñè÷íèìè
ìåõàí³çìàìè.
Ïðè ãîñòð³é ³øå쳿,
ÿêà ðîçâèíóëàñÿ
â ðåçóëüòàò³ òðàâìàòèçàö³¿
ãîëîâíîãî ÷è
ñïèííîãî ìîçêó
ïðîäåìîíñòðîâàíî
âòðàòó ³ìóíîðåàêòèâíîñò³
äî îë³ãîäåíäðîöèò-ñïåöèô³÷íèõ
ìàðêåð³â ³ ïîÿâó
ó êë³òèíàõ ï³êíîòè÷íèõ
ÿäåð. Îë³ãîäåíäðîöèò-ñïåöèô³÷íà
åêñïðåñ³ÿ ôëóîðåñöåíòíèõ
ìàðêåð³â â óìîâàõ
³øåì³÷íîãî ³íñóëüòó
äåìîíñòðóº çíèæåííÿ
³íòåíñèâíîñò³
ôëóîðåñöåíö³¿
â 쳺ë³íîâ³é îáîëîíö³.
Äàí³ ³øåì³÷íîãî
óøêîäæåííÿ á³ëî¿
ðå÷îâèíè â ïðèðîäíèõ
óìîâàõ ïîêàçàí³
íà ðàíí³õ òèì÷àñîâèõ
òî÷êàõ ïðè ôîêàëüí³é
³øå쳿, êîëè ëèøå
ñïîñòåð³ãàþòüñÿ
íåâåëèê³ óëüòðàñòðóêòóðí³
çì³í â ìîðôîëî㳿
쳺ë³íîâèõ îáîëîíîê.
óñòîëîã³÷í³
òà ³ìóíîöèòîëîã³÷í³
ìåòîäè, âèêîðèñòàí³
ó ïîñò³éíèõ ³
ïåðåõ³äíèõ êîîðäèíàö³éíèõ
ìîäåëÿõ ³øå쳿
âêàçàëè íà â³äíîñíó
âòðàòó ³ìóíîðåàêòèâíîñò³
äëÿ îë³ãîäåíäðîöèò³â
³ á³ëê³â 쳺ë³íó,
ïî÷èíàþ÷è âæå
ç 24 ãîäèíè ï³ñëÿ
³íäóêö³¿ ³øå쳿
[53].
Ó ïðîá³ðêîâèõ
ìîäåëÿõ ³øåì³ÿ
ï³ääàºòüñÿ ôàðìàêîëîã³÷íèì
ìàí³ïóëÿö³ÿì.
Òàê³ ìîäåë³ º ö³ííèìè
äëÿ âèâ÷åííÿ ãîñòðî¿
â³äïîâ³ä³ îë³ãîäåíäðîöèò³â
ïðè ïîøêîäæåíí³
ìîçêîâî¿ òêàíèíè,
îäíàê º íåïîâíèì
â³äîáðàæåííÿ
òîãî, ùî â³äáóâàºòüñÿ
â ïðèðîäíèõ óìîâàõ,
äå ñóäèíí³ ³ çàïàëüí³
ðåàêö³¿ º äîäàòêîâèìè
ôàêòîðàìè óøêîäæåíííÿ
쳺ë³íó. Ó ïðèðîäíèõ
óìîâàõ äîñë³äæåííÿ
áóëè îáìåæåí³
íàÿâí³ñòþ åï³òîï³â
â ïîøêîäæåí³é
òêàíèí³ òà çàáåçïå÷èëè
äîñë³äíèê³â ³íôîðìàö³ºþ
â³äíîñíî íåâåëèêèõ
ñòðóêòóðíèõ
çì³í, ÿê³ ìîæóòü
â³äáóâàòèñÿ
ð³çíèìè øëÿõàìè
â ñîì³ îë³ãîäåíäðîöèò³â.
Ñòðóêòóðí³ çì³íè
â îë³ãîäåíäðîöèò³,
ùî â³äáóâàþòüñÿ
ó â³äïîâ³äü íà
³øåì³þ, äîáðå âèçíà÷åí³
ïðè ïðîâåäåíí³
òðèâàëèõ äîñë³äæåíü.
Çì³íà
ïåðåá³ãó ïðîöåñ³â
ðå쳺ë³í³çàö³¿
ìîæå ñïðèÿòè
ôóíêö³îíàëüíîìó
â³äíîâëåííþ ïðè
äå쳺ë³í³çóþ÷èõ
çàõâîðþâàíü
³ ìîæå áóòè çàëó÷åíîþ
â ïî÷àòêîâå â³äíîâëåííÿ
ôóíêö³¿ êë³òèí
â ìîäåë³ ïîøêîäæåííÿ
ñïèííîãî ìîçêó.
ßê ñòâåðäæóþòü
äåÿê³ äîñë³äíèêè,
öüîãî ìîæíà äîñÿãòè,
ÿêùî çàì³ñòü
óøêîäæåíèõ êë³òèí
òðàíñïëàíòàö³éíèì
øëÿõîì ââåñòè
íîâ³, ãåííîìîäèô³êîâàí³
ïîïåðåäíèêè îë³ãîäåíäðîã볿.
Òèì íå ìåíø, íå
ö³ëêîì ñôîðìîâàíèé
ïîòåíö³àë äëÿ
ïîä³áíî¿ çàì³íè
îë³ãîäåíäðîöèò³â
ïðè ³øå쳿 á³ëî¿
ðå÷îâèíè ìîçêó,
îñîáëèâî ÿêùî
öå ñòîñóºòüñÿ
äîðîñëîãî îðãàí³çìó
[50].
Ó ìîçêó
íîâîíàðîäæåíèõ
òâàðèí º çàïàñ
íåäèôåðåíö³éîâàíèõ
êë³òèí, ÿê³ çà
óìîâ òðàâìàòèçàö³¿
ìîçêó ï³ä 䳺þ
åíäîãåííèõ ñèãíàëüíèõ
ìîëåêóë ìîæóòü
óòâîðþâàòè ð³çí³
êëàñè êë³òèí
íåðâîâî¿ ñèñòåìè.
Òàê ìîæå óòâîðþâàòèñÿ
êëàñ ñïåöèô³÷íèõ
«á³ëèõ» îë³ãîäåíäðîöèò³â,
ÿê³ º äîñòàíüî
ñò³éêèìè ïðè
ð³çíèõ ïàòîëîã³÷íèõ
ñòàíàõ ìîçêó.
Ïðîòå äëÿ äîðîñëîãî
ìîçêó òàêà ê³ëüê³ñòü
êë³òèí º íàáàãàòî
ìåíøîþ, òîìó ïèòàííÿ
ïðî ôîðìóâàííÿ
«îñîáëèâèõ» ðåçèñòåíòíèõ
îë³ãîäåíäðîöèò³â
çàëèøàºòüñÿ
â³äêðèòèì. Âèçíà÷åííÿ
äîë³ «á³ëèõ» îëèãîäåíäðîöèò³â
ðå÷îâèíè ï³ñëÿ
îñåðåäêîâî¿ ³øå쳿
â äîâãîñòðîêîâèõ
äîñë³äæåííÿõ
ìîæå äàòè óÿâëåííÿ
ïðî ïåðåäáà÷óâàí³
åíäîãåíí³ ìåõàí³çìè
ðåïàðàö³¿ 쳺ë³íó,
òàê³ ÿê ò³, ùî îïèñàí³
ïðè ó ìîäåëÿõ òðàâìàòè÷íîãî
ïîøêîäæåííÿ ñïèííîãî
ìîçêó.
Ñàëë³ ÌàêÀéâåð
òàê êîðîòêî îïèñóº
ñõåìó ïðîâåäåííÿ
äîñë³äæåíü. Ðåêîìá³íàíòíèé
ëåíò³â³ðóñ ñòâîðåíî
íà îñíîâ³ â³ðóñó
³ìóíîäåô³öèòó
ëþäèíè. Äî ñêëàäó
ðåêîìá³íàíòó
âíåñåíî íåâåëèêèé
1,9 êá (êá = 1 ê³ëîáàçà
= 1000 ïàð íóêëåîòèä³â
ó ÄÍÊ) ôðàãìåíò
ïðîìîòîðà ÎÁÌ
ðàçîì ç ãåíîì
GFP. Ðåêîìá³íàíòíèé
ëåíò³â³ðóñ áóâ
ï³äãîòîâëåíèé
ïåðåõ³äíîþ êî-òðàíñôåêö³ºþ
êë³òèííî¿ ë³í³¿
ÍÅÊ 293Ò ç âåêòîðîì
ÌÂÐ-EGFP òà ëåíòèâ³ðóñ³â
äîïîì³æíèõ ïëàçì³ä
(pMDLgpRRE, RSV-REV ³ PMDG äëÿ VSV-G pseudotyping) ç
âèêîðèñòàííÿì
ìåòîäó ñîîñàäæåííÿ
ôîñôàòîì êàëüö³þ.
Îáì³í ãåíåòè÷íèì
ìàòåð³àëîì ì³æâ³ðóñíèìè
ãåíîìàìè çä³éñíèâñÿ
÷åðåç 24 ãîä ³ ÷åðåç
48 ãîä òðàíñôåêö³¿
äîñë³äíèêè çáèðàëè
ëåíò³â³ðóñ³â,
ô³ëüòðóâàëè ÷åðåç
ô³ëüòð 0,45 ìêì ³ êîíöåíòðóâàëè
çà äîïîìîãîþ
óëüòðàöåíòðèôóãóâàííÿ
(90 õâèëèí ïðè 25000 îáåðò³â
íà õâèëèíó), à
ïîò³ì ðåñóñïåíäóâàëè
â ðîç÷èí³ Ð³íãåðà.
Çàðàæåííÿ êë³òèí
ÍÅÊ 293 ç â³ðóñîì
áóâ âèêîðèñòàíå
äëÿ òèòðóâàííÿ
çà äîïîìîãîþ
ïðîòî÷íî¿ öèòîìåòð³¿
÷åðåç 24 ãîäèíè
ï³ñëÿ ³íô³êóâàííÿ.
Àë³êâîòè â³ðóñíèõ
ñóñïåíç³é çáåð³ãàëè
ïðè -80 °Ñ äî âèêîðèñòàííÿ
[50].
Äîðîñëèõ
Sprague Dawley ñàìö³â ùóð³â
(Charles Rivers Laboratories, ³ëì³íãòîí,
øòàò Ìàññà÷óñåòñ)
ç ìàñîþ ò³ëà
200-250 ã âèêîðèñòîâóâàëè
â öüîìó äîñë³äæåíí³.
Õ³ðóðã³ÿ òâàðèí
³ äîãëÿä ïðîâîäèëèñÿ
â³äïîâ³äíî äî
«Êåð³âíèöòâà ïî
äîãëÿäó òà âèêîðèñòàííÿ
ëàáîðàòîðíèõ
òâàðèí» ²íñòèòóòó
íàóêîâî-äîñë³äíî¿
ëàáîðàòîð³ (ILAR). Âñ³
ïðîöåäóðè áóëè
ñõâàëåí³ Êîì³òåòîì
òâàðèííèõ äîñë³äæåíü
ïðè Âàøèíãòîíñüêîìó
óí³âåðñèòåò³.
Ùóð³â àíåñòåçóâàòè
³çîôëóðàíîì
(3% ³íäóêö³¿, 1,75% ç òåõí³÷íîãî
îáñëóãîâóâàííÿ
(Stoelting, Wood Dale, ²ëë³íîéñ).
ϳñëÿ àíåñòå糿
ðîáèëè ñåðåäèííèé
ðîçð³ç ãîëîâè,
ïðè öüîìó øïðèöü
Ãàì³ëüòîíà îïóñêàëè
â ë³âó áîêîâó
÷àñòèíó ìîçîëèñòîãî
ò³ëà ÷åðåç íåâåëèêèé
îòâ³ð. Êîìá³íîâàíèé
âåêòîð LV-ÌÂÐ-EGFP (4,5 ìêë)
áóâ äîñòàâëåíèé
ç³ øâèäê³ñòþ
0,45 ìêë / õâ ÷åðåç
íàíî³í'ºêòîð
íàñîñà (Stoelting), ï³ñëÿ
÷îãî ãîëêà øïðèöÿ
áóëà çàëèøåíà
íà ì³ñö³ ïðîòÿãîì
5 õâèëèí, ùîá çàáåçïå÷èòè
ïîâíå ïîøèðåííÿ
â³ðóñó [50].
×åðåç ø³ñòü
äí³â ï³ñëÿ ³í'ºêö³¿,
ùóðè ï³ääàâàëèñÿ
àáî ô³êòèâí³é
õ³ðóð㳿 (Sham-êîíòðîëüí³
òâàðèíè), àáî âïëèâó
ïåðåõ³äíî¿ ôîêàëüíî¿
³øå쳿 çà äîïîìîãîþ
60-õâèëèííî¿ îêëþ糿
ñåðåäíüî¿ ìîçêîâî¿
àðòå𳿠(ÌÑÀÎ)
âíóòðèïðîñâ³òíüîþ
íåéëîíîâîþ íèòêîþ.
Ðîçð³çè çàøèâàëè
³ òâàðèíàì äàâàëè
â³äíîâèòèñÿ
ï³ñëÿ àíåñòå糿
ï³ä ÷àñ îêëþ糿.
ϳñëÿ 60 õâèëèí
MCAO ùóð³â ïîâòîðíî
àíåñòåçóâàòè
òà ïðèïèíÿëè ³øåì³þ
øëÿõîì âèäàëåííÿ
âíóòð³øíüîïðîñâ³òíüîãî
øâà. Äîñë³äíèêè
âèêîðèñòîâóâàëè
ëàçåðíèé äîïëåð³âñüêèé
çîíä äëÿ âèì³ðþâàííÿ
ìîçêîâîãî êðîâîòîêó
(CBF) â ð³çí³ ìîìåíòè
÷àñó, ùîá ï³äòâåðäèòè
íàÿâí³ñòü ³øåì³÷íèõ
ñòàí³â òêàíèíè
ìîçêó: CBF âèì³ðþâàëè
áåçïîñåðåäíüî
íàä òåðèòîð³ºþ
MCA íà ïî÷àòêó îêëþ糿
³ äî ðåïåðôó糿,
ùîá ï³äòâåðäèòè
ñò³éêèé çíèæåííÿ
êðîâîòîêó (<20% âèõ³äíîãî
CBF), ³ íà ïî÷àòêó
ðåïåðôó糿, ùîá
ï³äòâåðäèòè äîñòàòíº
â³äíîâëåííÿ êðîâîòîêó
(> 60% CBF). Òâàðèíè, ùî
íå â³äïîâ³äàþòü
öèì êðèòåð³ÿì,
áóëè âèêëþ÷åí³
ç äîñë³äæåííÿ.
Sham-êîíòðîëüí³ òâàðèíè
áóëè ï³ääàí³ òèì
æå ïðîöåäóðàì,
áåç îêëþ糿 ÌÑÀ
âíóòð³øíüîïðîñâ³òíèì
øâîì.
Òâàðèíè
áóëè ðîçä³ëåí³
íà íàñòóïí³ ãðóïè,
â³äïîâ³äíî äî
MCAO: 24 ãîäèíè ðåïåðôó糿
(n = 11 äîñë³äæóâàíèõ,
7 Sham-êîíòðîëüíèõ);
48 ãîäèí ðåïåðôó糿
(n = 11 äîñë³äæóâàíèõ,
7 Sham-êîíòðîëüíèõ);
1 òèæäåíü ðåïåðôó糿
(n = 12 ç ³øåì³÷íèì
³íñóëüòîì, 12 Sham-êîíòðîëüíèõ).
Ñìåðòí³ñòü, ÿê
ïðàâèëî, â³ä çàòðèìêè
íåïîâíî¿ ðåïåðôó糿
³ / àáî êðîâîòå÷³,
áóâ ð³âíîþ ñåðåä
ãðóï (n = 2-3 íà ãðóïó).
Ùîá â³äñòåæóâàòè
äîëþ ïðîë³ôåðóþ÷èõ
êë³òèí, îêðåìèé
íàá³ð òâàðèí
(N = 4-õ òàêòíèé, 1
Sham-êîíòðîëü) ùîäíÿ
îòðèìóâàâ âíóòð³øíüî÷åðåâíó
³í'ºêö³þ 50 ìã/êã
BrdU (Sigma-Aldrich, Ñåíò-Ëó¿ñ,
øòàò ̳ññóð³)
â äåíü ï³ñëÿ ³íñóëüòó.
Òâàðèí óìåðòâëÿëè
÷åðåç îäèí òèæäåíü
ï³ñëÿ ðåïåðôó糿
[50].
Ùóð³â óìåðòâëÿëè
â êîæíîìó ïåâíîìó
ïóíêò³ ÷àñó âíóòð³øíüîñåðöåâîþ
ïåðôó糿 ç PBS (potasium
buffer solution, çàáóôåðåíèé
ôîñôàòíèé ðîç÷èí).
̳çêè òâàðèí
áóëè âèòÿãíóò³
ç íàñòóïíèì
ïîä³ëîì íà çð³çè
òîâùèíîþ 3 ìì.
Çð³çè ³íêóáóâàëè
ó ðîç÷èí³ õëîðèäó
òðèôåí³ë òåòðàçîë³þ
(ÒÒÑ; Sigma-Aldrich) ïðîòÿãîì
3 õâèëèí ïðè 37 ° Ñ,
ô³êñóâàëè â 4%-ìó
ð-í³ ïàðàôîðìàëüäåã³äó
ïðîòÿãîì 24 ãîäèí,
³ ï³ääàâàëè êð³îïðîòåêö³³
÷åðåç ãðà䳺íòè
ñàõàðîçè (10-30%) ïðîòÿãîì
ïðèíàéìí³ 24 ãîäèí
êîæåí. TTC-ïîôàðáîâàí³
çð³çè áóëè â³äñêàíîâàí³
äëÿ äîêóìåíòàö³¿
ðîçì³ðó ³íôàðêòó
òà 20-ì³êðîìåòðîâ³
ïîñë³äîâí³ êð³îçð³çè
áóëè ç³áðàí³
(êîæí³ 4 ÷àñòèíè)
íà 3 íàáîðè ñëàéä³â.
Îäèí íàá³ð áóâ
âèêîðèñòàíèé
äëÿ øâèäêîãî ôàðáóâàííÿ
áàðâíèêîì LFB íàñòóïíèì
÷èíîì: êð³îçð³çè
áóëè çíåâîäíåí³
â 70, 80 ³ 95%-ìó åòàíîë³
(EtOH, 5 õâ êîæåí), ³íêóáîâàí³
â 1% LFB (â 95%-ìó EtOH + 10%-î¿ îöòîâî¿
êèñëîòè) ïðîòÿãîì
íî÷³ ïðè 60°Ñ â ãåðìåòè÷íîìó
êîíòåéíåð³, ïðîìèâàþòü
ó 95%-ìó EtOH, âîäîþ (2 õâ),
0,05%-ì êàðáîíàòîì
ë³ò³þ (1 õâ), 70%-ì åòàíîëîì
³ âîäîþ. Îñòàíí³
òðè êðîêè ïîâòîðþþòüñÿ
äî òèõ ï³ð, ïîêè
íå îòðèìàþòü
îïòèìàëüíèé
êîíòðàñò ì³æ
á³ëîþ ³ ñ³ðîþ îáëàñòÿìè
ðå÷îâèíè ìîçêó.
Äðóãèé
íàá³ð êð³îçð³ç³â
áóâ âèêîðèñòàíèé
ê³ëüê³ñíî¿ ³ ìîðôîëîã³÷íî¿
îö³íêè GFP(+)-îë³ãîäåíäðîöèò³â.
Òðåò³é ñåò áóâ
âèêîðèñòàíèé
äëÿ ³ìóíîã³ñòîõ³ì³÷íîãî
âèÿâëåííÿ îë³ãîäåíäðîöèò³â
êë³òèí-ïîïåðåäíèê³â
(OPCs; NG2) àáî êîëîêàë³çàö³³
ç ìàðêåðàìè êë³òèííî¿
ïðîë³ôåðàö³¿
(BrdU) àáî çàãèáåë³
(TUNEL). Çð³çè ïðîìèâàëè
PBS (3 ðàçè êîæí³ 5 õâ)
³ áëîêóâàëè ïðîòÿãîì
30 õâèëèí ç âèêîðèñòàííÿì
2% íîðìàëüíî¿ êîçÿ÷î¿
ñèðîâàòêè (Sigma) ³
0,1%-ãî Òðèòîí-X (Sigma) â
PBS. Òêàíèíó ³íêóáóâàëè
ïðîòÿãîì íî÷³
ïðè 4°Ñ â àíòè-êðîëÿ÷³é
NG2 (Millipore, Billerica, Massachusetts; 1: 100) àáî àíòè-BrdU
áëîêóþ÷³é ñèðîâàòö³
êðîëèêà (1: 1500; Ìåãàáàçà,
Íüþ-Éîðê); ïîò³ì
ïðîìèâàëè ðîç÷èíîì
PBS (3 ðàçè êîæí³ 5 õâ),
òà ³íêóáóâàëè
ïðîòÿãîì 1-2 ãîäèí
ïðè ê³ìíàòí³é
òåìïåðàòóð³ ç
êîçÿ÷èìè àíòè-êðîëÿ÷èìè
Alexa-594 âòîðèííèìè
àíòèò³ëàìè
(Invitrogen; 1: 1000). Âèÿâëåííÿ
BrdU ïðîâîäèëè ç 10-õâèëèííîþ
³íêóáàö³ºþ â
2 í. HCl ïðè 37 °Ñ ç ïîäàëüøîþ
20-õâèëèííîþ ³íêóáàö³ºþ
â ðîç÷èí³ 0,2 Ì áîðíî¿
êèñëîòè, äî ñòà䳿
áëîêóâàííÿ ïðîöåñó.
Äëÿ âèÿâëåííÿ
çàãèáåë³ êë³òèí
ìàðêåð TUNEL (Millipore) áóâ
âèêîðèñòàíèé
â³äïîâ³äíî äî
ïðîòîêîëó. Âñ³
çð³çè îáðîáëÿëè
ç Hoechst 33342 ìåòîäîì íàêëàäåííÿ
ÿäåðíèõ ïëÿì
(Invitrogen) òà äîñë³äæóâàëè
çà äîïîìîãîþ
ëàçåðíî¿ ñêàíóþ÷î¿
êîíôîêàëüíî¿
(Zeiss, Maple Grove, ̳ííåñîòà)
ì³êðîñêîﳿ. Öèôðîâ³
êîëüîðîâ³ ì³êðîôîòîãðàô³¿
áóëè äîäàòêîâî
îáðîáëåí³ çà
äîïîìîãîþ ïðîãðàìè
Adobe Photoshop [50, 51].
Ðîçóì³ííÿ
ìåõàí³çì³â ³øåì³÷íîãî
óøêîäæåííÿ â
ïðèðîäíèõ óìîâàõ
â ìîäåë³ ³øå쳿
º íåîáõ³äíèì
êðîêîì íà øëÿõó
äî ðîçðîáêè òåðàïåâòè÷íèõ
âòðó÷àíü. Ó ôîêàëüí³é
³øå쳿 ëþäèíè,
³íôàðêòè ÷àñòî
ïîâ'ÿçàí³ ç óðàæåííÿì
á³ëî¿ ðå÷îâèíè,
³ ðåòåëüíå âèâ÷åííÿ
êë³òèííîãî ïîøêîäæåííÿ
â á³ë³é ðå÷îâèí³
ìຠâèð³øàëüíå
çíà÷åííÿ â ìîäåëÿõ
³íñóëüòó òâàðèí.
Ïîïåðåäí³ äîñë³äæåííÿ
âèâ÷àëè â³äíîñíó
çì³í³ åêñïðåñ³¿
îë³ãîäåíäðîöèò-
³ 쳺ë³íîñïåöèô³÷íèõ
ìàðêåð³â, àëå ö³
åï³òîïè ìîæóòü
áóòè òèì÷àñîâî
âòðà÷åí³, àáî
çàìàñêîâàí³
ïðè ïàòîëîã³÷íèõ
ñòàíàõ. Íàâ³òü
ó çäîðîâî¿ òêàíèíè,
â³çóàë³çàö³ÿ
àíòèò³ë äî öèõ
àíòèãåí³â, ÿê
ïðàâèëî, îáìåæåíà
àáî â ò³ë³ êë³òèíè
àáî òîâñòèì øàðîì
쳺ë³íó, ³ ìîæå
íå ïîêàçóâàòè
âñ³õ çì³í ó ìîðôîëî㳿
îë³ãîäåíäðîöèò³â,
ÿê³ â³äáóâàþòüñÿ
ó â³äïîâ³äü íà
ïîøêîäæåííÿ. Òðàíñãåíí³
ìèø³, ÿê³ ïðîäóêóþòü
îë³ãîäåíäðîöèòàðí³
êëîíè êë³òèí
ç êîíêðåòíèìè
ôëóîðåñöåíòíèìè
ì³òêàìè, äîçâîëÿþòü
ïîâí³ñòþ â³çóàë³çóâàòè
ìîôîëîã³þ îë³ãîäåíäðîöèò³â,
³ íàäàþòü ðîçóì³ííÿ
³øåì³÷íîãî óøêîäæåííÿ
öèõ êë³òèí. Òèì
íå ìåíø, â ë³í³ÿõ
òðàíñãåííèõ
òâàðèí, îòðèìàíèõ
íèí³, â³çóàë³çàö³ÿ
ôëóîðåñöåíòíèõ
ì³òîê ìîæå áóòè
âèðàæåíîþ â êë³òèíàõ-ïîïåðåäíèêàõ,
à íå ëèøå çð³ëèõ
îë³ãîäåíäðîöèòàõ.
Êð³ì òîãî, âèñîê³
ð³âí³ åêñïðåñ³¿
â òðàêòàõ á³ëî¿
ðå÷îâèíè óñêëàäíþþòü
ðîçìåæóâàííÿ
îêðåìèõ ïðîöåñ³â
쳺ë³íîãåíåçó,
³, îòæå, îáìåæóþòü
âèì³ðþâàííÿ àíàë³ç³â,
ÿê³ íå÷óòëèâ³
äî òîíêèõ çì³í
ó ìîðôîëî㳿.
Åëåêòðîííà
ì³êðîñêîï³ÿ (ÅÌ)
ìຠâèñîêó ÷óòëèâ³ñòü
äî âèÿâëåííÿ êë³òèííîãî
ïîøêîäæåííÿ ³
âèêîðèñòîâóºòüñÿ
äëÿ îïèñó óëüòðàñòðóêòóðíèõ
çì³í â îë³ãîäåíäðîö³òàõ,
ùî â³äáóâàþòüñÿ
â ðàíí³ òåðì³íè
ï³ñëÿ ³øå쳿.
EM çàáåçïå÷óº ìîðôîëîã³÷íèé
äåòàë³, íåîáõ³äí³
äëÿ îö³íêè òîíêèõ
â³äì³ííîñòåé
â æèòòºçäàòíîñò³
êë³òèí, àëå äëÿ
óëüòðàñòðóêòóðíîãî
ê³ëüê³ñíîãî àíàë³çó
òðàâìàòèçîâàíî¿
çîíè ñë³ä çä³éñíþâàòè
ïîâòîðíèé â³äá³ð
á³îçðàçê³â â ñåëåêòèâíèõ,
íåâåëèêèõ ðåã³îíàõ,
ÿê³ íåð³äêî äîñòàòíüî
ñêëàäíî âèÿâèòè.
Êð³ì òîãî, á³ëüø³ñòü
öèõ äîñë³äæåíü
áóëè îáìåæåí³
âèì³ðîì ð³çêèõ
çì³í ïðè ³øå쳿
á³ëî¿ ðå÷îâèíè
ìîçêó [53].
Ìàëî ùî
â³äîìî ïðî ÷àñîâó
çàëåæí³ñòü äåãåíåðàòèâíèõ
çì³í àáî ðåãåíåðàòèâíîãî
ïîòåíö³àëó á³ëî¿
ðå÷îâèíè â³ä òðèâàëîñò³
䳿 ôàêòîðó ³íäóêö³¿
³øåì³÷íîãî óðàæåííÿ.
Ó öüîìó äîñë³äæåíí³
â÷åí³ âèêîðèñòîâóâàëè
ëåíòèâ³ðóñíèé
âåêòîð ñïåö³àëüíî
äëÿ çð³ëî¿ ì³ºë³íïðîäóêóþ÷î¿
ïîïóëÿö³¿ îë³ãîäåíäðîöèò³â
ùóð³â â á³ë³é ðå÷îâèí³.
Íàïðàâëÿþ÷è
LV-MBP-EGFP ³í'ºêö³ºþ ó á³÷íå
ìîçîëèñòå ò³ëî,
äîñë³äíèêè îòðèìàëè
çîíó ïîøèðåííÿ
ïðîë³ôåðóþ÷èõ
êë³òèí ïðè ðåïåðôó糿.
Êîíôîêàëüíà
ì³êðîñêîï³ÿ çàñòîñîâóâàëàñÿ
äëÿ òîãî, ùîá á³ëüø
òî÷íî äîñë³äèòè
÷àñîâèé õ³ä â³äíîâëåííÿ
á³ëî¿ ðå÷îâèíè
ï³ñëÿ MCAO. Âèêîðèñòàííÿ
TTC òà ôàðáóâàííÿ
LFB ï³äòâåðäèëè, ùî
öÿ ìîäåëü ³øå쳿
ïðîâîêóº âèíèêíåííÿ
³íôàðêò³â, ïîâ'ÿçàíèõ
ç óøêîäæåííÿì
á³ëî¿ ðå÷îâèíè,
ÿê ïîâ³äîìëÿëîñÿ
ðàí³øå. TTC-çàáàðâëåí³
òêàíèíè âèêîðèñòîâóâàëè
äëÿ äîêóìåíòóâàííÿ
çàãàëüíî¿ ïëîù³
³íôàðêòó, à ïîò³ì
çãîäîì îáðîáëÿëè
äëÿ â³çóàë³çàö³¿
òðàâìè á³ëî¿
ðå÷îâèíè íà êë³òèííîìó
ð³âí³. Öå âàæëèâî,
îñê³ëüêè MCAO ìîæå
³íäóêóâàòè ïîÿâó
ð³çíèõ çà ðîçì³ðîì
³íôàðêò³â, íàâ³òü
ÿêùî âèì³ðþâàííÿ
ïîòîêó êðîâ³ ãîëîâíîãî
ìîçêó ïîñë³äîâíî
çíèæóºòüñÿ ï³ä
÷àñ îêëþ糿. Òóò
âèêîðèñòàííÿ
ÒÒÑ äîçâîëÿº â÷åíèì
ñòâåðäæóâàòè,
ùî çìåíøåííÿ
ê³ëüêîñò³ GFP(+)-îë³ãîäåíäðîöèò³â
â á³÷íîìó ìîçîëèñòîìó
ò³ë³ ïî÷èíàºòüñÿ
âæå ç 24-48 ãîäèí ðåïåðôó糿
ï³ñëÿ ³íñóëüòó.
Ùîäî ðîçïîä³ëó
GFP(+)-îë³ãîäåíäðîöèò³â,
ÿê³ ñïîñòåð³ãàþòüñÿ
â á³ë³é ðå÷îâèíè,
äîñë³äíèêè òàêîæ
ñïîñòåð³ãàëè
çàëåæíå â³ä ÷àñó
çìåíøåííÿ ÷èñëà
òèõ êë³òèí, ùî
óçäîâæ ìåä³àëüíî-á³÷íî¿
çîíè ìîçîëèñòîãî
ò³ëà, ïðè ìàéæå
ïîâí³é â³äñóòíîñò³
â çîâí³øí³é çîí³
÷åðåç 48 ãîäèí ï³ñëÿ
³øå쳿 [50].
Ìàëîéìîâ³ðíî,
ùî çíèæåííÿ åêñïðåñ³¿
GFP â³äáóâàëîñÿ
÷åðåç íåàêòèâí³ñòü
ïðîìîòîðà MBP, îñê³ëüêè
ð³âåíü òðàíñêðèïö³¿
MBP çá³ëüøóºòüñÿ
ï³ñëÿ ðîçâèòêó
³øå쳿. GFP(+)-îë³ãîäåíäðîö³òè,
ùî âèæèëè, áóëè
âèÿâëåí³ â ðåã³îíàõ
³øåì³÷íî¿ çàãèáåë³
êë³òèí, ÿê³ ìàëè
ó ñâîºìó ñêëàä³
ìàðêåð TUNEL. Âðàõîâóþ÷è
ö³ äàí³, òî ìàëîéìîâ³ðíî,
ùî çíèæåííÿ
GFP(+)-êë³òèí ïðèãí³÷óºòüñÿ
àêòèâí³ñòþ ïðîìîòîðà
MBP.
Øèðîêèé
íåêðîç â ñìóãàñòîìó
ò³ë³ (corpus striatum) ³ êîð³ º
âèçíà÷àëüíîþ
ðèñîþ ñåðöåâèíè
³íôàðêòó â ö³é
ìîäåë³ ³øå쳿,
òîìó ö³ëêîì ³ìîâ³ðíî,
ùî GFP(+)-îë³ãîäåíäðîöèòè
ï³ääàþòüñÿ êë³òèíí³é
çàãèáåë³, ùî ïðèçâîäèòü
äî âòðàòè àáî
äåãðàäàö³¿ GFP. Òóò
â÷åí³ ïðàãíóëè
âèâ÷èòè îë³ãîäåíäðîöèòè
áëèæ÷å äî ìåæ³
³øåì³çîâàíî¿
çîíè, äå ìîæå áóòè
á³ëüøèé ïîòåíö³àë
êë³òèí äëÿ â³äíîâëåííÿ.
Òîìó ùî âàð³àáåëüí³ñòü
â ðîçì³ðàõ ³íôàðêòó
º îñíîâíîþ ðèñîþ
ö³º¿ åêñïåðèìåíòàëüíî¿
ìîäåë³, äîñë³äíèêè
íå ìîãëè âèêëþ÷èòè
ìîæëèâ³ñòü òîãî,
ùî äåÿê³ êë³òèíè,
ïðîàíàë³çîâàí³
â äàíîìó äîñë³äæåíí,
çàãèíóëè ñàìå
â öåíòðàëüí³é
çîí³ (ÿäð³) ³íôàðêòó
[50]. (+)-îë³ãîäåäðîöèòè,
ùî âèæèëè, õàðàêòåðèçóâàëèñÿ
çíèæåííÿì 쳺ë³íîóòâîðþþ÷îãî
ïîòåíö³àëó. Ïðè
öüîìó áóëè âèÿâëåí³
çíà÷í³ çîíè ôðàãìåíòàö³¿
쳺ë³íîâèõ ìåìáðàí
íà 24- ³ 48-ó ãîäèíè
ï³ñëÿ ðåïåðôó糿.
Æèâ³ GFP(+)-îë³ãîäåäðîöèòè
õàðàêòåðèçóâàëèñÿ
òàêîæ TUNEL(-)-ïîêàçíèêîì
òà íå ìàëè ï³êíîòè÷íèõ
ÿäåð. Ö³ ðåçóëüòàòè
ïîêàçóþòü, ùî
äåãåíåðàö³ÿ ïðîöåñ³â
쳺ë³í³çàö³¿
(쳺ë³íîãåíåçó)
ìîæå ïåðåäóâàòè
çàãèáåë³ îë³ãîäåíäðîöèò³â
[50]. Öå ïåðåêîíëèâ³
ïåðñïåêòèâè ó
ñâ³òë³ äîêàç³â
òîãî, ùî íà öåé
ïðîöåñ ³íäóêóþòü
âèñîê³ êîíöåíòðàö³¿
ãëóòàìàòó. Ïîêàçàíî,
ùî çà óìîâ ³øå쳿
åêñïðåñ³ÿ ñóáîäèíèöü
ãëóòàìàòíèõ
ðåöåïòîð³â ñïîñòåð³ãàºòüñÿ
ñàìå â çîíàõ
äå쳺ë³í³çàö³¿
[54].
Çáåðåæåííÿ
ìîðôîëî㳿 ò³ëà
êë³òèíè ï³ä ÷àñ
ì³åë³íîâî¿ äåãåíåðàö³¿
ïðåäñòàâëÿº ³íòðèãóþ÷ó
ìîæëèâ³ñòü òîãî,
ùî ðåì³åë³í³çàö³ÿ
â³äáóâàºòüñÿ
çàâäÿêè ñòðóêòóðíîìó
â³äíîâëåííþ ðàí³øå
ïîøêîäæåíèõ
îëèãîäåíäðîöèò³â.
Íà ïåðøèé òèæäåíü
ðåïåðôó糿 ï³ñëÿ
îñåðåäêîâî¿ ³øå쳿,
ñïîñòåð³ãàëîñÿ
â³äíîâëåííÿ ³íòàêòíèõ
ïðîöåñ³â 쳺ë³í³çàö³¿
³ ê³ëüêîñò³ GFP(+)-îë³ãîäåíäðîöèò³â
â ³øåì³çîâàí³é
îáëàñò³ á³ëî¿
ðå÷îâèíè. Ïðîòå,
ÿê áóëî çàçíà÷åíî
ðàí³øå, ïîðóøåííÿ
쳺ë³íîãåíåçó
ñïîñòåð³ãàëîñÿ
÷åðåç 24-48 ãîäèí
ï³ñëÿ ³øå쳿.
Íà äîäàòîê
äî â³äíîâëåííÿ
ñòðóêòóðè îë³ãîäåíäðîöèò³â
ñïîñòåð³ãàëîñÿ
³ â³äíîâëåííÿ
GFP(+)-êë³òèí ï³ñëÿ
³øå쳿 á³ëî¿
ðå÷îâèíè ìîçîëèñòîãî
ò³ëà (corpus callosum). Ðåïîïóëÿö³³
GFP(+)-îë³ãîäåíäðîöèò³â,
â³çóàë³çîâàí³
â öüîìó äîñë³äæåíí³,
øâèäøå çà âñå,
ïîõîäÿòü â³ä êë³òèí-ðåçèäåíò³â
âæå â á³ë³é ðå÷îâèí³,
à íå êë³òèí, ùî
ì³ãðóþòü â ðàéîíàõ
ç ñ³ðîþ ðå÷îâèíîþ.
Âèêîðèñòàííÿ
BrdU-ðåºñòðàö³¿ äîçâîëèëî
â³äñòåæèòè ðåàêö³þ
ïðîë³ôåðóþ÷èõ
êë³òèí ïðîòÿãîì
îäíîãî òèæíÿ
ï³ñëÿ ðåïåðôó糿,
ùîá âèçíà÷èòè,
äèôåðåíö³þþòüñÿ
âîíè â GFP(+)-îë³ãîäåíäðîöèòè,
÷è í³. Â÷åí³ çíàéøëè
÷èñëåíí³ BrdU-êë³òèíè
â ò³é æå îáëàñò³
³øåì³÷íîãî óðàæåííÿ
á³ëî¿ ðå÷îâèíè,
äå áóëè çíàéäåí³
ðåã³îíè çá³ëüøåíèõ
ïîïóëÿö³é GFP(+)-îë³ãîäåíäðîöèò³â
[50].
Ç áàãàòüîõ
GFP(+)-îë³ãîäåíäðîöèò³â
ìåíøå 5% áóëè BrdU-ïîçèòèâíèõ.
Êð³ì òîãî, ñï³ëüíà
ëîêàë³çàö³ÿ ç
ìàðêåðîì îë³ãîäåíäðîöèò³â,
CC-1, ïîêàçàëà, ùî
ò³ëüêè 11% îë³ãîäåíäðîöèò³â,
ùî çíàéäåí³ â
³øåì³çîâàí³é
çîí³ á³ëî¿ ðå÷îâèíè,
ì³÷åí³ BrdU. Âðàõîâóþ÷è
ö³ äàí³, òî ìàëîéìîâ³ðíî,
ùî ìîëîä³ ïðîë³ôåðóþ÷³
êë³òèíè â³äïîâ³äàþòü
ïîâíîþ ì³ðîþ çà
â³äíîâëåííÿ çð³ëèõ
îë³ãîäåíäðîöèò³â.
Ìîæëèâî, ùî äàí³
ïðîôåñîðà ÌàéÀéâåð
íåäîîö³íþþòü
ê³ëüê³ñòü GFP(+)-îë³ãîäåíäðîöèò³â,
îòðèìàíèõ ç ïîïóëÿö³é
ïðîë³ôåðóþ÷èõ
êë³òèí. Òèì íå
ìåíø, ÑÑ-1(+)-îë³ãîäåíäðîö³òè
BrdU áóëî âèÿâëåíî
ïðîòÿãîì îäíîãî
òèæíÿ ï³ñëÿ òðàâìè
ñïèííîãî ìîçêó
ç âèêîðèñòàííÿì
àíàëîã³÷íîãî
ðåæèìó äîçóâàííÿ.
Íàâ³òü îäíîãî
³ìïóëüñó BrdU, âðàõîâóþ÷è
24 ãîäèí ï³ñëÿ òðàâìàòèçàö³¿
ñïèííîãî ìîçêó,
áóëî äîñòàòíüî,
ùîá â³äñòåæóâàòè
íîâîñòâîðåí³
îë³ãîäåíäðîöèòè
÷åðåç òèæäåíü
[50, 53].
 äàíèé
÷àñ øèðîêî âèçíàºòüñÿ,
ùî äîðîñë³ OPCs íåñóòü
â³äïîâ³äàëüí³ñòü
çà ðå쳺ë³í³çàö³þ
àêñîí³â ï³ñëÿ
³øåì³÷íîãî óøêîäæåííÿ.
Ó ìîäåëÿõ äå쳺ë³í³çàö³¿
áóëî äîáðå ïîêàçàíî,
ùî OPCs ðåàãóþòü íà
âòðàòó îë³ãîäåíäðîöèò³â
ïðîë³ôåðàö³ºþ
³ äèôåðåíö³àö³ºþ
â 쳺³ëíîóòâîðþþ÷³
îëèãîäåíäðîöèòè.
Íàïðèêëàä, â ñïèííîìîçêîâèõ
ìîäåëÿõ êîíòó糿
âòðàòà îë³ãîäåíäðîöèò³â
ñïîñòåð³ãàëàñÿ
îäíî÷àñíî ç ï³äâèùåííÿì
åêñïðåñ³¿ NG2 ³ ïðîë³ôåðàö³¿
êë³òèí â ðàíí³
òåðì³íè ï³ñëÿ
òðàâìè, ³ éøëà
çà ðàõóíîê çá³ëüøåííÿ
îë³ãîäåíäðîöèò³â
ïðîòÿãîì äåê³ëüêîõ
òèæí³â ï³ñëÿ òðàâìè.
Ó öèõ äîñë³äæåííÿõ,
çàì³íà îë³ãîäåíäðîöèò³â
÷³òêî ïðîñòåæóâàëàñÿ
â ñ³ðèõ ³ á³ëèõ
îáëàñòÿõ ìîçêó,
ùî ìåæóþòü ç ³øåì³çîâàíîþ
ä³ëÿíêîþ, ³ áóëà
ïîâ'ÿçàíà ç ôóíêö³îíàëüíèì
â³äíîâëåííÿì.
Êð³ì òîãî, â ìîäåë³
äå쳺ë³í³çàö³¿,
ðåòðîâ³ðóñí³
ìàðêóâàííÿ åíäîãåííî
ïðîë³ôåðóþ÷èõ
êë³òèí ïîêàçàëè,
ùî NG2 (+)-ïîïåðåäíèêè
ñïðèÿëè ðå쳺ë³í³çàö³¿.
Ìàëî óâàãè ïðèä³ëÿëîñÿ
â³äïîâ³ä³ NG2(+)-êë³òèí-ïîïåðåäíèê³â
³ çàì³í³ íèìè
îë³ãîäåíäðîöèò³â
ï³ñëÿ ³øåì³÷íîãî
óøêîäæåííÿ â
ìîçêó äîðîñëîãî
îðãàí³çìó, à ³ñíóþ÷³
äîñë³äæåííÿ áóëè
â îñíîâíîìó îáìåæåí³
ðîçãëÿäîì êë³òèííèõ
çì³í â ñ³ð³é ðå÷îâèí³,
äå 쳺ë³í³çàö³ÿ
º ì³í³ìàëüíîþ
ïîð³âíÿíî ç á³ëîþ
ðå÷îâèíîþ. Òèì
íå ìåíøå, ö³ äîñë³äæåííÿ
ïîêàçàëè, ùî çàëåæí³ñòü
÷àñîâîãî çá³ëüøåííÿ
NG2-³ìóíîðåàêòèâíîñò³
çá³ãàºòüñÿ ç
â³äíîâëåííÿì
îë³ãîäåíäðîöèò³â
³ 쳺ë³íó â ïðèëåãëèõ
äî ³øå쳿 çîíàõ
ìîçêó íà 1-2 òèæí³
ðåïåðôó糿. Ó ÿäð³
³øå쳿, îäíàê,
ñïîñòåð³ãàëàñÿ
óïîâ³ëüíåíà âòðàòà
NG2 + OPCs, îë³ãîäåíäðîöèò³â
³ 쳺ë³íó [50].
Äîñë³äíèêè
âèÿâèëè çá³ëüøåííÿ
NG2-³ìóíîðåàêòèâíîñò³
âñ³º¿ ³øåì³çîâàíî¿
á³ëî¿ ðå÷îâèíè,
ÿêå çáåð³ãàëîñÿ
íà 1 òèæäåíü ðåïåðôó糿.
 48 ãîäèí ï³ñëÿ
ðåïåðôó糿, NG2(+)-êë³òèíè
âèÿâëÿëèñÿ ã³ïåðòðîô³÷íèìè,
ç âèñîêèì ñòóïåíåì
ì³òîòè÷íî¿ àêòèâíîñò³,
îäíàê çì³íåíîþ
ìîðôîëî㳺þ. ×åðåç
1 òèæäåíü ï³ñëÿ
ðåïåðôó糿, NG2 êë³òèíè
â³äíîâëþâàëè
íîðìàëüíó ìîðôîëîã³þ
òà ³íäóêóâàëè
â³äíîâëåííÿ
GFP(+)-îë³ãîäåíäðîöèò³â.
Âðàõîâóþ÷è ö³
äàí³, ö³ëêîì ³ìîâ³ðíî,
ùî á³ëüø³ñòü â³äíîâëåíèõ
GFP(+)-êë³òèí, ðîçãëÿíóòèõ
ó äàíîìó äîñë³äæåíí³,
áóëè îòðèìàí³
íå â³ä OPCs, ÿê³ áóëè
³íô³êîâàí³
LV-MBP-EGFP [50].
Ó ìîäåëÿõ
òðàâìè ñïèííîãî
ìîçêó ³ äå쳺ë³í³çàö³¿,
äæåðåëà çàì³íè
êë³òèí ³ âèçíà÷àëüíèõ
÷èííèê³â ïðîë³ôåðàö³¿
³ äèôåðåíö³þâàííÿ
ìîæóòü â³äð³çíÿòèñÿ
â³ä àíàëîã³÷íèõ
ó á³ë³é ðå÷îâèí³
ãîëîâíîãî ìîçêó.
Íàïðèêëàä, â ãîëîâíîìó
ìîçêó ñóáâåíòðèêóëÿðíà
çîíà (SVZ) º ëîêàëüíèì
äæåðåëîì àêòèâíî
ïðîë³ôåðóþ÷èõ
êë³òèí íåðâîâî¿
ñèòåìè. [55, 56]
Íåðâîâ³
ñòîâáóðîâ³ êë³òèíè
â SVZ ðåàãóþòü íà
³øåì³÷íå ïîøêîäæåííÿ
çà ðàõóíîê çá³ëüøåííÿ
øâèäêîñò³ ïðîë³ôåðàö³¿
³ çìåíøåííÿ äîâæèíè
êë³òèííîãî öèêëó.
Êð³ì òîãî, ÌàéÀéâåð
âèÿâèëà çá³ëüøåííÿ
÷èñëà BrdU-êë³òèí
â SVZ â ìîçêó ³íòàêòíèõ
òâàðèí, ó ïîð³âíÿíí³
ç Sham-êîíòðîëüíèìè
òâàðèíàìè. Îñê³ëüêè
³ñíóº áàãàòî
äîêàç³â òîãî,
ùî êë³òèíè ñóáâåíòðèêóëÿðíî¿
çîíè ñïðèÿþòü
íåéðîãåíåçó
â ïðèëåãëèõ äî
³øå쳿 îáëàñòÿõ
êîðè øëÿõîì ì³ãðàö³¿
÷åðåç ìîçîëèñòå
ò³ëî, ö³ëêîì ìîæëèâî,
ùî äåÿê³ ç BrdU-êë³òèí,
ÿê³ â÷åí³ çíàéøëè
â ³øåì³çîâàí³é
çîí³ á³ëî¿ ðå÷îâèíè,
áóëè íåéðîãåííèìè
[56].
Êë³òèíè
ì³êðîã볿 òàêîæ
çíàéäåí³ ó ìåæàõ
ö³º¿ çîíè òà ñìóãàñòîìó
ò³ë³ ³ ìîæå ãðàòè
äîïîì³æíó ðîëü
â íåéðîãåíåç³.
Õî÷à êîìàíäà
ÌàêÀéâåð íåóâàæíî
âèâ÷èëà ïîøèðåííÿ
ì³êðîã볿 ïðè
³øåì³÷íîìó óðàæåíí³
á³ëî¿ ðå÷îâèíè,
ïðîòå ó äîñë³äíèê³â
ñïîñòåð³ãàëîñÿ
çá³ëüøåííÿ ³ìóíîðåàêòèâíîñò³
äëÿ ìàðêåðó ì³êðîã볿,
Iba-1. ªìí³ñòü SVZ-êë³òèí,
îòðèìàíèõ äëÿ
ãåíåðàö³¿ îë³ãîäåíäðîöèò³â,
ïðîäåìîíñòðîâàíà
â äå쳺ë³í³çóþ÷èõ
óðàæåííÿõ ìîçîëèñòîãî
ò³ëà [55].
³äíîâëåííÿ
ôóíêö³¿ á³ëî¿
ðå÷îâèíè çàçâè÷àé
â³äáóâàºòüñÿ
ó âèïàäêàõ ç ëþäñüêèì
³íñóëüòîì, à â
òâàðèííèõ ìîäåëÿõ
³íñóëüòó â³í
ïîâ'ÿçàíèé ç ïðîðîñòàííÿì
àêñîí³â. Öå áóäå
äóæå êîðèñíî
ïðè ç'ÿñóâàíí³
åíäîãåííèõ øëÿõ³â,
ùî âåäóòü äî â³äíîâëåííÿ
îë³ãîäåíäðîöèò³â
ï³ñëÿ ³øåì³÷íî¿
äå쳺ë³í³çàö³¿,
òàê ÿê ö³ ìåõàí³çìè
ìîæóòü òàêîæ
ñïðèÿòè â³äíîâëåííþ
ôóíêö³é á³ëî¿
ðå÷îâèíè ï³ñëÿ
³íñóëüòó [50].
Êîìàíäà
ÌàêÀéâåð òà ³íø³
äîñë³äíèêè íàâîäÿòü
äîêàçè, ùî ï³äòâåðäæóþòü
çäàòí³ñòü äî
ðåãåíåðàö³¿ á³ëî¿
ðå÷îâèíè, ÿêå
çàëåæèòü â³ä ê³ëüêîñò³
â³äíîâëåíèõ êë³òèí
³ çáåðåæåííÿ ïðîöåñ³â
쳺ë³íîãåíåçó.
Ëåíò³â³ðóñí³
âåêòîðè íå ò³ëüêè
ï³äâèùóþòü â³çóàë³çàö³þ
ìîðôîëîã³÷íèõ
çì³í îë³ãîäåíäðîöèò³â
ó â³äïîâ³äü íà
ïîøêîäæåííÿ, à
é çàáåçïå÷óþòü
åôåêòèâíèé ìåòîä
äëÿ îö³íêè ïîòåíö³éíèõ
çàõèñíèõ åôåêò³â
íîâî¿ òðàíñãåííî¿
åêñïðåñ³¿. Öå ìîæå
áóòè êîðèñíèì
ï³äõîäîì äëÿ ä³àãíîñòèêè
áàãàòüîõ çàõâîðþâàíü,
ïðè ÿêèõ àêòèâàö³ÿ
ïðîöåñ³â ðå쳺ë³í³çàö³¿
óøêîäæåíèõ ï³ñëÿ
òðàâìè ä³ëÿíîê
ìîçêó º òåðàïåâòè÷íîþ
ìåòîþ.
ìîçîê
쳺ë³í ³øåì³ÿ
îë³ãîäåíäðîöèò
Âèñíîâêè
Íà îñíîâ³
ðîçãëÿíóòîãî
ó ðîáîò³ ë³òåðàòóðíîãî
îãëÿäó ìîæíà
çðîáèòè íàñòóïí³
âèñíîâêè:
) ̳ºë³íîâ³
ìåìáðàíè - îáîâ'ÿçêîâà
ñêëàäîâà íåðâîâî¿
òêàíèíè, êëþ÷îâîþ
ôóíêö³ºþ ÿêèõ
º ³íòåãðàö³ÿ ïåðåäà÷³
íåðâîâîãî çáóäæåííÿ.
Îáì³í á³ëêîâî-ë³ï³äíèõ
êîìïîíåíò³â
쳺ë³íó ïîñò³éíî
çì³íþºòüñÿ ïðîòÿãîì
îíòîãåíåçó.
) Ñòðóêòóðà
쳺ë³íîâî¿ îáîëîíêè
ìîæå ïîðóøóâàòèñÿ
çà óìîâ ð³çíèõ
ïàòîëîã³÷íèõ
ñòàí³â íåðâîâî¿
ñèñòåìè àáî
âñüîãî îðãàí³çìó
â ö³ëîìó. Ïðè
ðóéíóâàíí³
쳺ë³íîâî¿ îáîëîíêè
â³äáóâàºòüñÿ
íàêîïè÷åííÿ
ó òêàíèíàõ ìîçêó
îñíîâíîãî á³ëêà
쳺ë³íó (ÎÁÌ). ̳æ
êîíöåíòðàö³ºþ
ÎÁÌ ³ ñòóïåíåì
äåñòðóêö³¿ (äåçàãðåãàö³¿)
쳺ë³íó ³ñíóº
ïðÿìà çàëåæí³ñòü.
4) Çà óìîâ
³øåì³÷íîãî óðàæåííÿ
á³ëî¿ ðå÷îâèíè
ìîçêó ñïîñòåð³ãàþºòüñÿ
ñóòòºâ³ çì³íè
âëàñòèâîñòåé
쳺ë³íîâî¿ îáîëîíêè.
HIF-1α
ó
âèñîêèõ êîíöåíòðàö³ÿõ
ìîæå áëîêóâàòè
æèòòºä³ÿëüí³ñòü
îë³ãîäåíäðîã볿,
ùî, ó ñâîþ ÷åðãó,
ïðèïèíÿº 쳺ë³íîãåíåç.
Ñïåöèô³÷í³ ïåïòèäàçè
òà ñô³íãî쳺ë³íàçè
â öèõ óìîâàõ ðóéíóþòü
쳺ë³íîâèé êàðêàñ,
òèì ñàìèì ïîðóøóþ÷è
ïðîâåäåííÿ íåðâîâîãî
³ìïóëüñó.
) Äåÿê³ íåéðîòðîïí³
ïðåïàðàòè (åíöåôàáîë,
ï³êðîçèä, α-êåòîãëóòàðàò
òîùî) ïîçèòèâíî
âïëèâàþòü íà
â³äíîâëåííÿ îë³ãîäåíäðîã볿,
ìîäóëþþ÷è 쳺ë³íîãåíåç
(쳺ë³í³çàö³þ).
) Âèêîðèñòàííÿ
â³ðóñíèõ âåêòîð³â,
çîêðåìà, ëåíò³â³ðóñíèõ
ðåêîìá³íàíò³â,
äîçâîëÿº ï³äâèùèòè
â³çóàë³çàö³þ
ìîðôîëîã³÷íèõ
çì³í îë³ãîäåíäðîöèò³â
ó â³äïîâ³äü íà
³øåì³÷íå óøêîäæåííÿ,
³ çàáåçïå÷èòè
åôåêòèâíèé ìåòîä
äëÿ ä³àãíîñòèêè
íåéðîäåãåíåðàòèâíèõ
çàõâîðþâàíü
íåðâîâî¿ ñèñòåìè,
íàïðèêëàä, ³øåì³÷íîãî
³íñóëüòó.
Ñïèñîê
á³áë³îãðàô³÷íèõ
ïîñèëàíü
1. Virchow, R. Über das ausgebreitete Vorkommen einer dem Nervenmark
analogen Substanz in den tierischen Geweben / R. Virchow // Virchows Arch. Pathol. Anat. - ¹ 6. - Ð. 562-572.
2. Îñíîâíîé
áåëîê ìèåëèíà.
Ñòðîåíèå, ñâîéñòâà,
ôóíêöèè, ðîëü â
äèàãíîñòèêå
äåìèåëèíèçèðóþùèõ
çàáîëåâàíèé
/ Â.Ï. ×åõîíèí, Î.È.
Ãóðèíà, Ò. Á. Äìèòðèåâà
è äð. // Âîïðîñû ìåäèöèíñêîé
õèìèè. - 2000. - N 6. - Ñ. 549-563.
3. Boggs, J.M.
Myelin basic protein: a multifunctional protein / J.M. Boggs // Cell Mol. Life
Sci.- 2006. - Vol. 63. - N 17. - Ð. 1945-1961.
. Arroyo,
E.J. On the molecular architecture of myelinated fibers / E.J. Arroyo, S. S.
Scherer // Histochem. Cell Biol. - 2000. - Vol. 113. - N 1. - Ð. 1-18.
. Baumann,
N. Biology of oligodendrocyte and myelin in the mammalian central nervous
system / N. Baumann, D. Pham-Dinh // Physiol Rev.- 2001. - Vol. 81. - N 2. - Ð.
871-927.
. Myelin
basic protein-diverse conformational states of an intrinsically unstructured
protein and its roles in myelin assembly and multiple sclerosis / G. Harauz, N.
Ishiyama, C.M. Hill [et al.] // Micron. - 2004. - Vol. 35. - N 7. - Ð.
503-542.
. Givogri,
M.I. New insights on the biology of myelin basic protein gene: the
neural-immune connection / M.I. Givogri, E.R. Bongarzone, A.T. Campagnoni // J.
Neurosci. Res.- 2000. - Vol. 59. - N 2. - Ð. 153-159.
8. Õàðàêòåðèñòèêà
ãåí³â ç³ çíèæåíîþ
åêñïðåñ³ºþ â ãë³îìàõ
ëþäèíè - ïîòåíö³éíèõ
ïóõëèíîñóïðåñîðíèõ
ãåí³â / Â. Â. Äìèòðåíêî,
Î. ². Áîéêî, Ê. Î. Øîñòàê
òà ³í. // Á³îïîë³ìåðè
³ êë³òèíà. - 2007. - 23, ¹
4. - Ñ. 347-362.
. Protein
tyrosine phosphatase receptor type z negatively regulates oligodendrocyte
differentiation and myelination / Ê. Kuboyama, À. Fujikawa, Ì.
Masumura [et al.] // PLoS One.- 2012. - Vol. 7. - N 11. - Ð. 1-11.
. Protein
S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial
fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological
patients / K.J. Lamers, P. Vos, Ì. Ì. Verbeek [et al.] // Brain
Res. Bull. - 2003. - Vol. 61. - N 3. - Ð. 261-264.
. Bedell,
M.A. Good genes in bad neighbourhoods / M.A. Bedell, N.A. Jenkins, N.G.
Copeland // Nat. Genet. - 1996. - Vol. 12. - N 3. - Ð. 229-232.
. Cerebral
white matter injury and damage to myelin sheath following whole-brain ischemia
/ Y. Chen, Q. Yi, G. Liu [et al.] // Brain Res.- 2013. - N 1495. - Ð.
11-17.
14. Planas A.M. Signalling pathways mediating
inflammatory responses in brain ischaemia
<http://www.ncbi.nlm.nih.gov/pubmed/17073799?dopt=Abstract>/ A.M. Planas,
R. Gorina, A. Chamorro //Biochem. Soc. Trans. - 2006.- ¹34.- Ð.1267-1270.
15. Ãóñåâ
Ë.È. Êâàíòîâàÿ
òåðàïèÿ â êàðäèîëîãèè
è àíãèîëîãèè.
Ìåòîäè÷åñêîå
ïîñîáèå äëÿ âðà÷åé
[Òåêñò] / Ë.È. Ãóñåâ,
Ò.Þ. Áàðñêîâà. -
Ì.: ÇÀÎ «ÌÈËÒÀ-ÏÊÏ
ÃÈÒ», 2006. - Ðóñ. - 31ñ.
16. Ãóñåâ
Å.È. Êëèíè÷åñêèå
ðåêîìåíäàöèè.
Íåâðîëîãèÿ è íåéðîõèðóðãèÿ
[Òåêñò]
/ Å.È. Ãóñåâ,
À.Í. Êîíîâàëîâ,
À.Á. Ãåõò. - Ì.: ÃÝÎÒÀÐ-Ìåäèà,
2007. - 510 ñ.
17. Ðóìÿíöåâà
Ñ.À. Ýíöåôàáîë
â òåðàïèè áîëüíûõ
ñ ýíöåôàëîïàòèÿìè
ðàçëè÷íîãî ãåíåçà.
²íòåðíåò-ðåñóðñ:
http://www.rmj.ru <http://www.rmj.ru/>/.
18. Cerebral
ischemia or intrauterine inflammation promotes differentiation of
oligodendroglial precursors in preterm ovine fetuses: possible cellular basis
for white matter injury / R. Kitanishi
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Kitanishi%20R%5BAuthor%5D&cauthor=true&cauthor_uid=25504018>,
Ò. Matsuda <http://www.ncbi.nlm.nih.gov/pubmed/?term=Matsuda%20T%5BAuthor%5D&cauthor=true&cauthor_uid=25504018>,
S. Watanabe
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Watanabe%20S%5BAuthor%5D&cauthor=true&cauthor_uid=25504018>[et al.] // Tohoku J. Exp. Med
<http://www.ncbi.nlm.nih.gov/pubmed/25504018>. - 2014. - Vol. 234. - ¹
4. - Ð. 299-307.
19. Fern, R.F
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Fern%20RF%5BAuthor%5D&cauthor=true&cauthor_uid=25043122>.
White matter injury: Ischemic and nonischemic / R.F.
Fern, Ñ. Matute, Ð.Ê.
Stys <http://www.ncbi.nlm.nih.gov/pubmed/?term=Stys%20PK%5BAuthor%5D&cauthor=true&cauthor_uid=25043122>
// Glia <http://www.ncbi.nlm.nih.gov/pubmed/25043122>. - 2014. - Vol. 62.
- ¹ 11. - Ð. 1780-1789.
20. MicroRNAs participate in the murine
oligodendroglial response to perinatal hypoxia-ischemia
/ D. Birch,
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Birch%20D%5BAuthor%5D&cauthor=true&cauthor_uid=25003912>Â.Ñ.
Britt,
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Britt%20BC%5BAuthor%5D&cauthor=true&cauthor_uid=25003912>S.C.
Dukes <http://www.ncbi.nlm.nih.gov/pubmed/?term=Dukes%20SC%5BAuthor%5D&cauthor=true&cauthor_uid=25003912>[et al.] // Pediatr. Res.
<http://www.ncbi.nlm.nih.gov/pubmed/25003912> - 2014. - Vol. 76. - ¹
4. - Ð. 334-340.
21. Oligodendrocyte
pathophysiology and treatment strategies in cerebralischemia / G. Mifsud,
Ñ.
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Mifsud%20G%5BAuthor%5D&cauthor=true&cauthor_uid=24703424>Zammit
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Zammit%20C%5BAuthor%5D&cauthor=true&cauthor_uid=24703424>,R.
Muscat <http://www.ncbi.nlm.nih.gov/pubmed/?term=Muscat%20R%5BAuthor%5D&cauthor=true&cauthor_uid=24703424>[et al.] // CNS Neurosci Ther.
<http://www.ncbi.nlm.nih.gov/pubmed/24703424> - 2014. - Vol. 20. - ¹
7. - Ð. 603-612.
22. Neuroprotective effects of neuregulin-1 ß
on oligodendrocyte type 2 astrocyte progenitors following oxygen
and glucose deprivation / Z. Linying,
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Linying%20Z%5BAuthor%5D&cauthor=true&cauthor_uid=24529326>W.
Wei, <http://www.ncbi.nlm.nih.gov/pubmed/?term=Wei%20W%5BAuthor%5D&cauthor=true&cauthor_uid=24529326>-
W. Minxia
<http://www.ncbi.nlm.nih.gov/pubmed/?term=Minxia%20W%5BAuthor%5D&cauthor=true&cauthor_uid=24529326>[et al.] // Pediatr. Neurol
<http://www.ncbi.nlm.nih.gov/pubmed/24529326>. - 2014. - Vol. 50. - ¹
4. - Ð. 357-362.
23. Oligodendrocytedegenerationandrecoveryafterfocalcerebral ischemia / S.R. McIver,
M. Muccigrosso, E.R. Gonzales [et al.] //
Neuroscience. - 2010. - Vol. 169. - ¹ 3. - Ð. 1364-1375.
Ðàçìåùåíî
íà Allbest.ru