Моносахариды и их физиологическая роль
МИНИСТЕРСТВО
СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ
ФГБОУ ВПО
ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ ИМЕНИ ПЕТРА I
КАФЕДРА
БИОЛОГИИ И ЗАЩИТЫ РАСТЕНИЙ
Курсовая
работа
На тему
«Моносахариды и их физиологическая роль
Выполнил:
Кучугурная Н.С.
Содержание
Введение
. Виды моносахаридов
. Структура моносахаридов
. Представители моносахаридов
. Свойства моносахаридов и их
физиологическая роль
. Методы исследования
. Практическая часть
Заключение
Литература
Введение
Углеводы - это полигидроальдегиды и
полигидрокетоны с общей формулой (СН2О)n, наиболее
распространенный на Земле класс органических соединений, входящих в состав всех
живых организмов. В клетках животных тканей их содержится около 2% сухой массы,
в клетках растений - 80% и более.
Углеводы являются первичными продуктами
фотосинтеза, в круговороте веществ в природе они играют роль своеобразного
моста между неорганическими и органическими соединениями. Выделяемая при
биологическом окислении углеводов химическая энергия используется в реакциях
синтеза, активном переносе веществ через клеточные мембраны, преобразуется в
механическую работу. Промежуточные продукты распада углеводов служат исходными
веществами для синтеза других соединений, необходимых живой клетке. На долю
углеводов приходится 60-70% пищевого рациона. Они содержатся преимущественно в
растительных продуктах, являются основными компонентами хлеба, круп, макарон,
кондитерских изделий; служат исходными веществами в бродильной промышленности
(спирт, вино, пиво), в производстве пищевых кислот - уксусной, молочной,
лимонной; служат важнейшими субстратами при микробиологических синтезах
ферментов, антибиотиков. Из животных продуктов углеводы содержатся в молоке. В
результате промышленной переработки сельскохозяйственного сырья (кукурузы,
картофеля, сахарной свеклы) получают чистые продукты - сахар (сахарозу) и
крахмал.
Углеводы явились первыми веществами, выделенными
в чистом виде, ранее других соединений были подвергнуты кислотному и
ферментативному гидролизу, сбраживанию; одними из первых были синтезированы
химическим путем. Большой вклад в изучение строения и химии углеводов внесли
А.М. Бутлеров, Э. Фишер, В.Н. Хеуорс.
Класс углеводов включает самые разнообразные
соединения, начиная от низкомолекулярных, содержащих три углеродных атома, и
кончая соединениями с длинными углеродными неразветвленными и
многократноразветвленными цепями и с большой молекулярной массой, достигающей
нескольких миллионов дальтон.
Классификация углеводов основана на их структуре
физико-химических свойствах. Структурную классификацию этих веществ можно
представить в виде следующей схемы:
По физико-химическим свойствам углеводы делятся
на нейтральные, содержащие только гидроксильные и карбонильные группы;
основные, включающие кроме названных групп аминогруппу (аминосахара); кислые,
содержащие кроме гидроксильных и карбонильных групп карбоксильные группы
Моносахариды - простые сахара с n=3ч10
углеродных атомов, представляющие собой полигидроксиальдегиды или
полигидроксикетоны. Они называются соответственно альдозами или кетозами.
1. Виды моносахаридов
Существует несколько видов классификации
моносахаридов:
) В зависимости от числа углеродных атомов,
содержащихся в молекуле, моносахариды делятся на триозы, тетрозы, пентозы,
гексозы, октозы, нонозы. Самыми простыми моносахаридами являются триозы -
глицеральдегид и дигидроксиацетон.
) В молекулах моносахаридов одновременно
содержится несколько функциональных групп: карбонильная группа (альдегидная или
кетонная) и несколько гидроксильных групп.
В зависимости от вида карбонильной группы
моносахариды подразделяются на:
альдозы - в моносахариде содержится альдегидная
группа, которая локализуется у первого углеродного атома;
кетозы - содержится кетогруппа, которая у
природных кетоз локализуется у второго углеродного атома
Наиболее важные в физиологическом отношении
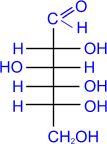
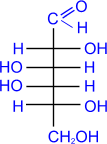
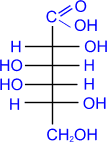
гексозы: из альдоз - глюкоза, галактоза, манноза; из кетоз - фруктоза.
. Структура моносахаридов
Элементарным звеном всех высших углеводов, так
же как и низкомолекулярных производных этого класса, являются моносахариды. В
типичных случаях их молекулы содержат прямую насыщенную цепь из пяти или шести
углеродных атомов, каждый из которых несет гидроксильный заместитель, а один
окислен до альдегидное или кетонной группы. Таковы, например, альдопентозы 1 (т.е.
С 5 -сахара с альдегидной группой), альдогексозы 2 (т.е. С 6 -сахара с
альдегидной группой), кетогексозы (C 6 -сахара с кетогруппой) и др. Кроме
наиболее распространенных пентоз и гексоз, существуют еще C 3 -, C 4 -, C 7 -,
C 8 - и даже C 9 -моносахариды, называемые соответственно триозами, тетрозами,
пентозами, октозами и нонозами.
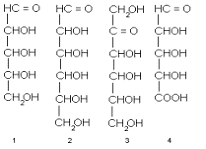
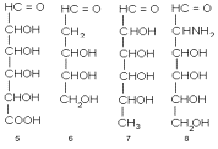
Концевое CH2ОН - звено цепи (кстати,
нумеруют углеродные атомы в моносахаридах всегда, начиная с карбонильной группы
или с ближайшего к ней конца цепи) может быть окислено до карбонила. При этом
возникает другой распространенный подкласс моносахаридов - уроновые кислоты,
например альдопентуроновые кислоты 4 или альдогексуроновые кислоты 5. В других
случаях наоборот, у углеродного атома отсутствует гидроксил. Возникает так
называемое дезоксизвено и соответственно дезоксисахара, например,
2-дезокси-альдопентозы (в частности, 2-дезокси-D-рибоза, комнонент ДНК) или
6-дезокси-альдогексозы 7. Одна из гидроксильных групп (а иногда и две или даже
три) может быть заменена аминогруппой. Это аминосахара, как, например,
2-амино-2-дезокси-альдогексозы 8, часто, но нестрого называемые гексозаминами.
Бывают, наконец, и моносахариды с разветвлением углеродного скелет, а также с
несколькими видами отклонений от классических структур типа 1-3 одновременно.
Не следует думать, что названные типы соединений - некие искусственные
«монстры». Наоборот, все это типичные и достаточно распространенные структурные
элементы более сложных природных углеводов (другое дело, что все они могут быть
получены и синтетически). Более того, существуют в природе и нередко играют
весьма важную роль в жизнедеятельности клетки и более сложные моносахариды, еще
более отдаляющиеся по структуре и составу от классических «угле-водов». Здесь
мы хотели указать на наиболее распространенные типы структурных вариаций,
встречающихся в этом классе.
В каждой из рассмотренных структур имеется по
нескольку ассиметричных центров и, следовательно, для каждой возможно
существование 2 n стереоизомеров, где n - число ассиметрических центров. В
альдогексозах (2), например, их 4. В классификационных целях из них выделяют
один: тот, который максимально удален от карбонильной группы (для гексоз это
С-5), и по его конфигурации (D или L) относят моносахарид соответственно к D-
или L-ряду. Для описания конфигурации применяют серию тривиальных названий для
всех возможных комбинаций относительных конфигураций. Так возникают такие
названия, как D-глюкоза (9), D-галактоза (10), D-арабиноза (11), L-арабиноза
(12), D-рибоза (13) и др.
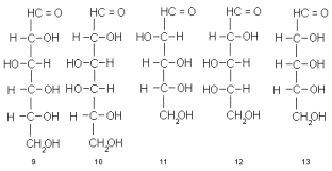
Структуры 9-13 написаны в проекции Фишера.
Напомним, что по правилам фишеровской проекции, тетраэдрический углеродный атом
располагают так, чтобы его четыре связи проектировались на плоскость в виде
креста, причем связи, смотрящие на наблюдателя (над плоскостью бумаги),
образуют горизонтальную линию, а уходящие под плоскость бумаги (от наблюдателя)
- вертикальную, как это показано на примере формул 14 и 15. Чаще всего символ
центрального атома опускают, заменяя его точкой пересечения прямых. Это
показано на схеме, составленной в проекции Фишера, где 1-4 - заместители при
центральном углеродном атоме, атом углерода в плоскости бумаги, заместители 1 и
3 - над плоскостью, заместители 2 и 4 - под плоскостью. Итак, главные источники
структурного и функционального многообразия моносахаридов лежат в различном
наборе функциональных групп (карбонильные, гидроксильные, карбоксильные,
аминогруппы и т.д.) и в не меньшей степени в различиях стереохимии. Последнее
надо особо подчеркнуть. В обычном курсе органической химии рассматривают
свойства и различия отдельных классов соединений, основанные в первую очередь
на различиях бутлеровских структур, и отдельно в виде некоего экзотического
приложения - вопросы стереохимии. В химии сахаров такого разделения не может
быть. В принципе вся эта область есть органическая стереохимия par excellence,
и все многообразие свойств углеводов проистекает, прежде всего, из их
стереохимических различий. Так, например, кардинальные различия свойств и
биологической функции целлюлозы и одного из двух компонентов крахмала - амилозы
- обусловлены различием конфигурации лишь одного ассиметричного центра
элементарного звена этих стереоизомерных полисахаридов. Целый ряд классических
деструктивных методов установления строения органических веществ привел
исследователей прошлого века к структурам типа 1-13 для моносахаридов.
И в смысле справедливости строения углеродного
скелета и положения заместителей эти структуры отражают непреложную, добытую
экспериментом истину. Тем не менее, они не соответствуют действительному
строению моносахаридов, хотя и удобны в дидактическом плане: для описания и
запоминания относительных конфигураций ассиметрических центров (чем мы в
дальнейшем еще воспользуемся). Чтобы продвинуться дальше (ближе к реальности)
нам нужно вспомнить некоторые свойства карбонильных соединений. Альдегиды и
кетоны (обычные) в присутствии кислот легко реагируют со спиртами, образуя
ацетали и кетали. Как и многие другие реакции конденсации, образование ацеталей
и кеталей резко ускоряется в том случае, когда реагирующие группы
пространственно сближены, например, расположены на подходящем расстоянии внутри
одной молекулы.
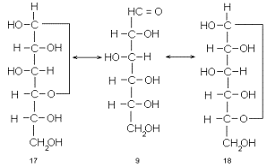
Моносахарижы представлены полиоксиальдегидами
или полиоксикетонами, в которых карбонильная группа может на выбор вступать в
конденсацию с любым гидроксилом той же молекулы. Естественно, что такая реакция
осуществляется с наиболее «удобно» расположенным гидроксилом. Вследствие ряда
причин, на которых мы сейчас не будем останавливаться, оптимальное расположение
карбонильной и спиртовой групп отвечает замыканию пяти- и шестичленных циклов.
Действительно, одна из спиртовых гидроксильных групп моносахарида, например
D-глюкозы, самопроизвольно вступает в конденсацию с альдегидной группой той же
молекулы с образованием ацетальной связи. При этом возникает циклическое
производное, но не ацеталь, а полуацеталь, т.е. такое, в котором один из
заместителей при бывшем карбонильном атоме углерода - спиртовый остаток, а
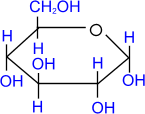
другой - гидроксильная группа. Так образуются пятичленные, так называемые
фуранозные циклы (17), если в реакции участвует гидроксил при С-4 или
шестичленные - пиранозные циклы (18), если в реакцию вступает гидроксил при
С-5.
. Представители моносахаридов
глюкоза является основным компонентом
виноградного сахара, хорошо сбраживается дрожжами Saccharomuces
cerevisiae и используется в
производстве виноградных вин. В чистом виде глюкоза усваивается организмом лучше
всех других углеводов. Ее получают при кислотном или ферментативном гидролизе
картофельного, кукурузного крахмала. Глюкоза входит в состав фруктов, зеленых
частей растений, семян хлебных злаков, играет важную роль при сбраживании
пшеничного и ржаного теста в производстве хлебобулочных изделий.
D-фруктоза
содержится в растениях, в больших количествах в меде, плодах, потому часто
называется фруктовым или плодовым сахаром. Из всех моносахаридов фруктоза -
самый сладкий сахар, она в 1,5 раза слаще сахарозы, в 2 раза - глюкозы. Она
заслуживает особого внимания при производстве кондитерских изделий для больных
сахарным диабетом. Существует ферментативный метод получения фруктозы из
глюкозы. Она также сбраживается дрожжами Saccharomuces
cerevisiae.
D-галактоза сбраживается
дрожжами Saccharomuces
fragilis, широко
используется в производстве кисломолочных продуктов. В больших количествах она
присутствует в сульфитных щелоках, образующихся в качестве побочных продуктов
при обработке древесины бисульфитом кальция в целлюлозной промышленности.
D-манноза
сбраживается дрожжами S.
cerevisiae несколько
медленнее, чем глюкоза и фруктоза. В больших количествах обнаруживается в
сульфитных щелоках, что делает их пригодными для многих процессов ферментации
(производство кормовых дрожжей, этанола).
L-сорбоза - сахар,
содержащийся в сброженном бактериями соке рябины. Образуется при окислении
шестиатомного спирта D-сорбита некоторыми бактериями. Сорбоза имеет большое
значение в витаминной промышленности как важный промежуточный продукт синтеза
антицинготного витамина С. Если производить окисление сорбита с помощью
бактерии Acetobacter
suboxydans при достаточном
доступе воздуха, то выход сорбозы достигает 90%
L-арабиноза широко
распространена в растениях в качестве составной части слизей, гумми, пектиновых
веществ и гемицеллюлоз. Арабинозу обычно получают путем кислотного гидролиза
вишневого клея или свекловичного жома. Не сбраживается дрожжами.ксилоза
(древесный сахар) входит в состав многих растительных слизей, гумми и
гемицеллюлоз. Образуется при кислотном гидролизе отрубей, соломы, древесины,
хлопковой шелухи. Для кондитерской промышленности ксилозу получают в довольно
значительных количествах (~12%) путем кислотного гидролиза кукурузных
кочерыжек. Обычными дрожжами ксилоза не сбраживается. При восстановлении
ксилоза дает многоатомный спирт ксилит, который вдвое слаще сахарозы, но не
усваивается организмом человека. Поэтому ксилит используют вместо сахара в
питании больных диабетом и ожирением.
D-рибоза и D-2-дезоксирибоза
входят в состав нуклеиновых кислот. Производное рибозы - спирт рибит - является
составной частью некоторых витаминов и ферментов. Именно поэтому рибоза и
дезоксирибоза представляют чрезвычайный интерес для биохимиков и биологов.
Рибоза и фруктоза - моносахариды, содержащиеся в природных соединениях в
фуранозной форме.
D-апиноза -
представитель группы моносахаридов с разветвленной углеродной цепью
(альдопентоза); найдена во многих растениях. Входит в состав флавонового
гликозида апиина, содержащегося в петрушке.
Сорбит (глюцит). Один из наиболее
распространенных в растениях многоатомных спиртов.
Особенно часто D-сорбит встречается в различных
фруктах и ягодах. В ягодах рябины, из сока которых он впервые был выделен, его
содержится до 7%. Заметные количества сорбита содержат плоды слив, персиков,
яблок, вишен, груш и абрикосов. В листьях его содержится до 4,5% на сухую
массу. Из воды кристаллизуется в виде тонких бесцветных палочек. При окислении,
в зависимости от условий, может образовывать глюкозу, фруктозу или сорбозу.
Маннит широко распространен в растениях. Часто
выделяется на поверхности коры некоторых деревьев. Он в большом количестве
содержится в так называемой «манне», которая представляет собой засохшие
выделения некоторых видов ясеня, а также растущего в Аравии тамарикса.
Содержится также в водорослях, грибах, в заразихе, многих овощах и плодах. При
окислении дает маннозу и фруктозу.
Дульцит (галактит). Подобно сорбиту и манниту,
он содержится во многих растениях, выделяется на поверхности коры деревьев.
Выделяется также на поверхности листьев бересклета. При окислении дает
галактозу и слизевую кислоту.
. Свойства моносахаридов и их физиологическая
роль
Физические свойства моносахаридов.
Моносахариды - твердые вещества, легко
растворимые в воде, плохо - в спирте и совсем нерастворимые в эфире. Водные
растворы имеют нейтральную реакцию на лакмус. Большинство моносахаридов
обладают сладким вкусом, однако меньшим, чем свекловичный сахар.
Химические свойства моносахаридов
I. Реакции по
карбонильной группе.
. Окисление.) Как и у всех альдегидов, окисление
моносахаридов приводит к соответствующим кислотам. Так, при окислении глюкозы
аммиачным раствором гидрата окиси серебра образуется глюконовая кислота
(реакция "серебряного зеркала").
 D- глюкоза +
2[Ag(NH3)2]OH
D- глюкоза +
2[Ag(NH3)2]OH
 аммониевая соль
D-глюконовой кислоты + 2Ag + 3NH3 + H2O
аммониевая соль
D-глюконовой кислоты + 2Ag + 3NH3 + H2O
) Реакция моносахаридов с гидроксидом меди при
нагревании так же приводит к альдоновым кислотам.
 D- галактоза +
2Cu(OH)2
D- галактоза +
2Cu(OH)2
 D- галактоновая
кислота + Cu2O + 2H2O
D- галактоновая
кислота + Cu2O + 2H2O
) Более сильные окислительные средства окисляют
в карбоксильную группу не только альдегидную, но и первичную спиртовую группы,
приводя к двухосновным сахарным (альдаровым) кислотам. Обычно для такого
окисления используют концентрированную азотную кислоту.
 D- глюкоза HNO3(конц.)
D- глюкоза HNO3(конц.)
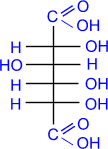 сахарная (D-
глюкаровая) кислота
сахарная (D-
глюкаровая) кислота
 D- глюкоза LiAlH4
D- глюкоза LiAlH4
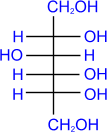 D- сорбит
D- сорбит
Несмотря на схожесть химических свойств
моносахаридов с альдегидами, глюкоза не вступает в реакцию с гидросульфитом
натрия (NaHSO3).. Реакции по гидроксильным группам
Реакции по гидроксильным группам моносахаридов
осуществляются, как правило, в полуацетальной (циклической) форме.
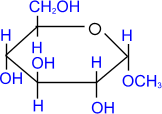
. Алкилирование (образование простых эфиров).
 , D- глюкопираноза
+ СH3ОН(газ)
, D- глюкопираноза
+ СH3ОН(газ)
 метил- ,
D- глюкопиранозид + H2О
метил- ,
D- глюкопиранозид + H2О
При действии метилового спирта в присутствии
газообразного хлористого водорода атом водорода гликозидного гидроксила
замещается на метильную группу.
При использовании более сильных алкилирующих
средств, каковыми являются, например, йодистый метил или диметилсульфат,
подобное превращение затрагивает все гидроксильные группы моносахарида.
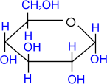
СH3I
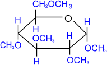 пентаметил, D-
глюкопираноза
пентаметил, D-
глюкопираноза
2. Ацилирование (образование сложных эфиров).
При действии на глюкозу уксусного ангидрида
образуется сложный эфир - пентаацетилглюкоза.

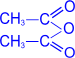
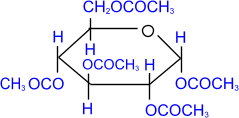 пентаацетил, D-
глюкопираноза
пентаацетил, D-
глюкопираноза
. Как и все многоатомные спирты, глюкоза с
гидроксидом меди (II) дает интенсивное синее окрашивание (качественная
реакция).. Специфические реакции
Глюкоза характеризуется и некоторыми
специфическими свойствами - процессами брожения. Брожением называется
расщепление молекул сахаров под воздействием ферментов (энзимов). Брожению
подвергаются сахара с числом углеродных атомов, кратным трем. Существует много
видов брожения, среди которых наиболее известны следующие:) спиртовое
брожение6H12O6 2CH3-CH2OH(этиловый
спирт) + 2CO2) молочнокислое брожение6H12O6
2CH3-CH-СОOH(молочная кислота) I OH) маслянокислое брожение6H12O6
CH3-CH2-СН2-СОOH(масляная кислота) + 2Н2
+ 2CO2
Физиологическая роль моносахаридов.
Глюкоза является альдозой и гексозой.
. Глюкоза входит в состав крахмала, клетчатки,
сахарозы.
. Является единственным источником энергии для
нервной ткани, активно используется мышцами и эритроцитами. В течение суток у
человека массой 70 кг головной мозг потребляет около 100 г глюкозы,
поперечно-полосатые мышцы - 35 г, эритроциты - 30 г.
. При достаточно большом количестве в клетке
глюкоза запасается в виде гликогена.
. В гепатоцитах (клетках печени) и адипоцитах
(клетках жировой ткани) глюкоза участвует в синтезе триацилглицеролов и в
гепатоцитах в синтезе холестерина.
. Определённое количество глюкозы участвует в
образовании рибозо-5-фосфата и НАДФН (пентозофосфатный путь).
. Глюкоза используется для синтеза гликозаминов
и затем структурных или иных гетерополисахаридов. Постоянный уровень
концентрации глюкозы в крови поддерживается с помощью гормонов поджелудочной
железы инсулина и глюкагона. Глюкоза поступает в организм при расщеплении в
кишечнике продуктов содержащих крахмал, сахарозу, лактозу или мальтозу, с
мёдом, фруктами, ягодами и рядом овощей, в которых она находится в свободном
виде. Значительное количество глюкозы содержится в абрикосах, арбузах,
баклажанах, бананах, виногораде, землянике, вишне, белокочанной капусте,
малине, облепихе, хурме, черешне, тыкве.
Биологическая роль фруктозы.
. Фруктоза обладает наибольшей сладостью из всех
натуральных сахаров. Для достижения одинакового вкусового эффекта её нужно в 2
раза меньше, чем глюкозы или сахарозы.
. Большая часть фруктозы при поступлении в
организм быстро усваивается тканями без участия инсулина, другая часть
превращается в глюкозу. Продукты, содержащие фруктозу, при определённых
условиях, могут быть рекомендованы больным сахарным диабетом. Больным ожирением
они противопоказаны, так как способствуют более быстрому и интенсивному набору
веса, чем продукты, содержащие глюкозу. Поэтому людям с повышенной массой тела
такими пищевыми веществами злоупотреблять не следует.
. Соединяясь с железом, фруктоза образует
хелатные соединения, которые намного лучше всасываются, чем обычные соединения
железа других продуктов, поэтому при анемии очень эффективно добавлять в свой
рацион пищевые вещества, богатые фруктозой. В данной ситуации её также можно
использовать и в чистом виде.
Большое количество фруктозы содержится в айве,
арбузе, бананах, грушах, вишне, винограде, мёде, малине, облепихе, болгарском
перце, хурме, чёрной смородине, черешне, яблоках.
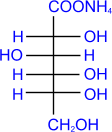
Биологическая роль галактозы.
Галактоза принадлежит к альдозам и гексозам.
. Галактоза является составной частью лактозы -
дисахарида молока.
. Большая часть галактозы превращается в печени
в глюкозу, и наоборот, глюкоза способна превращаться в галактозу.
. Методы исследования
Моносахариды представляют собой нелетучие,
легкорастворимые в воде и других полярных растворителях соединения, что
обусловлено наличием в их молекулах большого числа гидроксильных групп. Многие
из них легко кристаллизуются, устойчивы при воздействии разведенных кислот. В
более жестких условиях при воздействии кислот из пентоз образуется фурфорол, а
из гексоз - оксиметилфурфорол. Моносахариды неустойчивы при воздействии на них
щелочей: в их молекулах происходит разрыв углерод-углеродных связей.
За исключением дигидроксиацетона, все простые
сахара содержат ассиметрические углеродные атомы; общее их число равно числу
расположенных внутри углеродной цепи групп -C(H)OH,
а число стереоизомеров равно 2n, где n - число ассиметрических
атомов углерода.
Простейшая альдоза глицеральдегид с n=1 может
существовать в виде двух различных стереоизомеров:
Альдогексоза С6Н12О6 с
n = 4 может быть представлена любым из 16 стереоизомеров, 8 из которых
относятся к D-ряду, остальные 8 - к L-ряду. Если два стереоизомера различаются
конфигурацией одного из ассиметрических углеродных атомов, они называются
этимерами; так манноза является этимером глюкозы по второму углеродному атому,
галактоза - этимером глюкозы по четвертому углеродному атому.
Поскольку моносахариды содержат
ассиметрические углеродные атомы, то они обладают оптической активностью.
Интенсивность вращения плоскополяризованного луча для разных сахаров является
различной; она характеризуется удельным вращением 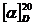 ,
представляющим собой угол, на который поворачивается плоскость поляризованного
луча, образованного пламенем натрия (фраунгоферова линия D, составляющая 589,3
нм) и проходящего через раствором сахара (1 г/см3) в трубке длиной
100 нм при 20 оС. Моносахариды обладают как правым (+), так и левым
(-) вращением; так, D-глюкоза имеет
,
представляющим собой угол, на который поворачивается плоскость поляризованного
луча, образованного пламенем натрия (фраунгоферова линия D, составляющая 589,3
нм) и проходящего через раствором сахара (1 г/см3) в трубке длиной
100 нм при 20 оС. Моносахариды обладают как правым (+), так и левым
(-) вращением; так, D-глюкоза имеет 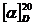 = +52,5о, а D-фруктоза -
= +52,5о, а D-фруктоза - 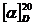 = -92,4о.
Оптическая активность сахаров нашла широкое применение (особенно в медицине)
при их количественном определении методом поляризации.
= -92,4о.
Оптическая активность сахаров нашла широкое применение (особенно в медицине)
при их количественном определении методом поляризации.
В водном растворе моносахариды
образуют равновесные системы, состоящие из молекул с развернутой цепью и
молекул с циклической структурой. Циклические структуры отсутствуют у триоз,
тетроз. Начиная с пентоз, происходит самопроизвольная реакция
внутримолекулярной конденсации одной из гидроксильных групп и карбонильной
группы моносахарида с образованием цикла
В случае альдогексоз возникает
шестичленное кольцо (формируется связь С1-С3),
кетогексозы образуют шестичленное кольцо (С2-С5,
соответственно). Углеродный атом карбонильной группы становится, таким образом,
новым центром ассиметрии и называется аномерным углеродным атомом, слева (НО-С)
- в-аномером. Реакция образования полуацеталя обратима, а два аномера способны
превращаться друг в друга, проходя через стадию образования молекулы со
свободной карбонильной группой. В биохимических реакциях иногда участвует лишь
один из изомеров, иногда - оба, а иногда необходимо наличие сахара со свободной
карбонильной группой.
По физико-химическим свойствам б- и
в-аномеры существенно отличаются друг от друга. Входя в олиго- и полисахариды в
качестве строительных блоков, они образуют совершенно различные углеводы: так,
б-D-глюкоза является структурной единицей полисахарида амилозы, в-D-глюкоза -
целлюлозы, оба моносахарида имеют резко отличные физико-химические свойства,
различные биологические функции в живой клетке. Аномеры обладают различной
оптической активностью; так, б-D-глюкоза имеет 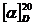 = +18,7о, в-D-глюкоза -
= +18,7о, в-D-глюкоза -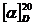 = +112,2о.
Оба эти соединения были выделены в чистом виде. При растворении б- или
в-изомера глюкозы в воде оптическое вращение раствора постепенно меняется,
достигая
= +112,2о.
Оба эти соединения были выделены в чистом виде. При растворении б- или
в-изомера глюкозы в воде оптическое вращение раствора постепенно меняется,
достигая 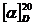 = +52,5о;
в случае в-D-глюкозы величина этого показателя уменьшается, раствора
б-D-глюкозы - возрастает; это явление получило название мутаротации.
= +52,5о;
в случае в-D-глюкозы величина этого показателя уменьшается, раствора
б-D-глюкозы - возрастает; это явление получило название мутаротации.
Как полиолы, моносахариды могут
вступать в реакцию со спиртами с образованием простых эфиров. Аномерный атом
углерода обладает наибольшей реакционной способностью, а образовавшаяся
структура полногоацеталя называется гликозидом, образовавшаяся связь -
гликозидной связью. Так, гидроксильная группа аномерного атома углерода легко
реагирует в кислой среде с метиловым спиртом, давая О-метильные производные -
метилгликозиды. D-глюкоза дает с ним метил-б-гликозид и метил-в-гликозид.
Метилирование остальных гидроксильных групп моносахаридов требует более жестких
условий, например, обработки диметилсульфатом или метилодидом в присутствии
оксида серебра.
Гликозидная связь при аномерном
атоме углерода легко образуется с другими спиртами, а также в результате
реакции моносахарида с гидроксильными группами других моносахаридов. Продуктом
такой реакции является дисахарид.
Из производных сахаров наиболее
важное биологическое значение имеют эфиры фосфорной кислоты и
нуклеозиддифосфатсахара.
В клетках эти производные легко
образуются при ферментативных реакциях. Биологическое значение сахарофосфатов
состоит в том, что они представляют собой метаболически активные формы сахаров,
играющие важную роль в биоэнергетике живой клетки. Фосфорилирование
моносахаридов переводит их в мобильное реакционноспособное состояние, а при
биологическом окислении химическая энергия моносахарида аккумулируется в
фосфатном радикале.
Фосфорилирование выгодно клетке еще
и потому, что клеточная мембрана мало проницаема для фосфорных эфиров
моносахаридов, что очень важно для активного транспорта моносахаридов, что
очень важно для активного транспорта моносахаридов из внешней среды внутри
клетки.
При химическом или биологическом
окислении концевых групп альдоз до карбоксильных образуется три различных
производных альдоз. Кислоты, образующиеся при окислении альдегидной группы,
называются альдоновыми. Эта реакция успешно используется в методах
количественного определения моносахаридов с помощью таких окислителей, как
фелинговые реактивы, К3Fе(СN)6,
йод. Если окислению подвергается концевая группа - СН2ОН, то при этом
образуются маннуровая, галактуроновая кислоты. Окисление двух концевых групп до
карбоксильной дает альдаровые кислоты - глюкароновую, галактаровую,
биологическая роль которых не установлена. Альдаровые кислоты образуются при
действии достаточно сильных окислителей, таких как азотная кислота.
Карбонильная группа моносахаридов
легко вступает в реакции восстановления с образованием сахароспиртов. В клетках
растений, микроорганизмов это восстановление осуществляется при помощи
ферментов. Простейшим сахароспиртов является трехатомный спирт глицерин,
образующийся при восстановлении глицеральдегида. Глюкоза при восстановлении
дает шестиатомный сахароспирт сорбит, галактоза - дульцит, манноза - маннит.
6. Практическая часть
химический углевод моносазарид
альдоза
1. Сахар-кетоза - это: 3 - рибулоза.
. При восстановлении глюкозы образуется
спирт: 2 - сорбит

. К трисахаридам относится: 2 - рафиноза.
. Клеточные стенки растений образует: 2 -
целлюлоза
Заключение
Моносахариды играют роль промежуточных продуктов
в процессах дыхания и фотосинтеза, участвуют в синтезе нуклеиновых кислот,
коферментов, АТФ и полисахаридов, служат источниками энергии, высвобождаемой
при окислении в процессе дыхания. Производные моносахаридов - сахарные спирты,
сахарные кислоты, дезоксисахара и аминосахара - имеют важное значение в
процессе дыхания, а также используются при синтезе липидов, ДНК и других
макромолекул.
Список литературы
1. Жеребцов Н.А., Попова Т.Н.,
Артюхов В.Г. Биохимия: Учебник. - Воронеж: Издательство Воронежского
государственного университета, 2002. - 696 с.
. Кретович В.Л. Биохимия
растений: Учеб. - 2-е изд., перераб. и доп.; для биол. спец. ун-тов. - М.:
Высш. Шк., 1986. - 503 с., ил.