Моделирование кинетики гомогенных химических реакций
Теоретическая часть
Цель работы
Ознакомиться с методами построения кинетических
моделей гомогенных химических реакций.
Построить кинетическую модель заданной
химической реакции.
Рассчитать изменение концентраций в ходе
химической реакции.
Исследовать влияние температуры на выход
продуктов и степень превращения.
Дать рекомендации по условиям проведения реакций
с целью получения максимального выхода целевых продуктов.
кинетический химический
реакция гомогенный
Кинетика гомогенных химических реакций
Скорость химической реакции есть изменение числа
молей реагентов в результате химического взаимодействия в единицу времени в
единице объема
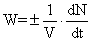 ,
,
Одним из основных законов химической
кинетики, определяющим количественные закономерности скоростей элементарных
реакций, является закон действующих масс.
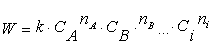 ,
,
Константа скорости химической
реакции является функцией температуры, и зависимость её от температуры
выражается законом Аррениуса:
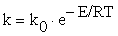 ,
,
Порядок выполнения работы
Составить в соответствии с заданной
схемой реакций на основании закона действующих масс кинетическую модель.
Разработать алгоритм расчёта
составленной кинетической модели с использованием численного метода Эйлера.
Разработать программу расчета
кинетики с учетом температурной зависимости констант скорости гомогенной
химической реакции.
Обсудить результаты. Сделать выводы
по работе.
Составить отчет.
Практическая часть
Задание №11
к1 к2
А → В ↔ С
к3
Сa0=0,8 моль/л; Cb0=Cc0=0моль/л;
h1=20;
K10=0.3; K20=0.25; K30=0.18; E1=10; E2=8; E3=9; T1=393; T2=453;
R=8.31;lb2;mas=array[1..3] of real;tempk=10.0; h=1.0; Ca0=0.8; Cb0=0; Cc0=0;
K10=0.3; K20=0.25; K30=0.18; E1=10; E2=8; E3=9; T1=393; T2=453; R=8.31; h1=20;C,
f : mas; i:integer; T, k1, k2, k3, temp:real;:=T1;T<=T2 do
begin:=k10*exp(-E1/(R*T));:=k20*exp(-E2/(R*T));:=k30*exp(-E3/(R*T));('T=',
T:5:2, ' ',
'k1=',
k1:5:5, ' ',
'k2=',
k2:5:5, ' ',
'k3=',
k3:5:5, ' ');:=0; C[1]:=Ca0; C[2]:=Cb0; C[3]:=Cc0;temp<=tempk do
begin[1]:=-k1*C[1];[2]:=K1*C[1]-K2*C[2]+K3*c[3];[3]:=K2*C[2]-K3*C[3];i:=1 to 3
do C[i]:=C[i]+h*f[i];('C[1]=', C[1]:5:2, ' ',
'C[2]=',
C[2]:5:2, ' ',
'C[3]=',
C[3]:5:2, ' ',
'temp=',
temp:5:2);:=temp+h; end;
T:=T+h1; end;.
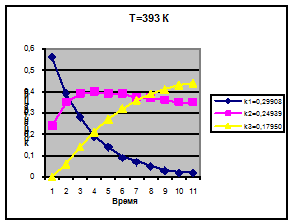
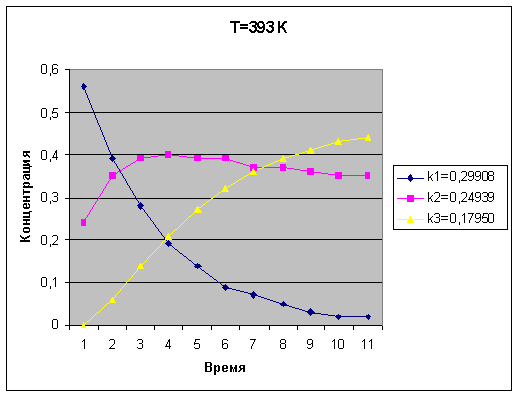
Температура 393 К
|
k1=0,29908
|
|
k2=0,24939
|
|
k3=0,17950
|
|
|
Концентрация
С1
|
Время
|
Концентрация
С2
|
Время
|
Концентрация
С3
|
Время
|
|
0,56
|
0
|
0,24
|
0
|
0
|
0
|
|
0,39
|
1
|
0,35
|
1
|
0,06
|
1
|
|
0,28
|
2
|
0,39
|
2
|
0,14
|
2
|
|
0,19
|
3
|
0,4
|
3
|
0,21
|
3
|
|
0,14
|
0,39
|
4
|
0,27
|
4
|
|
0,09
|
5
|
0,39
|
5
|
0,32
|
5
|
|
0,07
|
6
|
0,37
|
6
|
0,36
|
6
|
|
0,05
|
7
|
0,37
|
7
|
0,39
|
7
|
|
0,03
|
8
|
0,36
|
8
|
0,41
|
8
|
|
0,02
|
9
|
0,35
|
9
|
0,43
|
9
|
|
0,02
|
10
|
0,35
|
10
|
0,44
|
10
|
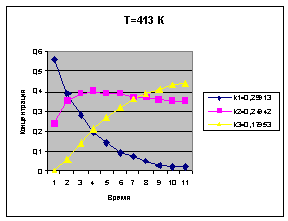
Температура 413 К
|
k1=0.29913
|
|
k2=0.24942
|
|
k3=0.17953
|
|
|
Концентрация
С1
|
Время
|
Концентрация
С2
|
Время
|
Концентрация
С3
|
Время
|
|
0.56
|
0
|
0.24
|
0
|
0.00
|
0
|
|
0.39
|
1
|
0.35
|
1
|
0.06
|
1
|
|
0.28
|
2
|
0.39
|
2
|
0.14
|
2
|
|
0.19
|
0.40
|
3
|
0.21
|
3
|
|
0.14
|
4
|
0.39
|
4
|
0.27
|
4
|
|
0.09
|
5
|
0.39
|
5
|
0.32
|
5
|
|
0.07
|
6
|
0.37
|
6
|
0.36
|
6
|
|
0.05
|
7
|
0.37
|
7
|
0.39
|
7
|
|
0.03
|
8
|
0.36
|
8
|
0.41
|
8
|
|
0.02
|
9
|
0.35
|
9
|
0.43
|
9
|
|
0.02
|
10
|
0.35
|
10
|
0.44
|
10
|
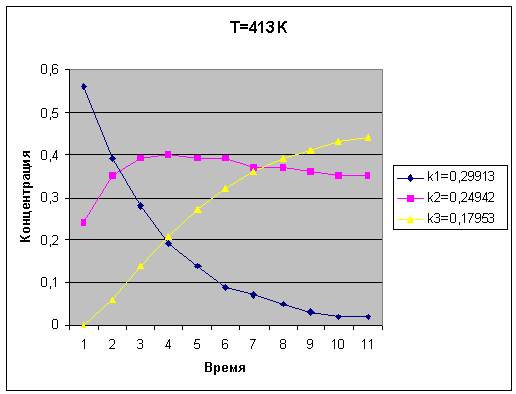
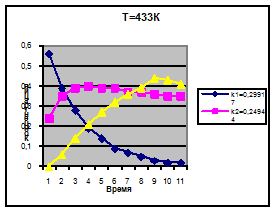
Температура T=433.00
|
k1=0.29917
|
|
k2=0.24944
|
|
k3=0.17955
|
|
|
Концентрация
С1
|
Время
|
Концентрация
С2
|
Время
|
Концентрация
С3
|
Время
|
|
0.56
|
0
|
0.24
|
0
|
0.00
|
0
|
|
0.39
|
1
|
0.35
|
1
|
0.06
|
1
|
|
0.28
|
0.39
|
2
|
0.14
|
2
|
|
0.19
|
3
|
0.40
|
3
|
0.21
|
3
|
|
0.14
|
4
|
0.39
|
4
|
0.27
|
4
|
|
0.09
|
5
|
0.39
|
5
|
0.32
|
5
|
|
0.07
|
6
|
0.37
|
6
|
0.36
|
6
|
|
0.05
|
7
|
0.37
|
7
|
0.39
|
7
|
|
0.03
|
8
|
0.36
|
8
|
0.44
|
8
|
|
0.02
|
9
|
0.35
|
9
|
0.43
|
9
|
|
0.02
|
10
|
0.35
|
10
|
0.41
|
10
|
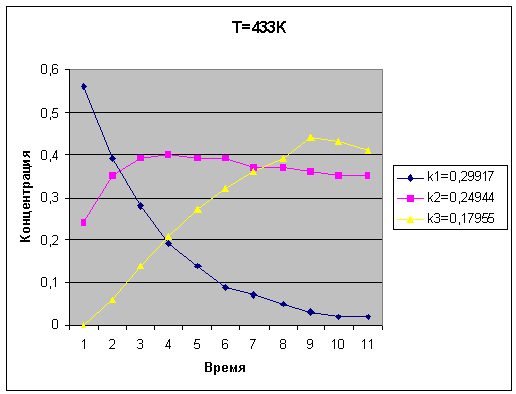
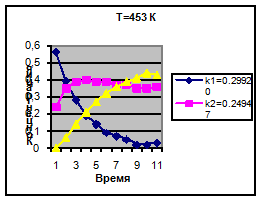
Температура 453 К
|
k1=0.29920
|
|
k2=0.24947
|
|
k3=0.17957
|
|
|
Концентрация
С1
|
Время
|
Концентрация
С2
|
Время
|
Концентрация
С3
|
Время
|
|
0.56
|
0
|
0.24
|
0
|
0.00
|
0
|
|
0.39
|
0.35
|
1
|
0.06
|
1
|
|
0.28
|
2
|
0.39
|
2
|
0.14
|
2
|
|
0.19
|
3
|
0.40
|
3
|
0.21
|
3
|
|
0.14
|
4
|
0.39
|
4
|
0.27
|
4
|
|
0.09
|
5
|
0.39
|
5
|
0.32
|
5
|
|
0.07
|
6
|
0.37
|
6
|
0.36
|
6
|
|
0.05
|
7
|
0.37
|
7
|
0.39
|
7
|
|
0.02
|
8
|
0.35
|
8
|
0.41
|
8
|
|
0.02
|
9
|
0.35
|
9
|
0.44
|
9
|
|
0.03
|
10
|
0.36
|
10
|
0.43
|
10
|
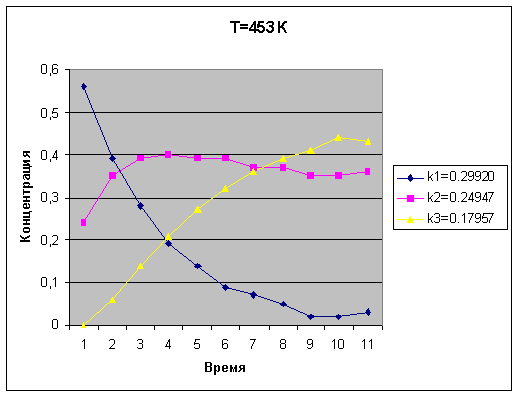
Вывод
В ходе лабораторной работы,
составили кинетические модели гомогенной химической реакции; построили
кинетическую модель химической гомогенной реакции; рассчитали концентрации
реагирующего, промежуточных веществ и продукта реакции при различных
температурах и времени протекания реакции. Построили зависимости изменения
концентрации от времени, при увеличении времени протекания реакции концентрация
исходного вещества уменьшается, промежуточных веществ увеличиваются, а
концентрация продукта реакции - возрастает. Рекомендации по условиям проведения
химической реакции с целью получения максимального выхода целевого продукта С:
температура 393 К и время 10 с.