Расчет кривой титрования
Федеральное
агентство по образованию Российской Федерации
Государственное
образовательное учреждение высшего профессионального образования
"Сибирский
государственный технологический университет"
Кафедра
аналитической химии.
Расчетно-графическая работа
Расчет
кривой титрования
Проверил:
Э.М. Зингеь
Разработал:
Студент группы 52-4
О.А. Крипченко
Задание
1. Рассчитать кривую титрования при
следующих условиях: титруется раствор сильной кислоты HCl
объёмом 10 см3 и молярной концентрацией 0.25 моль/дм3,раствором
сильного основания NaOH
с молярной концентрацией 0.25 моль/дм3.
2. По расчетам построить кривую титрования,
определить точку эквивалентности, прямую нейтральности.
. Подобрать индикатор, вычислить ошибку
индикатора, написать вывод.
Введение
Объемным (титрометрическим) методом анализа
называют метод количественного анализа, основанный на измерении количества
реагента, требующегося для завершения реакции с данным количеством
определяемого вещества. Метод заключается в том, что к раствору определяемого
вещества постепенно прибавляют раствор реактива известной концентрации.
Добавление реактива продолжают до тех пор, пока его количество не станет
эквивалентным количеству реагирующего с ним определяемого вещества. Таким
образом, этот метод основан на точном измерении объема реакции затраченного на
реакцию с определенным компонентом. При титровании употребляют не избыток
реактива, а количество его химически эквивалентное определяемому веществу.
Поэтому очень важно в ходе титрования установить момент окончания реакции или
определить так называемую точку эквивалентности. Обычно ее устанавливают по
изменению окраски индикатора. Достигнув точки эквивалентности, титрование
прекращают. По затраченному объему титранта к его концентрации вычисляют
результат анализа. В этом методе очень важное значение имеет точное
установление точки эквивалентности. Практически точку эквивалентности
устанавливают индикаторным методом по изменению окраски индикатора.
1. Расчет кривой титрования
Рассмотрим титрование сильной кислоты сильным
основанием на примере титрования соляной кислоты раствором гидроксида натрия.
HCl+NaOH
→
NaCl+H2O-
в молекулярной форме,
H+
+ OH-
→ H2O-
в ионной форме.
Пусть титруется 10см3 раствора
соляной кислоты с молярной концентрацией эквивалента 0,25 моль/дм3
раствором основания NaOH
с молярной концентрацией эквивалента 0,25 моль/дм3. При расчете
кривой титрования необходимо рассмотреть и определить значение pH
в начальный момент, в процессе титрования, в точке эквивалентности, и за точкой
эквивалентности.
. В начальный момент у нас имеется раствор
сильной кислоты. Не учитывая изменения ионной силы раствора, определим
водородный показатель раствора pH
по формуле:
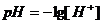 ,
,
где [H+]- молярная
концентрация эквивалента кислоты, моль/дм3.
С[1/1HCl]=0.25
моль/дм3. 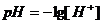 =-lg0.25=0.6.
=-lg0.25=0.6.
В процессе титрования, при
добавлении к кислоте раствора гидроксида натрия часть кислоты расходуется на
образование поваренной соли- хлорида натрия NaCl, поэтому
концентрация ионов водорода до точки эквивалентности начинает уменьшаться.
Молярную концентрацию эквивалента кислоты в процессе титрования рассчитываем по
формуле:
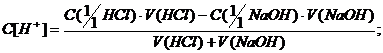
где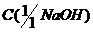 - молярная концентрация эквивалента
щелочи, моль/дм3,
- молярная концентрация эквивалента
щелочи, моль/дм3,
добавленной в процессе титрования.
Обозначим её через Сщ;
V(HCl)- объем
кислоты, взятой для анализа, см3, V(HCl)= Vк;
V(NaOH)- объем
щелочи, добавленной в процессе титрования, см3, V(NaOH)=Vщ.
Тогда формула (1.2) примет вид:
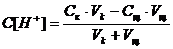
а) Пусть добавлено 5 см3 NaOH, тогда
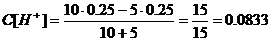 ,
,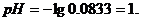
Аналогично рассчитываем pH в точках,
когда добавлено 9; 9,9; 9,99 см3 раствора NaOH.
б) Добавлено 9 см3 NaOH,
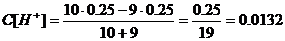
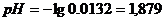
в)добавлено 9.9 см3
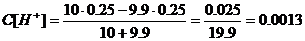
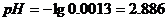
г)добавлено 9,99 см
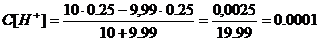
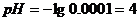
. В точке эквивалентности добавлено
10 см3 раствора NaOH, т.е. в раствор вводят как
раз эквивалентное имевшейся кислоте количество щелочи, т.е. достигают точки
эквивалентности. В этот момент раствор будет содержать только образовавшуюся
при реакции соль NaCl. Но так как последняя не
подвергается гидролизу, pH раствора можно определить,
исходя из ионного произведения воды.
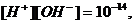
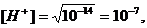
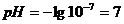
. За точкой эквивалентности
наблюдается избыток щелочи. В этом случае расчет pH, без учета
разбавления, проводится по формуле расчета pH сильного
основания
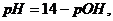
где 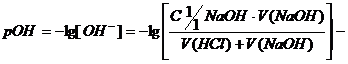 гидроксильный показатель раствора.
гидроксильный показатель раствора.
а) Пусть добавлено10,1 см3
раствора NaOH,
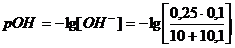
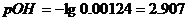
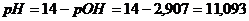
б) Добавлено 11 см3
раствора NaOH,
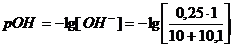
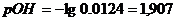
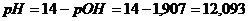
в) Добавлено 20 см3
раствора NaOH,
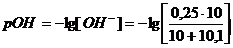
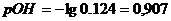
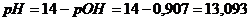
|
№
|
Добавлено
NaOH;
см3
|
Концентрация
|
[H+]
|
[OH-]
|
pH
|
|
|
Ск
|
Сщ
|
|
|
|
|
1
|
0
|
0,25
|
|
|
|
0,6
|
|
2
|
0,0833
|
|
|
|
1
|
|
3
|
9
|
0,0132
|
|
|
|
1,879
|
|
4
|
9,9
|
0,0013
|
|
|
|
2,886
|
|
5
|
9,99
|
0,0001
|
|
|
|
4
|
|
6
|
10
|
0,0000
|
|
|
|
7
|
|
7
|
10,1
|
|
|
|
2,907
|
11,093
|
|
8
|
11
|
|
|
|
1,907
|
12,093
|
|
9
|
20
|
|
|
|
0,907
|
13,093
|
Выделенные строки в таблице соответствуют началу
скачка- строка 5, точке эквивалентности- строка 6, концу скачка- строка 7.
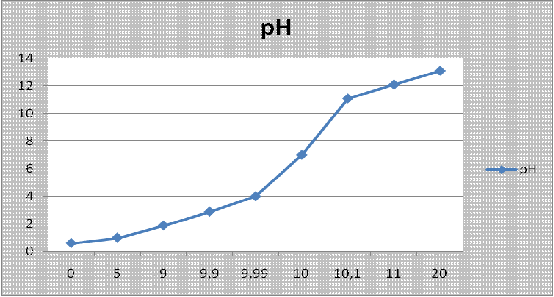
По данным таблицы построим график кривой
титрования:
Добавлено NaOH
(см3).
Ход кривой, слева направо характеризует
изменение pH при
титровании кислоты щелочью. Наоборот, справа налево- соответствует изменению pH
при титровании щелочи кислотой.
Рассматривая кривую титрования, прежде всего,
замечаем, что точка эквивалентности совпадает в данном случае с точкой
нейтрализации (pH=7).
Далее обращает на себя внимание чрезвычайно резкий скачок pH
при переходе от 0,1 см3 избытка кислоты к 0,1 см3 избытка
щелочи. Значение pH
при этом изменяется на 5,8 единицы (от 4,05 до 9,94). Какие же выводы можно
сделать из особенностей кривой титрования в отношении выбора индикатора?
. Выбор индикатора
На первый взгляд может показаться, что должен
быть употреблен такой индикатор, окраска которого меняется про pH
=7, т.е. в точке эквивалентности. Например лакмус или бриллиантовый синий,
показатели титрования которых около7.
Однако, если учесть, отмеченный выше скачок pH
на кривой титрования, то станет ясно, что с таким же успехом можно было бы
применить. Например, метиловый оранжевый, хотя с ним титрование заканчивается
не при pH=7, а при pH=4,
или фенолфталеин(pH
раствора будет 9,7). Вследствии несовпадения pT
выбранного индикатора и pH
титруемого раствора в точке эквивалентности, раствор обычно либо несколько раз
перетитровывают, либо, наоборот, недотитровывают. В результате, по окончании
титрования, раствор содержит некоторый избыток свободной кислоты или свободной
щелочи. Если значение pT<pH
в точке эквивалентности, то ошибка называется избытком Н+- иона и
называется водородной «Н+ - ошибкой». В противном случае, когда pT>pH,
ошибка вызвана избытком ОН- и называется гидроксильной «ОН-
- ошибкой». Важен знак ошибки. Если титруют кислоту и получают Н+ -
ошибку, то какая-то часть кислоты остается неоттированной, и ошибка получается
со знаком минус (-). Наоборот, если при титровании кислоты получают ОН-
- ошибку, то ошибка имеет знак (+), так как вызвана избытком ОН- -
ионов.
Рассчитаем индикаторную ошибку титрования.
Возьмем индикатор метилоранж, для которого pT=4.
Воспользуемся формулой:
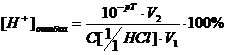
где pT- показатель
титрования индикатора;
V1-
первоначальный объем кислоты, см3;
V2- объем
раствора в конце титрования, см3
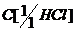 - молярная концентрация кислоты.
- молярная концентрация кислоты.
 . Величина 0,1% не выходит за
обычные пределы аналитических погрешностей, следовательно, метиловый оранжевый
применять можно.
. Величина 0,1% не выходит за
обычные пределы аналитических погрешностей, следовательно, метиловый оранжевый
применять можно.
Для фенолфталеина речь идет о
гидроксильной ошибке титрования.
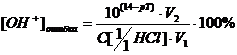
Получаем:
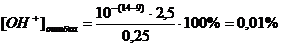
Таким образом, и фенолфталеин для
титрования вполне пригоден.
Из всего вышеприведенного нетрудно
сформулировать основное правило выбора индикатора титрования: для каждого
данного титрования можно применять только те индикаторы, показатели титрования
которых лежат в пределах скачка pH не кривой
титрования.
Вывод
титрование фенолфталеин индикатор
Я рассчитывала кривую титрования при следующих
условиях: титруется раствор сильной кислоты HCl
с молярной концентрацией эквивалента 0,25 моль/дм3, объемом 10см3
раствором сильного основания NaOH
с молярной концентрацией эквивалента 0,25 моль/дм3.
По расчетам построила кривую титрования,
определила точку эквивалентности линию нейтральности. Определила интервал
перехода окраски, подобрала индикатор, вычислила ошибку индикатора.
Таким образом, использование кривых титрования
позволяет выбрать наиболее оптимальный вариант индикатора, соответствующий
скачку рН на данной кривой титрования. В нашем случае при титровании NaOH
и HCl можно использовать
индикатор фенолфталеин, т.к относительная ошибка незначительная.
Список использованной литературы
1. Алексеев В.Н.
Количественный анализ. М.,”Химия” 1972-504c/
2. Крешков А.П. Основы
аналитической химии. М., ”Химия”1971-456с.
. Зингель Э.М.Расчет кривых
титрования. Красноярск: СибГТУ, 2002-38с.