Титрование раствора слабой кислоты раствором сильного основания
Российский
Химико-Технологический Университет им. Д.И. Менделеева
Кафедра
аналитической химии
Расчётно
графиеская работа
«Титрование
раствора слабой кислоты раствором сильного основания»
Вариант 7Б
Выполнил:
Чебышев Юрий Николаевич
Задание. Рассчитать и построить кривую
титрования 25 мл 0,05 М раствора CH3COOH
(Кα=
1,74∙10−5). Титрант: раствор KOH
0,05 M.
Пояснения: Кривую титрования строят по расчетным
точкам. Расчетные точки должны соответствовать следующим этапам титрования:
. Начальная точка
. Область до точки эквивалентности
. Точка эквивалентности (ТЭ)
. Область после точки эквивалентности
Расчет приводят в виде таблицы:
индикатор титрование раствор
эквивалентность
Таблица 1. Расчет кривой титрования 25 мл 0,05 М
раствора CH3COOH
0,05 М раствором KOH
|
Этап
титрования
|
Оттитровано,
кислоты, %
|
Объем добавленного
ттитранта, мл
|
Общий
объем смеси в колбе для титрования, мл
|
Состав
раствора
|
Расчетная
формула
|
рН
|
1 0 0 25 CH3COOH [H+]
= 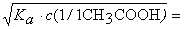
|
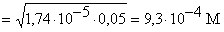 3 3
|
|
2 50 12,5 37,5 CH3COOH+
CH3COOK [H+] = 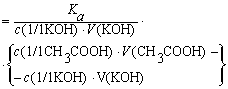
[H+]
=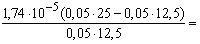
|
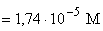 4,8 4,8
|
|
99,0 24,75 49,75 CH3COOH+
CH3COOK [H+] 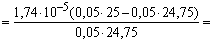
|
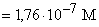 6,8 6,8
|
|
99,9 24,975 49,975 CH3COOH+
CH3COOK [H+] =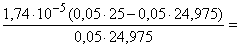
|
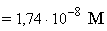 7,8 7,8
|
|
3 100 25 50 CH3COOK [OH-]
= 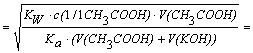
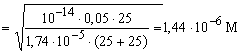
[H+]
=
|
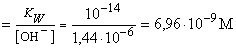 8,2 8,2
|
|
4 Избток
титранта 0,1% 25,025 50,025 CH3COOH+ KOH [OH-]
= 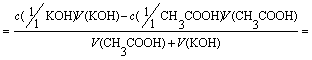
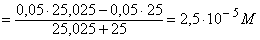
[H+]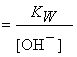
|
[H+]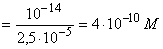 9,4 9,4
|
|
Избток титранта 1% 25,25 50,25 CH3COOK+
KOH [OH-]
= 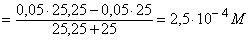
|
[H+]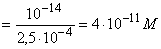 10,4 10,4
|
|
Избток
титранта 10% 27,5 52,5 CH3COOH+ KOH [OH-]
= 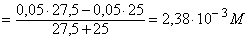
|
[H+]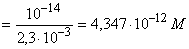 11,4 11,4
|
|
Избток
титранта 50% 37,5 62,5 CH3COOK+ KOH [OH-]
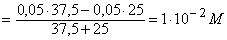
|
[H+]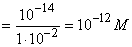 12 12
|
|
Выбор индикатора
Пояснения. Правило выбора индикатора:
- интервал перехода окраски
индикатора должен находиться в пределах скачка титрования или частично
перекрываться с ним;
- рТ индикатора должен быть как можно ближе к
точке эквивалентности и находиться в пределах скачка титрования.
Учитывая правило выбора индикатора выбираем 2
индикатора из справочной литературы (Лурье Ю.Ю. Справочник по аналитической
химии. М.: Химия, 1989. 190 с.).
Таблица 2. Некоторые кислотно-основные
индикаторы
|
Название
|
Интервал
перехода окраски, ∆рН
|
Показатель
титрования, рТ
|
|
Метиловый
оранжевый
|
3,1-
4,4
|
4,0
|
|
Метиловый
красный
|
4,4
- 6,2
|
5,5
|
|
Метиловый
желтый
|
2,4
- 4,0
|
3,0
|
|
Фенолфталеин
|
8,2
- 9,8
|
9,0
|
|
Тимолфталеин
|
9,3
- 10,5
|
9,6
|
|
Феноловый
красный
|
6,4
- 8,2
|
7,5
|
|
Тимоловый
синий
|
8,0
- 9,6
|
9,2
|
|
Бромтимоловый
синий
|
6,0
- 7,6
|
7,0
|
|
Бромкрезоловый
зеленый
|
3,9
- 5,4
|
4,5
|
|
Бромкрезоловый
пурпурный
|
5,2
- 6,8
|
6,0
|
Выбираем 2 индикатора: фенолфталеин (рТ=9,0) и
тимоловый синий (рТ=9,2)
Расчет индикаторных погрешностей
При недотитровывании (рТ < рНТЭ)
формула для расчета индикаторной погрешности (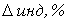 ):
):
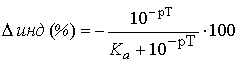 ,
,
где Ka - константа
кислотности
При перетитровывании (рТ > рНТЭ)
формула для расчета индикаторной погрешности (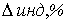 ):
):
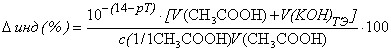 ,
,
где V(KOH)ТЭ
- объем титранта, прибавленный от начала титрования до точки эквивалентности.
Рассчитываем индикаторные погрешности для
выбранных индикаторов:
- фенолфталеин
(рТ=9,0>рНТЭ):
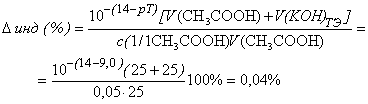
- тимоловый
синий (рТ=9,2 > рНТЭ):
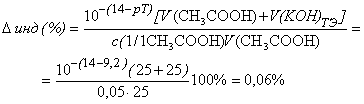
Кривая титрования
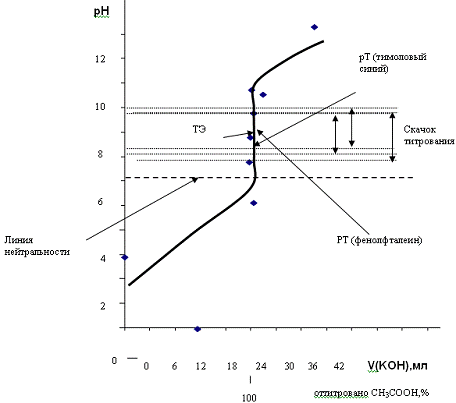
Рис. 1. Теоретическая кривая титрования 25 мл
0,05 М раствора CH3COOH
0,05 М раствором KOH.