Анионные комплексы
Реферат
Анионные комплексы
Введение
Комплексные соединения (лат.
complexus - сочетание, обхват) или, другими словами, координационные соединения
- это частицы (нейтральные молекулы или ионы), которые образуются в результате
присоединения к данному иону (или атому), называемому комплексообразователем,
нейтральных молекул или других ионов, называемых лимандами.
Комплексные соединения разнообразны
и многочисленны.
Применяются в химическом анализе, в
технологии при получении ряда металлов (золота, серебра, металлов платиновой
группы и др.), для разделения смесей элементов, например, лантаноидов.
Огромная область применения
комплексов переходных металлов - каталитические процессы.
Комплексные соединения играют
большую роль в жизнедеятельности организмов; например, гемоглобин, хлорофилл
являются комплексными соединениями.
Существует
различная классификация комплексных соеденений. Одна из них - классификация по
характеру электрического заряда (катионные, анионные и нейтральные комплексы).
В своей работе я рассмотрю анионные комплексы, их получение, химические
свойства и применение.
1.
Особенности строения анионных комплексов
Анионный
комплекс - в роли комплексообразователя
выступает атом с положительной степенью окисления (положительный ион), а лигандами
являются атомы с отрицательной степенью окисления (анионы). Анионные комплексы
обычно дают неметаллические элементы.
Например: К2[ВеF4]
- тетрафторобериллат (II) калия, Li[AlH4] -
тетрагидридоалюминат(III) лития, K3[Fe(CN)6] -
гексацианоферрат(III) калия
Примеры
геометрии строения анионных комплексов
· Гексацианоферрат(III)
калия
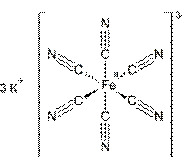
Тёмно-красные
кристаллы с моноклинной решеткой. Водный раствор зеленовато-жёлтого цвета. В
этаноле нерастворим.
· Тетрагидридоалюминат(III)
лития
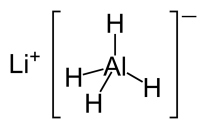
Тетрагидридоалюминат
лития образует бесцветные кристаллы, растворим в эфире, тетрагидрофуране.
Технический продукт
(ЛАГ) - твердые серые куски, очень легок. После измельчения - растворим в
эфире. Бурно реагирует с водой, содержащейся во влажном воздухе и способен к
самовозгоранию. Промышленный продукт выпускается с добавлением минеральных
масел для защиты от воздуха.
Очищенный
перекристаллизацией имеет вид белых кристаллов. Промышленный обычно серого цвета
из-за следов металлического алюминия. При хранении во влажном воздухе
разлагается на гидроксиды лития и алюминия.
· Тетраиодомеркурат(II)
калия
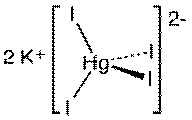
Тетраиодомеркурат(II)
калия образует светло-жёлтые кристаллы. Образует кристаллогидрат состава K2[HgI4]•2H2O.
Хорошо растворяется в небольшом количестве воды, при разбавлении разлагается.
· Гексафтороалюминат
калия
Образует бесцветные
кристаллы тетрагональной сингонии
3AlF6 - бесцветные кристаллы, слабо растворяется в воде.
· Тетрахлороплатинат(II)
аммония
Образует красные
кристаллы, растворяется в воде, не растворяется в этаноле.
[PdCl4]2-
ион имеет sp2d гибридизацию и тетрагональную пространственную
конфигурацию.
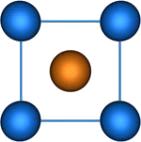
· Тетрафторобериллат
калия
Образует бесцветные
кристаллы ромбической сингонии. K2[BeF4] (иногда
записывают как 2KF•BeF2) - это бесцветные кристаллы, растворяется в
воде и не растворяется в этаноле.
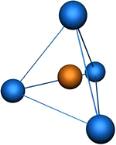
· Тетрафтороборат
натрия[BF4] - бесцветные кристаллы, хорошо растворимые в воде;
образует бесцветные кристаллы ромбической сингонии.
Ион BF4-
имеет sp3 гибридизацию и тетраэдрическую пространственную
конфигурацию.
2. Номенклатура анионных
комплексов
ион лиманд анионный
комплексообразователь
Названия соединений с комплексными
анионами строятся так же, как названия простых соединений, состоящих из катиона
и аниона (т.е. «анион катиона», например NaCl - хлорид натрия, BaCrO4
- хромат бария, H2O2 - пероксид водорода и т.п.). Однако
в рассматриваемом случае анион не простой, а комплексный.
Название комплексного аниона
строится из числа и названия лигандов, корня названия
элемента-комплексообразователя, суффикса - ат и указания степени окисления
комплексообразователя:
[BF4]- -
тетрафтороборат(III) - ион
[Al(H2O)2(OH)4]-
- тетрагидроксодиакваалюминат(III) - ион
[VS4]3- -
тетратиованадат(V) - ион
Для целого ряда
элементов-комплексообразователей вместо русских используются корни их латинских
названий:- аргент-; Au - аур-; Cu - купр-; Fe - ферр-; Hg - меркур-; Mn -
манган-; Ni - никкол-; Pb - плюмб-; Sb - стиб-; Sn - станн -.
Примеры названий комплексных
анионов:
[Fe(CN)6]3- -
гексацианоферрат(III) - ион
[Ag(SO3S)2]3-
- бис(тиосульфато) аргентат(I) - ион
Названия соединений, включающих
комплексный анион, строятся следующим образом:2[HgI4] -
тетраиодомеркурат(II) калия[Sb(OH)6] - гексагидроксостибат(V)
водорода[Ag(CN)2] - дицианоаргентат(I) натрия
3. Способы получения
Способы получения анионных
комплексных соединений я рассмотрю на примере нескольких определенных
комплексах.
1) Получение гексафтороалюмината
калия:
· Сплавление
фторидов алюминия и калия:
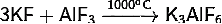
) Получение алюмогидрида
лития:
· Действием
хлорида алюминия на суспензию гидрида лития в эфире
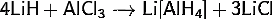
) Получение тетрафторобората
натрия:
· Пропускание
трифторида бора через раствор фторида натрия:
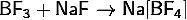
· Взаимодействие
тетрафторобората водорода с щелочью:
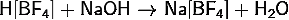
· Взаимодействие
с разбавленными щелочами трифторида бора на холоду:
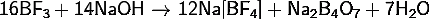
) Получение тетрафторобериллата
калия:
· Сплавление
фторидов калия и бериллия:
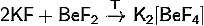
· Действие
плавиковой кислоты на смесь гидроксида бериллия и карбоната калия:
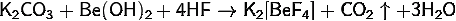
· Реакция
между концентрированными растворами хлорида ртути и иодида калия:
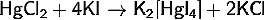
· Реакция
между концентрированными растворами иодидов ртути и калия:
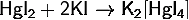
) Получение гексагидроксостибата
калия:
· Растворение
фторида или хлорида сурьмы в концентрированной гидроокиси калия:
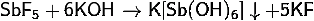
· Растворение
оксида сурьмы в концентрированной гидроокиси калия:
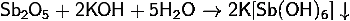
) Получение тетрахлороплатината(II)
аммония:
· Восстановление
гексахлороплатината(IV) аммония оксалатом аммония:
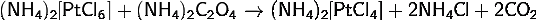
. Химические свойства
Химические свойства анионных
комплексных соединений я также рассмотрю на примере нескольких определенных
комплексах.
1) Тетрахлороплатинат(II)
аммония разлагается при нагревании:
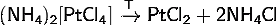
) Гексагидроксостибат
калия проявляет следующие химические свойства:
· При
нагревании разлагается, теряя воду:
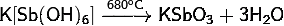
· Разлагается
в горячей воде:
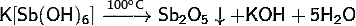
· Реагирует
с концентрированными кислотами:
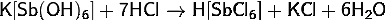
· и
с разбавленными кислотами при нагревании:
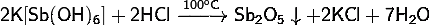
· Является
слабым окислителем:
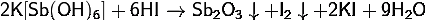
· Реагирует
с сульфидом калия, образуя тетратиостибат калия:
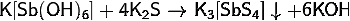
) Тетраиодомеркурат(II) калия:
· Безводную соль получают сушкой кристаллогидрата в вакууме:
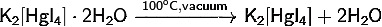
· Разлагается при нагревании:
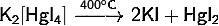
· В разбавленных водных растворах разлагается:
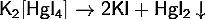
· Реагирует с концентрированными кислотами:
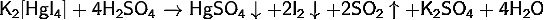
· и щелочами:
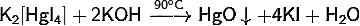
· Реагирует с раствором аммиака:
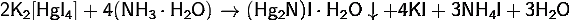
4) Тетрафтороборат натрия:
· Разлагается при нагревании выше температуры плавления:
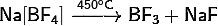
· В холодной воде подвергается частичному гидролизу по аниону:
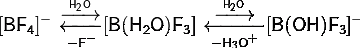
· В горячей воде полностью разлагается:
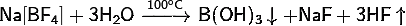
· Разлагается концентрированными кислотами
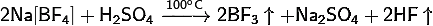
· С концентрированными щелочами даёт смесь продуктов:
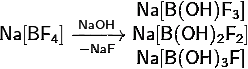
5) Тетрагидридоалюминат лития:
· Термически неустойчив:
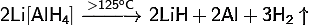
· Гидролизуется водой:
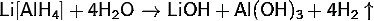
· Реагирует с разбавленными кислотами на холоде:
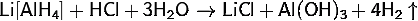
· Окисляется кислородом:
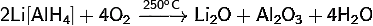
6. Применение анионных
комплексов
Тетрагидридоалюминат
лития применяют в органическом синтезе,
также для получения неводных электролитов, из которых гальваническим способом
осаждается алюминиевое покрытие.
Гексацианоферрат(III)
калия применяют как компонент тонирующих,
отбеливающих, усиливающих, ослабляющих растворов в фотографии, электролит в
хемотронных приборах, компонент электролитов вгальванопластике, реагент для обнаружения
Fe2+, Li+ Sn2+, а также в качестве сильного
окислителя. В почвоведении используют для качественного определения оглеения
(солей двухвалентного железа).
Тетрафтороборат
натрия применяют как компонент электролита
при электрохимическом рафинировании и нанесении покрытий, как флюс при пайке и
сварки металлов, также как компонент формовочных составов при литье магния,
алюминия и их сплавов; фторирующий агент; как гербицид.
Тетраиодомеркурат(II)
калия используют для приготовления
реактива Несслера, щелочного водного раствора дигидрата тетраиодомеркурата(II)
калия K2[HgI4]*2H2O.
При взаимодействии
с аммиаком NH3 и гуанидинами реактив образует красно-коричневый
осадок йодида оксодимеркураммония [OHg2NH2] I или йодида
дийоддимеркураммония [I2Hg2NH2] I, с органическими
восстановителями (например с первичными и вторичными спиртами, альдегидами) -
чёрный осадок металлической ртути (ртуть получается в мелкодисперсном
состоянии).
Применяется для
качественного обнаружения вышеуказанных соединений, а также для колориметрического
определения небольших количеств (около 0,001% по объёму) аммиака. Предложен к
применению немецким химиком Юлиусом Несслером в 1868 году.
Координационная
химия (химия комплексных соединений) длительное время считалась одним из
разделов неорганической химии; объяснялось это тем, что большинство известных
ранее координационных соединений содержало в качестве лимандов, как правило,
типичные неорганические молекулы и ионы - аммиак, воду, нитро-, роданогруппу и
т.п. Экспериментальные исследования неорганических комплексных соединений были
начаты за несколько десятилетий до того, как стала бурно развиваться
органическая химия. После создания А. Вернером координационной теории химия
комплексных соединений стала постепенно, в течение десятилетий, превращаться в
самостоятельный раздел химической науки. Ее успешное развитие связано с именами
Трассера, Цейзе, Йергенсена, Грэма, Клауса, Бломстранда, школы А. Вернера, а в
двадцатом веке - Л.А. Чугаева, И.И. Черняева, А.А. Гринберга, Чатта, Найхольма,
Фишера, Бьеррума и многих других ученых различных стран. В наши дни
координационая химия - интенсивно развивающаяся в различных направлениях наука,
тесно переплетающаяся с другими областями химии.
Список
литературы
1) Химическая энциклопедия /
Редкол.: Кнунянц И.Л. и др.. - М.: Советская энциклопедия, 1992. - Т. 3. - 639
с. - ISBN 5-82270-039-8.
2) Справочник химика / Редкол.:
Никольский Б.П. и др.. - 3-е изд., испр. - Л.: Химия, 1971. - Т. 2. - 1168 с.
) Рипан Р., Четяну И. Неорганическая
химия. Химия металлов. - М.: Мир, 1972. - Т. 2. - 871 с.
) Лидин Р.А. и др. Химические
свойства неорганических веществ: Учеб. пособие для вузов. - 3-е изд., испр. -
М.: Химия, 2000. - 480 с. - ISBN 5-7245-1163-0.