Хелатные комплексы
Бурятский государственный университет
Химический факультет
КУРСОВАЯ РАБОТА
Тема: Хелатные комплексы
Улан-Удэ
год.
Введение
Комплексные соединения представляют собой интересный класс веществ в
неорганической химии. Их природа представляет для науки большой интерес, так
как значительное количество элементов периодической системы могут образовывать
комплексы, как с другими элементами, нейтральными молекулами, так и с катионами
(анионами) кислотных (основных) остатков.
Особую группу составляют циклические комплексные соединения или хелаты.
Хелатную структуру имеют многие комплексы. Так, например молекула гемоглобина
представляет собой комплекс, который соединяет атом Fe(II) и
тетрадентатный хелатообразующий лиганд - порфирин. Этот лиганд образует
комплекс с магнием, который называется хлорофил.
Цель работы.
Основной целью данной работы является получение, изучение физических и
химических свойств хелатных комплексов. Интерес состоит в том, что хелаты по
отношению к другим комплексам обладают интересными свойствами: циклическое
строение, повышенная прочность. Еще одна причина по которой стоит изучать
хелатные комплексы - большинство органических комплексов в живой природе
относятся именно к ним. Так же в данной работе вообще затрагивается вообще вся
химия комплексных соединений и имена тех кто вложил большой вклад в изучение
комплексных соединений.
Задачи.
1) Подобрать теоретический материал.
2) Подобрать методики синтезов необходимых нам соединений.
) Повести синтез хелатных соединений
) Сделать выводы.
Глава первая.
Теоретическая часть
.1 Классификация комплексных соединений
Комплексные соединения (К.С.) - соединения образованные сложными
катионными и анионными составляющими единую структуру.
Применяется несколько видов классификаций комплексов:
По принадлежности к определенному классу соединений
Комплексные кислоты - H2[SiF6], H[AuCI];
Комплексные основания - [Ag(NH3)2]OH, [Co(En)3](OH)3.
По природе лигандов
Если лигандом является вода, комплексы называются аквакомплексами,
например, [Co(H2O)6]SO4, [Cu(H2O)](NO3)2. Находящиеся в водном
растворе гидратированые катионы содержат в качестве центрального звена
аквакомплекс. В кристаллическом состоянии некоторые из аквакомплексов
удерживают и кристаллизационную воду, например: [Cu(H2O)4]SO4·H2O и др. Кристаллизационная вода не
входит во внутреннюю сферу, она связана менее прочно, чем координационная, и
легче отщепляется при нагревании.
Комплексы образованные аммиаком - аммиакаты, например [Ag(NH3)2]Cl, [Cu(NH3)4]SO4. Известны комплексы аналогичные
аммиакатам, в которых роль лиганда выполняют молекулы аминов: CH3NH2 (метиламин), C2H5NH2 (этиламин), NH2CH2CH2NH2 (этилендиамин, условно обозначаемый En) и др. Такие комплексы называют
аминатами.
Оксалатные, карбонатные, цианидные, галогенидные, и другие комплексы
содержащие в качестве лигандов анионы различных кислот, называются
ацидокомплексами. Например, K4[Fe(CN)6] и
K2[HgI4] -
цианидный иодидный ацидокомплексами,.
Соединения с OH-группами в виде
лигандов называют гидрокомплексами, например: K3[Al(OH)6].
По знаку заряда комплекса различают
Катионные комплексы - [Co(NH3)6]Cl3
анионные комплексы - Li[AlH4], K2[Be(CO3)2]
нейтральные комплексы - [Pt(NH3)2Cl2],
[Co(NH3)3Cl3].
Нейтральные комплексы не имеют внешней сферы. Более сложными являются бикомплексы,
состоящие из комплексных катионов и анионов, например [Co(NH3)6][Fe(CN)6].
Особую группу составляют сверхкомплексные соединения. В них число
лигандов превышает координационную валентность. Примером может служить CuSO4·5H2O. У меди координационная валентность
равна четырем и во внутренней сфере координированы четыре молекулы воды. Пятая
молекула присоединяется к комплексу при помощи водородных связей.
.2 Циклические или хелатные (клешневидные) комплексные соединения
Они содержат би- или полидентатный лиганд, (лиганды, образующие с
центральным атомом, две связи, называются бидентатными; образующие три связи -
тридентатные и т.д.) который как бы захватывает центральный атом подобно
клешням рака:
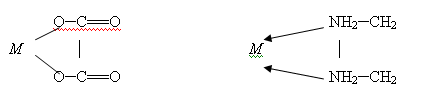
Таблица 1. Обозначения, применяемые для некоторых лигандов
|
Обозначение
|
Лиганд
|
Формула
|
|
En
|
Этилендиамин
|
H2N─CH2─CH2─NH2
|
|
Pn
|
Пропилендиамин
|
NH2CH2CH(CH3)NH2
|
|
dien
|
Диэтилентриамин
|
NH2CH2CH2NHCH2CH2NH2
|
|
trien
|
Диэтилентетраамин
|
NH2CH2CH2NHCH2CH2NHCH2CH2NH2
|
|
bipy
|
2,2-Дипиридил
|

|
|
phen
|
1,10-Фенантролин
|
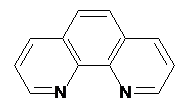
|
|
EDTA
|
Этилендиаминтетраацетато
|
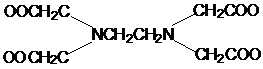
|
|
DMG
|
Диметилглиаксемато
|
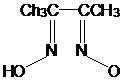
|
В этих комплексах символом М обозначен атом металла, а стрелкой -
донорно-акцепторная связь. Примерами таких комплексов служат оксалатный
комплекс железа (ΙΙΙ) [Fe(C2O4)2]3─ и этилендиаминовый
комплекс платины (ΙV) - [PtEn3]4+.
К группе хелатов относятся и внутрикомплексные соединения, в которых
центральный атом входит в состав цикла, образуя ковалентные связи с лигандами
разными способами: донорно-акцепторные и за счёт неспаренных электронов.
Комплексы такого рода весьма характерны для аминокарбоновых кислот.
Хелатообразующие лиганды содержат два или больше электронодонорных атомов, т.е.
может образовать две и более координационные связи, например: H2N─CH2─CH2─NH2 (этилендиамин),
Хелатную структуру имеют многие комплексы. Так, например молекула
гемоглобина представляет собой комплекс, который соединяет атом Fe(II) и тетрадентатный хелатообразующий лиганд - порфирин. Этот
лиганд образует комплекс с магнием, который называется хлорофиллом.
Хелатные соединения отличаются особой прочностью, т.к. центральный атом в
них как бы «блокирован» циклическим лигандом. Наибольшей устойчивостью обладают
хелаты с пяти- и шестичленными циклами. Многие органические лиганды хелатного
типа являются весьма чувствительными и специфическими реагентами на катионы
переходных металлов. К ним относится, например, диметилглиоксим, предложенный
Чугаевым как реактив на ионы Ni2+
и Pd2+.
1.3 Правило циклов Л.А. Чугаева
На основе фактического материала он пришёл к заключению, что наиболее
устойчивыми в комплексах являются циклы, состоящие из пяти и шести циклов.
Одним из оснований для заключения о правиле циклов послужили факты
взаимодействия никельсукцинимида Ni(Su)2 где Su - это СH2-С=О, с диаминами. Установлено что 1,2-диамин (этилендиамин)
и 1,3-диамин (пропилендиамин) взаимодействуют с этой солью никеля с
образованием соединения типа [NiEn3]Su2 u [NiEn2Su2].
При чем разница между триэтилендиамином и тетраэтилендиамином очень
существенна, свойства же тетраэтилендиамином и пентаэтилендиамином
близки.Реакция с 1,4- и 1,5-диаминами идёт совершенно иначе. Чугаев связал
различное поведение диаминов с числом звеньев в циклах, образуемых этими
лигандами и ионами никеля. В случае 1,2- и 1,3-диамина соответственно
образуются пяти- и шестичленные цыклы:
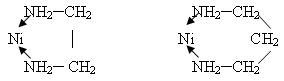
В случае 1,4- и 1,5-диаминов должны были бы образовываться семи- и
восьмичленные циклы, но они не устойчивы. Вследствие этого тетраметилен и
пентаметилендиамин связываются с двумя ионами никеля, образуя мостики:
…→Ni←NH2CH2CH2CH2CH2NH→Ni←…
В результате получаются полимерные комплексы.
Большой заслугой Л.А Чугаева следует считать то, что он впервые связал
характер и устойчивость комплексов с конкретной группировкой атомов в
органическом лиганде. Эти идеи легли в основу многочисленных работ по синтезу и
аналитическому применению органических реагентов и комплексонов.
Правило циклов получило развитие на базе большого фактического материала.
В настоящее время можно утверждать, что донорные группы атомов, несущие на себе
отрицательный заряд (чаще всего это кислотные остатки), способны образовывать
устойчивые четырёхчленные циклы. Это относится как к простым анионам, например NO3-, CO32-, SO42-, так и к остаткам органических кислот: диалкил(арил)фосфорных,
алкил(арил)фосфорных, диалкил(арил)дитиофосфарных, дитиокарбаминовых,
ксантогеновых и т.д.
Можно сделать заключение, что образованию необычных трёх- и
четырёхчленных циклов, вероятно, способствует связь металла с атомом углерода.
.4 Хелатный эффект
Правило циклов Л.А. Чугаев сформулировал на основании препаративных
данных. Количественные данные были получены лишь в 40-х годах ХХ в. Они были
частично обобщены Шварценбахом в 1952 г.
В 1920 г. Морган и Дрю ввели в химическую литературу термин «хелат» (от
англ. chtlate - коготь, клешня) для обозначения
циклов, образуемых лигандами при координации около иона металла.
Соответствующие комплексы, содержащие хелатный цикл, стали называть хелатными
соединениями.
Шварценбах предложил называть разность между логарифмом константы
устойчивости хелатного комплекса и нециклического аналога «хелатным эффектом».
Сравнивая хелатные эффекты для этилендиаминовых и 1,3-пропилендиаминовых
комплексов никеля (II) и меди (II) (за стандарт были выбраны аммиачные
соединения), Шварценбах пришёл к заключению, что пятичленное хелатное кольцо
стабильнее шестичленного.
Считают, что хелатный эффект связан с изменением энтропии системы. При
образовании комплексов, например в водном растворе, происходит замещение
молекул воды гидратированного иона металла на определённый лиганд. Если в
комплекс вступают монодентатные лиганды, то освобождается равное число молекул
воды:
[Ni(H2O)6]2+ + 6NH3 =
[Ni(NH3)6]2+ + 6H2O
Если вступает бидентатный лиганд, то число освобождающихся молекул воды
вдвое больше, чем число лигандов, входящих в комплекс:
[Ni(H2O)6]2+
+ 3En = [NiEn3]2+ + 6H2O
Это приводит к тому, что возрастает энтропийная составляющая свободной
энергии Т∆S в уравнении:
∆G = ─ RTlnK = ∆H ─
T∆S.
т.е. уменьшается свободная энергия системы. В ряде работ были сделаны
попытки прямой экспериментальной оценки вклада энтропии и энтальпии в константу
устойчивости комплексов.
Таблица 2. Константы образования и термодинамические параметры для
комплексов кадмия (ΙΙ) при 25оС
|
Комплекс
|
lg β, Моль·л-1
|
∆НО,
кДж·моль-1
|
∆GО, кДж·моль-1
|
∆SО, Дж·моль-1·К-1
|
|
Cd(NH3)22+
|
4,25
|
29,79
|
28,24
|
5,19
|
|
Cd(NH2CH3)22+
|
4,81
|
29,37
|
27,45
|
6,46
|
|
CdEn2+
|
5,84
|
29,41
|
33,30
|
─13,05
|
|
Cd(NH3)42+
|
7,44
|
53,14
|
42,51
|
35,50
|
|
Cd(NH2CH3)42+
|
6,55
|
57,32
|
37,41
|
66,94
|
|
CdEn22+
|
10,62
|
56,48
|
60,67
|
─13,75
|
Из этой таблицы [2] следует, что для комплексов кадмия с монодентатными
лигандами (аммиаком и метиламином) и бидентатным (этилендиамином) имеется лишь
небольшая разница (или она вообще отсутствует) в значениях ∆Н0.
В то же время разница в значениях ∆S0 достигает очень большой величины и, что самое главное, для
комплексов с бидентатным лигандом значение ∆S0 отрицательно.
Бьеррун и Нильсен впервые показали, что значение хелатного эффекта при
одних и тех же лигандах, но для ионов различных металлов, может отличаться.
Следовательно, хелатный эффект может зависеть не только от энтропийной, но и от
энтальпийной составляющей изобарного потенциала. Чаще всего влияние
хелатообразования на значение ∆Н объясняют отталкиванием лигандов в
комплексе, например, двух молекул аммиака.
Если лиганд с ионом металла способен образовать несколько хелатных
циклов, то комплексы с полициклическими лигандами оказываются более
устойчивыми, чем с моноциклическими.
Хелатный эффект проявляется практически у комплексов всех металлов. К
немногочисленным исключениям относятся соединения серебра (Ι) и, вероятно, меди (Ι). Если сравнить устойчивость
этилендиаминового [AgEn]+ и
аммиачного [Ag(NH3)2]+ комплексов, то оказывается, что
хелатный эффект имеет невероятно большое отрицательное значение, равное ─2.
Это связано с тем, что серебро (Ι) образует комплексы линейной
структуры, и это должно приводить к очень большому напряжению цикла. Вероятно,
в комплексе [AgEn]+ этилендиамин выступает
в роли монодентатного лиганда, т.е. цикл не замыкается.
.5 Транс-хелатные соединения
В последние годы были предприняты многочисленные попытки получения
комплексов, в которых хелатный лиганд занимал бы два координационных места в
транс-положении. Одними из первых о таком соединении заявили Исслейб и
Хольфельд. Они сообщили о получении комплекса [NiLCl2], где L - (C6H11)2P(CH2)5P(C6H11)2, в котором донорные лиганды располагаются в
транс-положении друг к другу. Дипольный момент этого комплекса равен всего лишь
7,9·10-30 Кл·м. Аналогичный комплекс с лигандом (C6H11)2P(CH2)3P(C6H11)2, цис-конфигурация которого не вызывает
сомнения, имеет дипольный момент 37,7·10-30 Кл·м.
Шоу с сотрудниками получили, вероятно, одно из первых соединений с
хелатным циклом в транс-положении. Взаимодействием [Pt(NCPh)2Cl2] c ButP(CH2)10P Bu2t они выделили два комплекса. На основании данных ЯМР,
ИК спектроскопии и результатов измерения молекулярной массы одному из этих
соединений приписана структура I, а
другому ΙΙ.

Позднее были синтезированы и охарактеризованы другие соединения платины (ΙΙ) транс-хелатного типа.
Рентгеноструктурное исследование комплекса транс-[PtLCl2], где L─But P(CH2)12P Bu2t, полностью подтвердило наличие в комплексе транс-хелатного
цикла, состоящего из 14 циклов.
Венанзи с сотрудниками синтезировали жесткий лиганд, который не может
образовывать цис-хелатные циклы.

С
этим лигандом удалось получить мономерные комплексы типа [MLX2] (где М - это Ni(ΙΙ) Pd (ΙΙ) u Pt (ΙΙ),
Х - галогенидный ион), которые имеют транс-конфигурацию. Хелатный цикл этих
комплексов состоит из 12 звеньев.
Бейлар
с сотрудниками ввели диэтилентриамин в соединении платины (ΙV), а
затем восстановили его, синтезировав транс-хелатный комплекс платины (ΙΙ):
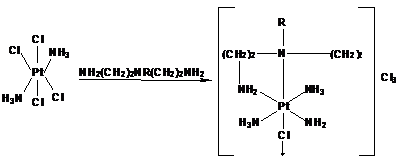
Комплекс
ΙΙΙ неустойчив, и при перекристаллизации из воды аммиак
вытесняется из его внутренней сферы. В процессе этого хелатный лиганд вместо
неустойчивого восьмичленного цикла замыкает два пятичленных с образованием
комплекса.
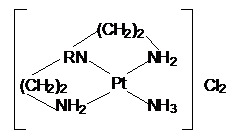
Таким
образом, можно считать несомненным, что существуют комплексы с транс-хелатными
циклами. Принципиальных ограничений для максимального числа звеньев не имеется,
но должно быть ограничение для их минимального числа. Вероятно, транс-хелатный
цикл способен образоваться в том случае, если он включает не менее восьми
звеньев.
Правило
циклов, сыграло исключительно важную роль в развитии координационной химии и
постоянно служило руководящим принципом в целенаправленном синтезе комплексов и
органических аналитических реагентов. Важным дополнением к правилу циклов,
сформулированному Л.А. Чугаевым, следует считать установление способности
отрицательно заряженных лигандов образовывать четырёх- и даже трёхчленные
циклы. Несомненно, что в ближайшие годы должен быть сформулирован принцип образования
наиболее устойчивых транс-хелатных циклов.
.6
Изомерия хелатных комплексов
Особый
тип изомерии хелатных комплексов связан с образованием различных циклов.
Нередки случаи, когда лиганд в комплексе способен замыкать как пятичленный, так
и шестичленный цикл. Это особенно характерно для органических оксимов и
нитрозосоединений. Например, диметилиминоглиоксим
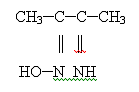
с
ионами Ni (ΙΙ)
может образовывать три изомерных соединения:
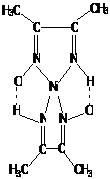
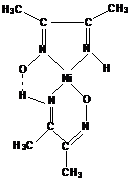
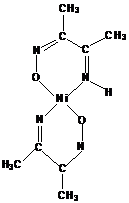
(I) (II)
(III)
Этот
тип изомерии связан с заменой донорного атома, участвующего в координации, и с
изменением числа звеньев в хелатном цикле. Первые два изомерных комплекса
стабилизированы за счёт водородных связей.
Рассмотренный
тип изомерии называют внутремолекулярной хелатно-связевой изомерией.
.7
Применение комплексных соединений
К.с.
находят широкое применение для выделения и очистки платиновых металлов, золота,
серебра, никеля, кобальта, меди, в процессах разделения редкоземельных
элементов, щелочных металлов и в ряде других технологических процессов. К.с.
широко используют в химическом анализе для качественного обнаружения и
количественного определения самых разнообразных элементов. В живых организмах
различные типы К.с. представлены соединениями ионов металлов (Fe, Cu, Mg, Mn,
Mo, Zn, Со) с белками (т.н. металлопротеиды), а также витаминами, коферментами,
транспортными и др. веществами, выполняющими специфические функции в обмене
веществ. Особенно велика роль природных К.с. в процессах дыхания, фотосинтеза,
окисления биологического, в ферментативном катализе.
Хелатные
комплексы находят широкое применение в фармацевтике - прочность циклов
позволяет внедрять в «центры» циклов активные вещества, либо бактерии тем самым
застабилизировать их, что дает возможность применять их более эффективно.
Глава
II
Практическая
часть
.1
Синтез №1
Хлорид
трис (этилендиамин) кобальта (ΙΙΙ)
[Co(en)3]Cl3
Цель:
получить хелатный комплекс кобальта и этилендиамина
Приборы
и посуда:
)
Стаканы химические(V=100мл)
)
Весы
)
Водяная баня
)
Мерный цилиндр на 100 мл
)
Фильтры бумажные
)
Шпатель, стеклянная палочка
)
Воронка Бюхнера, колба Бунзена
)
Водоструйный насос
)
Бюкс
Реактивы:
)
Хлоропентаамминкобальта [Co(NH3)5Cl]Cl3
2)
Этилендиамин (CH2)2(NH2)2
)Дистиллированная
вода
Растворяем
2 г. хлорида хлоропентаамминкобальта [Co(NH3)5Cl]Cl3 в 16 мл. воды при нагревании, добавляем 3 г.
этилендиамина (en=HN(CH2)2NH2), т.к. в лаборатории нет этилендиамина в твёрдом
состоянии, но имеется в жидком, то высчитываем количество этилендиамина
соответствующего трём граммам в мл. Плотность (en) ρ=0,893г/мл. Следовательно найдём объём (en)
из формулы V=m/ρ. V(en)=3г./0,893г./мл.
отсюда V=3,4 мл. (что соответствует 3 г.)
Далее
смесь нагреваем и немного выпариваем на водяной бане. Через час к
темно-оранжевому охлаждённому раствору прибавлял спирт до выделения кристаллов.
Кристаллы образуются в форме длинных игл похожих на морского ежа, отсасываем их
на воронке Бюхнера.
Комплекс
имеет темно-красный цвет, хорошо растворяется в воде.
Реакция
синтеза.
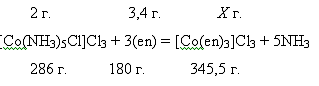
Рассчитываем
количество вещества исходных компонентов, и по недостатку определил теоретический
выход продуктов реакции:
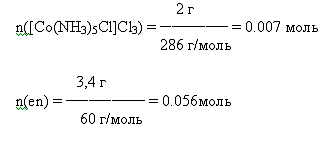
В
недостатке [Co(NH3)5Cl]Cl3
Следовательно,
находим теоретический выход по [Co(NH3)5Cl]Cl3
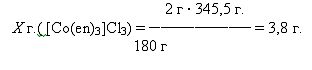
Полученный продукт трис(этилендиамин)кобальта высушил и взвесил. Масса
продукта равна 2,4 г.
Рассчитаем практический выход продукта в % по отношению к теоретическому
выходу продукта:
,4 г · 100%
,8 г - 100%
Следовательно, получаем, что 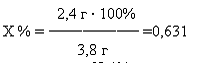
Практический выход составил 63,1%.
Проведем качественные реакции:
[Co(en)3]Cl3 + 3NaOH(k) →
Co(OH)3↓ + 3NaCl + 3en (на ион Co3+)
желтый осадок
[Co(en)3]Cl3
+ AgNO3 → AgCl↓ + (на ион Cl-)
белый осадок
Снимаем спектр поглощения 0,01М раствора [Co(en)3]Cl3 (l=10
мм )
|
№
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
λ
|
315
|
400
|
440
|
490
|
540
|
590
|
670
|
750
|
870
|
|
D
|
0,58
|
0,33
|
0,66
|
0,34
|
0,6
|
0,052
|
0,02
|
0,012
|
0,015
|
0,017
|
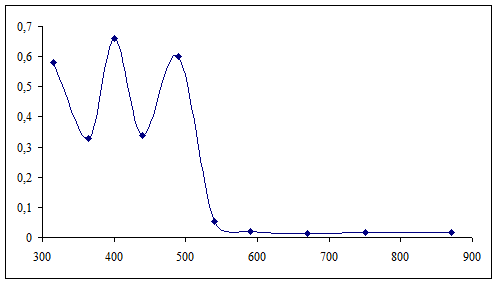
График
№1.Спектра поглощения раствора [Co(en)3]Cl3
2.2
Синтез №2
Дигидрат диоксалатокупрат (ΙΙ) калия
K2[Cu(C2O4)2]·2H2O
В термостойкий химический стакан ёмкостью 100 мл помещаем навеску
пентагидрата сульфата меди (ΙΙ) массой 5 г. и растворяем в 10 мл
воды (раствор Ι). Помещаем в другой химический стакан ёмкостью 100 мл
моногидрат оксалата калия массой 7,3 г и растворяем в 20 мл воды (раствор ΙΙ) и нагреваем оба раствора до 90оС.
Не охлаждая растворов, приливаем при интенсивном перемешивании раствор Ι к раствору II. После этого полученный раствор охлаждаем в водяной бане до
100С (внося в воду лёд).
Реакция синтеза
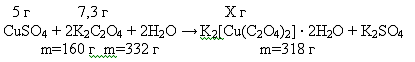
Рассчитываем количество вещества исходных компонентов, и по недостатку
определяем теоретический выход продуктов реакции:
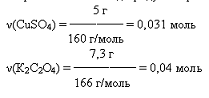
Находим выход по CuSO4, т.к. он
находится в недостатке:
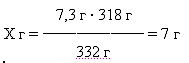
Полученный продукт просушил и взвесил, масса (K2[Cu(C2O4)2]) = 6,8 г.
Рассчитаем практический выход в % по отношению к теоретическому:
г - 100%
,8 г - Х%
Следовательно найдём выход
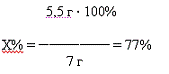
Проведем качественные реакции:
1) K2[Cu(C2O4)2] + 2NaOH(k) → Cu(OH)2↓
+ Na2C2O4 + K2C2O4 ( ион Cu2+)
Выпадает синий осадок гидроксида меди.
2) K2[Cu(C2O4)2]
+ Na3[Co(NO)2]→ K2Na[Co(NO2)6]
↓+ Na2C2O4 + (на ион K+)
Желтый осадок
) 5K2[Cu(C2O4)2]
+ 2KMnO4 +8H2SO4 → 10CO2↑+5CuSO4+5K2C2O4+10H2O+2MnSO4
+K2SO4 (на ион С2О42-)
Обесцвечивание раствора, выделение газа.
Снимаем спектр поглощения 0,01М раствора K2[Cu(C2O4)2]·2H2O(l=10мм)
|
№
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
λ
|
315
|
364
|
400
|
440
|
490
|
540
|
590
|
670
|
750
|
|
D
|
0,07
|
0,11
|
0,15
|
0,21
|
0,32
|
0,51
|
1,3
|
0,8
|
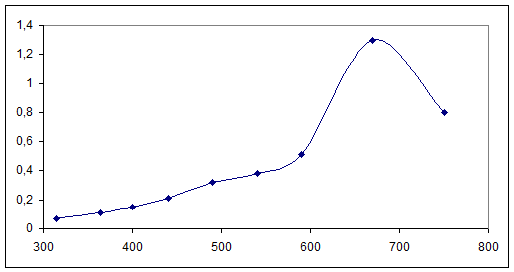
График№2
Спектра поглощения раствора K2[Cu(C2O4)2]
.3
Синтез №3
Получение
триоксалатоферрата(III) калия
K3[Fe(C2O4)3]
Цель:
получить хелатный комплекс калия и железа
Приборы и посуда:
1. Стаканы химические (V=100мл)
2. Весы
. Водяная баня
. Мерный цилиндр
. Фильтры бумажные
. Воронка Бюхнера, колба Бунзена
. Водоструйный насос
. Шпатель, стеклянная палочка
. Бюкс
Реактивы:
1. Дигидрат
хлорида бария BaCl2·2H2O 
. Оксалат
натрия Na2C2O4
. Сульфат
железа (III)
. Этанол
. Вода
дистиллированная
Ход работы:
Вначале приготовим оксалат бария, для чего к раствору 1.5 г оксалата
натрия в 40 мл воды приливаем раствор 2,5г хлорида бария в 6мл воды. Происходит
выпадение кристаллов,
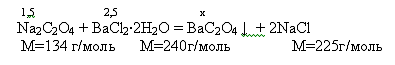

Теоретический выход 2,3
Практический
выход 1,2 или 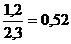 то есть 52%.
то есть 52%.
Далее
полученный оксалат бария, сульфат железа(1,25 г.) и оксалат калия(1,5 г.)
помещаем в стакан и добавляем 30мл. воды. Полученный раствор нагреваем на
водяной бане в течении 2-х часов поддерживая постоянный объем. Происходит
реакция:
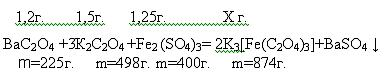
Раствор
фильтруем и упариваем до объема 5мл и охлаждаем при комнатной температуре.
Происходит выпадение зеленоватых кристаллов. Отсасываем их на воронке Бюхнера и
немедленно помещаем в темное место для сушки.
Взвешиваем
получившиеся кристаллы, их масса равна 1,4г.
n(BaC2O4)=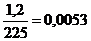 моль
моль
n(3К2C2O4)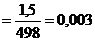 моль
моль
n(Fe2
(SO4)3 ) 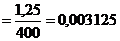 моль
моль
Находим
теоретический выход по оксалату калия так как он в недостатке.
,5
→ х
498 → 874 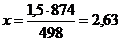
Практический
выход равен 1,4 или 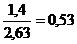 53%.
53%.
Проведем
качественные реакции:
)
K3[Fe(C2O4)3]+ Na3[Co(NO2)6]
→ K2Na[Co(NO2)6]↓
(на ион К+)
желтый
осадок
)
K3[Fe(C2O4)3]+
Снимаем
спектр поглощения 0,01М раствора K3[Fe(C2O4)3] (l=10мм)
|
№
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
λ
|
315
|
364
|
400
|
440
|
490
|
540
|
590
|
670
|
|
D
|
0
|
0
|
0,13
|
0,415
|
0
|
0,025
|
0
|
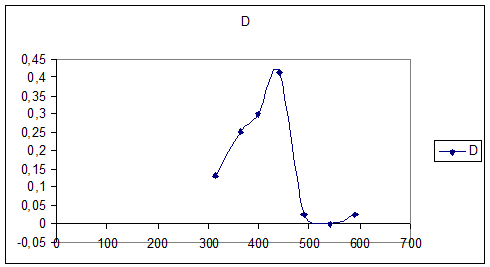
График №3
Спектра поглощения раствора K3[Fe(C2O4)3]
Заключение
В
результате проведения данной курсовой работы мы рассмотрели циклические
комплексы, изучили со стороны теории комплексных соединений, дав теоретическое обоснование
их химической и физических свойств; провели синтез представителей данного
класса веществ: триоксалатоферрат(III) калия K3[Fe(C2O4)3]
, диоксалатокупрат (II)калия K2[Cu(C2O4)2]·2H2O,
хлорид трисэтилендиамин кобальта III, подтвердили их качественный состав, сняли
спектры поглощения 0, 01 молярных растворв.
хелатный комплекс вещество химический
Список литературы
1. Васильев В.П. Аналитическая химия. Учеб. для студ.
вузов. 2-е изд., перераб и дополненное - М.: Дрофа, 2002. - 368с.: ил.
2. Желиговская Н.И., Черняев И.И., Химия комплексных
соединений. М.: Высшая школа, 1966. - 340с.
. Третьяков Ю.Д. Неорганическая химия, Т.2: Химия
непереходных элементов: Учебник для студ. высш. учеб. - М.: Издательский центр
«Академия», 2004. - 368с.
. Третьяков Ю.Д. Неорганическая химия, Т.2:
Физико-химические основы неорганической химии: Учебник для студ. высш. учеб. -
М.: Издательский центр «Академия», 2004. - 240с.
. Кнорре Д.Г. Физическая химия: Учебник для студ.
высш. учеб. - М.: Высшая школа 1990. - 416с.: ил.
. Угай Я.А. Общая и неорганическая химия: Учеб. для
вузов 3-е изд., испр. - М.: Высшая школа 2002. - 527с.: ил.
. Третьяков Ю.Д. Практикум по неорганической химии:
Учеб. пособие для студ. высш. уч. заведений. М.: Издательский центр «Академия»,
2004. -384с.:ил.
. Зломанов В.П. Практикум по неорганической химии:
Учеб. пособие. - М.: МГУ, 1994. - 320с.: ил.