Явление люминесценции
Контрольная работа
Явление люминесценции
Введение
флуоресценции люминисценция краситель поляризация
Время жизни электронно-возбужденного состояния молекул 10-8-10-9
с. После этого молекула возвращается в исходное состояние, израсходовав дополнительную
энергию безизлучательным образом на колебательные движения ядер и
поступательные движения соседних молекул, т.е. растратив ее в виде тепла. Но
эта энергия также может выделиться в виде излученного фотона. Это явление
называют люминесценцией. В зависимости от способа возбуждения молекулы -
светом, электрической энергией, химическими реакциями, нагреванием, и т.д. -
различают фото-, электро-, хемо-, или термолюминесценцию. Нас больше интересует
фотолюминесценция, обычно называемая флуоресценцией.
1. Законы флуоресценции
Спектром флуоресценции называют зависимость интенсивности
излученного света от энергии фотонов: Iфл = f (hn) или F(n). Но обычно в видимой и
ультрафиолетовой области строят зависимость интенсивности флуоресцентного света
от длины волны:
флуоресценция люминисценция краситель поляризация
Iфл = f(l).
По закону Стокса, спектр флуоресценции смещен в
длинноволновую область по сравнению со спектром поглощения. Это смещение
называется стоксовским сдвигом. Оно отражает потерю части энергии возбуждения
вследствие теплового рассеяния. Но нередко спектры флуоресценции частично
перекрываются со спектрами поглощения света (и со спектрами возбуждения
флуоресценции). В области перекрытия, называемой антистоксовской (Рис. 1),
энергия излученных фотонов больше энергии поглощенных квантов. Дополнительная
энергия в данном случае берется за счет колебательной энергии молекул, когда в
результате излучения происходит переход на более низкий колебательный
подуровень, чем тот, с которого происходило поглощение фотона (Рис. 2).
Рис. 1. Зеркальная симметрия спектров флуоресценции (1) и
поглощения (2) раствора родамина 6G. Антистоксова область заштрихована
Правило Каша гласит, что в растворах излучательные
переходы происходят, как правило, с нижних колебательных подуровней синглетных
или триплетных возбужденных уровней. Это происходит потому, что за время жизни
возбужденного состояния 10-8-10-9 с успевают
осуществиться все колебательно-вращательные переходы (их типичная длительность
10-13-10-12 с). Можно сказать, что к моменту испускания
фотона молекула «забывает», на какой подуровень она была возбуждена. Поэтому спектр
флуоресценции не зависит от длины волны возбуждающего света.
Рис. 2. Схемы переходов между электронно-колебательными при
стоксовой (а) и антистоксовой (б) флуоресценции, когда в результате перехода на
более низкий колебательный подуровень энергия излученного кванта выше энергии
поглощенного кванта
По правилу Лёвшина, спектры флуоресценции, построенные
в шкале частот (энергий фотонов, зеркально-симметричны относительно
длинноволновой полосе поглощения. Это связано с тем, что расстояния между
колебательными подуровнями и вероятности переходов на них у молекул в
возбужденном состоянии сходны с таковыми в основном состоянии. Причина этого в
том, что за время электронных переходов порядка 10-15 с положения
ядер не успевают измениться, так как типичные периоды их колебаний на два-три
порядка дольше - порядка 10-13-10-12 с. Поэтому по
принципу Франка-Кондона поглощение и испускание фотонов обусловлено одними и
теми же колебательными подуровнями.
Квантовым выходом флуоресценции называется отношение числа
излученных квантов к числу поглощенных:
j = nфл/nпогл
Величина 0 < j < 1, потому что кроме
испускания фотонов, есть и другие пути утилизации энергии возбуждения: она
может быть передана другим молекулам, расходоваться в химических реакциях или
рассеваться в виде тепла.
В соответствии с законом Вавилова, в стоксовой области
квантовый выход флуоресценции сложных молекул в растворах не зависит от длины
волны возбуждающего света.
Интенсивность флуоресценции разбавленных растворов
пропорциональна концентрации флуорохромов. Действительно, в разбавленных
растворах с низкой оптической плотностью D = ecl < 0,05
Iфл = Kj Iпогл = Kj I0 (1-Т) = Kj I0 (1-10─D)» 2,3 kj I0
D,
где k - доля флуоресцентного излучения, попадающего в
фотоприемник. Это позволяет по флуоресценции определять количество флуорохрома
и его изменения при различных воздействиях. Для количественного измерения
концентрации флуорохрома используют калибровочную кривую:
c = cстанд (Iфл/Iстанд),
где индекс «станд» относится к стандартному калибровочному
раствору.
. Регистрация флуоресценции. Спектрофлуориметры
При регистрации флуоресценции необходимо, чтобы более
интенсивный возбуждающий свет не попал в фотоприемник и не мешал измерениям.
Для этого располагают фотоприемник по углом 90о и используют
скрещенные светофильтры (Рис. 3). В канале возбуждения флуоресценции помещают
светофильтр, хорошо пропускающий возбуждающий свет, но не пропускающий свет в
диапазоне, где объект флуоресцирует, а в канале регистрации - светофильтр, не
пропускающий коротковолновый свет, используемый для возбуждения флуоресценции,
но хорошо пропускающий излучаемый свет. Пара таких взаимоисключающих
светофильтров не должна пропускать свет.
Рис. 3 Применение скрещенных светофильтров для регистрации
флуоресценции (А) и их спектры пропускания света (Б). 1 - светофильтр в канале
возбуждения, 2 - светофильтр в канале регистрации флуоресценции
Рис. 4. Схема спектрофлуориметра. 1 - источник света; 2 -
собирающий линзы; 3 и 5 - монохроматоры в каналах возбуждения и регистрации
флуоресценции; 4 - кювета с образцом; 6 - фотоумножитель; 7 - источник питания
фотоумножителя; 8 - усилитель; 9 - компьютер и принтер
В современных спектрофлуориметрах обычно используются два
монохроматора, один в канале возбуждения, другой - в канале регистрации
флуоресценции (Рис. 4) Это позволяет регистрировать как спектр флуоресценции,
так и спектр возбуждения. В последнем случае флуоресценцию регистрируют на
определенной длине волны, обычно в максимуме, а если в спектре флуоресценции
есть несколько максимумов, то можно для каждого из них зарегистрировать спектр
возбуждения и по ним идентифицировать флуорохромы, ответственные за появление
этих максимумов.
. Кинетика люминесценции. FLIM микроскопия
Не все возбужденные молекулы излучают фотоны в одно и то же
время. Это вероятностный процесс, поэтому одни молекулы испускают кванты
раньше, а другие позже. Поэтому после возбуждения коротким световым импульсом,
например, лазерным, флуоресценция постепенно затухает. Переход возбужденной
молекулы М* в основное состояние М0 можно описать с помощью
уравнения:
М* 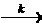 М0 + j Q,
М0 + j Q,
где k - вероятность перехода в единицу времени, а Q - квант
света (фотон).
Кинетика этого процесса описывается уравнением первого порядка:
[M*]/dt = - k [M*]
Его решение:
[M*(t)]=[M*(0)] exp (t/t),
где t = 1/k - среднее время жизни возбужденного
состояния. Интенсивность люминесценции также равна:
I(t) =
d[Q]/dt = - k [M*]= d [M*]/dt
или:
I(t) =
d(j[M*])/dt
= ─jk [M*]= ─j[M*(0)] exp (t/t) = ─ I(0) exp (t/t),
то есть кинетика
люминесценции повторяет кинетику концентрации возбужденных молекул (Рис. 5А,
Б). Постоянную времени затухания флуоресценции можно найти из графика кинетики
затухания флуоресценции. Для этого удобней воспользоваться линеаризованным
графиком (Рис. 5Б):
─ ln [I(t)/I(0)] = t/t,
на котором t = ctg a, где a - угол наклона прямой.
Практически такие
измерения провести трудно, так как время жизни синглетного возбужденного
состояния очень мало (обычно 0,5-10 нс). Поэтому часто используют метод
однофотонной фотометрии. В нем образец освещают очень коротким лазерным
импульсом длительностью менее 1 нс. Он возбуждает некоторое количество молекул,
которые высвечивают световые кванты через разные интервалы времени ti. При попадании фотона на фотокатод
фотоумножителя генерируется короткий импульс фототока. Гистограмма
распределения этих импульсов по величинам ti дает кинетику люминесценции. Для ее построения экспериментатор
задает временной интервал ∆t порядка нескольких сот пикосекунд,
в котором подсчитываются импульсы (это время подачи сигнала на вход
усилителя), и общее количество таких интервалов n. Соответственно, общее время регистрации:
T = n∆t. Функция
зависимости числа импульсов в i-м интервале от времени (или от номера
канала) как раз представляет кинетику спада флуоресценции после возбуждения. Ее
более точно определяют по полученным экспериментальным точкам с помощью метода
наименьших квадратов (Рис. 5А).
Нередко в состав
изучаемого биологического объекта входит несколько (i) компонент с близкими спектрами флуоресценция, но с разной
кинетикой затухания флуоресценции. В этом случае кинетика затухания
флуоресценции представляет собой сумму из нескольких экспонент. На
линеаризованном графике в этом случае они будут представлены отрезками с разным
наклоном:
─ ln [I(t)/I(0)] = S(t/ti),
по которому можно
определить число этих компонент и характерное время затухания флуоресценции ti для каждого из них.
Рис. 5. А.
Кинетика спада флуоресценции после возбуждения коротким световым импульсом.
Определение времени жизни возбужденного состояния t на экспоненциальном (Б) и линеаризованном
(В) графиках
Рис. 6.
Однофотонный и фазово-модулированный методы измерения постоянной времени
затухания флуоресценции: (Адаптировано из #"872478.files/image002.gif">
Для разных пар веществ R0 составляет от 1 до 10
нм, чаще 3-5 нм.
Рис. 14. Ферстеровский индуктивно-резонансный способ миграции
энергии. На графике изображена зависимость эффективности переноса энергии от
расстояния между молекулами
Индуктивно-резонансная миграция энергии может происходить между
энергетическими уровнями с разной мультиплетностью:
o Синглет-синглетная: D* +
A ®A*
+ D
o Синглет-триплетная: D* +
A®
Aт + D
o Триплет-синглетная: Dт
+ A ®
A*+ D.
Типичное время индуктивно-резонансного переноса энергии 10-9-10-10
с. Ферстеровский резонанс сокращает время жизни возбужденного состояния и
длительность флуоресценции донора энергии. Также снижается вероятность
обесцвечивания донора. Ферстеровскую миграцию энергии можно обнаружить по
появлению в спектре возбуждения флуоресценции акцептора полосы поглощения
донора или по исчезновению полосы флуоресценции донора энергии в присутствии
акцептора энергии.
Явление FRET широко применяется в последнее время для
изучения белок-белковых взаимодействий. Для этого к изучаемым белкам
присоединяют флуоресцирующие молекулы (Рис. 15). Одна служит донором энергии,
воспринимающим возбуждающий свет (в данном примере это зеленый флуоресцирующий
белок, GFP), а другая - акцептором. только, Когда изучаемые белки
взаимодействуют и акцептор сближается с донором, донор перестает
флуоресцировать и появляется флуоресценция акцептора, у которой спектр
возбуждения соответствует спектру поглощения донора энергии.
Рис. 15. Применение FRET для исследования белок-белковых
взаимодействий
Обменно-резонансное взаимодействие возникает при перекрывании
электронных орбит молекул донора и акцептора. Такое взаимодействие возможно при
существенно меньших межмолекулярных расстояниях по сравнению с
индуктивно-резонансным переносом (<2 нм). В отличие от
индуктивно-резонансного механизма, где происходит миграция энергии между синглетными
уровнями, в обменно-резонансном механизме разрешен перенос энергии электронного
возбуждения от триплетной молекулы донора на триплетный уровень акцептора.
Экситонный механизм миграции энергии также, как и
индуктивно-резонансный, основан на электрических диполь-дипольных
взаимодействиях между молекулами в случае тесного межмолекулярного
взаимодействия при плотной квазикристаллической упаковке молекул. При этом
происходит экситонное расщепление уровней энергии, энергетические уровни
молекул распределяются по сравнительно большому объему, и локализация
возбужденного электрона становится неопределенной. В этом случае вероятность
переноса энергии между соседними молекулами резко возрастает. Требуемое для
этого время составляет всего 10-14 - 10-12 с, что на
несколько порядков меньше, чем при индуктивном резонансе. Характерные
расстояния переноса энергии - до 2 нм.
9. Тушение флуоресценции
Квантовый выход флуоресценции всегда меньше единицы, потому
что часть энергии электронного возбуждения теряется внутри самой молекулы на
тепловые процессы или передается соседним молекулам. К внутримолекулярным
энергетическим тратам относятся безизлучательные переходы между
колебательно-вращательными подуровнями, между электронными уровнями с
одинаковой мультиплетностью (S1 → S0 или T1 → T0) или интеркомбинационная
конверсия (S1 → T1 или T1 → S0). Энергия возбуждения
может также растрачиваться на фотохимическую реакцию, например, на разрыв
собственных химических связей. К межмолекулярным тратам относятся
безизлучательный перенос энергии на соседние молекулы с увеличением их
кинетической энергии (тепловые потери), на электронное возбуждение соседней
молекулы с возвратом первой молекулы на основной уровень (миграция энергии).
Безизлучательная дезактивация возбужденных состояний называется тушением
флуоресценции.
Наиболее активными тушителями флуоресценции являются тяжелые
ионы, такие как Cu2+, Cs+, I─, Br─; парамагнитные ионы и молекулы: нитроксильные
радикалы, O2 или Mn2+; молекулы растворителя, особенно воды, акцепторы
энергии электронного возбуждения.
Время пребывания молекулы в возбужденном состоянии при
отсутствии безизлучательной растраты энергии называют естественным временем
жизни возбужденного состояния tR. После возбуждения
флуоресценция экспоненциально затухает. Скорость ее затухания, т.е. скорость
изменения количества флуоресцирующих молекул I=-dn/dt пропорциональна их числу
n:
I = - dn/dt = kfn = kfn0 e─kf t =I0 e─kf t = I0 e─t/tR,
где kf = 1/tR - константа скорости
флуоресценции, а n0 - исходное число молекул.
В реальности, когда часть энергии необратимо рассеивается,
время жизни возбужденного состояния tf, и квантовый выход
флуоресценции j понижаются вследствие расхода энергии возбуждения на другие
процессы:
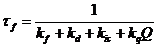
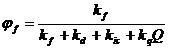 ,
,
где kd -
константа внутренней конверсии, kik - константа
интеркомбинационной конверсии, Q - концентрация молекул - тушителей
флуоресценции. Отсюда: tf =
tRjf и kf = jf /tf.
Если тушителя флуоресценции нет, то квантовый выход
флуоресценции составит:
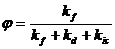 ,
,
Тогда степень тушения флуоресценции тушителем можно записать в
виде:
j /jf = 1 + K[Q].
Это уравнение Штерна-Фольмера. В нем константа K
характеризует эффективность тушения флуоресценции. Так как при тушении
флуоресценции на изменяется коэффициент поглощения флуорохрома, то такое же
уравнение можно написать и для отношения интенсивностей флуоресценции в
отсутствие и присутствии тушителя:
I /If = 1 +
K[Q].
10. Зависимость флуоресценции от микроокружения
молекулы
Спектры и квантовые выходы флуоресценции флуорохромов сильно
зависят от полярности и подвижности окружающих их молекул, т.е. от
диэлектрической проницаемости и вязкости растворителя. А если флуорохром
встроен в белковую макромолекулу или биомембрану - от полярности и подвижности
атомных группировок в их ближайшем микроокружении.
Владимиров и Потапенко (2006) рассматривают физику этих
эффектов на примере диметиламинохалкона (ДМХ), молекула которого в основном
состоянии (1 на Рис. 16) является электрическим диполем с небольшим дипольным
моментом (17×10-30 Кл×м). При растворении в
разных растворителях с диэлектрической проницаемостью, возрастающей от 1,9
(гептан), до 2,4 (толуол), 17,7 (бутанол), 32,7 (метанол) и 80 (вода) максимум
поглощения и особенно максимум флуоресценции ДМХ прогрессивно смещаются в
длинноволновую область от 383 до 427 нм и от 436 до 560 нм.
Авторы связывают этот сдвиг с потерей энергии при
реорганизации сольватной оболочки. В основном состоянии молекула окружена сравнительно
небольшой сольватной оболочкой. В полярных растворителях это оболочка из
дипольных молекул растворителя. Быстрый переход в возбужденное состояние,
происходящий за 10-15 с (состояние 2 на Рис. 16), приводит к
повышению дипольного момента до 77×10-30 Кл×м. Такое повышение
дипольного момента характерно и для многих других биологически значимых
органических молекул. Оно вызывает поляризацию окружающих молекул растворителя,
их переориентацию и дополнительную сольватацию ДМХ в течение последующих 10-13-10-8
с. В результате энергетических трат на эти процессы, энергия флуорохрома
несколько понижается (состояние 3 на рис. 26). Затем излучается фотон
флуоресценции и молекула флуорохрома быстро переходит на один из верхних
подуровней основного состояния (состояние 4 на рис. 26). Его энергия выше
энергии исходного состояния, т.к. молекула имеет дополнительную сольватную
оболочку. В результате последующей десольватации молекула возвращается в
исходное состояние. Энергетические траты на сольватацию приводят к снижению
энергии излученного фотона, т.е. к длинноволновому сдвигу. Этот сдвиг высок,
если возбуждение существенно повышает дипольный момент флуорохрома, если велик
дипольный момент окружающих молекул, т.е. высока диэлектрическая проницаемость
среды, и если высока подвижность молекул растворителя, т.е. низка его вязкость.
Все это облегчает переориентацию молекул растворителя, снижает энергетические
потери и вызывает длинноволновой сдвиг полосы поглощения.
Рис. 16. Изменения дипольного момента и сольватной оболочки
флуорохрома в результате поглощения и излучения фотона. Дипольный момент
обозначен соответствующим расстоянием между зарядами
Но такое свойство, вероятно, справедливо для дипольных
молекул, а в случае гидрофобных веществ сдвиг может быть противоположным.
Например, при переходе от неполярной среды (мембраны липосом или клеток) к
полярной (метанол) полосы поглощения (555 и 596 нм) и флуоресценции (602 и 651
нм) гиперицина смещаются в коротковолновую область спектра до 546 и 589 нм и
595 и 645 нм, соответственно. Возможно, в данном случае более важную роль
играла не полярность среды, а подвижность молекул в ближайшем микроокружении
хромофора. Красный спектральный сдвиг обычно происходит при повышении вязкости
микроокружения хромофора, когда подвижность молекул ограничена и больше энергии
расходуется на реорганизацию среды вокруг возбужденной молекулы хромофора.
Внутри мембран гиперицин локализуется в вязком липидном микроокружении, где его
подвижность ограничена по сравнению с метанолом, в котором наблюдается более
коротковолновое поглощение и флуоресценция.
11. Флуоресценция белков
Флуоресценция белков обусловлена флуоресценцией
аминокислотных остатков, наиболее интенсивно поглощающих ультрафиолетовое
излучение - триптофана, тирозина и фенилаланина. Основные параметры
флуоресценции этих аминокислот в водных растворах приведены в таблице У
триптофана и тирозина примерно одинаковые квантовые выходы флуоресценции, но
поскольку молярный коэффициент поглощения на порядок больше, чем тирозина, то и
флуоресцирует он сильнее; флуоресценцией остальных аминокислот можно
пренебречь.
Таблица 1. Квантовый выход и максимум спектра флуоресценции
хромофорных аминокислот
|
Аминокислота
|
(lmax), нм
|
j
|
|
Триптофан
|
348
|
0,20
|
|
Тирозин
|
303
|
0,21
|
|
Фенилаланин
|
282
|
0,04
|
Спектры и квантовые выходы флуоресценции белков не
тождественны спектрам и квантовым выходам флуоресценции эквимолярной смеси
соответствующих аминокислот и зависят от структурной организации белковых
молекул. Они изменяются при нарушении вторичной и третичной структуры белка и
даже при более тонких структурных изменения. Вклад тирозиновой компоненты в
общую флуоресценцию белка проявляется, когда в белке отсутствует триптофан.
Тирозиновая компонента имеет максимум при 303 нм, как и для
свободного тирозина, и не изменяется при денатурации белка. Но квантовый выход
флуоресценции тирозина в разных белках сильно варьирует. В составе белков он на
порядок ниже, чем в водном растворе и сильно зависит от своего микроокружения.
Например, в рибонуклеазе квантовый выход флуоресценции трех наружных
тирозиновых остатков, обращенных в водную среду равен примерно 0,03, а трех
остальных, находящихся внутри белковой глобулы, - всего 0,00 Возможно, низкий
кантовый выход флуоресценции внутренних тирозинов обусловлен ее тушением
карбоксильными группами глутаминовой и аспарагиновой аминокислот, дисульфидными
мостиками и другими факторами. Хотя изменение квантового выхода не позволяет
судить о характере микроокружения тирозина, но все же этот параметр можно
использовать как конформационно-чувствительный тест. После денатурации
рибонуклеазы квантовый выход флуоресценции ее тирозиновых остатков повышается
до 0,055.
Вклад триптофановой компоненты в ультрафиолетовую
флуоресценцию доминирует даже в сывороточном альбумине человека, в котором на
единственный триптофан приходится 17-18 тирозинов и 33 фенилаланина. Спектры
флуоресценции триптофана в разных белках сдвинуты в коротковолновую область по
сравнению со свободным триптофаном (348-350 нм) и сильно различаются. Например,
у рибонуклеазы максимум спектра флуоресценции приходится на 325 нм, а у
сывороточного альбумина человека - на 343 нм. При денатурации белков максимум
спектра флуоресценции сдвигается к 350 нм, как у свободного триптофана. По всей
вероятности, положение максимума триптофановой флуоресценции зависит от
микроокружения этой аминокислоты, которое определяется при укладке
полипептидной цепи в глобулу.
Квантовый выход флуоресценции триптофана также сильно зависит
от структуры белка и различается у разных белков. Например, у лизоцима он равен
0,08, а у пепсиногена - 0,27. После денатурации он становится равным 0,2, как у
водного раствора триптофана. Предполагается несколько причин изменения
квантового выхода флуоресценции триптофана при включении его в состав белковой
глобулы:
- Утрата заряженных групп -
NH3+ и - COO─ в полипептидной цепи и последующее тушение
флуоресценции (эффект пептидной связи);
- Взаимодействие с
триптофана с дисульфидной группой, остатками гистидина или карбоксильными
группами аспарагиновой и глутаминовой аминокислот может усилить внутреннюю
конверсию и безизлучательные переходы, что также снижает квантовый выход;
- Повышение квантового
выхода может быть обусловлено более гидрофобным микроокружением триптофанила в
белке по сравнению с раствором, ограничением его подвижности и, значит,
снижением вероятности безизлучательных переходов.
Согласно правилу Каша и закону Вавилова, спектр и квантовый
выход флуоресценции не зависит от длины волны возбуждающего света. Но во многих
белках, содержащих несколько триптофанилов, это не выполняется благодаря их
гетерогенности и, как следствие, вследствие разного поведения. Эта
гетерогенность, вероятно, обусловлена их различным микроокружением в белковой
глобуле. На основании многочисленных экспериментальных данных была составлена
эмпирическая схема зависимости спектров поглощения и флуоресценции
триптофанилов от их микроокружения (Рис. 17).
Рис. 17. Сдвиги спектров поглощения и флуоресценции
аминокислот в разных областях белков. 1 - красный сдвиг и спектра поглощения, и
спектра флуоресценции наблюдается в случае отрицательного заряда вокруг
триптофанила. 2 - синий сдвиг обоих спектров наблюдается, если заряд вокруг
триптофанилов отрицателен. 3 - сближение полос поглощения света и флуоресценции
происходит при повышении гидрофобности (уменьшении полярности) микроокружения
триптофанила. 4 - Удаление полос друг от друга происходит при уменьшении
гидрофобности (повышении полярности) микроокружения триптофанила
Согласно Фрайфелдеру (1980), эти эмпирические правила
следующие:
1. Максимум спектра флуоресценции триптофана (lmax) смещается влево, в
коротковолновую область, а интенсивность возрастает при уменьшении полярности
растворителя. Из этого следует:
─ Если белок находится в воде и при этом lmax смещена влево
относительно положения максимума триптофана в воде, то триптофан должен
находиться внутри глобулы в гидрофобном микроокружении.
─ Если белок находится в неполярной среде и при
этом lmax смещена влево
относительно положения максимума триптофана в воде, то триптофан должен
находиться на поверхности глобулы или попадать туда в результате вызванного
растворителем конформационного перехода.
2. Если вещество-тушитель флуоресценции, например, иодид
или нитрат, тушит флуоресценцию триптофана или тирозина, то последние должны
находиться на поверхности глобулы. Если же тушение не наблюдается, то либо
аминокислота находится внутри глобулы, либо она окружена электрическими
зарядами, отталкивающими этот тушитель.
3. Если вещество, не влияющее на квантовый выход
свободного триптофана или тирозина, влияет на флуоресценцию, когда они входят в
состав белка, то оно делает это путем конформационной перестройки белка.
. Квантовый выход флуоресценции триптофанила и
тирозинила понижается при протонировании карбоксильной группы.
. Флуоресценция триптофана может тушиться близлежащими
протон-донорными группами.
. Если связывание какой-то молекулы с белком приводит
к тушению флуоресценции триптофана, то либо она индуцирует большую
конформационную перестройку белка, либо часть триптофанилов находится вблизи
центра связывания этой молекулы.
. Если связывание молекулы-тушителя флуоресценции с
белком снижает флуоресценцию триптофана, то триптофан находится вблизи места
связывания этой молекулы.
Таким образом, можно:
─ различать «полярные» триптофанилы, находящиеся
на поверхности глобулы, у которых lmax » 350 нм и j » 0,2 и «неполярные»,
находящиеся в гидрофобном окружении внутри белка, характеризующиеся lmax » 330 нм и j » 0,05.
─ Оценивать гетерогенность триптофановых
остатков.
─ Оценивать полярность их микроокружения.
─ Изучать доступность этих остатков к разным
веществам, добавляемым в раствор и следить за ней при конформационных
превращениях белка.
─ Обнаруживать структурные конформационные
переходы в белках при разных воздействиях.
─ Исследовать кинетику этих переходов.
─ Изучать условия их осуществления (температура,
рН и т.д.)
─ Определять термодинамические параметры таких
переходов.
Основные преимущества флуоресцентного метода - практическая
безинерционность и исключительно высокая чувствительность, позволяющая работать
с очень малыми количествами исследуемых веществ. Если с помощью
спектрофотометра можно определить 10-8-10-9 М какого-то
вещества, то флуоресцентный метод позволяет обнаруживать концентрации 10-10-10-12
М. Точность измерения интенсивности флуоресценции ограничена различными
причинами: светорассеянием; экранировкой возбуждающего и испускаемого света
другими молекулами; реабсорбцией (поглощением фотонов в толще образца)
флуоресценции молекулами среды; гетерогенностью биообъектов, миграцией энергии,
тушением флуоресценции и т.д.
12. Флуоресценция нуклеиновых кислот
В отличие от белков, нуклеотиды и нуклеиновые кислоты, ДНК и
РНК, практически не флуоресцируют вследствие высокой вероятности
безизлучательной дезактивации возбужденного состояния. Время жизни их возбужденных
состояний порядка 10-11-10-10 с. Квантовые выход
флуоресценции меньше 0,01.
13. Собственная флуоресценция клеток
Для регистрации ультрафиолетовой флуоресценции микроскоп
должен быть оборудован ртутной лампой, излучающей ультрафиолетовый свет,
кварцевой оптикой, светофильтром, выделяющим возбуждающий свет с длиной волны
от 250 до 300 нм (lmax = 280 нм), и запирающим светофильтром, не
пропускающим свет с длиной волны короче 300 нм, но пропускающим
ультрафиолетовое излучение с длинами волн в области 300-350 нм. Наиболее
интенсивная ультрафиолетовая флуоресценция наблюдается в цитоплазме, а ядра
практически не флуоресцируют. Наибольший вклад во флуоресценцию клеток вносит
свечение митохондрий, в мембраны которых встроено большое количество белков.
Спектры флуоресценции клеток совпадают со спектрами белковых триптофанилов (lmax » 330-335 нм), находящихся
в гидрофобном микроокружении либо внутри белковых глобул, либо внутри
митохондриальных мембран, в которые встроены эти белки.
В видимой области (сине-зеленый диапазон) также интенсивней
всего флуоресцируют митохондрии, в которых сосредоточены флавопротеины и
рибонуклеопротеины, содержащие никотинамидадениндинуклеотид (NAD). При
возбуждении с длиной волны 340 нм флуоресцирует восстановленная форма
пиридиннуклеотида NADH, максимум флуоресценции которого в водной среде 470 нм,
а в составе белков - 440 нм. Окисленная форма NAD+ не поглощает
ультрафиолет и не флуоресцирует. Поэтому по флуоресценции можно судить о
степени восстановленности NAD. Флуоресценцию окисленных флавинов, прежде всего
флавинаденинмононуклеотида (FMN) и флавинадениндинуклеотида (FAD), удобно
возбуждать в синей области спектра при 450 нм, а регистрировать в зеленой
области (520 нм). Восстановленные флавины, в отличие от пиридиннуклеотидов, не
флуоресцируют. По соотношению флуоресценции при 440-470 и 520 нм можно
определить соотношение восстановленных пиридиннуклеотидов и окисленных флавинов
в клетке и, соответственно, оценить интенсивность биоэнергетических процессов и
ее изменения при различных воздействиях. В качестве примера на рис. 18
приведена микрофотография голубой аутофлуоресценции пиридиннуклеотидов и
зеленой флуоресценции флавинов в теле одиночных нервных клеток.
Рис. 18. Аутофлуоресценция механорецепторного нейрона рака.
А. Изображение нейрона в проходящем свете. Б. Голубое свечение
пиридиннуклеотидов. В. Зеленое свечение флавинов в теле клетки. Масштабный
отрезок 20 мкм
14. Флуоресцентная микроскопия
Исследование флуоресценции клеток, окрашенных специальными
красителями-флуорохромами или флуоресцирующими антителами к определенным
клеточным белкам, резко расширило возможности оптической микроскопии. В отличие
от традиционных микроскопов, в которых клетки рассматривались в проходящем
свете, во флуоресцентном микроскопе (Рис. 19) возбуждающий ультрафиолетовый или
синий свет от ртутной лампы подается на объект через объектив сверху. Через
этот же объектив свет флуоресценции попадает в глаза экспериментатора или на
фотоприемник. Для того, чтобы вместе с флуоресценцией не проходил намного более
интенсивный возбуждающий свет, отраженный от объекта, используют скрещенные
светофильтры: пропускающий только ультрафиолетовый или синий свет в канале возбуждения
и запирающий светофильтр, не пропускающий коротковолновый возбуждающий свет, в
канале регистрации. Запирающий светофильтр может или пропускать весь свет с
длиной волны, большей, чем длина волны возбуждающего света (длинноволновый или
long-pass светофильтр), или селективно пропускать только свет в заданном узком
диапазоне. Последним свойством отличаются интерференционные светофильтры,
имеющие полосу пропускания порядка 10-20 нм. Для разделения света с разной
длины также используется дихроическое зеркало, отражающее коротковолновый
возбуждающий свет, и пропускающее длинноволновый свет флуоресценции.
А
Б
Рис. 19. Флуоресцентный микроскоп. А. современный
флуоресцентный микроскоп Observer (K. Zeiss, FRG). Б. Схема
флуоресцентного микроскопа. 1 - ртутная лампа, возбуждающая флуоресценцию; 2 -
светофильтр возбуждения; 3 - дихроическое зеркало, отражающее коротковолновый
возбуждающий свет, и пропускающее длинноволновый свет флуоресценции; 4 -
объектив микроскопа; 5 - объект исследования на предметном столике; 6 -
запирающий светофильтр; 7 - сферическое зеркало с отверстием; 8 - зеркало; 9 -
окуляр; 10 - зеркало; 11 - коллимирующая линза; 12 - лампа накаливания для
наблюдения в проходящем свете; 13 - фотоприемник (видеокамера, цифровая
фотокамера, фотоаппарат или фотоумножитель)
Обычная световая микроскопия, основанная на поглощении света,
не свободна от недостатков:
o оптическое разрешение
менее половины длины световой волны:
d = 0,61l/NA=0,61l/n sin a,
где NA= n sin a - числовая апертура, n - показатель преломления
среды, a - угол раскрытия, т.е. максимальный угол, под
которым лучи от объекта могут попасть в объектив;
o невысокий контраст: кроме
изучаемой, видны окружающие структуры;
o высокие требования к
системе освещения и ее настройке;
o различные аберрации и
т.д.
Флуоресцентная микроскопия свободна от многих этих
недостатков:
• видны только флуоресцирующие структуры на темном
фоне;
• разрешение не ограничено;
• система освещения не участвует в построении
изображения;
• отсутствуют хроматические аберрации.
Однако, флуоресцентное изображение не очень четкое, так как к
флуоресценции каждого элемента объекта добавляется рассеянное флуоресцентное
излучение других элементов, лежащих вне фокальной плоскости.
15. Лазерная сканирующая конфокальная и
мультифотонная микроскопия
В 1957 году М. Мински запатентовал принцип конфокального
микроскопа, в котором ход лучей при рассматривании точечного объекта в канале
наблюдения совпадает с ходом лучей возбуждающего света и имеет общий фокус. Это
позволяет исключить флуоресцирующие элементы, находящиеся вне плоскости фокуса.
Внефокусные лучи снижают контраст и четкость изображения. В современном
лазерном сканирующем конфокальном микроскопе (Рис. 20) используются лазеры,
дающие параллельный монохроматический луч, который можно сфокусировать
объективом в плоскости препарата до диаметра порядка половины длины волны, т.е.
до 1 мкм и менее в соответствии с дифракционными ограничениями (теоретически до
l/2).
Микронный объем, в котором возбуждается флуоресценция, называется вокселем.
Если в плоскость промежуточного изображения ввести диафрагму (pinhole) с
диаметром, соответствующим диаметру изображения этого вокселя, то она будет
пропускать только лучи, исходящие из освещаемого объема, но не лучи, из точек,
лежащих выше или ниже фокальной плоскости (Рис. 20). Сканирование лучом в
плоскости фокусировки и «собирание» точечных изображений компьютером дает
полное изображение объекта в «оптическом срезе» клетки толщиной всего около 1
микрометра. Поскольку рассеянная флуоресценция выше- и нижележащих слоев
объекта не регистрируется, то изображение получается очень четким. Перемещение
объекта по вертикальной оси Z позволяет получить стопку оптических срезов, по которым с
помощью компьютера можно восстановить четкое трехмерное изображение объекта.
Более того, это изображение можно поворачивать и рассматривать с разных сторон
и под разными углами, что недостижимо в обычной оптической микроскопии.
Использование нескольких лазеров позволяет одновременно
регистрировать флуоресценцию от нескольких флуорохромов, селективно
окрашивающих разные клеточные структуры. Наложение этих изображений дает
многоцветное изображение клетки, где разные цвета показывают геометрию
различных клеточных компонентов (Рис. 21). Таким образом, использование
конфокальности позволяет повысить четкость изображения, а сканирование и
компьютерная реконструкция позволяют получить трехмерное изображение образца.
Рис. 20. Схема конфокального микроскопа. Через диафрагму
(pinhole) на фотоумножитель проходят только лучи, исходящие из точки
фокусировки лазерного луча (синие), но не лучи из точек, лежащих выше или ниже
плоскости фокусировки (красные) (по: Л.П. Незлин. Leica Microsystems)
Рис. 21. Построение многоцветного изображения клеток
Дальнейшим развитием сканирующей микроскопии явилась
разработка мультифотонных микроскопов. Они основаны на эффекте двух- или
трехфотонного возбуждения молекул. Например, двухфотонное поглощение квантов с
длиной волны 800 нм соответствует по энергии поглощению квантов света с
удвоенной энергией, т.е. с длиной волны порядка 400 нм. Поэтому воздействуя на
объект инфракрасным светом, можно получить такой же эффект, как и при действии
фиолетового или ультрафиолетового излучения.
Рис. 22. Возникновение двухфотонного эффекта при фокусировке
луча только в малой области вблизи фокальной плоскости, где интенсивность
излучения превышает пороговую. Однофотонное возбуждение происходит по всему
ходу луча - в фокусе и за его пределами
Двух- или трехфотонное поглощение происходит только при очень
больших интенсивностях света. Это достигается при очень малой длительности
импульса. Для мультифотонной микроскопии используются импульсно-периодические
лазеры, генерирующие импульсы длительностью 10-13 с высокой частотой
(порядка 100 МГц). При этом энергия импульса и средняя мощность излучения
обычно невелики, сравнимы с таковыми при однофотонном возбуждении. Другой
фактор, повышающий интенсивность облучения - фокусировка луча в маленькое пятно
микронных размеров. При этом интенсивность превышает пороговую, требуемую для
двухфотонного возбуждения только в малой области вблизи фокуса луча (Рис. 22).
Эта область начинает флуоресцировать, как если бы ее облучали коротковолновым
синим или ультрафиолетовым светом. Ее размер по высоте вдоль оси Z заметно
меньше, чем при однофотонном возбуждении в конфокальном микроскопе. Поэтому
конфокальная диафрагма не требуется, а при сканировании получается еще более
тонкий «оптический срез» и более четкая картина.
Хотя в сканирующем мультифотонном микроскопе не используется
конфокальный эффект, он конструктивно не отличается от сканирующего
конфокального микроскопа за исключением инфракрасного лазерного блока.
Используемое в нем инфракрасное излучение слабо поглощается тканями и клетками
и практически не повреждает их, поэтому его лучше применять для исследования
живых клеток. Оно глубоко проникает в ткани, что позволяет изучать толстые
срезы биологических тканей и даже проводить опыты на живых органах in situ. Инфракрасное излучение
не вызывает выцветание красителей, что позволяет дольше изучать флуоресценцию и
является еще одним преимуществом мультифотонной микроскопии.
16. Флуоресцентные зонды
Сильная зависимость флуоресценции от микроокружения
флуоресцирующих молекул лежит в основе метода флуоресцентных зондов.
Флуоресцентные зонды слабо флуоресцируют в воде, но их флуоресценция резко
усиливается при изменении определенных физико-химических свойств микроокружения
или при связывании с определенными веществами - ионами или молекулами. Это
позволяет охарактеризовать микросреду вокруг молекулы флуорофора, оценить ее
параметра и визуализировать молекулы, особенно сильно влияющие на флуоресценцию
зонда. Этот интенсивно развивающийся метод стал одним из мощнейших инструментов
изучения биомолекул и клеток и получил широкое распространение в последние
годы.
Потенциометрические зонды
Некоторые красители, такие как 1-анилинонафталин-8-сульфонат
(ANS, Рис. 23) очень
чувствительны к полярности их микроокружения. Квантовый выход флуоресценции ANS в воде равен 0,004, а в
липидном слое мембраны - 0,29, на два порядка выше. Длительность его
флуоресценции также возрастает от 0,55 в воде до 7,0 нс в мембране. Поэтому ANS является чувствительным
индикатором на присутствие гидрофобной фазы. Он выявляет присутствие
гидрофобных полостей в белковых глобулах, конформационные изменения белков, их
сворачивание в глобулы. ANS также широко используется для исследования
мембран. Например, ковалентно пришивая к молекуле ANS гидрофобные «хвостики»
разной длины, внедряющиеся в липидный слой, можно погрузить зонд на определенную
глубину в мембрану и по изменению ее флуоресценции зондировать свойства
мембраны на разной глубине.
|
2-аминонафталин-6-сульфонат
(ANS)
|
|
Производное
аминонафтилэтенилпиридина (di-4-ANEPPS) Раздел 1.01
|
|
Тетраметилродамин,
метиловый эфир (TMRM) Раздел
1.02
|
Рис. 23 Примеры потенциометрических флуоресцентных зондов
Рис. 24. Регистрация потенциала действия в мышечной клетке
сердца кролика с помощью флуоресцентного потенциометрического зонда di-4-ANEPPS. lвозб 488 нм. (А). Регистрация
флуоресценции двумя фотоумножителями на 540 (зеленый сигнал) и >610 нм
(красный сигнал). (В). Отношение зеленого и красного сигналов лучше отображает
изменения мембранного потенциала, чем измерения в каждом канале по-отдельности.
На (С) для сравнения представлен потенциал действия, зарегистрированный с
помощью микроэлектрода
Поскольку молекула ANS содержит отрицательно заряженную
группу SO3─, то она чувствительна к электрическому полю, в частности к
поверхностному потенциалу клеток или к трансмембранному потенциалу. При добавлении
ANS в наружную среду его молекулы встраиваются в клеточную мембрану так, что
анионная группа остается снаружи. Так как поверхность клетки заряжена
отрицательно, то зонд погружается в мембрану на некоторую глубину и начинает
флуоресцировать. При генерации потенциалов действия изменяется мембранный
потенциал клетки, и это модулирует флуоресценцию ANS. Это позволяет оптически
оценивать изменения мембранного потенциала клеток и даже регистрировать
потенциалы действия в возбудимых клетках. На Рис. 24 приведен пример
регистрации потенциала действия в мышечной клетке сердца кролика с помощью
флуоресцентного потенциометрического зонда di-4-ANEPPS.
Таблица
2. Области применения потенциометрических флуоресцентных зондов, разработанных
компанией Molecular Probes
|
Зонды
|
Области
применения
|
|
Di-4
- ANEPPS Di-8-ANEPPS Di-2-ANEPEQ Di-8-ANEPPQ Di-12-ANEPPQ
|
Картирование
пространственного распределения мембранных потенциалов в нервных и мышечных
клетках; комбинированные потенциометрические оптические и электрофизиологические
измерения, измерения уровня Са2+; визуализация биоэлектрической
активности сердечных мышц
|
|
RH
237, RH 414 RH 421, RH 795
|
Трассировка
нейронных отростков; Оценка активности синапсов и ионных каналов
|
|
RH 155
|
Измерение
мембранных потенциалов в разных клетках; измерение активности
потеницалзависимых Ca2+ каналов
|
|
DiOC5(3)
DiOC6(3) DiSC3(5)
|
Измерение
мембранных потенциалов в различных клетках; визуализация Ca2+ каналов; оценка активности митохондрий
|
|
JC-1 JC-9
|
Оценка
активности митохондрий, апоптотической деполяризации митохондрий,
митохондриальной регуляции уровня Са2+ в клетке
|
|
TMRM, Родамин 123
|
Измерения
мембранного потенциала митохондрий, активации высокопроницаемых
митохондриальных пор, регуляции уровня Са2+ в клетке митохондриями
|
|
DiBAC4(3) DiBAC4(5) DiSBAC2(3)
|
Комбинированные
измерения мембранного потенциала и уровня Са2+ в клетке. Оценка
активации АТФ-чувствительных К+-каналов
|
|
Мероцианин 540
|
Измерения
мембранного потенциала митохондрий Оценка строения поверхности мембраны и
липидной асимметрии мембран
|
В последние годы для этой цели разработан ряд более
совершенных потенциометрических флуорохромов, позволяющих изучать распределение
потенциалов в пределах одной клетки с пространственным разрешением,
недостижимым для микроэлектродной техники. С помощью флуоресцентных зондов
удалось зарегистрировать мембранные потенциалы маленьких клеток, в которые
невозможно ввести микроэлектроды, например, в бактерий, и даже внутриклеточных
органелл. Применение флуоресцентных зондов позволило экспериментально доказать,
что при переносе протонов через внутреннюю мембрану митохондрии ее матрикс
становится отрицательно заряженным относительно цитозоля, и измерить
трансмембранную разность потенциалов. Для нейрофизиологии особенно интересна
возможность одновременной оптической регистрации импульсной активности десятков
нейронов. В таблице 2 приведены примеры различных областей применения
потенциометрических флуоресцентных зондов.
Другое использование флуоресцентных зондов - визуализация
различных внутриклеточных компонентов, с которыми они специфически связываются,
и в ряде случаев измерение их концентраций. В настоящее время разработано
множество флуоресцентных зондов на:
─ различные биохимические компоненты клеток:
нуклеиновые кислоты, липиды, различные белки и субстраты разных ферментов,
активные формы кислорода, pH, различные ионы и т.д.;
─ структурные элементы клеток: цитоскелет,
хроматин, ионные каналы, рецепторы, клеточные органеллы - митохондрии,
эндоплазматический ретикулум, лизосомы;
─ клеточные функции: эндоцитоз, пролиферацию,
сигнальную трансдукцию, окислительный стресс, апоптоз и т.д.
Рассмотрим несколько примеров.
Ca2+-чувствительные флуорохромы
Одним из важнейших достижений последних лет является
использование флуоресцентных зондов Fura-2, Fluo-3 и других для измерения
уровня ионов кальция в клетках, позволившее изучить пути регуляции уровня Ca2+
в клетках. Ca2+ - важнейший регулятор многочисленных клеточных
процессов. Он контролирует функциональную активность клеток и процессы, ведущие
к их смерти. Разработка флуоресцентных зондов позволила изучить роль Ca2+
в этих процессах. При этом были открыты новые явления: кальциевые волны,
кальциевые спайки и др. Ca2+ зонды бывают двух типов: у одних,
например, принадлежащих семейству Fura, к ионам кальция особенно чувствителен
спектр возбуждения (Рис. 25А), а у других, например, принадлежащих к семейству
Fluo, - спектр флуоресценции (Рис. 25Б). В первом случае, регистрируя
флуоресценцию на длине волны 510 нм, определяют соотношение сигналов при
возбуждении на длинах волн 340 и 380 нм, где зависимость от концентрации Ca2+
особенно выражена (Рис. 25А). Это надежный и чувствительный метод, но
необходимость возбуждения флуоресценции на двух длинах волн в ультрафиолетовом
диапазоне существенно усложняет его. Проще проводить измерения в видимом
диапазоне на одной длине волны около 515 нм, что возможно при использовании
красителей семейства Fluo (Рис. 35Б).
Красители Fluo отличаются большей фотостабильностью, поскольку синий свет
(470 нм), используемый для возбуждения их флуоресценции не так сильно
повреждает молекулы флуорохрома, как ультрафиолетовый свет, используемый для
возбуждения флуоресценции Fura. Они отличаются повышенной яркостью
флуоресценции, возбуждаемой видимым светом. Они хороши для оценки относительных
изменений уровня Са2+ в клетке. Но точность измерений абсолютной
концентрации у них ниже, чем у ратиометрических флуорохромов семейства Fura.
Рис. 25. Спектральные характеристики кальциевых
флуоресцентных зондов. (А). Спектры возбуждения Fura2 (регистрация флуоресценции
на длине волны 510 нм), (Б). Спектры флуоресценции Fluo-5N при разных
концентрациях Ca2+ (длина волны возбуждающего света 470 нм)
FISH: анализ хромосом
Разработка метода многоцветного FISH анализа (fluorescence in
situ hybridization) в 1990-х годах в сочетании с конфокальной микроскопией
значительно расширила возможности изучения структуры и функций хромосом. В этом
случае хромосомы окрашиваются несколькими флуорохромами, каждый из которых
специфичен к определенным фрагментам ДНК, например, богатым А-Т или Г-Ц парами,
связывается с малой бороздкой и т.д. Эта специфичность не очень высока, но
совокупный анализ флуоресцентной картины для всех флуорохромов позволяет
довольно точно идентифицировать различные хромосомы, присвоив каждой с помощью
компьютерных методов определенный псевдоцвет, и даже разделить каждую хромосому
на характерные полосы (Рис. 26 и 27). В качестве флуорохромов часто используют
DAPI, FITC, Cy3, Cy5, красители ряда Alexa, Texas Red и некоторые другие
(Табл.3). В настоящее время чаще используется семицветный FISH анализ. Для
более точной регистрации флуоресценции разных флуорохромов и снижения
перекрытия их полос, применяются узкополосные интерференционные фильтры.
Рис. 26. Пятая хромосома человека, раскрашенная псевдоцветами
на 22 полосы методом FISH с использованием шести флуорохромов (По Рубцову и
Карамышевой, 2000)
Таблица Примеры флуорохромов, используемых в FISH анализе
|
Лазерные линии,
нм
|
Светофильтры
|
Флуорохромы
|
Альтернативные
варианты
|
|
405
|
410-480
|
DAPI
|
Alexa
350
|
|
488
|
495-540
|
FITC
|
Alexa
488
|
|
561
|
566-586
|
Cy5
|
TAMRA,
Alexa 555
|
|
594
|
600-625
|
Texas
Red
|
Cy5
|
|
633
|
655-800
|
Cy5
|
Alexa
633
|
Рис. 27. Метод флуоресцентной гибридизации in situ
(FISH) для идентификации хромосом как в митотических (Б), так и интерфазных
клетках (В и Г). На схеме (А) показаны псевдоцвета, присваиваемые различным
комбинациям из 7 флуорохромов, позволяющие различить разные хромосомы (Б). Срез
на (Г) проходит через середину ядра, а на (В) - на 2 мкм выше. Многоцветная
флуоресценция ядер (В и Г, слева) дает довольно нечеткую картину, но с помощью
конфокальной микроскопии и компьютерной обработки изображений можно четко
локализовать различные хромосомы в интерфазном ядре (Адаптировано из J. Walter et al. //Cytogenet. Genome Res., 2006, Vol. 114, P. 367-378)
Применение FISH в сочетании с конфокальной микроскопией и
трехмерной реконструкцией изображений анализа позволило ответить на вопрос: что
происходит с хромосомами после деления клетки? Оказывается, ДНК каждой
хромосомы после деконденсации занимает определенное место в ядре (Рис. 27C и D, справа).
17. Зеленый флуоресцирующий белок (GFP)
Важным достижением последних лет было открытие в 1994 году
так называемого зеленого флуоресцирующего белка GFP (green fluorescing protein) - природного флуорофора
с очень яркой флуоресценцией. Этот белок из 238 аминокислот с общей
молекулярной массой 27 кДа придает свечение тихоокеанской медузе Aequorea victoria. Его интенсивная зеленая
флуоресценция возбуждается синим светом. В организме медузы белок GFP находится в комплексе с
белком экворином (22кДа), излучающим синий свет (465 нм) при связывании ионов
кальция и поэтому служащим Са2+-сенсором. Появление Cа2+
во флуоресцирующих клетках медузы вызывает синюю биолюминесценцию экворина,
которая возбуждает зеленую флуоресценцию GFP.
Уникальной особенностью GFP является то, что его
флуорофорная группа не является отдельным химическим соединением наподобие
простетических групп в некоторых белках, а представляет собой короткую
последовательность из трех аминокислот: серин-тирозин-глицин, которая
закодирована генетически. В течение несколькие часов после синтеза этого белка
она самопроизвольно, автокаталитически принимает циклическую форму (Рис. 38А),
и после окисления тирозина приобретает способность интенсивно флуоресцировать.
GFP имеет два максимума возбуждения флуоресценции лежит около 395 и 475 нм и
максимум флуоресценции при 508 нм (Рис. 28А).
Флуорофорная группа в GFP окружена «бочонком» из 11 b-структурных
полипептидных цепей, защищающих ее от окружающей среды (Рис. 29). Флуоресценция
GFP устойчива к нагреванию
до 65 оС, обработке кислотами и щелочами, действию протеиназ и
других повреждающих факторов. Белок GFP совершенно не токсичен и устойчив к
фотообесцвечиванию, что позволяет проводить длительные исследования клеточной
динамики.
Рис. 28. Спектральные характеристики (А) и внутриклеточное
перераспределение GFP (Б)
Рис. 29. Структура зеленого флуоресцентного белка GFP.
Хромофорная группа обозначена желтым цветом (по: Незлин Л.П., Leics Microsystems)
Недостаток GFP - флуоресценция в зеленой области, где
некоторые клетки обладают заметной аутофлуоресценцией, скрывающей полезный
сигнал. Поэтому с помощью методов направленного мутагенеза и генной инженерии
были получены различные варианты белков флуоресцирующих в разных спектральных
областях от синей до красной (Рис. 30). Красный флуоресцирующий белов был также
выделен из кораллов.
Рис. 30. Различные формы флуоресцентных белков,
флуоресцирующих в разных спектральных диапазонах от синего до красного
Встроив ген GFP в геном различных организмов, можно по его
флуоресценции изучать локализацию белков в клетках, их динамику, взаимодействия
между молекулами белка, репликацию и реорганизацию хромосом, активность
промоторов и экспрессию разных генов и т.п. Особенно интересна возможность
визуализации различных белков в клетках. Для этого с помощью методов
молекулярной биологии осуществляют слияние интересующего белка с GFP. С этой
целью в клетку вводят специально сконструированный отрезок ДНК, в котором последовательно
соединены гены интересующего исследователей белка и GFP. Они контролируются
общим промотором, транскрипция этого комплексного гена приводит к синтезу
химерного белка, содержащего как интересующий белок, так и GFP. Во многих
случаях присоединение GFP не нарушает функционирование белков, а белок не
влияет на флуоресценцию GFP. По флуоресценции последнего можно проследить
динамику внутриклеточных перемещений интересующего исследователей белка и его
локализацию. К GFP можно присоединить сигнальные пептиды, направляющие белки в
разные органеллы, а затем по флуоресценции определить расположение и
перестройки этих органелл и даже клеток. Например, химерный белок, содержащий
GFP и NMDA-рецептор, очень важный ионный канал, встроенный в плазматическую мембрану
некоторых нейронов, позволяет визуализировать эти каналы, выявить их экспрессию
и оценить распределение в разных частях нейронов и перераспределение при
изменении функционального состояния клетки или при внешних воздействиях.

Рис. 31. Нейроны коры головного мозга мыши, экспрессирующие GFP (Препараты: J. Herms, M. Fuhrmann. University of Munich)
В качестве яркого примера использования GFP можно привести
данные о морфологии нейронов коры головного мозга мышей, которую трудно
проследить с помощью обычных гистологических методов из-за малой толщины
дистальных частей аксонов и дендритов и их сложного переплетения. Используя
метод мультифотонной флуоресцентной микроскопии, позволяющей изучать трехмерную
структуру толстых образцов (несколько десятков микрометров), удалось
визуализировать морфологию нейронов коры мозга мышей. Для этого получили
комплекс GFP с белком MAP (microtubule-associated protein), который соединяется
с микротрубочками. Так как в нервной клетке и особенно в ее отростках очень
много белка тубулина, из которого состоят микротрубочки, то то и
синтезированный клетками белок GFP распределился по цитоплазме и отросткам
нейронов (Рис. 31).
Рис. 32. Перераспределение комплекса протеинкиназы С с YFP в
сердечной клетке из цитоплазмы (А) к плазматической мембране (Б) после
активации форболовым эфиром PMA, имитирующей естественную активацию
диацилглицеролом (По данным L. Kaestner, 2008)
Другой пример, показывающий возможность в режиме on-line
следить за локализацией определенных белков в клетках и их перемещениях при
изменении функционального состояния клетки или ее реакции на внешнее
воздействие, приведен на Рис. 32. На нем показано, что при активации форболовым
эфиром PMA один из ключевых сигнальных белков протеинкиназа С, исходно
локализующийся в цитоплазме, быстро перераспределяется к плазматической
мембране, где он дополнительно активируется мембранными липидами.
Флуоресцирующие белки также эффективно используются при
анализе внутримолекулярных конформационных превращений в белках и
межмолекулярных белковых взаимодействий с помощью метода FRET (Рис. 33). В
первом случае перенос энергии от, например, голубого флуоресцентного белка CFP
к желтому YFP, присоединенных к разным концам белковой молекулы, и соответственно,
появление флуоресценции с длиной волны 525 нм вместо 475 нм происходит в
результате связывания лиганда (субстрата), конформационного превращения белка и
сближения флуорофорных групп (Рис. 33А). Во втором - соответствующий перенос
энергии происходит в результате образования надмолекулярного комплекса и, опять
же, сближения флуорофоров (Рис. 33Б).
Рис. 3 Использование голубого (CFP) и желтого (YFP)
флуоресцентных белков для оценки внутримолекулярных (А) и межмолекулярных
взаимодействий (Б) белков, инициированных связыванием лиганда (красный
треугольник)
За открытие GFP и разработку методов его использования О.
Симомуре, М. Чалфи и Р. Тсиену в 2008 г. была присуждена Нобелевская премия.
18. Иммуно-флуоресцентная микроскопия
Для визуализации различных компонент клеток широко применяют
иммуно-флуоресцентную микроскопию. При этом различают прямой и непрямой методы.
В первом случае в клетку вводят антитела против изучаемых молекул-мишеней
(антигенов), меченые ярко флуоресцирующими молекулами. Чаще всего ими служат
уже упомянутые фотостабильные красители с высоким квантовым выходом
флуоресценции (Табл.3). FITC, Cy3, Cy5, разновидности Alexa и другие. Но если
молекул антигенов в клетке мало, а это как раз характерно для сигнальных
белков, управляющих многими клеточными процессами, то их флуоресценция слаба.
Поэтому используется непрямой метод, в котором после связывания первичных
нефлуорохромированных антител добавляют вторичные антитела, выработанные против
первичных антител с которыми ковалентно связано большое количество флуорохрома
(Рис. 34).
Рис. 34. Принцип непрямой флуоресцентной микроскопии. 1 -
антиген; 2 - первичное антитело; 3 - вторичное антитела, 4 - флуоресцентная
метка
В настоящее время имеется широкий набор антител к самым
разным клеточным белкам, что позволяет «увидеть» их экспрессию в клетках,
локализацию и перемещения в процессе функционирования клеток. Это делает
иммуно-флуоресцентную микроскопию одним из самых мощных методов современной
клеточной биологии. В качестве примера на Рис. 34 приведено распределение
микротрубочек, выявленных антителами к b-тубулину,
флуорохромированных с помощью красителя Cy5.
Рис. 34. Непрямая флуоресценция микротрубочек в клетках рака
мозга человека (глиобластома D54Mg), окрашенных с помощью антитубулина и вторичного
антитела, конъюгированного с флуорохромом Cy5
Рис. 35. Конфокальная микроскопия цитоскелета в смешанной
популяции культивируемых нейронов (сверху) и глиальных клеток (снизу). Красная
флуоресценция актинового цитоскелета обусловлена фаллоидином, связанным с
флуорохромом Texas Red. Микротрубочки помечены анти-ß-тубулином и вторичным антителом с присоединенным флуорохромом
Alexa Fluor 488, придающим им зеленую флуоресценцию. (по: J. Zmuda; Invitrogen)
Флуорохромирование клеток антителами к разным белкам с
флуоресцентными метками разного цвета и различными флуоресцентными зондами
расширяет возможности визуализации внутриклеточных структур и позволяет
одновременно следить за локализацией и перераспределением различных
внутриклеточных структур (Рис. 21 и 35)
19. Фосфоресценция
Фосфоресценция - испускание фотонов при переходе электрона с
нижнего возбужденного триплетного уровня Т1 на основной
синглетный уровень S0: T1→S0. Поскольку такие
переходы с изменением спина электрона запрещены правилами отбора, то
вероятность их низка. Отсюда высокое время жизни триплетных состояний: порядка
10-6 - 10+2 с. Такие состояния являются метастабильными.
Соответственно, кинетика фосфоресценции на несколько порядков медленнее
кинетики флуоресценции. Так как фотохимические реакции происходят только в
электронно-возбужденном состоянии, то триплетные состояния с намного большим
временем жизни, чем синглетные, отличаются значительно большей химической
активностью. Другое отличие фосфоресценции от флуоресценции - длинноволновой
спектральный сдвиг вследствие некоторой потери энергии фотонов. При этом
спектры возбуждения флуоресценции и фосфоресценции одинаковы. Кроме того,
фосфоресцентное излучение слабее флуоресцентного из-за низкой вероятности
интеркомбинационной конверсии и высоких безизлучательных потерь энергии в
течение длительного существования молекулы в триплетном состоянии. Поэтому
фосфоресценция лучше регистрируется при низких температурах или в очень вязкой
среде, где подвижность молекул ограничена и ниже вероятность безизлучательной
дезактивации возбужденных состояний при столкновениях молекул. Другой фактор,
снижающий интенсивность фосфоресценции, - тушение в течение длительного
триплетного состояния путем передачи энергии другим молекулам (см. ниже). Очень
эффективным тушителем фосфоресценции при комнатных температурах является
кислород.
Обнаружить молекулы в триплетном состоянии можно путем
регистрации фосфоресценции или сигналов электронного парамагнитного резонанса
от бирадикальных триплетных молекул. Косвенным указанием на участие триплетных
состояний в том или ином фотобиологическом процессе является зависимость
последнего от присутствия кислорода в системе, так как молекулярный кислород,
являющийся естественным бирадикалом, имеющим два неспаренных электрона, эффективно
тушит триплетные состояния других молекул и ингибирует связанные с ними
процессы.
Рис. 36. Схема фосфороскопа
Для выделения фосфоресценции из общего люминесцентного
излучения пользуются фосфороскопом - прибором, создающим задержку между импульсом
возбуждающего света и моментом регистрации фосфоресценции (Рис. 36). В нем
вращающийся диск или цилиндр с одной или несколькими прорезями перекрывает пути
возбуждающего света, и излученного света. Они открываются последовательно на
короткое время, зависящее от ширины прорези: сначала путь возбуждающего света,
а затем с задержкой, зависящей от скорости вращения и ширины щели, - путь
излученного света на фотоприемник (ФЭУ). Меняя эти параметры, можно создать
задержку, превышающую длительность флуоресценции, и регистрировать только
фосфоресценцию. Время затухания фосфоресценции намного больше времени затухания
флуоресценции и его измерить намного легче. С помощью фосфороскопа можно
измерять спектры фосфоресценции при комнатной температуре даже при низкой интенсивности
излучения.
Изучение фосфоресценции позволяет охарактеризовать триплетные
состояния молекул. В некоторых случаях, когда флуоресценция молекул слаба, по
фосфоресценции можно их обнаруживать и изучать их фотохимические свойства.
Хорошим примером этого является регистрация синглетного кислорода по его
фосфоресценции. Это было непростой задачей вследствие слабой фосфоресценции 1О2
и излучения в инфракрасной области (1270 нм), где требовалась специальная
оптика. С помощью фосфороскопа создавалась задержка более 200 мкс, надежно
отсекавшая как импульс возбуждающего света, так и флуоресценцию. В другом
варианте экспериментальной установки использовался не фосфороскоп, а фазовая
модуляция возбуждающего света, наподобие описанной в п. 3 и изображенной на Рис.
6. В современных установках для возбуждения люминесценции используются
импульсные лазеры, дающие интенсивные и кратковременные световые импульсы
длительностью порядка нано- и пикосекунд. Регистрация кинетических параметров
фосфоресценции синглетного кислорода показала, что его время жизни в воде
составляет около 3 мкс, а в неполярных органических растворителях (бензол) -
около 30 мкс. Квантовый выход фосфоресценции 1О2 в водной
среде был всего 10-7 (А.А. Красновский, 2007).
Литература
1. Ремизов А.Н.: Медицинская и биологическая
физика. - М.: Дрофа, 2005
2. Самарский А.А.: Математическое
моделирование: Идеи. Методы. Примеры. - М.: Физматлит, 2005
. Трубецков Д.И.: Введение в теорию
самоорганизации открытых систем. - М.: Физматлит, 2005
. Чалисова Н.И.: Нейроиммуноэндокринные
механизмы действия пептидов и аминокислот в тканевых структурах. - СПб.: ДЕАН,
2005
. Антонов В.Ф.: Физика и биофизика. - М.:
ГЭОТАР-МЕД, 2004
. Жижин Г.В.: Саморегулируемые волны
химических реакций и биологических популяций. - СПб.: Наука, 2004
. Кудряшов Ю.Б.: Радиационная биофизика
(ионизирующие излучения). - М.: ФИЗМАТЛИТ, 2011
. Липунова Е.А.: Система красной крови. -
Белгород: БелГУ, 2009
. МО РФ, БелГУ, каф. медико-биологических
дисциплин; Сост. А.Г. Логвиненко: Программа промежуточной аттестации студентов
по дисциплине «Физика». - Белгород: БелГУ, 2008
. МО РФ, БелГУ, каф. медико-биологических
дисциплин; Сост. А.Г. Логвиненко: Учебная программа дисциплины «Физика». -
Белгород: БелГУ, 2004
. Ремизов А.Н.: Медицинская и
биологическая физика. - М.: Дрофа, 2004
. Харьковский национальный ун-т им. В.Н.
Каразина; Сост.: Н.И. Буланкина, П.А. Калиман, А.Ф. Коченков, С.М. Куделко;
Науч. ред.: В.А. Бондаренко, С.И. Посохов; Рец. И.И. Залюбовский: Академик Иван
Николаевич Буланкин. - Харьков: Автоэнергия, 2004
. А.М. Черныш и др; Под ред. В.Ф.
Антонова; Рец.: Каф. биофизики биологического фак. МГУ им. М.В. Ломоносова и
др.: Биофизика. - М.: ВЛАДОС, 2013
. А.М. Черныш и др.; Под ред. В.Ф.
Антонова; Рец.: Каф. биофизики биологического фак. МГУ им. М.В. Ломоносова и
др.: Биофизика. - М.: Владос, 2013
. А.Х. Тамбиев, Н.Н. Кирикова, О.В.
Бецкий, Ю.В. Гуляев и др.; Под ред. Ю.В. Гуяева, А.Х. Тамбиева; Рец.: А.А.
Красновский, А.Г. Шеин: Миллиметровые волны и фотосинтезирующие организмы. -
М.: Радиотехника, 2003
. МО РФ; БелГУ, каф. анатомии и физиологии
человека и животных; Сост. С.Д. Чернявских: Программа промежуточной аттестации
студентов по дисциплине «Физиология человека и животных». - Белгород: БелГУ,
2003
. МО РФ; БелГУ, каф. анатомии и физиологии
человека и животных; Сост. С.Д. Чернявских: Учебная программа дисциплины
«Физиология человека и животных». - Белгород: БелГУ, 2013
. Под ред. Ю.А. Ершова; Рец. Н.Е.
Кузьменко: Общая химия. Биофизическая химия. Химия биогенных элементов. - М.:
Высшая школа, 2003
. Ремизов А.Н.: Медицинская и
биологическая физика. - М.: Дрофа, 2003
. Ризниченко Г.Ю.: Математические модели в
биофизике и экологии. - М.; Ижевск: Институт компьютерных исследований, 2013
. БелГУ; Сост.: Г.И. Ткаченко, А.И.
Никитин; Рец. Е.А. Антонов: Концепции современного естествознания. - Белгород:
БелГУ, 2002
. Блохина М.Е.: Руководство к лабораторным
работам по медицинской и биологической физике. - М.: Дрофа, 2002
. Блохина М.Е.: Руководство к лабораторным
работам по медицинской и биологической физике. - М.: Дрофа, 2012
. Под ред. Ю.А. Ершова: Общая химия.
Биофизическая химия. Химия биогенных элементов. - М.: Высшая школа, 2002
. Фролов Ю.П.: Управление биологическими
системами: надорганизменный уровень. - Самара: Самарский университет, 2012
. Блохина М.Е.: Руководство к лабораторным
работам по медицинской и биологической физике. - М.: Дрофа, 2001
. В.Ф. Антонов, А.М. Черныш, В.И. Пасечник
и др.: Практикум по биофизике. - М.: ВЛАДОС, 2006
. Лахно В.Д.: Кластеры в физике, химии,
биологии. - М.; Ижевск: Регулярная и хаотическая динамика, 2011
. Мохан Р.: Биохимия мышечной деятельности
и физической тренировки. - Киев: Олимпийская литература, 2011