Технология конструкционных материалов и материаловедение
1. Опишите условия получения мелкозернистой
структуры при самопроизвольной развивающейся кристаллизации (используя теорию
Таммана)
Кристаллизация - это процесс перехода металла из
жидкого состояния в твердое с образованием кристаллической структуры. В природе
все самопроизвольно протекающие превращения, кристаллизация и плавление
обусловлены тем, что новое состояние в новых условиях является энергетически
более устойчивым, обладает меньшим запасом энергии.
Переход металла из жидкого или парообразного
состояния в твердое с образованием кристаллической структуры называется
первичной кристаллизацией. Образование новых кристаллов в твердом
кристаллическом веществе называется вторичной кристаллизацией. Процесс
кристаллизации состоит из двух одновременно идущих процессов зарождения и роста
кристаллов. Кристаллы могут зарождаться самопроизвольно - самопроизвольная
кристаллизация или расти на имеющихся готовых центрах кристаллизации -
несамопроизвольная кристаллизация.
Чем больше степень переохлаждения, понижающая свободную
энергию металла, тем меньше критический размер зародыша.
Кристаллы с неправильной формой называются
зернами или кристаллами. Твердые тела, в том числе и металлы, состоящие из
большого количества зерен, называют поликристаллическими.
Д.В. Черновым установлено, что процесс
кристаллизации состоит из двух элементарных процессов: зарождения центров
кристаллизации и роста кристаллов из этих центров. Гораздо позже Тамман, изучая
процесс кристаллизации, установил зависимость числа центров кристаллизации и скорости
роста кристаллов от степени переохлаждения.
Пока образовавшиеся кристаллы растут свободно,
они имеют более или менее правильную геометрическую форму. Однако при
столкновении растущих кристаллов их правильная форма нарушается, так как в этих
участках рост граней прекращается. Рост продолжается в тех направлениях, где
есть свободный доступ "питающей" жидкости. В результате растущие
кристаллы, имеющие сначала геометрически правильную форму, после затвердевания
получают неправильную внешнюю форму и поэтому называются кристаллитами или
зернами.
Рост зародышей происходит в результате перехода
атомов из переохлажденной жидкости к кристаллам. Кристалл растет послойно,
каждый слой имеет одноатомную толщину.
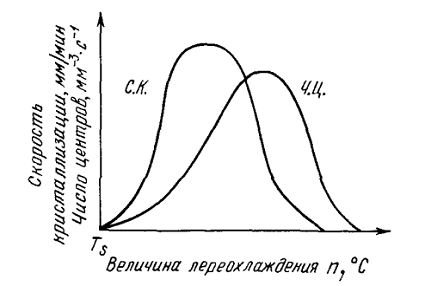
Рисунок 1 - Скорость роста кристаллов (с. к.) и
скорость зарождения центров кристаллизации (ч. ц.) в зависимости от степени
переохлаждения
Число зарождающихся в единицу времени
кристаллов, которые в дальнейшем обозначаются буквами ч. ц., имеет размерность
1/мм3ˑс (число центров кристаллизации, возникших в 1 мм3
за одну секунду). Скорость роста кристаллов, обозначаемая в дальнейшем через
с.к., есть скорость увеличения линейных размеров кристалла, выраженная в
миллиметрах в единицу времени. Размерность этой величины - мм/с; мм/мин.
Исследуя кристаллизацию прозрачных органических
веществ при разных температурах, Г. Тамман установил, что ч.ц. и с.к.
определяются степенью переохлаждения. Графически изменения величины ч.ц. и с.к.
в зависимость от переохлаждения представлены на рис. 1. Зависимость ч.ц. и с.к.
в зависимости от переохлаждения выражается кривой максимумом. При теоретической
температуре кристаллизации (n=0)
значения с.к. и ч.ц. равны нулю и процесс кристаллизации идти не может, что
находится в полном соответствии с положением о необходимости переохлаждения для
протекания процесса. С увеличением переохлаждения значения с.к. и ч.ц.
возрастают, достигают максимума и затем понижаются; при больших величинах
переохлаждения практически падают до нуля.
Увеличение с.к. и ч.ц. при малых степенях
переохлаждения обусловлено тем, что вблизи равновесной точки (TS)
подвижность атомов велика и ускорение кристаллизации с увеличением степени
переохлаждения вызывается увеличением разности свободных энергий жидкого и
кристаллического состояний. Снижение с.к. и ч.ц. при больших степенях
переохлаждения вызвано тем, что при больших переохлаждениях и, следовательно,
при низких температурах подвижность атомов уменьшена, а тем самым уменьшена и способность
системы к превращению. При больших степенях переохлаждения с.к. и ч.ц.
становятся равными нулю, так как подвижность атомов уже недостаточна для того,
чтобы осуществилась престройка их из хаотического расположения в жидкости и
правильное в кристалле.
Оптимальными условиями получения мелкозернистой
структуры являются: максимальное число центров кристаллизации и малая скорость
роста кристаллов.
Размер зерен, образующихся в процессе
кристаллизации от числа частичек нерастворимых примесей, всегда имеющихся в
жидком металле, которые играют роль готовых центров кристаллизации. Такими
частичками могут быть оксиды, нитриды, сульфиды. Центрами кристаллизации в
металле или сплаве могут быть твердые частицы, которые имеют небольшую разницу
в размерах атомов с атомами основного металла, их кристаллическая решетка
должна быть близка по строению и параметрам решетке кристаллизующегося металла.
Стенки изложниц и других форм, где происходит кристаллизация жидкого металла
имеют неровности, шероховатости. Эти неровности влияют на процесс
кристаллизации, увеличивая скорость кристаллизации.
Мелкозернистую структуру можно получить в
результате модифицирования, когда в жидкие металлы добавляются посторонние
вещества - модификаторы, по механизму воздействия различают:
· вещества не растворяющиеся в жидком
металле - выступают в качестве дополнительных центров кристаллизации.
· поверхностно - активные вещества,
которые растворяются в металле, и, осаждаясь на поверхности растущих
кристаллов, препятствуют их росту.
. Вычертите диаграмму состояния системы
свинец-сурьма. Опишите взаимодействие компонентов в жидком и твердом
состояниях, укажите структурные составляющие во всех областях диаграммы
состояния и объясните характер изменения свойств сплавов в данной системе с
помощью правил Курнакова
Сплавляемые компоненты (рис. 2) полностью
растворяются друг в друге в жидком состоянии, а в твердом состоянии образуют
механическую смесь (Pb - Sb; Al -Si; Sp - Zn).
Построим диаграмму для системы свинец - сурьма
(Pb - Sb).
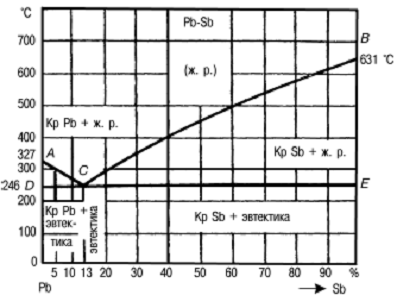
Рисунок 2 - Диаграмма состояния сплавов системы
свинец-сурьма (Pb-Sb)
На диаграмме в координатах температура - время
построим кривые охлаждения для чистого свинца (Pb), сурьмы (Sb) и для сплавов,
содержащих:
) 5 % сурьмы и 95 % свинца;
) 10 % сурьмы и 90 % свинца;
) 20 % сурьмы и 80 % свинца;
) 40 % сурьмы и 60 % свинца;
) 80 % сурьмы и 20 % свинца.
На основную диаграмму (Pb - Sb) перенесем все
точки кристаллизации и соединим их. Получим температурную линию начала кристаллизации
АЕВ, т. е. линию ликвидуса и линию конца кристаллизации - линию солидуса. Выше
линии ликвидуса сплав находится в жидком состоянии, ниже линии солидуса - в
твердом состоянии.
Между линией ликвидуса и солидуса сплав состоит
из двух фаз: жидкого раствора и кристаллов одного из компонентов.
У одного сплава этой системы, т. е. сплава,
содержащего 87% Pb и 13% Sb, начало и конец кристаллизации происходят при одной
постоянной температуре 246° С. Она же является температурой конца
кристаллизации для всех сплавов. Такой сплав называется эвтектическим.
На диаграмме данной системы все сплавы,
содержащие менее 13% Sb, называются доэвтектическими, а сплавы, содержащие
более 13% Sb, - заэвтектическими. Структура доэвтектических сплавов состоит из
эвтектической смеси (Pb - Sb) и избыточных кристаллов свинца. Структура
заэвтектических сплавов состоит из эвтектической смеси и избыточных кристаллов
сурьмы. Структура эвтектического сплава представляет собой механическую смесь
кристалликов свинца и сурьмы.
Свойства сплава в значительной степени
определяются фазовым составом, о котором можно судить по диаграмме состояния.
Впервые на связь между диаграммой состояния и свойствами указал Н.С. Курнаков.
Для систем, образующие непрерывные твердые
растворы, зависимость свойств от состава фазы изображается кривыми линиями, а
для двухфазных смейсей - прямыми линиями. Эти закономерности в равновесном
состоянии сплавов указвают на то, что у твердых растворов такие свойства, как
твердость НВ, удельное электрическое сопротивление p,
коэрцитивная сила Нс и другие всегда превосходят аналогичные свойства исходных
компонентов.
Сплавы в состоянии твердых растворов хорошо
обрабатываются давлением и тяжело - резаньем. Литейные свойства твердых
растворов, как правило, неудовлетворительны. Наилучшей жидкотекучестью обладают
эвтектические сплавы. Промежуточные фазы обладают высокими твердостью,
температурой плавления и хрупкостью.
Характерные особенности группы сплавов,
образующих соединения "механическая смесь", следующие:
а) компоненты сплавляются в любом весовом
соотношении;
б) сплавляемые компоненты в твердом состоянии
сохраняют свои первоначальные пространственные решетки; в сплаве они находятся
в виде механической смеси;
в) для данной системы сплава температура
затвердевания постоянная;
г) сплавы "механическая смесь"
обладают удельной ликвацией (распределение компонентов в слитке по плотности).
. Под действием каких напряжений возникает
пластическая деформация? Как при это изменяются структура и свойства металлов и
сплавов?
Деформацией называется изменение формы и
размеров тела под действием напряжений.
Напряжение - сила, действующая на единицу
площади сечения детали.
Напряжения и вызываемые ими деформации могут
возникать при действии на тело внешних сил растяжения, сжатия и т.д., а также в
результате фазовых (структурных) превращений, усадки и других физико-химических
процессов, протекающих в металлах, и связанных с изменением объема. Металл,
находящийся в напряженном состоянии, при любом виде нагружения всегда
испытывает напряжения нормальные и касательные.
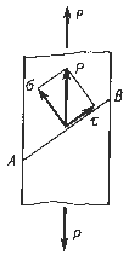
Рисунок 3 - Схема возникновения нормальных и
касательных напряжений в металле при его нагружении
Рост нормальных и касательных напряжений
приводит к разным последствиям. Рост нормальных напряжений приводит к хрупкому
разрушению. Пластическую деформацию вызывают касательные напряжения.
Деформация металла под действием напряжений
может быть упругой и пластической.
Пластической или остаточной называется
деформация после прекращения действия вызвавших ее напряжений.
При пластическом деформировании одна часть
кристалла перемещается по отношению к другой под действием касательных
напряжений. При снятии нагрузок сдвиг остается, т.е. происходит пластическая
деформация (рис. 4).
В результате развития пластической деформации
может произойти вязкое разрушение путем сдвига.
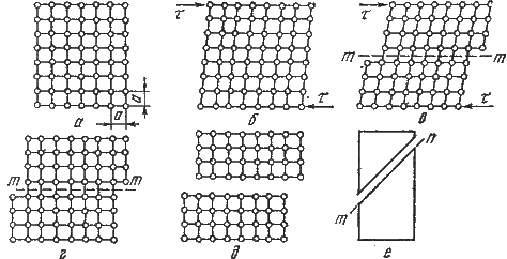
а - ненапряженная решетка; б - упругая
деформация; в - упругая и пластическая деформация; г - пластическая деформация;
д, е - пластичное (вязкое) разрушение в результате среза
Рисунок 4 - Схема пластической деформации и
вязкого разрушения под действием касательных напряжений
Пластическая деформация происходит в результате
скольжения или двойникования. Ранее предполагали, что при скольжении одна часть
кристалла сдвигается относительно другой части на целое число периодов как
единое целое. Необходимое для этого напряжение получается на несколько порядков
выше действительного сдвигового напряжения.
В основу современной теории пластической
деформации взяты следующие положения:
· скольжение распространяется по плоскости сдвига
последовательно, а не одновременно;
· скольжение начинается от мест
нарушений кристаллической решетки, которые возникают в кристалле при его
нагружении.
Схема механизма деформации представлена на
рисунке 5 а.
В равновесном состоянии дислокация неподвижна.
Под действием напряжения экстраплоскость смещается справа налево при
незначительном перемещении атомов. Нижняя часть плоскости Р/S (SR) сместится
вправо и совместится с нижним краем экстра- плоскости РQ.остаточная деформация.
При дальнейшем движении дислокация пройдет всю
плоскость скольжения и выйдет на поверхность зерна. При этом верхняя часть
зерна сдвинута относительно нижней на один межатомный период решетки (рис. 5
б).
При каждом перемещении дислокации на один шаг
необходимо разорвать связь только между двумя рядами атомов в плоскости Р/S, а
не между всеми атомами, расположенными выше и ниже плоскости скольжения.
Необходимое сдвиговое напряжение при этом мало, равно практически действительному.
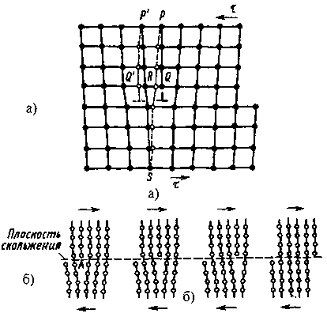
а - перемещение атомов при двихении краевой
дислокации на одно межатомное расстояние; б - перемещение дислокации через весь
кристалл
Рисунок 5 - Схема дислокационного механизма
пластической деформации
Влияние пластической деформации на структуру и
свойства металла и сплавов
Текстура деформации создает кристаллическую
анизотропию, при которой наибольшая разница свойств проявляется для
направлений, расположенных под углом 45o друг к другу. С увеличением степени деформации
характеристики пластичности (относительное удлинение, относительное сужение) и
вязкости (ударная вязкость) уменьшаются, а прочностные характеристики (предел
упругости, предел текучести, предел прочности) и твердость увеличиваются. Также
повышается электросопротивление, снижаются сопротивление коррозии,
теплопроводность, магнитная проницаемость.
Совокупность явлений, связанных с изменением
механических, физических и других свойств металлов и сплавов в процессе
пластической деформации называют деформационным упрочнением или наклепом.
Упрочнение при наклепе объясняется возрастанием
на несколько порядков плотности дислокаций:
Их свободное перемещение затрудняется взаимным
влиянием, также торможением дислокаций в связи с измельчением блоков и зерен,
искажениями решетки металлов, возникновением напряжений.
. Вычертите диаграмму состояния железо-карбид
железа, укажите структурные составляющие во всех областях диаграммы, опишите
превращения и постройте кривую нагревания в интервале температур от 0 до 1600°С
(с применением правила фаз) для сплава, содержащего 1,8% С. Для заданного
сплава при температуре 1300 С° определите: процентное содержание углерода в
фазах; количественное соотношение фаз
Диаграмма железо - углерод должна
распространяться от железа до углерода. Железо образует с углеродом химическое
соединение: цементит (карбид железа). Каждое устойчивое химическое соединение
можно рассматривать как компонент, а диаграмму - по частям. Так как на практике
применяют металлические сплавы с содержанием углерода до, то рассматриваем
часть диаграммы состояния от железа до химического соединения цементита,
содержащего углерода.
Диаграмма состояния железо - цементит
представлена на рисунке 6.
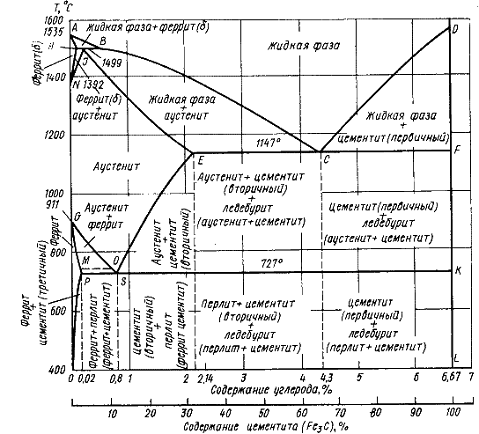
Рисунок 6 - Диаграмма состояния железо -
цементит
Компонентами железоуглеродистых сплавов являются
железо, углерод и цементит.
. Железо - переходный металл серебристо-светлого
цвета. Имеет высокую температуру плавления - 1539o С 5o С.
5o С.
В твердом состоянии железо может находиться в
двух модификациях. Полиморфные превращения происходят при температурах 911o
С и 1392o С. При температуре ниже 911o С существует
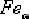 с
объемно-центрированной кубической решеткой. В интервале температур 911…1392o
С устойчивым является
с
объемно-центрированной кубической решеткой. В интервале температур 911…1392o
С устойчивым является 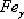 с
гранецентрированной кубической решеткой. Выше 1392o С железо имеет
объемно-центрированную кубическую решетку и называется
с
гранецентрированной кубической решеткой. Выше 1392o С железо имеет
объемно-центрированную кубическую решетку и называется 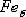 или
высокотемпературное
или
высокотемпературное  .
Высокотемпературная модификация
.
Высокотемпературная модификация 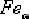 не представляет
собой новой аллотропической формы. Критическую температуру 911o С
превращения
не представляет
собой новой аллотропической формы. Критическую температуру 911o С
превращения  обозначают точкой
обозначают точкой 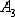 ,
а температуру 1392o С превращения
,
а температуру 1392o С превращения 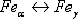 -
точкой А4.
-
точкой А4.
При температуре ниже 768o С железо
ферромагнитно, а выше - парамагнитно. Точка Кюри железа 768o С
обозначается А2.
Железо технической чистоты обладает невысокой
твердостью (80 НВ) и прочностью (предел прочности - 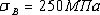 ,
предел текучести -
,
предел текучести -  ) и высокими
характеристиками пластичности (относительное удлинение -
) и высокими
характеристиками пластичности (относительное удлинение - 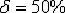 ,
а относительное сужение -
,
а относительное сужение - 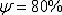 ). Свойства могут
изменяться в некоторых пределах в зависимости от величины зерна.
). Свойства могут
изменяться в некоторых пределах в зависимости от величины зерна.
Железо характеризуется высоким модулем
упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая
высокую жесткость деталей из этих сплавов.
Железо со многими элементами образует растворы:
с металлами - растворы замещения, с углеродом, азотом и водородом - растворы
внедрения.
. Углерод относится к неметаллам. Обладает полиморфным
превращением, в зависимости от условий образования существует в форме графита с
гексагональной кристаллической решеткой (температура плавления - 3500 °С,
плотность - 2,5 г/см3) или в форме алмаза со сложной кубической решеткой с
координационным числом равным четырем (температура плавления - 5000 °С).
В сплавах железа с углеродом углерод находится в
состоянии твердого раствора с железом и в виде химического соединения -
цементита (Fe3C), а также в свободном состоянии в виде графита (в
серых чугунах).
. Цементит (Fe3C) - химическое
соединение железа с углеродом (карбид железа), содержит 6,67 % углерода.
Аллотропических превращений не испытывает.
Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых
наклонены друг к другу.
Температура плавления цементита точно не
установлена (1250, 1550o С). При низких температурах цементит слабо
ферромагнитен, магнитные свойства теряет при температуре около 217o
С.
Цементит имеет высокую твердость (более 800 НВ,
легко царапает стекло), но чрезвычайно низкую, практически нулевую,
пластичность. Такие свойства являются следствием сложного строения
кристаллической решетки.
Цементит способен образовывать твердые растворы
замещения. Атомы углерода могут замещаться атомами неметаллов: азотом,
кислородом; атомы железа - металлами: марганцем, хромом, вольфрамом и др. Такой
твердый раствор на базе решетки цементита называется легированным цементитом.
Цементит - соединение неустойчивое и при
определенных условиях распадается с образованием свободного углерода в виде
графита. Этот процесс имеет важное практическое значение при
структурообразовании чугунов.
В системе железо - углерод существуют следующие
фазы: жидкая фаза, феррит, аустенит, цементит.
. Жидкая фаза. В жидком состоянии железо хорошо
растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
. Феррит (Ф) 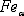 (C)
- твердый раствор внедрения углерода в
(C)
- твердый раствор внедрения углерода в 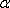 -железо.
-железо.
Феррит имеет переменную предельную растворимость
углерода: минимальную - 0,006 % при комнатной температуре (точка Q),
максимальную - 0,02 % при температуре 727o С ( точка P). Углерод
располагается в дефектах решетки.
При температуре выше 1392o С
существует высокотемпературный феррит (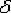 )
(
)
( (C), с предельной растворимостью углерода 0,1 % при температуре 1499o
С (точка J).
(C), с предельной растворимостью углерода 0,1 % при температуре 1499o
С (точка J).
Свойства феррита близки к свойствам железа. Он
мягок (твердость - 130 НВ, предел прочности - 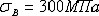 )
и пластичен (относительное удлинение -
)
и пластичен (относительное удлинение - 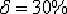 ),
магнитен до 768o С.
),
магнитен до 768o С.
. Аустенит (А) 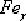 (С)
- твердый раствор внедрения углерода в железо.
(С)
- твердый раствор внедрения углерода в железо.
Углерод занимает место в центре
гранецентрированной кубической ячейки.
Аустенит имеет переменную предельную
растворимость углерода: минимальную - 0,8 % при температуре 727o С
(точка S), максимальную - 2,14 % при температуре 1147o С (точка Е).
Аустенит имеет твердость 200…250 НВ, пластичен
(относительное удлинение - 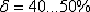 ), парамагнитен.
), парамагнитен.
При растворении в аустените других элементов
могут изменяться свойства и температурные границы существования.
. Цементит - характеристика дана выше.
В железоуглеродистых сплавах присутствуют фазы:
цементит первичный (ЦI), цементит вторичный (ЦII), цементит третичный (ЦIII).
Химические и физические свойства этих фаз одинаковы. Влияние на механические
свойства сплавов оказывает различие в размерах, количестве и расположении этих
выделений. Цементит первичный выделяется из жидкой фазы в виде крупных
пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и
располагается в виде сетки вокруг зерен аустенита (при охлаждении - вокруг
зерен перлита). Цементит третичный выделяется из феррита и в виде мелких
включений располагается у границ ферритных зерен. кристаллизация напряжение металл сплав
Процессы при структурообразовании
железоуглеродистых сплавов
Линия АВСD - ликвидус системы. На участке АВ
начинается кристаллизация феррита (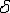 ),
на участке ВС начинается кристаллизация аустенита, на участке СD -
кристаллизация цементита первичного.
),
на участке ВС начинается кристаллизация аустенита, на участке СD -
кристаллизация цементита первичного.
Линия AHJECF - линия солидус. На участке АН
заканчивается кристаллизация феррита (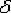 ).
На линии HJB при постоянной температуре 1499°С идет перетектическое
превращение, заключающееся в том, что жидкая фаза реагирует с ранее
образовавшимися кристаллами феррита (
).
На линии HJB при постоянной температуре 1499°С идет перетектическое
превращение, заключающееся в том, что жидкая фаза реагирует с ранее
образовавшимися кристаллами феррита ( ),
в результате чего образуется аустенит:
),
в результате чего образуется аустенит:
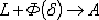
На участке JЕ заканчивается кристаллизация
аустенита. На участке ECF при постоянной температуре 1147o С идет
эвтектическое превращение, заключающееся в том, что жидкость, содержащая 4,3 %
углерода превращается в эвтектическую смесь аустенита и цементита первичного:
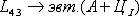
Эвтектика системы железо - цементит называется
ледебуритом (Л), по имени немецкого ученого Ледебура, содержит 4,3 % углерода.
При температуре ниже 727o С в состав
ледебурита входят цементит первичный и перлит, его называют ледебурит
превращенный (ЛП).
По линии HN начинается превращение феррита (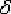 )
в аустенит, обусловленное полиморфным превращением железа. По линии NJ
превращение феррита (
)
в аустенит, обусловленное полиморфным превращением железа. По линии NJ
превращение феррита (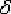 ) в аустенит заканчивается.
) в аустенит заканчивается.
По линии GS превращение аустенита в феррит,
обусловленное полиморфным превращением железа. По линии PG превращение
аустенита в феррит заканчивается.
По линии ES начинается выделение цементита
вторичного из аустенита, обусловленное снижением растворимости углерода в
аустените при понижении температуры.
По линии МО при постоянной температуре 768o
С имеют место магнитные превращения.
По линии PSK при постоянной температуре 727o
С идет эвтектоидное превращение, заключающееся в том, что аустенит, содержащий
0,8 % углерода, превращается в эвтектоидную смесь феррита и цементита
вторичного:
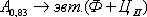
По механизму данное превращение похоже на
эвтектическое, но протекает в твердом состоянии.
Эвтектоид системы железо - цементит называется
перлитом (П), содержит 0,8 % углерода.
Название получил за то, что на полированном и
протравленном шлифе наблюдается перламутровый блеск.
Перлит может существовать в зернистой и
пластинчатой форме, в зависимости от условий образования.
По линии PQ начинается выделение цементита
третичного из феррита, обусловленное снижением растворимости углерода в феррите
при понижении температуры.
Температуры, при которых происходят фазовые и
структурные превращения в сплавах системы железо - цементит, т.е. критические
точки, имеют условные обозначения.
Обозначаются буквой А (от французского arret -
остановка):
А1 - линия PSK (727°С) - превращение
П  А;2
- линия MO (768°С, т. Кюри) - магнитные превращения;3 - линия GOS (
переменная температура, зависящая от содержания углерода в сплаве) -
превращение Ф
А;2
- линия MO (768°С, т. Кюри) - магнитные превращения;3 - линия GOS (
переменная температура, зависящая от содержания углерода в сплаве) -
превращение Ф  А;4 -
линия NJ (переменная температура, зависящая от содержания углерода в сплаве) -
превращение
А;4 -
линия NJ (переменная температура, зависящая от содержания углерода в сплаве) -
превращение 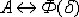 ;- линия SE
(переменная температура, зависящая от содержания углерода в сплаве) - начало
выделения цементита вторичного (иногда обозначается A3).
;- линия SE
(переменная температура, зависящая от содержания углерода в сплаве) - начало
выделения цементита вторичного (иногда обозначается A3).
Так как при нагреве и охлаждении превращения
совершаются при различных температурах, чтобы отличить эти процессы вводятся
дополнительные обозначения. При нагреве добавляют букву с, т.е. 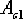 ,
при охлаждении - букву r, т.е.
,
при охлаждении - букву r, т.е. 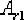 .
.
При температуре 1300оС для сплава,
содержаещего 1,8% С количественное соотношение фаз - жидкая фаза+аустенит.
. В чем отличие обычной закалки от ступенчатой и
изотермической? каковы преимущества и недостатки каждого из этих видов закалки?
Конструкционные стали подвергают закалке и
отпуску для повышения прочности и твердости, получения высокой пластичности,
вязкости и высокой износостойкости, а инструментальные - для повышения
твердости и износостойкости.
Верхний предел температур нагрева для
заэвтектоидных сталей ограничивается, так как приводит к росту зерна, что
снижает прочность и сопротивление хрупкому разрушению.
Основными параметрами являются температура
нагрева и скорость охлаждения. Продолжительность нагрева зависит от
нагревательного устройства, по опытным данным на 1 мм сечения затрачивается: в
электрической печи - 1,5…2 мин.; в пламенной печи - 1 мин.; в соляной ванне -
0,5 мин.; в свинцовой ванне - 0,1…0,15 мин.
Способы закалки
В зависимости от формы изделия, марки стали и
нужного комплекса свойств применяют различные способы охлаждения (рис. 7).
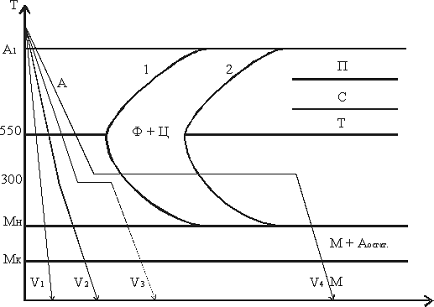
Рисунок 7 - Режимы закалки
1. Закалка в одном охладителе (V1).
Нагретую до нужной температуры деталь переносят
в охладитель и полностью охлаждают. В качестве охлаждающей среды используют:
· воду - для крупных изделий из
углеродистых сталей;
· масло - для небольших деталей
простой формы из углеродистых сталей и изделий из легированных сталей.
2. Закалка в двух сферах или прерывистая (V2).
Нагретое изделие предварительно охлаждают в
более резком охладителе (вода) до температуры ~ 300°C и затем переносят в более
мягкий охладитель (масло).
Прерывистая закалка обеспечивает максимальное
приближение к оптимальному режиму охлаждения.
Применяется в основном для закалки инструментов.
Недостаток: сложность определения момента
переноса изделия из одной среды в другую.
3. Ступенчатая закалка (V3).
Нагретое до требуемой температуры изделие помещают
в охлаждающую среду, температура которой на 30 - 50oС выше точки МН
и выдерживают в течении времени, необходимого для выравнивания температуры по
всему сечению. Время изотермической выдержки не превышает периода устойчивости
аустенита при заданной температуре.
В качестве охлаждающей среды используют
расплавленные соли или металлы. После изотермической выдержки деталь охлаждают
с невысокой скоростью.
Способ используется для мелких и средних
изделий.
4. Изотермическая закалка (V4).
Отличается от ступенчатой закалки
продолжительностью выдержки при температуре выше МН, в области промежуточного
превращения. Изотермическая выдержка обеспечивает полное превращение
переохлажденного аустенита в бейнит.При промежуточном превращении легированных
сталей кроме бейнита в структуре сохраняется аустенит остаточный.
Образовавшаяся структура характеризуется сочетанием высокой прочности,
пластичности и вязкости. Вместе с этим снижается деформация из-за закалочных
напряжений, уменьшаются и фазовые напряжения.
В качестве охлаждающей среды используют
расплавленные соли и щелочи.
Применяются для легированных сталей.
5. Закалка с самоотпуском.
Нагретые изделия помещают в охлаждающую среду и
выдерживают до неполного охлаждения. После извлечения изделия, его
поверхностные слои повторно нагреваются за счет внутренней теплоты до требуемой
температуры, то есть осуществляется самоотпуск. Применяется для изделий,
которые должны сочетать высокую твердость на поверхности и высокую вязкость в
сердцевине (инструменты ударного действия: мототки, зубила).
Список использованных источников
1. Фетисов, Г.П.; Карпман, М.Г.;
Матюнин В.М. и др. Материаловедение и технология металлов: Уч. Для ВУЗов. - М.:
Высшая школа, 2000. - 637 с.
2. Арзамасов, Б.Н.; Макарова,
В.И.; Мухин, Г.Г. и др. - 5-е изд., стереотип. - М.: Изд-во МГТУ им. Н.Э.
Баумана, 2003. - 646 с.
. Лахтин, Ю.М., Леонтьева,
В.Н. Материаловедение. Учебник для ВУЗов технич. Спец. - 3-е изд. - М.
Машиностроение, 1990. - 528 с.
. Солнцев, Ю.П.; Веселов,
В.А.; Демьянцевич, В.П.; Кузин, А.В.; Чашников, Д.И. - 2-е изд., перер., доп. -
М. МИСИС, 1996. - 576 с.
. Дриц, М.Е.; Москалев, М.А.
Технология конструкционных материалов и материаловедение: Учеб. Для студентов
немашиностроительных спец. ВУЗов. - М.: Высшая школа, 1990. - 446 с.