Абсорбционные методы очистки отходящих газов
Содержание
Введение
Теоритические основы
абсорбции
Растворы газов в
жидкостях
Абсорбционные методы
очистки отходящих газов от примесей кислого характера
.1 Очистка газов от
диоксида серы
.1.1 Абсорбция водой
.1.2 Известняковые и
известковые методы
.1.3 Магнезитовый метод
.2 Очистка газов от
сероводорода
.2.1 Вакуум - карбонатные
методы
.2.2 Фосфатный процесс
.2.3 Щелочно - гидрохиновый
метод
.3 Очистка газов от
оксидов азота
.3.1 Абсорбция водой
.3.2 Абсорбция щелочами
.3.3 Селективные абсорбенты
Технологический
расчет аппаратов
Преимущества и
недостатки абсорбционных методов очистки отходящих газов
Заключение
Список литературы
Введение
Многие технологические процессы на предприятиях металлургической,
химической, нефтехимической промышленности, в ряде цехов машиностроительных
заводов, на многих других производствах сопровождаются поступлением вредных
газов и паров в атмосферный воздух. Активным загрязнителем атмосферного воздуха
является транспорт, в первую очередь, автомобильный. Газовые загрязнения, как и
аэрозольные, загрязняя атмосферный воздух, значительно ухудшают его качество, а
в ряде случаев делают его непригодным для нахождения в нем людей. Санитарные
нормы ограничивают концентрацию вредных паров и газов в воздухе населенных
пунктов, однако эти требования не всегда соблюдаются. Это наносит значительный
ущерб здоровью людей, проживающих в местностях, подверженных воздействию
вредных газов и паров, ведению сельского хозяйства в данном районе, организации
отдыха людей, приводит к повреждению архитектурных сооружений, памятников
истории и культуры и т.д.
Под очисткой газового потока понимают отделение от него или превращения в
безвредную форму загрязняющих веществ, выбрасываемых в атмосферу вместе с
газовым потоком. Воздушными массами загрязнения могут переноситься на большие
расстояния и существенно влиять на состояние атмосферы и здоровья человека.
Цель данной работы - рассмотреть и изучить абсорбционные методы очистки
отходящих газов.
1
Теоретические основы абсорбции
Абсорбцией называется перенос компонентов газовой смеси в объем
соприкасающейся с ней конденсированной фазы. При абсорбции происходит
избирательное поглощение одного или нескольких компонентов из газовой смеси
жидкими поглотителями.
Вещество, которое содержится в газовой фазе и при абсорбции не переходит
в жидкую фазу, называют газом-носителем, вещество, в котором происходит
растворение абсорбируемых компонентов, называют растворителем (поглотителем или
абсорбентом), вещество, которое содержится в газовой фазе и при абсорбции переходит
в жидкую фазу, т.е. поглощаемый компонент, называют абсорбтивом, поглощаемое
вещество в объеме поглотителя - абсорбатом. Абсорбат удерживаются в абсорбенте,
равномерно распределяясь среди его молекул, вследствие растворения или
химической реакции.
Процесс, завершающийся растворением абсорбата в поглотителе, называют
физической абсорбцией. При физической абсорбции происходит физическое
растворение абсорбируемого компонента в растворителе, при этом молекулы
абсорбента и молекулы абсорбтива не вступают между собой в химическое
взаимодействие.
Иногда растворяющийся газ вступает в химическую реакцию непосредственно с
самим растворителем. Процесс, сопровождающийся химической реакцией между
поглощаемым компонентом и абсорбентом, называют химической абсорбцией
(хемосорбция). При хемосорбции абсорбируемый компонент вступает в химическую
реакцию с поглотителем, образуя новые химические соединения в жидкой фазе.
Абсорбция представляет процесс химической технологии, включающей
массоперенос между газообразным компонентом и жидким растворителем,
осуществляемый в аппарате для контактирования газа с жидкостью. Аппараты, в
которых осуществляют процесс абсорбции, называют абсорберы. Абсорбция -
наиболее распространенный процесс очистки газовых смесей во многих отраслях,
например, в химической промышленности.
Абсорбцию широко применяют для очистки выбросов от сероводорода, других
сернистых соединений, паров соляной, серной кислот, цианистых соединений,
органических веществ (фенола, формальдегида и др.).
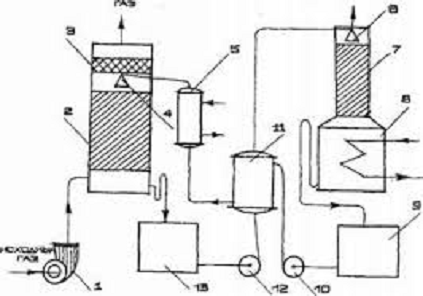
Рис. 1. Схема абсорбционной установки: 1 - вентилятор (газодувка);
2-абсорбер; 3-брызгоотбойник; 4,6-оросители; 5-холодильник; 7-десорбер; 8-куб
десорбера; 9,13-ёмкость для абсорбента; 10,12-насосы;
11-теплообменникрекуператор
Абсорбционная система может быть простой, в которой жидкость применяется
только один раз и удаляется из системы без отделения абсорбированного
загрязнения. В другом варианте загрязнение отделяют от абсорбирующей жидкости,
выделяя её в чистом виде. Затем абсорбент вновь подают на стадию абсорбции,
снова регенерируют и возвращают в систему.
Регенерацию поглотителей проводят физическими методами: повышением
температуры, снижением давления либо сочетанием указанных параметров.
2
Растворы газов в жидкостях
Растворение газа в жидкости называют абсорбцией газа жидкостью. По своей
природе и свойствам растворы газов в жидкости ничем не отличаются от других
жидких растворов.
Влияние давления при не слишком высоких его значениях достаточно хорошо
выражается законом Генри: при постоянной температуре растворимость газа в
растворителе прямо пропорциональна давлению этого газа над раствором.
Как правило, растворение газов в воде происходит с выделением тепла и с
уменьшением объема, поэтому в соответствии с принципом Ле Шателье при повышении
температуры их растворимость снижается. Это иллюстрируют данные (табл. 1.) по
содержанию (в нормальных литрах) некоторых газов в 1 л воды при 760 мм рт. ст.:
Таблица 1
|
Газ
|
0°C
|
20°C
|
60°C
|
100°C
|
|
Н2
|
0,021
|
0,018
|
0,016
|
0,016
|
|
CO2
|
1,713
|
0,88
|
0,36
|
-
|
|
NH3
|
1176
|
702
|
-
|
-
|
При хемосорбции в качестве абсорбента используют водные растворы солей,
органические вещества и водные суспензии различных веществ. При использовании
воды абсорбируемый газ должен достаточно хорошо растворяться в ней при данной
температуре в системе газ-жидкость. Для абсорбции газообразных загрязнителей с
ограниченной растворимостью в воде, таких как SO2 или бензол, необходимы очень
большие количества воды. Вода обладает высокой эффективностью при удалении
кислых растворимых газов, таких как HCl, HF и SiF4 при использовании
слабощелочной воды, для улавливания NH3 подкисленной водой. Газы с меньшей
растворимостью, например SO2, Cl2 и H2S, легче абсорбируются не чистой водой, а
щелочными растворами, в частности, разбавленным NaOH или водным раствором
(суспензией) извести, т.е. в последнем случае более приемлема хемосорбция.
Нецелесообразно использовать воду для очистки выбросов с нерастворимыми в
ней органическими примесями. Подобные загрязнители как правило хорошо
поглощаются органическими жидкостями, среди которых могут использоваться как
абсорбенты высококипящие вещества, такие как этаноламины и тяжелые предельные
углеводороды (минеральные масла). Абсорбция органическим растворителем наиболее
эффективна для удаления органических газообразных загрязнителей, поскольку в
этом случае обеспечивается хорошая растворимость. В качестве органических
жидких абсорбентов применяются диметиланилин, моно-, ди- и триэтаноламин и
метилдиэтаноламин. Использование таких абсорбентов ограничено системами, не содержащими
твёрдых частиц, поскольку твердые вещества загрязняют органические жидкости.
3
Абсорбционные методы очистки отходящих газов от примесей кислого характера
3.1 Очистка
газов от диоксида серы
3.1.1 Абсорбция
водой
Абсорбция водой диоксида серы сопровождается реакцией:
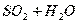
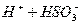
Растворимость SO в воде мала. Зависимость между общей концентрацией SO
в воде мала. Зависимость между общей концентрацией SO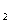 а растворе и равновесным давлением
а растворе и равновесным давлением 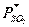 выражается формулой:
выражается формулой:
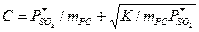 ,
,
где 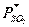 - равновесное давление SO
- равновесное давление SO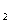 ;
; 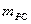 - константа фазового равновесия для
SO
- константа фазового равновесия для
SO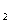 , м
, м *Па/кмоль; К - константа равновесия
реакции.
*Па/кмоль; К - константа равновесия
реакции.
При абсорбции SO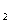 водой процесс лимитируется диффузионным сопротивлением со
стороны газа и жидкости. Он может быть проведен а абсорберах различной
конструкции. Для колонн с провальными и сетчатыми тарелками коэффициенты
массоотдачи могут быть определены из уравнений:
водой процесс лимитируется диффузионным сопротивлением со
стороны газа и жидкости. Он может быть проведен а абсорберах различной
конструкции. Для колонн с провальными и сетчатыми тарелками коэффициенты
массоотдачи могут быть определены из уравнений:
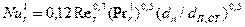 ,
,
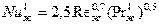 ,
,
где 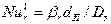 и
и 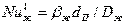 - диффузионные критерии Нуссельта для газа и жидкости;
- диффузионные критерии Нуссельта для газа и жидкости; 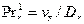 и
и 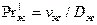 - диффузионные критерии Прандтля для
газа и жидкости;
- диффузионные критерии Прандтля для
газа и жидкости; 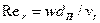 и
и 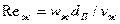 - критерии Рейнольдса для газа и жидкости;
- критерии Рейнольдса для газа и жидкости; 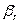 и
и 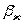 - коэффициенты массоотдачи со стороны
газа и жидкости, м/с;
- коэффициенты массоотдачи со стороны
газа и жидкости, м/с; 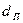 - поверхностно-объемный диаметр пузырьков газа, м (
- поверхностно-объемный диаметр пузырьков газа, м (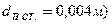 ;
; 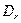 и
и 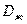 - коэффициенты молекулярной диффузии
SO
- коэффициенты молекулярной диффузии
SO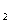 в газе и жидкости, м
в газе и жидкости, м /с;
/с; 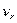 и
и 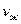 - кинематические коэффициенты
вязкости газа и жидкости, м
- кинематические коэффициенты
вязкости газа и жидкости, м /с;
/с; 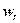 и
и 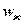 - скорость газа и жидкости а газожидкостном слое, м/с.
- скорость газа и жидкости а газожидкостном слое, м/с.
В связи с низкой растворимостью диоксида серы в воде для очистки
требуется большой ее расход и абсорберы с большими объемами. Удаление SO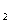 из раствора ведут при нагревании его
до 100
из раствора ведут при нагревании его
до 100 С. Таким образом, проведение процесса
связано с большими энергозатратами.
С. Таким образом, проведение процесса
связано с большими энергозатратами.
На практике применяются известняк, мел, доломиты, мергели. Известь
получают обжигом карбонатных пород при температуре 1100 - 1300 С.
С.
Процесс абсорбции диоксида серы для известкового и известнякового методов
представляется в виде следующих стадий:
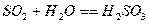 ,
,
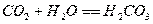 ,
,
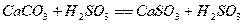 ,
,
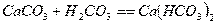 ,
,
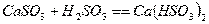 ,
,
 ,
,
Протекание тех или иных реакций зависит от состава и рН суспензии. В
присутствии в растворе различных примесей процесс абсорбции значительно
усложняется. Например, действие небольших количеств 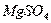 повышает степень очистки и степень
использования известняка. При этом протекают следующие реакции:
повышает степень очистки и степень
использования известняка. При этом протекают следующие реакции:
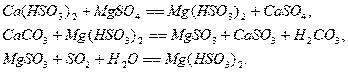
Для расчета равновесия при использовании солей кальция предложены
эмпирические уравнения:
для системы
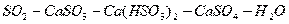 :
:
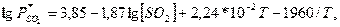
для системы
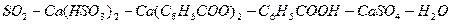 :
:
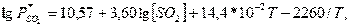

для системы
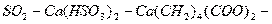
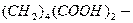
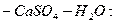
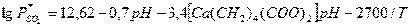 .
.
3.1.3 Магнезитовый
метод
Диоксид серы в этом случае поглощают оксид - гидрооксидом магния. В
процессе хемосорбции образуются кристаллогидраты сульфита магния, которые
сушат, а затем термически разлагают на 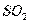 -содержащий газ и оксид магния. Газ
перерабатывают в серную кислоту, а оксид магния возвращают на абсорбцию.
-содержащий газ и оксид магния. Газ
перерабатывают в серную кислоту, а оксид магния возвращают на абсорбцию.
В абсорбере протекают следующие реакции:
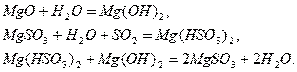
Растворимость сульфита магния в воде ограничена, избыток его в виде 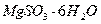 и
и 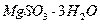 выпадает в осадок. Технологическая
схема процесса представлена на рис. 2.
выпадает в осадок. Технологическая
схема процесса представлена на рис. 2.
Дымовые газы поступают в абсорбер Вентури, орошаемый циркулирующей
суспензией. Отношение Т:Ж в суспензии 1:10, рН суспензии на входе 6,8 - 7,5, а
на выходе из абсорбера 5,5 - 6. состав циркулирующей суспензии (в %):
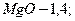
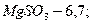
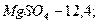 вода и примеси - 79,65.
вода и примеси - 79,65.
В абсорбере кроме сульфита образуется некоторое количество сульфата:
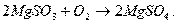
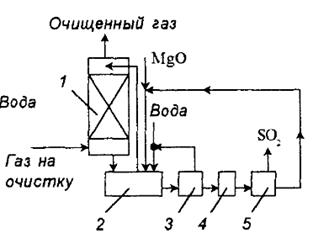
Рис. 2. схема установки очистки газа от диоксида серы суспензией оксида
магния: 1 - абсорбер; 2 - нейтрализатор; 3 - центрифуга; 4 - сушка; 5 - печь
Образование сульфата нежелательно, так как для его разложения необходима
более высокая температура (1200-13000С). При таких условиях получается
переобожженный 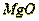 , который имеет малую активность по отношению к
, который имеет малую активность по отношению к 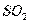 . Для устранения образования сульфата
необходимо использовать ингибиторы окисления или проводить процесс в абсорберах
при малом времени контакта газ - жидкость. Другой путь - производить обжиг
сульфата в присутствии восстановителей. В этом случае сульфат восстанавливается
в сульфит.
. Для устранения образования сульфата
необходимо использовать ингибиторы окисления или проводить процесс в абсорберах
при малом времени контакта газ - жидкость. Другой путь - производить обжиг
сульфата в присутствии восстановителей. В этом случае сульфат восстанавливается
в сульфит.
Из нейтрализатора часть суспензии выводят на центрифугу для отделения
кристаллогидратов солей магния. Обезвоживание солей производят в сушилках
барабанного типа с мазутной копкой. Безводные кристаллы обжигают во вращающихся
печах или печах кипящего слоя при 9000С, в печь добавляют кокс. При этом идет
реакция:
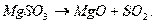
Концентрация 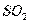 в газе, выходящем из печи, 7 - 15%. Газ охлаждают, очищают от
пыли и сернокислотного тумана и направляют на переработку в серную кислоту.
в газе, выходящем из печи, 7 - 15%. Газ охлаждают, очищают от
пыли и сернокислотного тумана и направляют на переработку в серную кислоту.
Выгружаемый из печи продукт содержит 86,1% 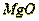 и 3,4%
и 3,4% 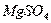 . Его охлаждают до 1200С воздухом,
идущим на сгорание мазута в топках, после чего отправляют на абсорбцию.
. Его охлаждают до 1200С воздухом,
идущим на сгорание мазута в топках, после чего отправляют на абсорбцию.
Достоинства магнезитового метода: 1) возможность очищать горячие газы без
предварительного охлаждения; 2) получение в качестве продукта рекуперации
серной кислоты; 3) доступность и дешевизна хемосорбента; 4) высокая
эффективность очистки.
Недостатки: 1) сложность технологической схемы; 2) неполное разложение
сульфата магния при обжиге; 3) значительные потери оксида магния при
регенерации.
3.2 Очистка
газов от сероводорода
3.2.1 Вакуум
- карбонатные методы
В этих методах сероводород поглощается из газов водным раствором
карбоната натрия или калия. Затем раствор регенерируют нагреванием под
вакуумом, охлаждают и снова возвращают на абсорбцию. В основе методов лежит
реакция:
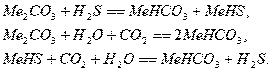
В следствие различной растворимости  ,
, 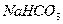 ,
, 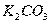 и
и 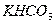 для абсорбции применяют растворы
разной концентрации. Поташ лучше растворим в воде, поэтому применяются более
концентрированные его растворы, которые имеют высокую поглотительную
способность. Это позволяет уменьшит его расход, а также сократить расход пара
на регенерацию поташа и расход энергии на перекачивание раствора.
для абсорбции применяют растворы
разной концентрации. Поташ лучше растворим в воде, поэтому применяются более
концентрированные его растворы, которые имеют высокую поглотительную
способность. Это позволяет уменьшит его расход, а также сократить расход пара
на регенерацию поташа и расход энергии на перекачивание раствора.
Недостатком использования раствора поташа является их высокая стоимость.
Исходя из этого, чаще используют содовый метод.
Если производится регенерация раствора без рекуперации сероводорода, то
раствор нагревают в регенераторе, а из него воздухом отдувают сероводород. При
этом некоторое количество сульфида натрия окисляется до тиосульфата, что
приводит к понижению концентрации абсорбирующей жидкости, поэтому периодически
ее заменяют свежей. Технологическая схема очистки газа от сероводорода вакуум -
карбонатном методом с получением из сероводорода серной кислоты приведена на
рис. 3.
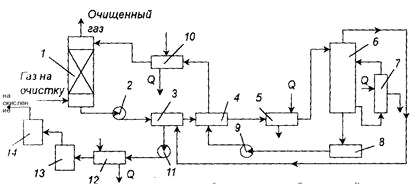
Рис. 3. Схема установки очистки газа от сероводорода вакуум - карбонатном
способом: 1 - абсорбер; 2, 9 - насосы; 3 - холодильник - конденсатор; 4 -
теплообменник; 5 - подогреватель; 6 - регенератор; 7 - циркуляционный
подогреватель; 10 - холодильник; 11 - вакуум - насос; 12 - холодильник; 13 -
печь; 14 - котел - утилизатор
После очистки газа в абсорбере раствор подают в холодильник -
конденсатор, где его подогревают за счет тепла конденсации паров, выделяющихся
при регенерации поглотительного раствора. Затем раствор проходит теплообменник
и подогреватель и поступает в регенератор. Раствор регенерирует кипячением под
вакуумом (15,6 кПа). Регенерированный раствор направляют в емкость, а затем
через теплообменник и холодильник - на орошение абсорбера. Выделяющиеся при
регенерации раствора пары сероводорода и воды отсасываются вакуумом - насосом
через конденсатор - холодильник, где конденсируется значительная часть паров
воды. Далее пары поступают в холодильник, а затем в печь для сжигания
сероводорода. Из печи газовая смесь, состоящая из диоксида серы, водяных паров,
кислорода и инертных газов, при 9000 С, а затем направляется на окисление в
контактный аппарат. После окисления газы направляют на абсорбцию для получения
серной кислоты.
3.2.2 Фосфатный
процесс
Для абсорбции сероводорода фосфатным методом применяют растворы,
содержащие 40 -50% фосфата калия:
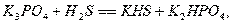
Из раствора сероводород удаляют кипячением при 107 - 1150С. Коррозии
кипятильников при этом не наблюдается. Растворы стабильны, не образуют
продуктов, ухудшающих их качество. Достоинством процесса является также
селективность раствора к сероводороду в присутствии 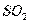 .
.
3.2.3 Щелочно
- гидрохиновый метод
Сущность метода в поглощении сероводорода щелочными растворами
гидрохинона. При регенерации растворов выделяются элементарная сера и
тиосульфата натрия. Гидрохинон является катализатором. Чем выше концентрация
хинона в растворе, тем активнее раствор. Метод состоит из следующих стадий:
взаимодействие сероводорода с карбонатом натрия (содой)
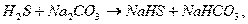
окисление гид2росульфида натрия хиноном (окисленная форма гидрохинона)
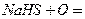
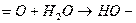
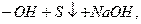
регенерация соды
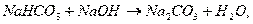
регенерация хинона
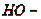
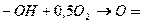
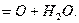
Последняя стадия осуществляется за счет кислорода, содержащегося в газе,
и протекает параллельно с процессами поглощения и окисления сероводорода. Более
полную регенерацию хинона проводят в регенераторах.
В процессе абсорбции протекает следующая побочная реакция:
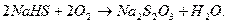
Накопление в растворе 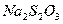 и
и 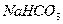 приводит к снижению его поглотительной способности вследствие
уменьшения концентрации карбоната натрия и снижения рН среды. Для поддержания
активности поглотительного раствора непрерывно добавляют свежие растворы соды и
гидрохинона. Для поддержания рН раствора в пределах 9 - 9,5 добавляют 42%-й
раствор едкого натрия.
приводит к снижению его поглотительной способности вследствие
уменьшения концентрации карбоната натрия и снижения рН среды. Для поддержания
активности поглотительного раствора непрерывно добавляют свежие растворы соды и
гидрохинона. Для поддержания рН раствора в пределах 9 - 9,5 добавляют 42%-й
раствор едкого натрия.
Абсорбцию сероводорода проводят в полом абсорбере с форсунками или
плотности орошения 4,35 м3/ч на 1 м3 орошаемого объема. Раствор регенерируют,
пропуская через него (барботаж) сжатый воздух. При этом происходит окисление
гидрохинона до хинона и флотации выделившейся серы, которую в виде пены
собирают на поверхности раствора. Одновременно здесь же происходит окисление
части гидросульфида др тиосульфата. Серная пена собирается в пеносборнике, а
затем поступает на вакуум - фильтр, где происходит ее отделение. Полученную
серу плавят в автоклаве.
Метод позволяют очистить газ от начального содержания сероводорода в газе
0,185 г/м3 до 0,02 г/м3. степень очистки газа зависит от концентрации в нем
сероводорода, скорости движения газа в абсорбере и интенсивности орошения,
концентрации активных компонентов в растворе и его рН, температуры процесса, от
равномерности распределения раствора в абсорбере.
3.3 Очистка
газов от оксидов азота
3.3.1 Абсорбция
водой
При абсорбции диоксида азота водой в газовую фазу выделяется часть оксида
азота, скорость окисления которого при низких концентрациях мала:
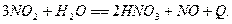
Для утилизации оксидов можно использовать разбавленные растворы пероксида
водорода с получением азотной кислоты:
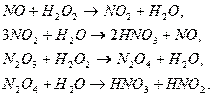
Основным фактором, определяющим экономику процесса, является расход
пероксида водорода. Он приблизительно равен 6 кг на 1 т кислоты в сутки.
Разработан процесс очистки газов водой и циркулирующей 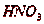 . Физическая абсорбция оксидов азота
в азотной кислоте увеличивается с ростом концентрации кислоты и парциального
давления
. Физическая абсорбция оксидов азота
в азотной кислоте увеличивается с ростом концентрации кислоты и парциального
давления 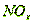 . Увеличение поверхности контакта
способствует протеканию процесса, так как на границе раздела фаз идет реакция
окисления NO в NO2. Для интенсификации процесса используют катализатор. Степень
очистки может достигать 97%.
. Увеличение поверхности контакта
способствует протеканию процесса, так как на границе раздела фаз идет реакция
окисления NO в NO2. Для интенсификации процесса используют катализатор. Степень
очистки может достигать 97%.
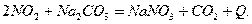
Уравнения для хемосорбции 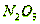 различными щелочными растворами или суспензиями представлены
ниже:
различными щелочными растворами или суспензиями представлены
ниже:
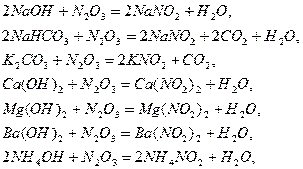
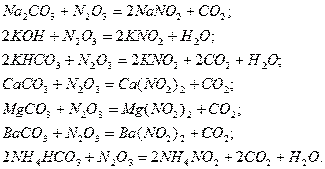
При абсорбции 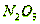 активность щелочных растворов убивает в такой
последовательности:
активность щелочных растворов убивает в такой
последовательности:
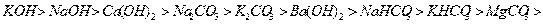
0,84 0,80 0,78 0,63 0,56 0,51 0,44 0,4
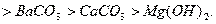
,40 0,39 0,35
Цифры под каждым из щелочных растворов показывают их активность
относительно раствора 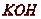 , активность которого условно принята за единицу. Данные
приведены для начальной концентрации растворов 100 г/л и времени проскока газа
10 мин. Активность щелочных растворов определяется начальным рН раствора.
Активность тем выше, чем выше этот показатель.
, активность которого условно принята за единицу. Данные
приведены для начальной концентрации растворов 100 г/л и времени проскока газа
10 мин. Активность щелочных растворов определяется начальным рН раствора.
Активность тем выше, чем выше этот показатель.
При абсорбции растворами аммиака образуются соединения с низкой
температурой разложения. Например, образующийся нитрит аммония 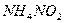 при 560С полностью распадается:
при 560С полностью распадается:
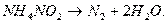
3.3.3
Селективные абсорбенты
Для очистки газов от 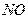 при отсутствии в газовой фазе кислорода могут быть
использованы растворы
при отсутствии в газовой фазе кислорода могут быть
использованы растворы 
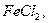
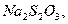
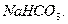 для первых растворов протекают реакции с образованием
комплексов:
для первых растворов протекают реакции с образованием
комплексов:

При нагреве до 95 - 1000С комплекс 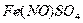 распадается и
распадается и 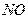 выделяется в чистом виде, а
восстановленный раствор вновь возвращают в производстве. Аналогично разлагается
и комплекс
выделяется в чистом виде, а
восстановленный раствор вновь возвращают в производстве. Аналогично разлагается
и комплекс 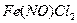 .
.
Раствор 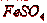 является наиболее доступным и эффективным поглотителем. В
качестве абсорбента могут быть использованы и травильные растворы, содержащие
является наиболее доступным и эффективным поглотителем. В
качестве абсорбента могут быть использованы и травильные растворы, содержащие 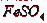 . Поглотительная способность раствора
зависит от концентрации
. Поглотительная способность раствора
зависит от концентрации 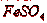 в растворе, температуры и концентрации
в растворе, температуры и концентрации 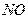 в газе. При температурах 20 - 250С
раствор может поглощать
в газе. При температурах 20 - 250С
раствор может поглощать 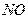 даже при небольших концентрациях. Предел растворимости
оксидов азота соответствует соотношению
даже при небольших концентрациях. Предел растворимости
оксидов азота соответствует соотношению 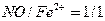 . Присутствие в растворе серной и
азотной кислот, солей и органических веществ снижает его поглотительную
способность. Однако наличие в растворе 0,5 - 1,5% (об.) серной кислоты
предохраняет
. Присутствие в растворе серной и
азотной кислот, солей и органических веществ снижает его поглотительную
способность. Однако наличие в растворе 0,5 - 1,5% (об.) серной кислоты
предохраняет 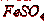 от окисления кислородом воздуха до
от окисления кислородом воздуха до 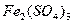 .
.
Использование растворов
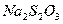 ,
, 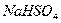 ,
, 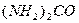 приводит к дефиксации азота:
приводит к дефиксации азота:
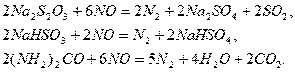
Таким же образом 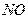 взаимодействует и с растворами
взаимодействует и с растворами 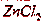 ,
, 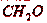 ,
, 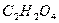 .
.
При температуре выше 2000С 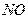 взаимодействует с аммиаком по
реакции:
взаимодействует с аммиаком по
реакции:
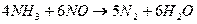 .
.
Серная кислота используется для поглощения 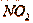 и
и 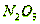 с образованием нитрозилсерной
кислоты:
с образованием нитрозилсерной
кислоты:

При нагревании нитрозилсерной кислоты или при разбавлении ее водой
происходит выделение оксидов азота:
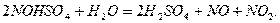
Взаимодействие оксидов азота с жидкими сорбентами наиболее эффективно
протекает при 20 - 400С.
4
Технологический расчет аппаратов
. Масса поглощаемого вещества и расхода поглотителя
Пересчитаем исходные концентрации в относительные массовые доли:
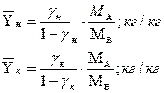
где:
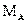 - мольная масса абсорбтива;
- мольная масса абсорбтива;
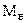 - мольная масса инертного газа;
- мольная масса инертного газа;
Объемный расход инертного газа при рабочих условиях:
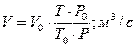
Массовый расход инертного газа:
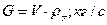

где: 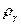 - плотность инертного газа при 0 0C;
- плотность инертного газа при 0 0C;
Уравнение материального баланса:
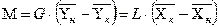
Используя данные равновесия:
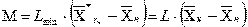
Отсюда минимальный расход поглотителя:
 , так как
, так как 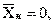 здесь
здесь
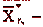 концентрация абсорбтива в воде, равновесная с газом
начального состава; определяем из уравнения равновесной прямой:
концентрация абсорбтива в воде, равновесная с газом
начального состава; определяем из уравнения равновесной прямой:
 здесь
здесь
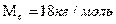 - мольная масса воды
- мольная масса воды
 =>
=> 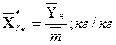 , где
, где
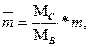 где
где 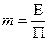 ,
,
здесь Е-коэффициент Генри, П-давление среды.
Действительный расход:
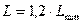
Удельный расход поглотителя:
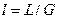
2. Движущая сила массопередачи
Для случая линейной равновесной зависимости между составами фаз, принимая
модель идеального вытеснения в потоках обеих фаз, определим движущую силу в
единицах концентрации газовой фазы:
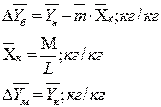
 кг/кг
кг/кг
. Скорость газа и диаметр абсорбера
Предельную скорость газа, выше которой наступает захлебывание насадочных
абсорберов, можно рассчитать по уравнению:
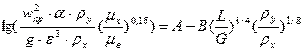 , здесь
, здесь
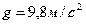 - ускорение свободного падения;
- ускорение свободного падения;
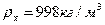 -плотность воды;
-плотность воды;
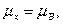 так как поглотитель вода;
так как поглотитель вода;
Подбираем насадку:
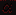 - удельная поверхность насадки;
- удельная поверхность насадки;
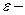 свободный объем, тогда
свободный объем, тогда

Принимаем рабочую скорость равную: 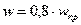
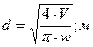
Выбираем стандартный диаметр обечайки абсорбера и определяем
действительную рабочую скорость газа в колонне.
. Плотность орошения и активная поверхность насадки
Плотность орошения:
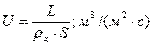 , где
, где
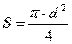
Минимальная эффективная плотность орошения:
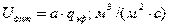 , где
, где
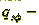 линейная эффективная плотность орошения;
линейная эффективная плотность орошения;
Доля активной поверхности насадки 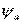 может быть найдена:
может быть найдена:
 здесь
здесь
, q - коэффициенты.
. Расчет коэффициентов массоотдачи и массопередачи
Коэффициент массоотдачи в газовой фазе:
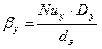 , здесь
, здесь
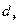 - эквивалентный диаметр насадки;- коэффициент диффузии;
- эквивалентный диаметр насадки;- коэффициент диффузии;

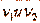 - мольные объемы;
- мольные объемы;
Диффузионный критерий Нуссельта для газовой фазы:
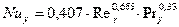 , здесь
, здесь
Критерий Рейнольдса для газовой фазы в насадке:
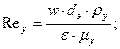 здесь
здесь
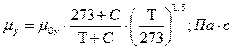 , здесь
, здесь
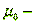 вязкость газа при 00C;
вязкость газа при 00C;
С=114 - константа Сатерленда;
Диффузионный критерий Прандтля для газовой фазы:
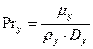 , тогда
, тогда
Коэффициент массоотдачи в жидкой фазе:
 , здесь
, здесь
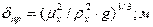 - приведенная толщина стекающей пленки жидкости, здесь
- приведенная толщина стекающей пленки жидкости, здесь 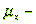 вязкость воды;
вязкость воды;
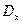 - коэффициент диффузии абсорбтива в воде при 200C;
- коэффициент диффузии абсорбтива в воде при 200C;
Диффузионный критерий Нуссельта для жидкой фазы:
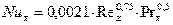 , здесь
, здесь
Модифицированный критерий Рейнольдса для стекающей по насадке пленке
жидкости:

Диффузионный критерий Прандтля для жидкой фазы:
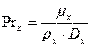 ,
,
Коэффициент массоотдачи:
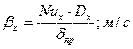
Переводим коэффициенты массоотдачи в требуемую размерность:
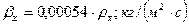
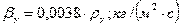
Коэффициент массопередачи по газовой фазе:
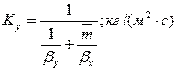
. Поверхность массопередачи и высота абсорбера
Поверхность массопередачи в абсорбере:

Высота насадки, требуемая для создания этой поверхности:
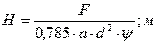 ,
,
Высота абсорбера:
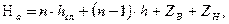 здесь
здесь
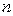 - число слоев
- число слоев
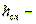 высота одного слоя;
высота одного слоя;
 - расстояние между слоями;
- расстояние между слоями;
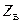 - высота сепарационной части;
- высота сепарационной части;
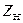 - высота кубовой части.
- высота кубовой части.
5
Преимущества и недостатки абсорбционных методов очистки отходящих газов
Абсорбционные системы разделяют на водные и неводные. Во втором случае
применяют обычно малолетучие органические жидкости. Жидкость используют для
абсорбции только один раз или же проводят ее регенерацию, выделяя загрязнитель
в чистом виде. Схемы с однократным использованием поглотителя применяют в тех
случаях, когда абсорбция приводит непосредственно к получению готового продукта
или полупродукта. В качестве примеров можно назвать:
· получение минеральных кислот:
§ абсорбция серного ангидрида (SO3) (производство серной кислоты - H2SO4);
§ абсорбция хлористого водорода (HCl) (получение соляной кислоты);
§ абсорбция оксидов азота (NOx)
водой (производство азотной кислоты - HNO3);
§ абсорбция оксидов азота (NOx)
щелочными растворами (получение нитратов);
§ др.
· получение солей (абсорбция оксидов азота щелочными растворами
с получением нитрит-нитратных щелоков, абсорбция водными растворами извести или
известняка с получением сульфата кальция);
· других веществ (абсорбция NH3 водой для получения аммиачной
воды и др.).
Схемы с многократным использованием поглотителя (циклические процессы)
распространены шире. Их применяют для улавливания углеводородов, очистки от SO2
дымовых газов ТЭС, очистки вентгазов от сероводорода железно-содовым методом с
получением элементарной серы , моноэтаноламиновой очистки газов от CO2 в
азотной промышленности.
В зависимости от способа создания поверхности соприкосновения фаз
различают поверхностные, барботажные и распыливающие абсорбционные аппараты.
В первой группе аппаратов поверхностью контакта между фазами является
зеркало жидкости или поверхность текучей пленки жидкости. Сюда же относят
насадочные абсорбенты, в которых жидкость стекает по поверхности загруженной в
них насадки из тел различной формы.
Во второй группе абсорбентов поверхность контакта увеличивается благодаря
распределению потоков газа в жидкость в виде пузырьков и струй. Барботаж
осуществляют путем пропускания газа через заполненный жидкостью аппарат либо в
аппаратах колонного типа с тарелками различной формы.
В третьей группе поверхность контакта создается путем распыления жидкости
в массе газа. Поверхность контакта и эффективность процесса в целом определяется
дисперсностью распыленной жидкости.
абсорбционный очистка газ
6
Заключение
В данной работе были рассмотрены абсорбционные методы очистки отходящих
газов от примесей кислого характера. Данный метод очистки газов не свободен от
определенных недостатков, связанных, прежде всего, с громоздкостью
оборудования. Этот метод достаточно капризен в эксплуатации и связан с большими
затратами. К недостаткам абсорбционного метода следует отнести также
образование твердых осадков, что затрудняет работу оборудования, и коррозионную
активность многих жидких сред. Однако, не смотря на эти недостатки,
абсорбционный метод еще широко применяется в практике газоочистки, так как он
позволяет улавливать наряду с газами и твердые частицы, отличается простотой
оборудования и открывает возможности для утилизации улавливаемых примесей.
7
Список литературы
· Ветошкин
А.Г., Таранцева К.Р. Технология защиты окружающей среды (теоретические основы).
Учебное пособие. /Под ред. доктора технических наук, профессора, академика
МАНЭБ и АТП РФ А.Г.Ветошкина - Пенза: Изд-во Пенз. технол. ин-та, 2004. - с.:
ил., библиогр.
· Страус В.
Промышленная очистка газов / Пер. с англ. М.: Химия, 1981.
· Дытнерский,
Ю. И. Основные процессы и аппараты химической технологии: Пособие по
проектированию / Г. С. Борисов, В. П. Брыков, Ю. И. Дытнерский - Изд. 3-е,
стереотипное. - М.: ООО ИД «Альянс», 2007.
· <http://filepo27.narod.ru/teor/63.htm>
Абсорбционные методы очистки газов(SO(2), N(x)O(y), H(2)S).
· <http://splitsystem-rostov.ru> Методы очистки
воздуха. Описание существующих методов очистки воздуха от вредных газообразных
примесей.
· <http://www.gazochist.ru/cba/proceses.html>
Очистка газов от примесей.