Исследование комплексных соединений
Исследование
комплексных соединений
Цель работы: познакомиться с методами получения
комплексных соединений и их свойствами.
Общие сведения:
Комплексные соединения- это частицы (нейтральные молекулы или ионы
<#"699575.files/image001.gif">++NO3-+Na++Cl-=Na++NO3-+AgCl +2+ Cl-= AgCl
+2+ Cl-= AgCl
Наблюдения: Выпал осадок белого
цвета.
Добавляем 3-5 капель
концентрированного раствора аммиака и немного встряхиваем пробирку.
AgCl +
2NH4OH = [Ag(NH3)2]Cl + 2H2O+2NH4++2OH-=[Ag(NH3)2]++Cl-+2H2O
Наблюдения: Осадок растворился,
раствор стал прозрачным.
Подкислить раствор аммиаката серебра
азотной кислотой.
[Ag(NH3)2]Cl+2HNO3=2NH4NO3+
AgCl
[Ag(NH3)2]++Cl-+2H++2NO3-=2NH4++NO3-+AgCl
[Ag(NH3)2]++Cl-+2H+=2NH4++AgCl
Наблюдения: Образовался осадок
белого цвета.
Опыт №2
Получение аминокомплекса никеля.
Наливаем в пробирку 3-4 капли NiSO4 и одну
каплю разбавленного раствора аммиака
2NiSO4 +
2(NH3*H2O)= (NiOH)2SO4 +(NH4)2SO4+H2O
+(NH4)2SO4+H2O
Ni2++
2SO42-+2(NH3*H2O)=(NiOH)2SO4 +H2O+2NH4++SO42-
+H2O+2NH4++SO42-
Ni2++SO42-+2(NH3*H2O)=(NiOH)2SO4 +H2O+2NH4+
+H2O+2NH4+
Наблюдения: Выпал студенистый
осадок.
(NiOH)2SO4+(NH4)2SO4+10NH4OH=2[Ni(NH3)6]SO4+12H2O
(NiOH)2SO4↓
+2NH4++SO42- = 2[Ni(NH3)6]2+ + SO42- + 12H2O
(NiOH)2SO4↓
+2NH4+=2[Ni(NH3)6]2+ +12H2O
Наблюдения: Раствор стал
сине-фиолетового цвета.
Добавим 1 млKBr.
[Ni(NH3)6]SO4
+2NaBr=[Ni(NH3)6]Br2+Na2SO4
[Ni(NH3)6]+2+SO42-+2Na++2Br-=[Ni(NH3)6]Br2+2Na++SO42-
[Ni(NH3)6]+2+2Br-=[Ni(NH3)6]Br2
Наблюдения: Образовался осадок
белого цвета.
Опыт 6
Получение комплексного йодида ртути.
Наливаем в пробирку 3-4 капли раствора Hg(NO3)2 и
добавляем 1-2 капли раствора иодида калия:
Hg(NO3)2
+2KI = HgI2 + 2KNO3+2 + 2NO3- + 2K+ + 2I- = HgI2 + 2K+ + 2NO3-2+ + 2I- = HgI2
Наблюдения: Выпал осадок морковного
цвета.
Добавляем в эту же пробирку 1-2
капли раствора KI:
HgI2 + 2KI =
K2[HgI4]+ 2K+ + 2I- = 2K+ + [HgI4]2-2 + 2I- = [HgI4]2-
Наблюдения: Осадок растворяется и
раствор становится прозрачным.
Комплексообразователем является ион Hg2+, лигандом
в данном растворе является ион I-.
В пробирку добавляем AgNO3:
K2[HgI4] +
2Ag(NO3) = Ag2[HgI4] + 2KNO3
K+ + [HgI4]
+ 2Ag+ + 2NO3- = Ag2[HgI4] + 2K+ + 2NO3-
Наблюдения: выпал желтый осадок.
Опыт №9
Образование труднорастворимого
гексоцианоферрата(III).
А. Налить в пробирку 3-4 капли
раствора K4[Fe(CN)6] и
добавить 2-3 капли раствора FeCl3:
3K4[Fe(CN)6]
+ 4FeCl3 = Fe4[Fe(CN)6]3 + 12KCl
K+ +
3[Fe(CN)6]4- + 4Fe+3 + 12Cl- = Fe4[Fe(CN)6]3 +12K+ +12Cl-
[Fe(CN)6]4-
+ 4Fe+3 = Fe4[Fe(CN)6]3
Наблюдения: Раствор стал
темно-синего цвета.
Опыт №10
Образование труднорастворимого
гексоцианноферратa(II).
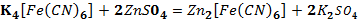
Наблюдения: образовался
светло-жёлтый, почти белый осадок.
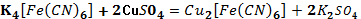
Наблюдения: образовался осадок
бурого цвета
Вывод: Комплексные соединения - это соединения,
в структуре которых можно выделить центральный атом - акцептор электронов,
находящихся в донорно-акцепторной связи с определенным числом доноров-лигандов.
Чем выше прочность связей лиганда и
комплексообразователя тем в меньшей степени в растворе проявляются свойства
центрального атома и лигандов и тем заметнее сказываются особенности комплекса.
Комплексные соединения проявляют химическую
активность в результате свободных орбиталей центрального атома и наличии
свободных электронных пар лигандов.
В этом случае комплекс обладает электрофильными
и нуклеофильными свойствами, отличными от свойств центрального атома и
лигандов.