Синтез та властивості 4-заміщених 2-метилхіноліну
МІНІСТЕРСТВО ОСВІТИ І НАУКИ
УКРАЇНИ
ЗАПОРІЗЬКИЙ НАЦІОНАЛЬНИЙ
УНІВЕРСИТЕТ
БІОЛОГІЧНИЙ ФАКУЛЬТЕТ
Кафедра хімії
Кваліфікаційна робота
бакалавра
(освітній рівень)
на тему: Синтез та властивості 4-заміщених
2-метилхіноліну
РЕФЕРАТ
Об’єкт дослідження -4-заміщені 2-метилхіноліни.
Предметом дослідження є умови синтезу та фізико-хімічні
властивості 4-заміщених 2-метилхінолінів.
Методи
досліджень та апаратура - теоретичний, хімічний, розрахунковий,
експериментальний; аналітичні та торсійні терези, водяна баня, хімічний посуд,
термостат, прилад для визначення температури плавлення, хроматографічна камера,
ІЧ-Фур’є спектрометр та спектрофотометр Hach Lange DR 2800.
Метою даної роботи є: дослідження умов синтезу
4-заміщених2-метилхінолінів, визначення їх спектральних показників і
квантово-хімічних констант.
Результати та їх новизна: вперше визначено фізико-хімічні
характеристики отриманих сполук, з’ясовано, що для даних сполук дослідження
спектральних властивостей є інформативним методом. Визначення їх квантово-хімічних
та фізико-хімічних констант дає змогу розрахувати найбільш реакційноздібну
варіацію 4-заміщеного 2-метилхіноліну для подальшого моделювання біодоступних
біологічно активних речовин на базі хіноліну.
СИНТЕЗ
ХІНОЛІНУ, фІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ 4-ЗАМІЩЕНИХ 2-МЕТИЛХІНОЛІНІВ, ТОНКОШАРОВА ХРОМОТОГРАФІЯ, ТЕМПЕРАТУРА ПЛАВЛЕННЯ, ЯКІСНІ РЕАКЦІЇ,
СПЕКТАЛЬНИЙ АНАЛІЗ.
ABSTRACT
The object of study-4-substituted 2-methylquinolinesubject of
research is the conditions of synthesis and physical-chemical properties of
4-substituted 2-methylquinoline.methods and apparatus - theoretical, chemical,
calculated, experimental; analytical and torsion balance, water bath, chemical
vessels, thermostat, apparatus for measuring melting point, chromatographic
chamber, Fourier infrared spectrometer and spectrophotometer Hach Lange DR
2800.aim of this work is to study the conditions synthesis of 4-substituted
2-methylquinoline, determine their spectral indices and quantum chemical
constants.
Results and newness: For the first time definedthe physical
and chemical properties of the compounds obtained, it was found that these
compoundsit was found that for these compounds research spectral properties it
is informative method. Determination of quantum-chemical and physico-chemical
constants allows to calculate the most reactionary capable variation of
4-substituted 2-methylquinoline for further modeling bioavailable biologically
active substanceswhich based on quinoline.SYNTHESIS, PHYSICOCHEMICAL PROPERTIES
OF 4-SUBSTITUTED 2-METHYLQUINOLINE, THIN-LAYER HROMOTOHRAFIYA, MELTING POINT,
QUALITATIVE REACTIONS, SPECTRAL ANALYSIS.
ЗМІСТ
ПЕРЕЛІК
УМОВНИХ ПОЗНАЧЕНЬ, СИМВОЛІВ, ОДИНИЦЬ, СКОРОЧЕНЬ І ТЕРМІНІВ
ВСТУП
1.
ОГЛЯД НАУКОВОЇ ЛІТЕРАТУРИ
1.1 Будова та властивості хіноліну
1.2Методи синтезу хіноліну
1.2.1
Утворення зв зв’язку С(3)-С(4)
1.2.2
Утворення зв зв’язку С(4)-С(4а)
1.3 Хімічні властивості хіноліну
1.4 Біологічно активні речовини на основі хіноліну
1.4.1 Хінін
1.4.2 Хінолони
2.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
2.1
Об’єкт дослідження
2.2
Тонкошарова хроматографія
2.3 Капілярний метод визначення температури
плавлення
2.4 Якісний аналіз функціональних груп
2.4.1Якісні реакції на ендоциклічний атом N в хіноліновому ядрі
2.4.2 Якісна реакція на Сульфур (реакція Фоля)
2.4.3 Якісна реакція на метильну групу (реакція
Кневенагеля)
3.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
3.1 Квантово-хімічні
розрахунки
3.2 Синтез алкоксизаміщених 4-тіохінолінів
3.3 Синтез пірроло[1,2-a]хіноліну
та його похідних
3.4 Фізико-хімічні властивості алкоксизаміщених
4-тіохінолінів
4.
ОХОРОНА ПРАЦІ
ВИСНОВКИ
ПЕРЕЛІК ПОСИЛАНЬПЕРЕЛІК УМОВНИХ ПОЗНАЧЕНЬ, СИМВОЛІВ,
ОДИНИЦЬ, СКОРОЧЕНЬ І ТЕРМІНІВ
Mr - молекулярна маса
R - радикал
Rf- швидкість переміщення речовини при хроматографічному
розділенні
год. - година
ІЧ - спектри - інфрачервоні спектри
мг - міліграм
с - секунда
ТШХ - тонкошарова хроматографія
УФ - спектри - ультрафіолетові спектри
хв. - хвилина
ВСТУП
Похідні гетероциклічної системи хіноліну з часу їх відкриття
і до сьогоднішнього дня привертають до себе увагу багатьох дослідників.
Це обумовлено високою біологічною активністю природних та
синтетичних представників цього гетероциклу. Значна кількість робіт вітчизняних
та зарубіжних авторів присвячена дослідженню методів синтезу, фізико-хімічних і
біологічних властивостей хіноліну та його похідних.
Особливу увагу приділяють синтезам на основі різноманітних
похідних хіноліну, що спрямовані на отримання біологічно-активних сполук -
нових лікарських, ветеринарних препаратів, а також пестицидів та аналітичних
реагентів. Відомі в науковій літературі дані свідчать, що різні замісники по
різному впливають на властивості новосинтезованих речовин.
На кафедрі хімії ЗНУ синтезуються нові
біологічно активні сполуки, які мають у своїй основі хінолін, акридин, піридин.
Під час синтезу нової сполуки виникає необхідність у
встановлені її будови, фізичних та хімічних властивостей, основних констант.
Такі задачі вирішуються за допомогою сучасних методів досліджень.
Дані, отримані в результаті багатостороннього аналізу,
дозволяють запропонувати для невідомої сполуки за меншою мірою ковалентну
структуру, а також дають можливість зробити висновки про відносну стехіометрію.
Задачу встановлення будови можна вирішити шляхом вдалого підбору одного чи двох
спектроскопічних методів, підтвердивши отримані дані простим хімічним тестом чи
за допомогою визначення температури плавлення або кипіння, ліпофільності та
інших фізико-хімічних характеристик.
Мета роботи: синтезувати 4-заміщенні2-метилхіноліни та
визначити їх деякі фізико-хімічні показники.
Завдання:
Проаналізувати літературні джерела на предмет
синтезу та реакційної здібності 4-хлоро-2-метилхінолінів;
Провести вивчення квантово-хімічних констант та
дослідити реакційну здібність4-хлоро-2-метилхінолінів;
Синтезувати 4-заміщенні 2-метилхіноліни та визначити
їх деякі фізико-хімічні і спектральні показники;
За матеріалами проведених досліджень опубліковано тези «Роль
цистеїну у біологічній активності 2(4)-меркаптохінолінів» (Молода наука 2017).
1. ОГЛЯД НАУКОВОЇ ЛІТЕРАТУРИ
.1 Будова та властивості хіноліну
Хінолін (бензо[b]піридин) - конденсована система, яка утворена ароматичним бензольним
ядром і гетероциклічним піридиновим циклом; є одним з трьох можливих
азанафталінів. Його біциклічна система вперше була запропонована Кьорнером
(рис. 1.1).
Хінолін міститься в кам’яно-вугільній смолі, звідки може бути
вилучений.
Наявність в молекулі хіноліну двох кілець - піридинового та
бензольного - обумовлює особливості його хімічної взаємодії. В реакції
нуклеофільного заміщення може вступати тільки піридинове кільце, в якому атака
відбувається в положеннях 2 або 4. В реакціях електрофільного заміщення
бензольне кільце легше піддається атаці ніж кільце піридину. Заміщення
відбувається переважно в положенні 5 або 8 [3, 4].
Хінолін є частиною структури алкалоїду хініну, який володіє
противомалярійною активністю. Саме цей факт вплинув на розробку і дослідження
багаточисленних похідних хіноліну. В результаті синтезу і аналізу фізіологічної
дії декількох тисяч похідних бензо[b]піридину були розроблені наступні теоретичніобґрунтування:
. Активний препарат повинен складатися з хінолінового
ядра, яке містить атом хлору в сьомому положенні або метоксигрупу (-ОСН3)
в шостому положенні (яка не є абсолютно необхідною для проявлення сполукою
противомалярійної активності).
. До хінолінового ядра повинен бути приєднаний боковий
ланцюг через аміногрупу в четвертому або восьмому положеннях.
. Боковий ланцюг повинен мати витягнуту (але не
розгалужену) форму. В кінці аміногрупи атоми гідрогену можуть бути заміщені не
менше, ніж етильними радикалами. В α-положенні по відношеннюдо аміногрупи може знаходитись
метильний радикал [1, 2].
Дослідженнями останніх років доведено, що поєднання
азотовмісного гетероциклу та карбонових або меркаптокарбонових кислот
призводить до появи нових ефектів і посилення біологічної дії, зокрема
здатності знижувати вміст продуктів вільнорадикального окиснення, проявляти
виражений церебропротекторний та гепатопротекторний ефекти[5, 6].
1.2 Методи синтезу хіноліну
Існує багато різноманітних синтетичних методів побудови
хінолінового ядра. В класичних методах в якості вихідних сполук використовують
похідні бензолу, а піридинове кільце утворюється в результаті циклізації. Деякі
сучасні методи засновані на використанні похідних піридину в якості вихідних
сполук. Найважливішим етапом побудови хінолінової системи є циклізація
замісника бензольного кільця за вільним орто-положенням. Подібний процес
використовується в синтезах Скраупа, Дебнера-Міллера, Комба [7].
Основним в синтезі хінолінів є анелювання піридинового ядра
до бензольного, тому розглядають два основних варіанта: утворення зв’язку між
атомами С(3)-С(4) і між атомами С(4)-С(4а).
1.2.1 Утворення зв’язку С(3)-С(4)
До даної групи методів належать синтези Фрідлендера, Пфітцингера,
а також конденсація о-нітроарилбензилсульфонів з ефірами малеїнової (або
фумарової) кислоти.
При виконанні синтезу Фрідлендера в якості вихідних речовин
використовують о-ациланіліди і карбонільні сполуки, які містять метиленову
групу (рис. 1.2).
Рисунок 1.2 - Схема синтезу хіноліну методом Фрідлендера
Напрямок циклізації залежить від умов реакції. В кислому
середовищі карбонільна сполука реагує у вигляді нейтрального С(3)-енолу,
а у лужному - у вигляді С(1)-енолят аніону. Аналогічні
закономірності спостерігаються і при альдольній конденсації метилетилкетону в
середовищах з різною кислотністю та основністю [8].
Так як о-ациланаліни важкодоступні, використовують
конденсацію о-нітрокарбонільних попередників з активними метиленовими
компонентами, після чого проводять відновну конденсацію (рис. 1.3).
Рисунок 1.3 - Схема конденсації о-нітрокарбонільних
попередників
Синтез Пфітцингера полягає у лужному гідролітичному розкритті
п’ятичленного кільця ізатину з наступною конденсацією утвореного аніону о-амінофенілгліоксилової
кислоти з кетонами (рис. 1.4). Така конденсація протікає аналогічно синтезу
Фрідлендера.
Рисунок 1.4 - Схема синтезу Пфітцингера
Конденсація о-нітроарилбензилсульфонів з еcтерами малеїнової (або фумарової)
кислоти складається з декількох стадій і завершується утворенням N-оксиду 2,3-діетоксикарбонілхіноліну
(рис. 1.5). Присутність у вихідній структурі сульфонільної групи дозволяє
отримувати ароматичні структури без застосування додаткового окислення.
Рисунок 1.5 - Схема конденсації о-нітроарилбензилсульфонів з
естерами малеїнової (або фумарової) кислоти
.2.2 Утворення зв’язку С(4)-С(4а)
Дану групу методів складають синтези Скраупа,
Дебнера-Міллера, Комба, Конрада-Лімпаха-Кнорра.
Синтез Скраупа - конденсація ариламінів з α,β-ненасиченими карбонільними
сполуками полягає в нагріванні аніліну з гліцерином і сульфатною кислотою, яка
виступає дегідратуючим агентом і кислотним каталізатором (рис. 1.6).
Дегідратація гліцерину призводить до утворення
α,β-ненасиченого альдегіду -
акролеїну. Наступним етапом є приєднання аніліну до активованого подвійного
зв'язку акролеїну. Подальше електрофільне замикання циклу вимагає кислотного
каталізу. Для окислення гідрованої структури, яка утворилася, використовують
нітробензол тієї ж будови, що й вихідний анілін. Реакція сильно екзотермічна,
тому зазвичай додають сповільнювач процесу - ферум (II) сульфат.
Рисунок 1.6 - Схема синтезу хіноліну методом Скраупа
Обмеженням методу є наявність в ароматичному субстраті
ацидофобних груп. У якості дегідратуючих агентів можна використовувати не
тільки нітробензени, а й інші окисники [7].
Модифікація Дебнера-Міллера полягає в тому, що замість
акролеїну використовуються α,β-ненасичені альдегіди або
кетони, що викликає більше число варіацій реакційних шляхів (рис. 1.7). У
якості каталізатора використовують хлоридну кислоту і цинк (ІІ) хлорид. При
цьому на першій стадії відбувається кротонова конденсація альдегіду з
утворенням α,β-ненасиченого альдегіду, який потім
реагує з аніліном.
Рисунок 1.7 - Схема модифікації Дебнера-Міллера
При такому варіанті проведення реакції немає потреби у
використанні додаткового окисника, роль якого в даному випадку виконує вихідний
альдегід [9, 10].
Синтез Комба полягає у конденсації ариламінів з
1,3-дикарбонільними сполуками (рис. 1.8). На першому етапі конструювання
піридинового циклу молекули хіноліну відбувається утворення основи Шиффа.
Дегідратація проміжної структури призводить до ароматизації.
Рисунок 1.8 - Схема синтезу Комбе
Особливістю синтезу Конрада-Лімпаха-Кнорра є використання β-кетоестерів в якості
1,3-дикарбонільних сполук (рис. 1.9).
Рисунок 1.9 - Схема синтезу Конрада-Лімпаха-Кнорра
При використанні ацетооцтового естеру в залежності від умов
реакції можуть утворюватися 2-метилхінолони-4 або 4-метилхінолони-2. Атака
аміногрупи карбонільної групи кетону є кінетично контрольованим процесом, який
протікає при низьких температурах (приблизно 20 0С). Наступне
нагрівання супроводжується циклізацією і призводить до утворення
2-метилхінолонів-4. Атака за складноефірною групою є термодинамічно
контрольованим процесом і відбувається при температурі 110-140 0С; в
результаті утворюються 4-метилхінолони-2 (рис. 1.10).
Рисунок 1.10 - Вплив умов реакції на продукти синтезу
Конрада-Лімпаха-Кнорра
У наведених вище методах синтезу хіноліну для мета-заміщених
анілінів існують дві орто-позиції, які здатні піддаватися електрофільній
атаці при циклізації. В результаті можливе утворення як 5-, так і 7-заміщених
хінолінів. У деяких випадках серед продуктів реакції переважає один ізомер [7].
.3 Хімічні властивості хіноліну
Хінолін ̶ основа, сильніша, ніж анілін, але слабкіша,
ніж піридин,
рКа = 4,9.
За хімічними властивостями хінолін нагадує піридин. Йому
характерні реакції за участю гетероатома, реакції електрофільного та нуклеофільного
заміщення атомів водню хінолінового ядра, а також реакції окиснення та
відновлення [11, 13].
Реакції за гетероатомом.
За участю гетероатома
хінолін, аналогічно піридину, утворює солі з сильними кислотами, алкіл- та
ацилгалогенідами (рис. 1.11).
Рисунок 1.11 - Реакції хіноліну за гетероатомом
Реакції електрофільного
та нуклеофільного заміщення.
Через
електронно-акцепторний вплив гетероатома в молекулі хіноліну електронна густина
зменшена у порівнянні з нафталіном та розподілена нерівномірно: в піридиновому
кільці вона менша, ніж у бензольному. Тому при дії електрофільних реагентів
заміщення переважно йде за бензольним кільцем, при дії нуклеофільних- за
піридиновим[12].
Реакції електрофільного
заміщення в молекулі хіноліну проходять здебільшого в положеннях 5 і 8 (рис.
1.12). Так, при нітруванні нітруючою сумішшю утворюється суміш 5- і
8-нітрохінолінів, сульфування концентрованою сірчаною кислотою при 220 °С
призводить до утворення 8-хінолінсульфокислоти, а при 300 °С - термодинамічно
вигіднішої 6-хінолінсульфокислоти (за цих умов 5- і 8-ізомери перегруповуються
в 6-ізомер) (рис. 1.12).
Рисунок 1.12- Реакції
електрофільного заміщення у хіноліновому ядрі
В реакції нуклеофільного
заміщенняхінолін вступає легше, ніж піридин. При цьому, як і в кільці піридину,
нуклеофільній атаці піддається переважно положення 2. Так, при дії на хінолін
амідом натрію в середовищі рідкого амоніаку утворюється 2-амінохінолін, з
гідроксидом калію при 280-300 °С хінолін утворює 2-гідроксихінолін (рис. 1.13) [14, 15].
Рисунок 1.13- Реакції
нуклеофільного заміщення в хіноліновому ядрі
Реакції відновлення і
окиснення.
Відновлення хіноліну
спочатку відбувається у піридиновому ядрі. При дії більшості відновників з
високим виходом утворюється 1,2-дигідрохінолін, у присутності нікелю Ренея
хінолін відновлюється воднем до 1,2,3,4-тетрагідрохіноліну. Каталітичне
гідрування за жорстких умов торкається також бензольного кільця (рис. 1.14).
Рисунок 1.14- Реакції
відновлення хіноліну
Окиснення хіноліну та
його гомологів з замісниками в бензольному ядрі дією перманганатом калію в
лужному середовищі супроводжується розщепленням бензольного кільця та приводить
до утворення 2,3-піридиндикарбонової кислоти (хінолінова кислота) (рис. 1.15).
Рисунок 1.15- Реакції
окиснення хіноліну
Для одержання похідних хіноліну найчастіше
використовують синтез Скраупа, оскільки, змінюючи склад вихідних речовин для
синтезу, можна одержати похідні різноманітної будови, наприклад, хінозол
(8-оксихіноліну сульфат). Для цього конденсують попередньо отриманий
2-амінофенол з гліцерином у присутності сульфатної кислоти і окисників -
нітробензолу або арсенатної кислоти H3AsO4 (рис. 1.16).
Рисунок 1.16- Добування
сульфату 8-оксихіноліну синтезом Скраупа
Речовину можна одержати сульфуванням хіноліну з
наступним сплавленням отриманого 8-сульфохіноліну з лугом [16-19].
1.4 Біологічноактивні речовини на основі хіноліну
Похідні хіноліну виявляють різноманітну
фармакологічну дію і застосовуються як:
. Протималярійні засоби: похідне 4-амінохіноліну
- хлорохін (хінгамін), похідні 8-амінохіноліну - хіноцид, плазмоцид та ін.
. Антисептичні й антибактеріальні засоби: похідні
8-оксихіноліну - хінозол, хініофон, нітроксолін, ентеросептол, хлорхінальдол та
ін.
. Анестезуючий засіб: похідне
4-хінолінокарбонової кислоти - совкаїн (перкаїн) та ін.
. Ціанінові барвники застосовуються для
сенсибілізації фотографічних емульсій(наприклад, етиловий червоний).
. 8-Гідроксихінолін (оксин) широко
використовується в аналітичній хімії для виявлення багатьох металів, що
утворюють з ним внутрішньокомплексні солі − оксинати(хелати) за рахунок
участі вільної пари електронів нітрогену [20-23].
Біологічно активні речовини (БАР) - це сполуки,
які внаслідок своїх фізико-хімічних властивостей мають певну специфічну
активність і виконують, змінюють або впливають на каталітичну (ферменти,
вітаміни, коферменти), енергетичну (вуглеводи, ліпіди), пластичну (вуглеводи,
ліпіди, білки), регуляторну (гормони, пептиди) або інші функції в організмі.
1.4.1 Хінін
Алкалоїд, що міститься в корі різних видів хінного дерева. За хімічною
будовою є [6'-метоксіхіноліл-(4')] - [5-вінілхінукліділ-(2)]-Карбінол (рис.1.17).
Рисунок 1.17 − Структура хініну
Місцева дія проявляється в роздратуванні тканин: при
підшкірному введенні розчини солей хініну можуть викликати больові відчуття, а
іноді і некротичні зміни. Резорбтивну дію проявляється в першу чергу зміною стану центральної
нервової системи, серцево-судинної системи, мускулатури матки. Хінін може
викликати пригнічення центральної нервової системи, стан оглушення, дзвін у
вухах, головний біль, запаморочення; у великих дозах - порушення зору, а іноді
втрату свідомості.
Хінолони − група синтетичних антибіотиків, що є
похідними 4-хінолону і мають в своєму складі піперазиновий цикл. Частиною групи
хінолонів є фторохінолони, що мають у своєму складі атоми фтору. Першим
препаратом групи, що уперше застосований у клінічній практиці у 1962 році, є
налідиксова кислота (рис. 1.18).
Рисунок 1.18 - Загальна структура хінолонів
2. МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
.1 Об’єкт дослідження
Об’єктом досліджень є 4-заміщених
2-метилхінолінів, похідні карбонових кислот на основі хінолінового
циклу, синтезовані в лабораторії біотехнології ФАР Запорізького національного
університету (рис. 2.1).
R1= 6-ОСН3,
R2
=CH3;H.
Рисунок 2.1- Загальна будова 4-заміщених
2-метилхінолінів
2.2
Тонкошарова хроматографія
Хроматографія (з грецьк. хромо-колір, графо-пишу) -
високоефективний фізико-хімічний метод розділення і аналізу, в якому речовина
розподіляється між двома фазами: рухомою і нерухомою.
Тонкошарова хроматографія (ТШХ), варіант хроматографії,
заснований на відмінностівшвидкостіпереміщення
компонентівсумішівплоскомутонкомушарі (товщина 0,1-0,5мм)сорбентуприїхньому
русівпотоцірухомої фази(елюента). Остання являєсобою,якправило, рідину,
протездійснений ігазовийваріантТШХ. Уякості
сорбентіввикористовуютьдрібнозернистісилікагель,Аl2О3, целюлозу, крохмаль, поліамід, іонітита
ін.Суспензіямицихсорбентівпокриваютьпластинкизі скла, фольги або пластику;
длязакріпленняшарузастосовуютькрохмаль, гіпс або іншісполучні.Промисловістю
випускаються готовіпластинкиз вжезакріпленимшаромсорбенту.Елюентамислужать
зазвичайсумішіорганічного розчинника, водні розчиникислот, солей,
комплексоутворюючихта ін речовин. Залежновід виборухроматографічної системи(складурухомої
інерухомоїфаз)у поділіречовин основну рольможутьгратипроцесиадсорбції,
екстракції, іонного обміну,комплексоутворення.
Напрактицічастореалізуютьсяодночаснодекількамеханізмів поділу.
Залежно від положення пластинки і напрями потоку елюента
розрізняють висхідну, спадну і горизонтальну ТШХ. За технікою роботи виділяють
фронтальний аналіз (коли рухомий фазою служить аналізована суміш) і зазвичай
використовується елюційний варіант. Застосовують також "кругову"
(коли аналізований розчин і розчинник послідовно подаються в центр пластинки) і
"антикругову" ТШХ (коли аналізований розчин наноситься по колу і
елюент переміщується від периферії до центру пластинки), ТШХ під тиском (коли
розчинник під тиском пропускають через шар сорбенту, покритий щільно
притиснутою поліетиленовою плівкою), а також ТШХ в умовах градієнта
температури, складу сорбенту і т. п. При так званій двомірній ТШХ
хроматографічний процес здійснюють послідовно в двох взаємно перпендикулярних
напрямках з різних елюентів, що збільшує ефективність розділення. З цією ж
метою застосовують багаторазове елюювання в одному напрямку.
У елюційному варіанті на шар сорбенту наносять краплі
(об’ємом 1-5 мкл) аналізованого розчину і занурюють край пластинки в елюент,
який знаходиться на дні герметично закритої скляної камери. Елюент просувається
по шару сорбенту під дією капілярних і гравітаційних сил; аналізована суміш
переміщується в тому ж напрямку. У результаті багаторазового повторення актів
сорбції та десорбції відповідно до коефіцієнту розподілу в обраній системі
компоненти поділяються і розташовуються на пластинці окремими зонами.
Післязавершенняпроцесупластинкувиймаютьз камери, висушують і
проявляютьрозділені зониза власнимзабарвленнямабо
післяобприскуванняїхрозчинамиреагентів, що утворюють забарвлені плями або
плями, що флуоресцують,
зкомпонентамирозділюваноїсуміші.Радіоактивніречовинивиявляютьавторадіографічно(експонуванням
нарентгенівськуплівку,накладенунахроматографії,пластинку).
Застосовуютьтакожбіологічні і ферментативніметодидетектування.Отриманакартинарозподілухроматографічних
зонназиваєтьсяхроматограмою(рис. 2.1).
Положення хроматографічних зон на хроматограмі характеризує
величина Rf - відношення шляху li, пройденого центром зони i-го компонента від
лінії старту, до шляху l, пройденого елюентом: Rf = li/l. Величина Rf залежить
від коефіцієнту розподілу (адсорбції) і від співвідношення обсягів рухомою і
нерухомою фаз [20-23].
Рисунок 2.1 - Хроматограма, отримана при поділі суміші трьох
компонентів методом тонкошарової хроматографії
Після розділення речовин необхідно виявити їх на
хроматограмі. Для виявлення безбарвних речовин, в першу чергу, слід
скористатися фізичними методами, заснованими на поглинанні світла і
флуоресценції. Для виявлення речовин, що поглинають в УФ-області спектру,
часто застосовують пластинки з шаром сорбенту, що містить флуоресціюючу
речовину або оприскують хроматограму після розділення суміші розчином
флуоресціюючої речовини. При опроміненні пластинки УФ−випромінюванням
речовини, що поглинаються в цій області спектру, виявляються у вигляді темних
зон (плям). Флуоресціювати в УФ−світлі здатна значна кількість речовин,
отримані плями мають при цьому різний відтінок. Для виявлення флуоресціюючих
речовин або речовин, що поглинають в УФ−області спектру, використовують
джерела світла з максимумами випромінювання в області 254 і 365 нм. Окрім
оптичних методів виявлення речовин, застосовують хімічні методи прояву
хроматограм. До хімічних методів відноситься використання «універсальних
реагентів» і реагентів, вибірково реагуючих з певними функціональними групами
визначуваних сполук [25, 26].
Метод запропонований Н.А. Ізмайловим і М.С. Шрайбером в 1938
р.
.3Капілярний
метод визначення температури плавлення
Температура плавлення визначається як температура, при якій
фазовий перехід з твердого до рідкого стану відбувається при атмосферному тиску
і така температура ідеально відповідає температурі затвердіння.
При дослідженні будь-якої нової речовини бажано проводити
одночасне визначення температури плавлення продукту реакції та вихідної
речовини, що дасть змогу впевнитися у протіканні реакції [28].
Температуру плавлення органічних речовин визначають за
допомогою капілярів. Попередньо слід заготувати капіляри, які можна створити зі
скляних трубок. Капіляри повинні мати внутрішній діаметр в межах 0,5-0,8 мм і
довжину в межах 70-90 мм, один з їх кінців має бути запаяним. Речовину
висушують, подрібнюють і вводять до капіляру, для чого відкритим кінцем
набирають її невелику кількість і, постукуючи, переміщують у запаяний кінець
капіляру. Так повторюють до отримання на дні капіляру стовпчика речовини
висотою 3-5 мм. Перед проведенням визначення температури плавлення капіляр з
речовиною прикріплюють до термометра так, щоб стовпчик речовини знаходився на
рівні середини ртутного резервуару термометра. Якщо речовина має температуру
плавлення, що не перевищує 150 0С, для прикріплення капіляра до
термометра доцільно користуватися гумовими кільцями, нарізаними з гумової
трубки невеликого діаметру. Термометр з капіляром вставляють у чисту суху
пробірку (на відстані 0,5-1 см вище дна) за допомогою пробки з отвором.
Пробірка з капіляром і термометром нагрівається у металевому блоці, при цьому
через отвори в блоці за ними може проводитись спостереження. Зростання
температури налаштовується на менш, ніж 1 К/хв. протягом всього плавлення.
Визначаються початкова та кінцева температури плавлення. Загалом температура
плавлення записується у вигляді інтервалу температур між початком та кінцем
плавлення речовини
[21,22].
2.4 Якісний аналіз функціональних груп
Якісний аналіз функціональних груп передбачає проведення
якісних реакцій на атом Нітрогену в хіноліновому кільці, атом Сульфуру і на
метильну групу (CH3).
.4.1Якісні реакції на ендоциклічний атом N в хіноліновому
ядрі
Присутність ендоциклічного Нітрогену в хіноліні можна
визначити загальними алкалоїдними реактивами, які є комплексними сполуками:
-Бушарда -
розчин йоду в калій йодиді К[І3] - при взаємодії зі слабокислим
водним розчином гетероциклічної сполуки утворюється бурий осад;
Майєра - розчин гідраргіум йодиду в калій йодиді К2[HgІ4] - при взаємодії зі
слабокислим або нейтральним розчинами гетероциклічної сполуки утворюються осади
білого або жовтуватого кольору;
Драгендорфа - розчин вісмут йодиду в калій йодиді К[ВіІ4]
- при взаємодії з кислим розчином гетероциклічної сполуки утворює аморфний
(рідко кристалічний) осад помаранчево-червоного або цегляного кольору.
Реактиви групового осадження, які представляють собою
комплексні сполуки, з досліджуваними сполуками утворюють осади, що є іонними
асоціатами. В якості групового реактиву також використовують гетерополікислоти,
а саме:
Зонненштейна - фосфорномолібденова кислота Н7[Р(Мо2О7)6]·Н2О
- утворюється осад жовтого кольору, який внаслідок відновлення молібденової
кислоти через деякий час набуває синього або зеленого забарвлення;
Шейблера - фосфорновольфрамова кислота;
Бертрана - сіліцийвольфрамова кислота Нg[Si(W2О7)6]·nН2О - зі слабокислим
водним розчином гетероциклічної сполуки утворюється характерний білий або
жовтуватий дрібнокристалічний осад.
Методика проведення реакцій осадження.Декілька крапель
досліджуваного розчину наносять на предметне скло та додають декілька крапель
одного з реактивів групового осадження. Утворення осаду вказує на
гетероциклічну сполуку [30, 31].
.4.2 Якісна реакція на Сульфур (реакція Фоля)
Реакція Фоля є якісною реакцією на атом Сульфуру. Принцип
методу: при нагріванні досліджуваних речовин в лужному середовищі від них легко
відщеплюється сірка у виді сірководню, який в лужному середовищі утворює натрій
сульфід (рис. 2.2.).
Рисунок 2.2 - Схема реакції взаємодії
(хінолін-4-ілтіо)карбонових кислот з натрій гідроксидом
Утворення натрій сульфіду можна підтвердити за допомогою
іонів важких металів. Для виявлення атому Сульфуру можна використовувати плюмбум
(ІІ) ацетат, який при взаємодії з натрій гідроксидом утворює натрій плюмбіт. В
свою чергу натрій плюмбіт, реагуючи з натрій сульфідом, призведе до утворення
плюмбуму (ІІ) сульфіду - осаду чорного кольору (рис. 2.3).
Pb(CH3COO)2 + 2NaOH → Pb(ONa)2
+ 2CH3COOH
Na2S + Pb(ONa)2 + 2H2O →
PbS↓ + 2NaOH
Рисунок 2.3 - Схема утворення плюмбум (ІІ) сульфіду
Методика проведення реакції Фоля.У пробірку наливають 1 мл
досліджуваного розчину і додають 0,5 мл 20%-го розчину натрій гідроксиду. Суміш
нагрівають до кипіння і додають 0,5 мл розчину плюмбум (ІІ) ацетату,
спостерігають утворення сіро-чорного осаду [32, 33].
.4.3 Якісна реакція на метильну групу (реакція Кневенагеля)
Реакція Кневенагеля полягає у конденсації альдегідів або
кетонів зі сполуками, які містять активну метильну групу, в присутності слабких
основ з утворенням похідних етилену (рис. 2.4).
Виходи реакції досягають 60-80%. В реакцію вступають
аліфатичні, ароматичні та гетероциклічні альдегіди. Кетони реагують складніше.
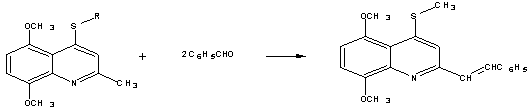
Рисунок 2.4 - Схема реакції Кневенагеля
При взаємодії аліфатичних або ароматичних альдегідів з кислотами, які
містять активну метильну групу в α-положенні по відношенню до карбоксильної групи, в
середовищі піридину (часто з додаванням піперидину) при температурі 100 0С
поряд з реакцією Кневенагеля протікає декарбоксилювання - модифікація Дебнера
(рис. 2.5).
СН3СНО + СН2(СООН)2 → СН3СН=СНСООН
+ СО2↑ + Н2О
С6Н5СНО + CH2(CN)COOH → C6H5CH=CHCN
+ СО2 ↑+ Н2О
Методика проведення реакції.Декілька крапель досліджуваного
розчину наносять на предметне скло та додають по одній краплі натрій ацетату,
концентрованої оцтової кислоти, бензальдегіду. Утворюється осад яскраво-жовтого
кольору, який свідчить про наявність метильної групи. Вихідні речовини зазвичай
нагрівають (не вище 100 0С) в етанолі, бензолі або
піридині. Іноді для протікання реакції достатньо простого змішування розчинів
реагентів при кімнатній температурі [34, 35].
3. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
синтез квантовий хімічний хінолін
3.1 Квантово-хімічні розрахунки
Було проведено квантово-хімічні розрахунки за
допомогою програмного забезпечення Mopac 2016, для хіноліну, 2-метил(феніл)
заміщених хіноліну а також їх хлоропохідних. Визначено значення зарядів для
Карбону у положеннях 2 і 4, та заряд на атомі Нітрогену і його зміну при
введенні хлору в положення С4 (рис. 3.1).
Рисунок 3.1 - Квантово-хімічні розрахунки хіноліну та його
похідних
З введенням метильної або фенільної групи значення
негативного заряду на атомі Нітрогену змінюється, підвищуються основні
властивості хінолінового циклу. Введення метилу є більш ефективним. При
введенні Хлору у 4 положення, значення заряду на атомі Нітрогену та на атомі С4
збільшується. Цепризводить до посилення нуклеофільних властивостей. Даний ефект
більш виражений у випадку метилу.
.2 Синтез алкоксизаміщених 4-тіохінолінів
Синтез алкоксизаміщених 4-тіохінолінів проводився у декілька
стадій. Ці стадії можна представити у загальному вигляді, в результаті наведених реакцій
одержуємо хлоропохідні алкоксизаміщених хіноліну (рис. 3.2).
Рисунок 3.2 - Схема синтезу 4-хлоропохідних хіноліну (де R = 6-OCH3; R1 = CH3, C6H5 )
Під час взаємодії певних 4-хлорохінолінів з відповідними
тіокарбоновими кислотами і з гомоцистеїном утворюються алкоксизаміщені 4-тіохіноліни
та їх похідні (рис. 3.3).
Рисунок 3.3 - Схема синтезу алкоксизаміщених 4-тіохінлінів та
їх похідних (де R=6-OCH3; R1 =CH3, C6H5; R2 =CH3,C6H5, фуро-2-іл; n=1,2)
.3 Синтез пірроло[1,2-a]хінолінута його похідних
Основою для синтезу пірроло[1,2-a]хіноліну є
2-метилзаміщені4-хлорохіноліни. Синтез проводиться в середовищі бензолу при
нагріванні і включає проміжну стадію. З отриманого Cl-заміщеного пірроло[1,2-a]хіноліну отримують S-заміщені сполуки (рис. 3.4).
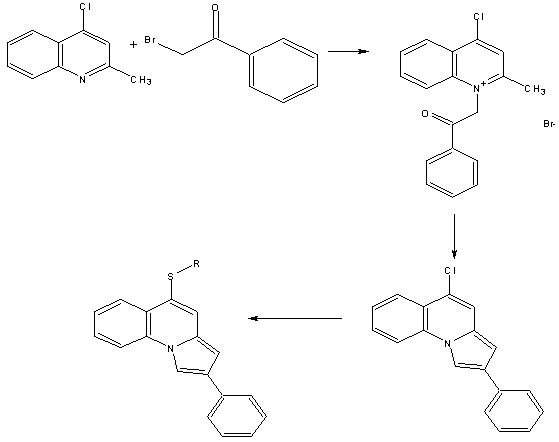
Рисунок 3.4 - Синтез синтезу пірроло[1,2-a]хіноліну та його похідних
3.4Фізико-хімічні властивості алкоксизаміщених 4-тіохінолінів
За допомогою використання пакетів програм HyperChem 2010та ACD/Labs 6.0 шляхом використання
фізико-хімічних дескрипторів для знаходження кількісного співвідношення
«структура-властивість» було отримано деякі фізико-хімічні показники
досліджуваних сполук (табл. 3.1, 3.2).
Таблиця 3.1 - Фізико-хімічні характеристики досліджуваних
алкоксизаміщенних 4-тіохінолінів
|
№ п/п
|
Досліджувана речовина
|
Мr, г/моль
|
Т.пл
|
logP(нейтральна форма)
|
log D (рН =7)
|
Rf (АсОН:
вода)
|
2
|
3
|
4
|
5
|
6
|
7
|
I 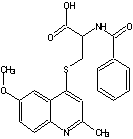
|
N-бензоїл-S-(6-метоксихінолін-4-іл)цистеїн396,6212-2143,61±1,530,260,65
|
|
|
|
|
|
|
|
IІ
|
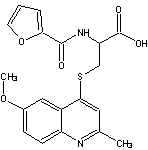 N-2-фуроїл-S-(6-метокси-2-метилхінолін-4-іл)цистеїн384,45 N-2-фуроїл-S-(6-метокси-2-метилхінолін-4-іл)цистеїн384,45
|
120
|
2,91±1,54
|
-0,45
|
0,76
|
|
|
|
|
|
|
|
|
|
ІІІ 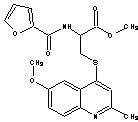
|
метил N-2-фуроїл-S-(6-метокси-2-метилхінолін-4-іл)цистеїн400,4558-592,93±1,202,920,75
|
|
|
|
|
|
Таблиця 3.2 - Фізико-хімічні характеристики ліпофільності
досліджуваних алкоксизаміщенних 4-тіохінолінів
|
Сполука
|
Назва
|
Log P
|
Log S
|
|
N-benzoyl-S-(6-methoxy-2-methylquinolin-4-yl)cysteine3,49-5,068
|
|
|
|
|
methyl
N-benzoyl-S-(6-methoxy-2-methylquinolin-4-yl)cysteinate3,75-5,29
|
|
|
|
|
N-(furan-2-carbonyl)-S-(6-methoxy-2-methylquinolin-4-yl)cysteine2,1-3,999
|
|
|
|
|
S-(6-methoxy-2-methylquinolin-4-yl)-N-(thiophene-2-carbonyl)cysteine3,47-4,454
|
|
|
|
|
methyl
N-(furan-2-carbonyl)-S-(6-methoxy-2-methylquinolin-4-yl)cysteinate2,37-4,223
|
|
|
|
|
methyl
S-(6-methoxy-2-methylquinolin-4-yl)-N-(thiophene-2-carbonyl)cysteinate3,73-4,676
|
|
|
|
Дуже важливою характеристикою будь-якої біологічно активної
речовини є ліпофільність (гідрофобність) - модель розподілу досліджуваної
речовини між двома фазами, що не змішуються (найчастіше використовується
система октанол − вода). Ця характеристика легко модулюється за допомогою
використання відповідного дескриптора і найчастіше використовується для оцінки
здатності речовини подолати біологічні мембрани [34].
Коли досліджувана речовина знаходиться у водній фазі у
вигляді молекул (незаряджених часток) для характеристики ліпофільності
використовують показник logP (Р - коефіцієнт розподілу на межі октаном − вода).Якщо
досліджувана речовина у водному розчині частково знаходиться у дисоційованому
стані у вигляді заряджених часток (йонів), то буде існувати певна динамічна
рівновага між різними формами сполуки, яка буде змінюватись в залежності від рН
середовища.
Ліпофільність такої системи буде визначатись коефіцієнтом
розподілу log D-
співвідношення сум активностей всіх компонентів органічної та водної фаз. Для
порівняння взято отримані квантово-хімічним розрахунком значення ліпофільності logP для нейтральних форм
алкоксизаміщенних 4-тіохінолінів та значення коефіцієнту розподілу logDпри рН=7. Дане значення рН обране
через те, що рН більшості тканинних рідин організму слабколужне підтримується в
межах 7,1-7,4: середня величина рН крові людини складає 7,4, рН лімфи -
7,35-7,40, міжклітинної рідини - 7,26-7,38, внутрішньосуглобної рідини - 7,3,
хоча рН слини в окремих випадках може коливатись в більш широкому діапазоні -
від 6,5 до 7,5 [35, 36].
.4 Результати ПМР-спектроскопії
У ПМР-спектрах (2-R-хінолін-4-ілcульфаніл)карбонових кислот та їх
похіднихвиявлено:
− складний мультиплет протонів ароматичних ядер
(d = 7,18-8,29 м.д.);
− сигнали протонів тіометиленової групи в четвертом
положенні хінолінового циклу;
− сигнали протонів замісників у гетероциклах (рис. 3.4,
3.5, 3.7, 3.8, 3.9, 3.11).
Синглет протонів тіометиленової групи в четвертому положенні
хінолінового циклу для оцтових кислот представлений в інтервалі
δ=3,59-4,01 м.д., а квартет протонів
тіометиленової групи в четвертому положенні хінолінового циклу для a-пропанових кислот - d=4,75 м.д.;
Сигнали протонів замісників у гетероциклі представлені
синглетом метильної групи у другому положенні (δ=2,56-2,64 м.д.).
Рисунок 3.5 - Теоретичний спектрN-бензоїл-S-(6-метоксихінолін-4-іл)цистеїну
Рисунок 3.6 - Теоретичний спектрметил N-бензоїл-S-
(6-метокси-2-метілхінолін-4-іл)цистеїну
Рисунок 3.7 - Теоретичний спектрN-
(фуран-2-карбоніл)-S-(6-метокси-2-метілхінолін-4-іл)цистеїну
Рисунок 3.8 - Теоретичний спектрS-
(6-метокси-2-метілхінолін-4-іл) -N- (тіофен-2-карбоніл)цистеїну
Рисунок 3.9 - Теоретичний спектрметил-N- (фуран-2-карбоніл)
-S-(6-метокси-2-метілхінолін-4-іл)цистеїн
Рисунок 3.10 - Теоретичний спектрметил-S-
(6-метокси-2-метілхінолін-4-іл)N- (тіофен-2-карбоніл)цистеїн
Рисунок 3.11 - Теоретичний спектр пірроло[1,2-a]хіноліну
4. ОХОРОНА ПРАЦІ
Тема моєї роботи «Фізико-хімічні властивості деяких похідних
5-метилтриазоло[4,3-а]хінолінів». Предметом дослідження в даній роботі були
біологічно активні речовини. Дослідження проводилось в хімічній лабораторії.
Основними небезпечними та шкідливими факторами були: органічні сполуки (кислоти
та розчинники), робота з електроприладами та з електронагрівачами, робота з
комп’ютером.
Перед початком роботи у лабораторії № 313 зі мною був
проведений інструктаж науковим керівником з охорони праці для лаборанта
хімічного аналізу №83.
Загальні вимоги до безпечного проведення робіт
За правилами техніки безпеки, жодна людина не повинна
працювати в хімічній лабораторій одна, тому виконання моєї дипломної роботи
проходило під чітким керівництвом наукового керівника.
Умови праці в лабораторії
В умовах, що розглядаються, можливими забруднювачами повітря
можуть бути органічні кислоти та розчинники.
Для забезпечення складу повітря робочої зони згідно з
12.1.016-79 ССБТ «Повітря робочої зони» проектом передбачено: 1) проведення
робіт з даними речовинами у витяжній шафі (згідно з ГОСТ 22360-86 «Шафи
демонстраційні, витяжні»; 2) використання природної вентиляції (СНіП
2.04.05-91) .
Виробничий шум. Єдиним джерелом шуму в лабораторії є витяжна
шафа, її шум не перевищує допустимі норми і не заважає при роботі.
Виробничі вібрації. Джерелом вібрації в умовах, що
розглядаються в роботі є робота витяжної шафи. Вібрації, які вона викликає не
перевищують допустимі норми і не заважають при роботі.
При роботі зі шкідливі та небезпечними речовинами лаборант
повинен працювати у спеціальному одязі, спеціальному взутті та у інших засобах
індивідуального захисту:
халат бавовняний ГОСТ ССБТ 12.4.103-83;
ковпак бавовняний ГОСТ ССБТ 12.4.011-89;
взуття шкіряне ГОСТ ССБТ 12.4.137-84*;
окуляри захисні ГОСТ ССБТ 12.4.013-85;
респіратор ШБ «Пелюстка»ГОСТ ССБТ 12.4.004-74;
рукавички гумові ГОСТ ССБТ 12.4.103-83;
фартух спеціальний ГОСТ ССБТ 12.4.029-76.
При проведенні робіт в умовах
можливого впливу на людину агресивних хімічних речовин (наприклад, кислот, луги
та ін.), повинен застосовуватись спецодяг, виготовлений з матеріалів, що
забезпечують захист від цих впливів.
При виконанні своїх обов’язків лаборант зобов'язаний
дотримуватися вимог санітарних норм та особистої гігієни:
приступати до роботи тільки у засобах
індивідуального захисту;
прийняти і утримувати на протязі зміни робоче місце
у чистоті й порядку;
зберігати і приймати їжу тільки у відведених місцях;
зберігати харчові продукти, в тому числі й молочні,
що видаються на підприємстві. в холодильниках, які використовуються тільки з
цією метою;
після роботи вимити забруднені частини тіла.
Перед початком роботи лаборант
зобов'язаний перевірити та одягти засоби індивідуального захисту. Включити
систему припливно-витяжної вентиляції за 10-15 хвилин до початку роботи. На
робочому місці лаборанта повинні бути тільки необхідні для виконання конкретної
роботи реактиви, прилади і обладнання.
Лаборант перед роботою зобов'язаний
перевірити справність приладів і обладнання, включити загальнообмінну
припливно-витяжну вентиляцію і при необхідності вентиляцію у витяжній шафі.
При виявлених несправностях
обладнання та засобів колективного захисту сповістити керівника робіт та не
приступати до роботи до усунення виявлених несправностей.
Вимоги безпеки під час роботи
Всі операції, пов'язані із
застосуванням або можливим утворенням і виділенням отруйних, їдких,
вибухонебезпечних речовин або речовин, які володіють запахом, виконувати тільки
у витяжній шафі при працюючій загальнообмінній вентиляції із застосуванням
засобів індивідуального захисту.
Для нагрівання легкозаймистих та
горючих рідин не використовувати відкрите полум’я.
Змішування або розведення хімічних
речовин, що супроводжуються виділенням тепла слід виконувати в термостійкому
або порцеляновому посуді.
При нагріванні рідини у пробірці
необхідно спрямовувати її у бік від себе і осіб, які находяться поруч.
При збовтуванні розчину у колбах і
пробірках закривати їх тільки пробками.
Не здійснювати відбір дрібних порцій
речовин безпосередньо з великих бутлів, бочок.
Лаборант повинен:
· не залишати запалені пальники та інші
нагрівальні прилади без нагляду;
· не зберігати будь-які речовини
невідомого походження без напису і етикеток;
· зливати відпрацьовані ефір, бензол та
інші горючі рідини (ГР), відходи кислот і луги тільки у спеціальну тару.
Вимоги безпеки при роботі зі скляним
посудом:
При збиранні скляних приладів і
з’єднань окремих частин гумовими трубками необхідно захищати руки рушником.
При роботі зі склом необхідно стежити
за відповідністю марки скла характеру роботи, що проводиться.
Скляний посуд не застосовуються для
роботи при підвищеному тиску.
При перенесенні посудин з гарячою
рідиною слід посудину брати рушником двома руками, однієї підтримуючи дно.
Вимоги безпеки при роботі з
легкозаймистими речовинами (ЛЗР) і ГР.
Роботи з ЛЗР та ГР повинні
виконуватись тільки у витяжній шафі, пристосованій для цієї роботи, у невеликих
кількостях, при працюючій загальнообмінній вентиляції, вимкнутих
електроприладах і газових пальниках.
Нагрівання і розгонку невеликих
кількостей горючих рідин виконувати тільки на водяній лазні і закритих
електроплитах.
ЛЗР і ГР переносити у щільно
закритому посуді, розміщеному у спеціальному металевому ящику з ручками.
Розлиті ЛЗР необхідно засипати
піском. Забруднений пісок необхідно збирати тільки дерев’яною лопатою або
совком.
Нагрівання ЛЗР можна виконувати
тільки у приладах, що забезпечують повну конденсацію пари, що утвориться.
Посудини. в яких виконувались роботи
з ЛЗР і ГР, після проведення роботи повинні негайно промиватись гарячою водою.
Вимоги безпеки при роботі з їдкими та
отруйними речовинами. Луги, кислоти та інші їдкі й отруйні речовини необхідно
набирати у піпетку тільки за допомогою гумової груші, неприпустимо засмоктувати
їдкі й отруйні рідини у піпетку ротом. Для приготування розчинів кислот,
кислоти необхідно приливати у воду тонкою цівкою при безперервному
перемішуванні, а не навпаки.
Роботи у лабораторії повинні
проводитись тільки на справному електрообладнанні. При відкритті дефектів в
ізоляції приводів, несправності рубильників, штепселів, розеток, вилок та іншої
апаратури слід негайно повідомити черговому електрику.
Треба використовувати тільки
переносні лампи з напругою 36 В у сухих приміщеннях і 12 В у приміщеннях з
підвищеною небезпекою ураження електрострумом.
У випадках припинення подачі
електроенергії всі електроприлади повинні бути обезживлені.
Вимоги безпеки під час роботи у
витяжні шафі.
Перед початком роботи необхідно
перевірити наявність тяги.
Зачинити всі відділення витяжної шафи
створами, крім тієї, де буде вестись робота, опустити створу нижче рівня
обличчя, але не нижче 0.4 м.
Всі роботи, пов'язані з можливістю
виділення вибухопожежонебезпечних пари і газів, повинні проводитьсь у витяжних
шафах і при працюючій припливно-витяжній вентиляції.
При виявленні під час роботи
несправностей на робочому місці, в обладнанні та засобах колективного захисту
зупинити роботу, вимкнути обладнання, прилади. Повідомити про це керівника
робіт та без його вказівки роботу не відновлювати.
Вимоги після закінчення роботи
Вимкнути обладнання, газові пальники,
електроприлади, закрити газ, воду, вимкнути електроенергію. Усунути
вогненебезпечні речовини у сховище. Прибрати робоче місце. Ключі здати
в установлене місце.
При виявленій недоліків в роботі
обладнання та засобах колективного захисту повідомити безпосереднього керівника
робіт чи іншу посадову особу.
Правила електробезпеки
Робота з електроприладами в хімічній лабораторії вимагає
великої уваги і безумовно виконання правил електробезпеки згідно з ДНАОП
0.00-1.21.-98 «Правила безпечної експлантації електроустановок споживачів»:
В хімічній лабораторії слід користуватися електронагрівниками
закритого типу та іншим електричним обладнанням тільки заводського
виготовлення.
Заземлення електрообладнання необхідно виконувати згідно з
ГОСТ 12.1.030-81 ССБП «Електробезпека. Захисне заземлення, занулення».
Вимоги безпеки в екстремальних ситуаціях.
Перша медична допомога.
При ураженні електрострумом потерпілого звільняють від
контакту з електрострумом (якщо це не зроблено раніше). Виключають джерело
електроживлення, а якщо це неможливо, те скидають обірваний провід дерев'яним
сухим ціпком. При зупинці подиху проводять штучне дихання, уводять серцеві і
серцево-судинні засоби ( 0.1% розчин адреналіну ─ 1 мол, кордіамін ─
2 мол, 10% розчин кофеїну ─ 1 мол підшкірно), засоби, що стимулюють подих
( 1% розчин лобелина ─ 1 мол внутрівенно чи повільно внутремишечно).
Накладають стерильну пов'язку на электроопікову рану. Штучне
дихання не припиняють протягом тривалого часу. При зупинці серця ─
непрямий масаж серця, внутрісерцеве введення розчину адреналіну і 10 мол 10%
розчину хлориду кальцію. Госпіталізація. Транспортування лежачи на носилках в
опікове чи хірургічне відділення.
Отруєння лугами. Причини: попадання лужних сполук натрію і
калію, які є у регенеративній речовині, у дихальні шляхи.
Ознаки: неприємний лужний смак у роті, кашель, різка печія
слизових оболонок очей і гортані, біль за грудиною, розширення зіниць, різка
слабість, загальні судоми.
Допомога. Забезпечити потерпілому приплив свіжого повітря,
вивільнити його від одягу, який утруднює дихання, дати понюхати нашатирний
спирт. У разі припинення дихання необхідно проводити штучне дихання.
Опіки шкіри. При опіках І і ІІ ст. слід негайно покласти на
вражене місце примочку зі спиртом, горілкою, одеколоном або слабким розчином
марганцевокислого калію. Спирт та його похідні стримують подальше руйнування
клітини і водночас знезаражують місце ушкодження. При ІІІ-IV ст. на вражені
місця накладають стерильні пов’язки. При великих опіках використовують чисті,
випрасувані простирадла. Потерпілого слід напоїти чаєм або мінеральною водою і
терміново доставити до лікарні.
Перелік негайних заходів при сильних опіках:
. Перевірте дихання і роботу серця. Якщо відсутнє дихання чи
пульс, негайно починайте штучне дихання рот в рот і масаж серця.
. Перевірте, чи не перебуває потерпілий в шоці.
. Негайно опустіть попечену частину тіла на 10 хвилин в чисту
воду. Якщо немає достатньої кількості води, накрийте опік намоченим тампоном.
. Промийте рану водою і зав'яжіть грубою сухою пов'язкою.
Потерпілому можна дати обезболюючі таблетки. Ніколи не змазуйте рану кремом чи
маззю. Вони створять тверду шкірку поверх опіку, яка може відкрити рану.
Використовуйте дезинфікуючі розчини: фурациліну і перманганату калію (1:5000),
3─4 рази в день.
При важких опіках ковток гарячої кави чи чаю допоможе
відновити втрачену рідину і заспокоїть потерпілого.
Охорона праці являє собою систему законодавчих актів,
соціально ─ економічних, організаційних, технічних і
лікувально-профілактичних заходів та засобів, що забезпечують безпеку,
збереження здоров'я і працездатності людини в процесі праці.
Вимоги пожежної безпеки (послідовність дій під час виникнення
пожежі)
Забезпечення пожежної безпеки в лабораторії визначається
«Правилами пожежної безпеки в Україні»:
В лабораторії повинні бути справні первинні засоби
пожежогасіння:
─ вогнегасники вуглекислотні, пінні або порошкові, які
розміщують безпосередньо в лабораторії;
─ ящик або відро з піском (об’ємом близько 0,01 м2) і
совком;
─ покривало з вогнетривкого матеріалу. До них
обов’язково необхідно забезпечити вільний доступ.
Загорання в лабораторії слід відразу ліквідувати. У разі
пожежі необхідно:
─ повідомити пожежну охорону;
─ вжити заходів щодо евакуації людей з приміщення;
─ вимкнути електромережу.
Техніка безпеки під час роботи на ПК
Розпочинаючи працювати на ПК, необхідно пам`ятати, що це дуже
складна апаратура, яка потребує акуратного й обережного ставлення до неї,
високої самодисципліни на всіх етапах її експлуатації.
Забороняється:
порушувати порядок увімкнення й вимикання апаратних блоків;
класти на апаратуру сторонні предмети;
працювати на комп`ютері у вологому одязі та вологими руками;
палити в приміщенні, де знаходяться комп`ютери.
Перед початком роботи на комп`ютері необхідно отримати дозвіл
на роботу в уповноважених осіб педагогічно-лаборантського складу. Під час
роботи на комп`ютері необхідно:
суворо дотримуватися інструкції з експлуатації
апаратури;
працювати на клавіатурі чистими сухими руками, не
натискуючи на клавіші без потреби чи навмання;
працюючи з дискетами, оберігати їх від ударів, дії
магнітного поля й тепла, правильно вставляти дискети в дисковод;
коректно завершувати роботу з тим чи іншим
програмним засобом.
У разі появи запаху горілого, самовільного вимикання
апаратури, незвичних звуків треба негайно повідомити про це обслуговуючий
персонал та вимкнути комп`ютер. Не можна працювати на комп`ютері при
недостатньому освітленні, високому рівні шуму тощо.
Під час роботи комп`ютера екран дисплея є джерелом
електромагнітного випромінювання, яке руйнує зір, викликає втому, знижує
працездатність. Через це треба, щоб очі користувача знаходилися на відстані 60
- 70 см від екрана, а безперервна робота за комп`ютером тривала не більше 25
хв. для дітей та 40 - 45 хв. для дорослих.
Напруга живлення ПК (220 В) є небезпечною для життя людини.
Через це в конструкції блоків комп'ютера, міжблочних з'єднувальних кабелів
передбачена достатньо надійна ізоляція від струмопровідних ділянок.
Користувач практично має справу лише з декількома вимикачами живлення і,
здавалось би, застрахований від ураження електричним струмом. Однак в
практичній роботі можуть зустрічатись непередбачені ситуації, і щоб вони не
стали небезпечними для користувача, необхідно знати та чітко виконувати ряд
правил техніки безпеки.
Особливо уважним треба бути при
роботі з дисплеєм, електронно-променева трубка якого використовує високу
напругу і є джерелом електромагнітного випромінювання. Неправильне поводження з
дисплеєм та іншою електронною апаратурою може призвести до тяжких уражень
електричним струмом, спричинити загоряння апаратури [37-42].
ВИСНОВКИ
1. Проаналізовано літературні джерела на предмет синтезу та реакційної здібності
4-хлоро-2-метилхінолінів.
2. Проведені квантово-хімічні розрахунки
похідних хіноліну. Результати показали, що введення атома Хлору в 4 положення
гетероциклу призводить до посилення нуклеофільних властивостей.
3. Визначено фізико-хімічні показники
деяких 4-заміщених
2-метилхінолінів: теоретично (за допомогою програмного забезпеченняlog P, log D, logS; теоретичні
спектри) та експериментально (температура плавлення, Rf).
4. Реакцією нуклеофільного заміщення
отримано пірроло[1,2-a]хінолін, основою для якого став
2-метилзаміщений4-хлорохінолін
ПЕРЕЛІК ПОСИЛАНЬ
1. Куценко С.А.Основы токсикологии/ С.А.Куценко- М.: Фолиант, 2004. - 570 с.
2. Cеверин Е.С.
Биохимия:учеб. для вузов / Е.С. Северин- М.: Геотар-мед, 2004.- 784 с.
3. ShriverD.F. Inorganicchemistry / D.F.Shriver, P.W.Atkins,
. C.H.Langford- Oxford: OxfordUniversityPress,
cop. 1994.- 819 p.
5. Лабенська І.Б. Біологічна
активність S-гетерилзаміщених
6. L-ацетилцистеїну /
І.Б.Лабенська, Л.О.Омельянчик, О.А.Бражко // Зб. наук. статей «Актуальні
питання фармацевтичної та медичної науки та практики».− 2006.− Вип.
XV, Т. 3.− С.
596.
. Омельянчик Л.О. Пошук
біорегуляторів з антиоксидантною дією серед S-похідних 4-меркаптохінолінів /
Л.О.Омельянчик, Д.М.Федоряк, О.А.Бражко // Ukrainica Bioorganica Acta. -
2007. - № 2. -
С. 17-24.
. Бауер К. Анализ органических
соединений / К.Бауер - 2-е изд.- М.: ИЛ, 1953.- С. 276-277.
. Workman J. Handbook of organic compounds: NIR, IR, Raman,
and UV-vis spectra featuring polymers and surfactants / J.
Workman.- SanDiegoetc.: Academic Press, 2000.- 1493 p.
. Хиккинботтом В. Реакции органических
соединений/Пер. с англ. А.Берлина, Я.Коммисарова -М.: Гонти, 1939. - 400
с.
11. Евсеев А.В. Комплексные соединения L-цистеина с биометаллами
как факторы самозащиты биологических систем/А.В.Евсеев, В.Л.Ковалёва,
И.А.Крылов //Бюллетень экспериментальной биологии и медицины.- 2006.- Т. 142, №
7.- С. 26-30.
. Овчинников М.М. Новая супрамолекулярная
система из наноразмерных фрактальных кластеров - L-цистеин-серебряный
раствор
13. /М.М.Овчинников, С.Д.Хижняк, П.М.Пахомов
// Второй Международный форум по нанотехнологиям.-Москва, 2009. - С. 37.
14. Куна П.Н. Химическая радиозащита: монография / П.Н. Куна. - М.: Медицина, 1989. -
193 с.
15. Клячкина И.Л. Муколитический
препарат N-ацетил-L-цистеин .
Л. Клячкина // Справочник поликлинического
врача. - 2008. - №4. -
С. 38-42.
16. Петруша Ю.Ю. Біологічна активність деяких S-гетерилзаміщених L-цистеїну та їх аналогів
/Ю.Ю.Петруша, Л.О.Омельянчик, О.А.Бражко, Завгородній М.П.// UkrainicaBioorganicaActa. - 2012. - № 1. - С. 46-52.
17. Соловьева М.Е. Прооксидантное и
цитотоксическое действие
18. N-ацетилцистеина и глутатиона в
сочетании с витамином B12b / М.Е.Соловьева, В.В.Соловьев,
А.А.Фасхугдинова // Цитология.- 2007.- Т. 49, № 1.- С. 71-78.
. Чичибабин А.Е. Основные начала органической
химии
. / А.Е. Чичибабин. - М.: Госхимииздат, 1957.- Т.
2. - 767 с.
21. Терней А. Современная органическая
химия. В 2-х томах.
. / А.Терней. - М.: Мир, 1981. -Т. 2.- 655 с.
. Нейланд О.Я. Органическая химия / О.Я. Нейланд. - М.: Высшая школа, 1990.
-751 с.
24. Киселев Ю.М. Химия координационных
соединений
25. / Ю.М. Киселев -М.: Интеграл-Пресс, 2008.
- 728с.
26. Харитонов Ю.Я. Комплексные соединения/ Ю.Я. Харитонов
27. // Соросовский образовательный журнал.-
1996.- № 1.- С. 48-56.
28. Основы аналитической химии: учебник
для вузов. / Под ред.
29. Ю.А. Золотова. - М.: Высшая школа,
2004.- 503 с.
. Васильев В.П.Аналитическая химия:
учебник для химико-технол. спец. Вузов / В.П. Васильев. - М.: Высшая школа,
2006. - 775 с.
31. Азизов М.А. О комплексных
соединениях некоторых микроэлементов с биоактивными веществами / М.А. Азизов. -
Ташкент: Медицина, 1969.-199 с.
32. Разделение смесей изомерных
N-алкил-3-нитро-1,2,4-триазолов путем комплексообразования / ГригорьевЮ.В.,
ДегтярикМ.М.,
33. ИвашкевичО.А., Григорьева И.М. //
Свиридовские чтения: сб. ст. Вып. 8. - Минск, 2012. - С. 189-194.
34. Нейковский С.И. Изучение взаимодействия
азот-, кислород- и серосодержащих производных пропионовой кислоты с некоторыми
переходными металлами /С.И.Нейковский, Е.А.Горенич // Журн. неорган. химии.-1997.-Т.42.-№7.-С.1214-1216.
35. Нейковский С.И., Строение и свойства
новых лигандов на основе производных пропионовой кислоты / С.И.Нейковский,
В.В.Алябьева
36. // Изв. вузов «Химия и хим. технология».-1997.-Т.40.-№1.-С.93-96.
. Фармацевтична хімія. Навч. посіб.
для студ. вищ. фарм. навч.закл. ІІІ-ІV рівнів акредитації / За заг. ред. П.О.
Безуглого. - Вінниця: Нова книга, 2008. - 560 с.
. ЛабенськаІ.Б. Синтез і
антирадикальна активність
. 6(8)-функціонально заміщених
N-ацил-S-(2-фенілхінолін-4-іл)-L-цистеїнів
. / ЛабенськаІ.Б., ОмельянчикЛ.О.,
БражкоО.А., Петруша Ю.Ю. // Ukrainica Bioorganica Acta. - 2008. - № 2. - С.
50-55.
. Продукты химические органические.
Методы определения интервала температуры плавления: ГОСТ 18995.3-73. -
[Действующий от 01.07.74].- М.: Министерство химической промышленности СССР, 1974. - 14с.
. Органикум в 2-х т.: Пер. с нем.,
4-е изд.- М.:Мир, 2008. - Т. 1. - 504 с.
43. Реактивы. Метод тонкослойной
хроматографии: ГОСТ 28366-89. - [Действующий от 01.01.91].- М.: Стандартинформ,
2008.- 8 с.
44. Колесник И.В. Инфракрасная
спектроскопия. Методическая разработка / И.В. Колесник, Н.А. Саполетова.- М.: Изд-во МГУ, 2011.- 88 с.
45. Губський Ю.І.Методи оцінки антиоксидантних
властивостей фізіологічно активних сполук при ініціюванні вільно радикальних
процесів у дослідах in vitro / ГубськийЮ.І., ДунаєвВ.В., Бєленічев І.Ф. та ін.:
Метод. рекомендації. - К.: ДФЦ МОЗ України, 2002. - 26 с.
46. Краснокутская Е.А. Спектральные методы исследования в
органической химии. Электронная и инфракрасная спектроскопия. Ч.2
47. / КраснокутскаяЕ.А., ФилимоновВ.Д.. - Томск:
Издательство Томского политехнического университета, 2010. - С. 9-10.
. Каратаева Ф.Х. Спектроскопия ЯМР в органической
химии. Общая теория ЯМР. Химические здвиги 1Н и 13С.Ч.1 /
Ф.Х. Каратаева, В.В. Клочков. - Казань, Казанский федеральный университет,
2012. - С. 6-8, 13-15.
49. Органикум в 2-х т.: Пер. с нем.,
4-е изд.- М.:Мир, 2008. - Т. 2 - 488 с.
. / В.І.Генчева // Вісник Запорізького
національного університету. - 2013. - № 3. - С.173-178.
52. Савчук О.М. Конспект лекцій з дисципліни “Основи
охорони праці” В 2-х ч. - Запоріжжя: Просвіта, 2000. - 124 с.
. Внутрішній контроль охорони праці в навчальних
закладах // Все для вчителя. - 1999. - № 5. - С. 8-11.
. Васильчук М.В. Основи охорони праці. - К, 1997. -
207 с.
. Каталог основних засобів забезпечення пожежної
безпеки. - К., 1997. - 259 с.
. Трахтенберг І.М., Коршун М.М., Чебанова О.В. Гігієна
праці та виробнича санітарія. - К., 1997. - 462 с.
. Науково-практичний коментар до Закону України “Про
охорону праці”. - К., 1997. - 528 с.