Синтез 3',6'-дигидрокси-3-оксо-спиро[изобензофуран-1(3H),9'-[9H]ксантен]-4'-карбоксальдегида
Введение
Производные флуоресцеина нашли широкое
применение в различных областях человеческой жизнедеятельности: от
флуоресцирующего красителя применяемого в промышленности для поиска различных
утечек в трубопроводах, до флуоресцирующей метки, которую позволяет отслеживать
пути различных биологических соединений или лекарств. Также флуоресцин нашел
широкое применение в спектроскопии.
Флуоресцеин открыт достаточно давно, и его химия
изучена достаточно хорошо. Но химия моно и бисформильных производных флуоресцеина
начала развиваться сравнительно недавно. Но данные производные имеют большие
перспективы, так как формальдегидная группа позволяет прикреплять различные
производные флуоресцеина к огромному спектру соединений, в частности к
некоторым биологическим интермедиатам, которые можно впоследствии отследить с
помощью флуоресценцентных методов анализа.
На данный момент существует несколько путей
получение формильного производного, а для наших целей был выбран методом
прямого формилирования фенолов в орто положение по Раймеру-Тиману.
В итоге, целью данной курсовой работы является
синтез 3',6'-дигидрокси-3-оксо-спиро[изобензофуран-1(3H),9'-[9H]ксантен]-4'-карбоксальдегида,
который является перспективным соединением для последующих научных изысков.
Сопутствующей целью данной курсовой работы является отработка методики его
получения.
. Обзор литературных данных
.1 Введение
Анализ литературы показывает, что область
синтеза и применения формильных производных флуоресцеина начала развиваться
сравнительно недавно. В данном обзоре будут рассмотрены наиболее популярные
методы формилирования фенолов, а также в отдельности будет рассмотрено
формилирование по Раймеру-Тиману.
.2 Флуоресцеин и его производные
Впервые флуоресцеин был получен Адольфом фон
Байером по реакции Фридаля-Крафтса между фталевым ангидридом с резорцином в
присутствии хлорида цинка при нагревании.
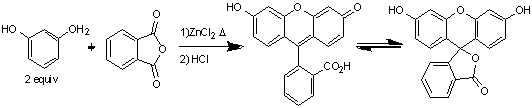
Схема 1
Также вместо хлорида цинка
используют метансульфоновуюкислоту. Данная замена позволяет добиться более
высоких выходов в более мягких условиях.
Механизм реакции Фридаля-Крафтса:
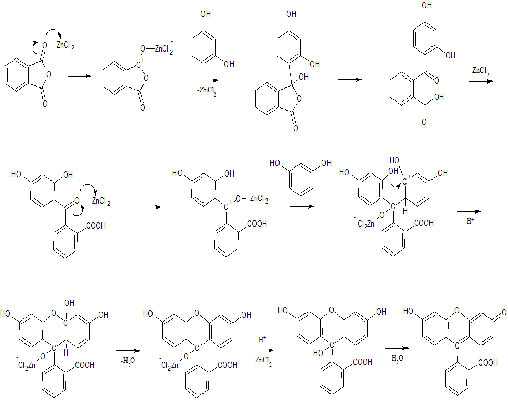
Химические свойства флуоресцеина:
Флуоресцеин представляет собой
полициклическую гетероатомную ароматическую систему, с гидроксильными группами
в 3`,6` положениях, а также в 9` положении, в случае депротонированной формы,
находиться фрагмент бензойной кислоты, с карбоксильной группой в
орто-положении.
В флуоресцеине три ароматических
кольца, два из которых симметричны относительно друг друга, по строению
электронный плотности (активированы гидроксильными группами), и одно
дезактивированное карбонильной группой. По-этому, все реакции электрофильного
присоединения происходят в первую очередь по двум активным кольцам
флуоресцеина,а точнее в орто-положения (2`,4`,5`,7`) относительно гидроксильных
групп. В следствии эквивалентности данных колец, возникают сложности с синтезом
несимметричных производных, которые решаются либо путём сборки несимметричного
флуоресцеина, либо специфическими реакциями.
.3 Формилирование фенолов
В основном формильные производные
фенолов получают косвенными путями. Например, в случае получения 4`,5`
замещенного флуоресцеина есть два варианта. Первый, в случае уже замещенных
2`,7` положений, можно воспользоваться реакцией Манниха [1] (схема 2), с
последующим моногалогенированием введенных атомов углерода и окислением их с
помощью диметилсульфоксида (схема 3).

Схема 2

Схема 3
Второй вариант, сборка флуоресцеина
с изначально введенными метилами (схема 4). Например, с помощью метил
резорцина, с последующим моногалогенированием и окислением с помощью
диметилсульфоксида[1].
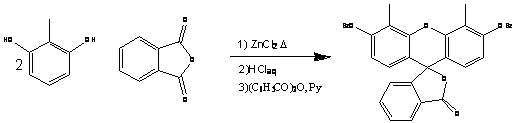
Схема 4
Но у данного метода, есть
существенный недостаток - сложность получения несимметричных формильных
производных флуоресцеина, как непосредственно при сборке, так и в случае
введение заместителей.
Есть также прямые способы, например
формилирование по Вильсмайер-Хааку [2] (схема 5) и по Раймеру-Тиману [3] (схема
6). Данные способы не отличаются высокой селективностью, и зачистую
используются для формилирования простейших субстратов.
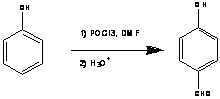
Схема 5
.4 Формилирование по Раймеру-Тиману

Схема 6
Данный метод формилирования не слишком широко
распространен, из-за своей низкой эффективности, а также посредственной
селективности, поскольку механизм реакции включает образование дихлоркарбена
как интермедиата[4]. Дихлоркарбен : CCl2 выполняет роль электрофильного агента
по отношению к феноксид-иону, образующемуся в щелочной среде. Предполагаемый
механизм реакции Реймера-Тимана для флуоресцеина может быть представлен
следующей последовательностью превращений (схема 8).
Также столь низкие выходы объясняются различными
побочными реакциями[4] (схема 7), например: образование дихлорметилового эфира
фенола, образующемуся в результате атаки дихлоркарбена по кислородному атому
фенолят-иона, который в свою очередь нацело гидролизуется в щелочной среде .
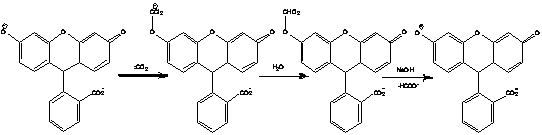
Схема 7
А также большая часть дихлоркарбена
гидролизуется в водной щелочи с образованием NaCl и СО
соответственно.
Предположительный механизм реакции
формилирования [5]:

Схема 8
Синтез
(3',6'-дигидрокси-3-оксо-спиро[изобензофуран-1(3H),9'-[9H]ксантен]-4'-карбоксальдегида)
Общая часть
Схемы реакций:
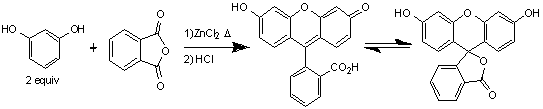
Схема 1
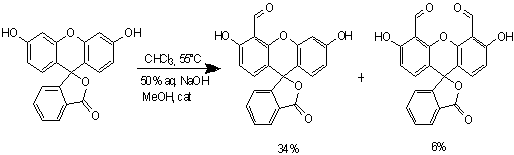
Схема 9
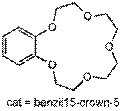
флуоресцеин фенол формилирование
анализ
Для первой стадии - синтеза
флуоресцеина, была выбрана данная методика[6].
Для второй стадии - формилирования
флуоресцеина, была выбрана методика описанная в данной статье[7].
Первая стадия представляет собой
двойное ацилирование ароматического субстрата по Фриделю-Крафтсу. В нашем
случае обезвоженные реагенты смешивались в пропорция описаныз в методике, и
нагревались на песчаной бане в течение нескольких часов. Поскольку вода из исходников
не была удалена полностью, то в результате её присутствия выход реакции первой
стадии снизился. Далее вещество было отфильтровано, промыто и высушено. После
чего часть вещества первой стадии была взята для проведения второй стадии.
Вторая стадия представляет собой
орто-формилирование фенола по Раймеру-Тиману. Смешав реагенты и добавив краун
эфир в каталитических количествах, нагрели смесь и оставили на несколько часов.
По прошествии 5 часов, реакционная масса была охлаждена и обработана кислотой,
в результате чего наблюдали выпадение темно-красного очень вязкой массы и
желтого осадка. Предположительно темно-красная масса - исходный флуоресцеин, не
вступивший в реакцию, а желтый осадок -целевые продукты. Данное предположение
подкреплялось ТСХ раствором данных осадков в метаноле и исходного флуоресцеина.
Третья стадия - длительная обработка
и разделение данной смеси веществ. Первоначальное измельчение и обработка
кислтой с последующим фильтрованием. Далее реакционная масса обрабатывалась
смесью EtOAc и CHCl3 в соотношении 1:4 (соотношение взято из стать [7]) и
разделялась путем хромотографирования на колонке с силикагелем. Первоначально
наблюдалось разделение на три продукта. После сбора различного количества
фракций было обнаружено, с помощью ТСХ, что разделение не полное и удалось
отделить лишь бис-формильное производное. Было проведено повторное разделение
смесью EtOAc и CHCl3 в соотношении 1:6. В итоге вещества удалось разделить.
. Экспериментальная часть
Для синтеза в качестве исходных
соединений и реагентов использовали:
Фталиевый ангидрид
Резорцин
Цинк хлористый
Соляная кислота концентрированная
Хлороформ
Бензил15-краун-5
Едкий натр
Метанол
Этилацетат
Методики стадий синтеза:
Флуоресцеин: Предварительно нагревал хлорид
цинка на пламени спиртовки для удаления воды. После прекращения выделения газа,
хлорид цинка остудил и измельчил. Далее тщательно растирал в ступке смесь
фталевого ангидрида (7.51 г, 0.0507моль) с резорцином(11.50 г, 0.1044 моль) до
мелкодисперсного состояния и перенес данную смесь в жестяную банку. Нагревал
смесь на песчаной бане при 200С. Когда смесь расплавилась, наблюдали
образование желто-зеленого плава. Далее при перемешивании, небольшими порциями,
вносил хлорид цинка(5.01г, 0,0368 моль), предварительно измельченный в порошок.
Наблюдал изменения окраски плава на темно-бардовую. Затем температуру бани
поднял до 210С и нагревал в течение 5 часов. Плав в течение этого
времени постепенно густел, пока не стал твердым. Охлажденный хрупкий плав
извлек из банки, отскребая его от стенок стеклянной палочкой, тонко измельчил и
кипятил в течении 10 мин в фарфоровой чашке с 20 мл 3%-ной соляной кислоты.
Флуоресцеин отфильтровал от водного раствора, и промывал водой до тех пор, пока
фильтрат не показал рН=5 и оставил сушиться. (Выход 9.24г 54.84%).

Флуоресцеин (5г 15ммоль) и 6 мл метанола
поместил в 100мл трехгорлую колбу. Далее добавил 13.15мл 50% водный раствор
NaOH, 4.85мл (30ммоль) CHCl3 и 0.06 мл бензил15-краун-5 эфира. Собрали
установку и осторожно, при перемешивании, нагрели до 52°С. Оставили
перемешиваться реакционную массу при данной температуре в течение 5 часов. По
прошествии данного времени, охладили данную реакционную массу и добавили 25 мл
10М H2SO4. В
результате подкисления продукт выпадает в осадок. Далее осадок фильтруют и
сушат под вакуумом.
Выделение 3',6'-дигидрокси-3-оксо-спиро[изобензофуран-1(3H),9'-[9H]ксантен]-4'-карбоксальдегида:
Высушенные осадок измельчаил и хромотографировал на силикагеле. Элюент - смесь
EtOAc/CHCl3 = 1:4. В
процессе хромотографии наблюдали образование двух фронтов. Одного с однородной
структурой (предположительно между бис и моно производным) и размытым
(монопроизводное и исходник). В результате после сбора целевой фракции, по ТСХ
показала недостаточное разделение исходника и целевого соединения. Провели
повторную хромотографию. Элюент - смесь EtOAc/CHCl3
= 1:6.В результате получили желтые кристаллы биспроизводного (159мг ηтеор=2.73%
ηпрак=45.49%)
и белые кристаллы монопроизводного (666мг ηтеор=12,33%
ηпрак=36.13%)
. Результаты и обсуждения
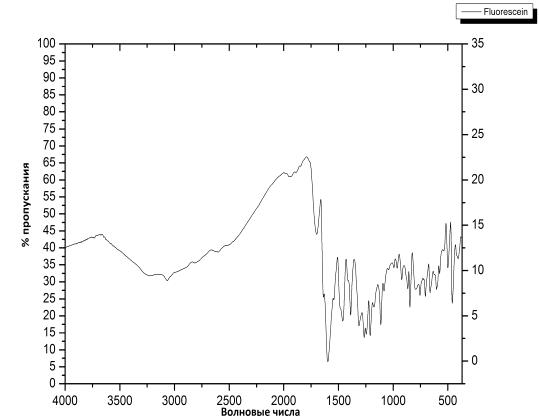
Флуоресцеин был характеризован спектром 1Н ЯМР (DMSO-d6,
250 МГц, δ, м.д)и ИК спектром (KBr,
см-1 ). В следствии таутомерного равновесия протоны под номером 4 и 9,
практически на дают видимых пиков на ЯМР.
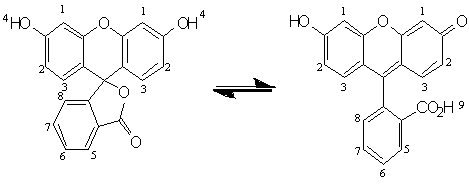
Литературный спектр №1[8]
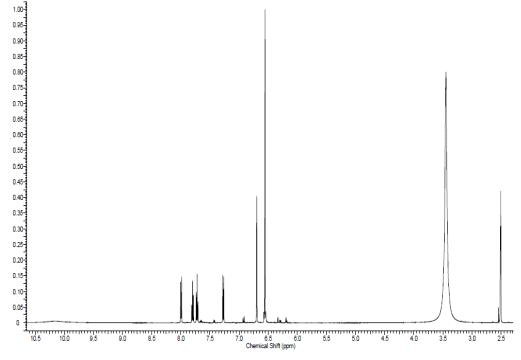
"Экспериментальный
спектр №2"
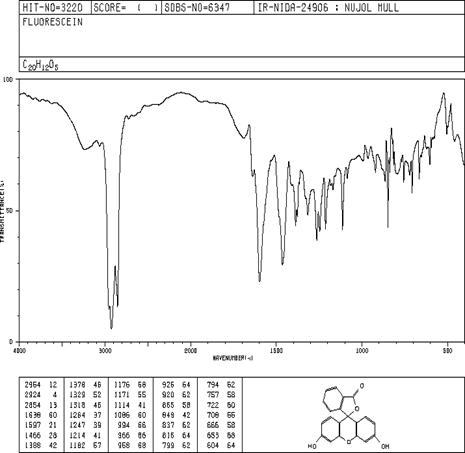
Литературный спектр №3 [8]
Экспериментальный спектр №4
В результате мы можем наблюдать
хорошее совпадение ИК-спектра с литературными данными, а также 1Н ЯМР спектра.
В экспериментальном спектре присутствуют полосы в районе 3.5 м.д. и 2.5м.д.
Поскольку, флуоресцеин продукт промежуточной стадии, то именно поэтому его не
подвергали дополнительной отчистке.
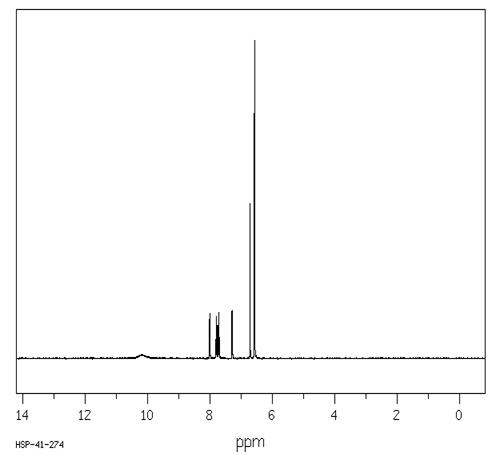
Моноформильное производное:
Литературный спектр был взять из
статьи [7]:
Спектр ЯМР 1H
(DMSO-d6,
250 MГц, δ,
м.д.): 6.60 (2H, с), 6.68 (1H,
д, J= 8.9 Гц), 6.84 (1H,
с), 6.92 (1H, д, J
= 8.9 Гц), 7.29(1H, д, J
=7.5 Hz), 7.69 (1H,
м, J = 1.1, 7.5 Гц),
7.77 (1H, m,
J =1.1, 7.5 Гц),
7.99 (1H, д, J=
7.5 Гц), 10.26 (1H,с), 10.62
(1H, с),11.87 (1H, с).
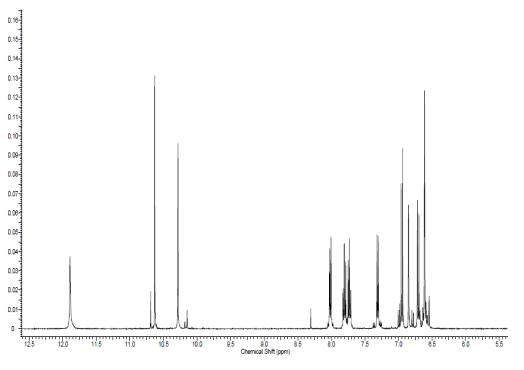
Экспериментальный спектр №5
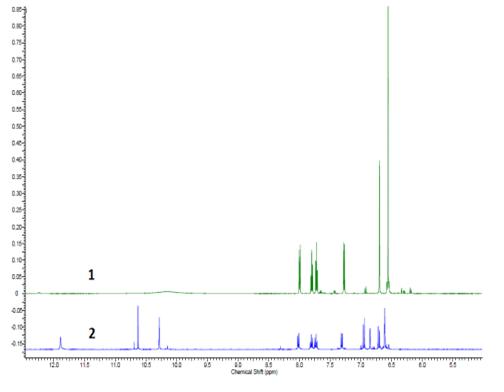
Наложение 1Н ЯМР спектров №2 (1) и №5 (2)
Вывод
В ходе курсовой работы синтезировано соединение
3',6'-дигидрокси-3-оксо-спиро[изобензофуран-1(3H),9'-[9H]ксантен]-4'-карбоксальдегида
с выходом 6.76%. Суммарный выход по литературным данным 34% Уменьшение выхода
связано С недостаточным удалением воды из исходников первой стадии, а так же с
потерями на стадии отчистки, из-за недостатка литературных данных, касающихся
данного этапа синтеза. Индивидуальность и чистота всех полученных соединений
была доказана с помощью спектров ЯМР 1Н и ИК. Для целевого
соединения
индивидуальность
была
доказана
1Н
ЯМР.
Цитируемая литература
[1]
Shawn C. Burdette,§ Grant K. Walkup,† Bernhard Spingler,§ Roger Y. Tsien,†,‡
and Stephen J. Lippard*,§ Fluorescent Sensors for Zn2+ Based on a Fluorescein
Platform: Synthesis, Properties and Intracellular Distribution J. Am. Chem.
Soc. 2001, 123, 7831-7841
[2]
Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro, Jr. NAME REACTIONS AND
REAGENTS IN ORGANIC SYNTHESIS Second Edition page 668-669
[3]Bradford
P. Mundy, Michael G. Ellerd, Frank G. Favaloro, Jr. NAME REACTIONS AND REAGENTS
IN ORGANIC SYNTHESIS Second Edition page 546-547
[4]
Курц А.Л., Ливанцов М.В,, Ливанцова Л.И. "Фенолы и хиноны" Москва
1996.
[5]
Wynberg, Hans (1991). "The Reimer-Tiemann Reaction". Comprehensive
Organic Synthesis
2
(Part
2): 769-775.
[6]
Лукашев Н.В., Дайнеко В.И., Казеннова Н.Б. Методические разработки к
практическим работам по органической химии для школ с углубленным изучением
химии.М.: МГУ, ХимФак, 1986 - 56 стр.
[7]
Weihua Wang, Oleksandr Rusin,* Xiangyang Xu, Kyu Kwang Kim,Jorge O. Escobedo,
Sayo O. Fakayode, Kristin A. Fletcher, Mark Lowry,Corin M. Schowalter, Candace
M. Lawrence, Frank R. Fronczek, Isiah M. Warner, and Robert M. Strongin*(2005)
"Detection of Homocysteine and Cysteine" Journal of the American
Chemical Society
[8]
http://sdbs.db.aist.go.jp/sdbs/cgi-bin/direct_frame_disp.cgi?sdbsno=6347