Оптимизация методик определения концентрации железа (III) в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах
Федеральное
государственное бюджетное образовательное
учреждение
высшего профессионального образования
«МОРДОВСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ им. Н. П. ОГАРЁВА»
Институт
физики и химии
Кафедра
общей физики
БАКАЛАВРСКАЯ
РАБОТА
Оптимизация
методик определения концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах
Автор бакалаврской
работы 16.06.2015 И.А. Юрлов
Направление
04.03.02 химия физика и механика материалов
Руководитель работы
д-р физ.-мат. наук,
доцент 16.06.2015 П.А. Рябочкина
Нормоконтролер
канд., физ.-мат.
наук, доцент 16.06.2015 С.А. Журин
Саранск
2015
Реферат
Выпускная квалификационная работа содержит 47т
страниц, 13 рисунков, 10 таблиц, 28 использованных источников.
Перечень ключевых слов:
ПОЛИЭЛЕКТРОЛИТНЫЕ МИКРОКАПСУЛЫ, МАГНИТОУПРАВЛЯЕМЫЕ ЛИПОСОМЫ, КОНЦЕНТРАЦИЯ
ЖЕЛЕЗА (III),
ЭПР-ЦЕНТРЫ, ЭПР-СПЕКТРОСКОПИЯ, ЭПР-МЕТОД, ФОТОКОЛОРИМЕТРИЧЕСКИЙ МЕТОД, МЕТОД
КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ, БИООБРАЗЕЦ.
Объекты исследования: полиэлектролитные микрокапсулы,
магнитоуправляемые липосомы
Цель работы:
подбор оптимального метода количественного определения железа (III)
в магнетитсодержащих контейнерах для направленной доставки лекарств
(полиэлектролитных микрокапсулах и магнитоуправляемых липосомах).
Методы исследования:
метод комплексонометрического титрования, метод фотоколориметрии, метод
ЭПР-спектроскопии.
Полученные результаты:
показано, что фотоколориметрический метод может считаться оптимальным для
определения концентрации железа (III)
в синтетических образцах полиэлектролитных микрокапсул и липосом. Так же
показано, что фотоколориметрический метод может использоваться в качестве
эталонного метода, для калибровки ЭПР-спектрометра по определению концентрации
магнетита. В процессе выполнения настоящей работы предложен метод, дающий
возможность определения концентрации магнетита в биообразцах, содержащих
ионизированное железо, этим методом является ЭПР-спектроскопия.
липосома микрокапсула наночастица
магнетит
Содержание
Введение
1.Литературный
обзор. Характеристика методов определения концентрации химических элементов в
сложных соединениях
1.1
Метод комплексонометрического титрования
.2
Метод фотоколориметрии
.3
Метод электронного парамагнитного резонанса
.
Описание экспериментальных методик определения концентрации железа (III)
в магнитоуправляемых липосомах и полиэлектролитных микрокапсулах
2.1
Методика определения концентрации железа (III)
в магнитоуправляемых липосомах и полиэлектролитных микрокапсулах методом
комплексонометрического титрования
.2
Методика определения концентрации железа (III)
в магнитоуправляемых липосомах и полиэлектролитных микрокапсулах методом
фотоколориметрии
.3
Методика определения концентрации железа (III)
в магнитоуправляемых липосомах и полиэлектролитных микрокапсулах методом ЭПР
.
Результаты определения концентрации железа (III)
и выбор оптимального метода его определения в полиэлектролитных микрокапсулах,
магнитоуправляемых липосомах
3.1
Характеристики полиэлектролитных микрокапсул и магнитоуправляемых липосом содержащие
наночастицы магнетита
.2
Результаты определения концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах методом
комплексонометрического титрования
.3
Результаты определения концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах методом
фотоколориметрии
3.4
Результаты определения концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах методом
ЭПР-спектроскопии
Заключение
Выводы
Список
литературы
Введение
Актуальность проблемы. В настоящее время
ведутся активные поиски путей снижения токсичности и повышения избирательности
лекарственной терапии. Одним из таких путей является создание таргетных форм
лекарств, управляемых с помощью внешних воздействий (постоянное и переменное
электромагнитное поле, ультразвук и др.). Примером данного подхода может
служить магнитоуправляемые лекарственные препараты. Они были предложены в 70-е
годы ХХ века и представляют собой комплекс ферромагнетика и лекарственного
препарата [1]. Такое сочетание может позволить концентрировать лекарство в зоне
патологического очага с помощью постоянного магнита или значимо повышать
локальную температуру путем воздействия СВЧ-излучением. В ранних работах по
магнитоуправляемому транспорту лекарств сообщалось о создании конъюгатов
наночастиц магнетита с лекарственными препаратами. Недостатками таких
конструкций были невысокая «лекарственная емкость» и сложность получения
обратимо диссоциирующих комплексов лекарства и ферромагнетика. В связи с этим,
современные исследования направлены на создание магнитоуправляемых микро- и
наноконтейнеров, в которые инкапсулируется лекарственный препарат. В начале XXI
века были предложены полиэлектролитные микрокапсулы, получаемые по технологии Layer-by-layer,
с инкорпорированными между слоями полимеров наночастицами магнетита [2]. До
настоящего времени для определения концентрации железа в микрокапсулах и других
экспериментальных магнитоуправляемых системах использовались простые, но не
обладающие достаточной точностью методы - гравиметрия и косвенный расчетный
метод [3] и др. Применение микрокапсул in vivo требует более точной их
стандартизации по качественному и количественному составу, в частности - по
массовой концентрации магнетита и/или железа (III).
В связи с этим необходим подбор оптимального метода, позволяющего с достаточной
точностью определять содержание железа (III)
в микрокапсулах. Еще одной важной задачей, возникающей при применении магнитных
микрокапсул in vivo, является необходимость их идентификации в биосредах,
имеющих в своем составе ионизированное железо (III).
Химические методы в данном случае неприменимы, так как не позволяют
дифференцировать эндогенное и экзогенное железо (III).
Одним из методов, позволяющих идентифицировать магнетит в различных объектах,
является ЭПР-спектроскопия. Однако сообщений о применении этого метода для
количественного определения железа (III)
в биосредах мы не встретили. Данные обстоятельства и послужили основанием для
проведения настоящего исследования.
Цель работы: подбор
оптимального метода количественного определения железа (III)
в магнетитсодержащих контейнерах для направленной доставки лекарств
(полиэлектролитных микрокапсулах и магнитоуправляемых липосомах).
Задачи исследования:
1. Проанализировать применимость
комплексонометрического титрования для определения концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах
. Проанализировать применимость фотоколориметрии
для определения концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах.
. Проанализировать возможность применения метода
ЭПР-спектроскопии для определения концентрации магнетита в синтетических
объектах и биологических средах.
4. Провести сравнительный анализ результатов по
определению концентраций железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах данных методов
1. Литературный обзор.
Характеристика методов определения концентрации химических элементов в
сложных соединениях
В последнее время широко применяются лекарства в
виде коллоидов микроскопических капсул и липосом [4,5], которые применяются для
лечения определенных заболеваний. В качестве защиты лекарственных средств от
нежелательного воздействия среды организма применяется полимерное покрытие а
также бислой фосфолипидов, в которых включен магнетит или его аналоги для того,
чтобы можно было доставлять и концентрировать защищенное лекарство в нужной
области. Определение концентрации железа (III),
магнетита в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах
является важнейшей задачей для характеристики препаратов содержащих магнитные
вещества, в качестве агента по доставке и концентрированию лекарственных
средств внутри пораженных, различными заболеваниями, частях тела. Для
определения концентрации железа в препаратах, автором работы был выполнен обзор
соответствующей литературы, выбраны наиболее доступные и простые в плане
подготовки и аппаратуры методы которые будут рассмотрены ниже.
1.1 Метод комплексонометрического
титрования
Метод комплексонометрии основан на реакциях,
которые сопровождаются образованием комплексных соединений катионов с
органическими реактивами - комплексонами. При этом образуются комплексные
соединения, которые называют внутрикомплексными или хелатными комплексными
соединениями. Комплексонами называют органические соединения, представляющие
собой производные аминополикарбоновых кислот [6,7]. к таким кислотам относится
этилендиаминтетрауксусная кислота (ЭДТА).
ЭДТА (ТРИЛОН Б) образует со многими катионами
металлов устойчивые мало диссоциируемые растворимые в воде внутрикомплексные
соли. В комплексах часть связей носит ионный характер, часть -
донорно-акцепторный. ЭДТА с ионами металлов любого заряда образует
четырех-пяти- или шести координационный комплекс с пятичленными циклами. Атом
металла находится в окружении атомов кислорода и атомов азота, находящихся в
цис-положении.
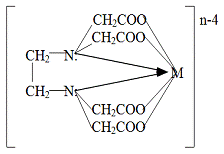
Рис.1.1.1. Структурная формула ЭДТА
В реакциях комплексообразования
реакции между ТРИЛОНОМ Б и ионами металлов протекают стехиометрически в
соотношении 1 : 1. Следовательно, молярная масса эквивалента ЭДТА и
определяемого иона металла равны их молярным массам. При титровании ЭДТА солей
металлов комплексообразователей протекают следующие реакции:
Ме2+ + Н2Y 2-
→ МеY2- + 2 Н+
Ме3+ + Н2Y 2-
→ МеY- + 2 Н+
Из приведенных реакций следует, что
на 1 моль ионов металла, независимо от степени окисления металла, идет 1 моль
ТРИЛОНА Б и освобождается 2 моль ионов водорода. Образующиеся комплексные
соединения различаются лишь по заряду. Ионы водорода понижают рН раствора, в
результате повышения кислотности среды требуемого комплексного соединения может
не получиться [8,9]. Поэтому титрование проводят в буферном растворе,
поддерживающем определенное значение рН. Все это позволяет использовать ЭДТА
для титриметрического определения солей металлов.
.2 Метод фотоколориметрии
По сравнению с другими методами
фотоколориметрический метод является наиболее объективным и дает более точные
данные. Принцип работы фотоколориметра заключается в следующем, световой поток,
проходя через окрашенный раствор, поглощается не полностью. Часть светового
потока, прошедшего через раствор, попадает на фотоэлемент, который преобразует
световую энергию в электрический ток. Возникающий в фотоэлементе ток
регистрируется с помощью микроамперметра [10].
Фотоколориметры предназначены для
измерения оптической плотности растворов в диапазоне 200-900 нм.
Оптическую плотность стандартного и
анализируемого растворов всегда измеряют по отношению к раствору сравнения, или
нулевому раствору. В качестве такого раствора можно использовать раствор,
содержащий все добавляемые реактивы, кроме определяемого вещества. Если же все
компоненты раствора сравнения и добавляемый реагент бесцветны и, следовательно,
не поглощают оптического излучения в видимой части спектра, то в качестве
раствора сравнения можно использовать дистиллированную воду.
Определение концентрации растворов
на фотоколориметрах проводят обычно с помощью градуировочного графика (рис.1.2.1.).
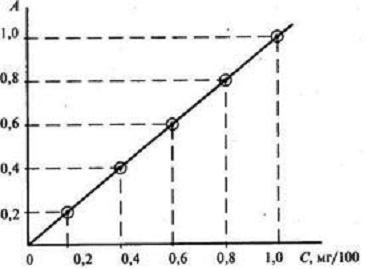
Рис.1.2.1. Пример градуировочного
графика для определения концентрации фотоколориметрическим методом [10]
Градуировочный график отражает связь
между оптической плотностью А и концентрацией С. Оптическую плотность называют
также абсорбцией (А). Для построения градуировочного графика готовят
стандартный раствор, содержащий строго определенное количество исследуемого
вещества. С этой целью точно измеренные объемы исходного стандартного раствора,
содержащего определенную концентрацию исследуемого вещества, переносят в мерные
колбы вместимостью 100 или 50 мл и добавляют соответствующие реактивы,
вызывающие окраску анализируемого раствора. Затем содержимое каждой колбы
доводят дистиллированной водой до метки. Определение оптической плотности
приготовленных стандартных растворов начинают с раствора, окрашенного слабее
других, соответственно этот раствор обладает меньшей концентрацией по сравнению
с другими растворами. По полученным данным строят градуировочный график.
В дальнейшем по градуировочному
графику определяют концентрацию вещества в анализируемом растворе, зная его
оптическую плотность [10].
1.3 Метод электронного
парамагнитного резонанса
Метод ЭПР является основным методом
для изучения парамагнитных частиц присутствующих в биологических системах. К
парамагнитным частицам имеющим важное биологическое значение относятся два
главных типа соединений - это свободные радикалы и металлы переменной
валентности (такие как Fe, Cu, Co, Ni, Mn) или их комплексы. Кроме свободнорадикальных
состояний методом ЭПР исследуют триплетные состояния, возникающие в ходе
фотобиологических процессов [11].
Орбитальное и спиновое движение
электронов лежат в основе существовании у них орбитального и спинового
механических моментов. Магнитный момент электрона складывается в общем случае
из спинового и орбитального магнитных моментов. Однако, в большинстве случаев,
орбитальный магнитный момент равен нулю. Поэтому при обсуждении принципа метода
ЭПР будет рассматриваться только спиновый магнитный момент.
В отсутствие внешнего магнитного
поля магнитные моменты электронов ориентированы случайным образом (рис. 1.3.1.
А), и их энергия практически не отличается друг от друга (Е0). При наложении
внешнего магнитного поля магнитные моменты электронов ориентируются в поле в
зависимости от величины спинового магнитного момента (рис. 1.3.1. Б), и их
энергетический уровень расщепляется на два (рис. 1.3.2.).
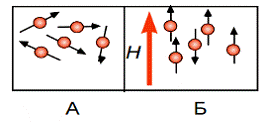
Рис.1.3.1. Ориентация магнитных
моментов электронов А) в отсутствии внешнего магнитного поля Б)во внешнем
магнитном поле Н [11]
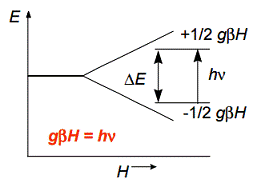
Рис.1.3.2. расщепление
энергетических уровней одиночных электронов в магнитном поле (эффект Зеемана),
где H напряжение
магнитного поля, g коэффициент пропорциональности [11]
Уравнение 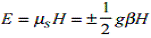 (1)
описывает эффект Зеемана, который заключается в следующем: энергетические
уровни электронов, помещенных в магнитное поле, расщепляются в этом поле в
зависимости от величины спинового магнитного момента и интенсивности магнитного
поля.
(1)
описывает эффект Зеемана, который заключается в следующем: энергетические
уровни электронов, помещенных в магнитное поле, расщепляются в этом поле в
зависимости от величины спинового магнитного момента и интенсивности магнитного
поля.
Основное уравнение резонанса.
Количество электронов, имеющих ту или иную энергию, будет определяться в
соответствии с распределением Больцмана, а именно
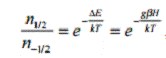 (2)
(2)
где n1 и n2 количество электронов на
более высоком или более низком энергетическом уровне, соответствующем
магнитному моменту электрона со спином +1/2 или -1/2
Если теперь на систему электронов,
находящуюся в магнитном поле, подать электромагнитную энергию, то при
определенных значениях величины энергии падающего кванта будут происходить
переходы электронов между энергетическими уровнями. Необходимым условием
переходов является равенство энергии падающего кванта (hν) разности
энергий между уровнями электронов с различными спинами (gβH).
Уравнение ΔE=hν=gβH выражает
основное условие поглощения энергии электронами. Под влиянием излучения
электроны, находящиеся на более высоком энергетическом уровне, будут испускать
энергию и возвращаться на нижний уровень. Электроны же, находящиеся на нижнем
уровне, будут поглощать энергию и переходить на более высокий энергетический
уровень, это явление называется резонансным поглощением. Поскольку вероятности
одиночных переходов между энергетическими уровнями равны, а общая вероятность
переходов пропорциональна количеству электронов, находящихся на данном
энергетическом уровне, то поглощение энергии будет преобладать над ее
излучением.
Необходимо отметить особое положение
свободных радикалов, то есть молекул, имеющих не спаренные электроны на внешней
электронной орбитали, в распределении электронов по уровням энергии. Если на
орбитали имеется парное количество электронов, то заселенность энергетических
уровней будет одинакова и количество поглощенной энергии электронами будет
равно количеству излученной энергии [12].
Площадь под линией поглощения
образца пропорциональна концентрации парамагнитных частиц в нем. Таким образом,
концентрация парамагнитных центров пропорциональна первому интегралу под линией
поглощения или второму интегралу от спектра ЭПР.
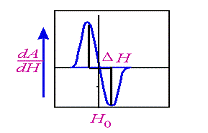
Рис.1.3.3. ЭПР-спектр, первая
производная поглощения амплитуды (А) по магнитному полю (Н) [11]
Для определения концентрации
измеряют площади под кривой поглощения у эталона с известной концентрацией
парамагнитных центров [13] и у измеряемого образца и неизвестную концентрацию
находят из пропорции, при условии, что оба образца имеют одинаковую форму и
объем:
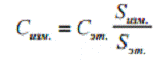 (3)
(3)
2. Описание
экспериментальных методик определения концентрации железа (III) в магнитоуправляемых
липосомах и полиэлектролитных микрокапсулах
В данной работе нами были применены
и апробированы различные методы определения концентрации железа (III) [14,15,16]
в выбранных нами объектах. Методы отличаются друг от друга сложностью
выполнения, а также аппаратной частью. Фотоколориметрический метод заключается
в анализе оптической плотности окрашенного раствора, содержащего неизвестную
концентрацию определяемого вещества. Комплексонометрическое титрование
позволяет определять концентрацию вещества по объему титранта при котором
окраска раствора полностью исчезает, ЭПР-спектроскопия позволяет определять
концентрацию по средством определения площади под кривой спектра поглощения.
следует заметить, что каждый из перечисленных методов имеет определенные
достоинства и недостатки которые будут перечислены ниже.
2.1
Методика определения концентрации железа (III)
в магнитоуправляемых липосомах и полиэлектролитных микрокапсулах методом
комплексонометрического титрования
Для определения концентрации железа (III)
использовали метод комплексонометрического титрования, описанный в [17].
Принцип метода. Метод основан на обесцвечивании
фиолетового раствора сульфосалицилата железа при взаимодействии с ТРИЛОНОМ Б
(ЭДТА).
Реактивы
Сульфосалициловая кислота (C7H6O6Sx2H2O)
ТРИЛОН Б(C10H14O8N2Na2*2H2O)
Вода дистиллированная
Оборудование
Штатив
Бюретка 20мл
дозатор автоматический biohit 1мл
Коническая колба 250мл
Весы аналитические
Методика титрования
Перед анализом необходимо подготовить раствор
ТРИЛОНА Б нужной концентрации и соответственно пробу в которой будет
определяться железо. Раствор ТРИЛОНА Б готовится по формуле Сэ(эдта)=m(навески)/(Мэ(ЭДТА)*Vколбы).
Подробное описание пробоподготовки приведено в [18].
Подготовленную пробу известного объема титруют
до полного обесцвечивания, при этом по каплям приливал из бюретки раствор
ТРИЛОНА Б, энергично перемешивая колбу с образцом. После того как образец
практически полностью обесцветился, определяется объем титранта использованного
для анализа. Затем добавляется еще несколько капель для проверки правильности
анализа. Если образец не изменяет окраску, значит определенный объем титранта
был правильный. Если происходит изменение окраски, значит процедуру нужно было
повторять до того момента, когда изменение цвета образца прекратилось.
Обработка результатов
Расчет концентрации железа (III)
производилось по формулам:
m(Fe(III))
= ((Cэ ∙ Vср)(ТРИЛОНА
Б) ∙ Mэ(Fe)
∙ V(всего исследуемого
раствора)) / (1000 ∙ V(пробы))
C(Fe
в коллоиде магнетита) = m(Fe(III))
/ V(маг. жидкости)
2.2 Методика определения
концентрации железа (III)
в магнитоуправляемых липосомах и полиэлектролитных микрокапсулах методом
фотоколориметрии
Метод основан на взаимодействии ионов железа в
щелочной среде с сульфосалициловой кислотой при этом происходит образование
окрашенного в желтый цвет комплексного соединения [19,20]. Интенсивность
окраски, пропорциональна массовой концентрации железа (III).
Измерения проводили при длине волны 430 нм, так
как на этой длине волны наблюдается максимальное поглощение раствора железа (III),
подготовленного из полиэлектролитных микрокапсул и магнитоуправляемых липосом.
Следует заметить, что на длине волны 430 нм не
наблюдается поглощения самими капсулами и липосомами что свидетельствует о
корректном выборе этой длины волны, для проведения измерений
Реактивы, использованные для
реализации фотоколориметрических измерений
железоаммонийные квасцы 12-водные
кристаллогидраты (FeNH4(SO4)2 x12H2O)
соляная кислота 37% (HCl)
сульфосалициловая кислота (кристаллы (C7H6O6Sx2H2O))
хлорид аммония (кристаллы (NH4Cl))
пероксид водорода 6% (H2O2)
аммиак раствор 1:1 (NH4OH)
вода дистиллированная
Оборудование, использованное для
осуществления спектрофотометрических измерений
спектрофотометр марки shimadzu uv2600
весы аналитические axis
дозатор автоматический biohit 1мл
колбы 50мл
колба 1000мл
колба 25мл
Описание методики пробоподготовки
образцов и проведения спектрофотометрических измерений
1. Приготовление основного
стандартного раствора железоаммонийных квасцов: 0,8636 г железоаммонийных квасцов
(FeNH4(SO4)2×12H 2O)
взвешивали с точностью до 0,0002 г по шкале
<#"876600.files/image009.gif">а) б)
б)
Рис.3.1.1. а) Фотографии взвеси
микрокапсул до обработки концентрированной соляной кислотой рис.3.1.1. б)
фотография капсул после обработки концентрированной соляной кислотой
При добавлении концентрированной
соляной кислоты в суспензию магнитоуправляемых липосом эмульсия расслаивалась
на раствор хлоридов железа и жиры, поскольку липосомы имеют наноразмеры, в
следствии этого не возможно визуально наблюдать их в оптический микроскоп, для
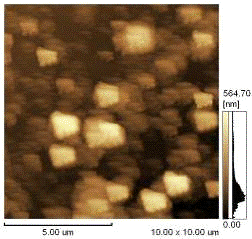
решения этой проблемы был использован метод атомно-силовой микроскопии (АСМ)
рисунок 3.1.2.
 а)
а)  б)
б)
Рис.3.1.2. а) АСМ фотография
образцов липосом до обработки концентрированной соляной кислотой рис.3.1.2. б)
липосомы после добавления концентрированной соляной кислоты
На рисунке 3.1.2 представлены
АСМ-изображения образцов магнитоуправляемых липосом до и после обработки. До
обработки наблюдаются сферические структуры, после обработки концентрированной
соляной кислотой каких либо структур не обнаружено.
Таким образом было установлено, что
обработка концентрированной соляной кислотой позволяет, полностью перевести
наночастицы магнетита в ионизированную форму, концентрация которых в дальнейшем
может быть определенна физико-химическими методами.
3.2 Результаты определения
концентрации железа (III) в
полиэлектролитных микрокапсулах и магнитоуправляемых липосомах методом
комплексонометрического титрования
Специфичность метода характеризуется
точностью определения требуемого аналита в исследуемом объекте. В нашем случае
в исследуемом объекте присутствуют различные компоненты: в частности в
полиэлектролитных микрокапсулах это смесь растворов полимеров, а в
магнитоуправляемых липосомах смесь фосфолипидов. Для определения специфичности
метода, нами был выполнен анализ влияния указанных выше компонентов на
результаты определения железа в исследуемых образцах. Для этой проверки
выполнялись следующие эксперименты. Для полиэлектролитных микрокапсул и липосом
не содержащих наночастицы магнетита (холостая проба), а также полиэлектролитных
микрокапсул, магнитоуправляемых липосом содержащих наночастицы магнетита
(опытный). В холостых пробах при добавлении сульфосалициловой кислоты не
замечено наличие фиолетовой окраски, которая характерна для комплекса
сульфосалицилата железа. В опытных пробах при добавлении к лизату
полиэлектролитных капсул и магнитоуправляемых липосом наблюдалась фиолетовая
окраска. Данный факт специфичен для комплекса железа с сульфосалициловой
кислотой. На основе этого следует вывод о том, что в лизатах образцов
отсутствуют вещества, которые могут вносить погрешность при определении железа
(III).
Так как суспензии полиэлектролитных
микрокапсул и магнитоуправляемых липосом изготавливаются в малых объемах и их
синтез имеет высокую себестоимость, объем исследуемого образца был ограничен и
составлял 0,1мл с синтеза. Оценка нижнего предела количественного определения
железа (III) методом
комплексонометрического титрования проводилась следующим образом: исследовали
стандартные растворы железоаммонийных квасцов (FeNH4(SO4)2
) в концентрациях равных 10мг/л; 100мг/л; 200мг/л. Возможность проведения
титрования оценивали по образованию визуально различимой фиолетовой окраски
результаты исследования представлены в таблице 1.
Таблица 1 Нижний предел
количественного определения титрования
|
Взятая
концентра-ция, мг/л
|
№
Определения
|
Наличие
визуально различимой окраски железа с сульфосалициловой кислотой
|
Объем
титранта, мл
|
Средний
объем, мл
|
Погрешность
|
Относительная
погрешность, %
|
|
10
|
1
|
-
|
-
|
-
|
-
|
-
|
|
2
|
-
|
-
|
|
|
|
|
3
|
-
|
-
|
|
|
|
|
100
|
1
|
Фиолетовая
окраска
|
1,5
|
1,70
|
0,20
|
11,76
|
|
2
|
Фиолетовая
окраска
|
1,7
|
|
|
|
|
3
|
Фиолетовая
окраска
|
1,9
|
|
|
|
|
200
|
1
|
Фиолетовая
окраска
|
2,6
|
2,57
|
0,15
|
5,95
|
|
2
|
Фиолетовая
окраска
|
2,7
|
|
|
|
|
3
|
Фиолетовая
окраска
|
2,4
|
|
|
|
Как видно из таблицы образование визуально
различимой окраски происходило при концентрации железоаммонийных квасцов (FeNH4(SO4)2
) начиная с 100мг/л, эта концентрация была принята за нижний предел
количественного определения. Следует отметить, что относительная погрешность
определения концентрации железа (III)
в области НПКО была выше чем в области других концентраций.
Для проверки гипотезы о линейной зависимости
между объемом титранта и концентрацией железа (III)
в образце было проведено определение железа (III)
в растворах с его известной концентрацией 1)100 мг/л; 2) 200 мг/л; 3) 400 мг/л;
4) 600 мг/л; 5) 800 мг/л; 6)1600 мг/л.
Эксперимент по определению концентрации железа (III)
проводили не менее 3 раз. Рассчитывали среднее значение объема титранта.
Погрешность эксперимента определялась, как стандартное отклонение,
относительную погрешность определяли как отношение стандартного отклонения к
средней величине. Результаты исследования и соответствующие значения
погрешностей представлены в таблице 2.
Таблица 2 Калибровка комплексонометрического
титрования
|
Взятая
концентрация, мг/л
|
№
Определения
|
Объем
титранта, мл
|
Средний
объем, мл
|
Погрешность
|
Относительная
погрешность, %
|
|
100
|
1
|
1,7
|
2,1
|
0,20
|
18,94
|
|
2
|
2,2
|
|
|
|
|
3
|
2,5
|
|
|
|
|
200
|
1
|
4,5
|
4,2
|
0,17
|
4,12
|
|
2
|
4,5
|
|
|
|
|
3
|
4,2
|
|
|
|
|
400
|
1
|
8,3
|
8,3
|
0,20
|
2,40
|
|
2
|
8,5
|
|
|
|
|
3
|
8,1
|
|
|
|
|
600
|
1
|
7,6
|
12,5
|
0,15
|
1,22
|
|
2
|
7,8
|
|
|
|
|
3
|
7,5
|
|
|
|
|
800
|
1
|
16,5
|
16,5
|
0,06
|
0,34
|
|
2
|
16,5
|
|
|
|
|
3
|
16,6
|
|
|
|
|
1600
|
1
|
31,5
|
31,5
|
0,06
|
0,18
|
|
2
|
31,5
|
|
|
|
|
3
|
31,4
|
|
|
|
На рисунке 3.2.1. представлена корреляционная
зависимость объема титранта от концентрации железа (III).
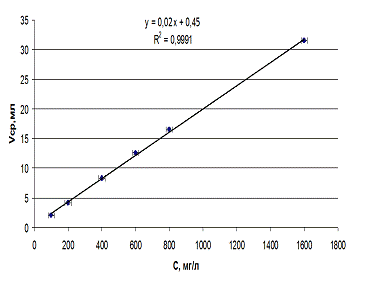
Рис.3.2.1. Калибровочный график для определения
концентрации железа (III)
методом комплексонометрического титрования
Из приведенного на рисунке 7 графика видно, что
в исследуемом диапазоне концентраций эта зависимость линейна. Уравнение
линейной регрессии имеет вид y=0,02x+0,45
коэффициент корреляции R2
= 0,999
Относительная ошибка составляет 0,18-19% в
зависимости от диапазона измеряемых концентраций, она увеличивается в области
малых концентраций. Таким образом метод комплексонометрического титрования
позволяет с достаточной точностью определить железо (III)
в образцах полиэлектролитных микрокапсул и магнитоуправляемых липосом, при условии
если концентрация железа в них превышает 10мг/л.
Выше описанный метод были использованы для
определения концентрации железа (III)
в образцах полиэлектролитных микрокапсул и магнитоуправляемых липосом, для
исследования были предоставлены по три образца полиэлектролитных микрокапсул (в
дальнейшем МК1, МК2, МК3) и три образца магнитоуправляемых липосом(в дальнейшем
Л1, Л2, Л3) синтезированных в разное время. Пробоподготовка взвеси
полиэлектролитных микрокапсул и магнитоуправляемых липосом проводилось по
методике описанной ниже [24] производили следующим образом:
Для выделения железа из полиэлектролитных
микрокапсул и магнитоуправляемых липосом использовали концентрированную соляную
кислоту. Суспензию полиэлектролитных микрокапсул и магнитоуправляемых липосом 1
мл растворяли 1мл 37% HCl.
Многослойные микрокапсулы формируются слабыми полиэлектролитами чувствительными
к pH среды, они
становятся незаряженными, что приводит к разрушению капсулы [25]. В результате
этого капсулы подвергаются деструкции, а освободившийся магнетит растворяется
кислотой с образованием соответствующих солей железа (II,
III). Липосомы под
действием концентрированной соляной кислоты раскрываются, содержащийся в них
магнетит высвобождается, под действием кислоты превращается в. соли железа (II,
III).Образцы,
растворенные в кислоте, необходимо нагреть на водяной бане при температуре
80-900С с добавлением 1мл H2O2
6% для того чтобы все железо перешло в степень окисления (III)
и довести объем до 50 мл.
Результаты определения концентраций железа (III)
в образцах комплексонометрическим титрованием представлены в таблице 3.
Таблица 3 Результаты определения концентрации
железа (III) в образцах
комплексонометрическим титрованием
|
№
|
Vпроб.,мл
|
Vтитр.,мл
|
<V>, мл
|
Погрешность
|
Относительная
погрешность, %
|
mх, мг
|
С(Fe3+), мг/л
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
Мк1
|
10
|
1,6
|
1,53
|
0,06
|
3,76
|
0,13
|
643
|
|
10
|
1,5
|
|
|
|
|
|
|
10
|
1,5
|
|
|
|
|
|
|
Мк2
|
10
|
2,0
|
2,27
|
0,25
|
11,10
|
0,19
|
953
|
|
10
|
2,5
|
|
|
|
|
|
|
10
|
2,3
|
|
|
|
|
|
|
Мк3
|
10
|
2,7
|
2,70
|
0,20
|
7,41
|
0,23
|
1134
|
|
10
|
2,9
|
|
|
|
|
|
|
10
|
2,5
|
|
|
|
|
|
|
Л1
|
10
|
3,9
|
3,93
|
0,06
|
1,46
|
0,33
|
1651
|
|
10
|
3,9
|
|
|
|
|
|
|
10
|
4,0
|
|
|
|
|
|
|
Л2
|
10
|
2,9
|
2,83
|
0,06
|
2,04
|
0,24
|
1191
|
|
10
|
2,8
|
|
|
|
|
|
|
10
|
2,8
|
|
|
|
|
|
|
Л3
|
10
|
0,6
|
0,73
|
0,15
|
20,83
|
0,06
|
|
10
|
0,9
|
|
|
|
|
|
|
10
|
0,7
|
|
|
|
|
|
Из данных таблицы видим, что концентрация железа
(III) в исследуемых
образцах различна и составляет 643мг/л; 953мг/л; 1134мг/л в капсулах и
1651мг/л; 1191мг/л; 305мг/л в липосомах. Относительная погрешность определения
концентраций железа в капсулах и липосомах метода комплексонометрического
титрования составила 4-7% и соответственно 1-21% для липосом.
.3 Результаты определения
концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах методом
фотоколориметрии
Также как и в случае комплексонометрического
титрования на первом этапе была произведена оценка специфичности метода. С
целью проверки были исследованы холостые образцы полиэлектролитных микрокапсул
и липосом, не содержащих магнетит (холостая проба) и образцы с содержанием
наночастиц магнетита (опытный). На рисунке 3.3.1. приведены спектры поглощения
растворенных холостых образцов и образцов с содержанием наночастиц магнетита.
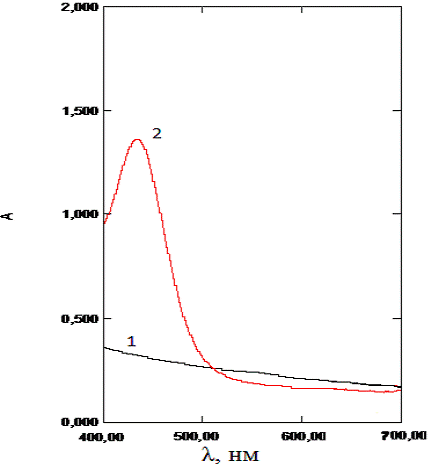
Рис.3.3.1. Спектры поглощения растворенных
пустых капсул (1) линия и растворенных микрокапсул с магнетитом (2)
Отметим, что растворенные липосомы дают такой же
спектр поглощения как и микрокапсулы, при условии что концентрация магнетита в
липосомах равняется концентрации магнетита в капсулах.
На спектрах поглощения растворенных магнетит
содержащих образцов имеется пик поглощения с максимумом в области 430 нм, на
спектрограммах холостых образцов этот пик отсутствует, поэтому в качестве
длинны волны, для определения железа, была выбрана длина волны (λ)=430нм.
В качестве нижнего предела измерений принималась
концентрация железа (III)
в растворе, при определении оптической плотности которого отношение шум/сигнал
равнялось 5. Для оценки НПКО исследовали стандартные растворы квасцов с
известными концентрациями железа 0,01мг/л; 0,1мг/л; 1,0мг/л. Результаты
измерений представлены в таблице 4.
Таблица 4 Нижний предел количественного
определения метода фотоколориметрии
|
Взятая
концентрация, мг/л
|
№
Определения
|
Отношение
шум/сигнал
|
|
0,01
|
1
|
3,4
|
|
2
|
3,8
|
|
3
|
2,6
|
|
0,1
|
1
|
5,7
|
|
2
|
6,3
|
|
3
|
6,5
|
|
1,0
|
1
|
12,4
|
|
2
|
15,8
|
|
3
|
17,2
|
Как видно из таблицы 4 наименьшее концентрация,
при которой отношение шум/сигнал было больше 5, равна 0,1мг/л. Эта концентрация
принималась за нижний предел количественного определения железа (III).
Таким образом чувствительность спектрофотометрического метода была практически
в 1000 раз выше чем у метода комплексонометрического титрования.
Проверка гипотезы о линейной зависимости
оптической плотностью (А) и концентрации железа в образце. Было проведено
определение железа (III)
в растворах с его известной концентрацией. Зависимость оптической плотности (А)
от концентрации железа (III)
в исследуемых образцах на длине волны 430нм показана на рисунке 9
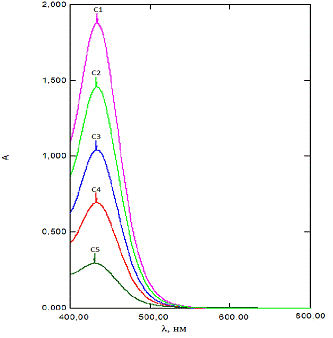
Рис. 3.3.2 Спектры поглощения растворенного
магнетита с различными концентрация ми (С)
Из рисунка 3.3.2. видно, что оптическая
плотность увеличивается при увеличении концентрации.
Построение калибровочной кривой для
фотоколориметрии было описано в параграфе 2.2. В данном разделе приведены
значения оптической плотности калибровочных растворов и метрологические
характеристики для каждой точки. Следует заметить, что определения оптической
плотности для каждого образца производилось не менее трех раз. Далее
рассматривалась средняя оптическая плотность, погрешность эксперимента
определялась как стандартное отклонение. Относительную погрешность определялась
как отношение стандартного отклонения к среднему значению. Результаты измерений
представлены в таблице 5.
Таблица 5 Калибровка для фотоколориметрического
метода
|
Взятая
концентрация, мг/л
|
№
Определения
|
Значение
A
|
Средняя
А
|
Погрешность
|
Относительная
погрешность, %
|
|
0,1
|
1
|
0,0095
|
0,009
|
0,0004
|
4,87
|
|
2
|
0,0110
|
|
|
|
|
3
|
0,0075
|
|
|
|
|
0,2
|
1
|
0,0165
|
0,017
|
0,0008
|
4,69
|
|
2
|
0,0171
|
|
|
|
|
3
|
0,0181
|
|
|
|
|
0,5
|
1
|
0,0471
|
0,045
|
0,0025
|
5,56
|
|
2
|
0,0455
|
|
|
|
|
3
|
0,0422
|
|
|
|
|
1,0
|
1
|
0,0976
|
0,095
|
0,0780
|
8,24
|
|
2
|
0,1012
|
|
|
|
|
3
|
0,0862
|
|
|
|
|
1,5
|
1
|
0,1511
|
0,148
|
0,0030
|
2,02
|
|
2
|
0,1452
|
|
|
|
|
3
|
0,1491
|
|
|
|
|
2,0
|
1
|
0,2038
|
0,196
|
0,0085
|
4,34
|
|
2
|
0,1971
|
|
|
|
|
3
|
0,1869
|
|
|
|
|
2,5
|
1
|
0,2471
|
0,238
|
0,0081
|
3,40
|
|
2
|
0,2363
|
|
|
|
|
3
|
0,2312
|
|
|
|
|
3,0
|
1
|
0,3212
|
0,298
|
0,0229
|
7,67
|
|
2
|
0,2754
|
|
|
|
|
3
|
0,2985
|
|
|
|
|
3,5
|
1
|
0,3511
|
0,343
|
0,0070
|
2,06
|
|
2
|
0,3371
|
|
|
|
|
3
|
0,3422
|
|
|
|
По результатам измерений была построена
калибровочная кривая (рисунок 3.3.3.), по которой в последующем производилось
определение концентрации железа (III)
в исследуемых образцах, уравнение калибровочной кривой имело вид y=0,11x-0,002
коэффициент корреляции R2
= 0,999
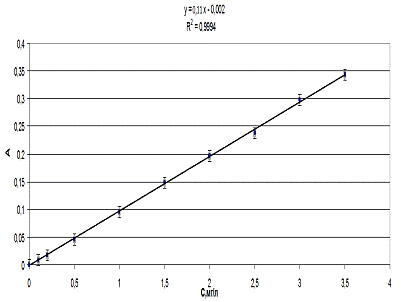
Рис. 3.3.3. Калибровочный график для определения
концентрации железа (III)
фотоколориметрическим методом
На рисунке 3.3.3. представлена корреляционная
зависимость оптической плотности от концентрации железа (III)
относительная ошибка в области НПКО составляет 5%.
Таким образом метод, фотоколориметрии для
определения концентрации железа (III)
оказался более чувствительным и имел меньшую погрешность измерения по сравнению
с методом комплексонометрического титрования. В связи с этим данному методу
было отдано предпочтение при исследовании концентрации железа (III)
в образцах полиэлектролитных микрокапсул и магнитоуправляемых липосом.
Выше описанные методы были использованы для
определения концентрации железа (III)
в образцах полиэлектролитных микрокапсул и магнитоуправляемых липосом, для
исследования были предоставлены по три образца полиэлектролитных микрокапсул (в
дальнейшем МК1, МК2, МК3) и три образца магнитоуправляемых липосом(в дальнейшем
Л1, Л2, Л3) синтезированных в разное время. Пробоподготовка взвеси
полиэлектролитных микрокапсул и магнитоуправляемых липосом по методике,
описанной ниже [26] следующим образом:
Для выделения железа из полиэлектролитных
микрокапсул и магнитоуправляемых липосом использовали концентрированную соляную
кислоту. Суспензию полиэлектролитных микрокапсул и магнитоуправляемых липосом
0,1 мл растворяли 0,1 мл 37% HCl.
Многослойные микрокапсулы формируются слабыми полиэлектролитами чувствительными
к pH среды, они
становятся незаряженными, что приводит к разрушению капсулы [27]. В результате
этого капсулы подвергаются деструкции, а освободившийся магнетит растворяется
кислотой с образованием соответствующих солей железа (II,
III). Липосомы под
действием концентрированной соляной кислоты раскрываются, содержащийся в них
магнетит высвобождается, под действием кислоты превращается в. соли железа (II,
III). Образцы
растворенные в кислоте необходимо нагреть на водяной бане при температуре 80-900С
с добавлением 1мл H2O2
6% для того чтобы все железо перешло в степень окисления (III)
довести объем до 50 мл.
Результаты определения концентраций железа (III)
в образцах фотоколориметрическим методом приведены в таблице 6.
Таблица 6 Результаты определения концентрации
железа (III) в образцах
фотоколориметрическим методом
|
№
|
А
|
<A>
|
Сx(Fe3+), мг/л
|
C(Fе3+),мг/л
|
Погрешность
|
Относительная
погрешность, %
|
|
Мк1
|
0,1021
|
0,10
|
1,20
|
600
|
0,01
|
5,81
|
|
0,0947
|
|
|
|
|
|
|
0,1063
|
|
|
|
|
|
|
МК2
|
0,1461
|
0,14
|
1,62
|
810
|
0,01
|
2,45
|
|
0,1393
|
|
|
|
|
|
|
0,1442
|
|
|
|
|
|
|
Мк3
|
0,2057
|
0,20
|
2,10
|
1050
|
0,01
|
5,12
|
|
0,1976
|
|
|
|
|
|
|
0,1857
|
|
|
|
|
|
|
Л1
|
0,3102
|
0,30
|
3,17
|
1585
|
0,01
|
2,24
|
|
0,2966
|
|
|
|
|
|
|
0,3027
|
|
|
|
|
|
|
Л2
|
0,219
|
0,22
|
2,30
|
1150
|
0,016
|
7,40
|
|
0,220
|
|
|
|
|
|
|
0,221
|
|
|
|
|
|
|
Л3
|
0,048
|
0,05
|
0,53
|
210
|
0,01
|
5,57
|
|
0,049
|
|
|
|
|
|
|
0,500
|
|
|
|
|
|
Из данных таблицы видим, что концентрация железа
(III) в исследуемых
образцах различна и составляет 600мг/л; 810мг/л; 1050мг/л в капсулах и
1585мг/л; 1150мг/л; 210мг/мл в липосомах. Относительная погрешность определения
концентраций железа (III)
в капсулах для фотоколориметрического метода 2-5% в липосомах 2-7%
соответственно.
3.4 Результаты определения
концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах методом
ЭПР-спектроскопии
Химические методы определения концентрации
железа (III) обладают
достаточной точностью и специфичностью в синтетических (искусственных)
объектах. При биомедицинском применении полиэлектролитных микрокапсул и липосом
возникает задача, по изучению их биокинетики и тканевого распределения.
Химические методы в данном случае не пригодны для определения концентрации
железа (III), так как
они не позволяют идентифицировать железо введенное в организм в капсулах,
липосомах и собственное железо присутствующее в организме. Для этой цели
необходим метод с помощью которого можно идентифицировать железо (III),
входящее в состав магнитных наночастиц и ионизированное железо (III)
организма (входящее в состав гемоглобина и миоглобина). В качестве такого
метода был выбран метод электронного парамагнитного резонанса (ЭПР).
Специфичность основана на
возможности достоверно определять магнетит в образцах и достигается путем
использования проб сравнения. В качестве образца сравнения были взяты образцы
донорской крови, в которых была определена концентрация железа методом
фотоколориметрии.
Проводили анализ образцов крови
(холостая проба) и образцов крови с добавлением магнитоуправляемых липосом и
полиэлектролитных микрокапсул (опытный образец). При ЭПР-спектроскопии холостых
образцов крови сигналов характерных для магнетита обнаружено не было. Данные
представлены на рисунке 3.4.1.
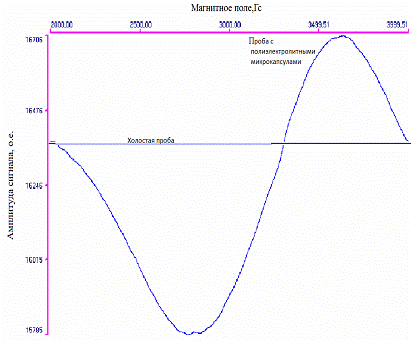
Рис. 3.4.1.ЭПР-спектр поглощения холостой пробы
и пробы с добавлением полиэлектролитных микрокапсул. Спектр поглощения для
холостой пробы не был зарегистрирован
Для нахождения нижнего предела
количественного определения магнетита проводили анализ проб, приготовленных из
растворов коллоидного магнетита с концентрациями в диапазоне от 4,6 до 277,8 мг/л (4,6; 46,3;
185,2; 277,8 мг/л). Каждая проба содержала после высушивания то же количество
магнетита, что и 10 мкл раствора, использовавшегося при ее приготовлении (0,05;
0,46; 1,85; 2,78 мкг). Выбор концентраций обусловлен литературными данными и результатами
предварительных собственных исследований отношения сигнал/шум. Эксперименты по
ЭПР-спектрометрии для каждого из проб проводили не менее 6 раз и определяли
отношение сигнал/шум. Уровень шума определялся по ЭПР-сигналу контрольного
образца, приготовленного из воды Milli-Q. Результаты исследований приведены в
таблице 7.
Таблица 7 Нижний предел
количественного определения магнетита методом
ЭПР-спектроскопии
|
№ серии
|
Масса вещества в образце, мкг
|
№ анализа
|
Отношение
сигнал/шум
|
Среднее
|
Погрешность
|
Относительная
погрешность, %
|
|
1
|
0,05
|
1
|
2,0
|
1,7
|
0,2
|
14,4
|
|
|
2
|
1,6
|
|
|
|
|
|
3
|
1,7
|
|
|
|
|
|
4
|
1,9
|
|
|
|
|
|
5
|
1,3
|
|
|
|
|
|
6
|
1,7
|
|
|
|
|
2
|
0,46
|
1
|
4,8
|
4,9
|
0,3
|
8,2
|
|
|
2
|
4,7
|
|
|
|
|
|
3
|
4,8
|
|
|
|
|
|
4
|
5,1
|
|
|
|
|
|
5
|
4,6
|
|
|
|
|
|
6
|
5,4
|
|
|
|
|
3
|
1,85
|
1
|
7,3
|
6,9
|
0,3
|
4,9
|
|
|
2
|
6,3
|
|
|
|
|
|
3
|
6,8
|
|
|
|
|
|
4
|
7,0
|
|
|
|
|
|
5
|
6,9
|
|
|
|
|
|
6
|
7,1
|
|
|
|
|
4
|
2,78
|
1
|
9,9
|
9,7
|
0,3
|
3,1
|
|
|
2
|
9,7
|
|
|
|
|
|
3
|
9,8
|
|
|
|
|
|
4
|
9,6
|
|
|
|
|
|
5
|
9,1
|
|
|
|
|
|
6
|
10,1
|
|
|
|
За нижний предел
количественного обнаружения принимали количество магнетита, для которой
отношение сигнал/шум было более 5,0. Нижний предел количественного определения
используемой методики составил 1,85 мкг/образец. Эта величина составляет 10 % от ожидаемой
максимальной концентрации (2 мг/мл), что не превышает допустимый предел, от Сmах.
Для проверки линейности
зависимости массы магнетита от концентрации ЭПР-центров была построена
калибровочная кривая. Концентрацию железа в образцах измеряли методом
фотоколориметрии далее рассчитывали концентрацию магнетита в образцах по
формуле полученной из стехиометрии Смагнетита=СFe3+*1,38, учитывая что ЭПР-центры представлены только
магнетитом. Для построения калибровочной кривой: были зарегистрированы 3 серии
спектров поглощения ЭПР-центров образцов с известными концентрациями магнетита.
Данные представлена в таблице 8.
Таблица 8 Калибровка для метода
ЭПР-спектроскопии
|
Масса
магнетита, мкг
|
Концентрация ЭПР-центров, ×103 (1/г)
|
Средняя концентрация ЭПР-центров, ×103 (1/г)
|
Погрешность
|
Относительная
погрешность, %
|
|
1,852
|
3,10
|
2,90
|
0,4
|
13,7
|
|
3,16
|
|
|
|
|
2,44
|
|
|
|
|
2,778
|
4,06
|
4,06
|
0,4
|
11,3
|
|
3,60
|
|
|
|
|
4,52
|
|
|
|
|
3,704
|
4,27
|
4,96
|
0,7
|
14,3
|
|
5,69
|
|
|
|
|
4,92
|
|
|
|
|
4,630
|
7,22
|
7,81
|
0,7
|
9,4
|
|
7,57
|
|
|
|
|
8,64
|
|
|
|
|
9,260
|
12,7
|
12,7
|
1,5
|
11,8
|
|
14,2
|
|
|
|
|
11,2
|
|
|
|
|
18,520
|
28,9
|
28,9
|
4,1
|
14,2
|
|
33,0
|
|
|
|
|
24,8
|
|
|
|
|
46,300
|
79,8
|
74,8
|
7,0
|
9,35
|
|
77,8
|
|
|
|
По результатом средних значений
концентраций ЭПР-центров была построена калибровочная кривая зависимости
ЭПР-центров от массы магнетита рисунок 3.4.2.
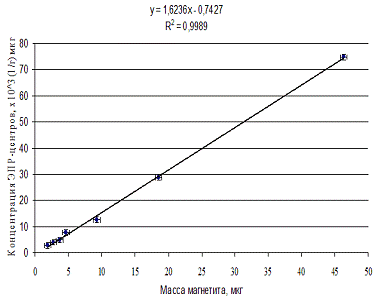
Рис. 3.4.2. Калибровочная кривая для
концентрации магнетита полученная методом ЭПР
Таким образом, проведенные исследования показали
что концентрация магнетита в полиэлектролитных микрокапсулах и
магнитоуправляемых липосомах выявляет корреляцию с концентрацией железа (III),
определенной методом фотоколориметрии, R2=0,9989
Следовательно можно использовать концентрацию железа определенную
фотоколориметрическим методом для калибровки ЭПР-спектрометра для измерений
концентрации магнетита.
Для определения концентрации железа в образцах
полиэлектролитных микрокапсул и магнитоуправляемых липосом, методом ЭПР
использовали образцы в объеме 10мкл. Объем исследуемых образцов был в 10 раз
меньше, чем объем образцов, исследованных химическими методами определения
концентраций. Эксперименты проводились не менее 3 раз. Результаты определения
концентраций, определенных методом ЭПР-спектроскопии, показаны в таблице 9.
Таблица 9 Значения концентраций ЭПР-центров
|
№
Образца
|
Конц.ЭПР-центров, ×103 (1/г)
|
Средняя конц. ЭПР-центров, ×103 (1/г)
|
mх, мкг
|
C(Fе3+),мг/л
|
Погрешность
|
Относительная
погрешность, %
|
|
Мк1
|
12,24
|
12,21
|
8,08
|
586
|
0,09
|
0,71
|
|
12,10
|
|
|
|
|
|
|
12,26
|
|
|
|
|
|
|
МК2
|
17,56
|
17,54
|
10,91
|
792
|
0,12
|
0,07
|
|
17,42
|
|
|
|
|
|
|
17,66
|
|
|
|
|
|
|
Мк3
|
24,02
|
23,93
|
14,92
|
1084
|
0,93
|
4,44
|
|
23,81
|
|
|
|
|
|
|
21,96
|
|
|
|
|
|
|
Л1
|
31,90
|
31,85
|
20,83
|
1512
|
0,28
|
0,87
|
|
32,11
|
|
|
|
|
|
|
31,56
|
|
|
|
|
|
|
Л2
|
24,81
|
24,90
|
15,07
|
1092
|
0,11
|
0,43
|
|
24,89
|
|
|
|
|
|
|
25,02
|
|
|
|
|
|
|
Л3
|
3,49
|
3,55
|
2,75
|
195
|
0,08
|
2,04
|
|
3,63
|
|
|
|
|
|
|
3,53
|
|
|
|
|
|
В таблице представлены данные концентраций
микрокапсул и магнитоуправляемых липосом полученных методом ЭПР-спектроскопии.
Данные представленные в таблице 9, совпадают с данными полученными химическими
методами, но обладают меньшей относительной погрешностью определения
концентрации 0,07-4,5%.
Заключение
В настоящей работе осуществлена оптимизация трех
различных методов определения концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах. В таблице 10
приведены метрологические характеристики методов комплексонометрического
титрования и фотоколориметрического методов.
Таблица 10 Метрологические характеристики
методов
|
Метод
исследования
|
Метрологические
характеристики
|
|
НПКО,
мг/л
|
Диапазон
линейности, мг/л
|
Относительные
погрешности измерения для НПКО, %
|
Относительные
погрешности измерений образцов, %
|
|
Комплексонометрическое
титрование
|
100
|
100-800
|
19
|
1-21
|
|
Фотоколориметрический
метод
|
0,1
|
0,1-3,5
|
4,9
|
3-7
|
Показано что чувствительность (НПКО) метода
фотоколориметрии превосходит метод комплексонометрического титрования более чем
в 1000 раз. В диапазоне линейности оба метода позволяют с достаточной степенью
точности определять концентрацию железа (III)
в исследуемых объектах. Погрешность измерения в области НПКО для метода
титрования составляет 19%, в области других концентраций - 1-21%. Для
фотоколориметрического метода величина относительной погрешности в области НПКО
равна 4,9%, в области других концентраций - 2,5-7,4%. Анализ результатов
исследования концентрации железа (III)
в микрокапсулах и магнитных липосомах показал, что для определения в них
концентрации железа чувствительность метода титрования недостаточна. Таким
образом, оптимальным методом количественного детектирования железа (III)
в полиэлектролитных микрокапсулах и магнитных липосомах является
фотоколориметрическое определение его окрашенного комплекса, образующегося в
реакции с сульфосалициловой кислотой в щелочной среде.
В процессе выполнения настоящей работы
предложен, дающий возможность определения концентрации магнетита в образцах,
содержащих ионизированное железо. В качестве такого метода был апробирован
метод ЭПР-спектроскопии. Проведено исследование зависимости между концентраций
железа (III),
определенной методом фотоколориметрии, и концентрацией ЭПР-центров в
биообразцах .Установлено наличие тесной прямой корреляционной зависимости между
этими показателями. Данный факт, при наличии калибровки ЭПР-спектрометра по
концентрации железа определенной аналитическими физико-химическими методами,
позволяет определять концентрацию магнетита в биообразцах методом ЭПР.
Выводы
1. Апробированы химические методы определения
концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах.
. Показано, что оптимальным методом определения
концентрации железа (III)
в полиэлектролитных микрокапсулах и магнитоуправляемых липосомах является
спектрофотометрический метод определения концентрации железа (III)
в реакции с сульфосалициловой кислотой.
. Проведено исследование корреляционной
зависимости между концентрацией магнетита и концентрацией ЭПР-центров,
определенной методом ЭПР-спектроскоскопии, в полиэлектролитных микрокапсулах и
липосомах с наночастицами магнетита. Установлено наличие прямой корреляционной
зависимости между этими показателями.
Список литературы
1. Sukhorukov
G. B. Polyelectrolyte assembly on particle surfaces: A Novel Approach to
Colloid Design / G. B. Sukhorukov, E. Donath, S. Davis A. Stepwise // Polym.
Adv. Technol. - 2014. -V. 9.-
P. 1-9.
2. Sukhorukov
G. B. Layer-by-layer self assembly of polyelectrolyteson colloidal Particles /
G. B. Sukhorukov, E. Donath, H. Lichtenfeld // Colloids Surf. A. 1998. - V.
137. - P. 253-266.
3. Исмаилова
К. Г. Биотехнология получения магнитоуправляемых липосом / К. Г. Исмаилова, В.
И. Ефременко, А. Г. Курегян // Хим.-фарм. журнал. - 2005. -Т. 39, № 7.
. Беликов
В. Г. Получение и медико-биологи-ческое использование магнитных полей и
носителей / В. Г. Беликов, А. Г. Курегян // Хим.-фарм. журнал. - 2001. - Т. 35,
№ 2.
. Вершинин
В. И. Основы аналитической химии : учебное пособие Омский Государственный
Университет, 2013, Учебные издания Омского университета / В. И. Вершинин //
ОмГУ, Омск. -2013. - С. 45-50.
. Пентин
Ю. А. Физические методы исследования в химии / Ю. А. Пентин, Л. В. Вилков. - М.
: Мир. - 2006.
. Харитонов
Ю. Я. Аналитическая химия. Аналитика. В 2-х кн. / Ю. Я. Харитонов. - М. : Высш.
шк. - 2001. Кн.1.
. ГОСТ
4011-72 Вода питьевая. Методы измерения массовой концентрации общего железа. -
Взамен ГОСТ 4011-48; введен 1974-01-01 М. : Изд-во стандартов. - 2010.
. Калинников
В. Т. Введение в магнетохимию / Ю. В. Ракитин, В. Т. Калинников. - М. : Наука.
- 1990. - С. 302.
. Хаханина
Т. И. Аналитическая химия : учебное пособие для бакалавров / Т. И. Хахахина //
Юрайт. - 2014. Бакалавр. Базовый курс , 3-е изд., испр. и доп.
. Драго
Р. Физические методы в химии / Р. Драго. - М. : Мир. - 1981. - 43 С.
. Люлевич
В. В. Механические свойства полиэлектролитных микрокапсул / В. В. Люлевич. - М.
: Автореф. дис. ... канд. мед. наук. - 2004.
. Огородова
Л. В. Методические указания, программа и контрольная работа № 1 по курсу
«Гравиметрия» / Л. В. Огородова, А. П. Юзефович. - М. : МИИГАиК. - 1983. - 30
С.
. Вода
питьевая. Общие требования. ГОСТ 5123 - 2002. - Введен 1999-07-01. - М. :
Изд-во стандартов, 2010.
. Другов
Ю. С. Анализ загрязненной воды : практическое руководство / Ю. С. Другов //
Бином, Лаборатория знаний. - 2015. Методы в химии.
. Замышляев
П. С. Определение концентрации магнитной жидкости в биообразцах с помощью
ЭПР-спектроскопии / П. С. Замышляев, В. В. Радайкин, Н. Н. Зырняева //
Актуальные проблемы медико-биол. дисциплин. Сборник науч. трудов II
Всероссийской научно-практ. конференции молодых ученых.- Саранск: Издательство
Мордовского университета. -
2013.
-
С.
20.
. Харитонов
Ю. Я. Аналитическая химия. Аналитика. В 2-х кн. / Ю. Я. Харитонов - М. : Высш.
шк. - 2001. Кн.2.
. Карпов
Ю. А. Методы пробоотбора и пробоподготовки / Ю. А. Карпов // Издательство
БИНОМ. - 2015. Методы в химии.
. Арзамасцев
А. П. О методах определения железа в лекарственных средствах / А. П.
Арзамасцев, A. B. Быков // Хим. - фарм. журн. - 1990. -Т.24, №5.
. Другов
Ю. С. Анализ загрязненной воды : практическое руководство / Ю. С. Другов //
Бином Лаборатория знаний. - 2015. Методы в химии. - С. 32.
. Вишневецкий
В. Ю. Экспериментальные исследования динамики концентрации тяжелых металлов в
поверхностном слое воды в Таганрогском заливе / В. Ю. Вишневецкий, В.С. Ледяева
// Инженерный вестник Дона. - 2012.
. Блюменфельд
Л. А. Электронный парамагнитный резонанс / Л. А. Блюменфельд, А. Н. Тихонов. -
М. : Мир. - 1997. - С. 91-99.
. Тихонов
А. Н. Электронный парамагнитный резонанс в биологии / А. Н. Тихонов // Хим.-фарм.
журнал. - 2012. Т4. С. 24-32.
. Кингстон
Г. М. Методы пробоподготовки / Г. М. Кингстон, Л .В. Джесси . - М. : Мир. -
1991. - С. 326.
. Пентин
Ю. А. Физические методы исследования в химии / Ю. А. Пентин, Л. В. Вилков. - М.
: Мир. - 2006. - С. 25.
. Карпов
Ю. А. Методы пробоотбора и пробоподготовки / Ю. А. Карпов // Издательство
БИНОМ. - 2015, Методы в химии- С.30.
. Пентин
Ю. А. Применение электронного парамагнитного резонанса / Ю. А. Пентин, Р. Н.
Жадов. - М. : Мир. - 2011. - С. 14.
28. Rieger
P. H. Electron Spin Resonance. Analysis and Interpretation / P. H. Rieger //
Cambridge: The Royal Society of Chemistry. - 2007.