Розробка лікарських форм
Вступ
клінічний лікарський фармакологічний організм
Ще в давнину людина намагалася лікувати хвороби і
рани, використовуючи рослини. Деякі рецепти дійшли до нас з античних часів. У
середньовічних «травниках» в якості лікарських засобів також пропонувалися всілякі
рослини. У сучасній медицині, де від кожного препарата очікують певної дії, з
сотень лікарських рослин затребувані тільки деякі.
Аж до кінця XIX в. при лікуванні хвороб
застосовували ліки, які готували з мінерального або природної сировини,
найчастіше з висушених рослин або їх частин, але нерідко в справу йшли і свіжі
рослини. Вони могли містити не тільки речовини, які надають цілющу
(терапевтичну) дію, але і речовини з отруйним (токсичним) ефектом.
При призначенні препарату природного походження
або екстракту пацієнт приймає відразу кілька речовин, які надають різну дію.
При цьому вміст діючих речовин та їх співвідношення в природній сировині можуть
сильно варіювати залежно від походження рослини (місця зростання), часу збору,
а також тривалості та умов зберігання. З цих же причин співвідношення різних
речовин в лікарському препараті може також значно варіювати.
У фармакологічних лабораторіях з різних природних
продуктів були виділені багато фармакологічно активних речовин у вигляді
хімічних сполук.
Хімічний синтез дозволяє отримувати ліки
незалежно від поставок природної сировини. На синтетичних препаратах вивчаються
зв'язки між хімічною будовою речовини і її дією, що врешті-решт і призводить до
відкриття нових сполук з цікавими фармакологічними властивостями.
Завдяки зміні хімічної структури синтезовані
речовини часто мають більш сильну фармакологічну дію.
Розробка нових ліків заснована на синтезі нових
хімічних сполук. Речовини складної будови отримують з рослин (наприклад,
серцеві глікозиди), тканин тварин (гепарин), на основі культур мікроорганізмів
(пеніцилін) або культур клітин людини (урокіназа), а також за допомогою генної
інженерії (людський інсулін). Чим більше відомо про зв'язок між хімічною
будовою речовини і його впливом, тим цілеспрямованіше здійснюється пошук нового
препарату.
Дія нової речовини перевіряється при доклінічному
дослідженні. На початковій стадії проводять фармакобіохімічні дослідження
(наприклад, експерименти щодо зв'язування з рецепторами) або вивчення на
клітинних культурах, ізольованих клітинах або органах. Однак, оскільки в таких
модельних дослідженнях не можна відтворити складні біохімічні процеси, що
відбуваються в живому організмі, подальші випробування нового препарату
проводяться на тваринах. Експерименти на тваринах показують, чи має препарат
лікувальну дію, і яка вірогідність токсичного впливу.
Токсикологічні дослідження проводяться для
визначення токсичності при короткочасному або тривалому застосуванні (гостра і
хронічна токсичність), здатності ушкоджувати генетичну структуру
(мутагенність), сприяти виникненню пухлин (канцерогенність) або порушувати
розвиток плода (тератогенність). В експериментах на тваринах вивчають, як
видозмінюється препарат при всмоктуванні, розподілі і виділенні
(фармакокинетика).
Лише невелика частина з'єднань витримує
доклінічні випробування і застосовується в подальшому для лікування людей.
Фармацевтична технологія пропонує для знайденої речовини лікарську форму.
1. Принципи створення нових лікарських речовин
.1 Основні етапи пошуку лікарських речовин
Пошук нових біологічно активних речовин
пов'язаний з величезною наукоємкістю робіт, тривалістю розробки технології
виробництва, складністю медико-біологічних випробувань і вимагає великих
витрат. У західних країнах вартість розробки оригінального лікарського
препарату оцінюється від декількох десятків до сотень мільйонів доларів, що в
десятки разів перевищує витрати на ці цілі в нашій країні.
Створення оригінальних лікарських препаратів може
бути здійснено на двох рівнях. До оригінальних лікарських засобів,
випереджаючих світовий рівень, відносяться ті з них, які за своєю лікувальною
дією перевершують відомі вітчизняні та зарубіжні аналоги. До оригінальних
лікарських засобів, відповідних світовому рівню, відносяться ті, які за своєю
лікувальною дією можна порівняти з кращими закордонними, але перевершують
вітчизняні аналоги. Процес створення оригінального лікарського препарату триває
не менше 10-12 років, а відтворюваних на основі зарубіжних аналогів - 5-6
років.
Розробка лікарського препарату включає наступні
стадії:
. Задум створення нового лікарського препарату.
Він виникає зазвичай в результаті спільної роботи вчених двох спеціальностей:
фармакологів і хіміків-синтетиків. Уже на цій стадії здійснюється попередній
відбір синтезованих сполук, які, на думку фахівців, можуть бути потенційно
біологічно активними речовинами.
. Синтез попередньо відібраних структур. На цій
стадії також здійснюється відбір, в результаті якого речовини, що відрізняються
нестабільністю, неможливістю або надмірною трудомісткістю синтезу, дорожнечею
вихідних речовин і т.д., не піддаються подальшому дослідженню.
. Фармакологічний скринінг. Основний етап, під
час якого відсіваються безперспективні речовини, синтезовані на попередньому
етапі.
. Клінічна перевірка. Її виконують тільки для
перспективних біологічно активних речовин, які пройшли всі етапи
фармакологічного скринінгу.
. Розробка технології виробництва нового
лікарського препарату і найбільш раціональної лікарської форми.
. Підготовка нормативно-технічної документації,
що включає способи контролю якості як самого лікарського препарату, так і його
лікарських форм.
. Впровадження препарату в промислове виробництво
та відпрацювання всіх стадій його отримання в заводських умовах.
Всі ці етапи пошуку та освоєння виробництва
нового лікарського речовини тісно пов'язані між собою.
Кожен новий препарат є підсумком спільної роботи
хіміків-фахівців в області синтезу та аналізу, а також біологів, біохіміків,
технологів, фармакологів і клініцистів. Нерідко в цій роботі бере участь кілька
наукових установ різного профілю.
Випробування біологічної активності хімічних
сполук послідовно ведуться на самих різних рівнях: молекулярному, клітинному,
субклітинному, на рівні тканин і органів тварин, а також цілісного організму.
Новий препарат повинен обов'язково мати переваги перед існуючими та витримувати
необхідні вимоги щодо токсичності, канцерогенності, тератогенності та інших
показників нешкідливості. Всі випробування виконують на піддослідних тварин.
Важливу роль в доклінічному вивченні потенційних
лікарських речовин займають біофармацевтичні дослідження. Останні дають
можливість встановити механізм впливу препарату на організм, рекомендувати
раціональні лікарські форми і схеми їх застосування в клініці. Терапевтична
цінність нового лікарського препарату остаточно оцінюється в процесі клінічних
випробувань. Проводяться вони в клініках і науково-дослідних інститутах
медичного профілю. За результатами клінічних випробувань робиться висновок про
доцільність застосування препарату в медичній практиці. На препарат, що пройшов
клінічні випробування, готується регламент виробництва, що відображає
технологію виготовлення та аналітичний контроль кожній стадії отримання
препарату. Крім того, розробляється нормативно-технічна документація на субстанцію
- кінцевий продукт виробництва.
Передумовами для створення нових ліків є
накопичені теоретичні та емпіричні уявлення про характер зв'язку між
структурою, фізичними властивостями і фармакологічною активністю хімічних
сполук. Сучасні дослідники, говорячи про існування зв'язку «структура -
активність», розуміють під структурою комплекс фізичних і хімічних
властивостей, обумовлених будовою молекули досліджуваного з'єднання.
.2 Зв'язок між структурою молекул речовин і їх дію на організм
Встановлення залежності між хімічною будовою і
дією речовини на організм має величезне значення в широкому біологічному плані.
Вирішення цієї проблеми дозволило б здійснювати цілеспрямований синтез
лікарських речовин, що володіють заданою фармакологічною дією. Ідея про наявність
зв'язку між хімічною структурою органічних сполук та їх біологічною активністю
була вперше висловлена ще в 1869 р. Однак, незважаючи на більш ніж вікову працю
вчених багатьох поколінь, до теперішнього часу вдалося встановити лише деякі
закономірності.
Наведені нижче відомості накопичені емпіричним
шляхом при вивченні зв'язку між фармакологічною активністю і хімічною
структурою цілого ряду аліфатичних і ароматичних сполук. Вони дають тільки
орієнтоване уявлення про те, які зміни може зазнавати дію речовини на організм
при введенні в його молекулу тієї чи іншої функціональної групи.
На численних прикладах показано, що ненасичені
сполуки більш фармакологічно активні, ніж насичені. Це пов'язано з реакційною
здатністю, яка значно вище у ненасичених сполук.
Введення галогенів підсилює фармакологічну
активність аліфатичних і ароматичних сполук, причому як активність, так і
токсичність залежать від числа атомів галогену. Галогени, введені в ароматичний
цикл, підвищують токсичність. Хлор- і бромпохідні надають наркотичну дію і
знижують кров'яний тиск. Йодпохідні менш активні, але мають більш виражену
антисептичну дію.
Вплив кисню знаходиться в залежності від
функціональної групи, до складу якої він входить. Введення в молекулу речовини
спиртового гідроксилу підвищує фармакологічний ефект, причому активність
зростає від первинних до третинних спиртів.
У ароматичних сполук введення гідроксильних груп
посилює активність. Введення альдегідної або кетогрупи підсилює фармакологічний
ефект. Дія альдегідів тісно пов'язана з їх високою реакційною здатністю.
Карбоксильна група знижує активність і токсичність і покращує розчинність. Це
відноситься як до аліфатичних, так і до ароматичних сполук. Великий вплив на
активність і токсичність органічних сполук надає процес ацилювання. Він може
привести до повної зміни фармакологічної активності і токсичності вихідних
спиртів, амінів, фенолів.
Введення нітрогрупи в молекулу приводить до
посилення впливу на довгастий мозок. Аліфатичні складні ефіри азотної кислоти і
нітропохідні мають судинорозширювальну дію.
Наявність у молекулі аміногрупи різко підвищує
токсичність. З'єднання типу аміаку подразнюють нервові центри і гладку
мускулатуру, викликають спазми і судоми. Первинні аміни подібні за дією з
аміаком. Вторинні аміни, як правило, більш активні, ніж третинні, але менш
активні, ніж первинні. Перехід амінів в четвертинні амонієві основи змінює
фармакологічну дію - з судомних отрут речовини перетворюються в
гангліоблокуючі.
Введення в молекулу аліфатичних радикалів,
розгалуження їх ланцюгів призводить до змін у дії речовин на організм.
Встановлено певні закономірності впливу заміщають алкільних груп на
фармакологічну дію і токсичність органічних сполук.
Приєднання метальних груп до атома азоту дає
різні ефекти. При введенні їх в молекулу аміаку або при алкілуванні атомів
водню в аміногрупи, гідроксильного або карбоксильного угруповання відбувається
майже завжди зниження фізіологічної активності або виражена її зміна. Існує
значна різниця між впливом етильної і метальної груп, введених в молекулу.
Етильний радикал має велику спорідненість до дії речовин, що впливають на
центральну нервову систему.
Довжина ланцюга аліфатичного радикала, що
вводиться в молекулу, - один з важливих факторів, що впливають на активність і
токсичність речовин. Зазвичай наростання ефекту відбувається при подовженні
аліфатичного ланцюга до шести атомів вуглецю. Фенільний радикал, введений в
молекулу, призводить до значного зсуву активності речовини. Встановлено, що
зростання біологічної активності в гомологічних рядах не безмежне, завжди
досягається «перелом» і вищі гомологи виявляються неефективними.
Вплив окремих радикалів може бути розглянуто на
прикладі змін, що відбуваються в фармакологічної активності і токсичності
похідних бензолу. Бензол, потрапляючи в організм, навіть у вигляді пари різко
збуджує рухові центри і призводить до отруєння зі смертельним результатом.
Введення одного алкільного радикала в молекулу бензолу посилює його токсичну
дію на організм, причому з подовженням алкільного радикала токсичність зростає.
Присутність же двох алкільних радикалів знижує токсичність, особливо якщо вони
розташовані в орто - або пара-положенні один до одного.
Введення нітрогрупи в молекулу не знижує
токсичності бензолу. Посилюється токсичність бензолу при введенні галогену в
його молекулу. Галогенпохідні бензолу проявляють, як правило, антисептичну
активність. Гідроксильні групи, введені в ядро бензолу, надають
речовині антисептичні властивості, які знаходяться в залежності від числа
фенольних гідроксилів. Карбонільні групи підсилюють фізіологічну активність і
токсичність бензолу. Присутність карбоксильної групи в молекулі бензолу знижує
токсичність. Препарати бензойної кислоти, зокрема її натрієву сіль,
застосовують всередину в якості лікарського засобу. Відновлення нітробензола
призводить до утворення аніліну. Він надає токсичну дію на центральну нервову і
судинну системи, але одночасно виявляє жарознижуючу і болезаспокійливу дію.
Значно менше досліджено питання про спрямованість
і силу дії речовин, що містять дві (або більше) функціональні групи. Деякі дані
з цього питання отримані на прикладі ароматичних сполук.
Фізіологічний ефект монозаміщених бензолу може
різко змінюватися при введенні інших функціональних груп. Це зазначено на
прикладі алкілпохідних, ди - та трихлорпохідних бензолів, двохатомних фенолів.
Токсичність аніліну помітно знижується при
введенні фенольного гідроксилу. Наприклад, п-амінофенол і особливо його похідні
менш токсичні, ніж анілін. Значною мірою зменшується токсичність аніліну при
введенні карбоксильної групи, орто- і пара-амінобензойні кислоти не мають
отруйних властивостей аніліну. Тут позначається позитивний вплив карбоксильної
групи. Значно знижується токсичність аніліну в результаті ацетилювання.
Ацетанілід (антифебрин) тривалий час використовувався як жарознижуючий засіб
Велике значення має встановлення зв'язку між
фармакологічною активністю і стереохімії молекул органічних сполук. На прикладі
ряду гетероциклічних сполук встановлено, що фармакологічний ефект залежить як
від самої гетероциклічної системи, так і від відносної орієнтації в ній різних
замісників. Заміна атома вуглецю в ароматичній або гетероциклічній системі на
гетероатоми, збільшення числа ланок циклу, подовження або розгалуження
аліфатичного ланцюга, приєднаного до гетероциклічної системі, викликають
стереохімічні зміни в молекулі. Останні можуть призвести до появи геометричних,
оптичних та інших ізомерів, які в свою чергу викликають зміну фармакологічної
дії.
Дослідженнями останніх років встановлено
наявність взаємозв'язку між просторовою структурою речовин, їх розчинністю в
воді і в ліпідах, оптичною активністю, з одного боку, і біологічною дією - з
іншого. Наприклад, такі прості речовини, як двоатомні феноли, відрізняються за
своєю токсичністю. Найменш токсичний з них мета-ізомер (резорцин). Біологічна
дія залежить від цис-транс-ізомерії, трео-еритро-ізомерії, оптичної ізомерії.
Оптичні ізомери, володіючи однаковою хімічною будовою та фізичними
властивостями, за виключенням лише напрямку обертання площини поляризованого
променя, мають різну біологічну активність, причому іноді навіть протилежну.
Найчастіше один з енантіомерів, званий еутомером, має виражену фармакологічну
активність одного виду, а інший енантіомер - дістомер - не активний. В якості
прикладів можна навести лікарські речовини, що мають в молекулі асиметричний
атом вуглецю. Серед них більше 90% адреноміметиків, адреноблокаторів,
антикоагулянтів і протиепілептичних засобів, понад 50% антигістамінних і
місцево-анестезуючих засобів і 20-25% інших лікарських речовин. Більш високою
біологічною активністю володіють лівообертаючі ізомери (гіосціамін в 40 разів,
адреналін в 17 разів, тироксин в 4 рази активніше правообертаючих антиподів). В
інших випадках (стероїди, антибіотики) активніше правообертаючі ізомери, значно
рідше (камфора) оптична ізомерія не впливає на фармакологічну активність.
1.3 Залежність фармакологічної дії від фізичних і хімічних
властивостей лікарських речовин
Хімічна структура молекули є далеко не єдиним
фактором, що впливає на фармакологічну активність лікарської речовини. Навіть
якщо обрана оптимальна хімічна структура, важливо, щоб лікарська речовина могло
бути перенесена до місця дії і поставлена в умови, необхідні для взаємодії з
біологічним субстратом. Для цієї мети потрібно, щоб лікарська речовина володіла
комплексом фізичних і хімічних властивостей, що забезпечують розподіл речовини
в організмі.
Біологічна активність даного з'єднання, або,
точніше, біологічна відповідь організму на це з'єднання, залежить від суми дуже
великої кількості факторів: проникності речовини через ліпідний шар,
транспорту, процесів адсорбції, іонізації, комплексоутворення, метаболізму та
ін.
Фізичні або хімічні властивості речовини є
функцією її хімічної будови. Разом з тим механізм первинної фармакологічної
реакції зводиться до взаємодії між клітиною і молекулою лікарської речовини.
На біологічну дію впливають як здатність речовини
вступати в хімічні реакції, так і його фізико-хімічні властивості.
Біологічна відповідь організму на лікарську
речовину насамперед залежить від такої фізичної властивості, як розчинність.
Розчинність обумовлює розподіл речовини в організмі і багато в чому визначає
фармакокінетичні властивості лікарських препаратів. Цей параметр можна
використовувати для прогнозування ефективності біологічної дії речовини.
Розчинність робить істотний вплив на проникнення лікарської речовини з
кишечника в кров, тобто на такі процеси, як всмоктування, фільтрація, дифузія
та ін.
Для врахування впливу розчинності певне
орієнтування при синтезі біологічно активних речовин може дати встановлена загальна
закономірність про вплив тих чи інших радикалів (атомних груп) на
гідрофільність або гідрофобність (ліпофільність) речовини. Показано, що
спорідненість до води зменшується при введенні радикалів в такій послідовності:
карбоксильна → гідроксильна → альдегідна → кетогрупи →
аміногрупа → іміногрупи → амідогрупа → імідогрупа
(гідрофільні групи) і метил → метилен → етил → пропіл →
алкіл → феніл (гідрофобні радикали)
Була зроблена спроба систематизувати лікарські
речовини з урахуванням залежності між їх гідрофобністю і фармако-терапевтичною
активністю. Це обумовлено тим, що більшість життєво важливих систем
функціонують у водному середовищі або включають воду. Водне середовище в
організмі висуває певні вимоги до структури біологічно активних речовин,
молекули яких повинні володіти гідрофільно-гідрофобними властивостями. Останні
визначають можливість їх розподілу між водою і ліпідами, а отже, взаємодії з
ферментами і рецепторами. Параметром гідрофобності є логарифм коефіцієнтів розподілу
лікарських речовин в системі «октанол - вода» (lgP). Цей параметр відомий для
багатьох лікарських речовин. Виявилося, що інтервал варіювання величини lgP
залежить від типу дії тієї чи іншої групи лікарських речовин і має середнє
значення у протималярійних - 4.5, снодійних - 1.33, анальгетиків - 0.83,
адреноміметиків - 0.43, антибіотиків - 0.27, сульфаніламідів - 0.13 і т.д.
Інакше кажучи, протималярійні засоби відносяться до надзвичайно гідрофобних
речовин, снодійні - до високогідрофобних і т.д. Аналогічним чином можна
систематизувати і всі відомі фармакотерапевтичні групи. Їх представники
розподіляються в широкому інтервалі: від надзвичайно гідрофобних до надзвичайно
гідрофільних.
Не менш важливе значення має розчинність
лікарської речовини в ліпідах. Поряд з розчинністю істотну роль відіграє
коефіцієнт розподілу лікарської речовини між водою і ліпідами. Цей фактор
обумовлює проникнення лікарської речовини через мембрани до клітин тканин.
Вплив розчинності і коефіцієнта розподілу
обумовлено двома можливими шляхами проникнення молекул лікарської речовини в
клітини. Один з них - проникнення молекул водорозчинних речовин та іонів через
субмікроскопічні (діаметром 0,7-1 нм) заповнені водою пори, що пронизують
протоплазму. Другий шлях - розчинення лікарських речовин у ліпідах, які входять
до складу протоплазми, особливо її поверхневого шару. По цьому шляху
здійснюється транспорт лікарських речовин, нерозчинних у воді, але розчинних у
ліпідах.
За сучасними уявленнями, фармакологічна
активність багатьох лікарських речовин в значній мірі обумовлена блокуванням
функції іонних каналів в біомембранах. У грубому наближенні взаємодія молекули
лікарської речовини з каналом біомембрани може бути представлено як перенесення
його молекули (або її частини) з водного середовища в органічну фазу. Останню
являє собою канальна система. Уявлення про іонні канали як молекулярні мішені
для лікарських речовин, а також відносну гідрофобність внутрішньої порожнини
іонних каналів в порівнянні з навколишнім полярним середовищем дозволяють
корелювати співвідношення «структура-активність» для даного класу органічних
молекул. Це дає можливість передбачити ефективність даної групи сполук і вести
спрямований синтез біологічно активних речовин, а також дослідити їх вплив на
організм.
Швидкість всмоктування лікарської речовини
залежить також від pH середовища. Іони водню і гідроксилу практично не можуть
проникати в клітини. Перешкодою служать їх висока реакційна здатність,
взаємодія з кінцевими хімічними групами, локалізованими на поверхні клітини.
Виходячи з цього, змінюючи pH середовища при пероральному введенні ліків, можна
збільшувати або зменшувати число не дисоційованих молекул і таким чином
посилювати чи послаблювати процес проникнення лікарського препарату в клітину.
Кислоти і луги чинять на тканини подразнюючу і
припікаючу дію, що є наслідком утворення альбумінатів. Сила дії зростає із
збільшенням ступеня дисоціації кислоти.
У медичній практиці застосовують значну кількість
лікарських препаратів - амфолітів, тобто хімічних сполук, в молекулах яких
одночасно присутні основне і кислотне угруповання. Кислотне і основне
угруповання амфолітов в певних умовах можуть взаємодіяти один з одним з
утворенням нейтральної або іонної форм молекул. Перехід цих форм відбувається в
результаті попередньої іонізації молекул в катіон і аніон. Число таких
препаратів зростає. Серед них значна кількість кислот або їх похідних
(нікотинової, цінхонінової), амінокислот (метіонін, аміналон), аліфатичних і
гетероциклічних амідів, похідних 4-оксіпірідіна, 4- і 8-оксихіноліну (хінозол,
ентеросептол) та ін.
Молекулярна маса є одним з факторів, що впливають
на фармакологічну активність. Так, аліфатичні вуглеводні і спирти в міру
збільшення молекулярної маси знижують свою активність і токсичність. Полімери
залежно від молекулярної маси нерідко настільки змінюють свою фармакологічну
дія, що вона стає протилежною до дії вихідних мономерів.
При встановленні залежності між фізико-хімічними
характеристиками і біологічною активністю важливе значення мають параметри, що
визначають фармакодинамічні властивості лікарської речовини. До їх числа
відносяться ті, які обумовлюють її рух в міжклітинні рідини і проникнення через
мембрани (ліпофільність, гідрофобність, розчинність). Всі вони прямо або
побічно залежать в розчинах від такої фундаментальної характеристики, як
поверхневий натяг. Такий вплив поверхневого натягу обумовлено тим, що він має
своєю основою некомпенсовану взаємодію між молекулами рідини, що утворюють її
поверхневий і найближчий до нього шар. Це призводить до появи надлишкової
вільної енергії у молекул поверхневого шару, яка впливає не тільки на
фізико-хімічні параметри, але й на біологічну активність. Встановлено,
наприклад, кореляцію між поверхневим натягом і наркотичною дією деяких речовин.
Необхідно відзначити, що кожний з розглянутих
факторів сам по собі не є визначальним у фармакологічній дії ліків. Вони
знаходяться у взаємозв'язку між собою і залежать від хімічної структури та
інших параметрів. Встановлення такого зв'язку в тій чи іншій групі органічних
сполук вимагає колосальної роботи, пов'язаної з синтезом і дослідженням
фармакологічної дії багатьох сотень і тисяч з'єднань. У кожній з груп хімічних
сполук існує певний взаємозв'язок між хімічною будовою, властивостями і
фармакологічною дією.
Різноманіття факторів, що впливають на
фармакологічний ефект, ускладнює процес пошуку нових лікарських препаратів.
Проте сучасні методи дослідження дозволили визначити шляхи вирішення цієї
важливої проблеми.
2. Напрямки і перспективи створення лікарських речовин
.1 Основні напрямки створення нових лікарських речовин
Вишукування нових лікарських речовин здійснюють
різними шляхами. Провідним напрямком створення нових лікарських речовин є
дослідження в області модифікації структури відомих природних біологічно
активних сполук. Одним з класичних прикладів цього напряму може служити
створення цілого ряду синтетичних місцево-анестезуючих засобів похідних
napa-амінобензойної кислоти (анестезин, новокаїн, дикаїн) на основі глибокого
дослідження хімічної структури природного алкалоїду - кокаїну. Подальші
дослідження привели до створення ще однієї групи місцево-анестезуючих речовин,
похідних диалкіламіноациланілідів (тримекаїн, ксикаїн).
Таким шляхом були синтезовані оригінальні
лікарські засоби, що мають гетероциклічну структуру. Прикладом може служити ряд
антимікробних засобів похідних 5-нітрофурану, «родоначальником» яких був
фурацилін. На основі встановлення структури 4-оксикумаринового антикоагулянту
природного з'єднання - дикумарину, який тривалий час застосовувався в медицині,
створені неодикумарин, синкумар та ін.
За останні роки в цьому напрямку стали
спостерігатися деякі тенденції, які носять характер загальних закономірностей.
Так, наприклад, при створенні лікарських речовин, механізм дії яких обумовлений
їх взаємодією з біохімічними рецепторами, важливою є незмінність в молекулі
відстаней між реакційними центрами, які відповідають за взаємодію з активними
ділянками рецепторів. Завдання дослідника полягає в тому, щоб, варіюючи
хімічною структурою молекули і її просторовими характеристиками, зберегти
зазначені відстані і тим самим посилити реакційну здатність цих центрів.
Поряд з дослідженням залежності між хімічною
структурою і фармакологічною дією ліків важливе значення має і вивчення
метаболізму речовини в організмі. Метаболізм визначає такі важливі властивості
ліків, як токсичність, побічні ефекти, тривалість дії. Метаболізму піддається
переважна більшість лікарських речовин. Як правило, вони інактивуються, значно
рідше відбувається їх активація або зміна характеру дії.
Можливість створення лікарських речовин, що не
утворюють метаболітів, мало перспективна, оскільки практично всі ксенобіотики
змінюються в організмі. Тому при конструюванні ліків найбільш реальним є
отримання так званих «м'яких» лікарських речовин, тобто структурних аналогів
вже відомих ліків з передбачуваним метаболічним перетворенням, в результаті
якого утворюються нетоксичні метаболіти.
Одним з напрямків пошуку нових лікарських речовин
є хімічна модифікація вже відомих ліків та отримання проліків. Це створює великі
потенційні можливості в посиленні активності, зняття побічних явищ, підвищенні
стабільності лікарських засобів. Вперше на це вказав в 1958 р. Альберт, який
ввів спеціальний термін «ліки-попередники» (проліки). До них віднесені
лікарські речовини, що проявляють фармакологічну активність після того, як вони
були піддані в організмі хімічним або метаболічним (ферментативним)
перетворенням. Дослідження таких речовин - активних метаболітів - дають
можливість створювати нові лікарські речовини. Головна умова при цьому -
необхідність оптимальної швидкості перетворення попередника в активний
метаболіт і прояв достатньої фармакологічної активності. Встановлено деякі
закономірності, які використовуються в здійсненні цієї мети. При створенні
нових ліків найчастіше потрібно підвищити активність, іноді ж, навпаки,
доцільно уповільнити абсорбцію лікарської речовини (сульфаніламіди). У ряді
випадків, наприклад при створенні протипухлинних засобів, необхідно, щоб
препарат діяв тільки по відношенню до потрібного органу або тканини.
Пролонгування дії можна домогтися, якщо ліки-попередники будуть кумулюватися в
жировій тканині. Для збільшення тривалості дії застосовують також етерифікацію
(спиртів і кислот). Алкільні ефіри спиртів стійкі до дії кислот і лугів. Іноді
перетворення в ефіри значно змінює фізико-хімічні та біофармацевтичні
властивості (пеніциліни).
Одним із способів отримання ліків-попередників є
приєднання до активної форми групи носія через різні форми зв'язку (іонний,
ковалентний, комплексний, водневий). Носієм може бути сахароза (серцеві
глікозиди). Хорошим носієм є піровиноградна кислота, так як це фізіологічний
компонент, і її звільнення нешкідливо для організму.
Створюються «контейнерні» лікарські засоби з
використанням, наприклад, макроціклідов. При цьому відомі лікарські речовини
з'єднують з іонофорними фрагментами, які сприяють проникненню через біологічні
мембрани. Так синтезовані «контейнерні» препарати стрептоциду і феназепама.
Великий інтерес проявляється до пептидів, що дозволяє отримати ліки-попередники,
що включають фрагменти амінокислот.
Встановлено ряд ознак, що дозволяють передбачити
можливість появи у даної речовини активного метаболіту. Наприклад, більша
активність ліків при пероральному введенні, ніж при парентеральному,
відсутність вихідної речовини в організмі під час прояву дії та ін. Можна також
передбачити наявність фармакологічної активності у метаболіти, наприклад, якщо
він її проявляє при будь-якому шляху введення в організм.
Свої особливості має процес конструювання
лікарських речовин в тому випадку, коли механізм дії пов'язаний з їх участю в
метаболізмі шляхом зміни або блокади ферментативних процесів. При цьому,
варіюючи хімічною структурою, прагнуть зберегти загальний обсяг молекули, щоб
забезпечити можливість її взаємодії з ферментами. У таких випадках змінюють
характер розподілу електронної щільності в молекулі, реакційну здатність
окремих її ділянок, вводять або видаляють реакційні центри, необхідні для
нормального перебігу процесів біохімічних перетворень, і т.д. Таким чином,
дослідження метаболітів і ліків-попередників - один з перспективних шляхів
створення нових лікарських речовин.
Перспективним є також розширення області
застосування відомих лікарських засобів внаслідок вивчення їх побічної дії.
Так, наприклад, у ацетилсаліцилової кислоти було виявлено крім анальгетичної
також протитромботичну дію; у сульфаніламідів крім антибактеріальної -
діуретичну, у хлорпромазина крім антиалергічної - нейролептичну, у анестетика
лідокаїну - антиаритмічну дію, у кортикотропного гормону кортизону -
протиревматичну і т.д. Після встановлення і дослідження нового ефекту ці
препарати починають застосовувати або для лікування і тих і інших захворювань,
або виключно в новій якості, встановленому після вивчення побічних явищ. Таким
чином, повний терапевтичний потенціал лікарського засобу з'ясовувалося іноді
цілими десятиліттями.
Одним з найважливіших сучасних напрямків пошуку
нових лікарських препаратів є дослідження ендогенних фізіологічно активних
сполук, тобто речовин, синтезованих організмом, які беруть участь у здійсненні
процесу життєдіяльності. Однією з перших таких речовин став відкритий в 1895 р.
гормон адреналін. В даний час виділено та ідентифіковано велике число
ендогенних сполук, що представляють по хімічній структурі аміни, амінокислоти,
пептиди, глюкопротеіди, пурини. Вони впливають на регуляцію нервових процесів,
метаболізму, імунні реакції, зростання тканин та інші життєві функції.
Дослідження цих сполук має дуже велике теоретичне і прикладне значення для
різних областей медичної, хімічної, фармацевтичної науки.
З точки зору пошуку нових лікарських засобів
ендогенні сполуки являють інтерес в тих випадках, коли проявляють виражену
специфічну фармакологічну активність. Враховуючи «спорідненість» по відношенню
до організму, вони не викликають алергічних реакцій, а токсичність, як правило,
мінімальна. Рівень розвитку сучасної хімічної науки дозволяє розшифрувати їх
хімічну структуру і здійснити синтез або отримати методами біотехнології та
генної інженерії. Вивчення ендогенних фізіологічно активних сполук відкриває
широкий простір для синтезу аналогів, які мають поліпшені або змінені
властивості, більш високу ефективність, вибірковість, специфічність і т.д.
Число відкритих ендогенних фізіологічно активних
сполук зростає з кожним днем завдяки зусиллям учених різних галузей науки.
Розширюються відомості про спектр їх можливої лікарської активності. В даний
час привернули до себе увагу вироблені різними органами і тканинами фактори
росту, які є речовинами білкової або глікопротеїнової природи. Так, наприклад,
вивчаються в якості потенційних лікарських засобів фактор некротізаціі пухлин,
фактор росту нервових клітин та ін.
.2 Емпіричний і спрямований пошук ліків
Складність створення нових високоефективних
лікарських препаратів обумовлена різноманіттям факторів, що впливають на
фармакологічний ефект.
Пошук біологічно активних речовин, у тому числі
лікарських, складається з двох основних етапів: хімічного синтезу і
встановлення фармакологічної активності отриманого з'єднання. Для кожного з цих
етапів потрібно перебір безлічі варіацій хімічної структури прототипу,
покладеного в основу пошуку. Така стратегія пошуку пов'язана з великою витратою
часу, реактивів, розчинників і праці, але в кінцевому рахунку малоефективна.
Ефективність пошуку біологічно активних сполук
(БАС) складає в даний час близько 0,02%, а за іншими даними, навіть 0,01%,
тобто в середньому з 5000-10000 синтезованих і перевірених на біологічну
активність сполук у практику впроваджується тільки одна лікарська речовина.
Емпіричний пошук здійснюється класичним методом
проб і помилок. Виходячи з емпірично встановлених закономірностей про вплив тих
чи інших функціональних груп на біологічну активність, здійснюють синтез ряду
сполук. Потім проводять попередні випробування, відбирають найбільш активні
речовини, які піддають всебічному фармакологічному дослідженню.
Спрямований пошук, або конструювання ліків,
полягає в теоретичному передбаченні біологічної активності речовини на основі
дослідження її зв'язку з хімічною структурою. Пошук ведеться з широким
використанням методів математичного моделювання і закладених в ЕОМ банків даних
про відомі біологічно активні речовини. Однак сучасний рівень розвитку науки не
дозволяє поки прогнозувати створення нових ліків за рахунок спрямованої
модифікації структур речовин. Занадто складним є характер зв'язку між хімічною
структурою та біологічною активністю. Наші знання фізіологічних і патологічних
процесів, молекулярних механізмів дії тих чи інших функціональних груп ще
недостатні для теоретично обгрунтованого прогнозування терапевтичної цінності
синтезованих сполук. Іншими словами, поки ще не створена загальна теорія
вишукування нових лікарських речовин.
Разом з тим основою для розробки майбутніх теорій
раціонального пошуку ліків, безсумнівно, є узагальнення і розвиток результатів
емпіричного підходу до пошуку ліків. Отже, найбільшого успіху можна досягти
тільки поєднанням теоретичного та емпіричного шляхів створення нових лікарських
речовин.
Емпіричний пошук нових лікарських засобів має
багатовікову історію. Ще давнину були відкриті лікувальні властивості ряду
мінералів і рослин. Починаючи з другої половини XIX ст. у зв'язку з розвитком
синтетичної хімііі емпіричним 56 шляхом були встановлені судинорозширювальні
властивості амілнітріта, снодійна дія хлоралгидрата, протизапальна активність
кислоти саліцилової, купуючий ефект нітрогліцерину при нападах стенокардії,
місцево-анестезуюча дія анестезину, болезаспокійлива та жарознижувальна дію
антіфебріна і антипірина, антисептичні властивості срібла нітрату і розчину формальдегіду
та ін. З кожним роком розширювалося число синтетичних лікарських речовин. Цей
процес відбувався не тільки за рахунок синтезу нових сполук, а й створення на
їх основі хімічної модифікації структури молекул природних і синтетичних
речовин, фармакологічна активність яких була встановлена раніше.
Принцип модифікації молекул використовується і в
даний час як один із шляхів створення нових лікарських препаратів, у тому числі
напівсинтетичних аналогів антибіотиків, гормонів, протипухлинних, серцево-судинних
та ін. Звичайно, техніка проведення. емпіричного пошуку в наші дні стала значно
досконалішою. Оцінка ефективності проводиться не тільки суб'єктивно,
використовуються численні сучасні тести, метод скринінгу та інші методи, що
дозволяють обстежувати велике число синтезованих сполук. Однак застосування і
цих сучасних методів пошуку нових лікарських засобів не є достатньо
результативним. Більш вірогідний при цьому вибір біологічно активних речовин,
що є аналогами у відомих фармакологічних групах. Нові оригінальні лікарські
засоби виявляються при цьому дуже рідко.
До числа емпіричних способів пошуку нових
лікарських препаратів відноситься метод скринінгу (відсіювання) біологічно
активних сполук з величезного числа синтезованих або одержуваних з природної сировини
хімічних речовин.
Одним із сучасних варіантів скринінгу є
багатопараметричний функціональний метод, який дозволяє одночасно реєструвати
на тварин показники функціонального стану різних органів і систем (реєстрація
артеріального тиску, температури, дихання, серцевого ритму і т.д.). На цій
основі здійснюються диференціація і класифікація випробовуваних сполук,
виключаються непридатні для використання як лікарських речовин.
Зараз у ряді великих наукових лабораторій
скринінг здійснюється по 60-80 параметрами з використанням сучасних
фізико-хімічних і біологічних методів випробувань, результати яких обробляються
на ЕОМ. Результати обробки ЕОМ видає в такій формі, яка може допомогти
досліднику знайти корисні закономірності і розробити нові підходи до створення
лікарських речовин.
Однак з кожним роком число синтезованих речовин
все більше зростає. Піддати їх скринінгу з використанням біологічних
експериментів на тваринах малоефективно і економічно невигідно. Тому
розробляються шляхи вдосконалення скринінгу на основі використання не тільки
фізичних, фізико-хімічних, біофізичних, біохімічних, але і обчислювальних
методів. В результаті створені нові варіанти застосування скринінгу, що
дозволяють відібрати з величезного потоку синтезованих речовин ті, які можуть
проявити біологічну активність і повинні бути випробувані на тваринах. Так,
наприклад, метод розрахункового скринінгу дозволяє не тільки здійснювати відсів
малоперспективних з'єднань, але і на підставі вивчення математичної залежності
між хімічною структурою і біологічною дією дати рекомендації для спрямованого
синтезу біологічно активних речовин.
Лікарські речовини, створені в результаті
спрямованої трансформації природних сполук, відносять в даний час до лікарських
засобів першого покоління. Їм на зміну приходять лікарські речовини другого
покоління, отримані в результаті спрямованого скринінгу, причому стратегія
пошуку нових лікарських речовин заснована на знанні молекулярних механізмів дії
хімічних сполук, а також виникнення, розвитку та корекції патологічних станів.
Вибір нових біологічно активних речовин все ширше ґрунтується на їх
спорідненості до терапевтично релевантним рецепторам або ферментам. Внаслідок
цього віднесення до різних груп роблять за механізмом дії (α-адреноблокатори, антагоністи кальцію, інгібітори
ангіотензинперетворюючого ферменту, Н2-антагоністи й ін.), а не за
показаннями (гіпотензивну, протизапальну, противиразкову та інші засоби).
Іншими словами, створюються активні інгредієнти щодо певного патологічного
стану. В останні роки більшість (до 70%) лікарських засобів створені
цілеспрямованим скринінгом.
За прогнозом зарубіжних економістів, в майбутнє
десятиліття різко зросте число нових лікарських засобів, що створюються в
результаті стратегії спрямованого скринінгу активних інгредієнтів, причому
мається на увазі широке використання для цієї мети ЕОМ, тобто мова йде про
конструювання ліків. Розроблені в даний час за кордоном фармацевтичними фірмами
лікарські речовини створюються тільки на основі раціональної стратегії пошуку.
Емпіричним шляхом були створені лікарські засоби
першого і другого покоління. Третє покоління - це раціональне створення
структури лікарських речовин з урахуванням гідрофільно-гідрофобних,
електронних, просторових, біохімічних і фармакокінетичних факторів. Лікарські
речовини четвертого покоління отримані на основі математичного прогнозування їх
хімічної структури з використанням накопиченого арсеналу даних про
функціональної залежності біологічної активності від хімічної структури. Таким
чином, відбувався послідовний перехід від емпіричного до спрямованого пошуку
лікарських речовин.
.3 Шляхи синтезу лікарських речовин
Для отримання лікарських речовин використовуються
різні синтетичні методи. Простіші за хімічною будовою органічні сполуки, що
мають аліфатичну, ароматичну, гетероциклічну структуру, отримують за допомогою
повного органічного синтезу. Його застосовують і для отримання ряду природних
біологічно активних речовин: алкалоїдів (атропін, кофеїн), вітамінів (кислота
нікотинова), антибіотиків (левоміцетин) та ін. Вихідними продуктами синтезу
служать головним чином продукти сухої перегонки кам'яного вугілля.
Широке застосування в медичній промисловості
знайшов частковий синтез (напівсинтез) на основі природних речовин, що мають
схожу з лікарськими препаратами хімічну структуру. Так отримують багато
лікарських речовин, які є синтетичними аналогами алкалоїдів, вітамінів,
продуктами гідролізу глікозидів, напівсинтетичні антибіотики, а також аналоги
андрогенних, гестагенних, естрогенних гормонів, анаболічні стероїдні препарати
та ін.
Синтез лікарських речовин - найважливіша складова
частина фармацевтичної хімії. Разом з тим фармацевтичний синтез - складова
частина органічної хімії. Розвиток досліджень в області фармацевтичного синтезу
(перший етап) бере свій початок з робіт Д.Л. Романовского, І.І. Мечнікова та П.
Ерліха після відкриття і становлення принципів хіміотерапії. Потім у 30-х роках
послідувала ера створення сульфаніламідів (Г. Домагк, О.Ю. Магідсон, М.В.
Рубцов та ін.) А в 40-х роках - ера антибіотиків (Е. Чейн, Е. Ваксман, А.
Флемінг та ін.).
Другий етап фармацевтичного синтезу пов'язаний з
встановленням хімічної структури та отриманням синтетичним шляхом вітамінів,
кортикостероїдів, анаболічних, протитуберкульозних, протипухлинних,
холинолитических, анестезуючих та інших засобів (Р. Вудворд, С.А.Гіллер, М.Н.
Щукіна, Н.А. Преображенський, І.Я. Постовський та ін.).
Третім етапом стало створення простагландинів і
нейрогормонов. Після класичних досліджень лауреатів Нобелівської премії Р.
Елоу, Р.Гіллемена, А. Шелли була встановлена структура нейрогормонів і
синтезовані різні пептиди (Г.І.Чіппенс).
Завдяки успіхам сучасної органічної хімії вдалося
здійснити повний синтез багатьох природних сполук, в тому числі таких складних,
як вітамін В2. Деякі з таких з'єднань (вітаміни, алкалоїди,
стероїди, антибіотики) синтезують в промислових масштабах. Однак складність
технологічних процесів, багатостадійність синтезу стримують розширення такого
шляху отримання ряду цінних лікарських речовин. Це викликає необхідність
розробки спрямованого органічного синтезу, пошуку раціональних синтетичних
схем. Велике значення в цьому плані має вивчення біогенезу природних сполук, що
відбувається в живій клітині через освіту метаболітів.
Мікробіологічнй синтез вітамінів і коферментів
все ширше включається в нові технологічні схеми. Використання досягнень в
галузі фізіології мікроорганізмів - продуцентів біологічно активних речовин -
дозволяє оптимізувати біосинтез і збільшувати їх вихід.
Використання в промисловості зазначених методів
дає можливість застосовувати більш дешеві джерела сировини, у тому числі
промислові відходи, оптимізувати біосинтез, збільшувати вихід продукції,
замінювати дорогі і трудомісткі стадії хімічного синтезу. Вивчення хімії та
біохімії мікробних ферментів не тільки розширює можливості отримання, але
дозволяє виявити існування нових вітамінів і ферментів. Це відкриває шляхи
створення нових лікарських речовин природного походження.
Пошук економічних схем синтезу природних сполук
здійснюється також блоковим методом, що дозволяє отримувати їх малим числом
стадій з великих фрагментів молекул або блоків, які пов'язують між собою. Уже в
самій хімічній структурі багатьох складних природних сполук закладена
інформація про можливі шляхи їх синтезу. Витягти її допомагає блоковий метод на
основі деструктивного підходу, що дозволяє здійснити підбір блоків, необхідних
для подальшого синтезу.
.4 Проведення доклінічних і клінічних випробувань
Після виявлення у досліджуваного з'єднання
фармакологічної активності проводиться ретельне і всебічне його вивчення як
потенційного лікарського речовини. До початку проведення цих випробувань
необхідно розробити способи стандартизації, якісної і кількісної оцінки
доброякісності. Всі доклінічні та клінічні випробування повинні проводитися із
зразками речовин, які попередньо були піддані ретельному контролю якості.
Доклінічні випробування включають перевірку
фармацевтичних, фармакологічних та токсикологічних властивостей біологічно
активної речовини, що проводиться за уніфікованими методиками, затвердженими
Фармакологічним комітетом. Ці випробування мають два основних напрямки:
фармакологічний і токсикологічний.
Фармакологічні дослідження проводяться з метою
встановлення терапевтичної ефективності випробуваного біологічно активної
речовини і її впливу на фізіологічні системи організму.
Токсикологічні випробування дозволяють встановити
характер і ступінь можливого токсичного впливу на організм експериментальних
тварин. Ці дослідження в свою чергу включають три етапи: вивчення гострої
токсичності випробуваного речовини при одноразовому введенні; вивчення
хронічної токсичності, що проводиться шляхом повторних введень протягом одного
року і більше; встановлення специфічної токсичності біологічно активної
речовини, у тому числі канцерогенності, мутагенності, тератогенності,
алергізуючої дії.
Проведені випробування виконують на різних видах
тварин (кішок, собак, мавп), що стоять в генетичному відношенні ближче до
людини. Ці випробування засновані на існуванні певної кореляційної залежності
між впливом випробовуваних речовин на біохімічні процеси, що відбуваються в
організмі людини і тварин. Однак ця подібність аж ніяк не гарантує повної
безпеки пропонованих лікарських речовин для людини. Ось чому необхідно
проведення клінічних випробувань.
Клінічні випробування проводяться тільки з відома
Фармакологічного комітету. Про високі вимоги, які висуваються до потенційних
лікарських речовин, свідчить перелік документів, які подаються у
Фармакологічний комітет для розгляду питання про проведення клінічних
випробувань нового фармакологічного засобу. У їх число входять: коротка
характеристика фармакологічного засобу, інструкція з проведення його клінічного
випробування, звіт про експериментальне випробуванні специфічної та загальної
фармакологічної активності, звіт про дослідження фармакокінетики, звіт про
експериментальне випробуванні токсичності як самого фармакологічного засобу,
так і його готової лікарської форми (у тому числі гострої і хронічної
токсичності, впливу на функції різних органів і фізіологічних систем, а також
патоморфологічних досліджень), дані про алергізуючу, місцево-подразнюючу дію і
вплив речовини на імунну систему, результати лікування отруєнь, пов'язаних з
передозуванням фармакологічного засобу, дані про канцерогенну активності,
тератогенцих і мутагенних властивості, літературні відомості про фармакологічну
дію самої речовини або його прототипів, проект ВФС на досліджуваний
фармакологічний засіб і результати його контрольних аналізів, проект ВФС на
готові лікарські форми з результатами контрольних аналізів і таблицями термінів
придатності, проект назви майбутньої лікарської речовини, економічна довідка
про доступність його виробництва та вартості. До зазначених документів
додаються зразки нового фармакологічного засобу та його лікарських форм.
Остаточний висновок про доцільність застосування
рекомендованого фармакологічного засобу як лікарської речовини в медичній
практиці робиться після отримання результатів клінічних випробувань.
Мета клінічних випробувань полягає в оцінці
терапевтичної ефективності і переносимості нового фармакологічного засобу,
встановленні оптимальних схем і доз його застосування, проведенні порівняльної
оцінки з існуючими лікарськими речовинами.
Процес клінічних випробувань включає кілька
етапів. Перший з них є «пристрілювальним», виконується на обмеженому числі
хворих (до 10 осіб) і має на меті встановити наявність терапевтичної дії та
переносимості фармакологічного засобу. Другий етап виконується на 100-200
хворих, причому паралельно з контрольною групою. Обидві групи підбираються однаковими
за статтю, віком, вихідному фоновому лікуванню і т.д. Проводяться клінічні
випробування другого етапу за методом подвійного «сліпого» дослідження, тобто в
умовах, коли ні хворий, ні лікар не знають, який препарат отримує даний хворий.
Третій етап клінічних випробувань ведеться на кількох сотнях хворих і
призначається для отримання додаткових відомостей про терапевтичну активність і
побічні ефекти випробуваного засобу.
У ряді випадків проводиться і четвертий етап
клінічних випробувань. Він виконується після дозволу до застосування та
впровадження нового лікарського засобу в медичну практику. При цьому вивчається
дія даного препарату в різних можливих ситуаціях. Особлива увага приділяється
збору та узагальненню різної інформації про побічну дію лікарського засобу.
Всі отримані по перших трьох етапах клінічних
випробувань результати оформляються у вигляді звіту і представляються в
Фармакологічний комітет. Міністерство охорони здоров'я приймає остаточне
рішення про застосування лікарського засобу, включення його в «Державний реєстр
лікарських засобів, дозволених для застосування в медичній практиці і до
промислового виробництва».
Позитивне рішення приймається тільки в тих
випадках, якщо новий лікарський засіб більш ефективний, ніж інші аналогічної
дії, має кращу переносимість, проявляє позитивний ефект при станах, що не
піддаються лікуванню відомими лікарськими засобами, вигідніший економічно, має
більш зручну лікарську форму або більш просту методику лікування, підвищує
активність існуючих лікарських засобів при комбінованій терапії, не збільшуючи
при цьому їх токсичність.
3. Отримання лікарських речовин
.1 Джерела отримання лікарських речовин
Джерелом отримання неорганічних лікарських
речовин є мінеральна сировина, причому використовують або самі мінерали, або
окремі елементи.
Для одержання синтетичних органічних лікарських
речовин застосовують продукти сухої перегонки кам'яного вугілля, дерева,
горючих сланців, а також різні фракції нафти. Переробкою цих видів сировини
займається коксохімічна, лісохімічна та нафтопереробна промисловість. Продукти
переробки широко використовуються в самих різних галузях народного
господарства, в тому числі і в медичній промисловості.
Кам'яновугільна смола являє собою складну суміш,
яка включає більше 400 різних ароматичних і гетероциклічних сполук. За
допомогою ректифікаційних колонок кам'яновугільну смолу піддають розділенню на
фракції.
Потім кожну фракцію переганяють в більш вузькому
температурному інтервалі, виділяючи індивідуальні речовини. Для їх очищення
використовують адсорбцію, обробку сірчаною кислотою (сульфування), лугами
(виділення фенолятів) і т.д. Виділені індивідуальні речовини служать вихідними
продуктами для синтезу різних органічних речовин, у тому числі лікарських
препаратів.
Аналогічно переробляють деревину, яка при сухій
перегонці утворює деревне вугілля та дві фракції рідин. Одна з них містить
метиловий спирт, ацетон і оцтову кислоту, а інша (деревне дьоготь) - феноли і
деякі інші органічні речовини. Деревина є також джерелом отримання фурфуролу.
Використовують як вихідних речовин для синтезу
лікарських засобів продукти переробки нафти, яка являє собою суміш вуглеводнів
різних класів. У медицині та фармації застосовують тільки суміші рідких і
твердих граничних вуглеводнів, одержуваних при перегонці нафти.
Більше 40% лікарських засобів, що
використовуються в медицині, мають рослинне походження. Як правило, їх
відрізняють мала токсичність і відсутність побічних ефектів при тривалому
застосуванні. В даний час, за даними ВООЗ, в 73 країнах світу для лікувальних
цілей застосовують близько 10000 видів лікарських рослин, але в офіційні
видання 38 країн входить тільки 1884 вида. У 1978 р. експертами ВООЗ було
складено «Перелік найбільш широко використовуваних у всьому світі видів
лікарських рослин», до якого увійшли 235 найменувань. У нашій країні
застосовують приблизно 170 видів рослин і отримують з них більше 100 лікарських
речовин, у тому числі близько 50 алкалоїдів і 20 серцевих глікозидів.
Рослинна сировина - листя, квітки, корки,
насіння, плоди, коріння рослин - саме по собі може представляти лікарські
засоби. Крім того, з цієї сировини виділяють ефірні і жирні олії, смоли, білки,
вуглеводи, які або прямо використовують як лікарські засоби, або в якості
вихідної сировини для їх отримання. Рослинна сировина є джерелом отримання
природних біологічно активних речовин: алкалоїдів, терпенів, глікозидів,
вітамінів. Виділені у вигляді індивідуальних сполук, вони являють собою
лікарські речовини. Шляхом екстракції з рослинної сировини отримують також
галенові препарати.
З сировини тваринного походження отримують
індивідуальні речовини - гормональні препарати. До цього виду сировини
відносять органи, тканини, залози забійної худоби. Продуцентами антибіотичних
речовин є мікроорганізми. Вони стали джерелами отримання найцінніших лікарських
препаратів - антибіотиків.
Великі перспективи має використання гідробіонтів
(морських організмів) для отримання лікарських речовин. Гідробіонти виявилися
носіями азотовмісних, аліфатичних речовин, галогенвмісних з'єднань ароматичного
ряду (похідних бензолу), гетероциклічних похідних, що містять гетероатом азоту,
полієнових кислот, терпеноїдів та ін.
Однією із загальних тенденцій розвитку
хіміко-фармацевтичної промисловості в країні був перехід від виділення
індивідуальних лікарських речовин з важкодоступного рослинного та іншої
сировини до здійснення їх повного синтезу. Уже в 30-х роках здійснений
промисловий синтез пілокарпіну, в наступні роки кофеїну, теофіліну, теоброміну,
потім левоміцетину, ефедрину, атропіну, гоматропіну та ін.
.2 Отримання лікарських речовин на основі застосування
біотехнології
Одним з перспективних шляхів отримання лікарських
речовин є біотехнологія з використанням методів генної інженерії. Її основу
складають генетичні ресурси, закладені в клітинах рослин, тварин і
мікроорганізмів. Сучасний рівень розвитку хімії, біології та інших наук
дозволяє змінювати молекули, що входять до складу біологічних систем, і
створювати варіанти рослин, тварин, бактерій, які не могли з'явитися в процесі
природної еволюції.
Біотехнологія - це технологія отримання різних
продуктів з живих клітин різного походження.
Успішний розвиток біології значно збагатив такі
напрямки біотехнології, як технічна біохімія, мікробіологія, і призвів до
виникнення принципово нових, перспективних напрямків - генетичної та клітинної
інженерії. Розвиток цих напрямків створює можливості оволодіння біологічними
процесами. Об'єктами біотехнології є культивовані тканини і клітини тварин і
рослин (вищих організмів), а також мікроорганізми, створені методами генної
інженерії, тобто шляхом перенесення генетичного матеріалу від одних організмів
до інших, в тому числі і від вищих до одноклітинних.
Поняття «клітинна інженерія» включає використання
або самих культивованих клітин, або різних маніпуляцій з ними для створення
нових технологій.
Клітинне конструювання здійснюють гібридизацією
або введенням в них чужорідного генетичного матеріалу (клітинних органел,
бактерій). Результатом клітинного конструювання є поліпшення клітин-продуцентів
в культурі або отримання клітинних систем з новими властивостями, а в разі
рослинних клітин - отримання рослин з новими властивостями.
Біотехнологія забезпечує найпрогресивніші методи
отримання нових лікарських речовин. Починаючи з другої половини 70-х років в
нашій країні і за кордоном, особливо в США, Японії, ФРН, створена галузь
біотехнології, що забезпечує отримання лікарських речовин на основі
використання генної інженерії. За допомогою генної інженерії були розроблені
нові штами мікроорганізмів, що дозволили отримати гормональні речовини,
здійснити мікробіологічний синтез інсуліну, інтерферону та інших цінних
речовин, синтезованих тільки організмом людини.
Надзвичайно важливо, що в якості джерел сировини
для біотехнології все ширше використовуються нехарчові рослинні ресурси і
відходи сільського господарства, харчової промисловості. Це дозволяє
перетворити біотехнологію в безвідходне виробництво. Порівняльна оцінка
тривалості традиційних і біотехнологічних методик переконливо підтверджують
переваги останніх.
Найбільший інтерес для фармації представляють
такі галузі біотехнології, як виробництво вторинних метаболітів, протеїнова
технологія, отримання моноклоніальних антитіл, інженерна ензимологія.
Традиційна методика отримання лікарських речовин
шляхом вирощування рослин на дослідному полі вимагає тривалого часу (1-6
місяців). Більш економічно використання біотехнологічної методики, заснованої
на вирощуванні калусних і меристемних клітинних культур (7-10 днів). При
отриманні біологічно активних речовин з тваринних тканин традиційний спосіб
розведення тварин вимагає 1-9 місяців, Вирощування культури клітин тканини на
твердій фазі - 7-10 днів. Найменше часу, всього 1-3 дня, потрібно для отримання
біологічно активних речовин шляхом культивування мікроорганізмів, так як вони
ростуть швидше клітин рослин і тварин і вимагають простих поживних середовищ.
Сутність протеїнової технології полягає у
застосуванні генетично змінених мікроорганізмів. Це дозволяє значно знизити
вартість дорогих лікарських речовин, наприклад таких, як інсулін або інтерферон,
що вимагають для виробництва дефіцитного природного сировини.
Так, найбільш продуктивними для отримання
інтерферону є дріжджові клітини. Введення в них чужого гена здійснюють за
допомогою вектора, яким служать міні-хромосоми (плазміди), що містяться в багатьох
бактеріях і складаються з маленьких кільцевих молекул ДНК. Технологія введення
гена полягає в його виділенні бактерії, створенні рекомбінантних ДНК,
вмонтування їх у мікробну або тваринну клітину - реципієнт, яка набуває нову
властивість - продукувати заданий білок.
Отримання моноклоніальних антитіл - метод імунної
біотехнології. Він заснований на створенні гібридів, які продукують
моноклоніальні антитіла до багатьох антигенів бактерій, вірусів, тварин і
рослинних клітин. Метод дозволяє отримувати чисті ферменти і білки.
Технологія отримання лімфоцитарних гібридів
включає такі етапи, як отримання мієломної лінії, селезінкових клітин від
імунізованого організму, створення в культурі умов для злиття хоча б деяких
клітин однієї й іншої популяції, виділення і вирощування клітин, дезінтеграцію
клітин, виділення та очищення білка або ферменту.
Важливою складовою частиною сучасної
біотехнології є інженерна ензимологія. Одне з її досягнень - створення
іммобілізованих ферментів - нового типу біокаталізаторів. На відміну від
природних ферментів вони володіють термостабільністю, працюють в широкому
інтервалі pH, можуть використовуватися багаторазово, легко відділяються від
продуктів реакції. В хіміко-фармацевтичній промисловості іммобілізовані
ферменти використовуються для розділення рацемічних сумішей амінокислот,
біосинтезу ряду природних речовин та їх напівсинтетичних аналогів, зокрема
6-амінопеніциланової (6-АПК) і 7-амінодезацетоксицефалоспоранової кислот та ін.
Поряд з виконанням функції активних біокаталізаторів іммобілізовані ферменти
перспективні в створенні нових лікарських форм орального, ректального,
трансдермального та інших шляхів введення лікарських речовин. Розвиток
біотехнології, широке впровадження мікробіологічних методів у різні галузі
промисловості стало стимулом для їх використання у виробництві ряду лікарських
речовин.
Більшість органічних кислот отримують хімічними
методами з продуктів переробки нафти і сухої перегонки деревини. Однак, коли
кислота використовується для харчових або медичних цілей або синтез її є
складним, доцільно використовувати мікробіологічні методи. Зараз лимонну,
глюконову, кетогулонову і ітаконову кислоти отримують тільки мікробіологічними
шляхом, а молочну та оцтову - як хімічним, так і мікробіологічним методами. Багато
з цих кислот або самі є лікарськими речовинами, або використовуються в якості
вихідних продуктів їх синтезу або отримання солей. Основною сировиною для
виробництва органічних кислот раніше служили вуглеводи (глюкоза, сахароза,
крохмаль). Починаючи з 60-х років для цієї мети все ширше використовується
нехарчове сировина - нормальні парафіни нафти в поєднанні зі спеціально
селекціонованими штамами дріжджів.
Мікроорганізми є також продуцентами амінокислот,
що використовуються в медичній практиці, або як напівпродукти синтезу
лікарських речовин. Виробництво амінокислот в даний час - широко розвинена
галузь біотехнології. У нашій країні широко розвинене промислове виробництво
триптофану, лізину, лейцину, ізолейцину, проліну та інших амінокислот.
Технологія виробництва заснована на керованому процесі ферментації з
використанням методів традиційної селекції. З цією метою попередньо проводиться
відбір мутантів для створення штамів - продуцентів тієї чи іншої амінокислоти.
Такі штами є активними продуцентами амінокислот, у тому числі застосовуваних у
медицині.
При отриманні ряду лікарських речовин
використовується мікробіологічна трансформація органічних сполук, тобто
перетворення одних органічних сполук в інші, здійснюване ферментами
мікроорганізмів. Перевага мікробіологічної трансформації в порівнянні з
органічним синтезом полягає в специфічності дії ферментів і виконанні
біосинтезу в «м'яких» умовах (у водному середовищі при температурі не вище
100°С), що значно спрощує технологію. При цьому істотно зменшується утворення
побічних продуктів і шкідливих відходів.
В даний час мікробіологічна трансформація може
бути застосована для перетворень органічних сполук з допомогою таких процесів,
як окислення, відновлення, амінування, декарбоксилювання, дезамінування,
гідроліз, метилювання, конденсація, етерифікація, галогенування, ізомеризація,
розщеплення на оптичні антиподи, синтез нуклеотидів з попередників і ін.
У нашій країні мікробіологічна трансформація
широко використовується при промисловому отриманні стероїдних гормонів, зокрема
преднізолону з гідрокортизону, преднізону з кортизону, гідрокортизону з
кортексолона і т.д. Застосування мікроорганізмів у синтезі таких лікарських
речовин, як кортизон, гідрокортизон і ін., дозволило у багато разів знизити
вартість виробництва. Ряд полісахаридів, що використовуються в медицині як
замінники плазми крові, також продукується мікроорганізмами. Ферменти, будучи
складними за хімічною структурою сполуками, в більшості випадків можуть бути
отримані тільки на основі мікробіологічного синтезу. Ферменти все ширше застосовуються
як лікарських речовин. Важливою галуззю використання мікроорганізмів є
отримання вакцин для медичних цілей.
Великі переваги у біотехнології алкалоїдів на
основі мікробіологічного синтезу в порівнянні з методами їх отримання з
рослинної сировини. Знаючи біохімічні особливості мікроорганізмів-продуцентів і
механізм біосинтезу алкалоїдів, можна направлено управляти процесом
мікробіологічного синтезу, який до того ж не залежить від погодних умов і може
бути максимально автоматизований. Методами селекції та генетики на основі диких
штамів отримують високоактивні продуценти алкалоїдів. Великий інтерес
представляють, наприклад, гриби і, зокрема, аскоміцети роду Claviceps, що
синтезують ергоалкалоіди.
Інтенсивний розвиток біотехнології відкриває нові
перспективи практичного застосування мікроорганізмів для отримання вітамінів і
коферментів, створює можливості для вдосконалення технічного рівня цих
виробництв, впровадження в практику процесів керованого безперервного
культивування. Великі можливості створює застосування в біотехнології вітамінів
таких джерел сировини, як вуглеводні, нижчі спирти і кислоти.
За допомогою біотехнології була вирішена проблема
отримання рибофлавіну, широко вживаного в медичній практиці. Методи генної
інженерії дозволяють в бацилах розмножувати гени, що відповідають за біосинтез
рибофлавіну. В результаті проведених досліджень кількість продукуємого
рибофлавіну зросла в 4-5 тис. разів. Мікроорганізми служать продуцентами
аскорбінової кислоти (на ряді етапів її отримання), β-каротину, деяких цитохромів і нуклеотидів, тіаміну,
ціанокобаламіну та ін.
Основну частину біотехнологічної продукції
займають антибіотики, потреба в яких дуже велика. При цьому біотехнологія
дозволяє вирішити дві проблеми: збільшити обсяг виробництва антибіотиків і
разом з тим зменшити їх негативний вплив на організм. Вирішенню цих проблем
сприяло створення науковим колективом ВНДІ антибіотиків під керівництвом акад.
АМН С.М. Навашином так званих «ключових з'єднань» для виробництва нових
антибіотиків. Для цієї мети з мікроорганізмів виділені речовини, що прискорюють
процеси утворення антибіотиків. Вміщені в спеціальні полімерні гранули, вони
протягом тривалого часу дозволяють отримувати нові антибіотики в промисловому
масштабі. Реактори, в яких відбувається цей процес, відрізняються високою
продуктивністю, займають мало місця, відходів практично не дають. Отримане нове
покоління антибіотиків має більш широкий спектр антимікробної дії. Вони
практично не викликають алергічних реакцій.
.3 Отримання лікарських речовин із рослинної і тваринної сировини
Основою для проведення досліджень в галузі
створення нових лікарських речовин з рослин зазвичай є відомості, наявні в
народній медицині, або інші передумови, що дозволяють вважати, що в рослині
містяться біологічно активні речовини. Під час проведених
вченими-фармакогностами експедицій ці рослини збираються, оцінюються їх запаси,
територіальне поширення. Для створення лікарських речовин не можна
використовувати рідкісні рослини або ті з них, які увійшли до «Червоної книги».
Обов'язковою умовою є наявність необхідних ресурсів для вихідної сировини. Якщо
її в природі недостатньо, то вона вводиться в культуру, що також вимагає
проведення необхідних випробувань.
Для отримання лікарських засобів перспективні
рослини піддають хімічним дослідженням. При цьому вивчається процес накопичення
біологічно активних речовин залежно від кліматичних, вікових, сезонних, добових
змін. Це дозволяє вибирати оптимальні умови вирощування або заготовки
дикоростучої лікарської рослинної сировини. Потім здійснюють розробку
оптимальних умов виділення суми і подальшого поділу біологічно активних
речовин.
Незважаючи на створення нових технологічних
прийомів і використання сучасних фізико-хімічних методів, виділення біологічно
активних речовин з рослинної і тваринної сировини, їх поділ та очищення являють
собою складну задачу. Незважаючи на різноманіття видів сировини, фізичних і
хімічних властивостей видобутих сполук, процес їх виділення складається в
основному з наступних стадій: подрібнення вихідної сировини, приведення його у
тісний контакт з розчинником, відділення екстракту від сировини, видалення і
регенерація розчинника з екстракту та вихідної сировини, виділення та очистка
біологічно активної речовини.
Екстракція природних речовин з рослинних або тваринних
тканин може бути здійснена або витягом комплексу містяться в них сполук з
наступним поділом на окремі компоненти, або послідовної екстракцією окремих
з'єднань або класів сполук. Зазвичай в рослинах міститься кілька біогенетично
пов'язаних сполук, подібних за хімічною структурою та властивостями, що значно
ускладнює завдання. Ось чому найчастіше витягується сума біологічно активних
речовин з домішкою супутніх природних сполук, що містяться у вихідній сировині.
З раніше не дослідженої рослинної або тваринної
сировини екстракцію послідовно проводять розчинниками з підвищенням полярності.
Якщо об'єктом служать сухі тканини, то проводять возгонку або перегонку з
водяною парою з наступною екстракцією наступними розчинниками: петролейним
ефіром, діетиловим ефіром, хлороформом, етанолом, водою (послідовно - холодною,
теплою, підкисленою, підлуженою). У разі необхідності створюють більш вузькі
інтервали pH водних розчинів. Нерідко з отриманих водних витягів біологічно
активні речовини екстрагують розчинником, не що змішується з водою (ефіром,
хлороформом). Потім після відділення екстракту і відгону розчинника отримують
виділяється речовина.
При виділенні біологічно активних речовин
необхідно враховувати можливість їх розкладу під впливом розчинників,
температури, умов виконання екстракції, а також впливу ферментів, що містяться
в рослинному або тваринному сировину. Особливо важливо враховувати ці обставини
при проведенні перекристалізації, сублімації, різних видів перегонки. Тому для
очищення лабільних органічних речовин зазвичай користуються перегонкою у
вакуумі при 13,33-19,99 Па (10-15 мм рт. ст.) або високому вакуумі при
1,33-0,133 Па (0,01-0,001 мм рт. ст.).
Головну масу рослинної сировини становлять
клітковина, білки, хлорофіл, смоли, слизу, дубильні та інші речовини. Тому дуже
складно відокремити біологічно активні природні сполуки від цих супутніх
речовин. В хіміко-фармацевтичної промисловості для цієї мети поки ще широко
використовуються різні варіанти екстракції (безперервна, напівбезперервна,
реекстракція і ін.). Застосовують також більш сучасні методи розділення,
наприклад метод багаторазового фракційного екстрагування, або метод
протиточного екстрагування, а також електрофорез, діаліз, що дозволяють
розділяти складні суміші високомолекулярних речовин.
Поряд з цими методами все ширше використовують
різні варіанти хроматографії. Для виділення, розділення і очищення від домішок
органічних сполук користуються колонковою і йонообмінною хроматографією.
Важливим етапом отримання антибіотиків,
вітамінів, ферментів та інших біологічно активних речовин є процес їх виділення
з культуральних рідин. З цією метою використовують такі традиційні методи, як
екстракція органічними розчинниками і подальша сорбція на іонообмінних смолах,
активованому вугіллі, силікагелі, оксиді алюмінію. Методи виділення та
оптимальні значення pH підбирають емпірично. Недоліками зазначених методів є
можлива дезактивація біологічно активних речовин внаслідок низької їх
стабільності і недостатня ступінь очищення. Більш перспективне використання для
виділення методу гельпронікаючої хроматографії, що дозволяє розділяти суміші на
складові компоненти, що розрізняються за молекулярною масою. Хімічна інертність
використовуваних при цьому нерухомою і рухомою фаз виключає можливість
дезактивації виділяються речовин. У разі необхідності хроматографічний процес
поділу нестабільних речовин можна проводити в холодильній камері.
Виділене нове з'єднання піддають структурному
хімічного дослідження, а потім вивчають його фармакологічна дія.
.4 Отримання лікарських речовин методом культури тканин вищих
рослин
У нашій країні заготовлюються десятки тисяч тонн
лікарської рослинної сировини, близько 70% якого переробляється на
підприємствах медичної промисловості. Однак потреба в біологічно активних
речовинах, що містяться в рослинах, з кожним роком зростає, а природні запаси
лікарських рослин знижуються внаслідок інтенсивної урбанізації, освоєння нових
орних земель, скорочення лісових угідь і т.д.
Зазначені обставини зажадали вишукування нових
шляхів отримання біологічно активних речовин. Одним з них є принципово новий
метод отримання цих речовин, заснований на використанні як сировини ізольованих
тканин і клітин, що ростуть на штучних поживних середовищах. Доведено, що в цих
умовах рослинні клітини здатні синтезувати різні біологічно активні речовини
подібно до того, як це відбувається при вирощуванні самої рослини. Крім того,
клітини культури тканин можуть бути використані для біотрансформації ряду
біологічно активних сполук. Все це дає можливість розробки технології отримання
лікарських речовин, що володіють різним фармакологічною дією.
Слід, однак, врахувати, що в культурах клітин, як
правило, різко знижується здатність до синтезу вторинних метаболітів у зв'язку
з частковою втратою реалізації генетичної інформації, що відноситься до
вторинного обміну. Тому необхідно створювати специфічні умови, зокрема введення
регуляторів росту, елементів живлення, біохімічних мутантів, щоб у клітинах
культур тканин відбувався спрямований біосинтез.
Дослідження в галузі культури тканин і клітин
різних рослин проводяться в останні десятиліття у багатьох країнах, особливо в
США, Англії, Японії. Основні напрямки досліджень - отримання штамів культур
лікарських рослин і скринінг виділяються ними біологічно активних сполук,
отриманих в умовах культур тканин рослин для виявлення найбільш ефективних
лікарських речовин.
Наукові основи методу культури тканин вищих
рослин почали розроблятися в нашій країні в 1959 р. в Інституті фізіології
рослин АН СРСР ім. К.А. Тимирязева. Тут ведуться дослідження культури тканини
маку снодійного - джерела морфінових алкалоїдів. Враховуючи складність синтезу
цієї групи алкалоїдів і ліквідацію посівів маку снодійного, культура його
тканини залишається єдиним шляхом отримання алкалоїдів групи морфіну.
Систематичні дослідження культури тканини зміїної
і женьшеню проводяться в С.-Петербурзькому хіміко-фармацевтичному інституті.
Розроблено оригінальну технологію вирощування тканин. Активізуються роботи в
ВІЛР з культивування тканин таких лікарських рослин, як крестовнік
ромболістний, скополія гімалайська, наперстянка шерстиста і червона, паслін
часточковий, діоскорея дельтовидна, стефанія гладка.
Виробництво біомаси культури тканини зміїної вже
здійснюється в дослідно-промисловому масштабі на Харківському фармацевтичному
заводі «Здоров'я трудящим». Біомаса служить джерелом отримання володіючих
протиаритмічною дією алкалоїду аймалина та інших індолінових алкалоїдів.
Екстракцію алкалоїдів можна робити як з висушеної (вихід до 88%), так і з сирої
(до 80%) біомаси. Технологія виділення алкалоїдів з біомаси мало відрізняється
від їх отримання з рослинної сировини. Виділення індолінових алкалоїдів у
вигляді підстав здійснюють з самочинного аміаком сировини перколяції
метиленхлоридом (хлористим метиленом). Відгонку останнього виконують до
отримання сухого залишку, який розчиняють у водному розчині ортофосфорної
кислоти. Фосфорнокислий розчин підлужнюють 50% розчином гідроксиду натрію до pH
5,0-5,3 і екстрагують для видалення слабких основ хлороформом. Потім до водного
розчину додають 25% розчину аміаку до pH 8,0-8,5 і знову екстрагують
хлороформом. При цьому виділяється технічний аймалин з виходом 74,8%.
Звичайно, культура рослинних тканин не завжди
може замінити традиційні способи вирощування лікарської сировини. У тих випадках,
коли сировинна база може бути легко забезпечена за рахунок гарантованих запасів
дикорослих видів в природі або в умовах сільськогосподарського виробництва, не
має сенсу займатися клітинної промисловою технологією. Однак безперечний
інтерес така технологія представляє для ендемічних видів, багатьох тропічних і
субтропічних рослин, вирощування яких в силу кліматичних умов неможливо в нашій
країні (строфант, пілокарпус, фізостігма, іпекакуана, чілібуха та ін.).
4. Хімічні реакції, що використовуються для синтезу лікарських
речовин
.1 Класифікація хімічних реакцій, що використовуються для синтезу
Отримання органічного лікарської речовини -
складний процес, нерідко складається з 10-20 стадій і більше. Він включає
безліч технологічних операцій, заснованих на хімічних, фізичних і
фізико-хімічних методах. Вихід готової продукції залежить від складності
технології та інших факторів. Він коливається в дуже широких межах (від 1-2 до
50-80%). Хімічні реакції, використовувані для синтезу органічних лікарських речовин,
можна класифікувати на три основні групи: реакції заміщення, реакції
перетворення замісників та реакції окислення-відновлення.
Реакції заміщення - ці реакції засновані на
заміщенні атомів водню в аліфатичному ланцюзі, ароматичному, гетероциклічному
ядрі або у функціональній групі різними замісниками. Реакції заміщення
використовують для того, щоб надати синтезованій речовині будь-які нові
властивості або отримати проміжний продукт з властивостями, необхідними для її
подальшого перетворення в лікарську речовину.
Реакції перетворення замісників - ця група
реакцій заснована на хімічних перетвореннях замісників, наявних в молекулі
проміжного продукту, щоб надати йому нові властивості або змінити його
реакційну здатність.
Реакції окислення-відновлення. Відновлення та
окиснення - єдиний процес, в результаті якого одна група атомів відновлюється,
набуваючи при цьому електрони, а інша група атомів окислюється. В
окисно-відновних реакціях відбувається не тільки зміна ступеня окислення, але і
змінюється склад молекули.
4.2 Реакції заміщення
Реакції сульфування і сульфохлорування.
Сульфування - процес заміщення атома водню в органічному поєднанні сульфогруп -
SO3H, здійснюваний впливом сульфуючих агентів (концентрованої
сірчаної кислоти, хлорсульфонової кислоти).
Сульфуванням піддають в основному ароматичні
вуглеводні, їх аміно- і оксипохідні. При цьому зазвичай утворюється суміш
декількох сульфокислот (моно-, ди-, трисульфокислота). Загальна схема реакції:
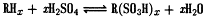
Сульфування здійснюють з різними цілями:
поліпшення розчинності, подальше перетворення сульфогрупи в гідроксильну або
аміногрупу і т.д.
Сульфування ароматичних сполук є процесом
електрофільного заміщення. Ця реакція має проміжну стадію утворення комплексу:
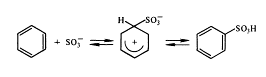
Процес сульфохлорування відбувається при
взаємодії 4-5-кратного надлишку хлорсульфонової кислоти з ароматичними
вуглеводнями:
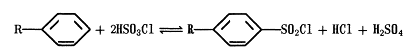
Утворені сульфохлоріди являють собою важливі
проміжні продукти синтезу амідів сульфокислот (хлораміни, пантоцин),
сульфаніламідних препаратів, алкілуреідов сульфокислот (бутамід, хлорпропамід
та ін.).
Реакція нітрування. Нітрування - процес заміщення
атома водню в органічному з’єднанні нітрогрупи. Процес здійснюють дією різних
нітра-агентів (азотна кислота, суміш азотної та сірчаної кислот, суміш азотної
і оцтової кислот, суміш нітратів з сірчаною кислотою та ін.).
Процес нітрування бензолу, толуолу, нафталіну і
їх хлор-, аміно-, окси- і сульфопохідних дуже широко застосовують у
хіміко-фармацевтичній промисловості. При нітруванні утворюються суміші моно-,
ди- і тринітросполук за схемою:
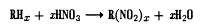
Нітрування - типова реакція електрофільного
заміщення іоном нітронія. На відміну від реакції сульфування вона необоротна:
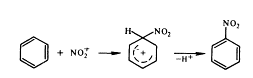
Нітросполуки або самі є лікарськими речовинами
(левоміцетин, фурацилін та ін.), Або являють собою проміжні продукти синтезу
аміносполук.
Реакція галогенування. Введення галогену в
молекулу органічної сполуки, або галогенування, - одна з дуже поширених реакцій
у синтезі проміжних продуктів. Залежно від природи вихідних речовин та умов
виконання реакція галогенування може протікати або як реакція заміщення атома
водню, або як реакція приєднання.
Поряд з моногалогенідами в реакціях заміщення
утворюються ди- і тригалогензаміщені за схемою:
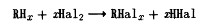
а в реакції приєднання:
Пряме фторування зазвичай не використовують через
технологічні труднощі. Найчастіше проміжними продуктами синтезу лікарських
препаратів є хлорпохідні. Бромування і йодування використовують рідше.
Процес галогенування в залежності від умов
реакції протікає по-різному. Так, наприклад, хлорування в ароматичному ядрі в
присутності каталізатора (солей заліза) протікає по типу електрофільного
заміщення:
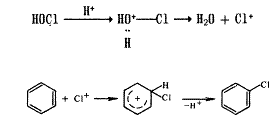
Якщо в відсутність каталізаторів під впливом
ультрафіолетового опромінення піддати хлоруванню арилароматичні з'єднання, то
відбувається хлорування бічного ланцюга. Заміщення водню в ароматичному ядрі
при цьому не відбувається. Залежно від умов виконання галогенування йде за
схемою:
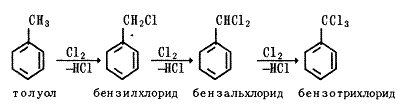
Хлорування аліфатичних спиртів - важливий етап
синтезу аліфатичних, ароматичних і гетероциклічних протипухлинних лікарських
препаратів, що містять в молекулі біс - (β-хлор-етил) -
амін групу:

Реакції конденсації. Карбонільні з'єднання
(альдегіди і кетони) є вихідними і проміжними продуктами синтезу багатьох
лікарських речовин. Використовують різні реакції карбонільних сполук, але
особливо широко - реакції конденсації. До цієї ж групи слід віднести реакції
конденсації карбонові кислот, що є продуктами окислення альдегідів. Реакції
конденсації являють собою одну з різновидів реакцій заміщення. Процес
конденсації супроводжується відщепленням молекули води або спирту.
Первинні аміни конденсуються з альдегідами в
основи Шифа (азометинів):
Процес конденсації відбувається при взаємодії
формальдегіду з гідразинами і гідразидом:
Кетони містять карбонільну групу >С=О. Вони
утворюють продукти конденсації з гідроксил аміном, гідразинами, семікарбазидом,
тіосемікарбазидом. Загальна схема цих реакцій:
Гідроксиламін з кетонами утворює оксими:
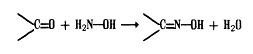
Гідразини дають відповідні гідразони:
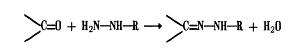
Семікарбазид і тіосемікарбазид конденсуються з
альдегідами, утворюючи семікарбазони і тіосемікарбазони:
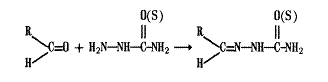
Класичним прикладом реакції конденсації
альдегідів є синтез гексаметилентетраміна з формальдегіду та аміаку.
Продукти окислення альдегідів - органічні кислоти
- утворюють різні похідні з аміносполук. Так, наприклад, взаємодіючи з
диалкіламіном, ароматичні та гетероциклічні монокарбонові кислоти утворюють
диалкіламіди:
Реакцію амідування сульфохлоридів використовують
у синтезі амідів сульфокислот, сульфаніламідів, алкілуреідов сульфокислот та
ін. Процес відбувається під дією амінопохідними за загальною схемою:
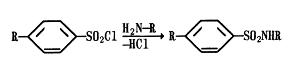
Органічні кислоти (їх ефіри, ангідриди),
взаємодіючи з гідразином, утворюють гідразиди:
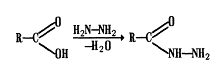
Амідування лежить в основі синтезу з сечовини
ациклічних і циклічних уреїдів. Ациклічні урєїди отримують з бромангідріда
аліфатичної кислоти:
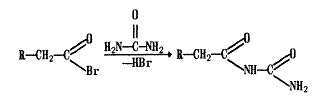
Конденсацію сечовини з малоновою кислотою (або її
ефірами) використовують для синтезу похідних барбітурової кислоти, які є
циклічними уреідов:
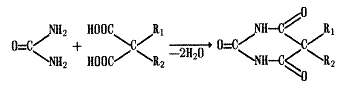
Цю схему синтезу слід розглядати як один з
варіантів отримання похідних піримідину, до числа яких відносяться барбітурати.
Реакції нейтралізації. Нейтралізація - один з
поширених хімічних процесів, широко застосовуються для синтезу лікарських
речовин. Солі аліфатичних, ароматичних і гетероциклічних кислот отримують
використовуючи процес нейтралізації гідроксидами або карбонатами лужних
(лужноземельних) металів, взятих в еквівалентних кількостях, за загальною
схемою:
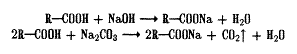
Численні лікарські препарати з числа органічних
основ, що містять третинний атом азоту, застосовують у вигляді солей
неорганічних (гідрохлоридної, гідробромідної, гідроіодідної, фосфатної) і
органічних (бензоатної, саліцилатної, лактатної, гідротартратної) кислот.
Отримують ці солі нейтралізацією органічних основ, наприклад соляною кислотою:
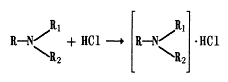
де R - аліфатичний, ароматичний або
гетероциклічний радикал; R1 і R2 - аліфатичні радикали.
4.3 Реакції перетворення замісників
Реакції приєднання та елімінування (відщеплення).
Приєднання - процес взаємодії ненасичених сполук з іншими елементами і
речовинами, в результаті якого відбувається розрив ненасичених зв'язків з
одночасним приєднанням відповідних замісників:
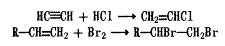
Реакції приєднання притаманні карбонільним
з'єднанням. При обробці альдегідів концентрованим водним розчином гідросульфіту
натрію утворюються Гідросульфітні сполуки (похідні оксіметіленсульфоната
натрію):
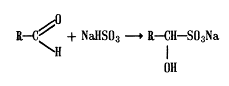
Наявність у молекулі такого радикала дозволяє
поліпшити розчинність лікарської речовини.
До цієї ж групи реакцій можна віднести процес
гідратації - приєднання води. При приєднанні до альдегідів молекули води
утворюються гідрати (1,1-діоли):
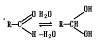
Елімінування - процес, зворотний приєднанню. Він
відбувається, наприклад, при утворенні ненасичених сполук:
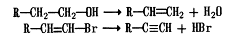
До реакцій елімінування можна віднести
дегідратацію (відщеплення води); декарбоксилювання (відщеплення діоксиду
вуглецю):
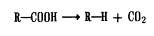
декарбонілювання (відщеплення монооксиду
вуглецю):
дегідрогалогенування (відщеплення галогеноводню);
дегалогенування (відщеплення галогену) і т.д.
Реакції оксидування і амінування. Процеси
введення в молекулу органічної сполуки окси - або аміногрупи називають
відповідно оксилюванням і амінуванням. Ці реакції протікають за механізмом
нуклеофільного заміщення.
Оксисполуки можуть бути отримані з хлорпохідних:
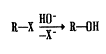
Залежно від структури і властивостей з'єднань
можна різними способами перетворювати аміносполуки в оксисполуки (і навпаки) за
загальною схемою:
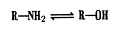
Процес перетворення амінів в оксисполуки зазвичай
виконують трьома способами: діазотування аміногрупи і наступним розкладанням
діазосполуки: кислотним гідролізом аміну; дією на амін солей сірчистої кислоти.
Амінування галогеналканів RX здійснюють дією
аміаку, первинних і вторинних амінів:
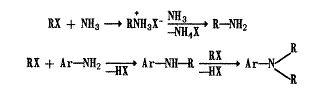
Реакції нітрозування, діазотування і перетворення
діазосполук. Ця група реакцій широко застосовується для отримання проміжних
продуктів синтезу лікарських речовин. Реакції нітрозування і діазотування
відбуваються в кислому середовищі і являють собою процес електрофільного
заміщення. Основною стадією діазотування є реакція нітрозуванія. Загальна схема
реакції діазотування:
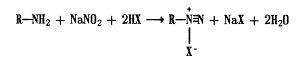
Встановлено, що процес цей багатостадійний.
Послідовно відбувається спочатку реакція утворення азотистої кислоти,
дисоціюють на іони:
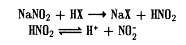
У присутності соляної кислоти далі реакція йде
так:
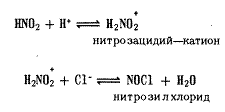
Активність утворюються катіонів значно вище, ніж
у азотистої кислоти.
Первинні ароматичні аміни реагують з
нітрозілхлорідом за схемою:
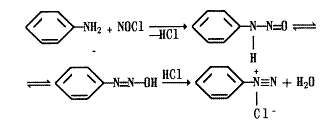
Вторинні ароматичні аміни утворюють в цих умовах
N-нітрозосполуки:
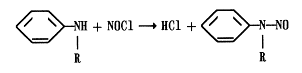
які можуть ізомеризуватися в п-нітрозосполуки:
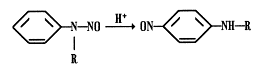
Третинні аміни відразу утворюють
п-нітрозосполуки.
Діазосполуки досить реакційно здатні. Їх будова і
властивості в розчинах залежать від pH середовища. Найбільш стійкі вони в
сильнокислому середовищі, так як при цьому утворюються солі діазонію. Найменш
стабільні розчини діазосполук при pH 8-10.
При розкладанні діазосполук залежно від умов
виконання реакції може відбуватися процес заміщення діазоніевої групи
гідроксилом, галогеном та іншими нуклеофільними радикалами. Ці реакції
протікають з відщепленням азоту від катіона діазонію:
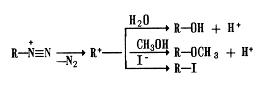
Реакції алкілування і ацилювання. Алкілування і
ацилювання відбуваються по типу електрофільного заміщення. Розрізняють два типи
алкілування (ацилювання). Один з них властивий вуглеводням (С-алкілування і
С-ацилювання), інший - аміно- і оксисполукам.Алкілування і ацилювання
вуглеводнів. Ароматичні сполуки алкілуючими галогеналканами або неграничними
сполуками в надлишку алкілуємого бензолу або в безводному нітробензолі:
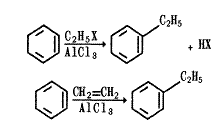
Алкілуючими агентами можуть також служити спирти
та їх складні ефіри (з неорганічними і органічними кислотами).
Наявність у молекулі ароматичного сполуки
замісників першого роду (-ОН, - СН3, - NH2 та ін.)
Полегшує процес алкілування, наприклад:
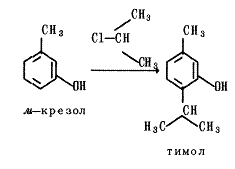
Прикладом С-ацилювання є отримання саліцилової
кислоти. Реакційна здатність ароматичного ядра фенолятів дозволяє отримувати
оксикислоти взаємодією з діоксидом вуглецю (реакція Кольбе - Шмідта). Процес
йде в автоклаві (180°С), діоксид вуглецю вводять під тиском. Реакція проходить
тільки з безводним фенолятом натрію, так як в присутності води фенолят повністю
дисоціює.
За сучасними уявленнями, процес карбоксилювання
фенолята натрію йде через стадію утворення комплексу:
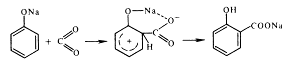
Алкілування і ацилювання аміно- і оксисполук. Ці
реакції відбуваються за типом електрофільного заміщення атома водню в аміно- і
оксисполукими.
Для алкілування аміносполук користуються різними
алкілуючими агентами. Найчастіше використовують галоген алкіл, особливо
метилйодид (для метилування):
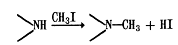
Алкілуючими агентами можуть також служити
диметилсульфат або суміш формальдегіду і мурашиної кислоти.
Галогеналкіли широко використовують для одержання
солей четвертинних амонієвих основ:
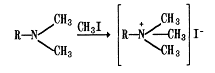
Реакція ацилювання амінів або введення ацильних
залишків (форміл-, ацетил-, бензоіл-, алкоксікарбоніл-) відбувається за
загальною схемою:
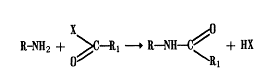
Особливо широко в хіміко-фармацевтичної
промисловості Використовують реакцію ацетилювання ароматичних амінів. Її
виконують зазвичай за допомогою оцтового ангідриду (оцтової кислоти):
Ацетилювання проводять для тимчасового захисту
аміногрупи, зокрема перед виконанням процесів сульфування (сульфохлорування),
нітрування та ін. Потім ацетильную групу видаляють гідролізом у лужному або в
кислому середовищі:
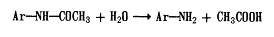
З ацилюючих агентів ароматичного ряду
використовують похідні бензойної кислоти. Ацилювання здійснюють за допомогою
бензоїлхлориду С6Н5СОС1:
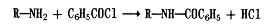
Алкілування оксигрупи в аліфатичних, ароматичних
і гетероциклічних сполуках R-ОH відбувається за загальною схемою утворення
простих ефірів:
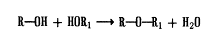
Так отримують метокси-, етокси - та інші алкіл
похідні. Цей процес можна здійснити, використовуючи не тільки оксипохідних, а й
галогенвуглеводні:
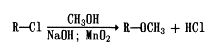
Ацилювання оксигрупи, що міститься в структурі як
аліфатичних, так і ароматичних сполук, здійснюють, використовуючи як ацилюючих
агентів кислоти, ангідриди і хлорангидріди кислот. При ацилюванням кислотою
виділяється воду пов'язують трихлоридом фосфору (III) РС13 або
трихлоросидом фосфору (V) РОС13.
Процес ацетилювання спиртів і фенолів лежить в
основі отримання складних ефірів оцтової кислоти:
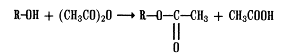
Реакції етерифікації та гідролізу ефірів.
Своєрідним різновидом хімічного процесу алкілування і ацилювання оксисполук є
реакції отримання простих і складних ефірів.
Синтез простих ефірів здійснюють етерифікацією
двох молекул спиртів у присутності водовіднімаючих засобів (концентрована
сірчана кислота та ін.):
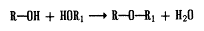
Вихідними продуктами синтезу простих ефірів
можуть служити також спирти і галогеналкіли:
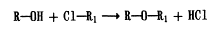
Складні ефіри отримують взаємодією спиртів з
неорганічними кислотами:
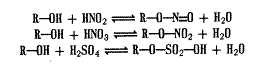
Одним з найбільш поширених методів отримання
складних ефірів є пряма етерифікація вільних кислот (алкоголіз карбонових
кислот) спиртами або фенолами:
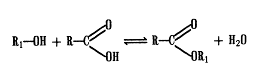
Процес є оборотним. Це відкриває широкі
можливості для отримання проміжних продуктів синтезу з «закритої» окси - або
карбоксигрупи. Після проведення необхідних перетворень в інших функціональних
групах молекули речовина гідролізують.
Етерифікація прискорюється в присутності сильних
кислот (сірчаної кислоти, безводного хлороводню, сульфокислот). Такі кислоти,
як мурашина, щавлева, піровиноградна, реагують зі спиртами і без каталізаторів.
Для етерифікації можуть бути використані також ангідриди і хлорангидріди кислот
(за загальним принципом ацилювання оксигрупи):
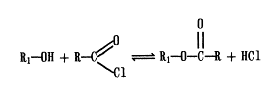
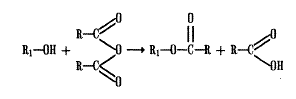
За цим же принципом здійснюють синтез уретанів зі
спиртів і карбомоїлхлорида:
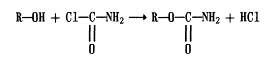
Іноді (наприклад, у виробництві новокаїну) використовують
реакцію переетерифікації. Остання являє собою процес перетворення одного
складного ефіру в інший.
4.4 Реакції відновлення та окислення
Застосовувані в хіміко-фармацевтичної
промисловості методи окислення і відновлення класифікують на хімічні,
каталітичні, електролітичні, біохімічні та мікробіологічні.
Реакції відновлення. Процес відновлення
використовують для гідрування неграничних і ароматичних сполук, відновлення
нітро- і нітрозосполук до аміносполук і т.д. Як відновлювачів найчастіше застосовують
метали та їх солі. Існують різні способи відновлення, засновані на використанні
натрію: із застосуванням амальгами натрію; натрію у поєднанні зі спиртом;
розчину натрію в рідкому аміаку. В основі процесу відновлення амальгамою натрію
лежить іонний механізм, що відбувається за схемою:
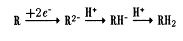
Відновлення цинком можна проводити як в кислому,
так і в лужному середовищі. Роль відновлювача виконує в цьому процесі
виділяється водень.
Поширений в промисловості спосіб відновлення
залізом.
Все більш широке застосування знаходить
каталітичний метод гідрування органічних сполук воднем в присутності
каталізаторів. Метод відрізняється швидкістю і простотою виконання, високим
ступенем чистоти одержуваних продуктів. Найбільш часто використовують платину,
паладій, скелетний нікелевий каталізатор. При каталітичному гідруванні
альдегідів утворюються первинні спирти, а кетонів - вторинні спирти:
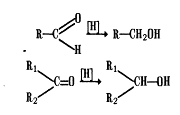
Загальна схема каталітичного гідрування,
наприклад нітросполук до відповідних амінів, дуже проста:
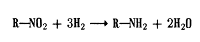
Аналогічно гідруються нітрозосполуки:
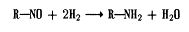
Гідруванням ароматичних сполук отримують
аліциклічні:
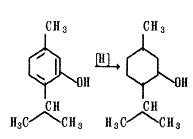
В останні роки все ширше використовують
електрокаталітичний метод гідрування. Переваги цього методу полягають у високій
швидкості в порівнянні з хімічним гідруванням. Процес відновлення протікає на
катодах, активованих каталізаторами гідрування. Електрокаталітичні методи
використовуються для відновлення третинних ацетиленових спиртів до вінілових і
граничних спиртів (синтез ізопрену, вітамінів), граничних ї ненасичених кетонів
до спиртів або амінів (синтез вітамінів А, Е), для перетворення нітрілів в
аміни (синтез папаверину). У синтезі алкалоїдів застосовують електрокаталітичні
відновлення піридинового циклу, а при отриманні анестезину та інших первинних
ароматичних амінів гідруються нітропохідні до амінів.
Реакції окислення. В якості окислювача зазвичай
використовують кисень. Дуже дешевим його джерелом є повітря. Процес окислення в
цьому випадку йде у присутності каталізатора. Окислювачами можуть служити також
багаті киснем з'єднання: дихромат калію, діоксид марганцю, перманганат калію,
пероксид водню, азотна кислота та ін.
Процес окислення можна представити у вигляді
єдиної схеми, так як перебіг і результат реакції залежать в кожному окремому
випадку від умов її проведення і природи реагентів.
Важливе значення процес окислення має для
отримання кислот з відповідних ароматичних або гетероциклічних алкілпохідних за
схемою:

В якості окислювача в даному випадку
використовують дихромат калію або перманганат калію. Цей спосіб широко
застосовують для отримання сполук, що містять в молекулі карбоксильну групу
(бензойна, нікотинова, ізонікотинової кислоти та ін.).
Окислення аліфатичних спиртів веде до утворення
альдегідів:
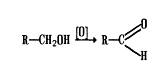
Альдегіди в свою чергу окислюються до кислот:
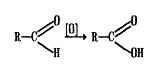
Цей процес може бути здійснений електрохімічним
шляхом.
Сутність біохімічного окислення полягає у
використанні ізольованих органів тварин. Так, наприклад, отримують
11-оксистероіди, пропускаючи через ізольовані наднирники або їх гомогенати
розчин відповідного стероїду.
Для мікробіологічного окислення стероїдних сполук
(наприклад, прогестерону в положенні 11) використовують мікроорганізми деяких
видів Rhizopus. Такого типу окислення відрізняється від біохімічного порівняно
більш простою технологією виділення, очищення і значним виходом (30-60%)
кінцевого продукту.
5. Сучасні методи встановлення структури лікарських речовин
.1 Методи розподілу і очистки
Одним з важливих етапів дослідження біологічно
активних синтетичних або природних речовин є встановлення їх хімічної
структури. Процес дослідження синтезованої або виділеної з рослинної
(тваринної) сировини речовини включає кілька етапів.
Дослідження хімічної структури починають з
отримання гомогенного зразка (високого ступеня чистоти). Очищення від домішок
досягається шляхом поділу рідкої і твердої фаз, а також перегонкою, сублімацією
(багаторазовою перекристалізацією речовини з різних розчинників). Широко
використовують для розділення і очищення різні види хроматографії, електрофорез
та іонофорез, протитечійний і полібуферний розподіл, метод зонної плавки.
Поділ рідкої і твердої фаз, заснований на
розходженні маси частинок, можна здійснити декантацією, фільтруванням і
центрифугуванням. Останнє відрізняється найбільшою швидкістю і повнотою поділу
під дією відцентрової сили, що виникає в результаті швидкого обертання.
Перегонка - спосіб, застосовуваний для очищення
досить летючих і нерозкладающихся рідких і низкоплавких твердих речовин.
Термолабільні речовини переганяють при зниженому тиску. Зниження тиску вдвічі
зменшує температуру кипіння, приблизно на 15°С. Достатня ступінь поділу
досягається в тому випадку, якщо температури кипіння компонентів суміші
розрізняються на 80-90°С.
Високий ефект поділу досягається фракційною
перегонкою, здійснюваною в спеціальних колонах за принципом протитечії. Метод
заснований на відділенні складу рідини від складу утвореної з неї пари.
Відігнана фракція збагачується більш летючими, а невідігнана - менш летючими
компонентами.
Перегонкою з водяною парою поділяють речовини,
киплячі при досить високих температурах даний спосіб заснований на фізичному
законі, відповідно до якого тиск пари над сумішшю рідин дорівнює сумі
парціальних тисків компонентів. Тому температура кипіння суміші нижче
температури кипіння самого легкозакипаючого компонента
Сублімація (сублімація) заснована на властивості
деяких речовин при нагріванні переходити в газоподібний стан минаючи фазу
плавлення. При охолодженні пари знову перетворюються на тверду фазу.
Нестабільні речовини возгоняють у вакуумі.
При проведенні перекристалізації використовують
розходження розчинності випробуваної речовини і вміщених в ній домішок. Інший
спосіб перекристалізації заснований на залежності розчинності речовини і
домішок від температури. Високий ступінь очищення досягається в тому випадку,
коли розчинність речовини при нагріванні поліпшується, а домішки в тому ж
розчиннику або дуже мало розчиняються (навіть при нагріванні) або розчиняються
краще, ніж очищувана речовина.
Хроматографічні методи - найбільш широко вживані
методи очищення і розділення сумішей природних речовин, у тому числі близьких
за хімічною структурою.
Методи хроматографічного аналізу засновані на
розподілі суміші речовин між рухомою і стаціонарною фазами до встановлення
стану рівноваги. Розподіл відбувається внаслідок відмінності в розчинності або
адсорбційної здатності компонента суміші. Для розділення і очищення речовин
можуть бути застосовані різні види хроматографії.
Одним з найбільш перспективних методів очищення і
концентрування біологічно активних речовин є ультрафільтрація. За допомогою
цього методу розчини, які містять вітаміни, ферменти, можуть бути очищені і
сконцентровані швидше і якісніше, ніж при використанні таких технологічних
прийомів, як випарювання, виморожування, сублімаційний або розпилювальна сушка,
осадження органічними розчинниками або солями і т.д. До того ж застосування цих
прийомів може привести до зміни структури або фізико-хімічних властивостей
біологічно активних сполук.
Зонна плавка, або зонна перекристалізація, - один
з методів, що дозволяють досягти високого ступеня очищення речовини. Остання
досягається за рахунок різного розподілу речовин між дотичними твердої і рідкої
фазами. Домішки, що містяться в розплаві, переміщуються, і одночасно
відбувається кристалізація чистої речовини. Техніка виконання полягає в тому,
що речовину поміщають в спеціальну форму, яку зі швидкістю 0,5-0,001 см/год
пропускають через вузьку нагріту зону. При цьому відбувається поступове
переміщення розплаву від одного кінця форми до іншого. Метод може бути
застосований лише до лікарських препаратів з низькою летючість і високою
термостабильностью, тобто не розкладається при температурі плавлення і не
мінливих при нагріванні. Зонну плавку нерідко поєднують з кріометричним
методом. Він заснований на встановленні зміни температури кристалізації в залежності
від сумарної кількості домішок (будь-якої хімічної природи). Метод дозволяє
визначати дуже невелику кількість домішок в широкому інтервалі температур (від
-150 до +200°С) і може бути використаний для оцінки ступеня очищення.
Крім зонної плавки для отримання високочистих
лікарських речовин (стандартних зразків) може бути використаний метод
спрямованої вакуумної сублімації. Він дає можливість очищення речовин в тих
випадках, коли дистиляція, екстракція, ректифікація незастосовні. Метод
дозволяє з високим виходом (70-90%) отримувати чисті речовини, в тому числі з
тих, які розкладаються при температурі плавлення, легко окислюються, мають малу
розчинність у звичайних розчинниках.
5.2 Встановлення фізичних властивостей і елементного складу
Після розділення і очищення встановлюють фізичні
властивості індивідуальних речовин: температуру плавлення (розкладання),
температуру кипіння, щільність, в'язкість і т.д.
Характеристикою індивідуальних речовин є такі
константи, як показник заломлення, питоме обертання, УФ - та ІЧ-спектр.
Зазначені властивості і константи не повинні змінюватися при повторному
очищенні.
Визначення фізичних і фізико-хімічних констант
виконується ідентично як при дослідженні нових органічних сполук, так і при
виконанні фармацевтичного аналізу лікарських речовин.
Після отримання індивідуальної речовини,
гомогенність якого підтверджена розглянутими вище методами, встановлюють його
емпіричну формулу і молекулярну масу.
Для одночасного виявлення в органічному поєднанні
вуглецю, кисню, азоту у присутності сірки, галогенів (Hal) використовують
реакцію розкладання з металевим натрієм. Елементи перетворюються в розчинні
неорганічні речовини.
Кількісне визначення вуглецю і водню можна
здійснити окисленням випробуваного з'єднання при підвищеній температурі
(спалюванні) до утворення СО2 і Н2О. В якості окислювача
використовують, наприклад, кисень в присутності каталізаторів. Утворені СО2
і Н2О вловлюють поглиначами, що зв'язують ці речовини. Аналіз
завершують газометричним, гравіметричним або титриметричним методом. Для
визначення азоту в основному використовують два хімічних методу. Один з них
метод Дюма-Прегля, що полягає в розкладанні і газометричному визначенні азоту.
Другий - метод Кьельдаля, широко застосовуваний у фармацевтичному аналізі
азотовмісних лікарських речовин. Галогени і сірку можна після спалювання
навішування речовини в струмі кисню визначати гравіметричним або титриметричним
методом.
В даний час для кількісного визначення вуглецю,
водню, азоту в органічних сполуках застосовують автоматичні аналізатори. В
органічному аналізі вони використовуються для встановлення брутто-формули
(підтвердження елементного складу) та кількісного визначення встановленого
з'єднання в синтезованому речовині.
У сучасних мікроаналізаторах при елементному
визначенні вуглецю і водню після спалювання проби в реакторі використовують
газохроматографічне закінчення випробування. Це дозволяє зменшити масу проби до
декількох міліграмів і скоротити тривалість аналізу до 30 с. Для визначення
азоту і сірки застосовують реактори з колонками з міді, яка відновлює оксиди
азоту або сірки. Подальший поділ здійснюють хроматографічно. Створені
мікроаналізатори, що дозволяють проводити одночасне автоматичне визначення всіх
чотирьох елементів (вуглецю, водню, азоту та сірки). Подальша автоматизація
аналізу досягнута за рахунок використання електронних ваг і ЕОМ для
запам'ятовування маси проби і обробки результатів хроматографічних даних.
Щоб встановити справжню брутто-формулу, потрібно
визначити молекулярну масу.
Визначення молекулярної маси. В залежності від
властивостей досліджуваної речовини для встановлення молекулярної маси
користуються такими фізичними методами, як ебуліоскопічний, кріоскопічний,
ізотермічний, дистиляційний, газометричний. Якщо досліджуване з'єднання являє
собою кислоту або основу, то використовують також хімічні методи.
При ебуліоскопічному визначенні проводять
вимірювання різниці температур кипіння чистого розчинника і розчину
досліджуваної речовини в тому ж розчиннику.
Кріоскопічне визначення засноване на зміні
температури плавлення розчинника, викликаному розчиненням в ньому досліджуваної
речовини.
Більш широку область застосування має метод
ізотермічної дистиляції. Він полягає у встановленні рівноваги молярних
концентрацій двох речовин у сполучених посудинах перегонкою розчинника при
певній температурі.
Газометричний метод придатний для визначення
молекулярної маси у речовин, які не розкладаються при переході в пароподібний
стан.
Для визначення молекулярної маси використовують
також віскозиметри - найбільш простий і доступний метод, який поєднують з
застосуванням ЕОМ для обробки результатів вимірювань. Осмометри - один з
найбільш поширених методів, точність якого залежить від різних чинників, але
насамперед від характеристик напівпроникних мембран. Прямим методом визначення
молекулярної маси є вимірювання світлорозсіювання, можливості якого значно
розширені за рахунок використання лазерного випромінювання. Абсолютним методом,
який дозволяє проводити визначення молекулярної маси в широкому діапазоні від
300 до 1 млн., Є седиментаційний аналіз, що виконується на основі аналітичного
ультрацентрифугування.
Для встановлення структури рідких органічних
речовин визначають молярний об'єм, що є відношенням молярної маси до щільності
рідини при температурі кипіння.
Адитивну величину для рідин представляє також
властивість, звана парахор. Розраховують парахор за допомогою коефіцієнта
поверхневого натягу рідини і щільності її парів. Відомі значення атомних
парахор елементів (вуглецю, водню, азоту, кисню, фосфору, сірки, галогенів);
парахор подвійного, потрійного зв'язку, а також парахор трьох-, чотирьох-,
п'яти- і шестичленних циклів.
В останні роки замість елементного аналізу або в
поєднанні з ним все ширше використовують методи ізотопного аналізу. Вони
засновані на спалюванні суміші досліджуваної і міченої речовин. Мічена речовина
містить важкий ізотоп аналізованого елементу. Практично для визначення в
досліджуваному з'єднанні вуглецю, наприклад 13С або 14С,
його перетворюють відповідно в 13СО2 і 14СОг
спалюванням. Потім співвідношення ізотопів визначають методом ІЧ-спектроскопії,
мас-спектрометрії та ін. Аналогічно поступають при визначенні водню і кисню.
Можна використовувати також радіоактивні ізотопи.
Руйнування речовини проводять таким же чином, як і при використанні стабільних
ізотопів, а радіоактивність встановлюють за допомогою лічильника Гейгера -
Мюллера, іонізаційної камери або сцінтілляційних детекторів.
.3 Методи, що застосовуються для встановлення хімічної структури
З'єднання, синтезоване або виділене з рослинної,
а також з тваринної сировини, може або виявитися ідентичним описаним раніше
речовинам, або бути невідомим за хімічною будовою. Тому дослідження починають з
ідентифікації з'єднання, застосовуючи для цієї мети різні хімічні і
фізико-хімічні методи. Зазвичай після вивчення фізичних констант,
брутто-формули, молекулярної маси встановлюють наявність тих чи інших
функціональних груп і зіставляють отримані дані з описаними сполуками, що мають
аналогічні параметри. Якщо відповідного з'єднання не виявиться, то встановлюють
структуру речовини.
Хімічні методи встановлення структури
Хімічні методи поки не втратили свого значення
для встановлення хімічної структури органічних речовин. Негативні результати
хімічних реакцій достовірно підтверджують відсутність тих чи інших
функціональних груп. Крім того, точність хімічних методів цілком достатня для
з'ясування числа однакових функціональних груп, що містяться в досліджуваному
з'єднанні.
У функціональному аналізі використовують способи
кількісного визначення рухомого водню в групах - ОН, - SH, - СООН, - SO3H,
- CОNHR, - NHR, - С=СН; способи визначення О-, S-, N- і С-алкільних груп; О- і
N-ацильних груп. Крім того, хімічні методи дозволяють визначати подвійні
зв'язки, карбонільні групи, а також карбонові кислоти, ангідриди, лактони та
складні ефіри.
Для ідентифікації тих чи інших функціональних груп
можуть бути використані й інші хімічні реакції (окислення-відновлення,
нейтралізації, конденсації, приєднання, діазотування, ацетилювання,
етерифікації та ін.).
Для встановлення хімічної структури велике
значення має реакція гідролізу. Особливо широко нею користуються при
дослідженні білків і поліпептидів, що утворюють при гідролізі амінокислоти.
Реакцію гідролізу використовують для визначення хімічної будови речовин, що
представляють собою складні ефіри, уретани, урєїди і т.д.
Таким чином, хімічні методи дають можливість
здійснити ідентифікацію та кількісне визначення ряду функціональних груп в
органічному поєднанні невідомої структури. Цим методам відводиться допоміжна
роль у дослідженні хімічної структури органічних сполук.
Фізико-хімічні методи встановлення хімічної
структури
Роль фізико-хімічних методів у встановленні
хімічної структури безупинно зростає. Вони не тільки скорочують час, необхідний
для проведення дослідження, а й дають порівняно з хімічними методами принципово
нову інформацію про структуру і властивості досліджуваних сполук.
При встановленні хімічної структури органічних
сполук важливі відомості можна отримати, вивчаючи взаємодію речовини з
електромагнітним випромінюванням. Воно відбувається в широкому інтервалі частот
від радіохвиль до γ-випромінювання
(довжини хвиль від 100 до 10-11 см). Електромагнітне випромінювання
є наслідком зміни енергії молекул,
Як правило, електромагнітне випромінювання
характеризують хвильовими параметрами, які виражаються довжиною хвилі λ (нм) або частотою коливання v (см-1).
Електромагнітний спектр характеризується різними
типами випромінювання. Для структурних досліджень найбільш широко
використовують абсорбційні методи або методи, засновані на поглинанні
випромінювання (спектроскопія в УФ-, видимій та ІЧ-областях, спектроскопія
комбінаційного розсіювання); методи, засновані на використанні магнітного поля
(ЯМР, ЕПР-, ЯКР-спектроскопія та мас-спектрометрія); методи, засновані на
поглинанні і дифракції рентгенівського випромінювання.
Спектроскопія в УФ і видимій областях спектра.
Метод заснований на використанні електронних спектрів і поглинанні в інтервалі
200-800 нм. Не поглинають у цій галузі алкани, спирти, ефіри й аміни
аліфатичного ряду. В області 200-250 нм розташовується частина смуги поглинання
алкілхлоридів, граничних карбонових кислот та їх похідних. В області вище 200
нм мають характерне поглинання ароматичні та аліфатичні сполуки, що містять
зв'язані зв'язки і деякі галогенпохідні. Якщо УФ-спектр має одну або кілька
смуг поглинання при довжині хвилі менше 300 нм, то з'єднання зазвичай містить
дві або три сполучені зв'язки.
УФ-спектри залежно від наявності в молекулі тієї
чи іншої функціональної групи розрізняються не тільки розташуванням довжини
хвилі максимуму, а й інтенсивністю поглинання (величина коефіцієнта молярного
поглинання). Найбільш інтенсивні смуги поглинання мають в області понад 200 нм
з'єднання з сполученими зв'язками. В області 250-300 нм поглинають похідні
бензолу. Найбільш низьку інтенсивність мають спектри поглинання сполук, які включають
групи з π-переходами (С=О, С=S, NО2,
NО, N=N, С=N).
Крім спектрофотометрії у видимій (400-800 нм) та
ультрафіолетової (200-400 нм) областях важливу інформацію для структурних
досліджень може дати область вакуумної спектрофотометрії (100-200 нм).
При використанні УФ-спектроскопії для вивчення
хімічної структури проводять порівняння спектрів досліджуваних сполук зі
спектрами речовин, що мають встановлене будову. Порівнюють криві
светопоглощения, зняті в області 200-800 нм. В якості модельних підбирають сполуки,
що мають аналогічні хромофори і пов'язані системи. Особливо важливу інформацію
можна отримати при встановленні хімічної структури з'єднань, що мають систему
кратних зв'язків. Наприклад, в спектрах цис-з'єднань спостерігається більш
довгохвильова і менш інтенсивна смуга поглинання, ніж у транс-з'єднань.
Більш складним є характер УФ-спектрів поглинання
ароматичних систем. Бензол має дві основні смуги поглинання (близько 200 нм і в
інтервалі 235-270 нм). Введення ауксохромних замісників призводить до Батохромний
зрушенню обох смуг. Встановлено правила про вплив інших замісників на характер
та інтенсивність поглинання ароматичних сполук.
Інфрачервона (ІЧ) спектроскопія. Поглинання
інфрачервоного випромінювання (10-4-10-3 см) викликає
зміни коливальних і обертальних станів молекули. Ці зміни знаходять
відображення в ІЧ-спектрах.
ІЧ-спектроскопія забезпечує більш широку, ніж
УФ-спектри, інформацію про наявність тих чи інших функціональних груп в
молекулі, їхні зв'язки. Вона дає можливість судити про структуру речовини в
цілому, а також про зміни, що відбуваються в молекулах при таких хімічних
процесах, як розчинення, дисоціація, сольволіза та ін.
Поведінка багатоатомних молекул органічних сполук
в ІЧ-спектрах характеризується головним чином поглинанням окремих груп, кожній
з яких відповідають певні смуги поглинання. Інша частина молекули мало впливає
на частоти поглинання. Тому різні за структурою речовини, що мають одні і ті ж
функціональні групи, характеризуються наявністю однакових смуг поглинання. Такі
смуги поглинання називають характеристичними або груповими.
Розрізняють також валентні коливання (обумовлені
зміною довжини зв'язків) і деформаційні коливання (залежні від кута між
зв'язками).
Можна попередньо встановити тип функціональної
групи по розташуванню характеристичних піків, розділивши ІЧ-спектр в діапазоні
частот 3600-400 см-1 на три області.
. Діапазон частот 3600-2300 см-1
відповідає валентним коливанням груп О-Н, N-Н, S-Н, Р-Н, С-Н.
. В області частот 2300-1900 см-1
спостерігаються валентні коливання потрійних зв'язків (С≡С, C≡N) і
кумульованих подвійних зв'язків.
. В інтервалі частот 1700-1400 см-1
розташовані піки поглинання, що відносяться до валентних коливань подвійних
зв'язків (С=С, С=О, C=N, N=О), а також деформаційні коливання N-Н.
Зазначені три області найбільш широко
використовують для попереднього встановлення відповідності піку поглинання
ІЧ-спектру тієї чи іншої функціональної групі.
В області менш 1400 см-1 знаходяться
інші смуги валентних, деформаційних, комбінаційних коливань, характерних для
різних груп. У цій області спектри найбільш сильно розрізняються.
При використанні ІЧ-спектрів для структурних
досліджень користуються емпірично встановленими правилами. Суть їх полягає в
тому, що кожна атомна група характеризується поглинанням при певній довжині
хвилі. Виходячи з цього, за ІЧ-спектру можна зробити висновок як про
вуглецевому кістяку, так і про наявність в молекулі тих чи інших функціональних
груп.
З достатньою впевненістю можна за
характеристичними частотам ІЧ-спектрів зробити висновок про відсутність в
досліджуваному з'єднанні відповідної групи. Робити висновок про наявність тієї
чи іншої функціональної групи можна тільки в тому випадку, якщо в ІЧ-спектрі
виявляються всі характеристичні для неї смуги. Крім того, слід паралельно
підтвердити наявність цієї групи іншим хімічним або фізико-хімічним методом.
Спектри комбінаційного розсіювання (СКР).
Сутність комбінаційного розсіювання світла полягає в наступному. Якщо речовина
опромінена монохроматичним випромінюванням (не перебуває в смузі поглинання
речовини), то відбувається збудження молекули на нестійкий рівень. При
поверненні молекули в первинний стан можуть здійснюватися переходи на
коливальні підрівні основного стану. Цей вид розсіювання називають
комбінаційним. Різниця частот збудливого і розсіяного світла відповідає
коливальним частотам даної молекули.
Спектри КР через розходження в природі з
ІЧ-спектрами можуть дати додаткову інформацію. Наприклад, про смугах валентних
коливань зв'язків С=С та С-С. Останні в ІЧ-спектрах мають дуже малу
інтенсивність, а в спектрах КР дуже інтенсивні.
Методи, засновані на використанні магнітного
поля. Поглинання випромінювання радіохвиль (більше 100 см) викликає зміну
енергетичних станів спинив ядер і електронів, пов'язаних з їх енергетичними та
магнітними властивостями. На цих процесах засновані такі методи, як
спектроскопія ядерно-магнітного резонансу (ЯМР), протонно-магнітного резонансу
(ПМР), електронного парамагнітного резонансу (ЕПР), ядерного квадрупольного
резонансу (ЯКР).
ЯМР-спектроскопія. Метод дозволяє вивчати
магнітні переходи ядер зі спіновими квантовими числами більше нуля. В основі
методу ЯМР-спектроскопії лежить використання магнітних властивостей ядер. Крім
маси і заряду ядро атома має ще одну характеристику - момент
кількості руху, обумовлений його обертанням (спіном) навколо осі. Оскільки ядро
заряджено, його спін призводить до кругового руху, тому ядро характеризується
магнітним дипольним моментом, величину якого можна відповідним чином виміряти.
За допомогою приладів ЯМР-спектрометрів вимірюють
різницю енергії, яка поглинається при переході ядра з нижнього енергетичного
рівня на верхній або виділяється при зворотному переході. Цей процес називають
резонансним поглинанням (резонансним сигналом). Так як кожне атомне ядро оточене
електронами та іншими ядрами, то внутрішнє магнітне поле послаблюється різною
мірою (залежно від структурних особливостей молекули). Тому резонансний сигнал
залежить від хімічного оточення ядер і спостерігається при різних частотах в
залежності від структурних особливостей молекули.
Таким чином, ЯМР-спектроскопія заснована на
поглинанні речовиною, поміщеним в сильне однорідне магнітне поле, енергії
радіочастотного випромінювання. В ЯМР-спектрометрах вимірюють залежність
інтенсивності сигналу від напруженості поля. Це дозволяє досліджувати
просторове розташування ядер і з'ясовувати природу оточення атомів. Знімаючи
ЯМР-спектр, встановлюють два основних параметри: характер спін-спінової зв'язку
між ядрами і ЯМР-хімічний зсув (зміщення сигналу ядерного резонансу під впливом
електронного оточення). Порівняння цих параметрів з відомим протонним сигналом
різних типів з'єднань дає початкове уявлення про структуру з'єднання, оскільки
дозволяє встановити, скільком протонам відповідає окремий сигнал. За допомогою
ЯМР-спектроскопії можна визначити близько 135 природних ізотопних ядер (2Н,
13С, 14N, 17О, 31Р та ін.).
Найчастіше вимірювання виконують на протонах.
Величина хімічного зсуву являє собою різницю між
становищем сигналу стандартного речовини і досліджуваного з'єднання. Вона
залежить від частоти накладеного електромагнітного поля і виражається в герцах
(Гц). Як стандарт зазвичай використовують тетраметилсілан, хімічний зсув якого
приймають за 0 Гц. Щоб висловити хімічний зсув у величинах, що не залежать від
частоти накладеного поля, знайдене значення ділять на робочу частоту, В
результаті отримують безрозмірну величину хімічного зсуву, що має порядок 10-6
або млн-1 (мільйонна частка).
ЯМР-спектр являє собою сукупність піків з різною
шириною, площею та інтенсивністю сигналів. Велика відмінність ЯМР-спектрів
обумовлено різницею хімічних зсувів сигналів, відмінностями в інтенсивності цих
сигналів та їх розщепленням.
ЯМР-спектр є своєрідним відображенням числа ядер,
порядку їх зв'язків і геометрії розташування ядер в молекулі досліджуваного
з'єднання. За характером протонних сигналів можна зробити висновок про
наявність в молекулі тих чи інших груп. Гострий сигнал називають сінглет,
розщеплений надвоє сигнал - дублетом, сигнал, що складається з трьох ліній, - кодонів,
з чотирьох - квадруплетом і т.д. На основі вимірювання сигналів і їх
розщеплення можна зробити висновок про довжину зв'язків, кутах між зв'язками в
молекулі, геометрії молекули, її електронегативності і т.д.
ЯМР-спектроскопія - один з найбільш тонких
методів досліджень. Він дозволяє розрізняти орта-, мета- і пара-ізомери,
вивчати кето-енольну рівновагу, трео- і еритро-форми і вирішувати інші питання
структурного аналізу.
У структурному аналізі використовують спектри
поглинання протонномагнітного резонансу (ПМР). Спектр протонного резонансу
молекули органічної сполуки складається з багатьох сигналів. Він дозволяє
розпізнавати типи водневих атомів в молекулі з невстановленою хімічною
структурою, оскільки частота резонансу водню відрізняється не тільки в різних
молекулах, але навіть в різних положеннях однієї і тієї ж молекули.
ПМР-спектроскопію використовують для встановлення
хімічної структури насичених і ненасичених вуглеводнів, ароматичних та інших
органічних сполук. Метод дозволяє досліджувати такі тонкі особливості хімічної
будови, як різного типу ізомерії, таутомерні рівноваги і т.д.
Спектроскопія електронного парамагнітного
резонансу (ЕПР). Метод дозволяє спостерігати поглинання електромагнітного
випромінювання неспареними електронами молекули речовини під впливом сильного
зовнішнього магнітного поля. ЕПР проявляють атоми або іони з незаповненими
внутрішніми електронними оболонками (наприклад, іони перехідних металів); атоми
і молекули з непарним числом електронів (Н, N, NO, NO2 та ін.);
вільні радикали з одним або декількома неспареними електронами. ЕПР-спектри
дозволяють отримати інформацію про структуру радикала і його оточення. Метод
застосуємо для дослідження речовин у всіх агрегатних станах.
Спектроскопія ядерного квадрупольного резонансу
(ЯКР). Метод дозволяє отримувати поряд з ЯМР-спектроскопією інформацію про стан
зв'язків, структурі кристалів. Він заснований на дослідженні переходів, що
відбуваються між квадрупольними підрівнями, під впливом змінних високочастотних
полів. Квадрупольні енергетичні підрівні утворюються у атомних ядер з ядерним
спіном більше 2. Для цих ядер не характерно сферично-симетричний розподіл
заряду, тому вони мають квадрупольний момент.
Мас-спектроскопія. Це один з найбільш
перспективних методів, який дозволяє визначати масу іонів, іонізованих молекул
або фрагментів молекул по відхиленню в магнітних і електричних полях або по
кінетичної енергії. Іонізація молекули органічної сполуки відбувається в
результаті хімічної реакції між молекулами і електронами. Іонізацію найчастіше
здійснюють дією пучка електронів. При цьому молекула втрачає електрон і утворює
позитивний іон-радикал або захоплює електрон і утворює негативний
аніон-радикал. Для вивчення хімічної структури органічних речовин частіше
використовується мас-спектрометрія позитивних іонів. Утворився позитивний
іон-радикал називають молекулярним іоном. При достатньої енергії електронного
пучка відбувається подальший розпад молекулярного іона з утворенням позитивних
іонів і радикалів фрагментації (іони-радикали і нейтральні молекули). Отже, при
іонізації молекули утворюється велика кількість осколкових іонів. Поява піку
молекулярного іона в спектрі спостерігається при енергії електронів,
відповідної потенціалу іонізації досліджуваного з'єднання (зазвичай ця енергія
становить 8-15 еВ). При енергії електронів близько 70 еВ відбувається не тільки
утворення молекулярного іона, але і фрагментація. Інтенсивність піку в
мас-спектрі пропорційна числу утворилися іонів даного виду. При структурних
дослідженнях знаходять кореляцію мас-спектра (що складається з ліній різних
фрагментів) з будовою молекул, введених в джерело іонів.
Мас-спектрометрія дозволяє визначати молекулярну
масу досліджуваного з'єднання, його брутто-формулу і хімічну структуру
молекули.
Інформацію про склад досліджуваного з'єднання
отримують виходячи з величин масових чисел, інтенсивності піків молекулярного
іона і ізотопних піків.
Вивчаючи піки фрагментних іонів, встановлюють
структуру сполуки. Імовірність розриву зв'язку в молекулярному іоні і, отже,
інтенсивність піку залежать від енергії зв'язків. Розрив одинарних зв'язків
відбувається легше, ніж кратних; зв'язку С-С розриваються легше, ніж зв'язку
С-Н, і т.д. Фрагментація деяких сполук призводить до утворення таких
нейтральних молекул, як Н2О, СО, СО2, NH3, H2S,
R-ОН та ін. Відносна інтенсивність піку відповідного фрагментного іона залежить
від його власної стійкості і стабільності утворився одночасно з ним радикала
або нейтральною молекули. Склад і масові числа характеристичних іонів
дозволяють встановити приналежність досліджуваного з'єднання до певного класу.
Фрагменти з великими масовими числами, що утворюються при первинних процесах
розпаду молекулярного іона, дають важливу інформацію про хімічному будову.
Можливу структурну формулу будують,
використовуючи каталоги мас-спектрів. Перевагою мас-спектрометрії є широка
інформативність і дуже висока чутливість. Для отримання мас-спектра досить
мікрограмових і навіть нанограмових кількостей речовини. Це дозволяє
використовувати метод для визначення речовин в біологічних середовищах, а також
поєднувати мас - спектрометрії з різними видами хроматографії.
При поглинанні або дифракції рентгенівського
випромінювання (10-8-10-6 см) відбувається зміна
енергетичного стану внутрішніх електронів атома. Цей процес лежить в основі
рентгенівської абсорбційної спектроскопії і рентгенівського дифракційного
аналізу.
Рентгенівська абсорбційна спектроскопія. Метод
заснований на видаленні електронів з внутрішніх орбіталей атомів. Його
використовують для визначення важких атомів у матриці з легких атомів.
Рентгенівський дифракційний аналіз. Цей метод
дозволяє з високою точністю аналізувати кристалічні речовини. Він заснований на
здатності атомів індивідуальних хімічних речовин при рентгенівському
опроміненні утворювати характерні спектральні піки дифракції. На
фотопластинках, знятих у різних проекціях, отримують фотографію дифракційної
картини, яка представлена у вигляді найдрібніших темних крапок.
Інтенсивність почорніння вимірюють мікрофотометри. В результаті отримують
карти, що складаються з ряду контурних ліній, за якими визначають положення
атомів в молекулі і молекул в кристалі.
Дифракція рентгенівського випромінювання
дозволила зробити висновок про хімічну структуру таких складних природних
сполук, як молекули інсуліну, гемоглобіну, дезоксирибонуклеїнової кислоти та
ін.
.4 Встановлення хімічної структури речовини
Висновок про хімічному будову речовини робиться
на основі комплексного використання даних, отриманих декількома методами. Такий
підхід забезпечує більшу достовірність результатів досліджень.
Для встановлення молекулярної формули
використовують елементний і ізотопний аналіз і різні методи визначення
молекулярної маси: фізичні (ебуліоскопія, кріоскопія, газометр, ізотермічна
дистиляція) або фізико-хімічні (мас-спектрометрія, дифракція рентгенівського
випромінювання).
Хімічні методи дозволяють якісно і кількісно
визначити рухливий водень, наявність подвійних зв'язків і ряду функціональних
груп. Ці результати потім підтверджують ІЧ-спектроскопією, що дозволяє зробити
більш об'єктивний висновок про наявність (або відсутність) тих чи інших
функціональних груп. УФ-спектроскопія дає можливість встановити тип хромофора
(якщо в молекулі є ненасичені зв'язку), підтвердити наявність цис-, транс- і
інших видів ізомерії. Характер та інтенсивність УФ-спектрів поглинання дають
інформацію про те, до якого класу належить досліджуване з'єднання.
Хімічну структуру можна вважати встановленою,
якщо визначені вид, число атомів і з'єднують їх хімічних зв'язків, а також
доведено просторове розташування атомних груп в молекулі (встановлена конфігурація
і конформація молекули). Підтвердженням встановленої структури є зустрічний
хімічний синтез досліджуваного з'єднання, яке піддають потім порівняльній
оцінці за допомогою тих же методів.
Висновки
Пошук нових лікарських засобів і речовин
реалізується спільними зусиллями різних галузей науки, де провідну роль
відіграють фахівці в таких галузях як: хімія, фармакологія, фармація.
Нові лікарські засоби повинні впливати на
організм доцільно і точно з мінімальними побічними ефектами. В кінці 19
століття Пауль Ерліх (1854-1915 рр.) Був першим хто почав цілеспрямований
пошук.
Джерела отримання лікарських речовин і засобів:
· Лікарські засоби
неорганічної природи отримують з мінералів, руд, води мінеральних джерел, озер,
морів і т.д.
· Лікарські засоби
органічної природи отримують з вихідної сировини: нафти, газу, кам'яного
вугілля, горючого сланцю, деревини і продуктів її переробки.
· Рослинна сировина служить
для отримання алкалоїдів, вітамінів, глікозидів.
· Тварина сировина служить
для отримання гормонів, ферментів, препаратів на основі тваринної сировини.
В середині 19 ст. з'явився хімічний синтез.
На початку 20 ст. з'являється імунологічний
спосіб отримання лікарських засобів у вигляді антимікробних та антитоксичних
сироваток і вакцин, а також отримані перші антибіотики (назва була введено в
1942 році Зельманом Ваксманом)
Починаючи з 1980-х років отримують комплексні та
індивідуальні препарати за допомогою генної інженерії та біотехнології.
В даний час основними напрямками для пошуку та
отримання нових лікарських засобів і речовин є:
· Емпіричне вивчення
(дослідне) видів фармакологічної активності різноманітних речовин, одержуваних
хімічним шляхом. Тут в основі лежить так званий, метод «проб і помилок», тобто
фармаколог бере існуючі речовини, після чого за допомогою фармакологічних
методик встановлює їх приналежність до певної фармакологічної групи, після чого
вибираються самі активні речовини і визначаться ступінь фармакологічної
токсичності та активності для них у порівнянні з нині існуючими лікарськими
засобами, що використовуються в якості стандарту. В іноземних книгах цей шлях
відбору фармакологічних речовин називається Скринінг (відсів, відбір).
· Направлене вишукування
лікарських речовин. Ключовий момент тут полягає у відборі сполук з одним
встановленим видом фармакологічної активності. Величезний плюс цього методу в
значно швидкому відборі фармакологічно активних речовин, але при це суттєвий
мінус в тому, що пропадає можливість виявити інші вельми важливі види
фармакологічної активності. Найчастіше цей метод називають обмеженим
скринінгом.
· Модифікація структури
існуючих лікарських засобів. В сучасний час цей метод займає лідируючі позиції.
Хіміки-синтетики замінюють в існуючих з'єднаннях один радикал іншим, наприклад
етиловий - пропиловим або метиловим і в зворотній послідовності, впроваджують
до складу первинної молекули інші хімічні елементи або здійснюють інші
модифікації. Даний метод дозволяє збільшувати активність лікарських препаратів,
зробити його дія найбільш виборчим, і що немало важливо значно знизити, або
зовсім прибрати побічні дії препарату.
· Цілеспрямований синтез.
Суть методу в тому, що спочатку ведеться пошук речовин з наперед заданими
фармакологічними параметрами. Синтез нових структур з очікуваною активністю
практично завжди все ведеться в тому класі хімічних сполук, де вже існують
речовини, що мають вплив на дану тканину або орган. Якщо вдається знайти таку
структуру, яка за формою, розміром, конформації, електронно-протонним
властивостям і ряду інших фізико-хімічних параметрів буде збігатися з живою
структурою, яка підлягає регулюванню.
· Синтез антиметаболітів -
антагоністів тих речовин, які беруть участь у життєдіяльності організму
(вітаміни, ферменти, трансмітери, гормони).
· Синтез стереоізомерів -
фармакологічна активність грунтується не тільки на розмірах і формах молекул, а
більшою мірою - їх стереометрії, так як може змінюватися не тільки
фармакологічна активність, але і токсичність.
· Біотехнологія - один з
найважливіших напрямків отримання лікарських засобів з мікроорганізмів, тканин
тварин і рослин. В результаті розробляються комплексні препарати.
· Генетична інженерія
(генна інженерія) - встановлює методи і прийоми, а також технології одержання
рекомбінантних ДНК і РНК, виділення генів з організму (клітин). Можливості
генної інженерії необмежені, так як вона здатна пересаджувати гени.
· Створення комбінованих препаратів.
Ефективний спосіб пошуку нових лікарських засобів. В комбіновані засоби
включають лікарські речовини, які надають дію на етіологію хвороби і основні
ланки патогенезу, при тому вони взаємно підсилюють дію. Комбіновані препарати
найчастіше створюються на основі включення речовин, що усувають побічні дії
основної речовини.
Після фармацевтичних випробувань препарат
проходить клінічні випробування. Виробляється дослідна заводська партія ліків,
розробляється технологічний регламент. Якщо препарат більш активний і менш
токсичний, ніж всі попередники, то починається заводське виробництво і препарат
заноситься до реєстру лікарських засобів, після чого потрібно займатися його
просуванням на ринок.
Список використаної літератури
1. Фармацевтична хімія. Підручник для студентів
вищ. фармац. начальних закладів і фарм. фак. вищих мед. навчальних закладів
III-IV рівня акредитації / За заг. ред. П.О. Безуглого. - Вінниця: Нова книга,
2008. - 560 с.
2. Арзамасцев А.П. Фармакопейний анализ -
М.: Медицина, 1971.
. Беликов В.Г. Фармацевтическая химия. В 2
частях. Часть 1. Общая фармацевтическая химия: Учеб. для фармац. ин-тов и фак.
мед. ин-тов. - М.: Висш. шк., 1993. - 432 с.
. Глущенко Н.Н. Фармацевтическая химия:
Учебник для студ. сред. проф. учеб. заведений / Н.Н. Глущенко, Т.В. Плетенева,
В.А. Попков; Под ред. Т.В. Плетеневой. - М.: Издательский центр «Академия»,
2004. - 384 с.
. Драго Р. Физические методи в химии - М.:
Мир, 1981
. Кольтгоф И.М., Стенгер В.А. Объемний
анализ В 2 томах - М.: Государственное научно-техническое издательство
химической литератури, 1950
. Коренман И.М. Фотометрический анализ -
М.: Химия, 1970
8. Коростелев П. П, Фотометрический и комплексометрический
анализ в металлургии - М.: Металлургия, 1984, 272 с.
9. Логинова Н.В., Полозов Г.И. Введение в
фармацевтическую химию: Учеб. пособие - Мн.: БГУ, 2003. - 250 с.
10. Мелентьева Г.А., Антонова Л.А. Фармацевтическая химия. - М.:
Медицина, 1985. - 480 с.
11. Мискнджьян С.П. Кравченюк Л.П. Полярография
лекарственних препаратов. - К.: Вища школа, 1976. 232 с
12. Фармацевтическая химия: Учеб. пособие / Под ред. Л.П.
Арзамасцева. - М.: ГЕОТАР-МЕД, 2004. - 640 с.
13. Фармацевтический анализ лекарственних средств / Под общей
редакцией В.А. Шаповаловой - Харьков: ИМП «Рубикон», 1995
14. Фармацевтичний аналіз: Навч. посіб. для студ.
вищ. фармац. навч. закл. III-IV рівнів акредитації/П.О. Безуглий, В.О. Грудько,
С.Г. Леонова та ін.; За ред. П.О. Безуглого, - X.: Вид-во НФАУ; Золоті
сторінки, 2001. - 240 с.
15. Халецкий A.M. Фармацевтическая химия -
Ленинград: Медицина, 1966
. Ешворт М.Р. Титриметрические методи
анализа органических соединений кн. 1,2 - М.: Химия, 1972