Производство серной кислоты из серного колчедана
Введение
Серная кислота - важнейший продукт основой
химической промышленности. Среди минеральных кислот, производимых химической
промышленностью, серная кислота по объему производства и потребления занимает
первое место. Объясняется это двумя причинами: ее дешевизной по сравнению со
всеми другими кислотами, и ее свойствами. Серную кислоту применяют в различных
отраслях народного хозяйства, поскольку она обладает комплексом особых свойств,
облегчающих ее технологическое использование. Серная кислота не дымит, в
концентрированном виде не корродирует черные металлы, способна образовывать
многочисленные устойчивые соли и является дешевым сырьем для различных
производств. Крупнейшим потребителем серной кислоты в настоящее время является
промышленность фосфорных и азотных минеральных удобрений, таких как сульфат
аммония, аммофос, суперфосфат и др. Простой суперфосфат получают обработкой
апатитов и фосфоритов серной кислотой. Применение минеральных удобрений
способствует повышению урожайности сельскохозяйственных культур и содержания в
них полезных веществ. Кроме того, серная кислота применяется для производства
некоторых кислот (фосфорной, соляной, уксусной), сульфатов, искусственных
волокон, лаков, красок, пластмасс, моющих средств, взрывчатых веществ,
лекарственных препаратов, ядохимикатов, а также при производстве цветных и
редких металлов, спиртов, эфиров. Она расходуется на очистку нефтепродуктов, в
качестве электролита в кислотных аккумуляторах, в машиностроении - на
подготовку поверхности металлов при нанесении гальванических покрытий. В
металлообрабатывающей промышленности серная кислота и ее соли применяют для
травления стальных изделий. Прежде, чем найти применение веществу, сначала
подробно изучают его физические и химические свойства. После этого становятся
ясны границы использования вещества.
1.Аналитический обзор
.1 Серная кислота: физико-химические свойства,
применение
Физические свойства
Серная кислота H2SO4 - сильная двухосновная
кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях
концентрированная серная кислота - тяжёлая маслянистая жидкость без цвета и
запаха. В технике серной кислотой называют её смеси как с водой, так и с серным
ангидридом SO3. Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и
содержит около 95 % H2SO4. Затвердевает она лишь ниже минус 20 °С. Температура
плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В
обычных условиях он представляет собой очень вязкую жидкость с весьма высоким
значением диэлектрической проницаемости (e=100 при 25 °С). Стандартная
энтальпия образования ДH=298 кДж/моль. Стандартная энергия Гиббса образования
ДG=298 кДж/моль. Стандартная энтропия образования S=298 Дж/моль·K. Стандартная
мольная теплоемкость Cp=298 Дж/моль·K.
Химические свойства
Серная кислота - сильная двухосновная кислота,
диссоциация ее протекает по двум ступеням:
= H+ + HSO4 - первая ступень = H+ + SO4 - вторая
ступень.
В концентрированных растворах диссоциация серной
кислоты по второй ступени незначительна.
Серная кислота - сильнейшее дегидратирующее
(водоотнимающее) вещество. Она поглощает влагу из воздуха (гигроскопична),
отнимает воду от кристаллогидратов:
SO4 (конц.) +CuSO4 ∙ 5H2O (голубой) =
CuSO4 (белый) + 5H2O;
углеводов (обугливает дерево и бумагу):
SO4конц.+ C12H22O = 12C + 11H2O,
спиртов:
конц.+ C2H5OH = CH2=CH2 + H2O.
Серная кислота проявляет все свойства сильных
кислот:
а) взаимодействует с основными оксидами,
например:
SO4 = CuSO4 + H2O.
б) с основаниями, например:
NaOH + H2SO4= Na2 SO4 + 2H2O.
в) вытесняет другие кислоты из их солей,
например те, которые слабее нее:
SO4 = CaSO4 + CO2 + H2O.
или более летучие (обладающие температурами
кипения ниже, чем у серной кислоты) : тв. + H2SO4 (конц). = NaH SO4 + HNO3 -
при нагревании.
В окислительно-восстановительных реакциях
разбавленная серная кислота проявляет свойства обычной кислоты (неокислитель) -
при этом восстанавливаются ионы Н+, например:
Fe + H2SO4 (разб).
= Fe SO4 + H2.
Разбавленная H2SO4 не взаимодействует с
металлами, стоящими в ряду напряжений правее водорода. Концентрированная серная
кислота - кислота-окислитель, при этом восстанавливается сера (+6). Она
окисляет металлы, стоящие в ряду напряжений правее водорода:
Cu + 2 H2SO4 (конц).
= Cu SO4 + SO2 + 2H2O
и металлы, стоящие левее водорода, при этом сера
восстанавливается до степени окисления +4, 0 и -2:
Zn + 2 H2SO4 = Zn SO4+ SO2 + 2H2O
(1,12) 3Zn + 4 H2SO4 =
= 3Zn SO4 + S + 4H2O;+ 5 H2SO4 = 4Zn
SO4 + H2S + 4H2O.
Железо, алюминий, хром концентрированной серной
кислотой пассивируются (не реагируют), однако при сильном нагревании реакция
начинается, например:
2Fe + 6 H2SO4 = Fe2(SO4)3 + 3SO2 +
6H2O.
Концентрированная серная кислота окисляет
неметаллы, например:
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
(1,16) S +2 H2SO4 = 3SO2 + 2H2O.
Концентрированная серная кислота окисляет также
сложные вещества, например HI и HBr:
2HBr + H2SO4 = Br2 + SO2 + 2H2O;
HI + H2SO4 = 4I2 + H2S + 4H2O.
соли железа:
SO4 + 2 H2SO4 = Fe2(SO4)3 + 2H2O +
SO2.
Серную кислоту выпускают нескольких сортов. Они
отличаются концентрацией и количеством примесей. Для производства медицинских
препаратов, особо чистых реактивов, для заливки аккумуляторов требуется чистая
кислота. При травлении металлов, в производстве суперфосфата можно
воспользоваться кислотой, имеющей некоторые загрязнения. Экономически это
выгодно. Такая кислота более дешевая.
Сернокислотная промышленность выпускает так называемый олеум, используемый при
производстве некоторых органических препаратов, взрывчатых веществ. Олеум
представляет собой раствор серного ангидрида в серной кислоте. Сорта олеума
различаются по концентрации серного ангидрида в серной кислоте. Для некоторых
особых целей выпускают олеум, содержащий серного ангидрида до 60 %. Так,
кислота серная техническая и олеум технический (ГОСТ 2184-77) применяются в производстве
различных солей, кислот, всевозможных органических продуктов, красителей,
взрывчатых веществ, минеральных удобрений, в качестве водоотнимающего и
осушающего средства, в процессах нейтрализации, травления и многих других. Эти
продукты не горючи и относятся к веществам 2-го класса токсичности.
Серная кислота находит самое широкое применение.
Самый крупный потребитель серной кислоты - производство минеральных удобрений.
На 1 т Р2О5 фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т
(NH4)2SO4 - 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся
строить в комплексе с заводами по производству минеральных удобрений. Серная
кислота также используется для получения соляной, азотной, фосфорной,
плавиковой и многих органических кислот методом обмена, органических
сульфосоединений, для очистки различных газов, входит в состав нитрующих
смесей, используется в производстве красителей, для зарядки аккумуляторов, в
металлургии серную кислоту применяют для обнаружения микротрещин в готовой
продукции, на металлообрабатывающих заводах серную кислоту используют в цехах
гальванопокрытий. Как известно, перед нанесением на металлические изделия
электрическим методом никеля, хрома, меди их нужно тщательно очистить,
протереть, обезжирить и, наконец, выдержать непродолжительное время в ванне с
раствором серной кислоты. При этом она растворяет тончайший слой металла и с
ним удаляются следы загрязнений. В то же время поверхность металла становится
более шершавой: на ней появляются микроскопические углубления и выступы.
Электролитические покрытия к такой поверхности лучше пристают и более прочно
сцеплены с металлом. Также серная кислота необходима для переработки различных
руд и ископаемых. При переработке руд редких металлов большое значение имеет кислотный
способ их расщепления. Обычно для этой цели используют наиболее дешевую
нелетучую серную кислоту. Измельченную руду смешивают в определенной пропорции
с серной кислотой и нагревают. Полученный раствор и осадок дальше
перерабатывают химическим путем, исходя из химических свойств того элемента,
который нужно выделить из раствора. На химическую переработку руд редких
элементов расходуют тысячи тонн серной кислоты. Большое количество серной
кислоты требуется нефтеперерабатывающей промышленности для очистки нефти и ее
различных фракций. В органическом синтезе концентрированная серная кислота -
необходимый компонент при получении многих красителей и лекарственных веществ.
Широко применяются соли серной кислоты. Сульфат натрия (глауберова соль Nа2SO4∙10Н2О)
применяется для производства соды и в стекольной промышленности. Сульфат
кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4∙2Н2О)
и безводной соли ангидрита (Са, SO4). Ангидритовые вяжущие материалы получают
путем обжига гипсового камня при повышенных температурах (600-700 оС) с
различными добавками. При этом получают отделочный гипсовый цемент и
кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно
медленнее, чем полуводный гипс, и применяются для изготовления строительных
растворов и бетонов малой прочности, а также искусственного мрамора, бесшовных
настилов полов и др. Сульфат магния, или горькая соль (МgSO4∙7Н2О)
применяется в медицине как слабительное. Сульфат железа (II), или железный
купорос (FеSO4 ∙ 7Н2О) применяется для приготовления желтой кровяной соли
(К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева. Сульфат меди,
или медный купорос (СuSO4 ∙ 5Н2О) применяется для борьбы с различными
грибками - вредителями сельского хозяйства, для производства медных покрытий и
получения различных соединений меди. Из растворов, содержащих сульфат
трехвалентного металла (Fе3+, Аl3+, Сг3+) и сульфат одновалентного металла (К+,
NН4+, Rb+ ), выкристаллизовываются двойные соли типа К2SO4Al2(SO4)32 ∙ 4H2O
или КАl(SO4)3 ∙ 12Н2О. Вместо калия и алюминия могут стоять в любом
сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы
существуют только в твердом виде. В растворе они ведут себя как две
самостоятельные соли, т. е. как смесь сульфатов одно- и трехвалентных металлов.
Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а
также в других отраслях легкой промышленности. В пищевой промышленности серная
кислота применяется для получения крахмала, патоки и ряда других продуктов. В
электротехнике она используется в качестве электролита в аккумуляторах. Серную
кислоту используют для осушки газов и при концентрации кислот. Наконец, серную
кислоту применяют как компонент реакционной среды в процессах нитрования, в
частности, при получении взрывчатых веществ.
1.2 Способы получения серной кислоты
Серную кислоту получают из SO2 двумя способами:
нитрозным (башенным) и контактным.
Нитрозный способ
Переработка SO2 в серную кислоту по нитрозному
способу осуществляется в продукционных башнях - цилиндрических резервуарах
(высотой 15 м и более), заполненных насадкой из керамических колец. Сверху,
навстречу газовому потоку разбрызгивается "нитроза" - разбавленная
серная кислота, содержащая нитрозилсерную кислоту NOOSO3H, получаемую по
реакции:
O3 + 2 H2SO4 = 2 NOOSO3H + H2O.
Окисление SO2 окислами азота происходит в
растворе после его абсорбции нитрозой. Водою нитроза гидролизуется:
H + H2O = H2SO4 + HNO2.
Сернистый газ, поступивший в башни, с водой
образует сернистую кислоту:+ H2O = H2SO3.
Взаимодействие HNO2 и H2SO3 приводит к получению
серной кислоты:
2 HNO2 + H2SO3 = H2SO4 + 2 NO + H2O.
Выделяющаяся NO превращается в окислительной
башне в N2O3 (точнее в смесь NO + NO2). Оттуда газы поступают в поглотительные
башни, где навстречу им сверху подаётся серная кислота. Образуется нитроза,
которую перекачивают в продукционные башни. Таким образом осуществляется
непрерывность производства и круговорот окислов азота. Неизбежные потери их с
выхлопными газами восполняются добавлением HNO3.
Серная кислота, получаемая нитрозным способом,
имеет недостаточно высокую концентрацию и содержит вредные примеси (например,
As). Её производство сопровождается выбросом в атмосферу окислов азота
("лисий хвост", названный так по цвету NO2).
Контактный способ
Принцип контактного способа производства серной
кислоты был открыт в 1831 П. Филипсом (Великобритания). Первым катализатором
была платина. В конце 19 - начале 20 вв. было открыто ускорение окисления SO2 в
SO3 ванадиевым ангидридом V2O5. Особенно большую роль в изучении действия
ванадиевых катализаторов и их подборе сыграли исследования советских учёных А.
Е. Ададурова, Г. К. Борескова, Ф. Н. Юшкевича.
Современные сернокислотные заводы строят для
работы по контактному методу. В качестве основы катализатора применяются окислы
ванадия с добавками SiO2, Al2O3, K2O, CaO, BaO в различных соотношениях. Все
ванадиевые контактные массы проявляют свою активность только при температуре не
ниже ~420 "С. В контактном аппарате газ проходит обычно 4 или 5 слоев контактной
массы. В производстве серной кислоты контактным способом обжиговый газ
предварительно очищают от примесей, отравляющих катализатор. As, Se и остатки
пыли удаляют в промывных башнях, орошаемых серной кислотой. От тумана серную
кислоту (образующейся из присутствующих в газовой смеси SO3 и H2O) освобождают
в мокрых электрофильтрах. Пары H2O поглощаются концентрированной серной
кислотой в сушильных башнях. Затем смесь SO2 с воздухом проходит через
катализатор (контактную массу) и окисляется до SO3:+ 1 / 2 O2 = SO3.
Серный ангидрид далее поглощается водой,
содержащейся в разбавленной H2SO4:
+ H2O = H2SO4.
В зависимости от количества воды, поступившей в
процесс, получается раствор серной кислоты в воде или олеум.
Посредством данного метода сейчас вырабатывается порядка 80% H2SO4 в мире.
Применение серной кислоты
Серная кислота может служить для очистки
нефтепродуктов от сернистых, непредельных органических соединений.
В металлургии серная кислота применяется для
удаления окалины с проволоки, а также листов перед лужением и оцинкованием
(разбавленная), для травления разичных металлических поверхностей перед
покрытием их хромом, медью, никелем и др. Также с помощью серной кислоты
разлагают комплексные руды (в частности, урановые).
В органическом синтезе серная кислота
концентрированная является необходимым компонентом нитрующих смесей, а также
сульфирующим средством при получении многих красителей и лекарственных веществ.
Широко применяется серная кислота для
производства удобрений, этилового спирта, искусственного волокна, капролактама,
двуокиси титана, анилиновых красителей и целого ряда других химических
соединений.
Серная кислота отработанная (отход) применяется
в химической, металлургической, деревообрабатывающей и других отраслях
промышленности Серная кислота аккумуляторная применяется в производстве
свинцово-кислотных источников тока.
1.3 Характеристика исходного сырья
Сырьевая база производства серной кислоты -
серосодержащие соединения, из которых можно получить диоксид серы. В
промышленности около 80% серной кислоты получают из природной серы и железного
(серного) колчедана. Значительное место в сырьевом балансе занимают отходящие
газы цветной металлургии. Некоторые производства используют в качестве сырья
сероводород, образующийся при очистке серы в нефтепереработке.
Исходными реагентами для получения серной
кислоты могут быть элементная сера и серосодержащие соединения, из которых
можно получить либо серу, либо диоксид серы. Традиционно основными источниками
сырья являются сера и железный (серный) колчедан. Около половины серной кислоты
получают из серы, треть - из колчедана. Значительное место в сырьевом балансе
занимают отходящие газы цветной металлургии, содержащие диоксид серы. В то же
время отходящие газы - наиболее дешевое сырье, низки оптовые цены и на
колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для
того чтобы производство серной кислоты из серы было экономически целесообразно,
должна быть разработана схема, в которой стоимость ее переработки будет
существенно ниже стоимости переработки колчедана или отходящих газов.
2 Технологическая часть
Технологическая схема производства серной
кислоты контактным способом представлена на рис. 1.
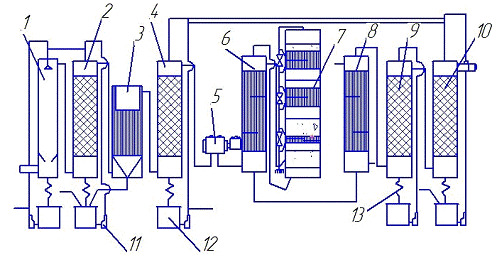
- первая промывная башня; 2 - вторая промывная
башня с насадкой;
- мокрый электрофильтр; 4 - сушильная башня с
насадкой;
- турбокомпрессор; 6 - трубчатый теплообменник;
7 - контактный аппарат; 8 - трубчатый холодильник газа; 9 и 10 - абсорбционные
башни с насадкой; 11 - центробежные насосы; 12 - сборники кислоты;
- холодильники кислоты
Рисунок 1 - Технологическая схема производства
серной кислоты
После сушильной башни обжиговый газ проходит
через фильтр-брызгоуловитель 11 и поступает в турбогазодувку 12. В
теплообменниках 13 газ нагревается за счет теплоты продуктов реакции до
температуры зажигания катализатора (420-440 °С) и поступает на первый слой
контактного аппарата, где происходит окисление 74 % SO2 с одновременным повышением
температуры до 600 °С. После охлаждения до 465 °С газ поступает на второй слой
контактного аппарата, где степень превращения достигает 86 %, а температура
газа возрастает до 514 ºС. После
охлаждения до температуры 450 ºС
газ поступает на третий слой контактного аппарата, где степень превращения SO2
увеличивается до 94,0-94,5 %, а температура повышается до 470 °С.
Затем в соответствии с требованиями метода ДК-ДА
реакционный газ охлаждают в теплообменниках 13 до 100 °С и направляют на
абсорбцию первой ступени: сначала в олеумный абсорбер 21, затем в моногидратный
абсорбер 20. После моногидратного абсорбера и фильтра-брызгоуловителя газ вновь
нагревают до температуры 430°С и подают на четвертый слой катализатора.
Концентрация SO2 в газе составляет теперь 0,75-0,85 %. В четвертом слое
происходит окисление остаточного SO2 с конверсией ≈ 80 %,
сопровождающееся повышением температуры до 449 °С. Реакционную смесь вновь
охлаждают до температуры 409 °С и направляют на последний (пятый) слой
контактного аппарата. Общая степень превращения после пяти стадий
контактирования составляет 99,9 %.
Газовую смесь после охлаждения направляют в
моногидратный абсорбер второй ступени абсорбции 17. Непоглощенный газ,
состоящий в основном из воздуха, пропускают через фильтр 11 для выделения брызг
и тумана и выбрасывают в атмосферу через выхлопную трубу.
Производительность установки составляет до 1500
т/сут по моногидрату.
Расход на 1 т моногидрата: колчедана 0,82 т,
воды 50 м3, электроэнергии 82 кВт -ч.
.2 Расчет материального баланса процесса
В материальном и тепловом расчетах введены
буквенные обозначения величин с индексами. Верхние левые цифровые индексы
означают:
- условный 45% колчедан;
- влажный колчедан;
- сухой колчедан;
- воздух;
- диоксид серы в сухом обжиговом газе;
- серный ангидрид в сухом обжиговом газе;
- сухой обжиговый газ;
- влажный обжиговый газ;
- пыль в обжиговом газе;
- огарок, удаляемый через спускную трубу;
- потери теплоты в окружающую среду;
- теплоты, отводимые охлаждающими элементами.
Нижний правый индекс показывает, какую из составляющих частей рассматривают.
Отсутствие такого индекса означает, что рассматривают всю совокупность,
определяемую левым верхним индексом. Например: 4m - масса влажного воздуха,
4mO2 - масса кислорода воздуха.
Часовой расход сухого колчедана составляет:
m = 1m ∙ 1cs / 3cs = 20 500 ∙ 46 /
42,5 = 221 882 кг/сутки или 9 245,1 кг/ч.
Расход влажного колчедана:
m = 3m ∙ 100 / (100 - 2cH2O) = 9 245,1 ∙
100 / (100 - 2,9) = 9 521 кг/ч.
Массовое количество серы в колчедане:
ms = 3ms = 3m ∙ 3cs / 100 = 9 345,1 ∙
42,5 / 100 = 3 929 кг/ч.
Суммарный выход огарка и пыли рассчитывают,
исходя из предположения, что в условиях кипящего слоя образование огарка можно
описать схемой
FeS2 + O2 → Fe2O3 + SO2.
В этом случае выход огарка из 1 кг колчедана
определяют:
x = (160 - 3cs) / (160 - 9cs) = (160 - 42,5) /
(160 - 0,72) = 0,737 кг/кг,
отсюда для суммарного выхода огарка и пыли
имеют:
m + 10m = 3m ∙ x = 9 245,1 ∙ 0,737 =
6 820кг/ч.
Потери серы и огарка составляют:
ms + 10ms = (9m + 10m) ∙ 9cs / 100 = 6 820
∙ 0,72 / 100 = 49кг/ч.
Выгорело серы с огарком:
5ms + 6ms = 2ms - (9ms + 10ms) = 3
929 - 49 = 3 880 кг/ч.
Образовалось SO2 и SO3 по объёму:
5V + 6V = (5ms + 6ms) ∙ VSO2 /
AS = 3 880 ∙ 21,895 / 32,066 = 2 649 м3/моль,
где VSO2 - молярный объём диоксида серы SO2
м3/моль- молекулярная масса серы.
Образовалось триоксида серы SO3
по объёму
(5V + 6V) ∙ 7сSO3 / (7сSO2 + 7сSO3) = 2
649 ∙ 0,12 / (13,8 + 0,12) = 22,8 м3/ч
по массе
m = 22,8 ∙ 80,066 / 22,4 = 81 кг/ч,
где 22,4 - молярный объём SO3, который условно
принимают равным нормальному мольному объёму, м3/кмоль
В этом количестве SO3 содержится серы
6ms = 6V ∙ As / VSO3 = 22,8 ∙
32,066 / 22,4 = 32 кг/ч,
где VSO3 - условный, м3/моль
Использовано серы на образование диоксида серы
SO2
5ms = (5ms + 6ms) - 6ms = 3 880 - 32
= 3 849 кг/ч.
Образовалось диоксида серы SO2
5m = 5ms ∙ MSO2 / As = 3 849 ∙
64,066 / 32,066 = 7 690 кг/ч,
5V = 7 690 / 2,927 = 2 627 м3/ч,
где MSO2 - молекулярная масса диоксида серы
кг/моль
2,927 - плотность диоксида серы SO2 кг/м3
Объём полученного сухого обжигового газа
составляет
V = 5V ∙ 100 / cSO2 = 2 627 ∙ 100 /
13,8 = 19 036 м3/ч.
Расход кислорода в обжиговом газе рассчитывают
по следующей реакции:
4FeS2+11O2 → 2Fe2O3+8SO2;
= 11 / 8 = 1,375 кмоль/кмоль,
где PSO2 - стехиометрическое отношение числа
израсходованных молей кислорода О2 к числу молей образовавшегося диоксида серы
SO2 кмоль/кмоль= PSO2 + 0,5
СO2 = 21 - ((1 - 1 / 100) ∙ PSO2 ∙
1,023 + 21 / 100) ∙ 7CSO2 - ((1 - 21 / 100) ∙ ( PSO2 + 0,5) ∙
0,999 + 21 / 100) ∙ 7CSO3,
где 21 = 7CO2 - значение n для обычного
воздушного дутья, не обогащённого кислородом, %,
1,023 = KSO2 = VO2 / V SO2 = 22,393
/ 21,895,
Расчет производят на 100 объёмов обжигового
газа. Получают следующую формулу для определения содержания кислорода в сухом
обжиговом газе при работе на воздушном дутье:
СO2 = 21 - 1,321 ∙ 7СSO2 - 1,691 ∙
7СO3 = 21 - 1,321 ∙ 13,8 - 1,691 ∙ 0,12=
= 2,56 %.
Считают, что мольные объёмы кислорода О2
диоксида серы SO2,триоксида серы SO3 равны, то KSO2 = KSO3 = 1, и рассчитанная
концентрация кислорода составляет 3,20 %. А это означает, что допускается
относительная ошибка равна
(3,20 - 2,56) ∙ 100 / 2,56 = 24,7 %.
Массовое количество кислорода в обжиговом газе
составляет
VO2=7V ∙ 7CO2 / 100 = 19 036 ∙ 2,56
/ 100 = 487м3/ч,
mO2 = 487 ∙ 1,429 = 696 кг/ч,
где 1,429 - плотность кислорода кг/м3
Объём азота в обжиговом газе равен
VN2=7V - (7VSO2 + 7VSO3 + 7VO2) = 19 036 - (2
627 + 22,8 + 696) = 15 690 м3/ч,
mN2 = 15 690 ∙ 1,257=19 722 кг/ч,
где 1,257 - плотность атмосферного азота кг/м3
Расход воздуха при обжиге
Vсух = 7VN2 ∙ 100 / (100 - 4CO2) = 15 690 ∙
100 / (100 - 21) = 19 860 м3/ч или
619 кг/ч.
Массовое количество влаги, поступающей с
воздухом d=3,6∙10-3 кг Н2О на 1 кг сухого воздуха, где d -
влагосодержание.
Отсюда
mcyx = 4mH2O ∙ d = 25 619 ∙ 0,0036 =
92 кг/ч.
Массовое количество влажного воздуха составляет
m = 4mcyx + 4mH2O = 25 619 + 92 = 25 711 кг/ч,
(19 860 + 92 / 0,804) =19 974 м3/ч,
где 0,804 - плотность воды при нормальных
условиях кг/м3
массовое количество паров воды в обжиговом газе
составляет
mH2O=2mH2O+4mH2O = (9 521 - 9 245) + 92=368
кг/ч,
/ 0,804=457,7 м3/ч.
Общая масса обжигового газа равна
8m = 5m + 6m + 7mO2 + 7mN2 + 8mH2O =
7 690 + 81 + 696 + 19 722 + 368 =
= 28 557 кг/ч.
Определяют массу пыли, уносимую с газом и массу
более крупного огарка, удаляемого через спускную трубу. Принимают, что унос
равен 90% от общего количества огарка.
m = (9m + 10m ) ∙ 90 / 100 = 6 820 ∙
90 / 100 = 6 138 кг/ч.
Массовое количество более крупного огарка,
удаляемого через спускную трубу
m = (9m +10m) - 9m = 6 820 - 6 138 = 682 кг/ч.
Материальный баланс печи обжига колчедана в
кипящем слое сводят в табл. 1.
Таблица 1 - Материального баланса
|
Приход
|
Кг/ч
|
Расход
|
Кг/ч
|
м3/ч
|
Об. д., %
|
|
Колчедан влажный В том числе:
Колчедан сухой Влага
|
9 521 9 245 276
|
Обжиговый газ В том числе Триоксид
серы Диоксид серы Кислород Азот Пары воды
|
28 557 81 7 690 696 19 722 368
|
19 284,5 22,8 2 627 487 15 690
457,7
|
100,00 0,12 13, 62 2,53 81,36
2,37
|
|
Воздух влажный В том числе Воздух
сухой Влага
|
25 711 25 619 92
|
Огарок В том числе Пыль, уносимая
с газом Крупный огарок
|
6 820 6 138 682
|
|
|
|
Всего
|
35 232
|
Всего
|
35 377
|
19 284,5
|
100,00
|
.3 Тепловой баланс процесса
Приход теплоты
Теплота реакции образования диоксида серы SO2.
Тепловой эффект реакции образования находят по стандартным энтальпиям:
ΔHFeS2 = - 177,40
кДж/моль;
ΔHО2 = 0;
ΔHFe2О3 = - 821,32
кДж/моль;
ΔHSО2 = - 296,90
кДж/моль.
Отсюда для реакции получают тепловой эффект:=
- ΔH1
= - (2 ∙ ΔHFe2O3 +8 ∙
ΔHSO2-4
∙
ΔHFeS2
-11 ∙ ΔHO2) =
=- (-2 ∙ 821,32 - 8 ∙ 296,9 + 4 ∙
177,4 + 11 ∙ 0) = 3 308кДж,
где G1 -тепловой эффект реакции, кДж;
ΔH1 -изменения
энтальпии, кДж.
При сгорании колчедана по реакции на каждый
киллограм сгоревшей серы выделяется теплоты:= (G1 ∙ 1 000) / (2 ∙ 4
∙ AS) = (3 308 ∙ 1 000) / (8 ∙ 32) =12 900 кДж/кг серы,
где АS - молекулярная масса серы.
Тепло реакции при образовании триоксида серы SO3
составляет
ΔHSО3 = -395,2
кДж/моль.
Для реакции
FeS2 + 15O2 → Fe2O3 + 8SO3.
Получают:= - ΔH2
= -(2 ∙ ΔHFeО3 +8 ∙ ΔHSО3
+4 ∙ ΔHFeS2 +15 ∙ ΔHО2)
= - (-2 ∙ 821,32 - - 8 ∙ 395,2+4 ∙ 177,4+15 ∙ 0) = 4
095 кДж,
где G2 - тепловой эффект реакции, кДж;
ΔH2 - изменение
энтальпии, кДж.
При сгорании колчедана на каждый килограмм серы,
сгоревшей до триоксида серы SO3, выделяется теплоты:=G2 ∙ 1 000 / 4 / 2 /
AS = 4 095 ∙ 1 000 / 4 / 2 / 32 = 16 000 кДж/кг серы.
При сгорании 6mS кг серы выделяется теплоты
Q = 6mS ∙ GSO3 = 32 ∙ 16 000 = 512
000 кДж/ч.
Физическая теплота воздуха
При температуре 3 0С и ϕ 75 % энтальпия
влажного воздуха в расчете на 1 кг сухого воздуха составляет 11,7кДж/кг
Отсюда:
Q =iB ∙ 4mсух = 11,7 ∙ 25 619 = 299
742,3 кДж/ч.
Физическая теплота сухого колчедана
Q = 3m ∙ 3с ∙ 2t = 9245,1 ∙
0,54 ∙ 7 = 34 946,5 кДж/ч,
где 0,54 - удельная теплоёмкость сухого
колчедана, кДж/(кг ∙ град).
Физическая теплота воды, поступающей с
колчеданом
Q - 3Q = 2mH2O ∙ 2IH2O = (9 521 - 9 245,1)
∙ 33,66 = 9 286,7 кДж/ч,
где 2IH2O - энтальпия воды при температуре 8 0С
кДж/ч.
Физическая теплота влажного колчедана
Q = 3Q +(2Q - 3Q) = 34 946,5 + 9 286,7 = 44 233
кДж/ч.
Общий приход теплотыпр = 5Q+ 6Q + 4Q +2Q = 50
684 100 + 512 000 + 299 742 + 44 223 =
= 51 540 075 кДж/ч
Расход теплоты
Физическая теплота влажного обжигового газа
Q = ( 8mSO2 ∙ 8сSO2 + 8mSO3 ∙ 8сSO3
+ 8mO2 ∙ 8сO2 + 8mN2 ∙ 8cN2 ) ∙ 8t + 8mH2O ∙ 8iH2O = =
(7 690 ∙ 0,768 + 81 ∙ 0,887 + 696 ∙ 1,019 + 19 722 ∙
1,102) ∙ 825 + 276 ∙
∙ 4 204 = 24 607 328 кДж/ч.
Физическая теплота пыли в газе. Зависимость
средней удельной теплоёмкости огарка от температуры приближённо можно выразить
уравнением
с = 10с = 0,6096 + 0,000788 ∙ t кДж/(кг ∙
град).
Отсюда для температуры 825 0С имеют
с = 0,6096 + 0,000788 ∙ 825 = 1,26
кДж/(кг*град);
Q = 9m ∙ 9с ∙ 8t =6 820 ∙ 1,26
∙ 825 = 7 089 390 кДж/ч,
где 9Q - физическое тепло пыли в газе кДж/ч.
Физическое тепло запыленного обжигового газа
Q + 9Q = 24 607 328 + 7 089 390 = 31 696 718
кДж/ч.
Физическая величина крупного огарка, удаляемого
через спускную трубу
Q = 10m ∙ 10c ∙ 10t = 682 ∙
1,26 ∙ 825 = 708 939 кДж/ч.
Потери теплоты во внешнюю среду принимают равным
2,8 % от прихода теплоты, тогда:
Q = Qпр ∙ 0,028 = 51 540 075 ∙ 0,028
= 1 443 122 кДж/ч,
где 11Q - потери теплоты во внешнюю среду
кДж/ч,пр - общий приход теплоты кДж/ч.
Теплоту, отводимую от кипящего слоя, находят по
разности между приходом тепла и его расходом
Q = Qпр - (8Q + 9Q + 10Q + 11Q) =51 540 075 - 31
696 718 - 708 939 -
1 443 122 = 17 691 296 кДж/ч.
Тепловой баланс печи обжига колчедана в кипящем
слое сводят в табл. 2.
Таблица 2 - Теплового баланса печи обжига
колчедана в кипящем слое
|
Приход
|
кДж/ч
|
%
|
Расход
|
кДж/ч
|
%
|
|
От сгорания колчедана: До SO2 До
SO3 С воздухом С колчеданом
|
50684100 512 000 299 742 44 233
|
98,33 0,99 0,58 0,1
|
С обжиговым газом С пылью в газе С
крупным огарком На парообразование Во внешнюю среду
|
24607328 7089390 708939 17691296
1 443122
|
47,74 13,76 1,38 34,32 2,8
|
|
Всего
|
51540075
|
100,00
|
Всего
|
51540075
|
100,00
|
.4 Расчет основного аппарата
Реактор (гидрататор) представляет собой
пустотелый цельнокованый цилиндрический стальной аппарат. Время контакта
паро-газовой смеси 20 с [1]. За время контакта через аппарат проходит 706,5 кг
этилена и 227,07 кг водяного пара.
νС2Н4 =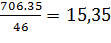 кмоль,
кмоль,
νН2О=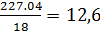 кмоль.
кмоль.
Из уравнения Клайперона - Менделеева, находим V,
м3=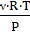 ,
,
где R − универсальная газовая постоянная,
равная 8,31 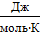 ;
;
Т − температура, К;
ν − количество, моль.
С2Н4 =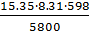 =
13,2 м3O =
=
13,2 м3O =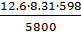 = 10,8 м3= 13,2 +
10,8 = 24 м3
= 10,8 м3= 13,2 +
10,8 = 24 м3
Реактор заполняется на 2/3 части, соответственно
объем реактора составит V = 32 м3.
Для заданной производительности, по справочным
данным, принимаем диаметр аппарата 2200 мм [1].
= h ∙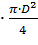
где h − высота, м;
D − диаметр, м;
= h∙
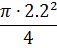
= 26 м.
Высота слоя катализатора 8 м. Фосфорная кислота
установлена на цеолите. Для снижения уноса кислоты в нижней части реактора
загружают слой чистого носителя высотой 1 м [1].
Толщина стенки S, мм реактора определяется по
формуле:
S ≧
SR + c,=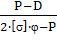
где P − давление, МПа;
D − диаметр аппарата, м;
[σ] −
напряженность материала, 150.8 МПа [2];
φ - коэффициент
запаса прочности, равный 1.
=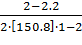
= 0,015.
С = с1 + с2 + с3,
где с1 − прибавка на коррозию 0.1 мм в
год;
с2 − прибавка на эрозию равная 0;
с3 - прибавка на минусовой допуск материала.
с1 = 0,0015 м,= 0,015 + 0,0015 = 0,0165.
Принимаем по ГОСТ 0.018 м [2]:
с3 = 0,18,
с = 0,0015 + 0,18 = 0,18515,≧
0,015 + 0,1815 = 0,1965∼20 мм.
По справочным данным выбираем штуцера [2]
приварные для ввода и вывода сырья (аппарат выполнен из стали):= 25 мм,= 150
мм.
3. Экологическая часть
Серная кислота и олеум - очень едкие вещества.
Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические
ожоги)[4]. При вдыхании паров этих веществ они вызывают затруднение дыхания,
кашель, нередко - ларингит, трахеит, бронхит и т. д. Предельно допустимая
концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³,
в
атмосферном воздухе 0,3 мг/м³ (максимальная
разовая) и 0,1 мг/м³ (среднесуточная).
Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин),
смертельная 0,18 мг/дм3 (60 мин). Класс опасности II. Аэрозоль серной кислоты
может образовываться в атмосфере в результате выбросов химических и
металлургических производств, содержащих оксиды S, и выпадать в виде кислотных
дождей.
На отравление серной кислотой может
указывать внешний вид объектов исследования. Так, например, у лиц, принявших
концентрированную серную кислоту
<http://www.xumuk.ru/encyklopedia/2/4025.html>, могут быть
повреждения тканей губ, языка, пищевода, желудка и т. д. Одежда, на
которую попала серная кислота
<http://www.xumuk.ru/encyklopedia/2/4025.html>, может быть
повреждена. Однако доказательством отравления серной кислотой является
обнаружение ее в дистиллятах, полученных после перегонки этой кислоты из
диализатов.
Выделение серной кислоты из
биологического материала. Подлежащие исследованию органы трупов измельчают,
заливают водой до получения кашицеобразной массы, которую оставляют на 1-2 ч.
Полученную вытяжку отфильтровывают, подвергают диализу, а затем из диализата
отгоняют серную кислоту.
При химико-токсикологическом
исследовании серной кислоты на одежде или на других объектах эту кислоту можно
извлечь этиловым спиртом, в котором растворяется эта кислота и не растворяются
ее соли. С этой целью исследуемый материал измельчают и прибавляют к нему
этиловый спирт. Через некоторое время жидкость отфильтровывают от твердых
частиц исследуемого материала. Фильтрат на водяной бане выпаривают досуха. К
сухому остатку прибавляют 10 мл воды, кипятят несколько минут, а затем
охлаждают жидкость до комнатной температуры. Из полученной жидкости отгоняют
серную кислоту и исследуют ее в дистилляте.
Выше говорилось о ресурсной части
проблемы. На сегодняшний день не менее, а более серьезной является вторая ее
часть - загрязнение окружающей среды. Все неиспользованное сырье, а это его
основная часть (до 90%), поступает в окружающую среду в виде различных отходов.
Следует отметить, что в природе эти вещества находились в наименее растворимой
и, следовательно, наименее токсичной форме. Например, металлы - в виде
малорастворимых оксидов или сульфидов, фтор - в виде фторида кальция или
фосфатов (последние всегда содержат фтор). И даже несмотря на это,
месторождения фторида кальция или фосфоритов являются зонами эндемического
(природного) флюороза. При получении металлов, фосфорных удобрений и ряда
других продуктов образуется большое количество твердых, жидких и газообразных
отходов, в которых тяжелые металлы и фтор находятся в активной форме,
губительно воздействующей на все живое. В конце ХХ столетия промышленность и
транспорт выбросили в окружающую среду свинца больше, чем за весь
предшествующий период существования цивилизации. Всего в результате
промышленной деятельности от всех антропогенных источников в биосферу по-
ступило около 20 млн т свинца, 14 млн т цинка, более 2 млн т меди и т. д.
Масштабы выбросов соединений кадмия, цинка, меди и других тяжелых металлов всеми
вулканами нашей планеты далеко уступают их количеству, поступающему только от
мусоросжигательных заводов. При этом следует отметить, что антропогенные
источники выделения тяжелых металлов распределены очень неравномерно и
сконцентрированы преимущественно в густонаселенных промышленных регионах.
Особую опасность вызывает непрерывное повышение регионального и глобального
фона - средней концентрации (например, меди, свинца, цинка) в почве, воде и
воздухе, сложившейся в регионе. Проанализировав состав льдов Гренландии и
Антарктиды, ученые установили, что содержание свинца, цинка и серы во льдах,
образовавшихся в 1970 г., в три раза выше, чем в пробах льда, соответствующих
1200-му и 1900-му годам, в которых оно примерно одинаково. Значит, за 700 лет
фон по этим элементам практически не изменился, в то время как за 70 лет ХХ
века он увеличился втрое. Повышенное внимание к тяжелым металлам уделяется
потому, что по общетоксическому воздействию на живые организмы они уже вышли на
первое место, далеко опередив радиоактивные вещества и пестициды, и вызывают
целый букет тягчайших человеческих недугов: сердечно - сосудистые заболевания,
умственную неполноценность, рак и другие болезни.
Научно-техническая революция и
связанный с ней интенсивный рост химического производства, вызывает
существенные негативные изменения в окружающей среде. Например, отравление
пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В
результате мир оказался в тисках экологического кризиса. Вредные выбросы
сернокислых заводов следует оценивать не только по действию содержащегося в них
оксида серы на расположенные вблизи предприятия зоны, но и учитывать другие
факторы - увеличение количества случаев респираторных заболеваний человека и
животных, гибель растительности и подавление ее роста, разрушение конструкций
из известняка и мрамора, повышение коррозионного износа металлов. По вине
кислых дождей повреждены памятники архитектуры (Тадж-Макал).
В зоне до 300 км от источника
загрязнения (SO2) опасность представляет серная кислота, в зоне до 600 км -
сульфаты. Серная кислота и сульфаты замедляют рост с/х культур. Закисление
водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб. Помимо
экологического ущерба налицо экономический ущерб - громадные суммы каждый год
теряются при раскисление почв.
Рассмотрим химические метода
отчистки от наиболее распространенных газообразных загрязняющих воздух веществ.
Известно более 60 методов. Наиболее перспективны методы, основанные на
поглощение оксида серы известняком, раствором сульфита - гидросульфита аммония
и щелочным раствором алюмината натрия. Интерес также представляют
каталитические методы окисления оксида серы в присутствии оксида ванадия.
Особое значение имеет очистка газов
от фторсодержащих примесей, которые даже в незначительной концентрации вредно
влияют на растительность. Если в газах содержится фтороводород и фтор, то их
пропускают через колоны с насадкой противотоком по отношению к 5-10 % раствору
гидроксида натрия. В течении одной минуты протекают следующие реакции:
+ 2NaOH → O2 + H2O + 2NaF +
NaOH → NaF + H2O.
Образующийся фторид натрия
обрабатывают для регенерации гидроксида натрия:
NaF + CaO +
H2O → CaF2 + 2NaOH.
Заключение
серная кислота колчедан
В курсовой работе рассмотрены теоретические
аспекты производства серной кислоты из серного колчедана, произведен расчет
материального и теплового баланса. Описаны технологические схемы и процессы
протекающие на каждой стадии. В производстве H2SO4 соблюдены основные
направления развития химической промышленности: технология малоотходная -
переход сырья в целевой продукт достигает 99.9%; энергосберегающее, так как
процесс обеспечивает свое энергосбережение. Эта химическая технология обладает
рядом функций: рациональное использование сырья и энергии; масштабность и
дешевизна. Поскольку процесс непрерывен, он обладает рядом достоинств: большое
количество продукта с 1 -го объема аппарата; высокая интенсивность процесса;
исключение потерь тепла из-за термодинамичности - нагрев-охлаждение; легкость
автоматизации технологического процесса. Такой процесс учитывает основные
принципы химической технологии: наибольшая интенсивность процесса; наилучшее
использование сырья; наибольшее использование сырья. Произведен и рассчитан
материальный баланс процесса получения серной кислоты. Произведен и рассчитан
тепловой баланс процесса получения серной кислоты. рассчитан основной аппарат
процесса получения серной кислоты.
Список использованных источников
1
Кутепов, А. М. Общая техническая технология [Текст] : учебник для техн. вузов /
А. М. Кутепов, Т. И. Бондарева, М. Г. Беренгартен. - М. : Академкнига, 2007. -
528 с.
Родионов,
А. И. Защита биосферы от промышленных выбросов. Основы проектирования
технологических процессов [Текст] / А. И. Родионов, Ю. П. Кузнецов, Г. С.
Соловьёв. - М. : Химия, КолосС, 2007. - 392 с.
Филимонова,
О. Н. Технологические расчёты производственных процессов [Текст] : учеб.
Пособие / О. Н. Филимонова, М. В. Енютина. - Воронеж : ВГУИТ, 2012. - 116 с.