Принципы работы химических источников тока
Оглавление
Введение
. История открытия аккумуляторов
. Принцип работы аккумуляторной
батареи
. Конструкция аккумуляторной батареи
. Современная классификация
аккумуляторов
.1 Свинцово-кислотные аккумуляторы
(SLA)
.2 Никель-кадмиевые
аккумуляторы (NiCd)
.3 Никель-металлгидридные
аккумуляторы (NiMH)
.4 Литий-ионные аккумуляторы
(Li-Ion)
Заключение
Источники и литература
Введение
Химические источники тока - это устройство, в
котором химическая энергия активных веществ при протекании
окислительно-восстановительных процессов превращается непосредственно в
электрическую энергию. Химические источники тока подразделяются на первичные
источники, или элементы, и вторичные, или электрические аккумуляторы.
Элементы могут использоваться до тех пор, пока в
них есть запас активных веществ, обеспечивающих образование электрической
энергии. При полном израсходовании этих веществ элементы становятся
непригодными для дальнейшего использования.
Аккумуляторы могут служить непосредственно
долгое время. При использовании активных веществ при разряде. Эти вещества
могут вновь образовываться при пропускании через аккумулятор в обратном
направлении постоянного электрического тока от другого источника. Такой процесс
регенерации израсходованных активных веществ называется процессом заряда
аккумулятора.
Области применения аккумуляторов постоянно
расширяются вместе с развитием новой техники и новых технологий. Они
применяются в различных областях народного хозяйства, военной промышленности,
авиации, железнодорожном и автомобильном транспорте, многочисленных электронный
устройств, в ракетной технике и быту[6].
1. История открытия аккумуляторов
Первый химический источник тока был изобретён
итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта -
сосуд с солёной водой с опущенными в него цинковой и медной пластинками,
соединенных проволокой. Затем учёный собрал батарею из этих элементов, которая
в последствии была названа Вольтовым столбом. Это изобретение использовали
другие учёные в своих исследованиях. Так, например, в 1802 году русский
академик В.В. Петров сконструировал Вольтов столб из 2100 элементов для
получения электрической дуги. В 1836 году английский химик Джон Дэниель
усовершенствовал элемент Вольта, поместив цинковый и медный в раствор серной
кислоты. Эта конструкция стала называется "элементом Даниэля" [1].
В 1854 году немецкий военный врач Вильгельм
Зинстеден наблюдал следующий эффект: при пропускании тока через свинцовые
электроды, погруженные в разведенную серную кислоту, положительный электрод
покрывался двуокисью свинца PbO2, в то время как отрицательный электрод не
подвергался никаким изменениям. Если такой элемент замыкали потом накоротко,
прекратив пропускание через него тока от постоянного источника, то в нем
появлялся постоянный ток, который обнаруживался до тех пор, пока вся двуокись
свинца не растворялась в кислоте. Таким образом, Зинстеден вплотную приблизился
к созданию аккумулятора, однако он не сделал никаких практических выводов из
своего наблюдения.
Только пять лет спустя, в 1859 году, французский
инженер Гастон Планте случайно сделал то же самое открытие и построил первый в
истории свинцовый аккумулятор. Этим было положено начало аккумуляторной
техники.
Аккумулятор Планте состоял из двух одинаковых
свинцовых пластин, навитых на деревянный цилиндр. Друг от друга они отделялись
тканевой прокладкой. Устроенный таким образом прибор помещали в сосуд с
подкисленной водой и соединяли с электрической батареей. Спустя несколько
часов, отключив батарею, можно было снимать с аккумулятора достаточно сильный
ток, который сохранял в течение некоторого времени свое постоянное значение.
Существенным недостатком аккумулятора Планте
была его небольшая емкость - он слишком быстро разряжался. Вскоре Планте
заметил, что емкость можно увеличить специальной подготовкой поверхности
свинцовых пластин, которые должны быть по возможности более пористыми. Чтобы
добиться этого, Планте разряжал заряженный аккумулятор, а затем опять пропускал
через него ток, но в противоположном направлении. Этот процесс формовки пластин
повторялся многократно в течение приблизительно 500 часов и имел целью
увеличить на обеих пластинах слой окиси свинца.
До тех пор, пока не была изобретена
динамо-машина, аккумуляторы представляли для электротехников мало интереса, но
когда появилась возможность легко и быстро заряжать их с помощью генератора,
аккумуляторы получили широчайшее распространение.
В 1882 году Камилл Фор значительно
усовершенствовал технику изготовления аккумуляторных пластин. В аккумуляторе
Фора формирование пластин происходило гораздо быстрее. Суть усовершенствования
Фора заключалась в том, что он придумал покрывать каждую пластину суриком или
другим окислом свинца. При заряжении слой этого вещества на одной из пластин
превращался в перекись, тогда как на другой пластине вследствие реакции
получалась низкая степень окисла. Во время этих процессов на обеих пластинах
образовывался слой окислов с пористым строением, что способствовало скоплению
выделяющихся газов на электродах.
В начале XX века усовершенствованием
аккумулятора занялся Томас Эдисон, который хотел сделать его более
приспособленным для нужд транспорта. В результате были созданы
железно-никелевые аккумуляторы с электролитом в виде едкого калия, т.н.
щелочные аккумуляторы. В 1903 году начинается производство новых портативных
аккумуляторов, которые получили широкое распространение в транспорте, на
электростанциях и в небольших судах.
Сначала корпуса аккумуляторов были деревянными,
потом эбонитовыми. Аккумуляторные батареи формировались из нескольких
элементов, каждый из которых имел рабочее напряжение около 2,2 вольт. Для
шестивольтовых аккумуляторов в одном корпусе последовательно соединялись три
элемента, для 12-вольтовых - шесть, для 24-вольтовых - двенадцать.
Для легковых автомобилей 6-вольтовая
электросистема была общепринятой почти полвека, и только в 50-х годах произошел
массовый переход на 12 вольт. Эбонитовые корпуса батарей с торчащими наружу или
залитыми мастикой перемычками между элементами постепенно уступили место более
легким и прочным полипропиленовым. Пионером в применении синтетических
материалов для корпусов аккумуляторов выступила в 1941 году австрийская фирма
Baren, а полипропилен начала использовать американская фирма Johnson Controls в
середине 60-х. В конструкции свинцово-кислотных аккумуляторов произошли и
другие изменения, повлиявшие на их параметры и срок службы[2].
2. Принцип
работы аккумуляторной батареи
В настоящее время выпускаются следующие типы
электрических аккумуляторов: свинцово-кислотные, щелочные железо-никелевые,
кадмий-никелевые и серебряно-цинковые аккумуляторы. Наиболее массовыми типами
аккумуляторов являются свинцово-кислотные автомобильные батареи и тяговые
щелочные железо-никелевые аккумуляторы. Серебряно-цинковые аккумуляторы находят
ограниченное применение из-за дороговизны и дефицитности исходных материалов и
сравнительно малого срока службы.
Кислотные аккумуляторы представляют собой сосуд,
заполненный электролитом соответствующей плотности, т. е. раствором серной
кислоты H2SO4 в дистиллированной воде, в который погружен
блок пластин из чистого свинца Рb
и блок пластин из перекиси свинца РbО2.
Вследствие постоянно происходящей диссоциации молекул кислоты в электролите
заряженного аккумулятора имеются ионы водорода Н2 (катионы) и ионы
кислотного остатка SO4 (анионы). Если пластины аккумулятора замкнуть
на некоторое сопротивление, то через него потечет ток. Отрицательно заряженные
ионы SO4 будут стремиться к пластинам из чистого свинца, заряженным
положительно. Ионы водорода, имеющие положительный заряд, будут стремиться к
отрицательным пластинам, содержащим двуокись свинца. Пластины из свинца принято
называть отрицательными, а из двуокиси свинца положительными. При разрядке
кислотного аккумулятора происходят следующие химические реакции:
у отрицательной пластины Pb
+ SO4 = PbSO4;
у положительной пластины РbО2
+ H2+H2SO4=PbSO4+2H2O.
Из рассмотренных химических реакций видно, что
при разрядке кислотных аккумуляторов на всех пластинах выделяется сернокислый
свинец PbSO4 и уменьшается концентрация электролита (вследствие
диссоциации кислоты и выделения воды). Сернокислый свинец обладает двумя
недостатками. Во-первых, при интенсивном образовании сернокислого свинца
возможно коробление или выпучивание пластин, а также "высыпание" из
пластин активной массы, так как объем сернокислого свинца больше объема
исходных продуктов, из которых он образуется. Во-вторых, сернокислый свинец по
истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть
пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом,
не участвует в химических реакциях. Вследствие этого снижается полезная емкость
аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов.
Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует
хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов.
При коротком замыкании в результате бурной химической реакции и интенсивного
выделения сернокислого свинца происходит коробление пластин кислотного
аккумулятора. Зарядка аккумуляторов производится от внешнего источника
электроэнергии, генератора постоянного тока или выпрямителя. При зарядке к
отрицательным пластинам направляются ионы водорода, а к положительным - ионы
кислотного остатка. В результате возникают следующие химические реакции:
у отрицательной пластины PbSO4
+ H2 = Pb + H2SO4;
у положительной пластины PbSО4+2Н2О
+ SO4 = РbO2
+ 2Н2 + 2H2SO4.
Следовательно, при зарядке аккумуляторов
происходит разложение сернокислого свинца на исходные продукты, а также
восстановление концентрации электролита. Очевидно, что окончанием зарядки
аккумуляторов можно считать такой момент, когда весь сернокислый свинец
разложился и концентрация электролита восстановилась до нормальной. При
дальнейшей зарядке потребляемая аккумулятором электрическая энергия будет расходоваться
на разложение воды, имеющейся в электролите. Вода разлагается на водород и
кислород. Кислород, как наиболее активный газ, производит окисление металлов,
имеющихся в аккумуляторе. Водород выделяется в атмосферу. Поэтому на
поверхности электролита появляются пузырьки, создающие впечатление
"кипения" электролита. В смеси с воздухом водород образует взрывчатый
гремучий газ, который должен быть немедленно удален из аккумуляторного
помещения. ЭДС не включенного на разрядку кислотного аккумулятора, принимается
в среднем равной 2,1 В независимо от размеров аккумулятора. Напряжение,
создаваемое аккумулятором на зажимах, определяется уравнениями:
при разрядке U = E-IPr;
при зарядке U=E+Iзар r,
где Е - ЭДС аккумулятора; Ip, Iзар -
соответственно ток разрядки и зарядки аккумулятора; r - внутреннее
сопротивление аккумулятора.
Кислотные аккумуляторы имеют небольшое
внутреннее сопротивление, поэтому напряжение на зажимах аккумулятора
незначительно снижается даже при больших токах нагрузки. В среднем
сопротивление кислотного аккумулятора составляет 0,005 Ом и является величиной,
зависящей от плотности электролита, а также от габаритов аккумуляторов (чем
больше габариты, тем меньше сопротивление). С уменьшением плотности
электролита, т. е. с увеличением степени разряда, ЭДС кислотных аккумуляторов
уменьшается, а внутреннее сопротивление увеличивается. Вследствие этого
напряжение аккумулятора в начале разрядки понижается незначительно, а к концу
падает быстро. В настоящее время применяются в основном две разновидности щелочных
аккумуляторов: кадмиево-никелевые и железо-никелевые. Электролитом их является
раствор едкого калия КОН в дистиллированной воде (плотность электролита 1,19
1,21). В качестве активной массы положительных пластин служит гидрат окиси
никеля Ni(OH)3, а активной массы отрицательных - губчатый кадмий Cd.
При разрядке аккумулятора анионы щелочного остатка ОН стремятся к пластинам из
чистого кадмия. Избыточные электроны кислотного остатка направляются во внешнюю
цепь и к пластинам из гидрата окиси никеля, где они нейтрализуются катионами
калия. Таким путем создается разрядный ток аккумулятора. При разрядке щелочного
аккумулятора происходят следующие химические реакции:
у отрицательной пластины Cd + 2OH
= Cd(OH)2;
у положительной пластины Ni (ОН)3 + К
= Ni(OH) + КОН.
Из данных реакций видно, что при разрядке
щелочного аккумулятора кадмий переходит в гидроокись кадмия Cd(OH)2,
а трехатомный гидрат окиси никеля Ni(OH)3 - в двухатомную гидроокись никеля
Ni(ОН)2. Эти вещества не обладают отрицательными свойствами, поэтому
щелочные аккумуляторы не требуют тщательного ухода в эксплуатации, могут быть
длительно незаряженными, мало разрушаются при коротки замыканиях. При зарядке
щелочных аккумуляторов катионы калия движутся к отрицательным пластинам, а
анионы щелочного остатка - к положительным. При зарядке происходят следующие
химические реакции:
у отрицательной пластины Cd(OH)2 + 2K
= 2KOH+Cd;
у положительной пластины Ni(OH)2 + OH
= Ni(OH)3.
При разрядке, и при зарядке щелочных
аккумуляторов плотность электролита остается постоянной, так как диссоциация
едкого калия на ионы К и ОН компенсируется образованием КОН. После переработки
всех веществ, участвующих в химических реакциях, при зарядке щелочных
аккумуляторов происходит разложение воды электролита и "кипение"
аккумулятора[3].
3. Конструкция аккумуляторной
батареи
аккумулятор батарея ток кислотный
Основы традиционного исполнения батарей
сформировались уже в начале 20-го века и постепенно трансформировались до
современного состояния по мере появления новых конструкционных материалов, но
их эксплуатационные недостатки при этом сохранились.
В России батареи традиционного исполнения
выпускают как в моноблоках с отдельными крышками, герметизируемыми битумной
смазкой, так и в моноблоках с общей крышкой, герметизируемой контактно-тепловой
сваркой.
Аккумуляторные батареи с отдельными крышками
(рис. 3.1) собирают в одном многоячеечном корпусе - моноблоке, выполненном из
эбонита или другой кислотостойкой пластмассы, разделенном перегородками на
отдельные камеры-ячейки (банки), по числу аккумуляторов в батарее. В каждую из
ячеек помещен блок, состоящий из чередующихся положительных и отрицательных
электродов, разделенных сепараторами. Он представляет собой отдельный
аккумулятор напряжением 2 В. Пространство между дном моноблока и верхними
кромками фиксирующих электроды опорных призм служит для накаливания шлама -
осадка, образующегося в процессе эксплуатации вследствие оплывания частиц
активной массы положительных электродов. Когда объем шламового пространства
заполняется, происходит замыкание нижних кромок разноименных электродов и
аккумулятор теряет работоспособность.
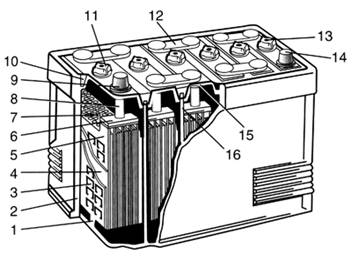
Рисунок 3.1 - Аккумуляторная батарея с
отдельными крышками: 1- опорные призмы; 2- моноблок; 3- отрицательный электрод;
4- сепаратор; 5- положительный электрод; 6- межэлементные соединения; 7- щиток;
8- борн; 9- положительный вывод; 11- пробка; 13- вентиляционное отверстие; 14-
отрицательный вывод; 15- крышка; 16- перегородки
Электроды состоят из активной массы, нанесенной
на токоотвод решетчатой конструкции - решетку. Сепараторы разделяют участвующие
в электрохимических превращениях реагенты, а также обеспечивают возможность
диффузии электролита от одного электрода к другому. Сторона сепаратора,
обращенная к положительному электроду для облегчения доступа электролита к
поверхности активной массы, выполнена ребристой.
Борн, который служит наружным токоотводом
аккумулятора, последовательно соединяет соседние аккумуляторы между собой в
батарею. К выводным борнам крайних аккумуляторов батареи привариваются полюсные
выводы и, служащие для соединения батареи с внешней электрической цепью.
Положительный и отрицательный выводы имеют разный диаметр, что позволяет
исключить возможность переполюсовки при подключении АКБ к бортовой цепи
автомобиля.
В верхней части электродного блока устанавливают
щиток, предохраняющий верхние кромки сепараторов от повреждения при замерах
уровня и плотности электролита.
Каждый аккумулятор после установки электродного
блока в камеру-ячейку моноблока закрывают сверху отдельной пластмассовой или
эбонитовой крышкой. В ней выполняют по два отверстия с втулками для выводных
борнов электродного блока. Между ними расположено резьбовое отверстие для
заливки электролита и периодического обслуживания аккумулятора в процессе
эксплуатации. После заливки электролита резьбовое отверстие закрывают пробкой
из полиэтилена, имеющей небольшое вентиляционное отверстие, предназначенное для
выхода газов при эксплуатации.
Для герметичной укупорки новых сухозаряженных
батарей в верхней части пробки над вентиляционным отверстием выполнен глухой
прилив. Для обеспечения нормальной эксплуатации этот прилив, после заливки
электролита в батарею, необходимо срезать.
Благодаря специфическим свойствам
термопластичной пластмассы появились аккумуляторные батареи с общей крышкой в
моноблоке из сополимера пропилена с этиленом, устройство которых показано на
рис. 3.2
В моноблоке установлены электродные блоки,
состоящие из разноименных электродов и, разделенных сепараторами. Эти блоки
соединены между собой при помощи укороченных межэлементных соединений через
отверстия в перегородках моноблока. Крышка сделана единой на все шесть
аккумуляторов батареи. Свойства термопластичной пластмассы позволили применить
для герметизации АКБ с общей крышкой метод контактно-тепловой сварки,
обеспечивающий сохранение герметичности как по периметру, так и между
отдельными аккумуляторами в широком диапазоне температур (от −50°C до
70°C).
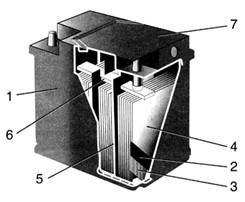
Рисунок 3.2- Аккумуляторная батарея с общей
крышкой: 1-моноблок; 2-отрицательный электрод; 3-положительный электрод; 4-
сепаратор; 5-перегородка; 6-межэлементные соединения; 7-крышка
Недостатки традиционных свинцовых батарей
обусловлены тем, что содержащаяся в сплаве положительных токоотводов сурьма
постепенно, по мере их коррозии, через раствор переходит на поверхность
отрицательного электрода. Осаждение большого количества сурьмы на поверхности
отрицательной активной массы снижает напряжение на электродах батареи, при
котором начинается разложение воды на водород и кислород. Поэтому, в конце
зарядного процесса и при небольшом перезаряде, происходит бурное газовыделение,
сопровождающееся "кипением" электролита вследствие электролитического
разложения входящей в него воды.
За последние 20-25 лет, по мере развития
технологии и совершенствования оборудования, появилось несколько разновидностей
батарей так называемого "необслуживаемого" исполнения. Их основная
отличительная особенность - использование сплавов с пониженным содержанием сурьмы
или вовсе без нее для производства токоотводов.
Усовершенствование конструкции при создании
необслуживаемых АКБ заключается еще и в том, что для увеличения запаса
электролита без изменения высоты батареи, один из аккумуляторных электродов
помещают в сепаратор-конверт, который изготовлен из микропористого
полиэтиленового материала с низким электросопротивлением. В этом случае
замыкание электродов различной полярности, при отсутствии сбоев в работе
сборочного оборудования, практически исключено. Поэтому опорные призмы
становятся ненужными, и блок электродов можно установить прямо на дно ячейки
моноблока. В результате та часть электролита, которая раньше находилась в
шламовом пространстве между призмами и не принимала участия в работе
аккумулятора, теперь находится над электродами и пополняет его запас,
расходуемый при эксплуатации батареи.
Первоначально такие батареи начали выпускать в
США на базе свинцово-кальциевого сплава (0,07-0,1% Ca; 0,1-0,12% Sn; остальное
- Pb) для токоотводов, положительного и отрицательного электродов. Это снизило
газовыделение, что обеспечило эксплуатацию АКБ без доливки воды в течение как
минимум двух лет. Расход воды у этих батарей так мал, что конструкторы убрали
из крышек отверстия для доливки воды и сделали батареи полностью необслуживаемыми.
При этом самозаряд батарей замедлился более чем в 6 раз. Однако, при нескольких
глубоких разрядах такие АКБ быстро теряют емкость и их стартерные
характеристики резко снижаются, из-за чего они не нашли широкого
распространения в Европе и России.
В это же время в США появились батареи системы
"кальций плюс" (гибридные) с содержанием до 1,5-1,8% сурьмы и
1,4-1,6% кадмия в положительном токоотводе и свинцово-кальциевым отрицательным
токоотводом. Характеристики этих батарей по расходу воды и саморазряду вдвое
лучше, чем у малосурьмяных, но все еще не такие хорошие, как у
свинцово-кальциевых.
К началу 80-х годов производство необслуживаемых
батарей стало быстро развиваться в странах Европы. Но там пошли по пути
применения сплавов с пониженным до 2,5-3,0% содержанием сурьмы. Однако, у таких
АКБ расход воды и саморазряд в 2-3 раза выше, чем у батарей с кальциевыми
токоотводами. Позже и в Европе появились так называемые гибридные батареи.
Наконец, в конце 90-х годов и в США, и в
Западной Европе началось производство батарей с токоотводами из
свинцово-кальциевого сплава с добавкой новых легирующих компонентов, в том
числе серебра, которые не боятся глубоких разрядов.
Следует отметить, что эксплуатация батарей без
отверстий для доливки воды требует более точной работы системы энергосбережения
автомобиля, а также более внимательного отношения автовладельцев к состоянию и
исправной работе электрооборудования. В первую очередь это касается натяжения
ремня привода генератора и исправности самого генератора, а также регулятора
напряжения. Отрицательно сказывается на состоянии батарей последнего поколения
и наличие утечек тока в системе электрооборудования или сигнализацию.
Подавляющее большинство АКБ, поступающих в
Россию из стран Европы, выпускают, как правило, в гибридном исполнении, либо с
токоотводами обеих полярностей из свинцово-кальциевых сплавов. При изготовлении
сухозаряженных батарей многие производители применяют для электродов обеих
полярностей малосурьмяные сплавы с содержание сурьмы 1,6-1,8% [4].
4. Современная классификация
аккумуляторов
Аккумуляторные батареи используются в автономных
источниках энергии в самых различных областях. Требования, предъявляемые к этим
устройствам, тоже различаются весьма значительно. При выборе конкретного типа
аккумулятора с потребительской точки зрения во внимание принимаются следующие
характеристики:
· рабочее напряжение;
· планируемый режим разряда
(постоянный или импульсный разряд);
· максимальный ток разряда;
· температурный режим при разрядке;
· допустимый режим зарядки
(стандартный, ускоренный, быстрый или режим постоянной подзарядки, называемый
также буферным);
· масса и габаритные характеристики;
· срок службы.
К тому же в случае, если заряженные батареи
некоторое время хранятся без использования, необходимо обращать внимание на
скорость их саморазряда.
В зависимости от электрохимической технологии
можно выделить следующие основные типы современных источников тока:
· герметизированные свинцово-кислотные
(SLA);
· никель-кадмиевые (NiCd);
· никель-металлгидридные (NiMH);
· литий-ионные (Li-Ion);
· литий-полимерные (Li-Pol).
К редким типам аккумуляторов можно отнести:
· никель-цинковые;
· серебряно-цинковые;
· серебряно-кадмиевые;
· топливные.
Чтобы удовлетворить разнообразные потребности
пользователей, аккумуляторы независимо от применяемой технологии традиционно
выпускают в различных конструктивных вариантах (формфакторах), с различной
емкостью и номинальным напряжением. Кроме того, они могут иметь специфические
свойства для обеспечения наилучших характеристик в особых режимах и условиях
эксплуатации.
.1 Свинцово-кислотные аккумуляторы
(SLA)
Для обозначения таких аккумуляторов применяется
аббревиатура SLA (Sealed Lead Acid - герметизированные свинцово-кислотные). Это
старейшие перезаряжаемые аккумуляторы, предназначенные для коммерческого
использования, причем они до сих пор остаются наиболее дешевыми автономными
источниками энергии. Видимо, самым существенным недостатком, присущим
свинцово-кислотным элементам, является выделение газов - кислорода и водорода.
Предотвратить его можно только путем уменьшения напряжения при зарядке, однако
при подзарядке это приводит к тому, что аккумулятор не заряжается полностью до
номинального напряжения. Так что проблема до сих пор не решена. Вместе с тем
способность удерживать номинальную силу тока при низком напряжении, небольшая
цена по сравнению с затратами на обслуживание батарей этого типа и отсутствие
сбоев питания при их использовании вполне оправдывают установку
свинцово-кислотных аккумуляторов большой емкости.
Сегодня SLA-аккумуляторы применяются в основном
там, где требуется большая мощность при низкой стоимости устройств, а их вес и
габаритные характеристики несущественны (например, в блоках бесперебойного
питания, охранных системах, системах резервного освещения). В портативных
приборах используются герметичные (необслуживаемые) аккумуляторы или
аккумуляторы с регулирующим клапаном давления. Подобными SLA-устройствами
иногда комплектуются переносные сотовые телефоны большой мощности и некоторые
видеокамеры, но в целом их применение для портативных систем нехарактерно.
Появились необслуживаемые и малообслуживаемые аккумуляторы, основанные на
внутренней рекомбинации газа, а также различные герметизированные аккумуляторы
(правильно говорить "герметизированные", а не
"герметичные"). Из особенностей современных свинцово-кислотных
аккумуляторов следует отметить:
• зарядка от простейших зарядных устройств;
• улучшение работы в буферном режиме, то есть в
режиме постоянного подзаряда - срок службы доведен уже до 25 лет;
• значительное увеличение ресурса - количество
циклов зарядки-разрядки составляет уже 600-800, а не 200-300, как раньше;
• сведение к минимуму величины саморазряда -
0,1% в день;
• появление множества типоразмеров и введение их
единой стандартизации.
В отличие от обычных свинцово-кислотных
аккумуляторов, в частности автомобильных, SLA-аккумуляторы для электроники
разрабатываются с низким потенциалом перезарядки с целью предотвращения
выделения газа. Поэтому SLA-аккумулятор имеет длительный срок хранения, но
никогда не заряжается до своей полной емкости, а следовательно, по сравнению с
другими типами заряжаемых батарей имеет самую низкую плотность энергии
(удельную энергоемкость), которая выражается в количестве запасенной энергии к
единице веса или объема. Вследствие низкого саморазряда, отсутствия эффекта
памяти и минимальных требований по обслуживанию такие батареи в некоторых
областях до сих пор остаются весьма выгодным решением. Так, если
NiCd-аккумуляторы за три месяца саморазряжаются на 40%, то SLA-аккумуляторам
для подобной саморазрядки понадобится не менее года.
Разновидностью SLA-устройств являются так
называемые гелевые аккумуляторы (некоторые из них продаются под торговой маркой
gelcell), основанные на технологии Gelled Electrolite (GEL), которая была
разработана в конце 50-х годов и предусматривает добавление в электролит
двуокиси кремния (SiO2), в результате чего через несколько часов после
заполнения электролит приобретает консистенцию желе. В толще желеобразного
электролита образуются поры и раковины, имеющие значительные объем и площадь
поверхности, где происходит рекомбинация молекул кислорода и водорода с
выделением воды. В результате количество электролита остается неизменным, и в
течение всего срока службы аккумулятора долив воды не требуется.
Кроме GEL-технологии, применяется технология
Absorptive Glass Mat (AGM), разработанная в конце 70-х годов и предполагающая
использование пористого заполнителя из стекловолокна, пропитанного жидким
электролитом. Микропоры этого материала заполнены электролитом не полностью, и
в этом свободном пространстве происходит рекомбинация газов, что позволяет
производить необслуживаемые батареи, как и по GEL-технологии.
У свинцово-кислотных аккумуляторов, естественно,
имеются и недостатки. Например, они не могут быстро заряжаться (зарядный ток, в
зависимости от конструкции, не должен превышать 0,1-0,3 Сн, а типовое время
зарядки - не менее 8-16 ч) и не переносят глубокого разряда. К тому же хранение
SLA-аккумулятора в разряженном состоянии вызывает сульфатацию, которая делает
последующую зарядку трудной или вообще невозможной, вследствие чего стандартные
свинцово-кислотные аккумуляторы выдерживают относительно небольшое число циклов
зарядки-разрядки. Так, в зависимости от глубины разрядки и температуры
эксплуатации, типичный SLA-аккумулятор выдерживает лишь 300-500 циклов
зарядки-разрядки. фактически каждый такой цикл отнимает у аккумулятора некоторую
часть емкости. Конечно, это верно и для аккумуляторов других электрохимических
систем, но в меньшей степени. Впрочем, у некоторых современных
SLA-аккумуляторов, как уже отмечалось, количество циклов зарядки-разрядки
доведено до 600-800, что сравнимо с NiMH-технологией.
К тому же при низких температурах у
SLA-аккумуляторов значительно уменьшается способность отдавать большой ток в
нагрузку. Зависимость нелинейная, но для каждого элемента наблюдается падение
напряжения на 2-5 мВ на один градус.
Что касается утилизации вышедших из строя
батарей, то из-за высокого содержания свинца SLA-аккумуляторы по нанесению
экологического вреда уступают только NiCd-аккумуляторам.
.2 Никель-кадмиевые аккумуляторы
(NiCd)
Основное преимущество никель-кадмиевых элементов
по сравнению со свинцово-кислотными заключается в том, что они почти не
выделяют газа и отличаются простотой в обслуживании. При этом у них очень
низкое внутреннее сопротивление и они способны отдавать большой ток в
относительно короткие промежутки времени - практически так же, как и
свинцово-кислотные. NiCd-аккумуляторы переносят даже короткое замыкание. Кроме
того, эти устройства могут выдерживать длительные нагрузки, причем их
функциональные свойства мало изменяются при понижении температуры.устройства, несмотря
на то, что они уступают по емкости (при тех же массе и габаритах) аккумуляторам
других типов, остаются наиболее популярными для применения в целом ряду
портативных устройств, особенно там, где требуется высокая отдача. Поэтому до
сих пор около половины выпускаемых аккумуляторов для переносного оборудования -
никель-кадмиевые. Появление новых технологий электрохимических аккумуляторов
сначала привело к резкому сокращению использования NiCd-аккумуляторов, однако
по мере выявления недостатков новых моделей интерес к NiCd-устройствам снова
возрос. Так, в приборах, где применяются электродвигатели и потребляются
довольно большие токи, NiCd-батареям трудно найти замену. Однако максимальная
емкость потребительских NiCd-аккумуляторов не превышает 3000 мА·ч. Типовые
разрядные токи, на которых используются подобные аккумуляторы, невысоки - 20-40
А. При токах до 70 А NiCd-батареи и ныне остаются вне конкуренции.
В числе преимуществ NiCd-аккумуляторов можно
назвать следующие:
· работоспособность в широком интервале
рабочих токов заряда, разряда и температур окружающей среды (допустимый ток
разряда составляет 0,2-2 Сн, диапазон рабочих температур от "минус"
40 до "плюс" 50 °С);
· высокая нагрузочная способность даже
при низких температурах (NiCd-аккумулятор при низких температурах даже можно
перезаряжать);
· возможность быстрой и простой
зарядки в любом режиме (NiCd-аккумуляторы нетребовательны к типу зарядного
устройства);
· большое количество циклов
зарядки-разрядки (при правильном обслуживании NiCd-аккумулятор выдерживает
свыше 1000 циклов);
· возможность восстановления после
понижения емкости или длительного хранения;
· пожаро- и взрывобезопасность,
устойчивость к механическим нагрузкам;
· низкая цена, длительный срок службы
и широкая доступность, большой ассортимент потребительских формфакторов.
Для зарядки NiCd-аккумуляторов быстрый режим
более предпочтителен, чем медленный, а импульсный заряд - чем заряд постоянного
тока. К тому же для восстановления никель-кадмиевых аккумуляторов можно
применять так называемый реверсивный заряд, когда импульсы разряда чередуются с
импульсами заряда. Реверсивный заряд даже ускоряет процесс, поскольку помогает
рекомбинации газов, выделяющихся во время заряда: дополнительные исследования
показали, что реверсивный заряд добавляет около 15% к сроку службы
NiCd-аккумулятора. Для увеличения отдачи этих аккумуляторов некоторые
пользователи практикуют быструю зарядку с дозарядкой слабыми токами, что
приводит к более полной зарядке батарей.
Однако, наряду с преимуществами, данные элементы
имеют серьезные недостатки. До недавнего времени у NiCd-аккумуляторов
наблюдался неприятный эффект, получивший название "эффект памяти".
Его возникновение объясняется тем, что в процессе циклической эксплуатации
источника меняется структура поверхности электродов, а в сепараторе
аккумулятора образуются химические соединения, мешающие его дальнейшей разрядке
малыми токами. Источник как бы запоминает свое состояние неполного разряда.
Чтобы избежать возникновения данного эффекта, необходимо после того, как NiCd-батарея
отработала, обязательно ее разрядить. Если этого не делать, то NiCd-аккумулятор
постепенно теряет эффективность, то есть его емкость постепенно уменьшается -
он очень быстро заряжается, но так же быстро и разряжается, имея при этом
пониженное напряжение на выходе. Вдобавок возможно и небольшое увеличение
внутреннего сопротивления.
Хранить NiCd-батареи необходимо в разряженном
состоянии. Если ваше зарядное устройство не имеет встроенного разрядника, то
для полного разряжения батареи можно воспользоваться лампочкой накаливания с
номинальным напряжением и с допустимым током 3-20 А. Необходимо подключить
такую лампу к аккумулятору и дождаться того момента, когда спираль начнет
краснеть (кстати, глубокая разрядка вовсе не означает, что аккумулятор следует
посадить "в ноль"). NiCd-батареи - это единственный тип
аккумуляторов, которые лучше выполняют свои функции в случае, если периодически
подвергаются полной разрядке. Электрохимические аккумуляторы всех остальных
разновидностей нуждаются в неглубокой разрядке. Впрочем, если выполнять
процедуру полного разряда слишком часто, то и NiCd-аккумуляторы неизбежно
изнашиваются.
Мировым лидером в производстве NiCd-элементов,
способных отдавать большие токи, является фирма Sanyo (по сравнению с моделями
других производителей, аккумуляторы Sanyo имеют меньшее внутреннее
сопротивление и большую отдачу, медленнее стареют и меньше греются).
Аналогичные NiCd-аккумуляторы производят фирмы Panasonic и Varta. Производители
непрерывно совершенствуют технологию никель-кадмиевых аккумуляторов, и в
современных NiCd-батареях от известных фирм эффект памяти почти не возникает.
Например, компания GP Batteries выпускает никель-кадмиевые аккумуляторы по
новой, пенной технологии. В этом случае дозаряд перед разрядом не требуется, а
ресурс батареи полностью используется по назначению. Благодаря этому не только
исключается эффект памяти, но и продлевается реальный срок службы
никель-кадмиевых устройств.
Очевидные недостатки NiCd-батарей -
необходимость периодической полной разрядки для сохранения эксплуатационных
свойств (устранения эффекта памяти), высокий саморазряд (до 10% в течение
первых суток после зарядки) и большие габариты при той же емкости по сравнению
с аккумуляторами других типов. Некоторые новые типы NiCd-элементов имеют высокую
емкость, близкую к емкости NiMH-батарей. Однако аккумуляторы высокой емкости не
могут обеспечивать такой же большой ток нагрузки, как стандартные
NiCd-аккумуляторы, а следовательно, лишаются одного из своих главных
преимуществ. Кроме того, в этом случае количество циклов зарядки-разрядки у них
несколько меньше, хотя все равно больше, чем у NiMH-аккумуляторов.
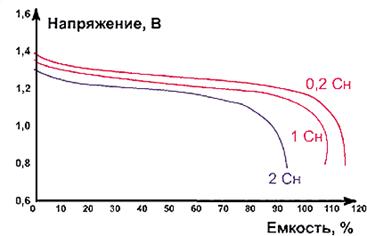
Рис. Разрядные характеристики NiCd-аккумуляторов
при различных токахразрядки при температуре окружающей среды 20 °С
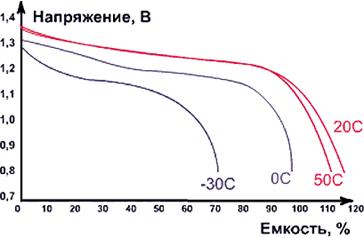
Рис. Разрядные характеристики NiCd-аккумуляторов
при различной температуре окружающей среды при токе разрядки 0,2 Сн
Следует особо отметить важность правильной
утилизации отработавших NiCd-элементов. Дело в том, что кадмий, содержащийся в
NiCd-аккумуляторах, по токсичности не уступает ртути. Поэтому во всех
цивилизованных странах имеются пункты приема таких батарей, а стоимость
переработки сразу включается в цену аккумуляторов. Более того, во многих
странах запрещено использовать NiCd-элементы, которые не включены в общую
программу утилизации, то есть на которых отсутствует специальная маркировка.
4.3 Никель-металлгидридные
аккумуляторы (NiMH)
Никель-металлгидридная технология развивалась
как альтернатива никель-кадмиевой - для преодоления вышеописанных недостатков.
Неэкологичный кадмиевый анод был заменен на анод на основе сплава,
абсорбирующего водород. Напряжение этих систем одинаковое, а изменение в
химическом составе позволило реализовать новый внутренний баланс элемента при
существенном увеличении плотности энергии. Новый катодный материал высокой
плотности на основе сферического гидрата закиси никеля с войлочной основой
позволил существенно улучшить характеристики NiMH-аккумуляторов. Кроме того,
NiMH-технология предусматривает возможность достижения более высокой удельной
емкости, чем по NiCd-технологии, что позволило никель-металлгидридным
аккумуляторам стать серьезными конкурентами никель-кадмиевых и вытеснить их из
целого ряда областей портативной техники, прежде всего из областей, где не
требуется высокий ток отдачи, а важнее время непрерывной работы.
Отличительные особенности современных
NiMH-аккумуляторов:
· высокая удельная энергия по массе и
объему (емкость в 1,5-2 раза больше, чем у стандартных NiCd-аккумуляторов тех
же габаритов);
· диапазон рабочих температур от
"минус"10 до "плюс"40 °С;
· меньшая склонность к эффекту памяти,
чем у NiCd-батарей (то есть периодических циклов восстановления практически не
требуется);
· устойчивость к длительному перезаряду
малыми токами;
· механическая прочность и
устойчивость к механическим нагрузкам;
· длительный срок службы и хранения (в
разряженном состоянии);
· меньшая токсичность при утилизации.
К сожалению, NiMH-аккумуляторы имеют ряд
недостатков и по некоторым параметрам уступают NiCd-батареям. Так, число циклов
зарядки-разрядки NiMH-аккумуляторов существенно меньше, чем никель-кадмиевых, -
гарантируется примерно 500 циклов, в то время как у NiCd-аккумуляторов оно
может доходить до 1000. К тому же для NiMH-аккумуляторов, в отличие от
NiCd-батарей, более предпочтителен поверхностный, а не глубокий разряд, а ведь
долговечность аккумуляторов непосредственно связана именно с глубиной разряда.
При быстрой зарядке NiMH-аккумулятора выделяется
значительно большее количество тепла, чем во время зарядки NiCd-батареи,
поэтому никель-металлгидридные аккумуляторы предъявляют к зарядным устройствам
повышенные требования - необходимы более сложные алгоритмы для обнаружения
момента полного заряда и контроль температуры (впрочем, большинство современных
NiMH-аккумуляторов оборудовано внутренним температурным датчиком для получения
дополнительного критерия обнаружения полного заряда). По той же причине
NiMH-аккумулятор не может заряжаться так же быстро, как никель-кадмиевый, - время
заряда NiMH-батареи такой же емкости обычно вдвое больше.
Кроме того, как для NiCd-, так и для
NiMH-аккумуляторов характерен высокий саморазряд. Однако если NiCd-батарея теряет
около 10% своей емкости в течение первых суток, после чего саморазряд
составляет примерно 10% в месяц, то саморазряд у NiMH-аккумуляторов примерно в
1,5-2 раза выше. Конечно, для некоторых типов NiMH-батарей применяются
гидридные материалы, улучшающие связывание водорода для уменьшения саморазряда,
но это обычно приводит к уменьшению емкости аккумулятора, то есть к потере
главного преимущества по сравнению с NiCd-технологией.
Диапазон рабочих температур у NiMH-аккумуляторов
также меньше, чем у NiCd-батарей. Так, если температура "минус" 20 °C
является пределом, при котором NiMH- и Li-ion-аккумуляторы прекращают
функционировать, то NiCd-батареи могут продолжать работать до температуры
"минус" 40°C.
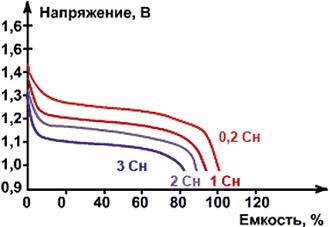
Рис. Разрядные характеристики NiMH-аккумуляторов
при различных токах разряда при температуре окружающей среды 20 °С
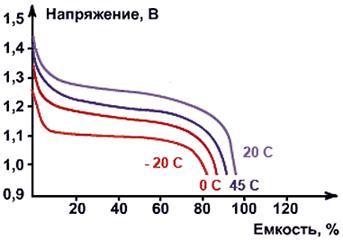
Рис. Разрядные характеристики NiMH-аккумуляторов
при токе разряда 1Сн при различной температуре окружающей среды
Наконец, цена NiMH-аккумуляторов приблизительно
на треть выше цены NiCd-батарей. Даже современные NiCd-аккумуляторы большой
емкости, которые дороже стандартных, по соотношению "емкость/цена"
все равно превосходят NiMH.
.4 Литий-ионные аккумуляторы
(Li-Ion)
Технологии непрерывно развиваются, и на смену
традиционно используемым никель-кадмиевым и никель-металлгидридным батареям
пришли литий-ионные. При примерно одинаковом весе одного элемента они имеют
большую емкость, чем рассмотренные выше аккумуляторы (превосходя
NiCd-аккумуляторы в 4-5, а NiMH в 3-4 раза), и дают более высокое напряжение на
одном элементе. Например, напряжение элемента наиболее распространенных
потребительских форматов у литий-ионных аккумуляторов составляет 3,6 В, что в
три раза больше, чем у NiCd- и NiMH-элементов. Следовательно, там, где прежде
требовались батареи из двух или трех элементов, теперь можно использовать
только один. Что касается количества рабочих циклов, то по этому параметру
литиевые элементы находятся между NiCd- и NiMH-аккумуляторами. Вообще говоря,
данных по реальному количеству рабочих циклов для литий-ионных аккумуляторов
пока еще очень мало, так что к приводимым производителями характеристикам
следует относиться критически. Однако технология изготовления Li-Ion-устройств
быстро совершенствуется, а вместе с этим увеличивается и срок службы батарей.
В литиевых батареях в качестве анода
используется металлический литий - один из химически активных металлов, самый
легкий, с наибольшим электрохимическим потенциалом, обеспечивающий самую
высокую плотность энергии. Благодаря этому теоретическая удельная емкость у
аккумуляторных батарей на основе лития максимальна, а источники тока на основе
лития обладают высоким разрядным напряжением. Однако химическая активность
лития очень осложняет технологические процессы изготовления и предъявляет
жесточайшие требования к герметичности источника тока, что в конечном счете
сказывается на себестоимости аккумуляторных батарей.
Долгое время вообще не удавалось получить
литий-ионные аккумуляторы для коммерческого использования, поскольку
производители не могли обеспечить надлежащего уровня безопасности при обращении
с ними. Если температура внутри аккумулятора достигнет температуры плавления
лития, то в результате бурного химического взаимодействия лития с электролитом
может произойти взрыв. Известно, что большое количество литиевых аккумуляторов,
поставленных в Японию в начале 1990-х годов, было возвращено производителям
после того, как после взрывов элементов питания в сотовых телефонах от ожогов
пострадало несколько человек. А последний скандал по поводу взрывов
литий-ионных аккумуляторов в мобильниках Nokia разгорелся совсем недавно, в
2003 году, когда ожоги получили более 20 человек. Nokia, конечно, утверждала,
что батареи во всех взрывоопасных телефонах были несанкционированно заменены на
произведенные сторонними фирмами, но независимые исследования показали, что и
некоторые фирменные батареи Nokia тоже не защищены от короткого замыкания и
взрыва.
Пытаясь создать безопасный источник тока на основе
лития, производители заменили неустойчивый при повышении температуры в процессе
зарядки-разрядки металлический литий на соединения лития с другими металлами в
оксидах. Сначала для создания литий-ионных аккумуляторов в качестве активного
материала применялся литий/кобальта оксид (Li/CoO2). Но этот
материал довольно дорог, склонен к разложению, которое резко ускоряется и
приобретает необратимый характер, если напряжение аккумулятора превышает
номинальное или падает ниже (например, для аккумуляторов 3,6 В допустимые
пределы - от 2,7 до 4,2 В). Поэтому использование аккумуляторов на его основе
невозможно без специального контроллера, ограничивающего напряжение заряда и
разряда на каждом аккумуляторе, входящем в состав батареи. Такой контроллер
обеспечивает и безопасность, останавливая работу аккумулятора при превышении
предельных величин тока и температуры. Кстати, именно для того, чтобы не
допустить использования литий-ионных аккумуляторов в оборудовании, не
приспособленном для их применения, производители отказались от выпуска
аккумуляторов в габаритах, идентичных массовым бытовым типоразмерам.
Сегодня под названием "литиевые
батареи" объединены источники с различной химической начинкой:
· литий/тионилхлоридные (Li/SOCl2);
· литий/серы оксид (Li/SO2);
· литий/никеля оксид (Li/NiO2);
· литий/марганца оксид (Li/MnO2).
Наиболее изученный и технологически отработанный
тип литиевых батарей - элементы на основе литий/оксидов марганца (Li/MnO2
и Li/Mn2O4), поэтому они из всей группы самые доступные
по цене. Их емкость ниже, чем у материалов на основе кобальта, но они дешевле и
не требуют сложного контроллера для управления процессами зарядки-разрядки.
Li/NiO2 имеет более высокую емкость, чем предыдущий оксид, но
труднее в производстве и более опасен. Поэтому для повышения безопасности в
аккумуляторах большой емкости начали использовать смешанные оксиды кобальта и
никеля (20-30% никеля).
Батареи Li/SOCl2 характеризуются
самым высоким выходным напряжением (3,6 В), наиболее широким диапазоном
температур (от "минус"55 до "плюс"85 °С), очень малыми
токами саморазряда и небольшим типовым током разряда. Однако батареи с таким
типом электролита не выносят высокой температуры. А поскольку при значительных
токах разряда на внутреннем сопротивлении батареи может выделяться тепло,
превышающее допустимый уровень, в конструкцию элемента вводят
предохранитель-ограничитель тока (терморезистор), не допускающий токовых
перегрузок. Впрочем, существуют специальные серии Li/SOCl2-элементов,
способных выдавать повышенные токи разряда и нормально работать при высокой
температуре. Достичь этого удалось благодаря специальной конструкции
цилиндрического корпуса, препятствующей проникновению влажных паров снаружи, но
не мешающей выходу газов.
Примерно такие же ограничения имеет и серия
батарей на основе Li/SO2, которые тоже критичны к высоким
температурам и не допускают сильноточного разряда, но имеют меньшее рабочее
напряжение (3,0 В). Кстати, из всех литий-ионных аккумуляторов эта серия
появилась на рынке раньше других.
Несмотря на то что новые электродные материалы
обладают в несколько раз меньшей, по сравнению с чистым литием, удельной
электрической энергией, аккумуляторы на их основе получаются более безопасными
для человека при условии соблюдения некоторых мер предосторожности в процессе
зарядки-разрядки. При этом удельные зарядно-разрядные характеристики
литий-ионных аккумуляторов на основе оксидов превышают аналогичные показатели
NiCd- и NiMH-аккумуляторов по крайней мере вдвое, они хорошо работают на
больших токах (что необходимо, например, в сотовых телефонах и портативных
компьютерах) и имеют низкий саморазряд (для современных батарей - всего 2-5% в
месяц). Как и все аккумуляторы, литиевые подвержены старению, но в меньшей
степени, чем многие конкуренты, - через 2 года батарея сохраняет более 80%
емкости.
Однако Li-Ion-технологии по-прежнему требуют
соблюдения техники безопасности, поэтому каждый пакет аккумуляторов должен быть
оборудован электрической схемой управления, чтобы ограничить пиковое напряжение
каждого элемента во время зарядки, а также предотвратить понижение напряжения
элемента при разрядке ниже допустимого уровня для долговечной работы батарей.
Кроме того, следует ограничить максимальный ток зарядки и разрядки и
контролировать температуру элемента. Эти меры приводят к удорожанию
аккумуляторов на основе лития, что является главным препятствием для их более
широкого распространения, не говоря уж о высокой стоимости как самого лития,
так и технологии производства данных батарей (необходимы инертная среда,
очистка неводных растворителей и т.д.).
Таким образом, главный недостаток литий-ионных
аккумуляторов - их дороговизна. Однако рынок литиевых элементов и батарей малой
емкости, цена которых по определению не может быть существенной, постоянно
расширяется, появляются все новые и новые области их использования, так что
литий-ионные аккумуляторы сегодня считаются самыми перспективными.
В 1991 году фирма Sony Energetic впервые начала
коммерческое производство литий-ионных аккумуляторов и в настоящее время
является одним из самых крупных поставщиков. Отметим, что по материалу
отрицательного электрода литий-ионные аккумуляторы можно разделить на два
основных типа: с отрицательным электродом на основе кокса (технология Sony) и
на основе графита. Источники тока с отрицательным электродом на основе графита
имеют более плавную разрядную кривую с резким падением напряжения в конце цикла
разряда по сравнению с более пологой разрядной кривой аккумулятора с коксовым
(сажевым) электродом. Поэтому в целях получения максимально возможной емкости
конечное напряжение разряда аккумуляторов с коксовым (сажевым) отрицательным
электродом обычно устанавливают ниже, чем на аккумуляторах с графитовым
электродом. Так, аналогичные по формфактору литий-ионные аккумуляторы одной и
той же компании с номинальным напряжением 3,6 В - это, как правило,
аккумуляторы с сажевым электродом, а 3,7 В - с графитовым, то есть
производители специально вводят различия по номинальному напряжению, чтобы
уравнять характеристики. Сегодня все больше производителей предпочитают выпускать
Li-Ion-аккумуляторы с графитовым отрицательным электродом, поскольку они
способны обеспечить более высокий ток нагрузки и меньший нагрев во время
зарядки-разрядки, чем коксовые аккумуляторы.
Из преимуществ современных Li-Ion-аккумуляторов
по сравнению с другими технологиями можно отметить следующие:
· самый высокий уровень удельной
емкости и плотности разрядного тока;
· минимальный саморазряд (для
некоторых типов литий-ионных батарей при 20 °С - не более 3% в год);
· длительный срок службы (до 10 лет);
· большое количество циклов
зарядки-разрядки (гарантируется свыше 1000 циклов);
· работоспособность в широком
диапазоне температур;
· высокая сохранность запасенной
энергии и постоянная готовность к работе.
Следует иметь в виду, что стандартные элементы
обеспечивают более высокую емкость при средних токах и высокое напряжение
разряда в широком диапазоне рабочих температур, а элементы повышенной емкости
гарантируют более длительный срок службы при малых токах.
За последние годы общая картина производства
литий-ионных источников претерпела существенные изменения. Производители
непрерывно совершенствуют технологию, находят более современные материалы
электродов и состав электролита. Параллельно прилагаются усилия для повышения
безопасности эксплуатации аккумуляторов на основе лития на уровне как отдельных
источников тока, так и управляющих электрических схем.
Что касается главного недостатка
Li-Ion-аккумуляторов - высокой цены, то сегодня решается задача замены оксида
кобальта батарей на менее дорогие материалы, что приведет к снижению их
стоимости в течение ближайших лет примерно в два раза. Дополнительные резервы в
плане удешевления Li-Ion-аккумуляторов при использовании новых материалов
кроются в повышении безопасности этой технологии в источниках питания.
Однако Li-Ion-технология, помимо высокой цены,
имеет и другие недостатки. Известно, что стандартные литий-ионные аккумуляторы
лучше всего функционируют при комнатной температуре, а работа при повышенной
температуре сокращает срок их службы, поскольку это приводит к ускоренному
старению, сопровождаемому увеличением внутреннего сопротивления. Плохо
реагируют Li-Ion-аккумуляторы и на отрицательные температуры.
Однако ученые из Американской национальной
лаборатории (INEEL) в штате Айдахо объявили о разработке новой конструкции
литиевой батареи, в которой значительно расширены функциональные возможности
этого традиционного устройства и преодолены имеющие недостатки.
Основное изменение в конструкции заключается в
использовании смеси гелеобразного полимера и керамического порошка, которые
образуют прозрачную мембрану, выполняющую роль электролита при контакте с двумя
электродами. Такая конструкция по сравнению с традиционными, где в качестве
электролита используются жидкости и гели, обладает рядом преимуществ. Прежде всего
в новой конструкции исключена возможность утечки электролита (поскольку
электролит там твердый) и нет осаждения изолирующего слоя на поверхности
электродов, что приводит к сокращению времени работы батареи, а в конце концов
- к потере ее работоспособности. Отсутствие жидкого электролита, который к тому
же потенциально пожароопасен и в некоторых случаях приводит к взрывам в
процессе зарядки батарей, значительно повышает безопасность использования. Сами
исследователи видят наибольшее преимущество твердого электролита в том, что
батареи теперь можно будет применять в более широком диапазоне температур -
электролит не расплавится при высоких температурах и не замерзнет при
отрицательных, сохраняя свою работоспособность даже при "минус" 73
°С.
Из других недостатков технологий на основе лития
можно отметить следующие: Li-Ion-аккумулятор не любит глубокого разряда, очень
требователен к температурному диапазону (при переохлаждении устройства с
литиевым аккумулятором повышается внутреннее сопротивление батарей, что может
проявляться в самопроизвольном отключении устройства), боится перезаряда,
взрывоопасен при нарушении герметичности и со временем понемногу теряет емкость
(то есть стареет даже при отключенной нагрузке). Одним словом, до идеального
источника энергии ему еще далеко, хотя все недостатки компенсируются высокой
удельной энергоемкостью.
В последнее время в области технологий на основе
лития наметился переход на литий-полимерные аккумуляторы (Lithium-Polimer
battery). Собственно, принципиальных различий в указанных технологиях нет,
однако при почти такой же плотности энергии, что у литий-ионных аккумуляторов,
литий-полимерные батареи могут изготовляться в различных пластичных
геометрических формах, что особенно актуально для миниатюрных устройств.
Нетрадиционные для обычных аккумуляторов формы литий-полимерных батарей
позволяют заполнять все свободное пространство внутри портативного устройства и
не требуют специального отсека, как прежде. Таким образом, при применении
литий-полимерной батареи той же удельной емкости, что у традиционной
цилиндрической батареи, за счет выбора оптимальной формы и заполнения всех
неиспользуемых объемов можно, не меняя формы самого портативного устройства,
сохранять на 20-30% больше энергии.
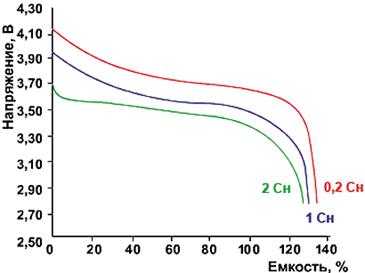
Рис. Разрядные характеристики
Li-Ion-аккумуляторов при различных токах разряда при температуре окружающей
среды 15-25 °С
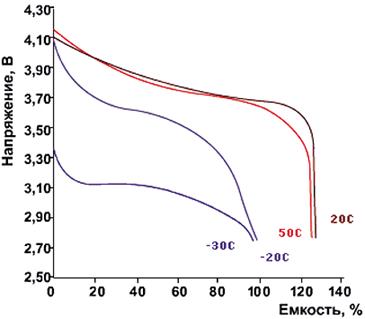
Рис. Разрядные характеристики
Li-Ion-аккумуляторов при токе разряда 0,2 Сн при различных температурах
окружающей среды
Основное отличие литий-полимерных (Li-Pol,
Li-Polymer) аккумуляторов от литий-ионных заложено в самом их названии и
заключается в типе применяемого электролита. Сухой твердый полимерный
электролит (или электролит в виде полимерного геля) похож на пластиковую пленку
и не проводит электрический ток, но допускает обмен ионами. В результате
становится возможным упрощение конструкции элемента, поскольку полимерному
электролиту не грозит утечка, а значит, нет необходимости обеспечивать герметичность.
Полимерный электролит фактически заменяет традиционный пористый сепаратор,
пропитанный электролитом. Такая конструкция элементов более безопасна, делает
процесс их изготовления менее сложным и позволяет производить тонкие
аккумуляторы произвольной формы, но пока, к сожалению, сухие полимерные
электролиты обладают недостаточной электропроводностью даже при комнатной
температуре. Внутреннее сопротивление их слишком высоко и не может обеспечить
величину тока, необходимую современным портативным устройствам. Кроме того,
вследствие недостаточной отработанности технологии изготовления
Li-Pol-аккумуляторы еще слишком дороги и недолговечны - гарантированное число
полных циклов зарядки-разрядки для них по крайне мере в 2 раза меньше, чем для
Li-Ion. Правда, промежуточные решения - с жидким гелевым электролитом - уже
весьма надежны и широко применяются. [5]
Заключение
В работы, были рассмотрены
принципы работы, классификация и значение химических источников тока.
Химические источники тока имеют огромное значение для развития науки, для
освоения космоса, и развития общества. Наиболее перспективным типом ХИТ
являются элементы с литиевым анодом. Значение химических источников тока
очевидно, потому как мы используем их в повседневной жизни, трудно представить
себе фотоаппараты, мобильные телефоны, карманные персональные компьютеры и т.п.
подключенные к электросети, ограничивающие свободу человека. Современная наука
стремится к созданию компактных и надежных приборов, сопровождающих человека в
его жизни, химические источники тока играют в это немаловажную роль.
Источники и литература
1. http://ru.wikipedia.org/wiki/Химический_источник_тока
История создания.
. http://www.aktex.ru/qa/36.html
История изобретения и усовершенствования аккумулятора.
. http://leg.co.ua/knigi/oborudovanie/akkumulyatornye-batarei-3.html
1.4 Принцип действия аккумулятора
. http://akbplus.ru/AKB-Spravka/ustroistvo-avto-akkumulatora.html
Назначение и устройство автомобильных аккумуляторов и аккумуляторных батарей
. http://compress.ru/article.aspx?id=16846
Современные аккумуляторы
. Шеханов Р.Ф., Ершова Т.В.
Химические источники тока: лабораторный практикум/ Иван. гос. хим.-технол.
ун-т. Иваново, 2008