Потенциометрия
Министерство образования и науки
Российской Федерации
Федеральное государственное бюджетное
образовательное учреждение
высшего профессионального образования
Кафедра химической технологии
неметаллических материалов
и физической химии
Курсовая работа
по дисциплине Аналитическая химия и
ФХМА
на тему: Потенциометрия
Содержание
Введение
1. Индикаторные электроды
Ионоселективные электроды
Газовые электроды
2. Электроды сравнения
3. Виды потенциометрического метода анализа
4. Прямая потенциометрия
рН-метрия
Ионометрия
Метод градуировочного графика
Метод добавок
Метод двойной стандартной добавки
Редоксометрия
5. Потенциометрическое титрование
Комплексонометрическое титрование
Титрование по методу осаждения
Окислительно-восстановительное титрование
6. Измерение ЭДС электрохимических цепей
7. Определение нитрата в техническом образце
Выполнение работы
Заключение
Библиографический список
Введение
Электрохимические методы анализа - это совокупность методов
качественного и количественного анализа <#"822483.files/image001.gif">, (1)
где Е0 - стандартный электродный потенциал; R -
универсальная газовая постоянная (R = 8.314 Дж/моль∙К); Т - абсолютная
температура; n - число электронов (ē), участвующих в реакции;
c - концентрация, моль/дм3; f - коэффициент активности.
Так как в потенциометрии используются разбавленные растворы,
где f=1, то активность (а) заменяют на концентрацию (с). Если
перейти от ln к lg, то при T = 298K (25°С) уравнение (1.1) запишется
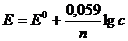 . (2)
. (2)
потенциометрия индикаторный электрод потенциал
1.
Индикаторные электроды
В потенциометрическом методе анализа используют обратимые
электроды. Токи обмена для обратимых электродов достигают несколько десятков и
сотен мА/см2. Потенциал у таких электродов зависит от активности
компонентов электродной реакции в соответствии с термодинамическими
уравнениями. На обратимых электродах быстро устанавливается равновесие, и
скачки потенциалов остаются неизменными во времени. При прохождении
электрического тока скачки потенциалов не должны значительно изменяться; а
после выключения тока быстро должно устанавливаться равновесие. Электроды, не
удовлетворяющие этим требованиям, называются необратимыми.
В потенциометрии применяют два основных класса индикаторных
электродов:
. Электроды, на межфазных границах которых протекают
реакции с участием электронов, так называемые электроннообменные
(окислительно-восстановительные, электроды первого и второго рода);
2. Электроды, на межфазных границах которых протекают
ионообменные реакции. Такие электроды называют мембранными, или ионообменными,
их называют также ионоселективными.
Электронообменные
электроды
1. Редокс-электроды состоят из электрохимически инертного
проводника (платины, графита и т.д.), погруженного в раствор, в котором
находятся окисленная и восстановленная формы потенциалопределяющего вещества.
Такой инертный проводник способствует передаче электронов от восстановителя к
окислителю через внешнюю цепь. Примерами таких электродов могут служить
редокс-электроды с ионами в различных степенях окисления: (Pt) Sn4+,
Sn2+, (Pt) Fe3+, Fe2+.
Уравнение Нернста при 298 К
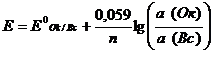 , (1.1)
, (1.1)
2. Электроды первого рода - электроды, находящиеся в
равновесии с катионами, одноименными с металлом, и обратимые по отношению к
ним. Простейший электронообменный электрод - металлическая пластинка,
погруженная в раствор или расплав электролита Zn/Zn2+; Cu/Cu2+ и т.д.
Уравнение Нернста для электрода первого рода при 298 К
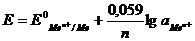 , (1.2)
, (1.2)
3. Электроды второго рода представляют собой
металлические электроды, покрытые слоем труднорастворимой соли того же металла.
При погружении в раствор соли одноименного аниона его потенциал будет
определяться активностью иона в растворе.
.1. Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl - представляет
собой серебряный проводник, покрытый твердым AgCl, который погружен в
насыщенный раствор KCl.
Серебро электрохимически взаимодействует со своим ионом:
Ag+ + e -
= Ag.
Уравнение Нернста для этого процесса:
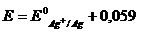 , (1.3)
, (1.3)
Однако в присутствии труднорастворимого AgCl активность ионов
серебра очень мала и ее трудно определить. Но активность ионов Ag+
связана с легко задаваемой в данной системе активностью ионов Cl - произведением
растворимости хлорида серебра ПРAgCl:
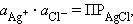 откуда
откуда 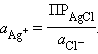
Подставляя это выражение в (1.3)
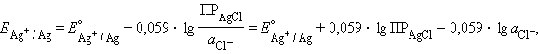
и обозначив

получим уравнение Нернста для хлорсеребряного электрода:
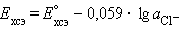 , (1.4)
, (1.4)
Потенциалопределяющими являются ионы хлора, а электродный
процесс может быть представлен уравнением
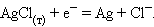
3.2. Каломельный электрод (КЭ) Hg|Hg2Cl2|Cl
- это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2,
которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Принцип действия каломельного электрода тот же, что и
хлорсеребряного.
Электродная реакция сводится к восстановлению каломели до
металлической ртути:
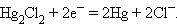
Потенциал каломельного электрода определяется активностью
ионов хлора:
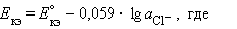
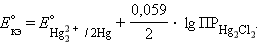
Электроды второго рода обеспечивают стабильное поддержание
электродных потенциалов за счет постоянно большой и неизменной концентрации
анионов. Поэтому они применяются как электроды сравнения в потенциометрической
ячейке.
Мембрана - основной компонент любого ИСЭ. Она разделяет
внутренний раствор с постоянной концентрацией определяемого иона и исследуемый
раствор. Одновременно мембрана служит средством электролитического контакта
между ними. Мембрана обладает ионообменными свойствами, причем проницаемость ее
к ионам разного типа различна. Таким образом, ИСЭ - это аналитические
устройства, позволяющие с помощью ионочувствительной мембраны узнавать
конкретный тип ионов и давать информацию об их количестве в виде электрического
сигнала - потенциала, который связан с активностью (концентрацией)
определяемого иона в анализируемом растворе (рис.1).

Рисунок 1 Ионоселективные электроды
Потенциал системы, состоящей из внешнего электрода сравнения
и ИСЭ, погруженных в анализируемый раствор, описывается модифицированным
уравнением Нернста (уравнением Никольского-Эйзенмана):
 . (1.5)
. (1.5)
где const ? константа,
зависящая от значений стандартных потенциалов внутреннего и внешнего электродов
сравнения и от природы мембраны ИСЭ;А - активность определяемого
иона А; аВ - активность мешающего иона В; ZВ - заряд
мешающего иона; К - коэффициент селективности электрода по отношению к
иону В.
Коэффициент селективности - это количественная
характеристика избирательности электрода. Чем меньше коэффициент селективности,
тем выше избирательность электрода к ионам, для которых он предназначен. Если
коэффициент селективности составляет, например, 10-3, то
определяемый ион фиксируется в 1000 раз чувствительнее, чем мешающий ион. Это
следует понимать таким образом, что при К=10-3 можно определять
концентрацию ионов А в присутствии почти 1000-кратного избытка ионов В. Если
коэффициент селективности К = 1, то мешающие и определяемые ионы вносят
одинаковый вклад в электродный потенциал.
Если коэффициент селективности больше единицы, то мешающий
ион определяется предпочтительнее, чем ион, для которого предназначался
электрод. Такой вариант реализуется почти у всех Са-электродов, которые к Zn++
чувствительнее в 3 раза.
В тех случаях, когда исследуемый раствор содержит мешающие
ионы в очень большом количестве, предварительно понижают их концентрацию
химическим осаждением, комплексообразованием или другими подобными операциями.
Имеются две группы методов определения коэффициента
селективности: первая - на основе отдельных растворов, один из которых содержит
только ионы А, а другой - только ионы В; вторая - определение с помощью
смешанных растворов.
Ионоселективные электроды имеют следующие достоинства: они не
оказывают воздействия на исследуемый раствор; портативны; пригодны как для
прямых определений, так и в качестве индикаторов в титриметрии.
В зависимости от типа мембраны ионоселективные электроды
можно разделить на следующие группы:
. твердые электроды - гомогенные, гетерогенные, на
основе ионообменных смол, стекол, осадков, моно - и поликристаллов;
2. жидкостные электроды на основе жидких ионитов хелатов
- нейтральные переносчики, биологически активных веществ;
. газовые и энзимные электроды.
Электроды
с твердыми мембранами.
В таких электродах мембрана изготовлена из малорастворимого
кристаллического вещества с ионным типом электрической проводимости.
Конструктивно электрод представляет собой трубку диаметром около 1 см из
инертного полимера (обычно поливинилхлорида), к торцу которой приклеена тонкая
(~0,5 мм) мембрана. В трубку заливают внутренний раствор сравнения, в который
погружают электрод сравнения.
К электродам с твердой мембраной относятся: лантанфторидный
электрод (мембрана на основе монокристалла LаF3), сульфидсеребряные
электроды, галогенсеребряные электроды, электроды на основе сульфидов
(халькогенидов) некоторых двузарядных ионов металлов, стеклянные электроды.
Наибольшее распространение получил стеклянный электрод.
Стеклянный
электрод
С помощью данного вида электродов определяют рН растворов. Их
изготавливают из специального электродного стекла, в состав которого входят
оксиды алюминия, натрия, калия, бора и др. Мембрана таких электродов
представляет собой тонкостенный шарик (~0,1 мм) диаметром 5 - 8 мм.
Существуют стеклянные электроды которые позволяют определить
концентрацию ионов Na+, K+. В основе теории стеклянного электрода лежит
представление о том, что стекло - это ионообменник, который может вступать в
ионообменное взаимодействие с раствором. Стекло при этом рассматривается как
твердый электролит. Стекло, состоящее из окислов натрия, кальция, кремния,
обладает резко выраженным специфическим сродством к ионам Н+. Вследствие этого
при соприкосновении с водными растворами в поверхностном слое стекол образуется
слой, в котором ионы Na+ оказываются почти полностью замещенными на ионы Н+.
Поэтому мембранный электрод, изготовленный из такого стекла, обладает
Н+-функцией.
Введение в состав стекла окислов бария, цезия, лантана и
замена натрия на литий значительно расширяет диапазон Н+-функции стеклянного
электрода. Введение же окислов алюминия и бора значительно снижают Н+-функции
стеклянного электрода. Таким путем удалось создать ионселективные стеклянные
электроды для ионов Na+, K+, Li+, Ag+.
Продолжительность функционирования стеклянного электрода
определяется рядом факторов - состав стекла, толщина рН-чувствтельного
поверхностного слоя мембраны, температура и состав раствора, в котором электрод
используется. Разрушение стекла водными растворами происходит в результате
сорбции воды стеклом и глубокое ее проникновение в толщу. Коррозионному
действию щелочных растворов, образующихся при экстракции щелочных компонентов
стекла, подвергается и горловое стекло. Кремнекислородная сетка испытывает
воздействие с обеих сторон мембраны. В конце концов развиваются трещины,
приводящие к нарушению функции электрода. Для защиты электрода от разрушения
необходимо хранить его в воде, так как в воде происходит выщелачивание
связанных ионными силами основных компонентов стекла и замена их ионами
водорода, в результате чего на поверхности стекла образуется слой
гидролизованного кремнезема, предохраняющий стекло от дальнейшего разрушения.
Факторы, влияющие на работу твердых мембранных электродов
Для достижения теоретических функций в электродах с твердыми
мембранами необходимо, что бы все твердые соединения, входящие в фазу мембраны,
находились в равновесии с анализируемом раствором. Этого не произойдет, если
ионы, присутствующие в анализируемом растворе, реагируют с отдельными
компонентами мембраны. Наиболее типичной реакцией, характерной для мембран,
содержащих галогениды серебра, является образование мене растворимой серебряной
соли. Для электрода с мембраной из смеси сульфидов серебра и меди обнаружен
более сложный характер влияния, связанный с образованием новой твердой фазы.
Если электрод оказался в растворе, ионы которого приводят к образованию новой
твердой фазы, то вернуть электрод в прежнее состояние можно выдержав его в
растворе с высокой концентрацией соответствующих ионов.
Электроды
с жидкостными мембранами.
В таких электродах жидкие мембраны, представляющие собой
растворенные в органических растворителях ионообменные вещества, отделяют от
анализируемого раствора гидрофобными мелкопористыми пленками, пористыми дисками
или гидрофобизированными керамическими диафрагмами.
Устойчивость мембраны повышается, если органическая жидкость
обладает высокой вязкостью. Низкая диэлектрическая проницаемость жидкого
органического вещества способствует ассоциации ионов в фазе мембраны. Высокая
селективность к определяемому иону требует большой стабильности ионного
комплекса, на которую влияет растворитель. Для создания электродов с жидкими
мембранами используют многие органические вещества, либо чистые, либо в
соответствующем растворителе. Общее свойство всех этих соединений - способность
селективно связывать некоторые небольшого размера ионы, образуя нейтральные
ионогенные группы с ионами противоположного знака заряда (в жидком
ионообменнике) или заряженные комплексы с нейтральными группами органической
природы. Жидкие мембраны разделяют две водные фазы. На границе между мембраной
и раствором происходит быстрый обмен между свободными ионами в растворе и
ионами, связанными органическими группами в фазе мембраны. Селективность
электрода зависит от избирательности этого ионного процесса.
В электродах с жидкими мембранами к мембранному веществу
предъявляется одно требование, так как если какой-либо ион способен вообще
существовать в фазе мембраны, то он в ней будет двигаться по закону диффузии, и
поэтому проблема обеспечения подвижности интересующего иона в мембране сама
собой разрешается. Селективность жидких мембран будет определяться ограничением
внедрения посторонних ионов в поверхность мембраны. Так как жидкая фаза
находится вконтакте с водными растворами, она должна быть нерастворимой в воде
и иметь низкое давление паров, чтобы избежать интенсивного ее испарения. Эти
требованиям могут отвечать жидкие органические вещества обладающие сравнительно
большим молекулярным весом и низкими диэлектрическими проницаемостями.
Их основным недостатком является постепенное вымывание
анализируемым раствором ионообменника, что сокращает срок работы электрода.
Этих трудностей удалось избежать после разработки электродов
с пленочными мембранами. В таких электродах в тонкую мембрану из гидрофобного
полимера (поливинилхлорида) вводят пластификатор и растворенное в нем
электродоактивное вещество, вступающее в ионообменную реакцию с анализируемым
ионом в растворе. В настоящее время промышленность выпускает пленочные
ионоселективные электроды на катионы Na+, К+, NH4+, Са2+, Mg2+; электроды для
определения общей жесткости воды; на анионы галогенидов, NCS-, NО3-. Существуют
электроды и на другие ионы.
Газовые
электроды
Газовый электрод включает ионоселективный электрод и
сравнительный электрод, контактирующие с небольшим объемом вспомогательного
раствора, который отделен от исследуемого раствора газовой прослойкой или
гидрофобной газопроницаемой мембраной.
Существует два вида газовых электродов:
Первый - ионоселективный и сравнительный электрод погружены в
небольшой объем раствора определенного состава, отделенного от исследуемого
раствора гидрофобной газопроницаемой мембраной. Для этого вида электродов
используют два вида мембран - гомогенные, представляющие собой пленку полимера,
в которой растворяется диффузионный газ, и гетерогенные, микропористые, в
которых газ диффундирует фактически через воздух, заполняющий поры. В качестве
мембран используют - силиконовый каучук, тефлон, полипропилен. Микропористые
мембраны обладают лучшими диффузионными характеристиками по сравнению с
гомогенными.
Второй тип - в нем газопроницаемая мембрана заменена газовой
прослойкой. В этом электроде для удержания электролита на поверхности
индикаторного электрода и создания стандартной по толщине пленки в электролит
вводят ПАВ или весь раствор впитывается слоем геля.
В электроде с гидрофобной мембраной не требуется обновлять
слой электролита на мембране индикаторного электрода после каждого измерения;
электрод можно использовать в условиях протока; на показания электрода
практически не влияют механические помехи (например, сотрясение); полимерная
пленка защищает электрод от воздействия воздуха.
В электроде с газовым зазором можно изменять толщину слоя
электролита, изменяя давление головки электрода на полимерную мембрану; слой
электролита на индикаторном электроде очень тонок, это значительно сокращает
время отклика электрода; диффузия газа в воздушной прослойке происходит гораздо
быстрее, чем в мембране из полимера; из-за отсутствия прямого контакта
электрода с образцом значительно возрастает срок жизни электрода.
Одним из наиболее распространенных электродов, является электрод
с чувствительным элементом на аммиак. Эта электродная система включает
катионоселективный электрод и гидрофобную мембрану, проницаемую для аммиака, но
непроницаемую для таких ионов, как Na+, K+, NH4+.
Мембрана отделяет исследуемый щелочной раствор от внутреннего раствора 0,1М
NH4Cl, в который погружен стеклянный рН-электрод и хлорсеребряный
электрод сравнения. Диффузия аммиака через мембрану вызывает изменение
рН раствора, находящегося между мембраной и стеклянным электродом, который
регистрирует это изменение рН. Электроды для определения кислорода и углекислого
газа используют преимущественно в медицине.
2. Электроды
сравнения
При измерении ЭДС обратимых гальванических элементов
необходим полуэлемент, потенциал которого был бы неизвестен, постоянен и не
зависел бы от состава полученного раствора. Электрод удовлетворяющий этим
требованиям, называют электродом сравнения. Электрод сравнения должен быть
прост в изготовлении сохранять практически постоянный и воспроизводимый
потенциал при прохождении небольших токов.
В качестве электрода сравнения используют стандартный
водородный электрод (СВЭ) - электрод I рода - Pt (H2) /2H+. Его потенциал
определяется величиной pH и при комнатной температуре равен:
E = E0 + 0,059lg [H+] = −0,059pH.
Стандартный водородный электрод (СВЭ) неудобен в работе, его
заменяют электродами II рода - насыщенным каломельным электродом (н. к. э.) и
хлорсеребряным (х. с. э.).
3.
Виды потенциометрического метода анализа
В зависимости от природы электродной реакции на индикаторном
электроде в потенциометрических методах существуют два направления: ионометрия
и редоксметрия. В обоих случаях потенциометрические методы анализа
подразделяются на два вида:
. прямая потенциометрия, или ионометрия;
2. потенциометрическое титрование.
4.
Прямая потенциометрия
Метод прямой потенциометрии основан на измерении потенциала
индикаторного электрода, погруженного в исследуемый раствор, и расчете
концентрации определяемых ионов согласно уравнению Нернста.
Метод достаточно прост и экспрессен. Достоинством и
недостатком метода одновременно является то, что измеряемый потенциал зависит
от активности. Это единственный метод прямого определения активности ионов в
растворах. Но с другой стороны аналитиков чаще интересует концентрация, а
пересчет активности ионов в концентрацию с применением эмпирических
коэффициентов активности вызывает некоторую дополнительную погрешность.
Существует вариант метода, в котором в калибровочные и анализируемые растворы
вводится индифферентный электролит. Это позволяет проводить калибровку и
последующий анализ в единицах концентрации.
Прямая потенциометрия обладает важными достоинствами. В процессе
измерений состав анализируемого раствора не меняется. При этом, как правило, не
требуется предварительного отделения определяемого вещества. Метод можно легко
автоматизировать, что позволяет использовать его для непрерывного контроля
технологических процессов.
Исторически первыми методами прямой потенциометрии были
способы определения водородного показателя (рН - метрия).
рН-метрия
Для определения величины pH существуют два основных метода:
колориметрический и потенциометрический.
Потенциометрический метод намного точнее, чем
колориметрический, но требует оборудования лабораторий специальными приборами -
pH-метрами.
pH-метр - прибор
<#"822483.files/image017.gif">
Рисунок 2 pH-метр
Наибольшее практическое применение определения величины pH
нашел стеклянный индикаторный электрод, который можно использовать в широком
диапазоне pH и в присутствии окислителей.
Крупный вклад в теорию и практику рН-метрии внесли ученые:
Б.П. Никольский, М.М. Шульц, Е.Н. Виноградова и др.
Ионометрия
С середины 60-х годов за рубежом, а с 70-х годов в нашей
стране стала бурно развиваться новая область физико-химических методов анализа
- ионометрия (рХ-метрии).
Этот метод основан на разработке, изучении и практическом
использовании различного рода ионоселективных электродов (ИСЭ). Иногда
рН-метрию рассматривают как частный случай ионометрии. Градуировка шкал
приборов потенциометров по значениям рХ затруднена из-за отсутствия
соответствующих стандартов.
Поэтому при использовании ионоселективных электродов
активности (концентрации) ионов определяют, как правило, с помощью
градуировочного графика или методом добавок. Применение таких электродов в
неводных растворах ограничено из-за неустойчивости их корпуса и мембраны к
действию органических растворителей.
Метод
градуировочного графика
Метод градуировочного графика является самым простым
ионометрическои методом анализа. Процедура анализа состоит из 2-х этапов и
включает в себя градуировку ионоселективного электрода (ИСЭ) относительно
электрода сравнения и проведения измерений в пробах.
. Градуировка состоит в измерении потенциала ИСЭ в
стандартных растворах с известным содержанием определяемого иона. По
результатам измерений строится график. В ионометрии принято выражать
концентрацию ионов через величину рХ, которая равна
pX = - lg a.
где а - активность компонента электрохимической
реакции.
Поэтому из уравнения Нернста следует, что закономерность
изменения потенциала имеет следующий вид:
E = B - S∙pX,
где E - разность потенциалов между ИСЭ и электродом
сравнения; S - наклон электродной функции; В - константа. Эта закономерность
называется электродной функцией.
В координатах Е от рХ градуировка электродов имеет вид
прямой, наклон которой приближается к величине 59,2 мВ (для температуры 25 0C)
для однозарядных ионов.
Для двухзарядных ионов наклон равен 29,6 мВ. Если полученная
из градуировки величина наклона существенно отличается от ожидаемой, то это
говорит о неблагополучном ходе измерений.
. Анализ состоит в измерении потенциала ИСЭ в пробе и
вычисления содержания определяемого компонента по градуировочному графику.
Поскольку градуировочный график представляет собой прямую, то произвести
расчеты по найденному потенциалу несложно.
На практике калибровка линейна только в определенном
диапазоне концентраций. Вне этого диапазона калибровка нелинейна.
В некоторых случаях можно использовать нелинейную часть
калибровки, но это надо делать с оглядкой, так как не всегда можно
контролировать процессы происходящие с ионоселективными электродами в этих
диапазонах.
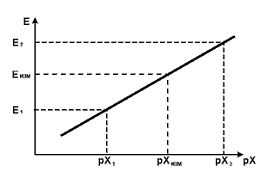 <#"822483.files/image019.gif">
<#"822483.files/image019.gif">
Рисунок 4
В качестве добавляемого можно применять не только раствор,
содержащий потенциалопределяющий ион, но и раствор вещества, связывающего
определяемый ион пробы в недиссоциирующее соединение. Процедура анализа при
этом принципиально не меняется. Тем не менее, для этого случая существуют
некоторые характерные особенности, которые следует учитывать. Особенности
заключаются в том, что график экспериментальных результатов состоит из трех
частей, как показано на рис.4.
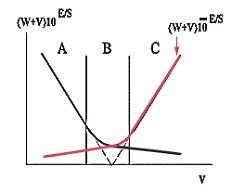
Рисунок 5
Первая часть (A) получается в условиях, когда концентрация
связывающего вещества меньше концентрации потенциалопределяющего. Следующая
часть графика (B) получается при примерно эквивалентном соотношении
вышеупомянутых веществ. И, наконец, третья часть графика (C) отвечает таким
условиям, при которых количество связывающего вещества больше, чем
потенциалопределяющего. Линейная экстраполяция части A графика на ось абсцисс
дает величину ΔV. Область
B обычно для аналитических определений не используется.
Если кривая титрования центральносимметрична, то для получения
результатов анализа можно использовать и область C. Однако, в этом случае
ордината должна вычисляться следующим образом: (W+V) 10 - E/S.
Метод Грана обладает большими преимуществами, чем метод
стандартных добавок.
Преимущества применения данных методов:
. Уменьшение погрешности определения в 2-3 раза за счет увеличения
числа измерений в одной пробе.
. Метод добавок не требует тщательной стабилизации ионной силы в
анализируемой пробе, так как ее колебания отражаются на величине абсолютного
значения потенциала в большей степени, чем на величине наклона электродной
функции. В связи с этим погрешность определения по сравнению с методом
градуировочного графика уменьшается.
. Применение целого ряда электродов проблематично, так как наличие
недостаточно стабильного потенциала требует частого проведения процедуры
градуировки. Поскольку в большинстве случаев дрейф потенциала мало сказывается
на наклоне калибровочной функции, то получение результатов методом стандартных
добавок и методом Грана существенно повышает точность и упрощает процедуру
анализа.
. Метод стандартных добавок позволяет контролировать правильность
проведения каждого аналитического определения. Контроль производится во время
обработки экспериментальных данных. Так как в математической обработке
принимает участие несколько экспериментальных точек, то проведение через них
прямой каждый раз подтверждает то, что математический вид и величина наклона
калибровочной функции не изменились. В противном случае линейный вид графика не
гарантирован. Таким образом, возможность контроля правильности анализа в каждом
определении повышает надежность получения результатов.
Как уже отмечалось, метод стандартных добавок позволяет проводить
определения в 2-3 раза точнее, чем метод градуировочного графика. Но для
получения такой точности определения следует пользоваться одним правилом.
Чрезмерно большие или малые добавки снижают точность определения. Оптимальная
величина добавки должна быть такой, чтобы она вызывала отклик потенциала в
10-20 мВ для однозарядного иона. Это правило оптимизируют случайную погрешность
анализа, однако в тех условиях, в которых часто применяется метод добавок,
становится значимой систематическая погрешность, связанная с изменением
характеристик ионоселективных электродов. Систематическую погрешность в этом случае
полностью определяет погрешность от изменения наклона электродной функции. Если
в течение эксперимента изменился наклон, то при определенных условиях
относительная погрешность определения будет приблизительно равна относительной
погрешности от изменения наклона.
Метод двойной
стандартной добавки
Метод заключается в том, что к анализируемому раствору
добавляются 2 порции стандартного раствора. Величина этих порций одинакова. По
результатам измерений вычисляется параметр
R = ΔE2/Δ E1,
где Δ E1 - разность
между потенциалом электродов в анализируемом растворе, и в растворе после
первой добавки; ΔE2 - разность между
потенциалом электродов в анализируемом растворе, и в растворе после второй
добавки.
Пользуясь вычисленным параметром, по специальной таблице находится
искомое значение концентрации. Использование таблицы оправдано тем, что для
поиска значения концентрации приходится решать трансцендентное уравнение
R = lg (1/ (1+ 2ΔV/W) + 2ΔC/Cx) / lg (1/ (1+ΔV/W) + ΔC/Cx).
Следует уточнить, что ΔС - концентрация в
анализируемом растворе после добавки, если бы в этом растворе не было бы больше
никаких ионов, т.е. ΔС = Сисх ΔV / (W+ ΔV). Сисх -
концентрация в стандартном растворе.
В изложенных выше формулах отсутствует упоминание о наклоне
электродной функции, так как это было целью разработки метода двойной
стандартной добавки. На первый взгляд это факт выгодно отличает этот метод,
поскольку процедура анализа упрощается, но это не так. Выиграв в одном, мы,
безусловно, теряем в другом. Во-первых, для того, чтобы ошибка анализа была
удовлетворительной, нужно быть уверенным в линейности электродной функции
ионоселективного электрода! Отклонения от линейности будут приводить к очень
большой ошибке анализа. Таким образом калибровать электроды все равно придется.
Во-вторых, случайная погрешность анализа существенно больше, чем в методе Грана
и методе стандартной добавки. Например, ошибка измерения потенциала в 1мВ может
приводить к погрешности анализа в 10-20%.
Метод двойной стандартной добавки лучше применять только для
очень надежных в эксплуатации электродов (фторидселективный).
Редоксометрия
К прямой потенциометрии относится также редоксметрия.
Редоксметрия - группа методов, в которых характеристическим
свойством определяемых веществ является их способность к химическим
превращениям, связанным с переносом электронов, а в качестве аналитического
сигнала измеряют редокс-потенциал определяемых веществ.
Окислительно-восстановительный потенциал зависит от
активностей окисленной и восстановленной форм вещества. Редоксметрию применяют
также для определения концентрации ионов в растворах.
5.
Потенциометрическое титрование
Более распространены методы потенциометрического титрования.
В потенциометрическом титровании измеряют потенциал индикаторного электрода для
отслеживания изменения концентрации определяемого иона в процессе химической
реакции между определяемым ионом и подходящим реагентом (титрантом).
Аппаратура для потенциометрического титрования та же самая,
что и для прямой потенциометрии. В схему потенциометрических измерений входят
индикаторный электрод, электрод сравнения и потенциало-измеряющий прибор.
Рисунок 6 Установка для потенциометрического титрования
В ходе титрования измеряют и записывают ЭДС ячейки после
добавления каждой порции титранта. В начале титрант добавляют небольшими
порциями, при приближении к конечной точке (резкое изменение потенциала при
добавлении небольшой порции реагента) порции уменьшают.
Для определения конечной точки потенциометрического титрования можно
использовать различные способы. Наиболее простой способ состоит в построении
кривой титрования - графика зависимости потенциала электрода от объема титранта
(рис.6, А). Другой способ состоит в расчете изменения потенциала на единицу
изменения объема реагента ΔE/ΔV (рис 6,
Б).
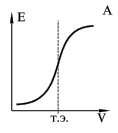
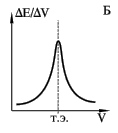
Рисунок 7 Кривые потенциометрического титрования
А - интегральная кривая; Б - дифференциальная кривая
При потенциометрическом титровании могут быть использованы
следующие типы химических реакций, в ходе которых изменяется концентрация
потенциалопределяющих ионов:
1. реакции кислотно-основного взаимодействия;
2. комплексообразования;
. реакции осаждения;
. реакции окисления-восстановления.
Кислотно-основное
титрование
В кислотно-основном титровании в качестве индикаторного обычно
используют стеклянный электрод <#"822483.files/image024.gif">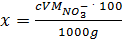 ,
,
где с - концентрация NO3-, определяемая из графика, моль/л; V - вместимость мерной колбы; М - молекулярная масса нитрата; g - навеска технического образца, г.
Описанная методика может быть использована для определения
содержания фторидов и хлоридов с помощью фторид - и хлоридселективных
электродов соответственно. Для создания постоянной ионной силы целесообразно
использовать ацетатный буферный раствор (при определении).
Заключение
Главное преимущество потенциометрического метода по сравнению
с другими методами анализа - быстрота и простота проведения измерений. Время
установления равновесного потенциала индикаторных электродов мало, что удобно
для изучения кинетики реакций и автоматического контроля технологических
процессов. Используя микроэлектроды, можно проводить определения в пробах
объемом до десятых долей, см3. Потенциометрический метод дает
возможность проводить определения в мутных и окрашенных растворах, вязких
пастах, при этом исключая операции фильтрации и перегонки. Потенциометрические
измерения относят к группе неразрушающих способов контроля, и анализируемый
раствор может быть использован для дальнейших исследований. Погрешность
определения при прямом потенциометрическом измерении составляет 2 - 10 %, при
проведении потенциометрического титрования - 0,5 - 1,0 %. Интервал определения
содержания компонентов потенциометрическим методом в различных природных и
промышленных объектах - в пределах от 0 до 14 рН для стеклянных электродов, и
от 10 до 10-5 (10-7) М определяемого иона для других типов ионоселективных
электродов.
Одним из достоинств метода потенциометрического титрования
является возможность полной или частичной его автоматизации. Автоматизировать
можно подачу титранта, запись кривой титрования, отключение подачи титранта в
заданный момент титрования, соответствующий точке эквивалентности.
Библиографический
список
1. Лебедева М.И. Аналитическая химия и физико-химические
методы анализа - Тамбов: Изд-во Тамб. гос. техн. ун-та, 2005.216 с.
2. Васильев В.П. Аналитическая химия. Ч.2. - М.: Высш. шк.,
2002. - 350с.
3. Практикум по физико-химическим методам анализа. Под
редакцией Петрухина О.М. - М.: Химия, 1987
4. Агасян П.К., Николаева Е.Р., Основы электрохимических
методов анализа (потенциометрический метод), М., 1986.
5. Никольский Б.П., Матерова Е.А. "Ионоселективные
электроды" - Л.: Химия, 1980. - 240 с.
6. http://multitest.
semico.ru/ptitr. htm <http://multitest.semico.ru/ptitr.htm>
7. <http://www.eurolab.ru/phmetriya,_vodorodnyy_pokazatel,_ponyatie_rn>
8. <http://www.chemport.ru/chemical_encyclopedia_article_3088.html>
9. <http://www.novedu.ru>
10. http://works.
tarefer.ru/94/100214/index.html
<http://works.tarefer.ru/94/100214/index.html>