Іоноселективні електроди з рідкими пластифікованими мембранами
Державний вищий навчальний
заклад
«Запорізький національний
університет»
МіністерствА освіти І НАУКИ,
МОЛОДІ ТА СПОРТУ України
КУРСОВА РОБОТА
Іоноселективні електроди з
рідкими пластифікованими мембранами
Виконала:
ст. групи 4111-1 Куліченко О.М.
Науковий керівник: к.х.н., доцент Луганська О. В.
Запоріжжя
ЗМІСТ
Вступ
1. Поняття
«пластифікована мембрана» в іоноселективному електроді
1.1 Потенціометрія
.2 Іоноселективні електроди
.3 Класифікація
іоноселектіних електродів
.3 Рівняння Нернста, рівняння
Нікольского
. Поняття «мембрана» та її
види
.1 Іоноселективні електроди з
рідкими мембранами
.2 Рідкі пластифіковані
мембрани
.3 Способи виготовлення
іоноселективних електродів з полімерними пластифікованими мембранами
.4 Приклади іоноселективних
електродів з полімерними пластифікованими мембранами
.5 Вплив вмісту матриці на
вибірковість ІСЕ
.6 Вплив вмісту
пластифікатора на основні електрохімічні характеристики ІСЕ, оборотного до
аніону калієвої солі 3-(5-метил-1,2,4- триазоло[4,3-а] хінолін)-пропанової
кислоти
Висновки
Перелік посилань
Вступ
Для прямого отримання інформації про хімічний склад різних
об'єктів в промисловості, сільському господарстві, медицині, довкіллю, в ряді
галузей наукових досліджень знаходять застосування хімічні сенсори, одним з
основних класів яких є іоноселективні електроди ( ІСЕ ).
Найважливішою частиною всіх іоноселектівних електродів є
мембрана (сенсорний шар). Який виникає на ній електричний потенціал (мембранний потенціал) чутливий
до відмінності складів електролітів, розділених мембраною. Тому електрорушійна сила (е.р.с.) гальванічних елементів, які
включають ІСЕ, залежить від активності електроліту в елементі. У цьому полягає
основа сенсорних можливостей ІСЕ, що дозволяють селективно (вибірково)
вимірювати концентрації іонів в різних об'єктах.
Важливе місце серед ІСЕ занижують електроди з мембранами, що містять
нейтральні і заряджені іонофори: частки складної хімічної структури, рухливі в
матеріалі мембрани. Селективність цих мембран зумовлена насамперед селективністю
взаємодії визначаються іонів з іонофорами. Рідкі мембрани, що складалися з органічного розчинника і розчинених у
ньому іонофорів, до теперішнього часу повністю
витіснені полімерними пластифікованими мембранами. Вони складаються з полімеру
(найчастіше - полівінілхлориду), пластифікатор якого одночасно служить
розчинником для іонофорів .
Актуальність роботи. Надзвичайно широкі можливості варіювання складів
пластифікованих мембран дозволили, створити на їх основі ІСЕ для визначення
декількох десятків катіонів та аніонів. Інтерес до ІСЕ з рідкими і полімерними
пластифікованими мембранами, початкові уявлення про які були закладені ще в
1960 -і і 1970 -і роки, значно зріс з середини 1990 -х, коли була показана
можливість різкого підвищення селективності цих сенсорів за рахунок комбінації
у складі однієї і тієї ж мембрани декількох іонофорів, що виявляють окремо значно меншу селективність.
Метою роботи стало створення обгрунтованого, цілісного і практично
корисного теоретичного опису полімерних пластифікованих мембран.
Завданнями роботи:
. Ознайомитися з поняттям «пластифікована мембрана» в іоноселективному електроді.
. Розглянути приклади електродів, що мають у складі пластифіковані мембрани.
. Розглянути графіки залежності електрохімічних характеристик ектродів з пластифікованими мембранами.
1. Поняття «пластифікована мембрана» в іоноселективному електроді
1.1 Потенціометрія
Потенціометрія - електрохімічний метод дослідження і аналізу
речовин, заснований на вимірюванні електрорушійних сил (ЕРС) оборотних гальванічних
елементів. Потенціометрія використовується для вивчення кінетики і визначення
констант стійкості комплексних сполук, констант дисоціації слабких кислот і
основ, а також добуток розчинності малорозчинних електролітів. Потенціометрія
включає редоксметрію і іонометри. Гальванічний елемент, застосовуваний у
потенціометрії, зазвичай складається з 2 електродів, які поміщають або в один і
той же розчин (лемент без переносу), або в 2 різних за складом розчину, мають
між собою рідинний контакт (елемент з перенесенням). Елементи без перенесення
використовують для визначення змін термодинамічних потенціалів, ентропій,
ентальпій та інших величин при різних процесах[5] .
Електрод, за потенціалом якого судять про концентрацію визначаються іонів
в розчині, називається індикаторним. Величину потенціалу індикаторного
електрода визначають, порівнюючи її з величиною потенціалу іншого електрода,
який прийнято називати електродом порівняння[6]. В якості електрода порівняння може бути застосований
тільки такий електрод, величина потенціалу якого залишається незмінною при
зміні концентрації визначаються іонів[23].
Розрізняють пряму потенціометрію і потенціометричне титрування. Перша використовується
для безпосереднього визначення концентрації речовин за значенням потенціалу
індикаторного електрода (рН- метрія, іонометрія). При потенціометричному титруванні в досліджуваний розчин, поміщений в потенциометрическом
осередок, опускають індикаторний електрод, виникнення потенціалу на якому
обумовлюється або безпосередньо визначальним речовиною (якщо воно
електроактивні), або побічно (якщо воно неелектроактівно) в результаті його
хімічної взаємодії з іншим потенціалопределяючим компонентом[25].
.2
Іоноселективні електроди
Іоноселективні електроди- це електрохімічні, електроди,
рівноважний потенціал яких в розчині електроліту при вмісті певних іонів
знаходиться у виборчій і оборотної залежності від концентрації цих самих іонів.
У зв'язку з цим дані
пристрої активно використовуються при визначенні концентрації (інакше -
активності) різних містяться в розчинах іонів, а також для аналізу і для
контролю за процесами, хід яких супроводжується змінами в іонному складі
розчинів. Іоноселективні електроди, застосовувані для визначення різних іонів,
розробляються і використовуються в рамках основних теоретичних і прикладних
задач іонометрії [15].
Серед хімічних сенсорів з електрохімічним сигналом найбільший
розвиток отримали потенціометричні сенсори- іоноселективні електроди (ІСЕ) і
іоноселективні польові транзистори (ІСПТ) [18]. Поява ІСЕ відноситься до початку ХХ-го століття: М.
Креміром була виявлена залежність електричного потенціалу скляних
мембран від рН, що дозволило Ф. Габеру і 3. Клеменсевіч створити перші скляні
рН- метричні електроди. На прикладі скляних електродів була розроблена так
звана "проста" іонообмінна теорія Б.П. Нікольського, методологія якої
лежить в основі всіх сучасних теорій іоноселектівних електродів[3].
Суттєвою особливістю ІСЕ є відгук на активність, а не на концентрацію
частинок в об'єкті аналізу. У
цьому сенсі аналіз за допомогою іоноселективних електродів не тільки технічно
відрізняється від класичного аналізу, але також дає принципово іншу інформацію[10].
Головною частиною будь-якого ІСЕ є його мембрана (сенсорний
шар), різниця потенціалів на якій закономірним чином змінюється при зміні
складу розчинів , поділюваних цією мембраною.
Найчастіше іоноселективні електроди являють собою, як правило, пристрій,
в якості основного елемента якого виступає мембрана, крізь яку здатні проникати
тільки певні іони. Таким чином, між розчинами електролітів, які власне і
розділяє мембрана, виникає стабільна різниця потенціалів, алгебраїчно
складається з дифузного потенціалу, що з'являється всередині мембрани і двох
міжфазних стрибків потенціалів. Виміряти концентрацію досліджуваного іона
можна, в принципі, визначивши електрорушійну силу гальванічного елемента, який
складений з контактуючих стандартного і аналізованого розчині, в кожному з яких
знаходяться занурені в них ідентичні іоноселективні електроди, що володіють
виборчою чутливістю до обумовленому іону. Причому концентрація цього іона, що
міститься в стандартному розчині, заздалегідь точно відома. Для здійснення
практичних вимірювань гальванічний елемент може бути складений з електрода
порівняння (наприклад, хлоросеребряного) і іоноселективного електрода, які
спочатку опускають в стандартний, а потім в досліджуваний розчини. Причому
бажан , щоб склад вимірюваного розчину був максимально близький по можливості
до складу стандартного. Шукана концентрація обчислюється за відповідним
рівнянням[12].
Іоноселективні електроди (ІСЕ) мають ряд наступних безперечних переваг:
а ) вони не роблять впливу на досліджуваний розчин;
б) портативні;
в) придатні як для прямих визначень , так і в якості індикаторів у
титриметрии;
г) недорогі.
.3 Класифікація
іоноселектіних електродів
Існують іоноселективні електроди наступних типів:
1) Твердотільні електроди, в яких мембраною служить монокристал або
таблетка, спресована з нерозчинної солі (
наприклад, AgX ) і запаяна в трубку (мал.1 ). Принципова перевага електрода такого типу полягає в тому, що
присутність в розчині окислювачів не впливає на е. д. с.
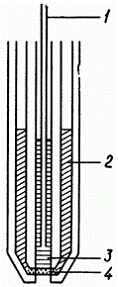
2)
Електроди з гетерогенними мембранами, в яких речовина, що має іонообмінними
властивостями, дисперговані в інертному сполучному, що забезпечує хороші
механічні властивості (мал. 2).
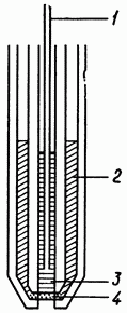
Твердотільний іоноселектівний електрод
- внутрішній електрод порівняння;
- внутрішній розчин порівняння;
- твердотіла мембрана.
Спочатку в якості інертних сполучних використовували полівінілхлорид
і полістирол, але згодом їх замінили силіконовим каучуком, що володіє більш
цінними властивостями. Речовинами, що володіють іонообмінними властивостями,
можуть служити іонообмінні смоли, обложені солі металів і графіт (для
окислювально-відновних реакцій). Доступні також електроди з хлориду, броміду, йодиду і
сульфіду срібла, але їх переваги перед твердотільними електродами поки не
очевидні.
Іоноселектівний електрод з гетерогенною мембраною
- внутрішній розчин порівняння;
- електрод порівняння;
- гетерогенна мембрана, закріплена в силіконовому каучуку.
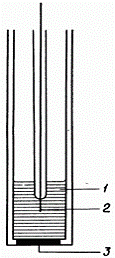
Схематичне зображення кальцій-селективного електрода з іонообмінної
мембраною
- порожниста трубка Ag / AgCl-електрода;
- рідкий ионо-обмінник;
- внутрішній розчин порівняння;
3) Рідинні іонообмінні електроди, в яких нас цікавить іон входить до
складу великої органічної молекули, погано розчинної у воді. Органічні
молекули, розчинені в органічному розчиннику, зазвичай відділяються від
досліджуваних водних розчинів електролітів плівкою з ацетату целюлози(мал. 3)
Наприклад, в електроді, селективному до іонів у концентраціях
використовують кальцієву сіль дідецілфосфорной кислоти розчинену в
ді-ацетілфенілфосфонате. Визначенню кальцію заважають іони водню, магнію та
барію.
) Газові електроди
Газовий електрод включає іоноселектівний електрод і
порівняльний електрод, що контактують з невеликим обсягом допоміжного розчину,
який відділений від досліджуваного розчину газової прошарком або гідрофобною
газопроницаемой мембраною[1]. Існує два види газових електродів. Перший-
іоноселектівний та порівняльний електрод занурені у невеликий обсяг розчину
певного складу, відокремленого від досліджуваного розчину гидрофобной
газопроницаемой мембраною. Для цього виду електродів використовують два види
мембран- гомогенні, що представляють собою плівку полімеру, в якій розчиняється
дифузійний газ, і гетерогенні, мікропористі, в яких газ дифундує фактично через
повітря, що заповнює пори. В якості мембран використовують - силіконовий каучук, тефлон,
поліпропілен. Мікропористі мембрани володіють кращими дифузійними
характеристиками в порівнянні з гомогенними. Другий тип - у ньому газопроникних
мембрана замінена газової прошарком. У цьому електроді для утримання
електроліту на поверхні індикаторного електрода і створення стандартної по
товщині плівки в електроліт вводять ПАР або весь розчин вбирається шаром гелю.
У електроді з гідрофобною мембраною не потрібно оновлювати шар електроліту на
мембрані індикаторного електрода після кожного виміру; електрод можна
використовувати в умовах протоки; на показання електрода практично не впливають
механічні перешкоди (наприклад, струс); полімерна плівка захищає електрод від
впливу повітря.
) Ензимні електроди
Ензимні електроди подібні мембранним електродним системам, чутливим до
газів. Істотна відмінність полягає в
іммобілізації ензимів на індикаторної поверхні електрода. Успішність
застосування ензімного електрода залежить від іммобілізації ензиму в шарі гелю[8]. Існує кілька способів іммобілізації
ензимів: ензим може бути закріплений в гідрофільній мембрані, або поперечно
пов'язані молекули ензиму самі утворюють мембрану; ензим може бути хімічно
пов'язаний з поверхню мембрани; можлива так само сополимеризация з іншими
ензимами або протеїнами; освіта мікрокапсул в рідкої вуглеводневої мембрані з
допомогою ПАР. При іммобілізації ензимів необхідно стежити, щоб не відбувалося
процесів ведуть до денатурації ферментів, для цього необхідно вимірювати активність
іммобілізованих ензимів, перш ніж використовувати їх будь індикаторної системі.
Вибір індикаторного пристрою в ензимними електроді залежить від того, які
речовини утворюються в результаті ферментативної реакції (в будь-якому випадку
застосовують так само один з твердих або рідких іоноселектівних електродів) .
Найбільш поширеними серед ензимних електродів є - електрод для визначення
глюкози і для оцінки концентрації сечовини. Існують так само електроди для
визначення концентрації сечової кислоти, амінокислот[9].
.3
Рівняння Нернста, рівняння Нікольского
Потенціометрічні методи засновані на вімірі електрорушійніх
сил
(ЕРС): E = E1-E2
E - електрорушійна сила (ЕРС);і E2 - потенціали електродів досліджуваної
ланцюга.
Потенціал електрода E пов'язаний з активністю і концентрацією речовин, що
у електродному процесі, рівнянням Нернста:
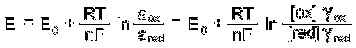
де-стандартний потенціал редокс-системи;універсальна газова постійна,
рівна 8,312 Дж / (моль К);абсолютна температура, К;постійна Фарадея, рівна
96485 Кл / моль;число електронів, що приймають участь в електродної реакції;,
ared - активності відповідно окисленої і відновленої форм редокс-системи;
[Ox], [red] - їх молярні концентрації[2].
Рівняння Нікольського
Рівняння, яке доповнює рівняння Нернста описом впливу активності іонів
(ab), присутніх у розчині крім основних потенціовизначаючих.
Застосовується в іонометрії в наступному вигляді:
φ = φ0 + RT/nF ln(a + K*ab),
де
φ0 - стандартний потенціал (константа);-
коефіцієнт селективності;- універсальна газова постійна;- температура;-
постійна Фарадея[14].
2.
Поняття «мембрана» та її види
Мембраною (від лат. Membrana - пергамент) у фізиці принято називати
еластичну двомірну пластину. Однак у хімії під цим терміном мають на увазі матеріал, звичайно у вигляді тонкого
шару, який грає роль фази, що розділяє дві-інші об'ємні фази. Якщо цей шар
однаково проникний для всіх компонентів примикають до нього фаз, то його еєдиним призначенням є запобігання швидкого
перемішування обох фаз. Таку мембрану називають
діафрагмою. Справжня мембрана повинна володіти певною селективністю до проникнення різних компонентів,
заснованої на її різної проникності. Це і є напівпроникна мембрана. Мембрани, що розділяють два електроліта і не проникні однаковою мірою для
всіх іонів, називають електрохімічними мембранами[21].
Іоноселективні електроди являють собою електрохімічні
датчики, які містять мембрану, що складається, як: правило, з шару твердого
електроліту або з розчину електроліту в розчиннику, не змішується з водою. Така мембрана з обох сторін (іноді
тільки з одного) знаходиться в контакті з водним розчином електроліту[16]. Іоноселектівний електрод має звичайно внутрішній електрод
порівняння, замість якого зрідка
використовують просто металевий контакт або в разі іоноселективного польового
транзистора (ІСПТ) або напівпровідниковий шар. Щоб зрозуміти, що ж відбувається на межі розділу між мембраною і рештою фазами, з
якими вона контактує, необхідно перш за все визначити різні види електричних потенціалів або: різниці
потенціалів, що виникають у таких мембранних систем[4].
.1
Іоноселективні електроди з рідкими мембранами
Різниця електричних потенціалів виникає на межі розділу двох
фаз, з яких принаймні одна містить заряджені частинки (іони, електрони або
навіть диполі) [7].
Мембрани ІСЕ являють собою суцільні фази, підлозі, проникні
для іонів і молекул розчинника розчину, контактуючого з мембраною. Ці фази
можуть бути гомогенними і гетерогенними. Прикладом останніх є полімерна
структура, утворена найдрібнішими, пов'язаними між собою крапельками органічної
рідини, в якій розчинений ионообменник; це рідка полімерна мембрана. Інший
різновид гетерогенних мембран - пористо гідрофільні мембрани з полімерних
матеріалів, в яких знаходяться іонообмінні активні центри з певним електричним
зарядом (іонообмінні мембрани). Мембрани цього типу, хоча і мають достатньо
широке технічне застосування (електродіаліз, мембранний електроліз та ін), не
знайшли поширення в якості мембран ІСЕ[20].
Рідкі мембрани являють собою розчин АК в
органічному розчиннику, не змішується з водою, утримуваний пористої
перегородкою. На відміну від твердих мембран, де активні центри закріплені в
просторі силами хімічного зв'язку, в рідких мембранах органофільние АК рухливі
в мембранної фазі.
Селективність рідких мембран визначається в першу чергу
екстракційними властивостями органічної фази. Як електродно активні речовини
(ЕАР) застосовують іонообмінник. Він повинен відповідати таким вимогам:
· не розчинятися у воді;
· утворювати міцне з'єднання з
потенціал утворюючим іоном;
· мати здатність швидко обмінюватися
іонами з розчином.
Існують катіоно- і аніонообмінниками[5].
Як катіонообмінник застосовують солі з великими органічними
аніонами, наприклад:
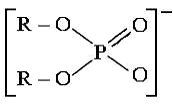
Диалкілфосфат
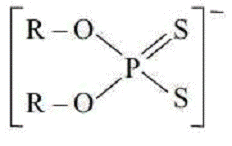
Диалкілдитіофосфат
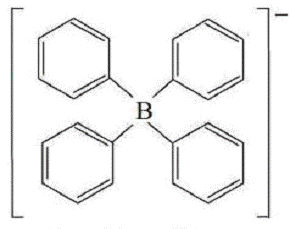
Тетрафенілборат- вуглеводневий радикал.
Роль аніонообмінника виконують солі з великими гідрофобними
катіонами, наприклад:
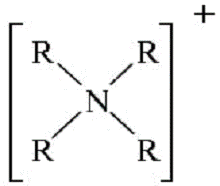
Тетраалкіламоній

Барвник трифенілметиленового ряду
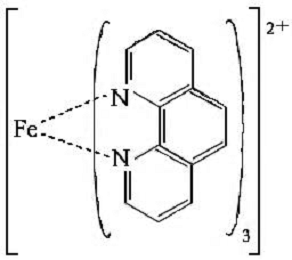
Органометалевий комплекс
Розглянемо принцип дії рідкої мембрани.
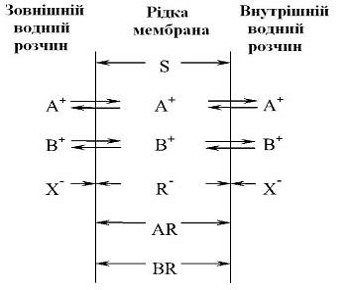
Схема рідкої мембрани
В органічному розчиннику S знаходиться сіль AR (або BR). В
даному випадку великий органічний аніон R розчиняється у воді і не може вийти
за межі мембрани. Його присутність в органічній фазі не дозволяє увійти в
мембрану однойменно з ним зарядженим аніонам Х. Вільно переходять межі фаз
тільки катіони А+ і В+. На відміну від мембран з твердими іонообмінниками на
основі кристалічних солей в рідких мембранах органофільні (гідрофобні)
іонообмінники (R в нашому прикладі) рухливі. Крім того, більш рухливими в
рідких мембранах (у порівнянні з твердими) стають іони А+ і В+, що обмінюються
з водним розчином. При переході з водного розчину в органічний іони А+ і В+
беруть участь у кількох процесах: вони втрачають повністю або частково гідратну
оболонку (процес дегідратації), сольватуються органічним розчинником (процес
сольватації), взаємодіють з аніонами R (процес асоціації) і переміщаються
усередині мембрани . Всі ці процеси впливають на величину мембранного
потенціалу, і саме їх варіювання дозволяє цілеспрямовано впливати на
селективність рідкої мембрани. [6]
Розглянемо як приклад ІСЕ на іон Са2 +. Рідинний ІСЕ - був
створений в 1967 р. Мембрани цих електродів представляли розчин кальцієвої солі
ді-н-децілфосфата в ді-н-октілфенілфосфаті.
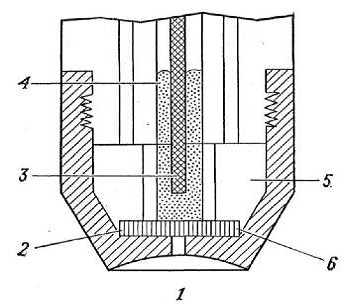
Конструкція кальцій селективного електрода з рідкою
мембраною:
- зовнішній розчин; 2 - пориста мембрана; 3 - хлор срібний
електрод порівняння; 4 - внутрішній водний розчин; 5 - резервуар для рідкого
іонообмінника; 6 - шар рідкого іонообмінника.
Заміна органічного розчинника призводить до зміни іонної
селективності електрода. Наприклад, використання н-деканола замість
диноктілфенілфосфоната забезпечує рівну селективність по відношенню до іонів
Ca2+ і Mg2+. Це дозволяє використовувати даний електрод для визначення
жорсткості води[19].
Електродноактівні речовини мембрани впроваджують в
полівенілхлоридну матрицю. Зазвичай використовують наступні іонофори
(рис.2.3.):
· катіонообмінник - кальцієву (II) сіль
біс(біс(4-(1,1,3,3-тетраметілбутіл)-фенілфосфорной кислоти (ББТФ);
· нейтральний переносник (ЕТН - 1001).
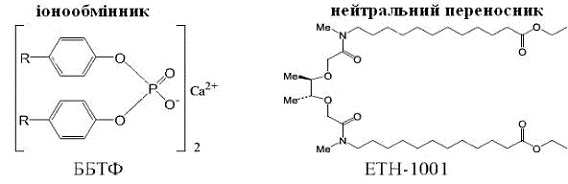
Іонофори, селективні по відношенню до кальцію
Комплексоутворюючим компонентом є аніон фосфорорганічних
кислот. Іонофор ЕТН-1001 називають нейтральним переносником. Ліганд
нейтральний, а комплекс з Ca2+ несе позитивний заряд.
Процес виникнення потенціалів представлений на (рис. 2.4.).
На межі розділу мембрана/розчин відбувається поділ зарядів, що приводить до
утворення міжфазного потенціалу.
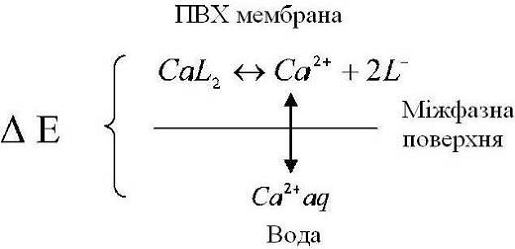
Процес виникнення потенціалів
У разі утворення комплексу кальцію з фосфорорганічною
кислотою відбувається перерозподіл іонів Ca2+ щодо між фазної межі. Цей процес
визначається гідратацією Ca2+. З боку мембрани на між фазному кордоні
залишаються негативно заряджені групи ліганда. Відбувається поділ зарядів, який
призводить до формування міжфазного потенціалу[11].
До рідких близькі пластифіковані мембрани, отримані внаслідок
запровадження рідкого АК в інертну, наприклад полівінілхлоридну, матрицю,
еластичність і механічну міцність якої додає присутність пластифікаторів-ефірів
фталевої, фосфорної, себаціновой та інших кислот. Якщо використовується пластифікована
мембрана, то можна відмовитися від внутрішнього рідинного електрода порівняння.
У цьому випадку платинова, срібна або мідний дріт
покривається плівкою полівінілхлориду (ПВХ), що містить АК-мембрани і
пластифікатор. Рідку активну фазу можна зафіксувати і на
графітової поверхні. Отримані таким чином ІСЕ, в конструкції яких відсутні
рідинна система електрода порівняння, називаються твердоконтактних. Важливу
роль у формуванні потенціалу таких електродів грає матеріал струмовідводу.
Перевагою подібних датчиків є мініатюрність і, отже, можливість аналізу малих
обсягів рідин (близько 0,1 мл) [22].
.2
Рідкі пластифіковані мембрани
До другої половини ХХ-го століття були відомі тільки
електроди з мембранами з силікатних стекол, які дозволяли проводити вимірювання
рН та активності іонів лужних металів. Пізніше з'явилися електроди з мембранами
на основі інших матеріалів: осадів малорозчинних солей, імпрегнованих в полімер
(Е. Пунгор і К. Той), моно-і полікристалів (І. Кольтгофф, Б.П. Микільський, Д.
Росс), халькогенідних стекол ( І. трахтен-берг, Ю.Г. Власов). Ці ІСЕ дозволяли
визначати цілий ряд катіонів та аніонів. Один з найважливіших видів ІСЕ
з'явився наприкінці 1960-х років: це електроди з рідкими мембранами, які
незабаром були модифіковані в полімерні пластифіковані плівки - solvent polymeric membrane electrodes. Такі мембрани являють собою плівки з полівінілхлориду (ПВХ)
або з інших полімерів, насамперед з фотополімерізуемих акрилових, уретанових
або акрілат-силоксанових матеріалів. Ці плівки містять пластифікатори, які
служать також розчинниками для електродноактівних речовин (ЕАВ), зазвичай
званих іонофоров і визначальних вид електродної функції (катионная, аніонна) і
селективність мембран[4]. Полімерні пластифіковані мембрани, що містять
нейтральні і заряджені ио-нофори, поступаються твердотілим (скляним і кристалічним)
по хімічній стійкості, перш за все щодо різних органічних розчинників, а також
щодо термінів служби. З
іншого боку, величезною перевагою полімерних пластифікованих мембран є
колосальна широта можливостей при розробці їх складів. Саме можливість широкої
варіації як виду електродноактівних речовин, так і їх концентрацій в мембранах
визначила створення сенсорів, селективних до багатьох десяткам катіонів та
аніонів, а також сенсорів для потенціометріінейтральних сполук. Для
характеристики практичної значущості цих ІСЕ досить згадати, що вже в середині
1990-х років тільки в США щорічно робилося близько 200 мільйонів клінічних
визначень калію за допомогою калійселектівного електрода з мембраною на основі
валіноміцина[24].
Пластифіковані мембрани за механізмом функціонування принципово не
відрізняються від рідких. Однак введення рідкого іонообмінника в полімерну
матрицю призводить до утворення більш чіткої межі розділу між фазами мембрана -
водний розчин і, отже, до більш стабільній роботі плівкової мембрани і більш
тривалого терміну служби[3].
В плівкових електродах в якості матриці найчастіше
використовують полівінілхлорид, однак застосовують і інші матеріали, зокрема
ацетил целюлозу.
Розчинники, які використовуються при виготовленні плівкових
мембран, повинні:
· не розчинятися у воді;
· мати низький тиск пари і високу
в'язкість;
· забезпечувати здатність визначуваного
іона міцно утримуватися в мембрані;
Конструкція пластифікованих електродів аналогічна конструкції твердих
мембранних електродів, тільки замість твердої мембрани в корпус електрода
вклеєна пластифікована мембрана, а всередину електрода залитий розчин
порівняння.
У електродах з рідкими пластифікованими мембранами розчин іонообмінника укладений
в полімерну плівку і виконує функції пластифікатора.
Виготовляти таку мембрану набагато легше; до того ж на виготовлення витрачається лише незначний обсяг іонообмінного розчину. Коли мембрана перестає функціонувати, її можно
легко замінити. Ці мембрани називають також мембранами з полівінілхлоридної
матрицею[18].
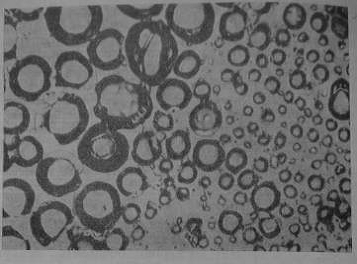
Мікрофотографія зрізу полівінілхлоридної мембрани. (З дозволу
Society of Analytical Chemistry, London.) Пори (затемнені) містять кальцієву
сіль дідецілфосфорной кислоти, розчинену в діоктілфенілфосфонаті.
Ідея застосування полімерної мембрани з іоноселективних
пластифікатором належить Шаткаю, який, досліджуючи мембранні системи, придатні
для виготовлення кальційселектівного електрода, зупинилися як на іонообмінному
розчині на розчині теноілтріфторацетона в трибутилфосфат, укладеному в
полівінілхлоридну матрицю. Така мембрана виявилася, проте, малопридатною для практичних цілей через
недостатню селективності. Кедем запатентував спосіб приготування мембрани з
використанням суміші розчину ацетилцелюлози в ацетоні і розчину відповідного
іонофоров в діметілсебацінате. Після висушування змішаного розчину на скляній
пластинці виходить тонка плівка, яка містить іонофор і пластикатор
в дуже високого ступеня дисперсності. Оскільки катіоний комплекс іонофоров (наприклад,
комплекс калію з валиномицин) заряджений позитивно, полімерна матриця повинна
мати слабкий негативний заряд.
Загальновизнаним є метод отримання рідинних мембран Муді,
Томаса та ін Згідно розробленої ними простій методиці, суміш 0,4 г розчину
іонообмінника і 0,17 г розчину полівінілхлориду в 6 мл тетрагидрофурана
наливають на відполіровану скляну пластинку, на яку для запобігання розтікання
розчину ставлять круглий порожнистий циліндр діаметром 30-35 мм і висотою 30
мм. Замість тетрагідрсфурана іноді використовують ціклогексанон. Суміш
залишають при кімнатній температурі до повного випаровування, накриваючи
циліндр листом фільтрувального паперу, розчин сохне близько двох днів. Товщина
одержуваної мембрани становить близько 0,2 мм. З мембрани вирізують диск
певного розміру (діаметром близько 5 мм), приклеюють його за допомогою розчину
полівінілхлориду в тетрагідрофурані до торця полівінілхлоридної трубки і трубку
вставляють в скляну трубку, отримуючи таким чином корпус електрода. Електрод заповнюють внутрішнім
розчином і постачають внутрішнім електродом
порівняння[21].
2.3
Способи виготовлення іоноселективних електродів з полімерними пластифікованими
мембранами
Пластифіковані мембрани можуть містити також фіксовані
іонообмінні центри. Піддвали хлорметилірованню смолу амберліт XAD-2, що представляє собою
поперечно-зшитий сополімер стиролу і дивинил-бензолу макросетчатого типу. Потім
шляхом обробки хлорметилірованної смоли діметилтетрадеціламіном отримували в
ній четвертинні амонієві групи. Отриманий електродно-активний матеріал переводили в хлоридну,
нітратну або перхлоратних форму і насичували його нітробензолом. Присутність гідрофобних іонообмінних центрів і
неводного розчинника надає мембрані зовсім іншу селективність порівняно з
селективністю гідрофільних іонообмінних мембран. Кейл та ін фосфорильований сополімер вінілхлорида і вінілацетату (VAGH) за допомогою
децілдігідрофосфата, переводили продукт реакції в кальцієву сіль і змішували її
з діоктилфенілфосфонатом і полівінілхлоридом.
Отримана мембрана не має яскраво виражених переваг перед мембранами звичайних
кальційселектівними електродами. Ебдон та ін прищеплювали тріаллілфосфат до
полівінілхлориду або сополімери VAGH, фосфорильований сополімер після
часткового гідролізу перетворювали на кальцієву сіль і виготовляли з неї
полімерну плівку без наповнювача або з рідким наповнювачем на основі
іонообмінника фірми Orion (марки Orion 92-20-02). Описаним способом автори
отримували іоноселективні електроди з досить хорошими властивостями, проте не кращими, ніж у
електродів зі звичайними рідинними полімерними мембранами.
Описаний вище електрод розроблено також з пластикової плівковою
мембраною, яка не стикається безпосередньо
з графітовим стрижнем, а відокремлена від нього шаром рідини, насиченої хлоридом калію, ртуттю і хлориду ртуті (I) (у
разі валіноміцинового калійселектівного електрода) [16].
Електроди типу покритого
дроту містять пластикову мембрану, нанесену безпосередньо на металеву проволоку
(спочатку платинову, але пізніше було показано, що для цієї мети цілком
підходить і мідний дріт).
Для виготовлення цього простого електрода досить зняти, ізоляцію з
коаксіального мідного кабелю і звільнити мідну жилу від ізоляційного шару на
довжину приблизно 2см. Далі дріт ретельно очищають, висушують і кілька разів
занурюють на глибину 1 см в суміш розчинів
полівінілхлориду та пластифікатора (за складом змішаний рас-твор близький до
використовуваного для отримання рідинних полімерних мембран). Цю операцію
повторюють доти, поки на кінці дроту не утворюється кулька мембранного
матеріалу діаметром близько 2мм. Після кожного занурення дроті дають обсохнути
у вертикальному положенні близько 2 хв. Електрод залишають сушитися на ніч і
потім дріт (за винятком мембранного шару) ізолюють. З точки зору електрод
ноактивних властивостей мембрани важливим є вибір типу та кількості пластифікатора, оскільки при недостатній
кількості останнього не вдається
домогтися зниження температури склування полімеру нижче рівня звичайної кімнатної
температури лабораторії. В іншому випадку мембрана не буде добре функціонувати.
Потім електрод витримують ніч в 0,1М розчині солі визначається іона. При
постійному неналежного використання зберігати електрод можна в тому ж розчині,
насиченому іонооб-ником. За іншим способом електрод зберігають просто на
повітрі.
Для серійних медико-клінічних аналізів запропоновані дискові ІСЕ такого
типу[22].
2.4
Приклади іоноселективних електродів з полімерними пластифікованими мембранами
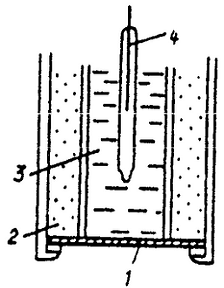
Іоноселектівний електрод з рідкою мембраною (з рухомим носієм.
- мембрана.
- ионит.
- внутрішній стандартний розчин.
- внутрішній електрод порівняння.
Сучасні конструкції подібних електродів виконують на основі
пластифікованих мембран. Для їх виготовлення електродно-активна речовина
змішують у визначених пропорціях з органічним розчинником і пластифікатором, з
отриманої плівки вирізують диск потрібного діаметру і приклеюють до тефлоновому
корпусі[25].
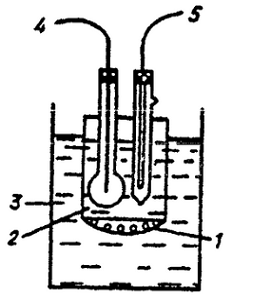
Газоселектівний електрод для визначення NH3.
-гідрофобна газопроникна мембрана.
- внутрішній розчин електроліту.
- аналізований розчин.
- NH3 - селективний електрод.
5-електрод порівняння
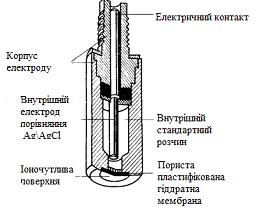
Калійний електрод
Калійний електрод фірми «Оріон», являє собою електрод з
рідкою мембраною, призначений для визначення концентрації калію у водних
розчинах і біологічних рідинах. Використовується з відповідним електродом
порівняння.
Електрод, конструкція якого представлена на рис, має змінний модуль з
пластифікованої мембраною, до складу якої входить рідкий селективний іонообменник. При контакті мембрани з
розчином, що містить іони калію, на розділі фаз мембрана - розчин виникає
різниця потенціалів, величина якої залежить від концентрації калію в розчині[14].
.5 Вплив
вмісту матриці на вибірковість ІСЕ
Літературні дані свідчать, що іонна проникність плівкових
електродів визначається природою електроднеактивної речовини та мембранного
розчинника - пластифікатора, а матриці ( найчастіше, полівінілхлоридній)
відводиться роль інертного структурованого елемента. З такого підходу випливає,
що електродні властивості ІСЕ повинні бути однаковими, незалежно від кількості
полімерного зв’язуючого у складі мембрани. Проте, є відомості про зростання
невідповідності характеристик плівкових електродів у результаті зміни катіонної
функції ІСЕ на аніонну чи змішану по мірі збільшення співвідношення полімерний
матеріал: пластифікатор, що вказує вплив матриці на вибірковість плівкових
мембран. Ймовірно, що цей вплив зумовлений зміною вільних енергій
пересольватації із зміною складу мембрани.
Деякі електродні властивості ІСЕ залежать також від природи полімерного матеріалу, що
використовується. Показано, що гідратцелюлозна матриця здійснює диференціюючий
вплив на іонний транспорт катіонів через мембрану порівняно з ПВХ-матрицею. Це
можна пояснити нуклеофільними властивостями полімеру гідрату целюлози, зумовленими
наявністю атомів оксисену, здатних до утворення водневих зв’язків з атомом
гідрогену гідратованого катіона органічної основи більшою мірою, ніж атомів хлору в полівінілхлориді.
Таким чином, припущення про інертність матриці у кожному конкретному випадку
вимагає відповідної перевірки. З цією метою були
співставлені електрохімічними характеристики плівкових
електодів з різним вмістом полімерного матеріалу у складі мембрани. Як ЕАР використовувало
синтезовані асоціати похідних триазинового ряду
з ГПА (PMo12O403-,SiMo12O404-,GaMo2W10O405-).
Полівінілхлоридні мембрани, пластифіковані розчинниками
різної полярності (ДОФ, ДБФ, ТКФ, НБ), виготовляли за методикою, змінюючи
співвідношення ПВХ:пластифікатор від 0.5:3.0 до 1.5:3.0 за масою, при цьому
маса полімерного зв'язуючого мембрани варіювалася в діапазоні 0.225-0.675 г з
інтервалом 0.045 г, маса пластифікатора залишалася постійною і становила 1.35
г.
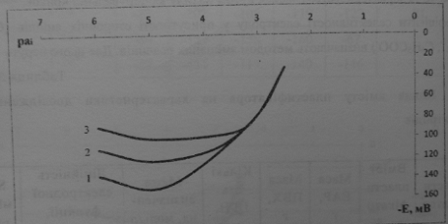
Графіки залежності потенціалу досліджуваних ІСЕ від концентрації
органічних основ мають класичний вигляд (рис.3.4). Електроди мають катіонну
функцію з нахилами, досить близькими до теоретичного для однозарядного катіона,
незалежно від кількості ПВХ у складі мембрани (табл.3.1). ІСЕ не демонструють відгук на ГПА, залежність ЕІСЕ
від СГПА нелінійна, і значення потенціалу електрода в розчинах ГПА лежать в
діапазоні більш від’ємних значень Е, ніж для того ж ІСЕ у розчинах триазинових
препаратів. Встановлено відсутність залежності аніонної чи змішаної функції
електродів від співвідношення ПВХ:пластифікатор, отже впливу матриці на
вибірковість плівкових мембран не спостерігається. Непрямим підтвердженням
такого припущення є близькість електродних параметрів досліджуваних ІСЕ по мірі
збільшення ПВХ:пластифікатор. [3]
Мал.3.4. Залежність електродних функцій ІСЕ на симазин від співвідношення матриця:пластифікатор (ГШХ:ТКФ)
1 -0.5:0.3; 2 -1.0:3.0; 3 - 1.5:3.0.

Залежність електродних функцій ІСЕ на симазин від співвідношення матриця:пластифікатор (ГШХ:ТКФ)
Електродні властивості ІСЕ, оборотних до симазину, з різним вмістом
полімерного матеріалу у складі мембрани

2.6 Вплив вмісту пластифікатора на
основні електрохімічні характеристики
ІСЕ, оборотного до аніону калієвої солі 3-(5-метил-1,2,4- триазоло[4,3-а] хінолін)-пропанової кислоти.
На електродні характеристики ІСЕ істотно впливає концентрація
пластифікатора у мембрані. Для того, щоб судити про оптимальний вміст ДОФ (є =4,13) у мембрані, знято калібрувальні
криві досліджуваних мембран із різним вмістом ДОФ (40 %, 50 %, 60 %, 65 %, 70
%).
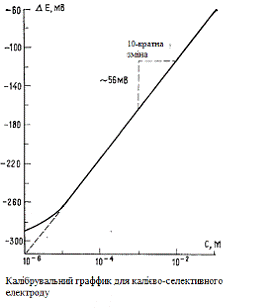
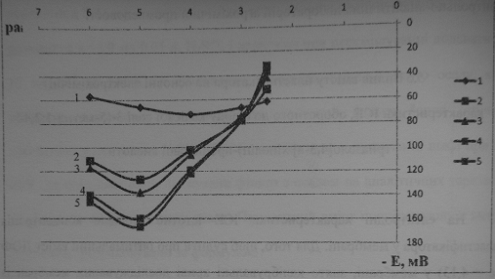
Потенціал (Е) ІСЕ в розчинах з концентрацією 10-6- 5*10-3, з різним вмістом пластифікатору (40-70% ДОФ).
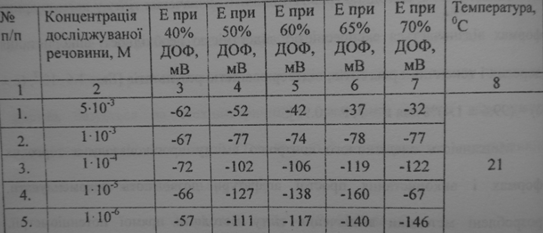
Вплив вмісту ДОФ на електродний потенціал мембран (6% ЕАР)
(1 - вміст пластифікатора 40 %; 2 - вміст пластифікатора 50 %; 3 - вміст
пластифікатора 60 %; 4 - вміст пластифікатора 65 %; 5 - вміст пластифікатора 70%)
Електродні характеристики ICE з різним вмістом пластифікатора наведено у
таблиці 3.5 з якої видно, що кращі характеристики
мають електроди з більшим вмістом пластифікатора (65-70 %).
Як бачимо, вже при вмісті 65 % у мембрані концентрація ДОФ веде до
збільшення чутливості з досить великим кутом нахилу калібрувальної кривої. При
вмісті 70 % спостерігаються найкращі електродні характеристики щодо крутизни,
при чому числове значення електродних функцій відповідає теоретичному значенню
нерстівської функції для однозарядних іонів. Вміст ДОФ 40 % характеризується
малим кутом нахилу калібрувальної кривої. Коефіцієнти селективності електроду у
присутності сторонніх аніонів (Cl-, PO43-, C6H5COO-) визначають методом змішаних
розчинів.
Вплив вмісту пластифікатора на характеристики досліджених електродів
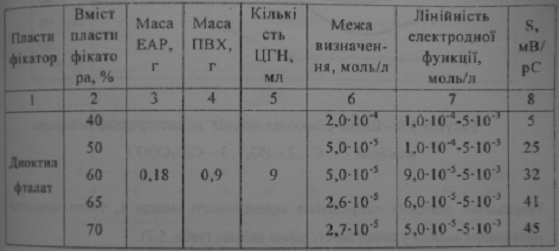
Для цього беруть серію розчинів порівняння NаА з концентраціями 55*10-3, 1*10-3,1*10-4,
та використовуючи як фоновий електроліт 10-3 М розчини KCl, Na3PO4-*12H2O,C6H5COONa. Будують градуювальний графік (рис.
3.8) в координатах Е - рА і знаходять концентрацію, відповідну відхиленню
електродної функції від прямолінійної залежності. Розраховують коефіцієнт
селективності по формулі:
Kj,i пот = 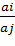
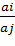
Де ai,aj- активність основного
і стороннього іонів відповідно, що відповідають точці перегину на графіці
залежності Е - рА. [12]
Вплив сторонніх аніонів на електродний потенціал мембран (KCl, Na3PO4-*12H2O, C6H5COONa )
іоноселективний електрод
мембрана
Висновки
1. Іоноселективні електроди застосовують не тільки в
хімічній промисловості, але і в медицині. Володіючи рядом достоїнств, електроди
не позбавлені недоліків, так як деякі електроди не можуть бути використані в
присутності певного виду іонів (наприклад пластифіковані іоноселективні
електроди).
2. Іоноселективні електроди (ІСЕ) мають ряд наступних безперечних переваг:
а ) вони не роблять впливу на досліджуваний розчин;
б) портативні;
в) придатні як для прямих визначень , так і в якості індикаторів у
титриметрі;
г) недорогі.
3. У електродах з рідкими пластифікованими мембранами розчин
іонообмінника укладений в полімерну плівку і виконує функції пластифікатора. Виготовляти таку
мембрану набагато легше; до того ж на виготовлення витрачається лише незначний обсяг іонообмінного
розчину.
4. Електроди з полівінілхлоридною плівковою мембраною
значно
розширюють можливості сучасної іонометрії при аналізі аніонів
та катіонів. Іонометричне визначення ряду іонів можливо тільки за допомогою
електродів з пластифікованими мембранами.
Перелік
посилань
1. Базель
Я.Р. Електродноактівние речовини на основі іонних асоціатів з катіонними
барвниками в іонометрії / Яросла́в Рудо́льфович Ба́зель // Журі аналитичної
хімії. . - 2002, №12. - С. 1252 - 1256.
2. Болотов
В. В. Аналітична хімія/ Валеоій Вікторович.Болотов - Х.: НФАУ Золоті сторінки,
2001. - 114 с.
. Васильєв
В.І. Аналітична хімія. у 2 т. Т. 2.: Фізико-хімічні методи аналізу. - М. :
Дрофа, 2007. - 383 с.
. Дарст
Р. Іонселективні електроди/ пер. з англ.: А. А. Белюстіна. - К.: Хімія, 2001. -
260 с.
5. Досон
Р. Мембрани/ Р. Досон // Інформаційно-аналітичний журнал. - 2008. - №4. - 115
с.
. Еггінс
Б. Хімічні та біологічні сенсори/ Б.
Еггінс. - М.: Техносфера, 2005. - 235с.
Володимирович
Єгоров// Російський хімічний журнал. - 2008. - № 2. - С. 37.
. Камман
К. Робота з іоноселективними електродами / пер. з нім. : А. Ф. Жукова. -
М. : МИР, 1980. - С. 53-61.
9. Келіна
Н. Ю. Аналітична хімія в таблицях і схемах/ Ніна Юрівна Келіна. - Х.: Фенікс,
2008. - 120 с.
10. Кельнер Р.
Т.1: Аналітична хімія/ пер. з англ.: Борзенко А.Г.- М.: Мір-Аст, 2004
<http://rushim.ru/books/analitika/kelner1.djvu>. - 607 с.
. Корита І.,
Штулік К. Іонселектівні електроди/ пер. з чеського: М.: Світ, 1989. - 272 с.
. Лакшимінараянайах
Н. Мембранні електроди/ пер. з англ.: А. А. Белюстіна. - К.: Хімія, 1979. - 360
с.
. Луганська
О.В. Електрохімічні та аналітичні характеристики іоноселективних електродів,
оборотних до біологічно активних речовин: монографія / О.В. Луганська, Л.О.
Омельянчик, Д.С. Коваленко- Запоріжжя: Запорізький національний університет,
2011. - 226 с.
. Нікольський
Б. П. Іоноселективні електроди./Борис Петрович Нікольський, Е. А. Матерова - Л.: Хімія,1980.
- С. 144-148.
15. Харітонов Ю.
Я. Аналітична хімія/ Юрій Ярославович Харітонов - М. : Гэотар-медіа, 2009. -
274 с
16. Харитонов C.B..
Іоноселективні електроди для визначення лікарських речовин /Сергій Володимирович Харитонов // Успіхи хімії. - 2007, №4. - С.398
- 431.
17. Хаханіна Т. І.
Аналітична хімія. Навчальний посібник/ Тетьяна Іванівна Хаханіна - М.: Вища
освіта, 2009. - 240 с.
. Шведене Н.В.
Іоноселективні електроди /Наталя Вікторівна Шведене // Соросівський освітній
журнал. - 1999. - №5. - С.
60-65.
. Шевчук І.А. Іоноселективні
електроди в аналізі природних і промислових об'єктів. Навчальний посібник./Ігор Артемович Шевчук, Тетяна
Миколаївна Сімонова - Д.:
«Нордкомпьютер», 2007. - С. 35-44.
20. Bedlechowicz
I., Sokalski T., Lewenstam A., Maj-Zurawska M. // Sens. Act. B. 2009. V. 108. №
6. P. 836.
21. Büchi
R., Pretsch E., Morf W. et al. 13C-Kernresonanzspektroskopishe und
elektromotorische
Untersuchungen der Wechselwirkung von neutralen Carriern mit Ionen in Membranen
Helv. Chim. Acta. - 2012. - V. 59. - N 7. - P. 2407-2416.
. Vigassy
T., Gyurcsanyi R.E., Pretsch E. // Electroanalysis. 2010. V. 15. № 5-P. 375.
23. Girault
H.H., Schiffrin D.J. Thermodynamics of a polarised interface between two immiscible electrolyte solutions
J. Electroanal. Chem. - 2011. - V. 170. - N 1/2. -P. 127-141.
. Morf
W.E. The Principles of Ion-Selective Electrodes and of Membrane
Transport.
Budapest: Akademiai Kiado, 2013. P. 296.