Окисление щавелевой кислоты перманганатом калия
Введение
Катализ - изменение скорости химической реакции
при воздействии веществ (катализаторов), которые участвуют в реакции, но не
входят в состав продуктов. Катализатор не находится в стехиометрических
отношениях с продуктами и регенерируется после каждого цикла превращения
реагентов в продукты. Он не смещает положения равновесия химической реакции и
вблизи от равновесия ускоряет прямую и обратную реакции в равной степени.
Автокатализом называется явление, когда
каталитическое действие на реакцию оказывает какой-либо из её продуктов.
Целью нашей работы являлось изучение зависимости
константы скорости k
автокаталитической реакции окисления щавелевой кислоты перманганатом калия от
температуры и определение энергии активации данной реакции.
ЛИТЕРАТУРНЫЙ ОБЗОР
окисление реакция химический скорость
Автокаталитические реакции.
Автокаталитическая реакция - реакция, в которой
один из её продуктов служит катализатором превращения исходных веществ.
Для автокаталитической реакции характерно, что
процесс идёт при возрастающей концентрации катализатора. В начальный период
реакции, в период индукции, скорость реакции неизмеримо мала, затем она
возрастает и лишь при достижении значительной степени превращения начинает
падать в результате убыли концентрации исходных веществ. В результате
кинетическая кривая для продукта реакции имеет S-образный
вид (рис. 1), подобно кинетической кривой продукта двух последовательных
реакций.
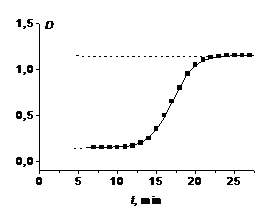
Рис. 1. Кинетическая кривая изменения оптической
плотности продукта автокаталитической реакции
Чтобы процесс мог развиться по
автокаталитическому пути, в системе с самого начала должен присутствовать
продукт реакции. Он может быть специально внесён экспериментатором (начальная
затравка) или образовываться без участия катализатора.
В простейшем случае реакции первого порядка по А
и В скорость образования продукта превращения равна
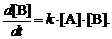 (1)
(1)
Обозначая через x прирост [B] в
результате реакции, т. е. полагая x = [B] - [B]0, и
учитывая, что прирост [B] равен убыли [A], получаем
следующее выражение:
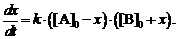 (2)
(2)
Уравнение такого же вида получается в случае,
если никакой затравки в систему не вносится, но параллельно с
автокаталитическим превращением идёт некаталитическое превращение А в В по
реакции первого порядка. В этом случае
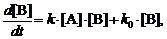 (3)
(3)
откуда
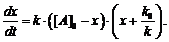 (4)
(4)
Интегрирование уравнения (2) дает
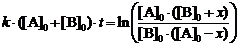 (5)
(5)
или в виде, разрешенном относительно
х,
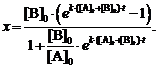 (6)
(6)
Если ввести безразмерные переменные 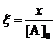 ,
,  , то
уравнение (6) примет вид
, то
уравнение (6) примет вид
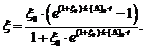 (7)
(7)
Если экспериментально получена
кинетическая кривая автокаталитической реакции, следующей уравнению (2), то для
вычисления константы скорости k пользуемся уравнениями (6 ,7).
Если [В]0 << [A]0, тогда
соотношение (7) записываем в виде
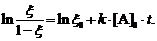 (8)
(8)
Построив графически зависимость 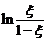 от t, по наклону
полученной прямой линии можно определить k×[A]0 и k.
от t, по наклону
полученной прямой линии можно определить k×[A]0 и k.
Окисление щавелевой кислоты перманганатом калия.
Автокаталитической реакцией является окисление
щавелевой кислоты перманганатом калия.
Эта реакция протекает по сложному
механизму, лимитирующей стадией которого является взаимодействие 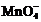 с ионом
с ионом 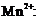 Где
лимитирующей стадией сложной химической реакции является та простая реакция,
константа скорости, которой оказывает наибольшее влияние на общую скорость
сложной реакции
Где
лимитирующей стадией сложной химической реакции является та простая реакция,
константа скорости, которой оказывает наибольшее влияние на общую скорость
сложной реакции
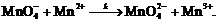 (9)
(9)
Образовавшийся ион Mn3+ далее
окисляет щавелевую кислоту с образованием CO2 и Mn2+:
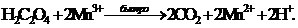 (10)
(10)
Последний процесс, по-видимому,
является двустадийным.
Учитывая тот факт, что помимо Mn2+ в реакции
образуется MnO2, в системе
протекает диспропорционирование 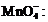
 (11)
(11)
Таким образом, записываем вероятную
брутто-реакцию:
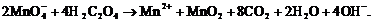 (12)
(12)
Скорость реакции равна скорости
лимитирующей стадии (9) и пропорциональна произведению концентраций одного из
исходных веществ [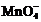 ] на
концентрацию одного из продуктов [Mn2+]. Поэтому
скорость реакции описывается уравнением, подобным уравнению (2):
] на
концентрацию одного из продуктов [Mn2+]. Поэтому
скорость реакции описывается уравнением, подобным уравнению (2):
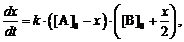
интегрирование которого даст
выражения:
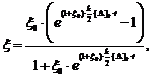 (13)
(13)
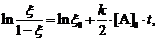 (14)
(14)
где 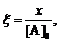
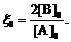
В отсутствие начальной затравки Mn2+ реакция
протекает со значительным временем индукции, это обусловлено протеканием
медленной некаталитической реакции окисления щавелевой кислоты с образованием Mn2+. При
использовании исходной затравки Mn2+ время индукции существенно
уменьшается.
Кинетику этой реакции изучают
спектрофотометрическим методом. Конечный продукт реакции - MnO2,
образующийся в виде мелкодисперсной взвеси, имеет интенсивную полосу поглощения
в видимой области спектра с центром при ~ 400 нм, за его образованием следят на
длине волны 430 нм, при этом значение коэффициента экстинкции исходного 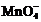 в этой
области мало.
в этой
области мало.
При наличии в растворе двух
поглощающих форм (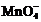 и MnO2)
оптическая плотность раствора равна
и MnO2)
оптическая плотность раствора равна
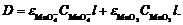 (15)
(15)
До начала реакции величина
оптической плотности определяется начальной концентрацией 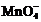 (С0):
(С0):
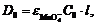
по окончании реакции после полного
превращении 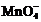 в
в 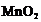 и Mn2+
оптическая плотность равна
и Mn2+
оптическая плотность равна
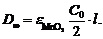
Отсюда 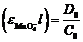 и
и 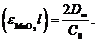
Подставляя эти выражения в уравнение
(15), имеем
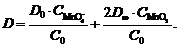 (16)
(16)
Учитывая, что 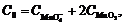 получаем
получаем
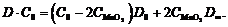 (17)
(17)
Преобразовывая, имеем
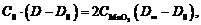 (18)
(18)
откуда
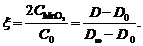 (19)
(19)
Поэтому, регистрируя зависимость оптической
плотности раствора от времени, получаем кинетическую кривую накопления MnO2
в результате автокаталитической реакции.
Экспериментальная часть
Реагенты:
- щавелевая кислота
(H2C2O4∙2H20)
- готовый 0.2 N
раствор перманганата калия (KMnO4);
- хлорид марганца (II)
(MnCl2∙4H2O);
Оборудование:
- 3 мерные колбы на 100 мл и одна на
250 мл
- пипетки
- весы
- секундомер
- спектрофотометр UV-mini-1240
Shimadzu
- кварцевая кювета на 1мм
Приготовление рабочих растворов в мерных колбах
на 100 мл:
№ 1 0.015 М щавелевая кислота
№ 2 0.0075 М перманганат калия
№ 3 0.0025 М хлорид марганца (II)
Подготовка раствора для спектрофотометрии:
Исследования проводились при температурах 25 °C,
30 °C, 35 °C,
40 °C , каждый раствор
должен термостатироваться до нужной температуры. Затем в колбу на 250 мл
налить ̴
200 мл дистиллированной воды и по 5 мл рабочих растворов № 1 и №3. Последним
добавить 5 мл рабочего раствора № 2, после приливания сразу включить
секундомер. Довести раствор до метки, перемешать. Таким образом, концентрации
растворов в реакционной колбе будут:
щавелевой кислоты 0.0003 М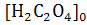 ,
,
перманганата калия 0.00015 М 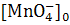 ,
,
хлорида марганца 0.00005 М 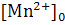 .
.
Налить полученный раствор в кювету, поместить её
в спектрофотометр, затем одновременно начать запись кинетики реакции и
остановить секундомер, записать время. После окончания регистрации кинетики
перенести данные в компьютер.
Обработка данных в Origin.
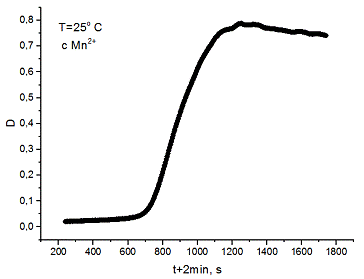
1. Полученные данные представляют таблицу
времени (t, c)
и оптической плотности (D).
Нужно изменить столбик со временем, прибавив ко всем значениям время засечённое
секундомером. Таким образом, можем построить график зависимости оптической
плотности от раствора.
. Оптическая плотность в ходе реакции
повышается из-за образования коричневого осадка MnO2.
На начальном участке (0-200 с) кривая возрастает слабо, происходит накопление
автокатализатора Mn2+,
и при достаточной его концентрации реакция идёт намного быстрее. Далее кривая
выходит на плато, значение которого фиксируется как D∞
- максимальная оптическая плотность. Здесь заканчивается реакция. Затем
начинают собираться более крупные частицы осадка, которые мешают правильной
регистрации оптической плотности, поэтому последний участок не представляет
интереса.
. Далее для обработки понадобится
вычислить значение
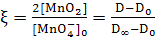 .
.
Для этого берм начальное и максимальное значения
оптической плотности, D
- текущее значение.
Последняя четвертая добавочная
колонка содержит значение 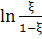
4. Далее были построены графики ξ
- t, 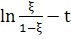 , и аппроксимированы
по формулам
, и аппроксимированы
по формулам
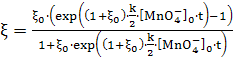
для первого графика и 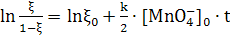 для
второго.
для
второго.
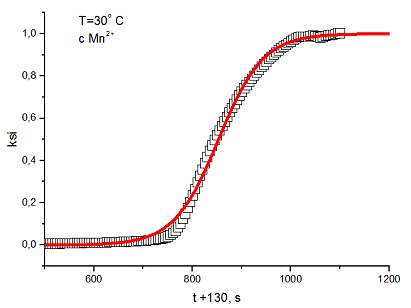
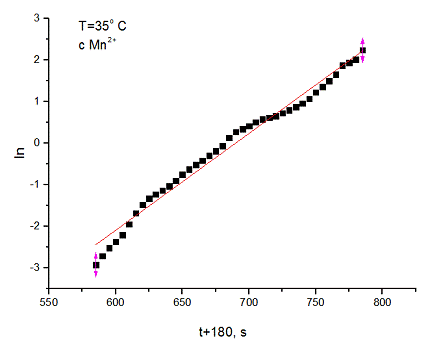
5. Вычисленные значения константы скорости
реакции, полученные разными способами
|
T, °C
|
ξ
- t
|

|
|
25
|
171 ± 3
|
168 ± 1
|
|
30
|
303 ± 8
|
295 ± 5
|
|
35
|
311 ± 7
|
304 ± 5
|
|
40
|
385 ± 4
|
347 ±5
|
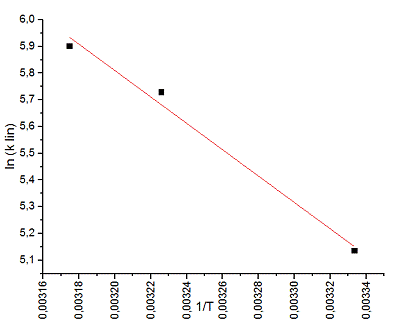
. Далее можем высчитать энергию активации
автокаталитической реакции. Для этого строим график 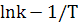 и
из значения наклона находим Ea
и
из значения наклона находим Ea
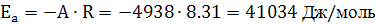
Результаты и выводы
(25° C)
= 170 ± 3 л/моль*с
k(30° C)
= 299 ± 9 л/моль*с
k(35° C)
= 308 ± 9 л/моль*с
k(40° C)
= 366 ± 6 л/моль*с
Ea = 41 ± 4
кДж/моль
ВЫВОДЫ
Была получена температурная зависимость
константы скорости автокаталитической реакции и определена энергия активации
данной реакции, Ea
= 41 ± 4 кДж/моль
СПИСОК ЛИТЕРАТУРЫ
1. Эмануэль
Н. М., Кнорре Д. Г. Курс химической кинетики, 4-е изд., М.: Высш. шк., 1984.
. Практикум
по физической химии НГУ Химическая кинетика Под редакцией В.А.Рогова, В.Н.
Пармона, Новосибирск, 2013