Измерение физико-химического состава веществ
Министерство
образования и науки Российской Федерации
ФГАОУ ВПО
«УрФУ имени первого Президента России Б.Н.Ельцина»
Институт
материаловедения и металлургии
Кафедра
метрологии, стандартизации и сертификации
Реферат на
тему:
«Измерение
физико-химического состава веществ»
По
дисциплине «Методы и средства измерения и контроля»
Преподаватель А.В. Матюхина
Студент гр. МтЗ-411102 А.В. Еремина
г.
Екатеринбург , 2015
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
. ОБЩИЕ СВЕДЕНИЯ
1.1 Особенности измерения состава
веществ и материалов
.2 Классификация методов
аналитической химии
2. ПРИЁМЫ ОПРЕДЕЛЕНИЯ НЕИЗВЕСТНОЙ
КОНЦЕНТРАЦИИ В ИНСТРУМЕНТАЛЬНЫХ МЕТОДАХ АНАЛИЗА
.1 Метод градуировочного графика
.2 Метод стандартов (метод молярного
свойства)
.3 Метод добавок
2.4 Инструментальное титрование
. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
3.1 Кондуктометрия
.2 Потенциометрия
.3 Вольтамперометрия
4. СПЕКТРОСКОПИЧЕСКИЕ И ДРУГИЕ
ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
.1 Атомные эмиссионные спектры.
Эмиссионная фотометрия пламени
4.2 Молекулярные абсорбционные
спектры. Методы молекулярного абсорбционного анализа
4.3 Нефелометрия и турбидиметрия
4.4 Рефрактометрия
5. МЕТОДЫ РАЗДЕЛЕНИЯ И
КОНЦЕНТРИРОВАНИЯ
.1 Ионный обмен
5.2 Хроматографические методы
анализа
ЗАКЛЮЧЕНИЕ
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
ВВЕДЕНИЕ
Несмотря на то, что
методы обычного химического анализа позволяют устанавливать состав самых сложных соединений, в
некоторых случаях они все же оказываются недостаточными. Обусловлено это тем,
что для установления состава путем химического анализа необходимо прежде всего выделить изучаемое вещество в индивидуальном состоянии. Если такое выделение
почему-либо невозможно, то неприменимыми становятся и методы химического
анализа.
Большую помощь
могут в подобных случаях оказать физические методы исследования. Тщательно
изучая ход изменения физических свойств той или иной системы по мере изменения
ее состава или внешних условий, часто удается не только обнаруживать само
наличие в ней химических превращений, но и следить за протеканием последних и
получать определенные указания относительно их характера и состава образующихся
продуктов. Обнаружение и изучение происходящих в системе химических изменений
путем исследования ее физических свойств и составляет предмет
физико-химического анализа. Обобщенная трактовка физико-химического анализа как
самостоятельной научной дисциплины была дана Н. С. Курнаковым (1913 г.).
. ОБЩИЕ СВЕДЕНИЯ
.1 Особенности измерения состава веществ и
материалов
Основной отличительной особенностью
физико-химических измерений является важная роль процесса подготовки пробы к
анализу. При хранении пробы, при ее транспортировке от места забора к
аналитическому прибору и в самом процессе анализа возможны самые разнообразные
трансформации состава. К таким трансформациям могут привести изменения
температурного режима, изменения влажности, давления. Важным моментом является
так называемое влияние третьей компоненты на результат анализа. В химии хорошо
известен каталитический эффект - то есть влияние на скорость химических реакций
веществ, не участвующих в химических превращениях, но изменяющих скорость их
протекания, а в ряде случаев определяющих конечный результат химической
реакции.
В ряде случаев необходимая информация о составе
вещества может быть получена только с использованием измерения нескольких
свойств, например, массы и теплопроводности или массы и показателя преломления.
Возможность определять состав веществ и
материалов по различным свойствам отражается на методах оценки систематических
погрешностей. В самом деле, использование различных уравнений измерения для
определения одной и той же величины, например концентрации какого-либо
компонента в смеси газов, жидкостей или твердых тел позволяет с большей
степенью достоверности определять состав вещества.
Еще одной отличительной особенностью
физико-химических измерений является разнообразие методов и приборов для
определения микроконцентраций и макроконцентраций одного и того же компонента в
определенной среде. Под этим термином здесь подразумевается, что в зависимости
от относительного содержания компонента в смеси нужно использовать в ряде
случаев совершенно разные подходы.
1.2 Классификация методов аналитической химии
Принцип определения химического состава вещества
любым методом сводится к тому, что состав вещества определяется по его
свойствам.
Любое свойство вещества, которое можно
использовать для установления качественного или количественного состава
объекта, называется аналитическим сигналом. Все методы аналитической химии
основаны на получении и измерении аналитического сигнала.
В зависимости от принципа получения
аналитического сигнала все методы аналитической химии делятся на 3 основные
группы:
. Химические методы анализа.
. Физические методы анализа.
. Биологические методы анализа.
Кроме того, различают ещё 3 группы комбинированных
(переходных) методов анализа:
1. Физико-химические методы анализа основаны на
измерении физических свойств веществ, которые появляются или изменяются в
результате химических реакций. При этом сначала проводят реакцию, а затем
измеряют физическое свойство продукта реакции или используют измерение
физического свойства в ходе реакции для установления конечной точки титрования.
. Биофизические методы анализа.
. Биохимические методы.
По физическим свойствам анализируемой среды
физико-химические измерения делятся на: анализ состава газов, анализ состава
жидкостей и анализ состава твердых тел.
Применяются также
физико-химические способы анализа: колориметрия (изменение интенсивности
окраски цветного соединения, получаемого по аналитической реакции), турбудиметрия,
нефелометрия (изменение интенсивности света, проходящего через суспензию
осадка, полученного в результате аналитической реакции, или рассеянного им),
полярографические и адсорбционные методы.
Химические методы анализа иначе называют
классическими, а физические и физико-химические методы анализа -
инструментальными, так как проведение анализа с привлечением этих методов
невозможно без использования измерительной аппаратуры.
Наибольшее значение имеют следующие группы
инструментальных методов анализа:
спектральные и другие оптические методы анализа,
основанные на измерении оптических свойств и различных эффектов, наблюдаемых
при взаимодействии вещества с электромагнитным излучением.
электрохимические методы анализа, основанные на
измерении электрических параметров.
хроматографические методы анализа, основанные на
использовании сорбции в динамических условиях, применяются для разделения и
анализа однородных многокомпонентных смесей.
. ПРИЁМЫ ОПРЕДЕЛЕНИЯ НЕИЗВЕСТНОЙ КОНЦЕНТРАЦИИ В
ИНСТРУМЕНТАЛЬНЫХ МЕТОДАХ АНАЛИЗА
Для определения неизвестной концентрации
вещества по величине аналитического сигнала химики-аналитики используют
несколько прямых и косвенных приёмов, общих для всех физических и
физико-химических методов анализа.
.1 Метод градуировочного графика
Метод градуировочного графика - это графический
приём нахождения неизвестной концентрации (Сх) по величине аналитического
сигнала пробы (Iх). Для проведения анализа готовят серию стандартных растворов,
измеряют величины аналитического сигнала этих растворов и строят градуировочный
график I = f(C). Затем в точно таких же условиях измеряют аналитический сигнал
пробы Iх и по графику определяют концентрацию анализируемого вещества в пробе
Сх.
.2 Метод стандартов (метод молярного свойства)
Метод стандартов - это расчётный приём
нахождения неизвестной концентрации. Он имеет две разновидности:
а) Метод одного стандарта. Для проведения
анализа готовят один стандартный раствор с концентрацией определяемого вещества
Сст, затем измеряют величины аналитического сигнала этого раствора (Iст) и
пробы (Iх) в одинаковых условиях.
Неизвестную концентрацию рассчитывают по
формуле:
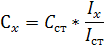
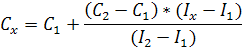
.3 Метод добавок
Сущность метода добавок заключается в том, что
сначала измеряют аналитический сигнал пробы (Iх), а затем - аналитический
сигнал той же пробы с добавкой стандартного раствора определяемого вещества (Iх+ст).
Метод имеет две разновидности.
а) Метод однократной добавки является расчётным.
Неизвестную концентрацию рассчитывают по формуле:
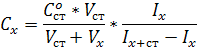
где С0ст - исходная
концентрация стандартного раствора;ст - объём стандартного раствора,
добавленный к пробе; х - объём пробы
б) Метод серии добавок является графическим. Для
проведения анализа измеряют величины аналитического сигнала пробы и нескольких
растворов той же пробы с добавками стандартного раствора. Строят график в
координатах «Аналитический сигнал - концентрация добавки» и по нему находят Сх
как величину отрезка, отсекаемого прямой на оси абсцисс.
.4 Инструментальное титрование
При проведении анализа с использованием
инструментального титрования измеряют какое-либо свойство раствора в процессе
титрования. Кривые титрования получаются разными в зависимости от измеряемой
величины.
Линейные кривые титрования получают, если
аналитический сигнал линейно меняется при изменении концентрации вещества в
растворе. К таким сигналам относятся, например, светопоглощение, сила тока,
электрическая проводимость и др. Объём в точке эквивалентности находят по
излому кривой.
Логарифмические кривые титрования получают, если
аналитический сигнал связан с логарифмом концентрации вещества в растворе. К
таким сигналам относятся, например, потенциал, рН и др. Точку эквивалентности
находят по перегибу кривой.
В любом случае после построения кривой
титрования и определения с её помощью объёма титранта, который потребовался для
достижения точки эквивалентности, расчёт результатов анализа проводят по закону
эквивалентов.
. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Электрохимические методы анализа (ЭХМА) основаны
на использовании процессов, которые протекают на поверхности электродов или в
приэлектродном пространстве. Аналитическим сигналом в ЭХМА может служить любой
электрический параметр, связанный с составом раствора и концентрацией вещества
в нём, например, потенциал (Е), сила тока (I), сопротивление (R), электрическая
проводимость (W), количество электричества (Q). Названия конкретных методов
чаще всего связаны с измеряемыми электрическими параметрами: потенциометрия,
амперометрия, кондуктометрия и так далее.
В качестве устройств для измерения электрических
параметров служат микроамперметры (измерение силы тока I), милливольтметры
(измерение разности потенциалов Е), мосты переменного тока (измерение
сопротивления R), кондуктометры (измерение электрической проводимости W) и
другое. Внешние металлические проводники осуществляют связь электрохимической
ячейки с устройством для измерения электрического параметра.
3.1 Кондуктометрия
Кондуктометрия является старейшим, самым простым
и наименее селективным из электрохимических методов анализа.
Кондуктометрический метод анализа основан на измерении электропроводности
раствора:
W=I/R,
где W - электропроводность раствора; -
сопротивление раствора.
Таким образом, аналитическим сигналом могут
служить либо электропроводность раствора, либо его сопротивление. Сигнал
формируется в межэлектродном пространстве и возникает за счёт:
- диссоциации молекул на ионы;
миграции ионов под действием внешнего источника
напряжения.
По этой причине методом кондуктометрии можно
анализировать только растворы электролитов.
По способу выполнения различают прямую
кондуктометрию и косвенную (кондуктометрическое титрование).
Сущность метода прямой кондуктометрии
заключается в том, что концентрацию вещества определяют по результатам
измерения электрической проводимости (или сопротивления). При этом используют
два приёма нахождения неизвестной концентрации:
а) метод градуировочного графика. График строят
в координатах ч - С. Он линеен в небольшом диапазоне концентраций.
б) расчётный метод. Метод используют для очень
разбавленных растворов. В этом случае при С ® 0:
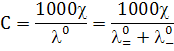
Таким образом, неизвестную концентрацию можно
рассчитать по измеренной величине ч и табличным значениям предельных
подвижностей ионов. Прямая кондуктометрия используется в качестве метода
аналитического контроля растворов электролитов. Поскольку в величину
аналитического сигнала вносят вклад все ионы, присутствующие в растворе, то
применение метода ограничено из-за малой селективности
Сущность метода кондуктометрического
титрования заключается в том, что измеряют электрическую проводимость раствора
в ходе титрования и строят кривую титрования. Кривая титрования является
линейной. По её излому определяют объём титранта в точке эквивалентности и
проводят расчёт результатов анализа по закону эквивалентов. В
кондуктометрическом титровании используют реакции осаждения,
комплексообразования и кислотно - основные реакции в водных и неводных
растворах.
.2 Потенциометрия
Потенциометрический метод анализа основан на
зависимости равновесного электродного потенциала (Е) от активности (a) или
концентрации (С) вещества в растворе. Для измерений необходимо составить
гальванический элемент из подходящего индикаторного электрода и электрода
сравнения, а также иметь прибор для измерения потенциала индикаторного
электрода. В качестве таких приборов используют:
потенциометр (для особо точных измерений);
электронные вольтметры, рН-метры, иономеры -
современные потенциометры заводского типа с электронными усилителями тока.
По способу выполнения анализа различают прямую
потенциометрию и потенциометрическое титрование.
Прямая потенциометрия.
Измеряют ЭДС гальванического элемента и по зависимости Е = f(a) находят
активность иона графическим или расчётным способом. При этом используют:
метод градуировочного графика;
метод добавок;
метод концентрационного элемента.
Потенциометрическое титрование.
Измеряют ЭДС в процессе титрования, затем строят кривую титрования. По ней
определяют объём титранта в точке эквивалентности и рассчитывают результат
анализа по закону эквивалентов. Используют реакции всех типов: кислотно-основные
реакции, ОВР, реакции осаждения и комплексообразования. Метод удобен для
титрования окрашенных и разбавленных растворов, а также смесей веществ. Для
нахождения т. э. используют 4 графических способа:
по интегральной кривой титрования - наиболее простой
способ;
по дифференциальной кривой титрования - более
точный способ;
по второй производной;
по кривой в координатах ДV/ДE - V(R) (метод
Грана)- используется для разбавленных растворов.
.3 Вольтамперометрия
Вольтамперометрия это совокупность электрохимических
методов анализа, основанных на использовании вольтамперных зависимостей I =
f(E), которые получают в процессе электролиза на поляризуемом электроде.
По разнообразию решаемых задач
вольтамперометрические методы являются наиболее универсальными среди методов
электрохимического анализа. Они позволяют одновременно получать качественную и
количественную информацию о находящихся в растворе электроактивных, то есть
способных вступать в химические реакции под действием электрического тока,
веществах.
Инверсионная вольтамперометрия позволяет
существенно увеличить чувствительность. Идея метода инверсионной полярографии
состоит в выделении определяемого элемента из очень разбавленного раствора на
ртутной капле, тонкой плёнке ртути на графитовом электроде или просто на
графитовом электроде электролизом с последующим анодным растворением
полученного продукта. Процесс накопления происходит при потенциале,
соответствующем предельному току. Зависимость силы тока от напряжения при
анодном растворении имеет вид характерного пика, высота которого
пропорциональна концентрации определяемого иона, а потенциал максимума
определяется природой иона.
. СПЕКТРОСКОПИЧЕСКИЕ И ДРУГИЕ ОПТИЧЕСКИЕ МЕТОДЫ
АНАЛИЗА
Спектроскопические и другие оптические методы
анализа - это большая группа методов, основанных на взаимодействии
электромагнитного излучения с веществом. Аналитический сигнал можно получать в
различных областях спектрального диапазона. В зависимости от этого различают
следующие виды спектроскопии (табл.1).
Таблица 1 - Области спектрального диапазона и
виды спектроскопии
|
Область
спектрального диапазона
|
Название
метода
|
|
Рентгеновская
|
Рентгеновская
спектроскопия
|
|
Оптическая
(ультрафиолетовая, видимая и инфракрасная)
|
Оптическая
спектроскопия
|
|
Микроволновая
|
Микроволновая
спектроскопия
|
|
Радиоволновая
|
Радиоволновая
спектроскопия
|
Из всех видов спектроскопии в аналитической
химии наибольшее применение находит оптическая спектроскопия. Методы оптической
спектроскопии очень разнообразны, поскольку при взаимодействии света с
веществом происходят различные явления.
Явления, обусловленные корпускулярной природой
света, лежат в основе спектроскопических методов анализа. Такие явления
наблюдаются при взаимодействии света с отдельными атомами или молекулами. При
этом может происходить поглощение или испускание света. Поглощение света
атомами и молекулами лежит в основе методов абсорбционной спектроскопии.
Явления, обусловленные волновой природой света, лежат в основе оптических
методов анализа. Такие явления наблюдаются при взаимодействии света со всем
веществом.
В зависимости от типа взаимодействия излучения с
веществом различают спектры испускания и спектры поглощения.
Виды спектров испускания:
эмиссионные спектры - испускаются термически
возбуждёнными частицами;
спектры люминесценции - испускаются нетермически
возбуждёнными частицами (под действием энергии электромагнитного излучения,
электрического поля, энергии химической реакции и др.).
В зависимости от природы частиц спектры делят на
атомные (линейчатые) и молекулярные (полосатые). В свою очередь, молекулярные
спектры могут быть: вращательными; колебательными; электронными.
.1 Атомные эмиссионные спектры. Эмиссионная
фотометрия пламени
Атомные эмиссионные спектры состоят из отдельных
линий, поэтому их называют «линейчатыми» Для каждого элемента характерен свой
вид спектра. Спектры атома и иона различаются, так как у них разное электронное
строение. Атомные эмиссионные спектры обусловлены только спонтанными
(самопроизвольными) электронными переходами в термически возбуждённых атомах.
Если атомной системе сообщить энергию, то электроны атомов переходят в
возбуждённое состояние. Затем они спонтанно возвращаются в основное состояние.
При этом избыточная энергия испускается в виде квантов света с частотой н = ДЕ
/ h.
атомизировать вещество (перевести его в
атомарное состояние);
возбудить полученные атомы. При этом энергия,
затраченная на возбуждение, должна быть меньше потенциала ионизации, иначе
получится спектр иона. Если условия атомизации и возбуждения постоянные и не
осложняются посторонними физико-химическими и оптическими явлениями, то число
возбуждённых атомов прямо пропорционально концентрации вещества.
Регистрация атомных эмиссионных спектров
проводится двумя способами:
фотографическим, при котором мерой интенсивности
служит степень почернения фотоэмульсии;
фотоэлектрическим, при котором мерой
интенсивности служит величина электрического сигнала (сила фототока).
Метод эмиссионной фотометрии пламени основан на
измерении интенсивности света, излучаемого возбуждёнными частицами (атомами или
молекулами) при введении вещества в пламя горелки. Аналитические возможности
метода - определение щелочных и щелочноземельных металлов. Они ограничены
возможностями источника возбуждения - пламени. Оно обладает меньшей энергией
возбуждения, чем другие источники (дуга, искра и т. п), поэтому в пламени
возбуждаются только элементы с низким потенциалом возбуждения.
Принцип метода заключается в следующем.
Анализируемый раствор распыляют в виде аэрозоля в пламя горелки. Возникающее
излучение определяемого элемента отделяется от постороннего с помощью
светофильтра и, попадая на фотоэлемент, вызывает фототок, который измеряется с
помощью микроамперметра.
Пламя - это низкотемпературная равновесная
плазма. Основными характеристиками пламени являются его состав и рабочая
температура. В состав пламени всегда входят два газа:
горючий газ - природный газ, метан, пропан,
ацетилен и другие;
газ-окислитель - воздух, кислород, озон, фтор и
другие.
Поскольку метод фотометрии пламени является
чисто физическим, то есть не требует проведения химических реакций, то для
определения неизвестной концентрации невозможно применить косвенный приём -
инструментальное титрование. Для этих целей применяются все остальные известные
приёмы (прямые):
метод градуировочного графика;
метод стандартов;
метод добавок: очень эффективен для уменьшения
систематических погрешностей, вызванных физико-химическими помехами.
.2 Молекулярные абсорбционные спектры. Методы
молекулярного абсорбционного анализа
Спектры поглощения, в отличие от спектров
испускания, обусловлены вынужденными электронными переходами, которые
происходят под воздействием излучения от внешнего источника. Для получения
спектров поглощения вещество помещают в поле электромагнитного излучения. Если
энергия кванта с частотой нi не меньше, чем энергия перехода то переход может
осуществиться, в результате вещество будет поглощать свет с частотой нi. Если
энергия кванта с частотой нi меньше энергии перехода то переход не может
осуществиться, поэтому вещество не будет поглощать свет с частотой нi.
Следовательно, основным условием поглощения является совпадение энергии
перехода и энергии поглощаемого фотона. Ещё одним условием поглощения является
то, что переход должен быть разрешён правилами отбора. Так, запрещены переходы
между уровнями s ® d, p ® f, с
участием более одного электрона, с изменением спина и так далее.
Область интенсивного поглощения излучения
называется полосой поглощения. Совокупность полос образует спектр поглощения.
Спектр поглощения вещества - это графическое изображение распределения
поглощаемой им энергии по длинам волн.
В зависимости от области оптического диапазона,
способа измерения и монохроматичности используемого света различают следующие
методы молекулярного абсорбционного анализа:
а) фотометрические методы - основаны на
поглощении света веществом в ультрафиолетовой и видимой областях и
использовании электронных спектров поглощения. Включают в себя три метода:
визуальная колориметрия - основана на сравнении
окраски анализируемых и стандартных растворов визуальным способом;
фотоколориметрия - основана на измерении
интенсивности света, прошедшего через окрашенный раствор, фотоэлектрическим
способом;
спектрофотометрия - основана на измерении
интенсивности строго монохроматического света, прошедшего через раствор,
фотоэлектрическим способом.
б) инфракрасная - спектроскопия - основана на
поглощении света веществом в инфракрасной - области и использовании
колебательных спектров поглощения.
4.3 Нефелометрия и турбидиметрия
Сущность нефелометрического и
турбидиметрического методов анализа заключается в следующем. Определяемый
компонент переводят в малорастворимое соединение, которое может находиться в
виде взвеси. Затем измеряют интенсивность света, рассеянного суспензией
(нефелометрия) или прошедшего через неё (турбидиметрия) При этом интенсивность
светового потока меняется, а длина волны излучения остаётся постоянной С
помощью методов нефелометрии и турбидиметрии можно определять малые концентрации
(< 100 мг/л) многих ионов, которые об- разуют малорастворимое соединение
В нефелометрии и турбидиметрии чаще всего
используют два из четырёх известных приёмов нахождения концентрации по величине
аналитического сигнала: метод градуировочного графика и нефелометрическое и
турбидиметрическое титрование.
Для нефелометрических измерений используют
нефелометры. Они аналогичны фотоколориметрам. Отличие заключается в том, что
наблюдают не проходящий, а рассеянный свет, располагая фотоэлемент сбоку кюветы
(обычно перпендикулярно падающему свету). Для турбидиметрических измерений
можно использовать приборы абсорбционной спектроскопии - фотоколориметры,
абсорбциометры, спектрофотометры, а также специальные приборы -
фототурбидиметры. Они отличаются от фотоколориметров наличием мешалки,
благодаря чему частицы суспензии не оседают.
4.4 Рефрактометрия
Метод основан на измерении относительных
показателей преломления (n). Преломление света на границе двух сред - это
изменение направления и скорости распространения светового луча. В
рефрактометрии используют следующие приёмы нахождения концентрации по величине
аналитического сигнала: метод градуировочного графика, по специальным
рефрактометрическим таблицам n - щ, которые составлены для многих веществ,
метод стандартов - по значению аналитического рефрактометрического фактора Для
рефрактометрических измерений используют рефрактометры разных типов, в
аналитической химии чаще всего - рефрактометры Аббе.
. МЕТОДЫ РАЗДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ
Разделение - это операция, позволяющая отделить
компоненты пробы друг от друга. Его используют, если одни компоненты пробы
мешают определению или обнаружению других, т. е. когда метод анализа
недостаточно селективен и надо избежать наложения аналитических сигналов. При
этом обычно концентрации разделяемых веществ близки.
Концентрирование - это операция, позволяющая
увеличить концентрацию микрокомпонента относительно основных компонентов пробы
(матрицы). Его используют, если концентрация микрокомпонента меньше предела
обнаружения Сmin, т. е. когда метод анализа недостаточно чувствителен. При этом
концентрации компонентов сильно различаются. Часто концентрирование совмещается
с разделением.
Разделение и концентрирование имеют много
общего, для этих целей используются одни и те же методы. Они очень
разнообразны.
Существует множество классификаций методов
разделения и концентрирования, основанных на разных признаках.
а) классификация по природе процесса
химические методы разделения и концентрирования
основаны на протекании химической реакции, которая сопровождается осаждением
продукта, выделением газа.
физико-химические методы разделения и
концентрирования чаще всего основаны на избирательном распределении вещества
между двумя фазами.
физические методы разделения и концентрирования
чаще всего основаны на изменении агрегатного состояния вещества.
б) классификация по физической природе двух фаз
Распределение вещества может осуществляться
между фазами, которые находятся в одинаковом или разном агрегатном состоянии:
газообразном (Г), жидком (Ж), твёрдом (Т).
в) классификация по количеству элементарных
актов (ступеней)
одноступенчатые методы - основаны на однократном
распределении вещества между двумя фазами. Разделение проходит в статических
условиях.
многоступенчатые методы - основаны на
многократном распре- делении вещества между двумя фазами. Различают две группы
многоступенчатых методов: с повторением процесса однократного распределения,
методы, основанные на движении одной фазы относительно другой .
г) классификация по виду равновесия
термодинамические методы разделения основаны на
различии в поведении веществ в равновесном состоянии. Они имеют наибольшее
значение в аналитической химии.
кинетические методы разделения основаны на
различии в поведении веществ во время процесса, ведущего к равновесному
состоянию. Например, в биохимических исследованиях наибольшее значение имеет
электрофорез. Остальные кинетические методы используются для разделения частиц
коллоидных растворов и растворов высокомолекулярных соединений. В аналитической
химии эти методы применяются реже.
хроматографические методы основаны и на
термодинамическом, и на кинетическом равновесии. Они имеют огромное значение в
аналитической химии, поскольку позволяют провести разделение и одновременно
качественный и количественный анализ многокомпонентных смесей.
5.1 Ионный обмен
Ионный обмен - это обратимый стехиометрический
процесс, который происходит на границе раздела фаз ионит - раствор электролита.
Иониты - это высокомолекулярные полиэлектролиты
различного строения и состава. Основным свойством ионитов является то, что они
поглощают из раствора катионы или анионы, выделяя при этом в раствор
эквивалентное число ионов того же знака заряда.
.2 Хроматографические методы анализа
Хроматография - это динамический метод
разделения и определения веществ, основанный на многократном распределении
компонентов между двумя фазами - подвижной и неподвижной. Вещество поступает в
слой сорбента вместе с потоком подвижной фазы. При этом вещество сорбируется, а
затем при контакте со свежими порциями подвижной фазы - десорбируется.
Перемещение подвижной фазы происходит непрерывно, поэтому непрерывно происходят
сорбция и десорбция вещества. При этом часть вещества находится в неподвижной
фазе в сорбированном состоянии, а часть - в подвижной фазе и перемещается
вместе с ней. В результате скорость движения вещества оказывается меньше, чем
скорость движения подвижной фазы. Чем сильнее сорбируется вещество, тем
медленнее оно перемещается. Если хроматографируется смесь веществ, то скорость перемещения
каждого из них различна из-за разного сродства к сорбенту, в результате чего
вещества разделяются: одни компоненты задерживаются в начале пути, другие
продвигаются дальше.
В зависимости от агрегатного состояния фаз
различают газовую хроматографию (подвижная фаза - газ или пар) и жидкостную
хроматографию (подвижная фаза - жидкость).
По механизму взаимодействия вещества с сорбентом
различают следующие виды хроматографии: адсорбционная, распределительная,
ионообменная, осадочная, окислительно-восстановительная,
комплексообразовательная и др.
Метод газовой хроматографии получил наибольшее
распространение, поскольку для него наиболее полно разработаны теория и
аппаратурное оформление. Газовая хроматография - это гибридный метод,
позволяющий одновременно проводить и разделение, и определение компонентов
смеси. В качестве подвижной фазы (газа-носителя) используют газы, их смеси или
соединения, находящиеся в условиях разделения в газообразном или парообразном
состоянии. В качестве неподвижной фазы используют твёрдые сорбенты или
жидкость, нанесённую тонким слоем на поверхность инертного носителя.
ЗАКЛЮЧЕНИЕ
Физико-химический анализ - область химии,
изучающая посредством сочетания физических и геометрических методов
превращения, происходящие в равновесных системах.
Под физико-химическими измерениями в системе
Госстандарта РФ принято понимать все измерения, связанные с контролем состава
веществ, материалов и изделий. Измерения химического состава веществ могут
проводиться самими различными методами, поскольку в измерительном процессе в
большинстве случаев измеряется какое-либо свойство материала, а затем состав
находят из связи состав-свойство. Таким свойством могут быть механические
свойства, электромеханические, тепловые, оптические.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
химический вещество концентрация
1 Физико-химический анализ химия
[Электронный ресурс] // Энциклопедии & Словари - Коллекция
энциклопедий и словарей. - Электрон. дан. - Энциклопедии & Словари,
2009 - 2015- . - Режим доступа: http://enc-dic.com/enc_chemistry/Fiziko-himicheski-analiz-4015.html,
свободный. - Загл. с экрана. - Вкладка «Химическая энциклопедия». - Дата
обращения 09.03.2015.
2
Козлов М.Г., Метрология и стандартизация [Электронный ресурс] : учебное
электронное текстовое издание / Козлов М.Г.- Электрон. дан. - Москва :
«Московский Государственный университет печати», 2007. - Режим доступа :
hi-edu.ru <http://www.hi-edu.ru/>›e-books/xbook109/01/part-025.htm,
свободный. - Загл. с экрана. - Вкладка «Физико - химические измерения».-Данные
соответствуют 13 Марта 2015.
Аналитическая
химия [Электронный ресурс] // Википедия - свободная энциклопедия. - Электрон.
дан. - Википедия Фаундейшн, 2015- . - Режим доступа:
https://ru.wikipedia.org/wiki/, свободный. - Загл. с экрана. - Вкладка «Химия».
- Дата обращения 09.03.2015.
Соколовский
А. Е., Физико-химические методы анализа [Электронный ресурс] : учебное
электронное текстовое издание / А. Е. Соколовский, Е. В. Радион - Электрон.
дан. - Минск : «Белорусский Государственный Технологический Университет», 2007.
- Режим доступа : analit.belstu.by
<http://analit.belstu.by/>›files/fhma/FHMA_teksty_lekcii.pdf, свободный.
- Загл. с экрана. - Данные соответствуют 13 Марта 2015.
ГОСТ
23201.0 - 78 Глинозем. Общие требования к методам спектрального анализа [Текст].
- Введ. 1980-01-01. - М. : Изд-во стандартов, 1990. - 6 с.