Дослідження по визначенню вмісту нітрат іонів у стічній воді
Зміст
Вступ
. Загальна частина
.1 Характеристика води по
її фізичним та хімічним властивостям
. Спеціальна частина
.1 Теоретичні основи
фотометричного методу аналізу
.2 Обладнання
фотометричного методу аналізу
. Експериментальна частина
.1 Методики визначення
вмісту нітрат іонів у стічній воді фотометричним методом аналізу
.1.1 Методика визначення вмісту
нітрат іонів у стічній воді з саліциловою кислотою
.1.2 Методика визначення вмісту
нітрат іонів у стічній воді з саліцилатом натрію
.2 Експеримент по визначенню
вмісту нітрат іонів у стічній воді фотометричним методом аналізу
.2.1 Експеримент по визначенню
вмісту нітрат іонів у стічній воді з саліциловою кислотою
.2.1 Експеримент по визначенню
вмісту нітрат іонів у стічній воді з саліцилатом натрію
. Статистично-математична
обробка результатів аналізу
.1 Математична обробка
результатів аналізу визначення вмісту нітрат іонів у стічній воді фотометричним
методом аналізу
.1.1 Математична обробка
результатів аналізу визначення вмісту нітрат іонів у стічній воді з саліциловою
кислотою
.1.2 Математична обробка
результатів аналізу визначення вмісту нітрат іонів у стічній воді з саліцилатом
натрію
.2 Статистична обробка
результатів аналізу визначення вмісту нітрат іонів у стічній воді фотометричним
методом аналізу
.2.1 Статистична обробка
результатів аналізу визначення вмісту нітрат іонів у стічній воді з саліциловою
кислотою
.2.2 Статистична обробка
результатів аналізу визначення вмісту нітрат іонів з саліцилатом натрію
. Техніка безпеки і охорона
природного навколишнього середовища
.1 Загальні вимоги техніки
безпеки в лабораторії хіміко-аналітичного контролю шкідливих викидів та стоків
.2 Пожежна безпека
.3 Електробезпека
.4 Гігієна праці лаборанта
.5 Перша допомога при нещасних
випадках
.6 Охорона навколишнього природного
середовища
Висновки
Перелік посилань
Вступ
Вода складається осібно в історії
нашої планети. Немає ні одного природного тіла яке могло би з нею зрівнятися по
впливу на хід основних,самих грандіозних геологічних процесів.
Не тільки земна поверхня та і в
масштабі біосфери частинки планети визначаються в своїх проявах, в самих сутніх
своїх проявах, її існування та її властивостями.
Вода грає важливу роль в природі, в
житі діяльності людини, які в основному складаються із води та без неї існувати
не може.
Води класифікують на дощові,
підземні, річні, озерні, ставкові, стічні води та води морів.
Стічні води Стічні води можуть бути
класифіковані за такими ознаками:за джерелом походження:виробничі (промислові)
стічні води (що утворюються в технологічних процесах виробництв), відводяться
через систему промислової або загально сплавної каналізації побутові
(господарсько-побутові) стічні води (що утворюються в результаті побутової
життєдіяльності людини), відводяться через систему господарсько-побутової або
загально сплавної каналізації поверхневі стічні води (діляться на дощові і
талі-утворюються при таненні снігу, льоду, граду), відводяться, як правило,
через систему зливової каналізації.
Виробничі стічні води, на відміну
від атмосферних і побутових, не мають постійного складу і можуть бути
розділені:за складом забруднювачів на:забруднені по перевазі мінеральними
домішками забруднені по перевазі органічними домішками забруднені як
мінеральними, так і органічними домішка мимо концентрації забруднюючих речовин:з
вмістом домішок 1-500 мг / л з вмістом домішок 500-5000 мг / л з вмістом
домішок 5000-30000 мг / л з вмістом домішок більше 30000 мг / л за
властивостями забруднювачі в по кислотності:неагресивні (pH 6,5-8) слабо
агресивні (слабо лужні - pH 8-9 і слабо кислие - pH 6-6,5)сильно агресивних
(сильно лужну - pH> 9 і сильно кислі - pH <6)по токсичній дії і дії
забруднювачів на водні об'єкти:містять речовини, що впливають на загально
санітарний стан водойми (наприклад, на швидкість процесів самоочищення)містять
речовини, що змінюють органолептичні властивості (смак, запах)містять речовини,
токсичні для людини і що мешкають у водоймах тварин і рослин.
У складі стічних вод виділяють дві
основні групи забруднювачів - консервативні, тобто такі, які насилу вступають в
хімічні реакції і практично не піддаються біологічному розкладанню (приклади
таких забруднювачів солі важких металів, феноли, пестициди) і неконсервативні,
тобто такі, які можуть в тому числі піддаватися процесам самоочищення водойм.
До складу стічних вод входять як
неорганічні (частки грунту, руди і порожньої породи, шлаку, неорганічні солі,
кислоти, луги); так і органічні (нафтопродукти, органічні кислоти), в тому
числі біологічні об'єкти (грибки, бактерії, дріжджі, в тому числі
хвороботворні).
Очищення стічних вод - це руйнування
або видалення з них забруднюючих речовин, знезараження та видалення патогенних
організмів. Існує велике різноманіття методів очищення, які можна розділити на
такі основні групи з основним використовуваним принципам:фізичні. Засновані на
гравіметричних та фільтраційних методах поділу.
Дозволяють відокремити нерозчинні
тверді домішки. За вартістю механічні методи очищення відносяться до одних з
найдешевших методів,хімічні - засновані на реакціях компонентів стічних вод з
реагентами.
Найчастіше, хімічні методи,
використовують для нормалізації pH стічних вод або осадження нерозчинних солей
і гідроксидів важких металів, що утворюються в результаті реакції.
При використанні, в якості реагентів
перекисних або містять активний хлор сполук (наприклад, озон і гіпохлорит)
досягають знезараження і освітлення стічних вод, за рахунок окислення
органічних домішок. У процесі хімічного очищення може накопичуватися досить
велика кількість осаду, якщо ж утворення осаду не відбувається, то підвищується
солевміст стічних вод.
Фізико-хімічні властивості стічних
вод засновані на поєднанні фізичних і хімічних методів у процесі очищення
стічних вод. Можна виділити коагуляцію, сорбцію, екстракцію, електроліз, іонний
обмін, зворотний осмос. Це, порівняно, низькопродуктивні методи, які
відрізняються високою вартістю очищення стічних вод. Дозволяють очистити стічні
води від розчинних і рідких нерозчинних сполук біологічні. В основі цих методів
лежить використання мікроорганізмів, що розкладають органічні сполуки в стічних
водах. Застосовуються біофільтри з тонкою бактеріальної плівкою, біологічні
ставки з населяють їх мікроорганізмами, аеротенки з активним мулом з бактерій і
мікроорганізмів. Часто застосовуються комбіновані методи, які використовують на
декількох етапах різні методи очищення. Застосування того чи іншого методу
залежить від концентрації і шкідливості домішок. Якісне очищення стічних вод,
не можна реалізувати без послідовної обробки стічних вод кількома методами.
Залежно від того, витягуються чи
компоненти забруднюючих речовин із стічних вод, всі методи очищення можна
розділити на регенеративні і деструктивні.
Використання стічних вод. Виробничі
стічні води після відповідного очищення можуть бути повторно використані в
технологічному процесі, для чого на багатьох промислових підприємствах
створюються системи оборотного водопостачання або замкнуті (безстічні) системи
водопостачання та каналізації, при яких виключається скидання будь-яких вод у
водойми. Перспективні методи фізико-хімічної очистки (коагулювання,
відстоювання, фільтрація) в якості самостійних способів очищення або в
поєднанні з біологічним очищенням, а також методи додаткової обробки (сорбція,
іонообмін, гіперфільтрація, видалення азотистих речовин і фосфатів та інші), що
забезпечує досить високий ступінь очищення стічних вод перед спуском їх у
водойми або при використанні стічних вод у системах оборотного водопостачання
промислових підприємств. Ефективні методи термічного знешкодження і переробки
високо концентрованих стоків у вторинну сировину, а також спосіб закачування
стоків в глибокі, надійно ізольовані підземні горизонти. Наявні в стічних водах
(переважно побутових) в значній кількості речовини, що містять азот, калій,
фосфор, кальцій і інші елементи, є цінними добривами для сільськогосподарських
культур, у зв'язку з чим стічні води використовуються для зрошення
сільськогосподарських земель. Доцільно знешкодження стічних вод на станціях
біологічного очищення виробляти з подачею очищених стічних вод на поля. Опади
стічних вод після відповідної обробки (зброджування, сушка) зазвичай
використовують в якості добрив.
У поверхневих і підземних джерелах
води присутні сполуки азоту у вигляді нітратів і нітритів.
В даний час відбувається постійне
зростання їх концентрації через широке використання нітратних добрив, надлишок
яких з грунтовими водами надходить у джерела водопостачання. Згідно з
санітарними правилами і нормами, у воді централізованого водопостачання вміст
нітратів не повинно перевищувати 45 мг / л, нітритів - 3 мг / л.
Нітрати в концентрації більше 20 мг
/ л роблять токсичну дію на організм людини.
Вміст нітратів у стічній та інших
видах води можна визначити такими методами аналізу як фотометричний та
потенціометричний.
В фотометричному методі аналізу
вміст нітрат іонів (нітратів) у стічній воді можна визначити за допомогою таких
реактивів як саліцилова кислота, саліцилати натрію, з фенолдисульфоновою
кислотою, після відновлення до аміаку з сульфаніловою кислотою та альфа нафтил
аміном.
Постійне вживання води з підвищеним
вмістом нітратів призводить до захворювань крові, серцево-судинної системи.
При виявленні в пробі води нітратів
у кількості вище нормативу вдаються до очищення води за допомогою зворотного
осмосу або іонного обміну.
1. Загальна частина
.1 Характеристика води по
фізичним та хімічним властивостям
Вода - це унікальна речовина, і всі
її аналітичні властивості висока температура кипіння, значення розчинювальна та
дисоціююча здатність, мала теплопровідність, висока теплота, випари та інше,
обумовлені її молекулами і просторовою структурою. Вода чудовий розчинник для
полярних речовин.
До них відносяться іонні з’єднання,
такі як солі яких заряджені частинки (іони) дисоціюють у воді, коли речовина
розчиняється, а також деякі неіонні з’єднання наприклад цукру і прості спирти,в
молекулі яких присутні заряджені (полярні) групи (- ОН).
Велика теплоємність - питомою
теплопровідністю води називають кількість теплоти в джоулях, яке необхідне для
того щоб підняти температуру і кг води на 1 0С, теплоємність води
4,184 Дж/г
Велика теплота випару прихована
теплотою випару є міра кількості теплової енергії, яку необхідно повідомити
рідині для її переходу в пару, тобто подолання молекулярного значення рідини.
Велика теплота плавлення є мірою
теплової енергії, необхідної для розплавлення твердої речовини (льоду).
Щільність і поведінка води поблизу
точки замерзання, щільність води максимальна + 4 0С від +
4 0С до 0 0С. Із знижується тоді коли лід легший за воду
і у воді не тоне, велике поверхневе на тяжіння і когезія.
Когезія - це зчеплення молекул
фізичного тіла один з одним під дією сил тяжіння.
Вода як реагент - біологічне
значення води визначається тим що вона є однією з най необхідних метаболітів,
тобто бере учать у метабологічних реакціях.
Чиста вода не має запаху, смаку в
тонких умовах безкольорова, в більших тощах - блакитного - білого кольору.
Температура плавлення 0 0С,
температура кипіння 100 0С (при тиску 1 атм).
Густина води при 0 0С
становить 0,9998; при 4 0С 1,000г/см3.
Вода взаємодіє з багатьма речовинами
при звичайній температурі.
З лужними та лужноземельними
металами та їх оксидами вода утворює гідроксиди металів:
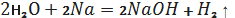
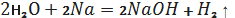 (1.1)
(1.1)
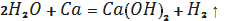
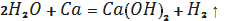 (1.2)
(1.2)
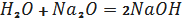
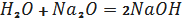 (1.3)
(1.3)
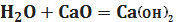
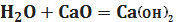 (1.4)
(1.4)
Вода реагує з неметалами. Так
хлор розчиняючись в воді дає дві кислоти - хлорнуватисту та соляну кислоти:
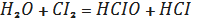
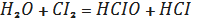 (1.5)
(1.5)
Оксиди неметалів з водою
утворюють кислоти:
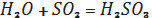
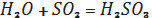 (1.6)
(1.6)
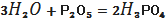
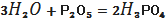 (1.7)
(1.7)
2. Спеціальна частина
.1 Теоретичні основи фотометричного
методу аналізу
Фотометричний метод аналізу
(фотометрія) - це сукупність методів молекулярно-абсорбційного спектрального
аналізу, заснованих на вибірковому поглинанні електромагнітного випромінювання
у видимій, ІЧ та УФ областях молекулами визначає мого компонента або його
з'єднання з відповідним реагентом.
Концентрацію визначуваного
компонента встановлюють за законом Бугера-Ламберта - Бера.
Фотометричний метод включає
візуальну фотометрію, спектрофотометрію і фотометрію
Остання відрізняється від
спектрофотометрії тим, що поглинання світла вимірюють у видимій області спектра,
рідше - в ближніх УФ та ІЧ областях (тобто в інтервалі довжин хвиль від ~ 315
до ~ 980 нм), а також тим, що для виділення потрібної ділянки спектру (шириною
10-100 нм) використовують не моно-хроматори, а вузькосмугові світлофільтри.
Приладами для фотоколориметрії
служать фотоелектроколориметри (ФЕК), що характеризуються простотою оптичної та
електричної схем.
Більшість фотометрів має набір з
10-15 світлофільтрів і являє собою двопроменеві прилади, в яких пучок світла
від джерела випромінювання (лампа розжарювання, рідко ртутна лампа) проходить
через світлофільтр і дільник світлового потоку (зазвичай призму), який ділить
пучок на два, що направляються через кювети з досліджуваним розчином і з
розчином порівняння.
Після кювет паралельні світлові
пучки проходять через калібровані ослаблювачі (діафрагми), призначені для
зрівнювання інтенсивносте й світлових потоків, і потрапляють на два приймача
випромінювання (фотоелементи), підключені по диференціальній схемі до
нуль-індикатора (гальванометр, індикаторна лампа).
Недолік приладів - відсутність
монохроматора, що призводить до втрати селективності вимірювань; гідності
фотометрів - простота конструкції і висока чутливість завдяки великій
світлосилі.
Вимірюваний діапазон оптичної
щільності становить приблизно 0,05-3,0, що дозволяє визначати мн. елементи та
їх сполуки. в широкому інтервалі змістів - від ~ 10-6 до 50% по масі.
Для додаткового підвищення
чутливості і селективності визначень істотне значення мають добір реагентів, що
утворюють інтенсивно забарвлені комплексні сполуки. з обумовленими речовинами,
вибір складу розчинів та умов вимірювань.
Похибки визначення становлять
близько 5%.
При диференціальному фотометричного
аналізу оптична щільність аналізованого розчину вимірюють відносно оптичної
щільності (яка не повинна бути менше 0,43) розчину порівняння.
Останній містить визначуваний
компонент в концентрації, близької до концентрації цього компонента в
аналізованому розчині.
Це дозволяє визначати порівняно
великі концентрації в-в з похибкою 0,2-1% (у випадку спектрофотометрії).
При фотометричному титруванні
отримують залежність оптичної щільності
Титрування розчину від об'єму
додається титранту (криву титрування).
За зламу на цій кривій визначають
кінцеву точку титрування і, отже, концентрацію досліджуваного компонента в
розчині. Іноді
Фотометричний аналіз розуміють більш
широко, як сукупність методів якісного і кількісного аналізу по інтенсивності
ІК, видимого і УФ випромінювання, що включає атомно-абсорбційний аналіз,
фотометрію полум'я, турбидиметрія, нефелометрія, люмінесцентний аналіз,
спектроскопію відбивання і молекулярний абсорбційний спектральний аналіз.
Методи кількісної ідентифікації у
фотометричному методі аналізу
У фотометричному методі аналізу
виділяють такі методі кількісної ідентифікації як: метод порівняння зі
стандартом, метод каліброваного графіку, метод додатку та диференційний метод.
Метод каліброваного графіку
Практика аналізу - готують
досліджуваний розчин та п’ять - шість стандартних розчинів.
Вимірюють оптичне поглинання досліджуваного
розчину та п’яти - шести стандартних розчинів.
По отриманим даним будують
калібрований графік залежності оптичне поглинання від концентрації розчину.
Маючи оптичне поглинання
досліджуваного розчину по каліброваному графіку знаходять концентрацію
досліджуваного розчину.
Характеристика методу каліброваного
графіку
Метод найбільш точний так як
використовується велика кількість стандартних розчинів дає можливість
усереднити похибку виміру.
Не використовується метод
каліброваного графіку якщо у досліджуваному розчині є велика кількість домішок,
то визначення ведуть у межах оптимальних концентрацій.
.2 Обладнання фотометричного методу
аналізу
Реєстрація оптичних спектрів у
фотометричному методі аналізу здійснюється вимірюванням світло поглинання
розчину аналітичної форми.
Загальний принцип вимірювання
оптичного поглинання полягає у послідовному порівнянні світлових променів що
проходять крізь розчин порівняння та досліджуваний розчин.
Для вимірювання оптичного поглинання
розчинів використовують фотоколориметри принцип яких ґрунтується на
використанні фотоефектів різних типів.
Фотоколориметри класифікують по
способу виміру, та по способу монохроматизації світлового променю
По способу виміру фотоколориметри
діляться на однопроменеві, та двопроменеві.
Про способу монохроматизації
світлового променю фотоколориметри діляться на за допомогою світлофільтрів, та
за допомогою призминного або решітчастого монохроматора.
Фотоколориметр містить такі вузли -
джерело світла, фокусуюча лінза, світлофільтри, кювети виділення, фотоелемент,
підсилювач, реєструючий пристрій, щілинна діафрагма.
Принцип роботи фотоколориметрів
Світловий потік від лампи
розжарювання попадає на систему фокусуючи лінз та теплозахисних фільтрів у
щілину діафрагми, кольоровий світлофільтр та проходить крізь кювети відділення,
де знаходиться досліджувана речовини та кювета з розчином порівняння.
Спочатку у світловий промінь
встановлюють кювету з розчином порівняння (дистильованою водою) або холостого
(нульова проба).
За допомогою діафрагми стрілку
показую чого приладу встановлюють на відмітку 100% світло пропускання що
відповідає оптичному нулю системи.
Якщо потім в світловий промінь
ввести аналізований розчин то світловий промінь проходить крізь нього
зменшується пропорційно його концентрації у відповідності з законом Бугера
Ламберта Бера.
Зменшений сигнал через обернений
підсилювач в реєструю чий гальванометром у одиничних оптичної густини.
У фотоколориметрів типу К Ф К є
одинадцять світлофільтрів, ширина пропускання кожного з них досить мала і
світло яке пройшло через таких світлофільтр наближається до монохроматичного.
Фотоколориметр нового покоління КФК
відрізняється від інших типів однопроменевих фотоколориметрів тим, що кювет не
відділення подається світловий промінь певної вузької довжини хвилі.
Монохроматизацією світла у даному
приладі досягається за допомогою кварцової диспергуючої призми від якої промінь
попадає у щілину що має перемінну величину, та забезпечує додаткову
монохроматизацію світла кольоровим світлофільтром в цьому приладі відсутні сірі
світлофільтри що є в конструкції приладу призминні.
Кювети - складаються із матеріалу що
добре пропускають світло.
При роботі у видимій області спектра
використовують скляні кювети, при роботі у використовують розплаву срібла.
Вибір кювети ґрунтується на
отриманні мінімальної похибки виміру.
Кювети підбираються так щоб оптичне
поглинання знаходилось у межах від 0,2 до 0,6 при цьому похибка виміру
мінімальна.
Оптичні концентрації це ті
концентрації забарвлених розчинів при яких оптичне поглинання знаходиться від
0,2 до 0,5.
Основні вимоги при роботі з кюветами
Робочі поверхні кювет повинні перед
кожним виміром ретельно протиратися спиртово-ефірною сумішшю.
При установці кювет в кювето тримач
неможна торкатися пальцями робочих ділянок поверхні.
Наявність забруднень або крапель
розчину на робочій поверхні кювети приводить до отримання невірних результатів
вимірів.
Рідина наливається в кювети до мітки
на боковій частині стінки кювети. Кювети обов’язково закриваються кришками.
Рисунок 2.1 - Оптична схема
фотоколориметра К Ф К 3- 01
- джерело світла;
- конденсор;
- світлофільтр;
- дифракційна решітка;
- ввігнуте дзеркало;
дзеркало;
, 8 - об’єктиви;
- кювет не відділення;
- лінза;
- приймач;
Д1,Д2 - щілинна діафрагма.
3. Експериментальна частина
.1 Методики визначення вмісту нітрат
іонів у стічній воді фотометричним методом
.1.1 Методика визначення вмісту
нітрат іонів у стічній воді з саліциловою кислотою
Методика встановлює алгоритм кількісного
визначення вмісту нітрат іонів у стічних водах після біохімічної очистки та у
поверхневих водах у районах впливу випусків стічних вод.
Діапазон визначення вмісту нітрат
іонів 0,5 - 110 мг/дм3.
Методика є обов’язковою для органів
державного контролю за рівнем забрудненості та станом природного середовища
України.
У цьому керівному документі наведено
посилання на такі стандарти та нормативні документи:
ГОСТ 17 05 85 - Охорона
навколишнього середовища. Гідросфера. Загальні вимоги до відбору проб поверхневих
та морських вод, льоду та атмосферних осадів.
ГОСТ 1770 - 74 - Посуд мірний
лабораторний, склянки, циліндри, мензурки, колби, пробірки. Технічні умови.
ГОСТ 3760 - 79 - Аміак водний.
Технічні умови.
ГОСТ 42 17 - 77 - Галуни
алюмоамонійні. Технічні умови.
ГОСТ 43 28 - 77 - Натрій гідроксид.
Технічні умови.
ГОСТ 58 45 - 79 - Калій, натрій
виннокислий та водний. Технічні умови.
ГОСТ 67 09 - 72 - Вода дистильована.
Технічні умови.
ГОСТ 91 47 - 80 - Посуд та
обладнання лабораторні фарфорові. Технічні умови.
ГОСТ 18 300 - 87 - Спирт етиловий
ректифікаційний. Технічні умови.
ГОСТ 24 1 04 - 88 - Ваги лабораторні
загального використання та зразкові.
ГОСТ 25 336 - 82 - Посуд та
обладнання лабораторні скляні. Типи, основні параметри та розміри.
ГОСТ 29 169 - 91 - Посуд
лабораторний. Піпетки з однією міткою.
ГОСТ 29 227 - 91 - Посуд
лабораторний скляний. Піпетки градуйовані. Частина перша. Загальні вимоги.
КНД 211 1 0 009 - 94 - Гідросфера.
Відбір проб для визначення складу та властивостей технологічних вод. Основні
положення.
ТУ 6 09 16 - 78 - Фільтри беззольні.
ТУ 6 16 3076 - 88 - Вугілля
активоване марки БАУ - 2
Метрологічні характеристики
одиничного вимірювання за методикою, встановлені у процесі атестації, виражені
у формі:
Найбільшого можливого значення
середнього квадратичного відхилення випадкової похибки (показника
відтворюваності).
Систематичної складової похибки.
Границь інтервалу що накриває
похибку х імовірністю Р = 0,95.
Методика визначення вмісту нітрат
іонів у стічній воді забезпечує одержання результатів з похибкою, як не
перевищує значень, приведених у таблиці:
Значення характеристик
похибки вимірювання концентрації у будь якій точці і діапазону 0,5 - 110 мг/дм3
розраховують, припускаючи прямолінійну залежність характеристики похибки від
концентрації С, наприклад 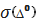
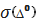 :
:
Метод базується на взаємодії
нітрат іонів з саліцилат іонами у сірчанокислому середовищі з утворення суміші
3 нітросаліцилової кислоти та 5 нітросаліцилової кислоти.
Солі цих кислот у лужному
середовищі мають жовте забарвлення
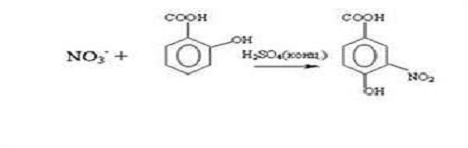
Рисунок 3.1. - Реакція
взаємодії нітрат іонів з саліциловою кислотою з утворенням сполуки 3 нітро
саліцилової кислоти.
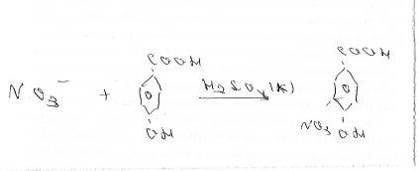
Рисунок - 3.2 - Реакція
взаємодії нітрат іонів з саліциловою кислотою з утворенням сполуки 5 нітро
саліцилової кислоти
Світло поглинання при довжині
хвилі 410 нм, використовують кювети з товщиною поглинаючого шару 2 см.
Перешкоджаючі впливи та
способи їх усунення:
Завислі речовини і
забарвленість
А) до 100,0см3
проби води додають 0,5г активованого вугілля та перемішують. Фільтрують крізь
густий фільтр синя стрічка. Фільтр змивають водою.
Б) До 100,0см3
проби води додають суспензію гідроксиду алюмінію та перемішують. Дають
відстоятися та фільтрують. Перші 5,0 - 10,0см3 фільтрату відкидають.
Хлориди концентрація
перевищує 200 мг/дм3
А) Розведення проби
досліджуваної води.
Залізо концентрація перевищує
5 мг/дм3
А) До 100,0см3
проби води додають суспензію гідроксиду алюмінію та перемішують. Дають
відстоятися та фільтрують через фільтр біла стрічка. Перші 5.0 -10,0см3
фільтрату відкидають.
Б) Осадити розведеним
розчином аміаку (1:1) і прокип’ятити до зникнення аміачного запаху. Гідроксид
заліза що утворився, відфільтрувати, осад на фільтрі змити дистильованою водою
і довести до початкового об’єму.
Нітрити концентрація
перевищує 2 мг/дм3
До 20,0см3 проби
води додають 0,05г сірчанокислого амонію і випарюють насухо на водяній бані.
Тривалість виконання окремого
визначення без урахування часу на упарювання 40 хвилин.
Відбір та попередня обробка
проб
Проби води відбирають згідно
з КНД 211 1.0 000 з ГОСТ 17 1 5 05.
Об’єм проби води повинен бути
не менше 100,0см3.
Аналіз виконують у день
відбору проб води.
Якщо аналіз не виконують у
день відбору проб води то пробу консервують додаючи до неї концентрованої
сірчаної кислоти.
Концентровану пробу
зберігають не більше 48 годин.
Засоби вимірювання, реактиви
та матеріали
При виконанні вимірювань за
даною методикою використовують такі засоби вимірювань, допоміжне обладнання,
реактиви та матеріали.
Фотоколориметр або
спектрофотометр, спроможній вимірювати світло поглинання при довжині хвилі 410
нм.
Обладнання:
Фотоколориметр або
спектрофотометр спроможній вимірювати оптичну густину при довжині хвилі 410 нм.
Кювети кварцеві з товщиною
поглинаючого шару 2 см.
Сушильна шафа електрична,
загального лабораторного призначення.
Водяні бані.
Чашки випарні порцелянові.
Терези аналітичні та технічні
загального призначення з похибкою вимірювання 0,0002.
Посуд:
Мірні колби скляні ємкістю
50,0, 100,0 та 1000,0см3.
Піпетки ємкістю 1,2,5см3.
Фільтри беззольні.
Реактиви:
Стандартний зразок нітрату
калію з атестованим вмістом нітрат іонів (наприклад 1 мг/дм3).
Калій нітрат.
Галуни алюмоамонійні.
Вугілля активоване.
Аміак водний.
Амоній сірчанокислий.
Спирт етиловий
ректифікований.
Саліцилова кислота
фармацевтичний препарат.
Сірчана кислота.
Натрію гідроксид.
Калій натрій виннокислий
чотирьох водяний (сегнетова сіль).
Вода дистильована.
Роботу за даною методикою
треба виконувати з додержанням вимог техніки безпеки при роботі з кислотами,
лугами а електроприладами.
Аналіз може виконувати хімік
кий має стаж роботи що найменше шести місяців, та засвоїв дану методику.
Підготовка до вимірювань
Підготовка до засобів
вимірювання
Спектрофотометр або
фотоколориметр, який пройшов державну перевірку і здатний вимірювати оптичну
густину при довжині хвилі 410нм, готують до роботи як вказано в паспорті.
Приготування реактивів:
Для виконання за даною
методикою вимірювань готують такі реактиви:
А) Основний розчин калію
нітрату
На аналітичних терезах беруть
наважку нітрату калію масою 0,1631г висушеного при температурі 1050С
до постійної ваги та кількісно переносять в мірну колбу на 1дм3
Наважку розчиняють в
невеликому об’ємі дистильованої води, та доводять дистильованою водою до мітки.
Отриманий розчин ретельно
перемішують, та переливають в склянку з темного скла.
см3 даного розчину
містить 0,1 мг нітрат іонів.
Робочий розчин нітрату калію
Робочий розчин нітрату калію
готують із основного розчину нітрату калію
Аліквоту основного розчину
нітрату калію об’ємом 10,0см3 кількісно переносять в мірну колбу на
100,0см3 та доводять дистильованою водою до мітки.
Отриманий розчин ретельно
перемішують.
,0 см3 робочого
розчину містить 0,01 мг нітрат іонів.
Змішаний реактив (гідроксид
натрію та сегнетова сіль)
На технічних терезах беруть
наважку гідроксиду натрію 400г та наважку сегнетової солі масою 60г.
Зважені наважки розчиняють в
невеликих об’ємах дистильованої води,та переносять в мірну колбу на 1дм3
після чого охолоджують до кімнатної температури та доводять об’єм в мірній
колбі до мітки дистильованою водою.
Розчин саліцилової кислоти
На аналітичних терезах беруть
наважку саліцилової кислоти масою 1 г та переносять в мірну колбу на 100,0 см3.
Перенесену наважку розчиняють
в невеликому об’ємі етилового спирту, та доводять об’єм до мітки етиловим
спиртом.
Отриманий розчин ретельно
перемішують.
Виконання аналізу:
Побудова градуйованого
графіку:
Вимірювання оптичної густини
холостої проби
В дві керамічні чашки вносять
аліквоти дистильованої води об’ємами по 10,0см3, додають 2,0см3
розчину саліцилової кислоти.
Після додавання саліцилової
кислоти вміст чашок випарюють на водяній бані.
Після випарювання вміст чашок
охолоджують та додають 2,0см3 розчину сірчаної кислоти, та залишають
на 10 хв. при цьому безперервно помішують.
Після додавання до сірчаної
кислоти вміст чашок розводять дистильованою водою об’ємом 15см3, та
переносять в колби на 100,0 см3.
В колби на 100,0см3
приливають 15,0см3 змішаного реактиву, та переносять вміст колб в
мірну колбу на 50,0см3.
Відразу ж вимірюють оптичну
густину при довжині хвилі 410 нм, проти дистильованої води з товщиною поглинаючого
шару 2 мг.
Побудова градуйованого
графіку:
В керамічні чашки вносять
такі об’єми робочих розчинів нітрату калію, що мітить мг нітрат іонів та
додають певні об’єми дистильованої води, для того щоб довести об’єм до 10,0 см3,
(об’єми робочого розчину та дистильованої води можна побачити в таблиці 3.2),та
додають 2,0 см3 розчину саліцилової кислоти.
Після додавання саліцилової
кислоти вміст чашок випарюють на водяній бані.
Після випарювання вміст чашок
охолоджують та додають 2,0см3 розчину сірчаної кислоти, та залишають
на 10 хв. при цьому безперервно помішують.
Після додавання до сірчаної
кислоти вміст чашок розводять дистильованою водою об’ємом 15см3, та
переносять в колби на 100,0см3.
В колби на 100,0см3
приливають 15,0см3 змішаного реактиву, та переносять вміст колб в
мірну колбу на 50,0см3.
Відразу ж вимірюють оптичну
густину при довжині хвилі 410 нм, проти дистильованої води з товщиною
поглинаючого шару 2 мг.
Таблиця 3.1 - Дані до
приготування стандартних розчинів
|
Об’єм робочого розчину нітрату калію см3
|
Кількість мг/дм3 нітрат іонів що
міститься в аліквоті робочого розчину
|
Об’єм дистильованої води який необхідно додати
для того щоб довести об’єм до 10,0см3
|
|
0,5
|
0,005
|
9,5
|
|
1,0
|
0,01
|
9,0
|
|
2,0
|
0,02
|
8,0
|
|
3,0
|
0,03
|
7,0
|
|
4,0
|
0,04
|
6,0
|
|
5,0
|
0,05
|
5,0
|
|
8,0
|
0,06
|
2,0
|
|
10,0
|
0,1
|
---
|
Проведення аналізу:
Пробу об’ємом 100,0см3
обробляють (при необхідності) як вказано в розділі (метод вимірювання).
Для аналізу використовують фільтрат,
об’ємом 0,5 - 10,0см3, в залежності від концентрації нітрат іонів у воді,
але так щоб у відібраній аліквоті було не менше 0,03 мг нітрат іонів.
В дві керамічні чашки вносять
аліквоти досліджуваної води об’ємами по 10,0см3, додають 2,0см3
розчину саліцилової кислоти.
Після додавання саліцилової кислоти
вміст чашок випарюють на водяній бані.
Після випарювання вміст чашок
охолоджують та додають 2,0см3 розчину сірчаної кислоти, та залишають
на 10 хв. при цьому безперервно помішують.
Після додавання до сірчаної кислоти
вміст чашок розводять дистильованою водою об’ємом 15 см3, та
переносять в колби на 100,0 см3.
В колби на 100,0 см3
приливають 15,0 см3 змішаного реактиву, та переносять вміст колб в
мірну колбу на 50,0 см3.
Відразу ж вимірюють оптичну густину
досліджуваної води при довжині хвилі 410 нм, проти дистильованої води з
товщиною поглинаючого шару 2 мг.
.1.2 Методика визначення вмісту
нітрат іонів у стічній воді з саліцилатом натрію
Загальні положення:
Нітрати зустрічаються майже у всіх
видах вод. В поверхневих та підземних водах кількість їх звичайно незначно, проте
в деяких типах підземних вод концентрація нітратів може бути висока.
При концентраціях нітратів 0,5 20
мг/дм3 в питних та поверхневих водах найбільш зручним являється
колориметричне визначення з фенолсульфоновою кислотою. Більша кількість
нітратів можна визначити вказаними методами при відповідному розведенні проби
води.
Для свідку приведено також
колориметричний метод, який складається в відновленні нітратів то нітритів
гідразином - метод застосовується для концентрації нітрат іонів від 0.1 до 2,0
мг/дм3.
Якщо проба не була відпрацьована в
день відбору проби, її зберігають в холодильнику або консервують додаванням 1дм3
концентрованої сірчаної кислоти на 1дм3 проби або 2,0 - 4,0 дм3
хлороформу.
Суть методу визначення вмісту нітрат
іонів у стічних водах фотометричним методом аналізу з саліцилатом натрію:
Визначення засновано на реакції
нітрат іонів з саліцилатом натрію в сірчанокислому середовищі, в результаті
чого утворюється забарвлений в жовтий колір солі нітросаліцилової кислоти.
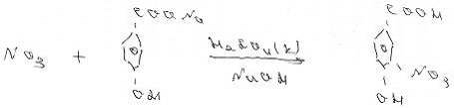
Рисунок 3.3 - Реакція взаємодії
нітрат іонів з саліцилатом натрію з утворенням сполуки 3 - нітросаліцилату
натрію
Без розведення проби можна визначити
від 0,1 до 20 мг/дм3 нітрат іонів.
Заважаючи впливи:
Колоїдні, органічні та забарвлені
сполуки, які присутні в пробі, заважають визначенню.
Концентрація їх в пробі не повинна
перевищувати 10 мг/дм3.
Заважаючи впливи хлоридів можна
видалити додаванням сульфату срібла.
Визначенню потрібного іону заважають
такі іони як хлориди, нітрити а також забарвленість.
Проте при аналізі деяких вод
надлишок іонів срібла викликає забарвленість та утворення муті.
Для під луження проби застосовують
їдкий калій або аміак.
Якщо осадження хлоридів було
застосовано сульфат срібла, то підлужувати в подальшому розчин їдким калієм
неможна, так як цей реактив викликає коричневу окраску.
Тоді замість нього слід
застосовувати розчин аміаку.
При вмісті нітратів більш як 0,7
мг/дм3 отримується підвищенні результати. Забарвлені сполуки не
повинні бути присутніми.
Видалення хлоридів
Визначення в пробі води вмісту
хлоридів.
До 100,0дм3 проби води
додають еквіваленту кількість розчину сульфату срібла (4,40г сульфату срібла ч.
д. а. вільного від нітратів розчиняють в дистильованій воді та доводять до 1дм3).
,0 дм3 розчину відповідає
1 мг хлорид іонів).
Осад хлориду срібла відфільтровують
або центрифугують після попереднього нагрівання суміші.
Целеобразно залишити суміш стояти на
ніч в темному місці.
Видалення забарвлення
До 150,0 дм3 проби води
додають 3,0 дм3 суспензії гідроксиду алюмінію (125 г сульфату
алюмінію та калію та амонію розчиняють в мірній колбі на 1 дм3,
нагрівають до 60 0С та поступово додають 55,0 дм3
концентрованого розчину аміаку при постійному перемішуванні, після часового
відстоювання осад що утворився переносять в великий стакан та промивають
декантацією дистильованою водою до зникнення реакції на вільний аміак, хлориди,
нітрити та нітрати), ретельно перемішують залишають стояти на декілька хвилин
та фільтрують.
Окиснення нітритів до нітратів
До 100,0 дм3 проби води
додають 1,0 дм3 1 н розчину сірчаної кислоти та перемішують.
Потім по краплям додають при
постійному перемішування необхідну кількість 0,1н розчину перманганату калію
або 3% розчин перекису водню.
Перманганат додають в такій кількості,
щоб рожеве забарвлення не зникало протягом п’ятнадцяти хвилин.
Із результатів визначення
вираховують вміст нітритів.
Вони визначаються в окремій пробі
води.
Апаратура:
Фотометри (довжина хвилі 400 - 413
нм).
Кювети довжиною 1 - 5 см.
Водяна баня.
Реактиви:
Саліцилат натрію 0,5% розчин (завжди
свіже приготовлений).
Сірчана кислота (ч. д. а.
концентрована, вільна від нітритів).
Їдкий натр приблизно 10н розчин
(400г натрій гідроксиду розчиняють в дистильованій воді та після охолодження
доводять дистильованою водою до 1дм3).
Нітрат калію (запасний розчин).
На аналітичних терезах беруть
наважку нітрату калію масою 0,1631 г висушеного при температурі 105 0С
до постійної ваги та кількісно переносять в мірну колбу на 1 дм3
Отриманий розчин ретельно
перемішують, та переливають в склянку з темного скла.
см3 даного розчину
містить 0,100 мг нітрат іонів.
Робочий розчин нітрату калію.
Робочий розчин нітрату калію готують
із основного розчину нітрату калію
Аліквоту основного розчину нітрату
калію об’ємом 10,0см3 кількісно переносять в мірну колбу на 100,0см3
та доводять дистильованою водою до мітки.
Отриманий розчин ретельно
перемішують.
,0см3 робочого розчину
містить 0,010 мг нітрат іонів.
Побудова каліброваного графіку:
Калібрований графік будують обробкою
ряду стандартних розчинів, які містять 0 - 0,5 - 1,0 - 2,0 - 5,0 - 10,0 - 20,0
мг стандартних розчинів, які містять 0 - 0,5 - 1,0 и так далі дм3
робочого розчину нітрату калію, доводять об’єм дистильованою водою до 10,0дм3
та закінчують як описано в ході аналізу.
Хід визначення вмісту нітрат іонів у
стічній воді фотометричним методом аналізу з саліцилатом натрію:
До 10,0 дм3 проби води
додають 1,0 дм3 саліцилату натрію та випарюють на водяній бані до
суха в фарфоровій чашці.
Після охолодження до сухого залишку
додають 1,0 дм3 розчину сірчаної кислоти та залишають стояти 10-
хвилин.
Вміст чашки переносять в мірну колбу
ємкістю 50,0 дм3, додають 7 дм3 10 н розчину їдкого
натру, доводять дистильованою водою до мітки та ретельно перемішують.
Після охолодження до кімнатної
температури знову доводять дистильованою водою до мітки та ретельно
перемішують.
Вимірюють оптичне поглинання
забарвленого розчину.
Протягом 10 хвилин після додавання
розчину їдкого натру забарвлення не змінюється.
Із знайдених значень оптичної
густини віднімають значення оптичної густини холостої проби (яка готується
таким же чином що і досліджувана проба тільки замість стічної води беруть
дистильовану воду).
Обробка результатів аналізу:
Вміст нітрат іонів у стічній воді
фотометричним методом аналізу за допомогою реактиву саліцилату натрію
визначається за формулою мг/дм3:
.2 Експерименти по визначенню вмісту
нітрат іонів у стічній воді фотометричним методом аналізу
.2.1 Експеримент по визначенню
вмісту нітрат іонів у стічній воді з саліциловою кислотою
По методики 3.2.1 розділу 3 провели
аналіз на визначення вмісту нітрат іону у стічній воді фотометричним методом
аналізу з саліциловою кислотою та отримали дані, та звели їх у таблицю:
Таблиця 3.2 - Результати аналізу -
визначення вмісту нітрат іонів у стічній воді фотометричним методом аналізу з
саліциловою кислотою
|
Об’єм мірної колби
|
Довжина хвилі
|
Кювета
|
Оптичне поглинання
|
Холоста проба
|
|
50/10
|
410
|
20
|
0,228 0,224
|
0,013
|
|
|
|
0,271 0,278
|
0,010
|
|
|
|
0,245 0,241
|
0,012
|
|
|
|
0,230 0,235
|
0,012
|
|
|
|
0,257 0,252
|
0,012
|
|
|
|
0,267 0,263
|
0,010
|
.2.2 Експеримент по визначенню
вмісту нітрат іонів у стічній воді фотометричним методом аналізу з саліцилатом
натрію
По методики 3.2.1 розділу 3 провели
аналіз на визначення вмісту нітрат іону у стічній воді фотометричним методом
аналізу з саліцилатом натрію та отримали дані, та звели їх у таблицю
Таблиця 3.3 - Результати аналізу
визначення вмісту нітрат іонів у стічній воді фотометричним методом аналізу з
саліцилатом натрію
|
Об’єм мірної колби
|
Довжина хвилі
|
Оптичне поглинання
|
Холоста проба
|
|
50,0дм3
|
400 - 413
|
0,228 0,226
|
0,018
|
|
|
0,272 0,280
|
0,025
|
|
|
0,260 0,245
|
0,035
|
|
|
0,235 0,240
|
0,020
|
|
|
0, 320 0,260
|
0,020
|
|
|
0,269 0,270
|
0,021
|
4. Статистично-математична обробка
результатів аналізу
.1 Математична обробка
результатів аналізу визначення вмісту нітрат іонів у стічній воді фотометричним
методом аналізу
.1.1 Математична обробка результатів
аналізу визначення вмісту нітрат іонів у стічній воді з саліциловою кислотою
Після експериментів по методики
(3.1) розділу 3, по формулам 3.1,3.2, 3.3,та 3.4 проводимо математичну обробку
результатів аналізу визначення вмісту нітрат іонів у стічній воді фотометричним
методом аналізу з саліциловою кислотою
Визначаємо оптичне поглинання проб
стічної води без холостої проби за формулою (3.1) розділу 3:
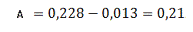
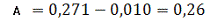
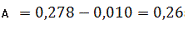
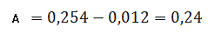
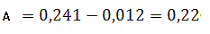
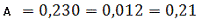
Визначаємо концентрацію(графіку)
проб стічної води за формулою (3.2) розділу 3 в перерахунку на коефіцієнт (0,1416):
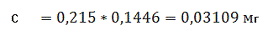
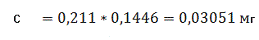
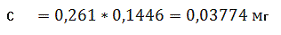
Дані розрахунків результату аналізу
визначення вмісту нітрат іонів у стічній воді фотометричним методом аналізу
зводимо до таблиці (4.1):
Таблиця 4.1 - Результати аналізу
після математичної обробки.
|
Номер проби
|
Концентрація мг/дм3
|
 С,
мг/дм3 С,
мг/дм3
|
|
1
|
С1=3,109 С2=3,051
|
Ссер=3,080
|
|
2
|
С1=3,774 С2=3,875
|
Ссер=3,825
|
|
3
|
С1=3,499 С2=3,311
|
Ссер=3,405
|
|
4
|
С1=3,152 С2=3,222
|
Ссер=3,187
|
|
5
|
С1=3,543 С2=3,470
|
Ссер=3,507
|
|
6
|
С1=3,716 С2=3,658
|
Ссер=3,687
|
.1.2 Математична обробка
результатів аналізу - визначення вмісту нітрат іонів у стічній воді з
саліцилатом натрію
Після експериментів по методики
(3.2) розділу 3, по формулам 3.4, 3.5,3.7, та 3,8 проводимо математичну обробку
результатів аналізу визначення вмісту нітрат іонів у стічній воді фотометричним
методом аналізу саліцилатом натрію:
Визначаємо концентрацію нітрат іонів
у стічній воді за формулою (3.5) розділу 3 в мг ∕ дм3:
Визначаємо оптичне поглинання проб
стічної води за формулою (3.4):
А1 = 0,228-0,018 = 0,21
А2= 0,226-0,018 = 0,208
А3 = 0,272-0,025 = 0,247
А4 = 0,280 - 0,025 =
0,255
А5 = 0,260 - 0,035 =
0,225
А6= 0,245 - 0,035 = 0,21
А7 = 0.235 - 0,020 =
0,215
А8 = 0,240 - 0,020 = 0,22
А9 0,320 - 0,019 = 0,301
А10 = 0,260 - 0,019 =
0,241
А11 = 0,269 - 0,021 =
0,248
А12 = 0,270 - 0,021 =
0,249
Визначаємо концентрацію
(графіку)проб стічної води в перерахунку на коефіцієнт (0,1446) за формулою:
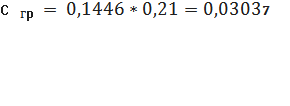
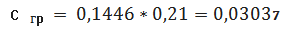 мг
мг
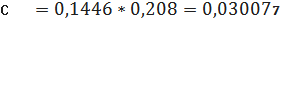
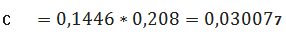 мг
мг
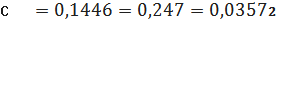
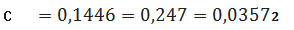 мг
мг
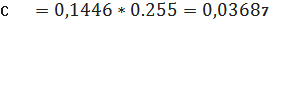
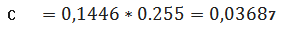 мг
мг
Дані результатів аналізу
визначення вмісту нітрат іонів у стічній воді фотометричним методом аналізу з
саліцилатом натрію зводимо у таблицю (4.2):
Таблиця - 4.2 Результати
аналізу після математичної обробки
|
Номер проби
|
Концентрація мг ∕ дм3
|
|
|
1
|
С1 = 3,037 С2 = 3,0077
|
С сер = 3,022
|
|
2
|
С1 = 3,572 С2 =3,687
|
С сер = 3,630
|
|
3
|
С1 = 3.255 С2 = 3,037
|
С сер = 3.146
|
|
4
|
С1 = 3,109 С2 = 3,181
|
С сер = 3,145
|
|
5
|
С1 = 4.352 С2 = 3,485
|
С сер = 3,917
|
|
6
|
С1 = 3,586 С2 = 3,601
|
С сер = 3,594
|
.2
Статистична обробка результатів аналізу визначення вмісту нітрат іонів у
стічній воді фотометричним методом аналізу з саліциловою кислотою та
саліцилатом натрію
Проводимо статистичну обробку
результатів аналізу зразку, отриманих одним методом але з різними реактивами,
для того щоб визначити істинне значення вибірок, визначити довірчі результати
вибірок та провести перевірку результатів вибірок на достовірність по
дисперсіям та середнім значенням.
Таблиця 4.3 - Результати аналізу
|
Перша вибірка
|
Друга вибірка
|
|
3,080
|
3,022
|
|
3,825
|
3,630
|
|
3,340
|
3.146
|
|
3,187
|
3,145
|
|
3,507
|
3,917
|
|
3,587
|
3,594
|
Основною задачею статистичної
обробки результатів аналізу є встановлення довірчої правильності отриманих
результатів та виключення грубих помилок, а також оцінка метрологічних
характеристик результатів аналізу, що отримані різними методами або одним
методом але з різними реактивами та виявлення із отриманих результатів
випадкових (помилкових) результатів.
Хід статистичної обробки результатів
аналізу
Позначаємо значення першої вибірки
символом 1, значення другої вибірки символом 2 та зводимо результати вибірки до
таблиці (4.4):
Таблиця 4.4 - Результати аналізу
одним методом але з двома реактивами
|
Перша вибірка
|
Друга вибірка
|
|
кількість вимірів
|
Результати Вимірів
|
(ч і - ч)2
|
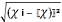
|
кількість вимірів
|
Результати Вимірів
|
(ч і - ч)2
|
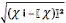
|
|
1
|
3,080
|
0,1369
|
0,37
|
1
|
3,022
|
0,1505
|
0,3879
|
|
2
|
3,825
|
0,1446
|
0,38
|
2
|
3,630
|
0,0484
|
0,22
|
|
3
|
3,405
|
0,002025
|
0,045
|
3
|
3,146
|
0,06970
|
0,2640
|
|
4
|
3,187
|
0,06917
|
0,083
|
4
|
3,145
|
0,07026
|
0,7760
|
|
5
|
3,507
|
0,003249
|
0,057
|
5
|
3,594
|
0,6022
|
0,2651
|
|
6
|
3,687
|
0,5616
|
0,24
|
6
|
3,917
|
0,03386
|
0,1840
|
n- 6 
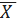 3,45S20,069S 0,26
3,45S20,069S 0,26
S 0,52
S 0,78n- 6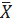
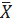 =3,41S2 0,19S 0,45
=3,41S2 0,19S 0,45
S0,9
) Розраховуємо середнє (середньо -
арифметичне)значення вибірок за формулою:

 =
=
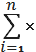
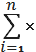 i
i
де:Х 1, Х 2,…Хn-
результати вимірів;кількість вимірів;

 - середнє значення - сукупність
окремих результатів отриманим одним методом,однаковою ретельністю.
- середнє значення - сукупність
окремих результатів отриманим одним методом,однаковою ретельністю.
3) Розраховуємо значення середнього
квадратичного відхилення окремого результату за формулою:
S=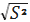
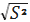
де:S -абсолютне стандартне
відхилення окремого результату;2 - дисперсія.
для I вибірки:=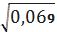
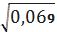 =0, 26
=0, 26
* S = 2 * 0, 26 = 0, 52
* S = 3 * 0, 26 = 0, 78
для II вибірки:=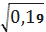
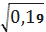 =0, 45
=0, 45
*S = 2 * 0,45 = 0,9
*S = 3 * 0,45 = 1,35
) Розраховуємо довірчий
інтервал вибірок згідно з формулою:
n=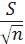
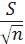
де: Sn - довірчий
інтервал - який залежить кількості вимірів, тобто чим більше значення n тім
менший довірчий інтервал;- абсолютне стандартне відхилення окремого
результату;- кількість вимірів.
для I вибірки:n=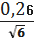
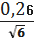 =0, 11
=0, 11
для II вибірки:n=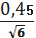
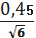 =0, 18
=0, 18
) Встановлюємо істинне
значення вибірок за формулою:

 - Sn*tб< µ <
- Sn*tб< µ <
 +Sn*tб
+Sn*tб
де:µ- істинне значення -
значення, що не має систематичних і випадкових похибок

 - середнє значення вибірки;n
- довірчий інтервал;б- коефіцієнт Стьюдента(довідкова величина) -
показує в скільки разів різниця між істинним та середнім результатами більша
абсолютного стандартного відхилення середнього результату. Знаходять за
таблицею в залежності К - б, де К=n - 1.
- середнє значення вибірки;n
- довірчий інтервал;б- коефіцієнт Стьюдента(довідкова величина) -
показує в скільки разів різниця між істинним та середнім результатами більша
абсолютного стандартного відхилення середнього результату. Знаходять за
таблицею в залежності К - б, де К=n - 1.
Для обох вибірок значення
nоднакове і дорівнює 6, отже знаходимо коефіцієнт Стьюдента:
К=n - 1= 6-1=5, б=95%, tб=2,571
Розраховуємо істинне
значення:
для I вибірки:

 - Sn*tб=3,45-0,11*2,571=3,17
- Sn*tб=3,45-0,11*2,571=3,17

 +Sn*tб=3,45+0,11*2,571=3,73
+Sn*tб=3,45+0,11*2,571=3,73
,17< µ <3,73
µ=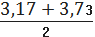
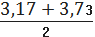 =3,45
=3,45
для II вибірки:

 - Sn*tб=3,41-0,18*2,571=2,94722
- Sn*tб=3,41-0,18*2,571=2,94722

 +Sn*tб=0,95+0,18*2,571=3,8728
+Sn*tб=0,95+0,18*2,571=3,8728
,94722< µ <3,8728
µ=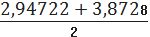
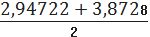 =3,41
=3,41
) Перевіряємо точність
вимірів, тобто виявляємо сумнівні результати за правилом 3S: знаходимо
результати в межах довірчої вірогідності, що дорівнює 
 ±S;
±S; 
 ±2S;
±2S; 
 ±3S
±3S
для I вибірки:

 - S=3,45 - 0,26=3,19
- S=3,45 - 0,26=3,19

 + S=3,45 + 0,26=3,71
+ S=3,45 + 0,26=3,71

 - 2S=3,45 - 2*0,26=2,93
- 2S=3,45 - 2*0,26=2,93 
 + 2S=3,45+2*0,26=3,97
+ 2S=3,45+2*0,26=3,97

 - 3S=3,45 - 3*0,26=2,67
- 3S=3,45 - 3*0,26=2,67 
 + 3S=3,45+3*0,26=4,23
+ 3S=3,45+3*0,26=4,23
Оцінюємо результати за
діапазонами:
Результати в діапазоні 
 ±S=3,19- 3,71 є результатами дуже
високої точності, з вибірки підпадають результати (3,080); (3,187); (3,507);
(3,405); (3,687) що складає:
±S=3,19- 3,71 є результатами дуже
високої точності, з вибірки підпадають результати (3,080); (3,187); (3,507);
(3,405); (3,687) що складає:
результатів - 100%
результатів - х%
звідси х== 83,33%
Результати в діапазоні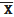
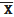 ±2S=2,93 - 3,97 є результатами
достатньої точності, з вибірки підпадають результати; (3,825); що складає:
±2S=2,93 - 3,97 є результатами
достатньої точності, з вибірки підпадають результати; (3,825); що складає:
результатів - 100%
результат - х%
звідси х== 16,67%
У діапазон сумнівної точності
(
 ±3S= 2,67- 4,23) не підпадає ні один
результат, тобто вибірка сумнівних результатів не містить.
±3S= 2,67- 4,23) не підпадає ні один
результат, тобто вибірка сумнівних результатів не містить.
Отже, вибірка має більшість
результатів високої точності.
для II вибірки:

 - S=3,41 -0,45=2,96
- S=3,41 -0,45=2,96 
 + S=3,41 + 0,45=3.86
+ S=3,41 + 0,45=3.86

 - 2S=3,41- 2*0,45=2,51
- 2S=3,41- 2*0,45=2,51 
 + 2S=3,41+ 2*0,45=4,31
+ 2S=3,41+ 2*0,45=4,31

 - 3S=3,41- 3*0,45=2,06
- 3S=3,41- 3*0,45=2,06 
 + 3S=3,41 + 3*0,45=4,76
+ 3S=3,41 + 3*0,45=4,76
Оцінюємо результати за
діапазонами:
Результати в діапазоні 
 ±S=0,64 - 1,26 є результатами дуже
високої точності, з вибірки підпадають результати (3,022);(3,630);(3,146);
(3,145);(3,594) що складає:
±S=0,64 - 1,26 є результатами дуже
високої точності, з вибірки підпадають результати (3,022);(3,630);(3,146);
(3,145);(3,594) що складає:
результатів - 100%
результати - х%
звідси х== 83,33%
Результати в діапазоні 
 ±2S=0,33 - 1,57є результатами
достатньої точності, з вибірки підпадають результати (3,917); що складає:
±2S=0,33 - 1,57є результатами
достатньої точності, з вибірки підпадають результати (3,917); що складає:
результатів - 100%
результат - х%
звідси х== 16,67%
У діапазон сумнівної точності
(
 ±3S=0,02 - 1,88) не підпадає ні один
результат, тобто вибірка сумнівних результатів не містить.
±3S=0,02 - 1,88) не підпадає ні один
результат, тобто вибірка сумнівних результатів не містить.
Отже, вибірка має більшість
результатів достатньої точності.
)Перевіряємо на сумнівність мінімальне
і максимальне значення вибірок по Wmax фактору за формулою:
max= 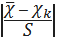
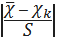
де: 
 - середнє значення вибірки;-
абсолютне стандартне відхилення окремого результату;
- середнє значення вибірки;-
абсолютне стандартне відхилення окремого результату;
чk- сумнівне
значення вибірки.
для I вибірки:
а) для сумнівного
мінімального значенняmin= 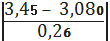
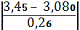 =1, 42
=1, 42
По таблиці знаходимо, що при
n=6 значення 1,16 наближається до мінімального значення по таблиці 2,04, при
якому в=0,1, тобто в нашому випадку в<0,1; отже сумнівне чkне
являється промахом, і ми його залишаємо.
б) для сумнівного
максимального значенняmax= 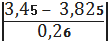
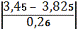 =1, 44
=1, 44
По таблиці знаходимо, що при
n=6 значення 1,36 наближається до мінімального значення по таблиці 2,04, при
якому в=0,1, тобто в нашому випадку в<0,1; отже сумнівне чkне
являється промахом, і ми його залишаємо.
для II вибірки:
а) для сумнівного
мінімального значенняmin= 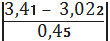
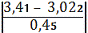 =0, 86
=0, 86
По таблиці знаходимо, що при
n=6 значення 2 наближається до мінімального значення по таблиці 2,04, при якому
в=0,1, тобто в нашому випадку в<0,1; отже сумнівне чkне являється
промахом, і ми його залишаємо.
б) для сумнівного
максимального значенняmax= 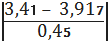
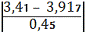 =1, 13
=1, 13
По таблиці знаходимо, що при
n=6 значення 2 наближається до мінімального значення по таблиці 2,04, при якому
в=0,1, тобто в нашому випадку в<0,1; отже сумнівне чkне являється
промахом, і ми його залишаємо.
) Розраховуємо
відтворюваність результатів за формулою:
=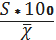
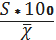
де: S - абсолютне стандартне
відхилення окремого результату;
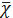
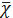 - середнє значення вибірки;-
відносна відтворюваність результатів.
- середнє значення вибірки;-
відносна відтворюваність результатів.
для I вибірки: =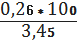
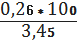 = 7,54%
= 7,54%
для II вибірки:=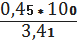
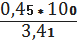 = 13,2%
= 13,2%
)Розраховуємо вірогідну
похибку аналізу по формулі з довірчою вірогідністю б=95%:
е=Sn*tб
де: е - вірогідна похибка
аналізу;n - довірчий інтервал;б- коефіцієнт
Стьюдента(знаходимо за таблицею)
Для обох вибірок значення n
однакове і дорівнює 6, отже знаходимо коефіцієнт Стьюдента:
К=n - 1= 6-1=5, б=95%, tб=2,571
для I вибірки:
е=0,11*2,571=0,28
для II вибірки:
е=0,18*2,571=0,46
) Знаходимо вірогідний
результат вимірів за формулою:
=
 ±е
±е
де:R- вірогідний результат
вимірів;
е - вірогідна похибка
аналізу;

 - середнє значення вибірки.
- середнє значення вибірки.
для I вибірки:=3,45±0,28
для II вибірки:=0,45±0,46
) Розраховуємо збіжність
результатів за формулою:
Р=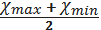
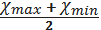
де: Р - збіжність
результатів;
чmax - максимальне
значення вибірки;
чmin - мінімальне
значення вибірки.
для I вибірки:
Р=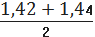
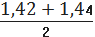 = 1,43
= 1,43
для II вибірки:
Р=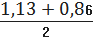
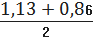 = 0,99
= 0,99
Дані проведеної
статистично-математичної обробки заносимо до таблиці
Таблиця 4.5 - Метрологічні
характеристики визначення вмісту нітрат іонів у стічній воді фотометричним
методом аналізу з саліциловою кислотою та саліцилатом натрію
|
Назва метрологічної характеристики
|
Позначення
|
I вибірка
|
II вибірка
|
|
Кількість визначень
|
n
|
6
|
|
Середній результат вимірів
|

|
3,45
|
3,41
|
|
Дисперсія вибірок
|
S2
|
0,069
|
0,19
|
|
Відтворюваність результатів
|
S
|
0,26
|
0,45
|
|
Довірчий інтервал
|
S n
|
0,11
|
0,18
|
|
Мінімальне значення вибірки
|
W min
|
1,42
|
1,13
|
|
Максимальне значення вибірки
|
W max
|
1,97
|
0,86
|
|
Відносна відтворюваність результатів
|
V
|
7,74%
|
13,2%
|
|
Істинне значення вимірів
|
µ
|
3,45
|
3,41
|
|
Збіжність результатів
|
Р
|
1,43
|
0,99
|
|
Припустима похибка вимірів
|
±е
|
±0,28
|
±0,46
|
|
Вірогідний результат вимірів
|
  ±е3,45±0,280,96±0,31 ±е3,45±0,280,96±0,31
|
|
|
5. Техніка безпеки та охорона
природного навколишнього середовища
.1 Загальні вимоги техніки безпеки в
лабораторії хіміко-аналітичного контролю шкідливих викидів та стоків
Загальні вимоги техніки безпеки в
лабораторії
Вимоги безпеки перед початком роботи
Одягнути спецодяг, що вважається по
нормах, застебнути обшлаг рукавів.
Перевірити справність лабораторного
устаткування, надійність кріплення частин, що обертаються, наявність
обгороджувань і захисних кожухів, блокувань, справність пускової апаратури,
наявність і справність заземлення, вентиляції і освітлення і наявність
нейтралізуючих розчинів.
Про виявлені недоліки доповісти
начальнику групи або інженеру, при можливості усунути їх самостійно або із
залученням відповідних служб випробувального центру.
Вимоги безпеки під час виконання
робіт
Виконувати тільки доручену роботу з
дотриманням вимог правил охорони праці.
На робочому місці підтримувати
порядок, виключити захаращення сторонніми предметами, щоб уникнути випадків
можливого травматизму. Постійно стежити за справністю електропускової
апаратури, лабораторних приладів, вентиляції.
Не залишати своє робоче місце без
нагляду і без дозволу начальника групи аналізу.
Використовувати тільки справний
спецодяг, передбаченої нормами, і закритого взуття, користуватися відповідними
засобами захисту і запобіжними пристроями.
При виникненні ситуацій, небезпечних
для життя і здоров'я, припинити виконання робіт до прийняття заходів, що
усувають небезпечну ситуацію. При нещасному випадку на виробництві вжити
заходів з надання постраждалому першої долікарської допомоги та направити його
в найближчий медпункт чи викликати швидку допомогу за телефоном "03".
Про кожний нещасний випадок на виробництві негайно сповістити начальника групи
аналізу або вище стоячого керівника.
До прибуття комісії з розслідування
нещасного випадку, зберегти робоче місце в стані, при якому стався нещасний
випадок (якщо це не загрожує безпеці оточуючих).
Транспортування кислот, лугів та
інших сильнодіючих хімічних речовин готувати у товстостінному скляному посуді,
який поміщений у спеціальний поліетиленовий ящик з ручками або поліетиленовій
тарі з ручками.
Переносити бутлі з концентрованими
кислотами, лугами та сильнодіючими речовинами повинні дві людини в спецодязі,
призначеною для даного виду робіт (прогумованому фартусі, гумових чоботях і
рукавицях, захисних окулярах).
Розфасовку кислот і лугів виконувати
з використанням спеціальних насосів і сифонів з бутлів, що знаходяться в кошику
або ящику. Набирати концентровані кислоти і луги в піпетку ротом забороняється,
щоб уникнути опіку гортані.
Дотримуватися встановленого порядку
розбавлення концентрованих кислот: кислоту необхідно доливати тільки в холодну
воду тонким струменем при постійному перемішуванні скляною паличкою, а не
навпаки, тому що може відбутися розбризкування кислоти.
Не допускається, щоб уникнути викиду
і розбризкування кислоти, виробляти нейтралізацію концентрованого лугу
концентрованими кислотами і навпаки.
При випадковому пролитті великих
кількостей концентрованої кислоти на підлогу необхідно:
а) провітрити приміщення, для чого
необхідно відкрити вікна чи двері, включити витяжну вентиляцію;
б) засипати кислоту піском і
видалити пісок, просочений кислотою, за межі приміщення у спеціально відведене
місце;
в) нейтралізувати залишки кислоти 5%
содовим розчином і змити великою кількістю води. Дотримуватися особливих
заходів обережності при роботі з плавіковою кислотою (фторидною).
Працювати з плавіковою кислотою в
гумових кислотостійких рукавичках. У місцях роботи з плавіковою кислотою
обов'язкова наявність нейтралізуючого 10% розчину хлористого кальцію.
При подрібненні їдких лугів одягати
захисні окуляри, гумові рукавички, халат, прогумований фартух і головний убір.
Подрібнені шматки їдкого лугу
накривати листовою гумою або серветкою з отвором для зубила.
Пришліфовані пробки в склянках з
концентрованою хлоридною і сульфатною кислотами, бензолом, толуолом та іншими
речовинами, розлив яких у приміщенні може призвести до загазованості,
відкривати у витяжній шафі.
Користуватися з особливою
обережністю ртутними термометрами, не допускати їх биття.
У разі розливу ртуті роблять її
демеркуризацію 10-20% розчином перманганату калію або хлорида заліза (ІІІ).
Вимоги безпеки при роботі з гарячими
рідинами
Переносити посудини (колби,
склянки), що містять гарячу рідину на дерев'яних тацях з бортиками.
Перед нагріванням фільтратів, їх
попередньо перемішують, щоб уникнути утворення шарів рідини з різною
концентрацією і можливого викиду гарячої рідини під час нагрівання.
Знімати гарячі посудини з плити або
виймати з сушильної шафи за допомогою рушників, гумових пальчиків або щипців з
гумовими наконечниками.
При відкриванні посудин з гарячою
рідиною не нахилятися над отвором посудини, користуватися при цьому рушником
або серветкою.
Вимоги безпеки при роботі з газами
та газовими балонами
Всі роботи, що проводяться з газами
(киснем), що знаходяться під тиском, вимагають виконання "Правил будови і
безпечної експлуатації посудин, що працюють під тиском".
Користуватися газами із загальної
магістралі або балонів можна тільки через редуктори.
Відповідальність за зберігання,
транспортування та експлуатацію газових балонів, перевірку відповідності напису
і забарвлення на них несуть особи, які мають посвідчення на право виконання цих
робіт відповідно до розпорядження по випробувальному центру.
Використовувати тільки чистий (не
промаслений) спецодяг та інструмент, апаратуру, призначені для роботи з киснем,
у відповідності з вимогами правил з охорони праці.
Зберігати балони з газами необхідно
в спеціально відведеному для них місці в штативах або стійках, обладнаних
кріпленням.
Транспортувати балони з газами на
спеціальних візках або носилках з накрученими на вентиль захисними ковпаками.
Не допускається перенесення балонів
на плечах.
Уникати ударів по балонам, не
допускати попадання масла або інших жирів на вентиль кисневого балона щоб
уникнути вибуху.
Не допускається встановлення
кисневих балонів поблизу нагрівальних приладів.
Працювати тільки з тими балонами, у
яких вентилі знаходяться в справному стані.
Вимоги безпеки при роботі з скляним
посудом
Не допускається брати в роботу
хімічний посуд з тріщинами або надбитими краями.
Перед одяганням гумової трубки на
склянку, кінець останньої змочити водою або слабким розчином лугу, аміаком,
гліцерином.
Скляні трубки повинні бути з рівно
відрізаними, оплавленими або відшліфованими краями.
Монтаж установок із застосуванням
скляних трубок виробляти спокійно без поспіху, захистивши кисті рук рушником.
При монтажі скляних приладів на
пробках, колбу тримати за горло біля краю (ні в якому разі не тримати за
денце), а другу частину приладу тримати за пробку і обертальними рухами руки
з'єднати частини приладу.
Відкривати пришліфовані пробки на
колбах, банках дуже обережно, обгорнувши горло посудини рушником.
Вимоги безпеки при роботі з
лабораторним електроустаткуванням
Працювати тільки зі справними
приладами та обладнанням, що мають видимий контур заземлення.
Не допускати пошкодження
електропроводів, а також роботи з пошкодженою ізоляцією і відкритими
контактами.
Не допускати обливання
електропроводів та приладів розчинами їдких речовин (розчинами кислот і лугів)
та іншими електропровідними рідинами. Утримувати все електрообладнання в
чистоті.
Систематично стежити за роботою
включеного електрообладнання та у разі виявлення несправностей у роботі,
негайно вимкнути рубильник або автомат на вступному розподільчому щиті і
доповісти начальнику групи аналізу або інженеру групи аналізу.
У разі замикання або загоряння
електропроводки негайно вимкнути рубильник або автомат на вступному
розподільчому щиті.
Щоб уникнути ураження електричним
струмом, не допускається:
а) включати в освітлювальну мережу
електронагрівальні прилади потужністю 1,0 кВт і вище;
б) робити будь-який ремонт
електрообладнання, витирати на ньому пил і т.д. без зняття напруги;
в) користуватися непридатними і
неперевіреними засобами індивідуального захисту (діелектричні килимки і
інструмент з ізольованими ручками);
г) залишати включеним
електрообладнання після закінчення роботи;
д) допускати до роботи працівників,
не навчених правилам безпечної експлуатації електрообладнання.
Ваги включати в мережу, що має
заземлення.
Не допускається робота на вагах при
знятому захисному кожусі.
Не допускається після проведення
робіт залишати ваги включеними в мережу живлення.
Вимоги безпеки при роботі з
сушильною шафою.
Перевірити справність видимого
контуру заземлення.
Перевірити наявність всіх знімних
кожухів блоків.
Провести візуальний огляд сушильної
шафи і робочого місця.
Щоб уникнути опіків виймати з
сушильної шафи гарячий посуд за допомогою рушника або щипців з гумовими
наконечниками.
Забороняється:
а) поміщати в робочу камеру займисті
матеріали;
б) включати сушильну шафу при
знятому кожусі;
в) працювати без заземлення. В кінці
зміни привести сушильну шафу в порядок, прибрати робоче місце.
Вимоги безпеки після закінчення
роботи
При роботі в одну зміну:
а) вимкнути лабораторне обладнання,
керуючись інструкціями для експлуатації заводу-виготовлювача.
б) зняти напругу мережі на
лабораторних щитках і відключити воду.
в) доповісти начальнику групи або,
за його відсутності, начальникові лабораторії про закінчення робіт і повідомити
всі виявлені відхилення в роботі за своїм робочим місцем.
г) провести очищення лабораторного
обладнання після проведення аналізу.
д) прибрати своє робоче місце.
е) зібрати і привести в порядок
робочий інструмент.
є) дотримуватися правил особистої
гігієни, після закінчення роботи ретельно вимити руки, при необхідності
прийняти душ, переодягнутися.
ж) спецодяг зберігати у відведеному
для нього місці.
з) повертатися додому встановленим
маршрутом.
.2 Пожежна безпека
Пожежна безпека - стан об'єкта, при
якому з регламентованою ймовірністю виключається можливість виникнення та
розвиток пожежі і впливу на людей її небезпечних факторів, а також
забезпечується захист матеріальних цінностей.
Небезпечними факторами пожежі і
вибуху, які можуть призвести до травми, отруєння, загибелі або матеріальних
збитків є відкритий вогонь, іскри, підвищена температура, токсичні продукти
горіння, дим, низький вміст кисню, обвалення будинків і споруд.
На підприємствах слід організувати
навчання всіх робітників і службовців з питань пожежної безпеки.
Особи, які не пройшли інструктаж з
пожежної безпеки, вживати заходів щодо усунення порушень вимог правил пожежної
безпеки, брати участь в ліквідації пожеж і загорянь.
Робітники та службовці найбільш
пожежне безпечних дільниць, електрозварники повинні пройти спеціальне пожеж о
технічне навчання та скласти залік.
Співробітники хімічної лабораторії
забов'язані знати пожежну небезпеку хімічних речовин і матеріалів, якими
користуються та дотримуватися заходів безпеки при роботі з ними.
Зберігання в лабораторіях речовин і
матеріалів має здійснюватися суворо за асортиментом.
Не допускається спільне зберігання
речовин, хімічна взаємодія яких може викликати пожежу або вибух.
Лабораторні меблі та устаткування
повинні бути встановлені так, щоб вони не перешкоджали евакуації людей. Ширина
мінімально допустимих проходів між обладнанням повинна бути не менше 1 м.
Робочі столи і витяжні шафи,
призначені для роботи з пожежо- та вибухонебезпечними речовинами, повинні бути
справними, покриті вогнетривкими матеріалами, а при роботі з кислотами, лугами
та іншими хімічно активними речовинами - матеріалами, стійкими до впливу, і
мати бортики.
Легкозаймисті та горючі речовини
повинні зберігатися тільки в тому посуді, яка визначена інструкцією.
Скляні банки повинні знаходитися в
спеціальному металевому ящику з щільно закритою кришкою, стінки і дно якого
викладені азбестом.
На внутрішній стороні кришки має
бути чіткий напис із зазначенням найменування та загальної допустимої норми
зберігання горючих і легкозаймистих рідин для даного приміщення.
Склянки, в яких міститься більше 50
мл ЛЗР (легкозаймисті речовини), повинні зберігатися в залізних ящиках для
пального.
Забороняється зберігати горючі
рідини в поліетиленовому, а також тонкостінному скляному посуді.
Забороняється нагрівати або
переганяти в скляному посуді більше 0,5 л легкозаймистої рідини.
Робота з ЛЗР у кількостях, що
перевищують 0,5 л, проводиться тільки з дозволу завідувача лабораторією.
Забороняється виливати легкозаймисті
та горючі рідини в каналізацію. Відпрацьовані рідини збирають в спеціальну
герметично закриту тару, яку наприкінці робочого дня передають з лабораторії
для регенерації або знищення.
Роботи в лабораторії, які пов'язані
з можливістю виділення токсичних, пожежо- та вибухонебезпечних парів і газів,
повинні проводитися лише у витяжних шафах.
Якщо за умовами експерименту
необхідно виконувати роботу з ЛЗР і ГР (горючими речовинами) поза витяжної шафи
(рідинна хроматографія, тонка ректифікація і т.п.), то на проведення таких
робіт складають інструкцію.
Скляний посуд з кислотами, лугами та
іншими їдкими речовинами дозволяється переносити тільки в спеціальних металевих
або дерев'яних ящиках, викладених зсередини азбестом.
Для сульфатної та нітратної кислоти
допускається використання дерев'яних ящиків, корзин і стружки за умови їх
обробки вогнезахисними засобами.
Банки з лужними металами необхідно
поміщати в металеві ящики з кришками, стінки і дно яких викладені азбестом.
У лабораторії забороняється мати
лужні метали в кількості, що перевищує змінну потребу.
Балони із стиснутим, зрідженими та
розчиненими газами необхідно встановлювати поза будівлею лабораторії в
металевих шафах.
Шафи повинні мати прорізи або
жалюзійні грати для провітрювання. Забезпечення лабораторних приміщень цими
газами, а також киснем має здійснюватися централізовано.
Припливно-витяжні вентиляції у всіх
приміщеннях лабораторії повинні включатися не пізніше ніж за 5 хвилин до
початку робочого дня і виключатися після закінчення роботи.
Проводити роботи в лабораторії при
несправній вентиляції забороняється.
У приміщеннях лабораторії
забороняється: захаращувати коридори і проходи, а також підходи до засобів
пожежогасіння; мити підлогу, стіни та інше лабораторне обладнання бензином,
гасом та іншими легкозаймистими рідинами; прибирати випадково пролиті
вогненебезпечні рідини при запалених пальниках і включених електронагрівальних
приладах. Приміщення лабораторій після закінчення робочого дня можуть бути
закриті лише після відключення всіх працюючих приладів і агрегатів, прибирання
в спеціально відведене місце горючих рідин, виносу із приміщень горючих
відходів і сміття.
Приміщення лабораторії та архіву
повинні бути забезпечені засобами пожежогасіння.
Біля входу в зазначені приміщення
повинні бути вивішені попереджувальні плакати про спосіб гасіння виникаючих у
них загорянь. Способи та засоби пожежогасіння.
В комплексі заходів, що вживаються
для протипожежного захисту лабораторій, важливе значення має вибір найбільш
раціональних способів та засобів гасіння різних речовин та матеріалів.
Горіння припиняється:
а) при охолодженні горючої речовини
до температури нижчої, ніж температура її спалахування;
б) при зниженні концентрації кисню в
повітрі в зоні горіння;
в) при припиненні надходження пари,
газів горючої речовини в зону горіння.
Припинення горіння досягається за
допомогою вогнегасних засобів:
а) води (у вигляді струменя або у
розпиленому вигляді);
б) інертних газів (вуглекислота та
ін..);
в) хімічних засобів (у вигляді піни
або рідини);
г) порошкоподібних сухих сумішей
(суміші піску з флюсом);
д) пожежних покривал з брезенту та
азбесту.
Вибір тих чи інших способів та
засобів гасіння пожеж та вогнегасних речовин і їх носіїв (протипожежної
техніки) визначається в кожному конкретному випадку залежно від стадії розвитку
пожежі, масштабів загорянь, особливостей горіння речовин та матеріалів.
Успіх швидкої локалізації та
ліквідації пожежі на її початку залежить від наявних вогнегасних засобів,
вміння користуватися ними всіма працівниками, а також від засобів пожежного
зв'язку та сигналізації для виклику пожежної допомоги та введення в дію
автоматичних та первинних вогнегасних засобів.
.3 Електробезпека
Електротравматизм людини можливий,
коли при експлуатації електроустановок не виконуються необхідні технічні умови,
коли електроустановка експлуатується на низькому технічному рівні, коли не
виконують вимоги ПУЕ і ПТБ (Правила улаштування електроустановок і правила
техніки безпеки).
Електротравматизм - це результат
порушення вимог правил техніки безпеки та інструктажів, відсутності технагляду
та аварійного режиму роботи електроустановок.
Це наслідок незадовільної ізоляції
струмопровідних частин, перехід напруг на корпус електроустановок, обрив
проводів (і як наслідок - крокова напруга, напруга дотику).
Причиною електротравматизму в
багатьох випадках є непродумані, помилкові дії оперативного обслуговуючого
персоналу.
Можна виділити наступні основні
причини уражень електрострумом:
а) дотик до струмопровідних або не
струмопровідних частин, що опинились під напругою;
б) користування несправним електрообладнанням,
електроінструментом, вимірювальними приладами, лампами і побутовими
електроприладами.
Електрострум - прихований вид
небезпеки.
Людина не має органа чуття на
електрострум, не може ідентифікувати небезпеку на віддалі, тому чверть усіх виробничих
травм - це електротравматизм; 40 % з них - зі смертельним наслідком.
Електрострум характеризується
чотирма особливостями ураження організму:
а) відсутність зовнішніх ознак
небезпеки та раптовість ураження;
б) важкість наслідків електротравми;
в)промисловий струм силою більше 15
мА викликає судоми м'язів, тобто приковує ураженого до струмопровідних частин
електроустановки;
г) існує ймовірність наступного
механічного травмування (при падінні з висоти можливі травми внутрішніх органів
як вторинне ураження). Проходячи через людський організм, електрострум зумовлює
термічну, електролітичну та біологічну дію.
Термічна дія струму спричиняє опіки
тіла, нагрівання і пошкодження кровоносних судин, нервів, мозку та інших
органів і систем, що викликає їх серйозний функціональний розлад. Небезпека
ураження людського організму електрострумом залежить від багатьох факторів,
основні з яких наступні: величина струму, що проходить через тіло
людини;електричний опір тіла людини;тривалість дії струму;рід стуму частота;шлях
проходження струму;індивідуальні особливості організму людини (стан організму,
вік та стать).
Електричний струм силою 1 мА вже
викликає фізіологічні відчуття у людини.
Змінний струм промислової частоти
силою понад 15 мА, постійний струм силою 60 мА і більше можуть викликати явища
паралічу органів дихання і руху (людина сама не може відірватися від джерела
струму).
Зі зростанням величини струму
небезпека уражень зростає.
Струм різної сили викликає різну дію
на людину.
В електроустановках до 1000 В в
техніці способи захисту від уражень електрострумом згідно з ПУЕ і ПТБ ділять на
2 групи:
захист при дотику до струмопровідних
частин;
захист при дотику до не
струмопровідних частин, на які перейшла напруга.
Захист від дотику до струмопровідних
частин досягається надійною електроізоляцією за допомогою блокування і
пристроїв захисного відключення.
Доступ людей до струмопровідних
частин обмежують влаштуванням захисних огороджень, розташуванням
струмопровідних частин на недоступній висоті та в недоступному місці,
попереджувальною сигналізацією. При роботі в електроустановках під напругою
застосовують захисні засоби, що ізолюють і відгороджують людину від
струмопровідних частин або від землі.
В електроустановках та
електромережах при експлуатації електрообладнання згідно з ПУЕ і ПТБ
застосовують наступні захисні засоби:контроль і профілактика пошкоджень
ізоляції;використання малих напруг;електричне і механічне блокування;
сигналізація і маркування;захист від випадкового дотику;захисні засоби і
запобіжні пристрої (ізолюючі захисні засоби, переносні прилади та
пристосування);
захист від переходу високої напруги
на сторону низької.
При захисті від дотику до
струмопровідних частин, на які перейшла напруга,використовуються: захисне
заземлення, захисне занулення, захисне вимкнення, подвійна ізоляція, захисний
розподіл мереж.
5.4 Гігієна праці лаборанта
Лаборанту хімічного аналізу часто
доводиться працювати в несприятливих умовах при високій або над то низькій
температурі повітря, підвищеній вологості, на протягах.
Усі ці фактори можуть призвести до
професійних захворювань дихальних органів, очей і всього організму.
Щоб запобігти тимчасовим або
хронічним професійним захворюванням, слід дотримуватись правил гігієни праці в
лабораторії.
Підвищення і зниження температури в
приміщенні, а також протяги спричиняють захворювання верхніх дихальних шляхів,
а тривала робота при низькій температурі може призвести до обморожування.
Тому для нормальних умов праці в
закритих приміщеннях коливання температури повинно бути від 10 до 20 єС. при
важкій фізичній праці допускається температура до 10 єС. відносна вологість
повітря за цих самих умов має бути не більше 60%, а швидкість руху повітря - не
більш як 0,3 м/с.
Крім влаштування природної
вентиляції (працювати слід при відкритих вікнах), під час роботи треба
користуватись різними захисними приладами і спецодягом, призначеним тільки для
роботи.
Частота коливань інструмента (більше
ніж 1500 хвилин) негативно впливає на нервову систему робітника, а при великій
амплітуді коливання інструмента він може захворіти на вібраційну хворобу.
Тому працювати слід у рукавицях,
оскільки вони частково амортизують удари і лише справними інструментами з
допустимою амплітудою коливання. Робочі місця в лабораторіях повинні бути
достатньо освітленні природним або штучним світлом.
Для забезпечення природного світла
необхідно слідкувати за тим, щоб приміщення, в якому працюють, було очищене від
зайвих матеріалів і пристроїв, шибки вікон і зовнішніх дверей очищені від пилу
і бруду.
Якщо природного світла недостатньо,
то обладнують штучне освітлення.
Електричні лампи повинні освітлювати
робоче місце рівномірно так, щоб не створювались різкі тіні від пристроїв і
пучки променів не потрапляли в очі лаборанта, який працює.
Для захисту робітників лабораторії
від шкідливих виробничих факторів застосовують спеціальні індивідуальні захисні
пристрої.
Для захисту тіла використовують
спец. одяг, органів зору-спец. окуляри з гумовою або шкіряною оправою, яка
щільно прилягає до обличчя.
Особиста гігієна в лабораторії.
Для збереження здоров’я і
працездатності кожен робітник повинен не тільки виконувати правила гігієни
праці, використовувати під час роботи засоби захисту, створювати на робочому
місці належний санітарний стан, а й дотримуватись особистої гігієни в житті.
В лабораторії хімічного аналізу
обладнують тимчасові побутові приміщення, в яких кожен робітник може відпочити
під час обідньої перерви, прийняти їжу.
Кількість санітарно-побутових
приміщень і їхні розміри залежать від кількості робітників, що водночас
працюють.
Перед початком роботи лаборант
повинен одягнути спец. одяг.
Після закінчення робочого дня
спецодяг чистять від пилу, бруду і ховають в індивідуальний ящик.
Після закінчення роботи обличчя і
руки треба добре вимити.
.5 Допомога при нещасних випадках
Перша допомога при зупинці серцевої
діяльності
Причинами порушення або зупинки
серцевої діяльності або дихання в практиці хімічних лабораторій можуть бути або
враження електричним струмом, або гостре отруєння.
Необхідно пам'ятати, що необоротні
процеси в корі головного мозку настають через 5-6 хвилин після зупинки серця
або дихання.
Тому рятування життя потерпілого
повністю залежить від своєчасного і повноцінного проведення реанімаційних
заходів: масажу серця і штучної вентиляції легенів.
Кожен працівник лабораторії, повинен
впевнено володіти цими основними прийомами надання першої допомоги.
Ознаки зупинки сердечної діяльності:
втрата свідомості;припинення пульсу;
припинення дихання; різке збліднення
шкірних покривів; поява рідких судорожних вдихів;розширення зіниць.
В рамках надання першої допомоги
використовується лише непрямий (зовнішній) масаж серця, що полягає в ритмічному
натисканні на передню стінку грудної клітки.
В результаті серце стискається між
грудиною і хребтом і виштовхує зі своїх порожнин кров; у проміжках між
натисканнями серце пасивно розпрямляється і заповнюється кров'ю.
Це вистачає для вступу крові до всіх
органів і тканин тіла і підтримки життя потерпілого.
Масаж серця обов'язково проводиться
у поєднанні із штучним диханням. Із усіх відомих способів штучного дихання, що
не вимагає спеціальних пристосувань, найбільш ефективним і доступним в даний
час визнаний спосіб "з рота в рот" (або "з рота в ніс").
Перша допомога при опіках
Термічні опіки рук I і II ступенем -
найбільші ураження, що часто зустрічається. Проте при пожежах і особливо у
випадках займання одягу можливі і важчі опіки. По мірі важкості опіки прийнято
умовно поділяють на чотири групи:
а) I ступінь - почервоніння шкіри;
б) II ступінь - утворення міхурів;
в) III ступінь - омертвіння окремих
ділянок шкіри;
г) IV ступінь - омертвіння глибше
лежачих тканин.
Опіки I ступеня небезпечні при
ураженні більше 50% поверхні тіла, опіки II ступеня приводять до розвитку
опікового шоку при ураженні 25-30% поверхонь, опіки III ступеня - менше 25%
поверхні (долоня людини рівна приблизно 1% поверхні його тіла).
Завдання першої допомоги при важких
термічних опіках полягає в боротьбі з болем і запобіганні травмуванню,
роздратуванню і забрудненню обпалених ділянок.
При термічних опіках шкіри (окрім
обмежених опіків I ступеня) слід викликати лікаря або негайно доставити
потерпілого до найближчої лікувальної установи.
До надання медичної допомоги
необхідно обережно, не допускаючи травмування, оголювати обпалену ділянку і
закрити її сухою асептичною пов'язкою.
З обпаленої ділянки не можна знімати
прилиплі залишки обгорілого одягу і взагалі як-небудь очищати його.
Дієвим засобом знеболення при опіках
служить використання сухого холоду (лід, сніг, холодна вода в міхурі або
поліетиленовому мішечку) поверх пов'язки.
Охолоджування одночасно зменшує
набряк і запальні процеси в обпалених тканинах.
При опіках II і III ступеню не слід
змочувати обпалені ділянки холодною водою.
В рамках надання першої допомоги не
допускається також промивання важких опіків етиловим спиртом, перекисом водню
або іншими засобами, змащування мазями, жирами і маслами, присипання питною
содою, крохмалем і так далі.
При хімічних опіках уражене місце
промивають струменем води з-під крану протягом тривалого часу - не менше 15
хвилин.
Далі при опіках кислотами і кислото
подібними припікаючи ми речовинами накладають примочки 2%-м розчином
бікарбонату натрію, а при опіках лугами - 2%-м розчином оцтової, лимонної або
виннокам'яної кислот.
Практика показує, що постраждалі або
надають їм допомогу часто недооцінюють необхідність тривалого промивання шкіри
при хімічних опіках.
Вже після декількох хвилин виникає
помилкове відчуття, що агресивна речовина змита повністю.
Проте, як правило, речовина в тій
або іншій мірі проникає углиб уражених тканин і для його видалення потрібний
тривалий час.
Навряд чи доцільно рекомендувати
подібний метод до підтвердження його ефективності у вітчизняній літературі,
проте довільне скорочення мінімального часу промивання (15 хвилин) недопустимо.
Якщо агресивна речовина потрапила на
шкіру через одяг, його слід перед зняттям розрізати ножицями, щоб не збільшити
площу ураження.
Синтетичний одяг може розчинятися в
деяких агресивних речовинах, наприклад, в сульфатній кислоті.
При змиванні водою полімер коагулює
і покриває шкіру липкою плівкою. В цьому випадку промивання не досягає мети.
Необхідно спочатку як можна
ретельніше стерти кислоту з шкіри сухою бавовняною тканиною і лише потім
промивати водою.
Перша допомога при ураженні
електричним струмом
Результат ураження струмом залежить
від тривалості його дії на людину. Тому головне завдання при наданні першої
допомоги - найшвидше звільнити від струму, того хто постраждав від його дії.
У приміщеннях лабораторій це швидше
і найнадійніше досягається шляхом відключення електроенергії загальним
рубильником.
Допускається відключення від мережі
приладу, що викликав ураження. Забороняється доторкатися голіруч до голих
частин тіла потерпілого до розмикання електричного ланцюга.
Після звільнення від дії струму
потерпілому негайно надають медичну допомогу.
Слід пам'ятати, що при ураженнях
електричним струмом, що викликали навіть короткочасну втрату свідомості,
незалежно від самопочуття потерпілого і успішності заходів першої допомоги,
необхідно обов'язково і негайно викликати лікаря Якщо потерпілий знепритомнів,
необхідно в першу чергу перевірити його пульс і дихання.
За наявності дихання і пульсу
необхідно покласти його на спину і повернути голову на бік, щоб попередити
западання язика.
Далі приймають заходи, щоб привести
потерпілого в свідомість - обливають особу холодною водою, дають понюхати вату
змочену нашатирним спиртом, і тому подібне.
Після того, як він прийде в
свідомість, йому дають випити настойки валеріани (15-20 крапель) і гарячого
чаю.
Якщо потерпілий після непритомності
прийшов у свідомість, до приходу лікаря потрібно забезпечити йому повний
спокій, покласти в теплому приміщенні, дати тепле пиття, розстебнути одяг, що
затрудняє дихання.
Не можна залишати потерпілого без
нагляду, дозволяти йому рухатись, а тим більше продовжувати роботу.
Якщо дихання слабке і нерівне,
роблять штучне дихання і масаж серця.
Якщо дихання і пульс відсутні, у
жодному випадку не слід вважати потерпілого мертвим.
Необхідно негайно приступити до
штучного дихання за способом "з рота в рот" з одночасним масажем
серця. Допомога повинна виявлятися безперервно до повного відновлення дихання і
пульсу незалежно від часу, протягом якого потерпілий знаходиться в стані
клінічної смерті.
Підставою для припинення реанімаційних
заходів може служити лише висновок лікаря або повне підставою для припинення
реанімаційних заходів може служити лише висновок лікаря або повне заціпеніння і
пониження температури тіла.
Якщо на тілі потерпілого є опіки,
першу допомогу слід надавати так само як при термічних опіках.
Перша допомога при потраплянні
агресивних речовин в очі
При потрапляння агресивних речовин в
очі необхідне негайне промивання очей водою за допомогою душу або водяного
фонтанчика протягом 10-15 хвилин.
Віка ураженого ока під час
промивання мають бути розсунені. За відсутності фонтанчика струминне промивання
очей може викликати скруту. У таких випадках рекомендується, опустити особу в
таз або велику каструлю з водою.
В разі попадання в очі кислоти після
промивання водою продовжують промивання 2%-м розчином натрію бікарбонату. При
різких болях закапують 1-2 краплі 1%-го розчину новокаїну. Особливо небезпечні
ураження очей лугами.
Після видалення більшої частини лугу
за допомогою струменя води протягом 5-10 хвилин продовжують промивати очі
ізотонічним розчином хлориду натрію ще 30-60 хвилин.
При ураженні очей лугами корисне
промивання теплим 1%-м розчином аскорбінової кислоти. При ураженні очей
хімічними речовинами після ретельного промивання очей слід негайно звернутися
до лікаря, навіть якщо виникло суб'єктивне відчуття, що опік не становить
небезпеки.
Перша допомога при кровотечах
Найбільш частіші причини кровотеч -
порізи рук склом. Можуть траплятися і важчі поранення, але для хімічних
лабораторій вони нехарактерні. Залежно від того, які кровоносні судини
пошкоджені при пораненні, розрізняють кровотечі:
а) капілярне;
б) венозне;
в) артеріальне. При капілярній і
венозній кровотечі кров темна, витікає краплями або суцільним струменем. Спосіб
зупинки капілярної і венозної кровотеч - накладення на рану пов'язки, що
давить. При артеріальній кровотечі кров яскраво-червоного кольору, витікає
пульсуючим струменем. Зупинку артеріальної кровотечі роблять шляхом накладення
джгута або повного згинання кінцівки в суглобі і фіксації її а такому положенні
за допомогою ременя або бинта.
При наданні першої допомоги
необхідно дотримуватися наступних правил:
а) промивати рану можна лише в разі
попадання в неї їдких або отруйних речовин;
б) у випадку якщо в рану попав
пісок, іржа і тому подібне, тоді потрібно промивати її водою без лікарських
засобів;
в) не можна змащувати рану мазями
або засипати порошком - це перешкоджає її загоєнню;
г) при забрудненні рани слід
обережно видалити бруд із шкіри довкола рани по напрямку від країв рани
назовні; очищену ділянку перед накладенням пов'язки змащують настойкою йоду;
д) не можна допускати попадання йоду
всередину рани;
е) не можна торкатися до рани
руками, навіть якщо вони чисто вимиті; не можна видаляти з рани згустки крові,
оскільки це може викликати сильну кровотечу;
є) видаляти з рани дрібні уламки
скла може лише лікар;
.6 Охорона природного навколишнього
середовища
Охорона атмосферного повітря
Це система заходів спрямованих на
запобігання забрудненого атмосферного повітря вище допустимих норм у процесі
господарської діяльності та на відновлення і збереження його якості.
Ряд проблем атмосферного повітря
потребує міжнародного регулювання, тому що з’являються конфліктні ситуації,
пов’язані з перенесенням забруднення з повітрям та водою (кислотні дощі в
Европі, перенесення з Західної та Центральної Европи Україну разом з
атмосферним повітрям сірчистого газу та сульфатів, перенесенням водами.
Підлягають регулюванню заходи,
пов’язані зі споживанням повітря і його змінами по якості складу, що ведуть до
змін погоди й клімату.
Екологічна експертиза обов’язкова
для всіх проектів.
За чистотою атмосферного повітря і
роботою діючого законодавства слідкує санітарно - епідеміологічна служба.
Екологічна проблема - глобальна і
зачіпає інтереси багатомільярдного населення землі. Можна виділити три основні
складові екологічних проблем а) біологічну, б) технічну, в) соціально -
економічну.
Найбільш складною проблемою є
соціально - економічна.
Людство повинно відповісти на
запитання - чи здатне суспільство запобігти глобальній екологічній кризі, чи
воно приречене на загибель від виснаження природних ресурсів і надзабреднення
оточуючого природного середовища.
Загальна картина економічного
розвитку сучасного суспільства.
Світове господарство здатне
випускати за рік 800 млн т чорних металів, - 60 млн т невідомих природних
синтетичних матеріалів, 500 млн т мінеральних добрив, - 8 млн т отруто
хімікатів, - 300 млн т різноманітних вуглеводів, - 120 млн т золи, - 150 млн т
- діоксиду сірки.
У води Світового океану за цей час
потрапляє - 6 - 10 млн и сирої нафти, - 17 млн т - твердого стоку.
Крім того, для іригації
(зрошування), промислового виробництва,побутового обслуговування
використовується більше 15% річкового стоку та скидається в водоймища до 500
млрд. м3 промислових і комунальних стоків. Їх нейтралізація потребує
5 - 10 кратного розведення.
Регіональні забруднення виходять на
глобальний рівень,перетворюючи планету в єдину технобіологічну систему. Це не
проходить безслідно для людини.
У викидах промислових підприємств -
150 шкідливих для здоров’я сполук, частина з яких - мутагенні.
На протязі всього свого існування
людство весь час стоїть перед вічними проблемами: 1. Наступ на природу та її
перетворення. 2. Нестача знань про природу.
У відповідь на це суспільство весь
час відчуває помсту природи за свої дії. Американський вчений Б Коммонер
сформулював чотири основних екологічних закони.: 1. Все пов’язано з усім. 2. За
все треба платити. 3. Нічого не проходить безслідно. 4. Природа знає краще.
У свідомості багатьох людей і до
цього часу існують помилкові твердження відносно природи. Так наприклад,
вважати лісові ресурси джерелом тільки деревини - помилка. Треба пам’ятати, що
значно більше перевищує вартість деревини те, що дає ліс:гриби, ягоди, звірина,
птиця, фітонциди. В кінці кінців ліс - це фільтр, що очищає та підтримує на
належному рівні якості повітря, яким ми дихаємо.
Охорона водного середовища
Основні джерела прісної води на
території України - стоки річок Дніпра, Дністра, Південного Бугу Сіверського
Дінця, Дунаю, з притоками. а також малих річок південного узбережжя Чорного та
Азовського морів. Порушення норм якості води досягло рівнів, які ведуть до
деградації водних екологічних систем, зниження продуктивності водойм. Значна
частина населення України використовує для своїх життєвих потреб недоброякісну
воду, що загрожує здоров’ю нації. Сумарна величина стоків річок України без
Дунаю в середній заводністю рік становить 87,1 млрд куб метрів, знижуючись
умаловодний рік до 55,9 млрд куб метрів. Безпосередньо на території держави
формується відповідно 52,4 і 29,7млрд куб метрів води, решта надходить з
суміжних територій України вкрай нерівномірно і становить 22,5 млрд. куб метрів
на рік (61,7 куб метрів на добу), з яких 8,9 млрд. куб метрів становить додаткову
складову до поверхневого стану. Водозабір підземних вод у складі прогнозних
ресурсів становить 21 %, що свідчить про забезпечення населення та природного
господарства необхідною кількістю води в Україні збудовано 1087 водосховищ
загальним об’ємом понад 55 млрд. куб метрів, 7 великих каналів довжиною близько
2000 кілометрів з подачею на них понад 1000 куб метрів води за секунду, 10
великих водоводів діаметру, по яких вода надходить у маловодні регіони України.
Витати свіжої води в Україні на
одиницю виробленої продукції значно перевищують такі показники у розвинутих
країнах Європи: Франція - в 2,5 рази, ФРН - в 4,3, Великобританія та Швеція - в
4,2 рази.
Забезпечення водою населення України
в повному обсязі ускладнюється через незадовільну якість води та водних
об’єктів. Якість води більшості з них за станом хімічного та бактеріального
забруднення класифікується як забруднена і брудна (IV - V клас якості).
Найгостріший екологічний стан спостерігається в басейнах річок Дніпра,
Сіверського, Дінця, річках Приазов’я, окремих притоках Дністра, Західного Бугу,
де якість води класифікується як дуже брудна (IV - клас). Для екосистем
більшості водних об’єктів України властиві елементи екологічного та
метаболічного регресу.
Для основних забруднюючих речовин
належать нафтопродукти, феноли, азот амонійний та нітритний, важкі метали тощо.
Для переважної більшості підприємств
промисловості та комунального господарства скид забруднюючих речовин істотно
перевищує встановлений рівень гранично допустимого скиду (далі ГДС). Це
призводить до забруднення водних об’єктів, порушення норм якості води.
Основними причинами забруднення поверхневих вод України є: скид неочищених та
не досить очищених комунально-побутових і промислових стічних вод безпосередньо
у водних об’єктів та через систему міської каналізації, надходження до водних
об’єктів забруднюючих речовин в процесі поверхневого стоку води з забудованих
територій та сільгоспугідь; ерозія ґрунтів та водозабірній площі.
Якісний стан підземних вод внаслідок
господарської діяльності також повністю погіршується. Це пов’язано з існуванням
та території України близько 3 тисяч фільтруючих накопичувачів стічних вод, а
також з широким використанням мінеральних добрив та пестицидів. Найбільш
незадовільний якісний стан підземних вод у Донбасі та крив басі. Значну
небезпеку в експлуатаційних свердловинах Західної України становить наявність
фенолів (до 5 - 10 гранично допустимих концентрацій - далі ГДК), а також
підвищення мінералізації та зростання вмісту важких металів в підземних водах Криму.
Проблема екологічного стану водних
об’єктів є актуальною для всіх водних басейнів України. Що ж до Дніпра, водні
ресурси якого становлять близько 80% водних ресурсів України і забезпечують
водою 32 млн. населення та 2/3 господарського потенціалу країн, то це одне з
найважливіших завдань економічного і соціального розвитку та природоохоронної
політики держави.
Це зумовлено складною екологічною
ситуацією на території басейну, оскільки 60% її розорано, на 35 % земля сильно
еродована, на 80% - трансформовано первинний природний ландшафт.
Водосховища на Дніпрі стали
акумуляторами забруднюючих речовин.
Значної шкоди завдано північній
частині басейну внаслідок катастрофи на Чорнобильський АЕС; в критичному стані
перебувають малі річки басейну, значна частина яких втратила природну здатність
до самоочищення. У катастрофічному стані знаходиться річки Нижнього Дніпра, де
щорічно має місце ускладнення санітарно - епідеміологічної ситуації, знижується
вилов риби, блідніє біологічне різноманіття.
Значної шкоди екосистемі Дніпра
поряд із щорічним забрудненням басейну органічними речовинами (40 тисяч тонн),
нафтопродуктами (745 тонн), хлоридами, сульфатами (понад 400 тонн), солями
важких металів (65 - 70 тонн), завдає забруднення біогенними речовинами
внаслідок використання відсталих технологій сільськогосподарського виробництва,
низької ефективності комунальних та очисних споруд.
Екологічне оздоровлення басейну
Дніпра є одним з найважливіших пріоритетів державної політики у галузі охорони
та відтворення водних ресурсів. 27 лютого 1997 року Верховною Радою України
затверджена Національна програма екологічного оздоровлення басейну Дніпра та
поліпшення якості питної води. Основною метою Національної програми є
відновлення і забезпечення сталого функціонування Дністровської екологічної
системи, якісного водопостачання, екологічно безпечних умов життєдіяльності
населення і господарської діяльності та захисту водних ресурсів від забруднення
та виснаження. Не в кращому, а подекуди і в гіршому стані перебувають басейни інших
річок України (Сіверського Дінця, Дністра, Західного Бугу Південного Бугу,
басейни річок Приазовської та Причорноморської низовини).
Тому мета та стратегічні напрямки,
визначенні Національною програмою для Дніпра, є аналогічними і для інших водних
басейнів України.
Системний аналіз сучасного
екологічного стану басейнів річок України та організації управління охороною і
використанням водних ресурсів дав змогу окреслити коло найбільш актуальних
проблем, які потребують розв’язання,саме: надмірне антропогенне навантаження на
водні об’єкти внаслідок екстенсивного способу ведення водного господарства
призвело до кризового зменшення само відтворюючих можливостей річок та
виснаження водо ресурсного потенціалу; стала тенденція до значного забруднення
водних об’єктів внаслідок неупорядкованого відведення стічних вод від населених
пунктів, господарських об’єктів і сільськогосподарських угідь;широкомасштабне
радіаційне забруднення басейнів багатьох річок внаслідок катастрофи на
чорнобильський АЕС; погіршення якості питної води внаслідок незадовільного
екологічного стану джерел питного водопостачання; недосконалість економічного
механізму водокористування і реалізації водоохоронних заходів, недостатня
ефективність існуючої системи управління охороною та використанням водних
ресурсів внаслідок недосконалості нормативно - правової бази і організаційної
структури управління; відсутність автоматизованої постійно діючої системи
моніторингу екологічного стану водних басейнів акваторії Чорного та Азовського
морів, якості питної води і стічних вод у системах водопостачання і
водовідведення насалених пунктів і господарських об’єктів.
Висновки
Провівши теоретичні та
експериментальні дослідження по визначенню вмісту нітрат іонів у стічній воді
фотометричним методом аналізу з двома реактивами саліциловою кислотою та
саліцилатом натрію у шести паралелях, виконавши математичну та статистичну
обробку отриманих результатів аналізу розрахованим по метрологічним
характеристикам, можна зробити наступні висновки:
Розрахувавши середнє значення двох
вибірок х - ми бачимо, що вони близькі один до одного (3,45 - 3.41), це
свідчить про те, що результати вимірів з достатньою ретельністю.
Дисперсія двох вибірок показує, що
випадкові відхилення які треба очікувати при повторних вимірах будуть незначні
(с саліциловою кислотою дисперсія 0,069а з саліцилатом натрію 0,19).
Фотоколориметричний метод аналізу
використовують лише при дотримані закону Бугера-Ламберта-Бера: оптичне
поглинання світлового променю забарвленим розчином прямо пропорційне його
концентрації та товщині поглинаючого шару, крізь який проходить світловий
промінь
Закон Бугера-Ламберта-Бера має певні
обмеження за рахунок порушення прямо пропорційної залежності між А і С, а саме:
якщо утворені забарвлені молекули
або комплекси мають низьку стійкість на протязі певного часу;
якщо в забарвленому розчині присутні
сторонні електроліти, які здатні деформувати забарвлені молекули;
якщо під час виміру в забарвленому
розчині відбуваються побічні процеси(гідроліз, конденсація, комплексоутворення,
полімеризація);
якщо температура розчинів
змінюється;
закон дотримується тільки для систем
у яких світло поглинання ведеться тільки частинками одного виду;
не дотримується при концентрації
забарвленого розчину більше 1 моль/л, так як відбувається деформація
забарвлених молекул і в результаті чого інтенсивність забарвленого розчину не
відповідає дійсності
Якщо вище перераховані умови
дотримуються, то можна виконувати фотоколориметричний аналіз, так як
відбувається дотримання основного закону Бугера-Ламберта-Бера.
При побудуванні кривої Гауса видно
що крива першої та другої вибірки майже однакові, та мають голкоподібну форму.
Із розрахунків видно що найменшою
похибкою виміру є похибки результатів отриманих при визначенні вмісту нітрат
іонів з реактивом саліциловою кислотою тому визначати вміст нітрат іонів у
стічній воді з даним реактивом краще, так як цей метод являється достатньо
точним та несе меншу похибку.
вода хімічний нітрат іон
Перелік посилань
1. Борисова О.М. Хімічні,
фізико хімічні та фізичні методи аналізу. Підручник для технікумів. Металургія
2011- 272с.
. Шапіро С.А., Шапіро
М.А. Аналітична хімія. Підручник для вузів - М. Вища школа 1971- 342с.
. Бедрій Я.І. Охорона
праці. Підручник для вищій начальних закладів - 258с.
. Білявський Г.О., Падун
М.М., Фурій Р.С Основи загальної екології. Підручний для вищих навчальних
закладів.
. Барковский В.Ф.
Городенцова Т.Б. Топорова Н.Б. Основы физико химических методов анализа.
Учебник для техникумов.
. Борисова О.М.
Сальников В.Д Химические, физико-химические и физические методы анализа. М.:
Металлургия,1991 = 269с.
. Воскресенский П.И.
Неймарк А.М. Основы химического анализа - М Просвещение, 2009 - 192с.
. Глушман Л.Д. Эдельман
И.И. Лабораторный контроль коксохимического производства - М. Металлургия 1968
- 472с.
. Крешков А.П.,
Ярославцев А.А. Курс аналитической химии в 2-х кн. Учебник для техникумов - М.:
Химия 2008.
. М.Э. Поллес.
Аналитическая химия. 1981 г. - 271с.
. К.И. Годовская, Л.И.,
Рябина, Г.Ю. Новик, М.М. Гернер. Технический анализ. 2009 г. - 479с.