Газовые законы и скорость химической реакции
МЕЛИТОПОЛЬСКИЙ
ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ БОГДАНА ХМЕЛЬНИЦКОГО
Кафедра
химии и методики преподавания химии
ГАЗОВЫЕ
ЗАКОНЫ И СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Курсовая
работа
по
неорганической химии
Студента
22 гр. хб фак.-та дневной формы обучения
Яковейчука
Александра Владимировича
Научный
руководитель: ассистент
Янкив
К.Ф.
Мелитополь-2010
Введение
Данная работа посвящена свойствам газообразных
веществ и газовым законам, а именно более детальному их изучению для раскрытия
и глубокого изучения кинетических представлений и кинетических свойств,
объяснению процессов которые происходят с газовой (гомогенной) системой , а
именно изменение скорости химической реакции, при воздействии на нее различных
факторов: таких как изменение температуры, давления и объема. Так же не малая
часть данной работы посвящена раскрытию общих понятий кинетической химии в
целом таких как скорость химической реакции и факторы которые на нее влияют ,
не только в истинно газовой (гомогенной) смеси но и в других как гомогенных так
и гетерогенных смесях.
Данная работа является очень интересной и с
точки зрения практической значимости, поскольку знание скоростей химических
реакций в газовых системах и умение объяснить их с точки зрения газовых законов
имеет очень большое научное, и что самое главное промышленное значение.
Поскольку в химической промышленности от скорости химической реакции зависят
размеры установок, производительность аппаратов, количество производимого
сырья, и качество вырабатываемого продукта что является очень не маловажным и
даже можно утверждать определяющим в производстве газообразных реактивов и всей
промышленности в целом.
Актуальность: Решение данной проблемы, а именно
глубокое изучение кинетических представлений с точки зрения газовых законов,
является очень актуальной, Поскольку данные темы в курсе химической кинетики
являются очень не однозначными и трудно воспринимаемыми. И тем более
сопоставление этих двух тем между собой не является успешным. По этому в ходе
данной работы мы попробуем более качественно и доступно рассмотреть процессы
изменения скорости химической реакции под действием различных факторов с точки
зрения газовых законов.
Целью данной работы является изучение процессов
изменения скорости химической реакции под действием различных факторов, и
пояснение их с точки зрения газовых законов.
Нами была предпринята попытка решить следующие
задачи:
. Ознакомиться с различными источниками
литературы по теме исследования
. Дать понятие скорости химической
реакции и газовых законов
. Определить факторы влияющие на скорость
химической реакции в целом, и исключительно для газовой смеси
. Описать суть основных газовых законов
. Объяснить изменение скорости химической
реакции при помощи газовых законов
. Сформировать выводы.
Объект исследования: Газовые законы и скорость
химической реакции.
Предмет исследования: влияние различных факторов
на скорость химической реакции с точки зрения газовых законов.
Новизна данной работы заключается в том, что в
ходе ее написания впервые было использовано обоснование изменения скорости
химической реакции с точки зрения газовых законов.
Методы исследования: анализ литературы,
обобщение, сравнение, формулирование выводов, измерение, эксперимент,
наблюдение.
Практическая значимость: Данная работа позволяет
более глубоко изучить материал касающийся понятий газовых законов и скорости
химической реакции.
РАЗДЕЛ 1. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. ФАКТОРЫ
ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
1.1 Скорость химической
реакции
Химические реакции могут существенно различаться
по времени протекания. Смесь водорода и кислорода при комнатной температуре
может долгое время оставаться практически без изменений, однако при ударе или
поджигании произойдет взрыв. Железная пластина медленно ржавеет, а кусочек
белого фосфора самовоспламеняется на воздухе. Важно знать, насколько быстро
протекает та или иная реакция, чтобы иметь возможность контролировать ее ход.
Количественной характеристикой того, насколько
быстро протекает данная реакция, является скорость химической реакции, т. е.
скорость расходования реагентов или скорость появления продуктов. При этом
безразлично, о каком из участвующих в реакции веществе идет речь, поскольку все
они связаны между собой через уравнение реакции. По изменению количества одного
из веществ можно судить о соответствующих изменениях количеств всех остальных.
Скоростью химической реакции называют изменение
количества вещества реагента или продукта за единицу времени в единице объема
(V):
= ν/(V*T).
Скорость реакции в данном случае обычно выражается
в моль/(л•с).
Приведенное выражение относится к гомогенным
химическим реакциям, протекающим в однородной среде, например между газами или
в растворе:
Газы : 2SO2 + O2 = 2SO3,
Раствор: BаСl2 + Н2SO4 = ВаSО4 + 2НСl.
Гетерогенные химические реакции идут на
поверхности соприкосновения твердого вещества и газа, твердого вещества и
жидкости и т.п. К гетерогенным реакциям относятся, например, реакции металлов с
кислотами:
е + 2НСl = FeСl2 + Н2.
В этом случае скоростью реакции называют
изменение количества вещества реагента или продукта за единицу времени на
единице поверхности (S):
= ν
/(S* T).
Скорость гетерогенной реакции выражается в
моль/(м2•с).
Чтобы управлять химическими реакциями, важно не
только уметь определять их скорости, но и выяснить, какие условия оказывают на
них влияние. Раздел химии, изучающий скорость химических реакций и влияние на
нее различных факторов, называется химической кинетикой.
1.1.1 Понятие про
энергию активации
Столкновение химических частиц приводит к
химическому взаимодействию лишь в том случае, если сталкивающиеся частицы
обладают энергией, превышающей некоторую определенную величину. Рассмотрим
взаимодействие газообразных веществ, состоящих из молекул А2 и В2:
А2 + В2 = 2АВ.
В ходе химической реакции происходит перегруппировка
атомов, сопровождающаяся разрывом химических связей в исходных веществах и
образованием связей в продуктах реакции. При столкновении реагирующих молекул
сначала образуется так называемый активированный комплекс, в котором происходит
перераспределение электронной плотности, и лишь потом получается конечный
продукт реакции:
Энергию, необходимую для перехода веществ в
состояние активированного комплекса, называют энергией активации.
Активность химических веществ проявляется в
низкой энергии активации реакций с их участием. Чем ниже энергия активации, тем
выше скорость реакции. Например, в реакциях между катионами и анионами энергия
активации очень мала, поэтому такие реакции протекают почти мгновенно. Если
энергия активации велика, то очень малая часть соударений приводит к
образованию новых веществ. Так, скорость реакции между водородом и кислородом
при комнатной температуре практически равна нулю.
1.2 Факторы, влияющие
на скорость химической реакции
.2.1 Влияние
концентрации на скорость химической реакции
Важнейший фактор, определяющий скорость
химической реакции, - концентрация. При повышении концентрации реагирующих
веществ скорость реакции, как правило, возрастает. Для того чтобы вступить в
реакцию, две химические частицы должны сблизиться, поэтому скорость реакции
зависит от числа столкновений между ними. Увеличение числа частиц в данном
объеме приводит к более частым столкновениям и к возрастанию скорости реакции.
Для гомогенных реакций повышение концентрации
одного или нескольких реагирующих веществ приведет к увеличению скорости
реакции. При понижении концентрации наблюдается противоположный эффект.
Концентрация веществ в растворе может быть изменена путем добавления или
удаления из сферы реакции реагирующих веществ или растворителя. В газах концентрация
одного из веществ может быть увеличена путем введения дополнительного
количества этого вещества в реакционную смесь. Концентрации всех газообразных
веществ можно увеличить одновременно, уменьшая объем, занимаемый смесью. При
этом скорость реакции возрастет. Увеличение объема приводит к обратному
результату.
Скорость гетерогенных реакций зависит от площади
поверхности соприкосновения веществ, т.е. от степени измельчения веществ,
полноты смешивания реагентов, а также от состояния кристаллических структур
твердых тел. Любые нарушения в кристаллической структуре вызывают увеличение
реакционной способности твердых тел, т.к. для разрушения прочной
кристаллической структуры требуется дополнительная энергия.
Рассмотрим горение древесины. Целое полено горит
на воздухе сравнительно медленно. Если увеличить поверхность соприкосновения
дерева с воздухом, расколов полено на щепки, скорость горения увеличится.
Вместе с тем древесина горит в чистом кислороде значительно быстрее, чем на
воздухе, который содержит лишь около 21% кислорода.
Для протекания химической реакции должно
произойти столкновение частиц - атомов, молекул или ионов. В результате
столкновений происходит перегруппировка атомов и возникают новые химические
связи, что приводит к образованию новых веществ. Вероятность столкновения двух
частиц достаточно высока, вероятность одновременного столкновения трех частиц
существенно меньше. Одновременное столкновение четырех частиц чрезвычайно
маловероятно. Поэтому большинство реакций протекает в несколько стадий, на
каждой из которых происходит взаимодействие не более трех частиц.
Реакция окисления бромоводорода протекает с
заметной скоростью при 400-600 °С:
НВr + O2 = 2Н2О + 2Вr2.
В соответствии с уравнением реакции одновременно
должно столкнуться пять молекул. Однако вероятность такого события практически
равна нулю. Более того, экспериментальные исследования показали, что повышение
концентрации - либо кислорода, либо бромоводорода - увеличивает скорость
реакции в одно и то же число раз. И это при том, что на каждую молекулу
кислорода расходуется четыре молекулы бромоводорода.
Детальное рассмотрение данного процесса
показывает, что он протекает в несколько стадий:
) НBr + О2 = НООВr (медленная реакция);
) НООВr + НВr = 2НОВr (быстрая реакция);
) НОВr + НВr = Н2О + Вr2 (быстрая реакция).
Приведенные реакции, так называемые элементарные
реакции, отражают механизм реакции окисления бромоводорода кислородом. Важно
отметить, что в каждой из промежуточных реакций участвует только по две
молекулы. Сложение первых двух уравнений и удвоенного третьего дает суммарное
уравнение реакции. Общая же скорость реакции определяется наиболее медленной
промежуточной реакцией, в которой взаимодействуют одна молекула бромоводорода и
одна молекула кислорода.
Скорость элементарных реакций прямо
пропорциональна произведению молярных концентраций с (с - это количество
вещества в единице объема, с = ν/V) реагентов,
взятых в степенях, равных их стехиометрическим коэффициентам (закон действующих
масс для скорости химической реакции) который был открыт и сформулирован как
основной постулат химической кинетики В середине XIX в. (1865 г. - Н.Н.
Бекетов, 1867 г. - К. Гульдберг, П. Вааге) и звучит так:
скорость химической реакции прямо
пропорциональна произведению концентраций реагирующих веществ в степенях,
равных коэффициентам перед формулами веществ в уравнении реакции: υ
= k [A]а
* [B] b, для реакции aA + bB = cC + dD, где υ - скорость
химической реакции; [А] - концентрация вещества А; [В] - концентрация вещества
В; k - константа скорости реакции (коэффициент пропорциональности); а и b -
коэффициенты в уравнении реакции.
Из чего видно что если [А]= [В]= 1 моль/л, то
скорость химической реакции (υ) равна
константе (k). Константа скорости реакции зависит от природы реагирующих
веществ, температуры, но не зависит от концентрации вещества.
Например, напишем кинетическое уравнение для
реакции синтеза аммиака
(г) + 3 H2 (г) ↔ 2 NH3 (г):
υ = k [N2] * [H2] 3.
Это справедливо лишь для уравнений реакций,
отражающих механизмы реальных химических процессов, когда стехиометрические
коэффициенты перед формулами реагентов соответствуют числу взаимодействующих
частиц.
Взаимодействие йода с водородом: I2 + Н2 = 2HI -
бимолекулярная реакция. Закон действующих масс для химических реакций разной
молекулярности записывается по-разному.
Мономолекулярные реакции:
А = В + С,
= kcA,
где k - константа скорости реакции.
Бимолекулярные реакции:
А + В = С,
= kcAcВ.
химический реакция скорость
температура
1.2.2 Влияние давления
на скорость химической реакции
Давление так же оказывает очень заметное влияние
на скорость химической реакции, но оно имеет смысл лишь для гомогенных систем,
а именно для газовой. Поскольку при взаимодействии твердых и жидких веществ
между собой или в гомогенных реакциях не какого изменения в скорости не
наблюдается.
При сжатии газовых реакционных смесей
в области давление, ограниченных десятками МПа, наблюдается увеличение скорости
реакций и смещение химического равновесия. Это объясняется главным образом
изменением концентраций реагирующих веществ. Для веществ в конденсированной
фазе или для газов <#"821151.files/image001.jpg">
Рис.1 Изотерма.
2.2 Закон Гей-Люссака.
Изобара
Французский ученый Ж. Гей-Люссак в 1802 году
нашел экспериментально зависимость объема газа от температуры при постоянном
давлении. Данные лежат в основе газового закона Гей-Люссака.
Формулировка закона Гей-Люссака следующая: для
данной массы газа отношение объема газа к его температуре постоянно, если
давление газа не меняется. Эту зависимость математически записывают так:
V/Т=const,
если
P=const и
m=const
Данный закон приближенно можно наблюдать, когда
происходит расширение газа при его нагревании в цилиндре с подвижным поршнем.
Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю
поверхность поршня. Другим проявлением закона Гей-Люссака в действии является
аэростат. Закон Гей-Люссака не соблюдается в области низких температур, близких
к температуре сжижения (конденсации) газов.
Закон справедлив для идеального газа. Он неплохо
выполняется для разреженных газов, которые по своим свойствам близки к
идеальному. Температура газа должна быть достаточно велика.
Графически эта зависимость в координатах V-T
изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют
изобарой. Разным давлениям соответствуют разные изобары. Процесс изменения
состояния термодинамической системы при постоянном давлении называют изобарным
(рис.2 график изобарного процесса).
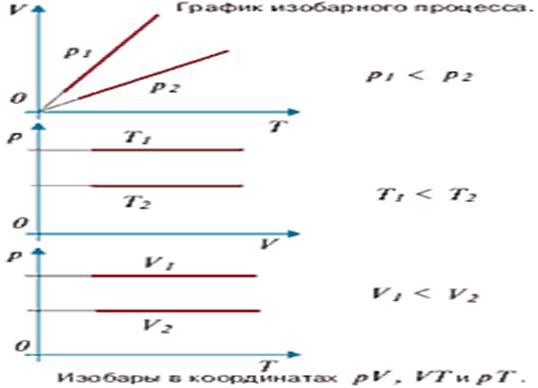
Рис.2 Изобара
2.3 Закон Шарля.
Изохора
Французский ученый Ж. Шарль в 1787 году нашел
экспериментально зависимость давления газа от температуры при постоянном
объеме. Данные лежат в основе газового закона Шарля.
Формулировка закона Шарля следующая: для данной
массы газа отношение давления газа к его температуре постоянно, если объем газа
не меняется. Эту зависимость математически записывают так:
/Т=const, если V=const и m=const
Данный закон приближенно можно наблюдать, когда
происходит увеличение давления газа в любой емкости или в электрической
лампочке при нагревании. Изохорный процесс используется в газовых термометрах
постоянного объема. Закон Шарля не соблюдается в области низких температур,
близких к температуре сжижения (конденсации) газов.
Закон справедлив для идеального газа. Он неплохо
выполняется для разреженных газов, которые по своим свойствам близки к
идеальному. Температура газа должна быть достаточно высокой. Процесс должен
проходить очень медленно
Графически эта зависимость в координатах P-T
изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют
изохорой. Разным объемам соответствуют разные изохоры. Процесс изменения
состояния термодинамической системы при постоянном объеме называют изохорным.
Рис.3 (график изохорного процесса).
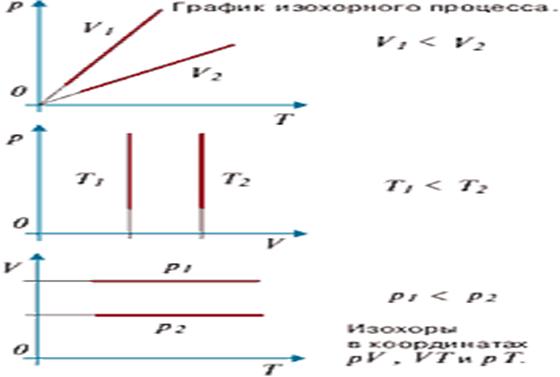
Рис.3 Изохора
РАЗДЕЛ 3. ИЗМЕНЕНИЕ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ
С ПОЗИЦИИ ГАЗОВЫХ ЗАКОНОВ
3.1 Влияние
температуры. Закон Шарля
Нагревание или повышение
температуры является одним из первых условий протекания химических реакций.
Температура - это степень
нагревания или охлаждения, которая может привести к изменению строения вещества
и тем самым обусловить процесс начала и протекания реакции, или вообще
исключить возможность ее протекания.
В ходе нагревания газовой смеси
начинают происходить различные процессы с веществами которые ему подвергаются,
например если нагревать гомогенную смесь кислорода и водовода, в пределах
1000°С, то молекулы начнут диссоциировать на ионы [H+] и [O2-], что в
дальнейшем при их взаимодействии приведет к образованию молекул воды, которое
при обычных (нормальных) условиях не возможно. Так же при нагревании данных
веществ и их диссоциации, ионы получают определенную скорость, которая
обеспечивает при их столкновении преодоление определенного энергетического
барьера который позволяет соединяться данным ионам в молекулы, данный
энергетический барьер как уже упоминалось раньше имеет название энергии
активации.
Абсолютно любое изменение
температуры в смеси газов непременно ведет к изменениям в системе в целом, что
обуславливается изменением кинетической энергии молекул веществ находящихся в
данной системе. При пониженных температурах скорость молекул относительно не
высока что в большинстве случаев препятствует протеканию химических реакций,
при повышении же температуры скорость движения молекул возрастает, что обеспечивает
более частое их столкновение и возможность протекания химической реакции. Как
уже упоминалось раньше повышение температуры на каждые 10°С ведет к увеличению
скорости реакции в 2-4 раза (правило Вант-Гоффа). Исходя из этого закономерным
было бы и повышение скорости молекул в те же 2-4раза, но на самом деле данного
явления не наблюдается. Это все связанно с тем что молекулы газа двигаются
хаотически и постоянно между собой контактируют, число таких контактов
увеличивается с повышением температуры. То есть можно утверждать что повышение
температуры очень близко к повышению концентрации реагирующих веществ. В
реальной жизни мы очень часто наблюдаем реакции которые протекают очень быстро
или наоборот практически не заметно. При столкновении молекул происходят
процессы разрыва одних связей и образования других, что есть основным условием
протекания любой химической реакции. Но для этого процесса необходима
определенная энергия. В данном случае при повышении температуры энергия
накапливается молекулой в результате ее столкновения с другими молекулами, а
так же в результате ударения молекул об стенки горячего сосуда в котором они
находятся, то есть можно утверждать что при столкновениях происходит переход
энергии от одной молекулы к другой, что в последствии ведет к образованию
активных молекул - обладающих высокой кинетической энергией, количество таких
молекул и обуславливают скорость протекания данной реакции.
Для подтверждения допущения что
молекулы которые владеют енергией активации, двигаются с довольно большей
скоростью чем средняя скорость молекул нужно провести ряд расчетов которые
подтверждают данный факт. Например рассмотрим реакцию взаимодействия
Н2 + Вг > НВг + Н Еа =
74кДж/моль
Для протекания данной реакции
необходима энергия активации значением 74кДж/моль что видно из реакции.
По формуле
υ=160 √Т/М
где υ
- средняя
скорость движения молекул (м/с)
Т - температура (К)
М - молярная масса (г/моль)
В ходе расчетов мы выяснили что
для водовода при Т = (27°С) = 300К средняя скорость движения молекул будет
следующей
υ =160 √300/2
= 2816м/с
Кинетическая энергия для 1 моля
любого газа расчитывается по формуле:
Е = Мυ2/2
исходя из этой формулы и
принимая энергию активации за кинетическую мы имеем:
υ = √Еа/0,001М=
√74000/0,001*2 = 6100 м/с
Исходя из этих расчетов видно
что наявность активных молекул средняя скорость их движения становится гораздо
выше примерно в 2 раза, а если увеличивается скорость движения молекул то и
частота их соударений становится выше. Проведя те же расчеты для брома мы
получили следующие данные
υ = 219 м/с
исходя из выражения где энергия
активации принимается за кинетическую средняя скорость движения молекул будет
равна:
υ = 680 м/с
Данные процессы можно объяснить
с помощью газового закона Шарля поскольку в результате повышения температуры
увеличивается значение давления а объем остается постоянным
P/Т=
const , если
V=const .
В ходе таких изменений скорость
движения и частота столкновения молекул увеличивается что провоцирует появление
нових активних молекул и тем самым увеличивает скорость химической реакции.
3.2 Влияние давления и
объема. Закон Бойля-Мариотта и Закон Шарля
Скорость химической реакции обуславливается не
только температурным коэфициэнтом как рассматривалось выше но и многими другими
факторами, например изменением объема и давления.
При повышении давления что может быть
обеспеченно различными способами, например повышением концентрации одного или
даже нескольких реагирующих веществ, путем закачивания их в систему в которой
происходит взаимодействие между данными веществами. В ходе повышения давления
скорость химической реакции значительно увеличивается и равняется изменению
давления то есть:
υ = P
Повышение давления в системе ни как на
изменение, а именно на увеличение скорости движения молекул и ионов не влияет.
Но тога как же и за счет чего происходит ускорение процессов химического
взаимодействия. В данном случае давление можно повысить за счет, например как
уже упоминалось ранее, повышением концентрации одного из веществ системы,
данную процедуру проводят путем введения в смесь дополнительного количества
газа, или путем уменьшения объема исследуемой системы, что в нашем случае
является более простым и целесообразным путем увеличения значения давления. В
результате уменьшения объема, количество вещества в смеси остается постоянным,
но давление создаваемое его молекулами на стенки сосуда увеличивается, и хотя
скорость элементарных частиц остается постоянной, частота соударений их между
собой возрастает. В результате частых соударений энергия отдельных молекул возрастает
и количество таких молекул так же увеличивается. В ходе соударений энергия
достигает значения энергии активации, и реакция начинает идти более энергично и
быстро.
Скорость химической реакции в данном случае
будет повышаться если количество активных молекул будет увеличиваться , то есть
будет повышаться концентрация , которая есть обуславливающим фактором изменения
скорости любой гомогенной химической реакции, если например химическая реакция
идет по схеме:
+B=C
то скорость данной реакции будет выражаться так:
υ= [A][B]
Повышение давления в данном случае мы
обеспечиваем путем уменьшения объема , если сопоставить изменение объема с
концентрацией то мы получим прямую зависимость и выразим ее так:
/V = [A][B]
если подставить данное выражение в формулу
скорости, то выражение примет вид:
Но в данном случае мы рассматриваем влияние
давления на скорость химической реакции, и через давление концентрацию можно
выразить так:
[A][B] = P
Поскольку любое увеличение давления, на такое же
значение и повышает концентрацию. Если подставить данное выражение в уравнение
скорости реакции то мы будем иметь следующее выражение:
υ = [A][B] = P , то есть
υ
= P
Исходя из этого можно подставить два полученных
ранее выражения и тогда мы получим:
υ = [A][B] = P= υ = 1/V
= [A][B]
Сократим тождественные члены и получим:
= 1/V
Это выражение указывает нам на зависимость
давления от объема , но при постоянной температуре. Данную закономерность
описывает закон Бойля-Мариотта. Из уравнения видно что подальше увеличение
давления будет повышать концентрацию что обеспечит увеличение скорости
химической реакции.
В другом случае если оставить давление смеси в
первоначальном значении, а на скорость химической реакции повлиять например
изменением значений температуры или объема что мы рассматривали в случаях выше,
то изменение скорости химической реакции можно будет изобразить таким образом.
Повышение температуры приводит к увеличению скорости движения молекул и тем
самым частоту их соударений, что примерно приводит температуру к значению
равному концентрации, если реакция идет за схемой:
υ= [A][B],
тогда:
= [A][B],
исходя из данного уравнения:
= υ.
Понижение же объема увеличивает частоту
соударений молекул без повышения их скорости, что так же приравнивается к
значению обратно пропорциональному концентрации:
[A][B] = 1/V,
исходя из данного уравнения:
υ = 1/V.
Сопоставив два выше полученных уравнений
получаем:
υ = 1/V = T = υ
После сокращения одинаковых членов данной
пропорции получаем:
/V = T
Тут мы можем видеть зависимость температуры от
давления или наоборот. Данную закономерность выражает газовый закон закон
Гей-Люссака.
ВЫВОДЫ
В ходе данной работы нам удалось проследить
множество закономерностей связанных со скоростью химической реакции и газовых
законов. Мы смогли изучить влияние различных факторов на скорость химической
реакции и объяснили данные изменения с позиции газовых законов. Все полученные
нами данные и закономерности мы смогли получить и изучить только после
ознакомления с различными источниками литературы, которые соответствовали теме
нашего исследовании. В ходе написания данной работы мы выяснили что на скорость
химической реакции влияют такие факторы как: изменение показания температуры
системы , концентрации реагирующих веществ что характерно только для гомогенных
систем, изменение давление оказывает воздействие на скорость химической реакции
лишь в газовой смеси, для всех же остальных систем изменение данного фактора не
к каким изменениям не ведет. Изменение скорости химической реакции путем
изменения объема системы так же свойственно только для газообразных веществ и
ни как не влияет на скорость других реакций. Так же скорость химической реакции
может изменяться в результате изменения площади соприкасающихся поверхностей,
данный фактор имеет смысл только лишь для твердых веществ и гетерогенных
систем. Природа реагирующих веществ является универсальным фактором
обеспечивающим характер протекания химической реакции, и чем более активные
реагенты находятся в системе тем энергичнее идет процесс взаимодействия.
Но все же основной целью нашей работы было
исследование влияния различных факторов, а именно давления, объема и
температуры на протекание химической реакции и объяснение их с помощью газовых
законов. Это нам вполне удалось сделать с помощью различных экспериментов и
сформулированных в процессе изучения литературы знаний и навыков.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Азимов А. Краткая история развития
химии. Развитие идей и представителей в химии. Пер. с англ. - М.: Мир, 1983. -
187с, ил
2. Волков В. А., Вонський Е.В., Кузнецова
Г. И. Вьідающие химики мира. - М.: Вьісш. школа, 1991. - 656 с.
3. Джуа М. История химии - М.: Мир, 1996. -
435с.
4. Кузнецова
Н.Е. Формирование систем понятий в современном обучении химии. - Л.: ЛГПИ им.
А.И. Терцина, 1985.-103 с.
5. Кульман А.Г.Общая химия. - М.: Колос.
1979. - 528 с.
6. Колдин
Е., Быстрые реакции в растворе, пер. с англ., М., 1966
7. Варламова
Т.М., Кракова А.И. Общая и неорганическая химия: Базовый курс. - М.: Рольф,
2000г.
8. Леенсон И.А. Почему и как идут
химические реакции. - М.: МИРОС, 1994.-с.76 - 130.
9. Максимов А. С, Янкив К.Ф. Газові закони
- зв'язуючий елемент природничих наук // Хімія та біологія в школі. - 2007. -
№3. -С. 49-51
. Манолов К. Великие химики. - М.: Мир,
1985. - 396 с.
. .Пилипенко А.Т. Справочник по
элементарной химии. Изд. 2-е, перераб. И доп. К., «Наукова думка», 1977. -
с.103 - 114.
12. Уэйт
Н. Химическая кинетика, пер. с англ. - М. Просвещение, 1994.
13. Кондратьев
В.Н., Определение констант скорости газофазных реакций, ., 1971;
14. Янкив
К.Ф. Газовые законы смещают химическое равновесие. Методика викладання
природничих дисциплін у вищій і середній школі. Матеріали міжнародної
науково-практичної конференції «Методика викладання природничих дисциплін у
вищий школі і середній школі». ХУІКАРИШИНСЬКІ ЧИТАННЯ //За заг.ред. проф..М.В.
Гриньової. - Полтава: Астрая, 2009. - с.231-233.
15. Янків К.Ф., Терно Ю.М. Газові закони в
розчинах. - Нові виміри сучасного світу: Збірник наукових матеріалів V
Міжнародної наукової інтернет-конференції 23 листопада - 15 грудня 2009 р. -
Мелітополь: МДПУ , 2010. - с.48 - 50.
16. Янків К.Ф., Стець М.Л. История развития
газовіх законов. - Нові виміри сучасного світу: Збірник наукових матеріалів V
Міжнародної наукової інтернет-конференції 23 листопада - 15 грудня 2009 р. -
Мелітополь: МДПУ , 2010. - с.52 - 53.
17. Янків К.Ф., Яковійчук О.В. Газові закони.
Кінетичні уявлення. - Нові виміри сучасного світу: Збірник наукових матеріалів
V Міжнародної наукової інтернет-конференції 23 листопада - 15 грудня 2009 р. -
Мелітополь: МДПУ , 2010. - с.57 - 60.
18. <http://www.allbest.ru/>
. <http://www.chem.msu.su/rus/teaching/Kinetics-online/chapter3.html>
. <http://www.chemport.ru/chemical_encyclopedia_article_980.html>
. <http://www.eunnet.net/metod_materials/wm6/gaslaw/problems.htm>
. <http://maratakm.narod.ru/index2.files/a20.htm>
. <http://www.vebtav.ru/texts/072.htm>.