Химическая кинетика и равновесие
Лабораторная работа
Химическая кинетика и
равновесие
Цель работы: изучение влияние температуры на скорость
реакции, концентрации на сдвиг химического равновесия.
Теоретическое обоснование:
Скоростью химической реакции называется количество вещества,
вступающего в реакцию или образующегося в результате реакции за единицу времени
в единице объёма (для гомогенных реакций) или на единице поверхности раздела
фаз (для гетерогенных реакций).
Если за промежуток времени ∆τ = τ2 - τ1 концентрация одного из веществ, участвующих в реакции,
уменьшается на ∆С = С2 - С1, то средняя
скорость химической реакции за указанный промежуток времени равна
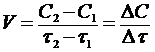 ,
, 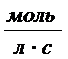

Величина V выражает скорость химического процесса на некотором отрезке
времени. Поэтому чем меньше ∆τ, тем средняя скорость
будет ближе к истинной.
Скорость химической реакции зависит от следующих факторов:
1) природы и концентрации реагирующих веществ;
2) температуры реакционной системы;
) наличия катализатора;
) давления,
) величины поверхности раздела фаз и скорости
перемешивания системы (для гетерогенных реакций);
6) типа растворителя.
Влияние концентрации реагентов. Скорость реакции
пропорциональна числу соударений молекул реагирующих веществ. Число соударений,
в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ.
Общую формулировку влияния концентрации на скорость
химической реакции даёт закон действия масс (1867 г., Гульдберг, Вааге,
Бекетов).
При постоянной температуре скорость химической
реакции пропорциональна произведению концентраций реагирующих веществ, взятых в
степенях их уравнительных (стехиометрических) коэффициентов.
Для реакции аА + вВ = сС V = K[A]а[B]в,
где К - коэффициент пропорциональности или константа
скорости;
Если [А] = 1 моль/л, [В] =1 моль/л, то V = K, отсюда физический смысл
константы скорости К: константа скорости равна скорости
реакции при концентрациях реагирующих веществ, равных единице.
Влияние температуры на скорость реакции. С ростом температуры
увеличивается частота столкновения реагирующих молекул, а следовательно,
увеличивается скорость реакции.
Количественно влияние температуры на скорость гомогенных
реакций может быть выражено правилом Вант-Гоффа.
В соответствии с правилом Вант-Гоффа при повышении
(понижении) температуры на 10 градусов скорость химической реакции
увеличивается (уменьшается) в 2-4 раза:
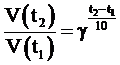 или
или 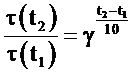 ,
,
где V(t2) и V(t1) - скорости химической реакции при соответствующих температурах; τ(t2) и τ(t1) - продолжительность химической реакции при соответствующих
температурах; γ - температурный коэффициент Вант-Гоффа,
который может принимать числовое значение в интервале 2-4.
Энергия активации. Избыточная энергия, которой должны обладать
молекулы для того, чтобы их столкновение могло привести к образованию нового
вещества, называется энергией активации данной реакции (выражается в кДж/моль).
Одним из способов активации является увеличение температуры: при повышении
температуры число активных частиц сильно возрастает, благодаря чему резко
увеличивается скорость реакции.
Зависимость скорости реакции от температуры выражается уравнением
Аррениуса:
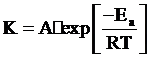 ,
,
где К - константа скорости химической реакции; Eа - энергия активации;
R - универсальная газовая постоянная; А - постоянная; exp - основание натуральных логарифмов.
Величина энергии активизации может быть определена, если известны
два значения константы скорости К1 и К2 при температуре
соответственно Т1 и Т2, по следующей формуле:
Химическое равновесие.
Все химические реакции можно разделить на две группы:
необратимые и обратимые. Необратимые реакции протекают до конца - до полного
израсходования одного из реагирующих веществ, т.е. протекают только в одном
направлении. Обратимые реакции протекают не до конца. При обратимой реакции ни
одно из реагирующих веществ не расходуется до конца. Обратимая реакция может
протекать как в прямом, так и в обратном направлении.
Химическое равновесие - это такое состояние
системы, при котором скорости прямой и обратной реакций равны.
Для обратимой реакции
A
+ nB ⇄ pC + qD
константа химического равновесия равна
 .
.
В обратимых химических реакциях равновесие устанавливается в тот
момент, когда отношение произведения концентраций продуктов, возведенных в
степени, равные стехиометрическим коэффициентам, к произведению концентраций
исходных веществ, также возведенных в соответствующие степени, равно некоторой
постоянной величине, называемой константой химического равновесия.
Константа химического равновесия зависит от природы реагирующих
веществ и от температуры. Концентрации, при которых устанавливается равновесие,
называются равновесными. Изменение внешних условий (концентрации, температуры,
давления) вызывает смещение химического равновесия в системе и переход ее в
новое равновесное состояние.
Подобный переход реакционной системы из одного состояния к другому
называется смещением (или сдвигом) химического равновесия.
Направление смещения химического равновесия определяется принципом
Ле Шателье: если на систему, находящуюся в состоянии химического равновесия,
производить какое-либо внешнее воздействие (изменять концентрацию, температуру,
давление), то в этой системе самопроизвольно возникают процессы, стремящиеся
ослабить произведенное воздействие.
Повышение концентрации одного из исходных реагентов сдвигает
равновесие вправо (усиливается прямая реакция); повышение концентрации продуктов
реакция смещает равновесие влево (усиливается обратная реакция).
Если реакция протекает с увеличением числа молекул газа (т.е. в
правой части уравнения реакции суммарное число молекул газов больше, чем число
молекул газообразных веществ в левой части), то повышение давления препятствует
реакции, а уменьшение давления - благоприятствует реакции.
При повышении температуры равновесие смещается в сторону
эндотермической реакции, а при понижении - в направлении экзотермической
реакции.
Катализатор изменяет в одинаковое число раз как скорость прямой,
так и обратной реакции. Поэтому катализатор не вызывает сдвиг равновесия, а
лишь сокращает или увеличивает время, необходимое для достижения равновесия.
Опыт №1 Зависимость скорости гомогенной реакции
от концентрации исходных реагентов.
ü Приборы, оборудование: пробирки,
секундомер, растворы тиосульфата натрия (III), разб. серной кислоты
(1М), вода.
ü Методика проведения: Эту зависимость можно
изучить на классическом примере гомогенной реакции взаимодействия тиосульфата
натрия с серной кислотой, протекающей по уравнению
Na2S2O3 + H2SO4
= Na2SO4 + S↓ + SO2↑ + H2O.
Сера в первый момент образует с водой коллоидный раствор
(едва уловимое помутнение). Необходимо измерить по секундомеру время от момента
сливания до появления едва заметной мути. Зная время протекания реакции (в
секундах), можно определить относительную скорость реакции, т.е. величину,
обратную времени:
химический гомогенный кинетика
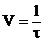 .
.
Для опыта следует приготовить три сухие чистые пробирки,
пронумеровать их. В первую внести 4 капли раствора тиосульфата натрия и 8
капель воды; во вторую - 8 капель тиосульфата натрия и 4 капли воды; в третью -
12 капель тиосульфата натрия. Пробирки встряхнуть.
Если условно обозначить молярную концентрацию тиосульфата
натрия в пробирке 1 через «с», то соответственно в пробирке 2 будет 2 с моль, в
пробирке 3 - 3 с моль.
В пробирку 1 внести одну каплю серной кислоты, одновременно
включить секундомер: встряхивая пробирку, следить за появлением мути в
пробирке, держа ее на уровне глаз. При появлении малейшей мути остановить
секундомер, отметить время реакции и записать в таблицу.
Проделать аналогичные опыты со второй и третьей пробирками.
Данные опыта внести в лабораторный журнал в виде таблицы.
|
№ пробирки
|
Количество капель Na2S2O3
|
Количество капель воды
|
Количество капель H2SO4
|
Концентрация Na2S2O3 в молях
|
Время реакции τ, с
|
Относительная скорость V=1/τ, c-1
|
|
1
|
4
|
8
|
1
|
26,09
|
3,83
|
|
2
|
8
|
4
|
1
|
2с
|
12,19
|
8,2
|
|
3
|
12
|
-
|
1
|
3с
|
8,27
|
12,09
|
ü Вывод: с повышением концентрации
тиосульфата натрия скорость данной реакции возрастает. Графиком зависимости
является прямая линия, проходящая через начало координат.
Опыт №2. Изучение зависимости скорости гомогенной
реакции от температуры.
ü Приборы и оборудование: пробирки,
секундомер, термометр, растворы тиосульфата натрия (III), серной кислоты (1М)
ü Методика проведения:
Приготовить три чистые сухие пробирки, пронумеровать их. В
каждую из них внести по 10 капель раствора тиосульфата натрия. Пробирку №1
поместить в стаканчик с водой при комнатной температуре и через 1…2 минуты
отметить температуру. Затем в пробирку добавить одну каплю серной кислоты,
одновременно включить секундомер и остановить его при появлении слабой, едва
заметной мути. Отметить время в секундах от момента добавления кислоты в
пробирку до появления мути. Записать результат в таблицу.
Затем повысить температуру воды в стакане точно на 100
либо нагреванием на плитке, либо смешиванием с горячей водой. Поместить в эту
воду пробирку №2, выдержать несколько минут и добавить одну каплю серной
кислоты, включив одновременно секундомер, встряхивать пробирку с содержимым в
стаканчике с водой до появления мути. При появлении едва заметной мути
выключить секундомер и внести показания секундомера в таблицу. Аналогичный опыт
провести с третьей пробиркой. Температуру в стакане предварительно повысить ещё
на 100, поместить в неё пробирку №3, выдержать несколько минут и
добавить одну каплю серной кислоты, одновременно включив секундомер и
встряхивая пробирку.
Результаты опытов выразить графиком, откладывая по оси
ординат скорость, а по оси абсцисс - температуру.
Определить температурный коэффициент реакции γ
|
№ Пробирки
|
Температура t, 0C
|
Время реакции τ,
с
|
Относительная скорость реакции 1/τ, с-1
|
Температурный коэффициент γ
|
|
1 2 3
|
23 33 43
|
26,09 17,22 10,74
|
3,83 5,81 9,31
|
1,51 1,6 1,55
|
ü Вывод: в ходе опыта был рассчитан средний
температурный коэффициент, который оказался равным 1,55. В идеале он составляет
-4. Отклонение от идеала можно объяснить погрешностью
измерения времени помутнения раствора. График зависимости скорости реакции от
температуры имеет вид ветви параболы, которая не проходит через 0. С повышением
температуры скорость реакции увеличивается
Опыт №3 Влияние концентрации реагирующих веществ
на химическое равновесие.
ü Приборы и оборудование: пробирки, хлорид
калия (крист.), растворы хлорида железа (III), роданид калия
(насыщ.), дистиллированная вода, цилиндр
ü Методика проведения:
Классическим примером обратимой реакции является
взаимодействие между хлоридом железа и роданидом калия:
FeCl3 + 3 KCNS ? Fe(CNS)3 + 3 KCl.
красного цвета
Образующийся роданид железа имеет красный цвет, интенсивность
которого зависит от концентрации. По изменению окраски раствора можно судить о
смещении химического равновесия в зависимости от увеличения или уменьшения
содержания роданида железа в реакционной смеси. Составить уравнение константы
равновесия данного процесса.
В мерный стаканчик или цилиндр налить 20 мл дистиллированной
воды и добавить одну каплю насыщенного раствора хлорида железа (III) и одну каплю
насыщенного раствора роданида калия. Полученный окрашенный раствор
разлить в четыре пробирки поровну. Пробирки пронумеровать.
В первую пробирку прибавить одну каплю насыщенного раствора
хлорида железа (III).Во вторую пробирку прибавить одну каплю насыщенного раствора
роданида калия. В третью пробирку добавить кристаллический хлорид калия и
сильно взболтать. Четвёртая пробирка - для сравнения.
Исходя из принципа Ле Шателье, объяснить, чем вызвано
изменение окраски в каждом отдельном случае.
Результаты опыта записать в таблицу по форме
|
№ пробирки
|
Что добавлено
|
Изменение интенсивности окраски
|
Направление смещения равновесия (вправо, влево)
|
|
1 2 3
|
|
|
|
В первом во втором случае мы повышали концентрацию исходных
веществ, поэтому получается более интенсивная окраска. Причем во втором случае
окраска темнее, потому что концентрация KSCN изменяется с кубической
скоростью. В третьем опыте мы повышали концентрацию конечного вещества, поэтому
окраска раствора светлей.
Вывод: при повышении и концентрации исходных веществ
равновесие смещается в сторону образования продуктов реакции. При повышении
концентрации продуктов равновесие смещается в сторону образования исходных
веществ.
Общие выводы: в ходе опытов мы экспериментально установили
зависимость скорости реакции от концентрации исходных веществ (чем выше
концентрация, тем выше скорость реакции); зависимость скорости реакции от
температуры (чем выше температура, тем больше скорость реакции); как
концентрация реагирующих веществ влияет на химическое равновесие (при повышении
концентрации исходных веществ химическое равновесие смещается в сторону
образования продуктов; при повышении концентрации продуктов хим. равновесие
смещается в сторону образования исходных веществ)