Производство азотной кислоты
ВВЕДЕНИЕ
Азотная промышленность является
одной из быстро развивающихся отраслей.
Азотная кислота является одним из
исходных продуктов для получения большинства азотосодержащих веществ и
принадлежит к числу важнейших кислот.
По масштабу производства азотная
кислота занимает второе место среди различных кислот после серной. Большой
масштаб производства объясняется тем, что азотная кислота и ее соли приобрели в
народном хозяйстве весьма существенное значение.
Потребление азотной кислоты не
ограничивается производством удобрений. Она находит широкое применение при
получении всех видов взрывчатых веществ, целого ряда технических солей, в
промышленности органического синтеза, при производстве серной кислоты, в
ракетной технике и во многих других отраслях народного хозяйства.
Промышленное производство азотной
кислоты основано на каталитическом окислении аммиака кислородом воздуха с
последующим поглощением образующихся оксидов азота водой.
Целью данного курсового проекта является
рассмотрение
первой
ступени
производства азотной кислоты - контактное окисление аммиака,
а так же расчет материального и теплового балансов реактора.
В технологических схемах получения
азотной кислоты процесс каталитического окисления аммиака имеет важное
значение, так как именно он определяет три основных показателя - расход
аммиака, вложения и потери платиновых металлов, а также энергетические
возможности схемы. В связи с этим совершенствование процесса каталитического
окисления аммиака имеет большое значение для производства азотной кислоты и
минеральных удобрений в целом.
1. ХАРАКТЕРИСТИКА АЗОТНОЙ КИСЛОТЫ
1.1 Сорта азотной
кислоты
В промышленности применяют 2 сорта
азотной кислоты: разбавленную (слабую) с содержанием 30-60 % HNO3
и концентрированную, содержащую 97-99 % HNO3,
а так же сравнительно небольшое количество реактивной и особо чистой азотной
кислоты. Качество выпускаемой азотной кислоты должно соответствовать
установленным стандартам.
По физико-химическим показателям
концентрированная азотная кислота должна удовлетворять нормам,
указанные в таблице 1.
Таблица 1
- Требования к качеству концентрированной азотной
кислоты (ГОСТ 701-89)
|
Содержание, %
|
Норма марки
|
|
А
|
Б
|
|
Массовая доля азотной кислоты, не
менее
|
98,6
|
97,5
|
|
Массовая доля серной кислоты, не
менее
|
0,05
|
0,06
|
|
Массовая доля оксидов азота N2O4, не
более
|
0,2
|
0,3
|
|
Массовая доля остатка после прокаливания, не
более
|
0,014
|
0,025
|
Качество выпускаемой азотной кислоты должно
соответствовать установленным стандартам, указанные в таблице 2 и 3.
Таблица 2
- Требования к качеству неконцентрированной
азотной кислоты (ОСТ 6-03-270-76)
|
Содержание, %
|
Высший сорт
|
1-ый сорт
|
2-ой сорт
|
|
Азотная кислота, не менее
|
57,0
|
56,0
|
46,0
|
|
Оксиды азота (в пересчете на N2O4),
не более
|
0,07
|
0,1
|
0,2
|
|
Прокаленный остаток, не более
|
0,004
|
0,02
|
0,05
|
Таблица 3
- Требования к качеству азотной кислоты (ГОСТ
4461-67)
|
Содержание в %, не более
|
Х.ч.
|
Ч.д.а.
|
Чистая
|
|
Азотная кислота
|
61-68 54-60
|
61-68 54-60
|
61-68 54-60
|
|
Оксиды азота (NO2)
|
0,1
|
0,1
|
0,1
|
|
Остаток после прокаливания
|
0,001
|
0,003
|
0,005
|
|
Сульфаты (SO42)-
|
0,0002
|
0,0005
|
0,002
|
|
Фосфаты (PO43-)
|
0,00002
|
0,0002
|
0,002
|
|
Хлориды (Cl-)
|
0,00005
|
0,0001
|
0,0005
|
|
Железо (Fe)
|
0,00002
|
0,0001
|
0,0003
|
|
Кальций (Ca)
|
0,0005
|
0,001
|
0,002
|
|
Мышьяк (As)
|
0,000002
|
0,000003
|
0,00001
|
|
Тяжелые металлы (Pb)
|
0,00002
|
0,0005
|
0,0005
|
1.2 Применение азотной
кислоты
Азотную кислоту используют в разных
сферах деятельности:
1) при гальванизации и хромирования
деталей;
) для производства минеральных удобрений;
) для получения взрывчатых веществ
(военная промышленность);
) в производстве лекарств (фармацевтика);
) получение азотнокислого серебра для
фотографии;
) для травления и гравировки
металлических форм;
) в качестве сырья для получения
концентрированной азотной кислоты;
) в гидрометаллургии;
) в ювелирном деле - основной способ
определения золота в золотом сплаве;
) для получения ароматических
нитросоединений - прекурсоров красителей, фармакологических препаратов и прочих
соединений, используемых в тонком органическом синтезе;
) для получения нитроцеллюлозы.
1.3 Свойства азотной
кислоты
.3.1 Физические
свойства азотной кислоты
Азотная кислота - одна из сильных
одноосновных кислот с резким удушливым запахом, чувствительна к свету и при
ярком освещении разлагается на один из оксидов азота (ещё называемый бурым
газом
- NO2) и воду. Поэтому её желательно хранить в тёмных
ёмкостях. В концентрированном состоянии она не растворяет алюминий и железо,
поэтому можно хранить в соответствующих металлических ёмкостях. Азотная кислота
- является сильными электролитом (как многие
кислоты) и очень сильный окислитель. Её часто используют при реакциях с
органическими веществами.
Азот в азотной кислоте
четырёхвалентен, степень окисления +5. Азотная кислота - бесцветная, дымящая на
воздухе жидкость, температура плавления -41,59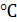 ,
кипения +82,6
,
кипения +82,6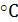 с частичным разложением. Растворимость азотной кислоты в воде не ограничена.
Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной
кислотой», с массовой долей 0,6-0,7 - концентрированной
азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20
= 1,41 г/см, Tкип =
120,7
с частичным разложением. Растворимость азотной кислоты в воде не ограничена.
Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной
кислотой», с массовой долей 0,6-0,7 - концентрированной
азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20
= 1,41 г/см, Tкип =
120,7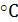 )
)
При кристаллизации из водных растворов азотная
кислота образует кристаллогидраты:
) моногидрат
HNO3·H2O, Tпл = -37,62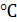 ;
;
2) тригидрат
HNO3·3H2O, Tпл = -18,47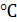 .
.
Азотная кислота, как и озон, может
образовываться в атмосфере при вспышках молнии. Азот, который составляет 78
%
состава атмосферного воздуха, реагирует с атмосферным кислородом, образуя оксид
азота NO. При дальнейшем окислении на воздухе этот оксид переходит в диоксид
азота (бурый газ NO2), который реагирует с атмосферной влагой (облаками и
туманом), образуя азотную кислоту.
Но такое малое количество совершенно
безвредно для экологии земли и живых организмов. Один объем азотной и три
объема соляной кислоты образуют соединение, называемое «царской водкой». Она
способна растворять металлы (платину и золото), нерастворимые в обычных
кислотах. При внесении в эту смесь бумаги, соломы, хлопка, произойдёт
энергичное окисление, даже воспламенение.
1.3.2 Химические
свойства азотной кислоты
Азотная кислота проявляет различные
химические свойства в зависимости от концентрации и вещества, с которым она
реагирует.
Если азотная кислота
концентрированная:
1) с металлами
- железом (Fe), хромом (Cr), алюминием (Al), золотом (Au), платиной (Pt),
иридием (Ir), натрием (Na) - не взаимодействует по причине образования на их
поверхности защитной плёнки, которая не позволяет дальше окисляться металлу. Со
всеми остальными металлами <#"810537.files/image003.gif">10-6
% по массе [17].
3. СЫРЬЕВАЯ БАЗА В
ПРОИЗВОДСТВЕ НЕКОНЦЕНТРИРОВАННОЙ АЗОТНОЙ КИСЛОТЫ
Основным сырьем для
производства неконцентрированной азотной кислоты в настоящее время являются
аммиак, воздух и вода. Вспомогательными материальными и энергетическими
ресурсами являются катализаторы окисления аммиака и очистки выхлопных газов,
природный газ, пар и электроэнергия.
1. Аммиак.
В обычных условиях представляет собой бесцветный газ с резким запахом, хорошо
растворим в воде и других растворителях, образует геми- и моногидраты.
Поворотным этапом в развитии производства синтетического аммиака явилось
применение главенствующего сейчас в промышленности метода получения водорода
конверсией метана, содержащегося в природном газе, в попутных нефтяных газах и
продуктах нефтепереработки. Содержание примесей в жидком аммиаке
регламентируется ГОСТ 6221-82. Наиболее типичными примесями являются: вода,
смазочные масла, катализаторная пыль, окалина, карбонат аммония, растворенные
газы (водород, азот, метан). При нарушении ГОСТ содержащиеся в аммиаке примеси
могут попасть в аммиачно-воздушную смесь и снизить выход оксида азота(II), а
водород и метан могут изменить пределы взрываемости аммиано-воздушной смеси.
. Воздух.
Для технических расчетов принимают, что сухой воздух содержит [%, (об.)]: N2 =
78,1, О2 = 21,0, Ar2 = 0,9, Н2О = 0,1-2,8. В воздухе могут присутствовать также
следы SO2, NH3, CO2. В районе промышленных площадок воздух загрязнен пылью
различного происхождения, а также разнообразными компонентами неорганизованных
газовых выбросов (SO2, SO3, H2S, С2H2, Cl2 и др.). Количество пыли в воздухе
составляет 0,5-1,0 мг/м3.
3. Вода.
Используется в производстве азотной кислоты для орошения абсорбционной колонны,
для выработки пара при утилизации тепла в котлах-утилизаторах, для охлаждения
реакционных аппаратов. Для абсорбции оксидов азота используют чаще всего
паровой конденсат и химически очищенную воду. В некоторых схемах разрешено
применять конденсат сокового пара аммиачной селитры. В любом случае вода,
используемая для орошения колонн, не должна содержать свободного аммиака и
твердых взвесей, содержание хлорид-иона должно быть не более 2 мг/л, масла не
более 1 мг/л, NH4NO3 - не более 0,5 г/л. Химически очищенная вода для
котлов-утилизаторов должна соответствовать требованиям ГОСТ 20995-75.
Техническая вода, предназначенная для отвода тепла в теплообменниках и
охлаждения оборудования (оборотная вода), должна соответствовать следующим
требованиям: жесткость карбонатная не
более 3,6 мэкв/кг, содержание взвешенных веществ
не
более 50 мг/кг, значение pH 6,5-8,5.
4. Кислород.
Применяется преимущественно в производстве концентрированной азотной кислоты по
методу прямого синтеза. В отдельных случаях используется для обогащения аммиачно-воздушной
смеси при получении неконцентрированной азотной
кислоты.
4.
КОНТАКТНОЕ ОКИСЛЕНИЕ АММИАКА
4.1
Физико-химические основы процесса
Современные способы производства
азотной кислоты основаны на контактном окислении аммиака. При окислении аммиака
на различных катализаторах и в зависимости от условий, протекают следующие
реакции:
NH3
+ 5O2 = 4NO
+ 6Н2O
+ 907,3 кДж (14)
4NH3
+ 4O2 = 2N2O
+ 6Н2O
+ 1104,9 кДж (15)
4NH3
+ 3O2 = 2N2
+ 6Н2O
+ 1269,1 кДж (16)
Кроме реакций (14-16)
возможны и другие, протекающие в приповерхностных слоях катализатора. Например,
разложение NO,
взаимодействие N2O,
NO2 и NH3:
NO
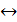 N2+O2 (17)
N2+O2 (17)
2NH3
+ 3N2O
= 4N2+3H2O (18)
NH3 + 6NO2
= 7N2 + 12H2O (19)
Естественно, что реакция (14)
будет являться «полезной». Термодинамические расчеты показывают, что реакции (14-16)
практически протекают до конца.
Константы равновесия для обратных
реакций (14-16)
при 900°С имеют следующие значения
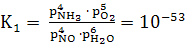 (20)
(20)
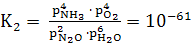 (21)
(21)
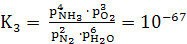 (22)
(22)
K1 = , (23)
, (23)
где k1
- NO + Н2O;
k2 - NH3
+ O2.
При 900 каталитическое превращение аммиака в конечные продукты достигает 100 %, т. е.
процесс практически необратим.
каталитическое превращение аммиака в конечные продукты достигает 100 %, т. е.
процесс практически необратим.
Однако уравнения (14-16)
не отражают действительного механизма процесса,
т. к. в этом случае в реакции (14)
должны были бы одновременно столкнуться девять молекул; в реакции (16)
- семь молекул. Это практически невероятно.
Предложено несколько механизмов
окисления аммиака на катализаторах. Различия в представлениях о механизмах
заключаются в следующем:
1) образование NO
и N2 через промежуточное соединение на катализаторе;
2) образование NO
происходит на катализаторе, а образование N2 на катализаторе и в объеме газа.
На основании сказанного (о
константе равновесия и механизмах окисления) можно констатировать, что
выбранный катализатор должен обладать высокой активностью (большая скорость
реакции и малое время контакта: при его увеличении возрастает вероятность
образования N2) и селективностью по отношению к реакции (14).
Среди нескольких механизмов,
предложенных нашими и зарубежными учеными, наибольшее распространение получил
механизм, предложенный Л.К. Андросовым, Г.К. Боресковым, Д.А. Эпштейном.
Поэтапно механизм можно представить
следующим образом:
1 этап - окисление
поверхности платины. Образуется пероксидный комплекс катализатор-кислород (рисунок
1).
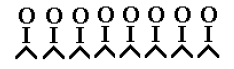
Рисунок
1
- Структура пероксидного
комплекса катализатор-кислород
этап - диффузия
и адсорбция
аммиака на покрытой кислородом поверхности платины. Образуется комплекс
катализатор-кислород-аммиак (рисунок 2).
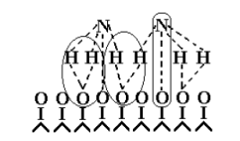
Рисунок 2
- Структура комплекса катализатор-кислород-аммиак
этап -
перераспределение
электронных связей, разрыв старых связей и упрочнение новых связей.
этап -
десорбция
продуктов
и диффузия в поток газа (устойчивые соединения NO
и Н2O
удаляются с поверхности).
Освободившиеся центры вновь
адсорбируют кислород, поскольку скорость диффузии кислорода выше, чем у аммиака
и т. д. По мнению ученых, кислород, входящий в решетку катализатора
(неплатиновый контакт) в реакции окисления аммиака не участвует (доказано с
помощью метода меченых атомов).
Превращение аммиака в азот, по
мнению И.И. Бергера и Г.К. Борескова, может происходить в объеме в результате
реакций аммиака, как с кислородом, так и с оксидом азота.
Различают кинетическую, переходную и
диффузионную области протекания процесса. Кинетическая область свойственна
низким температурам: она ограничивается температурой зажигания катализатора,
при которой отмечается быстрый самопроизвольный разогрев его поверхности, т. е.
до температуры зажигания скорость лимитируется скоростью химической реакции на
контакте. При Т > Тзаж уже диффузия контролирует процесс
- химическая реакция быстрая. Процесс переходит
в диффузионную область. Именно эта область (600-1000 )
характерна для стационарного автотермического процесса в промышленных условиях.
Отсюда следует непременное увеличение объемной скорости газа и уменьшение
времени контакта.
)
характерна для стационарного автотермического процесса в промышленных условиях.
Отсюда следует непременное увеличение объемной скорости газа и уменьшение
времени контакта.
Реакция окисления аммиака на
активных катализаторах начинается раньше: на палладие
(Pd)
при 100 ,
на
платине
(Pt)
при 145
,
на
платине
(Pt)
при 145 ,
на
железе
(Fe)
при 230
,
на
железе
(Fe)
при 230 ,
на оксидах металлов температура начала реакции колеблется в широких пределах.
Вместе с тем достаточной скорости и степени превращения она достигает при Т
> 600
,
на оксидах металлов температура начала реакции колеблется в широких пределах.
Вместе с тем достаточной скорости и степени превращения она достигает при Т
> 600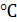 [13].
[13].
4.2 Катализаторы
окисления аммиака
Почти на всех азотнокислотных
заводах в качестве катализатора для окисления аммиака применяют платину или ее
сплавы.
Платина является дорогим
катализатором, но зато она в течение длительного времени сохраняет высокую
активность, обладает достаточной устойчивостью и механической прочностью и
легко регенерируется. Наконец, при современной сетчатой форме катализатора
применение платины дает возможность использовать наиболее простой тип
контактных аппаратов. Она легко разжигается, и расход ее на единицу продукции
незначителен.
В производстве азотной кислоты не
применяют носителей для платины и ее сплавов, так как при наличии носителей
относительно быстро падает активность катализатора и затрудняется регенерация
его. На современных заводах платину для катализаторов применяют в виде сеток.
Сетчатая форма создает большую поверхность катализатора в контактном аппарате
при относительно малом расходе платины. Обычно применяют сетки, в которых
диаметр проволоки равен 0,045-0,09 мм с размерами со стороны ячейки 0,22 мм.
Площадь сеток, не занятая проволокой, составляет примерно 50-60
%
всей ее площади. При применении нитей другого диаметра число плетений изменяют
с таким расчетом, чтобы свободная площадь, не занятая проволокой, оставалась в
указанных пределах.
В контактных аппаратах, работающих
под атмосферным давлением. устанавливают от 2 до 4 сеток, большей частью 3, а в
аппаратах, работающих под давлением до 8 атм,
- от 13 до 16 сеток. При установке одной сетки часть молекул аммиака не
соприкасается с катализатором, что понижает выход окиси азота. В наилучших
условиях на одной сетке степень контактирования может достигать 86-90
%,
на двух сетках 95-97
%,
а на трех 98 %.
При работе под атмосферным давлением не применяют больше 4 сеток, так как при
большом количестве сеток хотя производительность контактного аппарата и
возрастает, но сильно увеличивается сопротивление газовому потоку. Сетки должны
плотно прилегать друг к другу, так как, в противном случае, в свободном
пространстве между сетками протекает ряд гомогенных реакций, снижающих выход
окиси азота.
В процессе работы платиновые сетки
сильно разрыхляются. Гладкие и блестящие нити их делаются губчатыми и матовыми,
эластичные сетки делаются хрупкими. Образование губчатой, разрыхленной
поверхности увеличивает толщину нитей. Все это создает сильно развитую
поверхность сеток, повышающую каталитическую активность платины. Только
отравление катализатора примесями, поступающими с газами, может в дальнейшем
вызвать снижение его активности.
Разрыхление поверхности платиновых
сеток с течением времени приводит к сильному разрушению сеток, что вызывает
большие потери платины.
Платина, предназначенная для
изготовления катализатора, не должна содержать железа, которое уже при 0,2 %
значительно снижает выход окиси азота.
Чистая платина при высоких
температурах быстро разрушается, и ее мельчайшие частички уносятся с потоком
газа. Другие металлы платиновой группы в чистом виде в качестве катализаторов
не применяют. Палладий быстро разрушается. Иридий и родий мало активны. Осмий
легко окисляется.
Были изучены и применены сплавы
платины, обладающие большей прочностью и не меньшей активностью, чем чистая
платина. На практике применяют сплавы платины с иридием или с родием и иногда с
палладием. Сетки из сплава платины с 1 % иридия при высоких температурах
обладают большей активностью, чем платиновые. Значительно большая активность и,
в особенности, механическая прочность свойственны сплавам платины с родием.
Наилучший выход окиси азота
получается при работе на сплавах платины, в которых содержится 10
%
родия. Однако, учитывая более высокую стоимость родия по сравнению с платиной,
содержание его в сплавах обычно снижают до 7-5
%.
При окислении аммиака под давлением
на платино-родиевых сетках получается значительно больший выход окиси азота,
чем на чисто платиновых.
Платиновые катализаторы
чувствительны к некоторым примесям, содержащимся в исходном газе. Так, наличие
в газе 0,00002 % фосфина
(РН3)
снижает степень конверсии до 80 %. Менее сильными ядами являются сероводород,
пары
ацетилена, смазочных масел, оксиды железа и другие вещества. Регенерируют
сетки, обрабатывая их 10-15
% раствором соляной кислоты
при 60-70°С
в течение 2 ч. Затем
сетки тщательно промывают дистиллированной водой, сушат и прокаливают в пламени
водорода. В процессе работы изменяется физическая структура сеток и уменьшается
механическая прочность
сплава, что увеличивает потери металла и сокращает
срок
службы катализатора [4].
4.3 Состав газовой
смеси. Оптимальное содержание аммиака в аммиачно-воздушной смеси
Для окисления аммиака применяют
преимущественно воздух. Расход кислорода на окисление аммиака по реакции (24)
с образованием NO
можно рассчитать следующим образом:
NH3
+ 5O2 = 4NO
+ 6Н2O (24)
По реакции (24)
на 1 моль NH3
приходится 1,25 моля O2
=
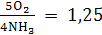 ,
тогда - содержание NH3
можно выразить так:
,
тогда - содержание NH3
можно выразить так:
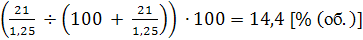
где 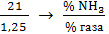 -
количество NH3 в смеси с воздухом; 100 - общее количество смеси (%).
-
количество NH3 в смеси с воздухом; 100 - общее количество смеси (%).
Однако это теоретически. Для
практических целей используют определенный избыток кислорода, тогда концентрация
аммиака будет меньше 14,4 % (об.).
Оптимальной концентрацией аммиака в
аммиачно-воздушной смеси является
наибольшее его содержание, при котором еще возможен высокий выход NO
при соотношении O2:NH3
< 2.
Резкое уменьшение степени конверсии
наблюдается при снижении соотношения O2:NH3
< 1,7 и содержании NH3
в смеси равном 11,5 % (об.).
Если увеличивать соотношение O2:NH3,
например, >2, то степень конверсии повышается значительно.
Таким образом, важный момент:
1) с одной стороны,
увеличение содержания NH3
в аммиачно-воздушной смеси, т. е. уменьшение отношения O2:NH3,
приводит к снижению степени конверсии аммиака;
2) с другой стороны, с
увеличением содержания NH3
в аммиачно-воздушной смеси,
увеличивается температура системы, т. к. выделяется больше тепла по реакциям
(14-16), и степень конверсии возрастает, что видно из таблицы 4.
Таблица 4
- Зависимость
степени
конверсии аммиака от его содержания в аммиачно-воздушной
смеси (P = 0,65 МПа)
|
Содержание NH3
в смеси, % (об.)
|
Соотношение O2:NH3
|
Температур конверсии,
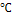
|
Степень конверсии NH3,
%
|
|
9,53
|
1,98
|
743
|
91,88
|
|
10,42
|
1,78
|
786
|
93,16
|
|
10,50
|
1,76
|
789
|
93,30
|
|
11,10
|
1,67
|
828
|
94,21
|
|
11,53
|
1,59
|
834
|
95,30
|
Из таблицы
4 следует, что повышение температуры с 740 до
830°С при соотношении O2:NH3
в пределах 1,6-2 благоприятно
влияет на процесс. При соотношении O2:NН3
< 1,35 лимитирующая стадия процесса - диффузия кислорода.
Избыток О2 необходим для того, чтобы
поверхность платины всегда была покрыта кислородом для осуществления процесса
окисления по рассматриваемому ранее механизму и исключения образования N2 и N2O
(при недостатке кислорода). Он должен быть более 30 %, т. е. соотношение O2:NH3
> 1,62.
Состав газа будет также зависеть и
от протекания второй стадии получения азотной кислоты (окисление NO)
2NO
+ 1,5O2
+ Н2O
= 2HNO3 (25)
Для ее проведения также необходим
избыток кислорода:
1) для систем,
работающих под давлением - 2,5 %;
2) для систем,
работающих при атмосферном давлении - 5 %.
Суммарная реакция, определяющая
потребность кислорода для получения азотной кислоты, записывается следующим
образом
NH3
+ 2O2 = HNO3
+ Н2O (26)
По реакции (26)
можно рассчитать количество аммиака (при отношении O2:NH3
= 2)
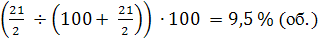
Если содержание аммиака будет более
9,5 % (об.),
то в поглотительные башни необходимо дополнительно вводить воздух (т. к. для
конверсии нужно 11,5 % (об.)
NH3, а аммиачно-воздушную
смесь готовят, как правило, одного состава для всей
технологической схемы, то необходимо уменьшить процентное содержание аммиака).
Есть еще одно обстоятельство, по
причине которого нежелательно увеличивать концентрацию аммиака выше 9,5 % (об.).
В этом случае имеет место снижение концентрации оксидов азота в поглотительных
башнях, за счет введения дополнительного кислорода (т. е. идет разбавление NO).
Таким образом, 9,5 % (об.)
- оптимальное содержание аммиака для всех стадий получения разбавленной азотной
кислоты.
Можно вместо воздуха применять для
окисления кислород. Тогда, в соответствии с суммарной реакцией (26),
необходимо повысить концентрацию аммиака до 33,3 % (об.).
Однако здесь вступает в силу техника безопасности, поскольку смесь с такой
концентрацией аммиака становится взрывоопасной (таблица
5).
Таблица 5
- Нижний (НПВ) и верхний (ВПВ) пределы
взрываемости смеси аммиак-кислород-азот
|
Содержание O2
в смеси кислород-азот, % (об.)
|
Содержание NН3в
смеси аммиак-кислород-азот, % (об.)
|
|
НПВ
|
ВПВ
|
|
100
|
13,5
|
82
|
|
80
|
18
|
77
|
|
60
|
19
|
69
|
|
50
|
19
|
64
|
|
40
|
18
|
57
|
|
30
|
17
|
46
|
|
24
|
22
|
31
|
При повышении влажности газа пределы
взрываемости сужаются, т. е. возможно применить парокислородную конверсию
аммиака.
Смеси аммиака с кислородом
воспламеняются со взрывом (Твоспл
= 700-800 ).
В этих температурных пределах самовоспламенение происходит при любом содержании
аммиака в аммиачно-кислородной смеси.
).
В этих температурных пределах самовоспламенение происходит при любом содержании
аммиака в аммиачно-кислородной смеси.
Практически применяемые
аммиачно-воздушные смеси (концентрация аммиака 9,5-11,5
% (об.))
не взрывоопасны (таблица 5).
Существуют зависимости пределов взрываемости аммиачно-воздушной
смеси от содержания аммиака и кислорода при различных
давлениях.
Однако следует заметить, что
скорость распространения взрыва невелика и для аммиачно-воздущной
смеси составляет 0,3-0,5
м/с. Т. е. для устранения возможности распространения взрыва нужно создать
скорость газа больше этого значения (0,5 м/с). Это как раз и достигается
использованием в процессе активных платиноидных катализаторов, где время
контакта составляет 10-4 сек
и, следовательно, линейная скорость более 1,5 м/с [13].
4.4
Окисление аммиака под давлением
Целью повышения давления являются:
1) необходимость
увеличения скорости процесса;
2) компактность
установок.
Термодинамически доказано, что даже
при высоких давлениях выход NO
близок к 100 %. Производительность конвертора увеличивается с возрастанием
давления и увеличением числа сеток платиноидного катализатора. С ростом
давления увеличивается и температура процесса выше 900 .
Однако при увеличении давления для достижения высокой степени конверсии NH3
необходимо увеличить время пребывания газа в конверторе
.
Однако при увеличении давления для достижения высокой степени конверсии NH3
необходимо увеличить время пребывания газа в конверторе
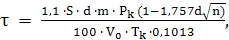
что в свою очередь
приводит к увеличению числа сеток.
Главный недостаток - повышенные
потери катализатора платины
(Pt) при высоких
температурах. Эти недостатки (потеря платины,
снижение степени конверсии) можно исключить, прибегнув к комбинированной схеме
производства, т. е. осуществляя процесс окисления NH3
при атмосферном или близком к нему давлении, а окисление NO
и абсорбцию при повышенном давлении. Такой подход часто реализуется в
технологических схемах многих стран. Вместе с тем расходы энергии на
копремирование газа повышают себестоимость азотной кислоты
[13].
4.5 Оптимальные условия окисления аммиака
. Температура.
Реакция аммиака на платине начинается при 145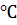 ,
но протекает с малым выходом NO и образованием преимущественно элементарного
азота. Повышение температуры приводит к увеличению выхода окиси азота и росту
скорости реакции. В интервале 700-1000
,
но протекает с малым выходом NO и образованием преимущественно элементарного
азота. Повышение температуры приводит к увеличению выхода окиси азота и росту
скорости реакции. В интервале 700-1000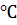 выход NO может быть доведен до 95-98 %. Время контактирования при повышении
температуры от 650 до 900
выход NO может быть доведен до 95-98 %. Время контактирования при повышении
температуры от 650 до 900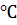 сокращается
примерно в пять раз (от 5
сокращается
примерно в пять раз (от 5 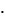 10-4 до 1,1
10-4 до 1,1 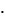 10-4
сек). Необходимый температурный режим процесса может поддерживаться за счет
тепла реакций окисления. Для сухой аммиачно-воздушной смеси, содержащей 10 %
NH3, при степени конверсии 96 % теоретическое повышение температуры газа
составляет примерно 705
10-4
сек). Необходимый температурный режим процесса может поддерживаться за счет
тепла реакций окисления. Для сухой аммиачно-воздушной смеси, содержащей 10 %
NH3, при степени конверсии 96 % теоретическое повышение температуры газа
составляет примерно 705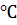 или около 70
или около 70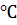 на каждый процент аммиака в исходной смеси. Применяя аммиачно-воздушную смесь,
содержащую 9,5 % аммиака, можно за счет теплового эффекта реакции достигнуть
температуры порядка 600
на каждый процент аммиака в исходной смеси. Применяя аммиачно-воздушную смесь,
содержащую 9,5 % аммиака, можно за счет теплового эффекта реакции достигнуть
температуры порядка 600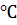 , для еще большего
повышения температуры конверсии необходим предварительный подогрев воздуха или
аммиачно-воздушной смеси. Следует учитывать, что подогревать аммиачно-воздушную
смесь можно только до температуры не выше 150-200
, для еще большего
повышения температуры конверсии необходим предварительный подогрев воздуха или
аммиачно-воздушной смеси. Следует учитывать, что подогревать аммиачно-воздушную
смесь можно только до температуры не выше 150-200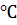 при температуре греющего газа не более 400
при температуре греющего газа не более 400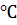 .
В противном случае возможна диссоциация аммиака или его гомогенное окисление с
образованием элементарного азота.
.
В противном случае возможна диссоциация аммиака или его гомогенное окисление с
образованием элементарного азота.
Верхний предел
повышения температуры контактного окисления аммиака определяется потерями
платинового катализатора. Если до 920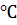 потери платины в какой-то мере компенсируются ростом активности катализатора,
то выше этой температуры рост потерь катализатора значительно опережает
увеличение скорости реакции.
потери платины в какой-то мере компенсируются ростом активности катализатора,
то выше этой температуры рост потерь катализатора значительно опережает
увеличение скорости реакции.
Согласно заводским
данным, оптимальная температура конверсии аммиака под атмосферным давлением
составляет около 800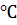 ; на установках,
работающих под давлением 9 атм,
она равна 870-900
; на установках,
работающих под давлением 9 атм,
она равна 870-900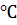 .
.
. Давление.
Применение повышенного давления при получении разбавленной азотной кислоты в
основном связано со стремлением увеличить скорость окисления окиси азота и
переработки образующейся двуокиси азота в азотную кислоту.
Термодинамические
расчеты показывают, что и при повышенном давлении равновесный выход NO близок к
100 %. Однако высокая степень контактирования в этом случае достигается лишь
при большом количестве катализаторных сеток и более высокой температуре.
За последнее время
в промышленных условиях на многослойных катализаторах при тщательной очистке
газов и температуре 900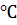 удалось довести
степень конверсии аммиака до 96 %. При выборе оптимального давления следует
иметь в виду, что повышение давления приводит к росту потерь платины. Это
объясняется увеличением температуры катализа, применением многослойных сеток и
усилением их механического разрушения под действием большой скорости газа.
удалось довести
степень конверсии аммиака до 96 %. При выборе оптимального давления следует
иметь в виду, что повышение давления приводит к росту потерь платины. Это
объясняется увеличением температуры катализа, применением многослойных сеток и
усилением их механического разрушения под действием большой скорости газа.
3. Содержание
аммиака в смеси. Для окисления аммиака обычно применяют воздух, поэтому
содержание аммиака в смеси определяется содержанием кислорода в воздухе. При
стехиометрическом отношении О2:NH3 = 1,25 (содержание аммиака в смеси с
воздухом составляет 14,4 %) выход окиси азота не значителен. Для увеличения
выхода NO требуется некоторый избыток кислорода, следовательно, содержание
аммиака в смеси должно быть меньше 14,4 %. В заводской практике содержание
аммиака в смеси поддерживают в пределах 9,5-11,5 %, что соответствует отношению
O2:NH3 = 21,7.
Суммарная реакция
(26), определяющая потребность в кислороде при
переработке аммиака в азотную кислоту дает отношение O2:NH3 = 2, что
соответствует содержанию аммиака в исходной смеси, равному 9,5 %. Это говорит о
том, что увеличение концентрации аммиака в смеси выше 9,5 % в конечном итоге не
приведет к росту концентрации NO, так как в этом случае в адсорбционную систему
придется вводить дополнительный воздух. Если в качестве исходных реагентов
применять аммиачно-кислородную смесь, то в соответствии с уравнением суммарной
реакции можно было бы увеличить концентрацию в ней аммиака до 33,3 %. Однако
применение высоких концентраций аммиака затруднено тем, что подобные смеси
взрывчаты.
. Влияние
примесей. Платиновые сплавы чувствительны к примесям, содержащимся в
аммиачно-воздушной смеси. В присутствии 0,0002 % фосфористого водорода в газовой
смеси степень конверсии аммиака снижается до 80 %. Менее сильными контактными
ядами являются сероводород, ацетилен, хлор, пары смазочных масел пыль,
содержащая окислы железа, окись кальция, песок и др.
Предварительная
очистка газов увеличивает продолжительность работы катализатора. Однако со
временем катализатор постепенно отравляется и выход NO снижается. Для удаления
ядов и загрязнений сетки периодически регенерируют посредством обработки их
10-15 % раствором соляной кислоты.
5. Время
контактирования. Оптимальное время контактирования определяется скоростью
окисления аммиака. Чаще всего скорость окисления определяют как количество
окисленного аммиака (кг) на единицу поверхности (м2) в сутки (напряженность
катализатора). Продолжительность соприкосновения газа с катализатором, или
время контактирования определяют по уравнению:
=
Vсв / W
где t - время
пребывания газа в катализаторной зоне, сек;
Vсв
- свободный объем катализатора, м3; W
- объемная скорость в условиях контактирования м3 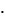 сек-1.
сек-1.
Максимальная
степень превращения аммиака в окись азота достигается при вполне определенном
времени контакта газа с катализатором. Оптимальным временем контактирования
следует считать не то, при котором достигается максимальный выход NO, а
несколько меньшее, так как экономически выгодно работать при большей
производительности даже за счет снижения выхода продукта. В практических
условиях время контакта аммиака с катализатором колеблется в пределах
от 1 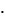 10-4
до 2
10-4
до 2 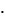 10-4
сек.
10-4
сек.
. Смешение
аммиака с воздухом. Полная однородность аммиачно-воздушной смеси, поступающей в
зону контактирования, является одним из основных условий получения высокого
выхода окиси азота. Хорошее смешение газов имеет большое значение не только для
обеспечения высокой степени контактирования, но и предохраняет от опасности
взрыва. Конструкция и объем смесителя должны в полной мере обеспечивать хорошее
перемешивание газа и исключать проскок аммиака отдельными струями на
катализатор[17].
5.
КОНТАКТНЫЕ АППАРАТЫ
Наиболее сложной и претерпевшей
значительные усовершенствования является конструкция самого контактного
аппарата.
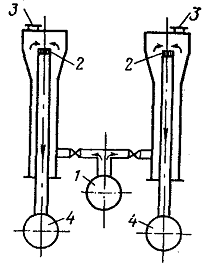
Рисунок
3
- Контактный аппарат Оствальда:
1
- коллектор аммиачно-воздушной смеси; 2 - платиновая спираль; 3 - смотровое
окно; 4 - коллектор нитрозных газов
Первым промышленным контактным
аппаратом был аппарат Оствальда (рисунок 3),
состоящий из двух концентрических труб: внешней чугунной диаметром 100 мм,
эмалированной изнутри, и внутренней из никеля диаметром 65 мм.
Аммиачно-воздушная смесь поступала в аппарат снизу по внешней трубе и попадала
на катализатор, расположенный в верхней части внутренней трубы. Нитрозные газы
по внутренней трубе направлялись вниз в коллектор, отдавая тепло поступающей
смеси.
Катализатор состоял из лент
платиновой фольги толщиной 0,01 мм и шириной 20 мм, свернутых вместе в спираль.
Одна из лент гладкая, вторая гофрированная с изгибами в 1 мм. Степень конверсии
аммиака достигала 90-95
%,
в смеси с воздухом содержалось NH3
8
%
(об.),
производительность аппарата составляла 100 кг азотной
кислоты в сутки.
Подобная форма катализатора не
позволяла повышать производительность аппарата за счет увеличения его размеров.
В аппарате Оствальда не
обеспечивалась равномерность подачи газовой смеси, так как перед поступлением
на катализатор поток газа изменил свое направление на 180° и уже затем поступал
на него. Кроме того, конструкция аппарата не позволяла быстро выводить оксиды
азота (II)
из зоны высоких температур.
В последующих конструкциях
контактного аппарата был использован катализатор в форме сетки из нитей
диаметром 0,06 мм.
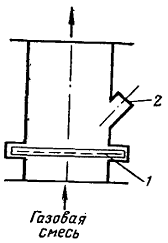
Рисунок 4 -
Контактный аппарат Андреева: 1
- платиновые сетки; 2 - смотровое окно
Первое в России производство азотной
кислоты было оснащено контактными аппаратами Андреева, вырабатывавшими 386 кг азотной
кислоты в сутки и считавшимися наиболее
совершенными в мире. Аппарат цилиндрической формы диаметром 300 мм и высотой
450 мм был изготовлен из чугуна. Смесь газов поступала снизу (рисунок
4).
Сетка платинового катализатора располагалась поперек аппарата, посередине его.
Применение чугуна для изготовления
этого аппарата имело ряд недостатков: протекание побочных реакций, загрязнение
платины окалиной. Степень конверсии в нем не превышала 87
%.
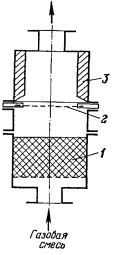
Рисунок 5 -
Контактный аппарат Фишера: 1
- насадка; 2 - платиновая сетка; 3 - изоляция
Аппарат Фишера изготовляли из
алюминия, его диаметр был равен 1000 мм, высота 2000 мм (рисунок
5). Снизу аппарат заполняли фарфоровыми кольцами
Рашига, верхнюю часть футеровали огнеупорным кирпичом. Конструкция аппарата не
обеспечивала равномерной подачи аммиачно-воздушной смеси на катализатор, выход
оксидов составлял 89-92
% при температуре контактирования 700-720°С.
Производительность аппарата по аммиаку 600-700
кг/сут. Частицы огнеупорного кирпича, попадая на катализатор, снижали его
активность.
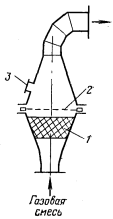
Рисунок 6 - Аппарат
Бамаг:
1
- насадка; 2 - платиновая сетка; 3 - смотровое окно
Аппарат, предложенный фирмой Бамаг
(рисунок
6),
состоял из двух усеченных конусов, соединенных широкими основаниями, между
которыми помещались катализаторные сетки. Диаметр аппарата в широкой части был
равен 1,1 м или 2,0 м.
Аммиачно-воздушную смесь подавали в
аппарат снизу. Вначале аппарат изготовляли из алюминия, затем его верхнюю,
горячую, часть выполняли из нержавеющей стали. Для лучшего перемешивания смеси
в нижнюю часть аппарата засыпали кольца Рашига.
Основным недостатком этих аппаратов
было направление газовой смеси на катализатор снизу, что приводило к вибрации
сеток и к увеличению потери платины.
Исследования конструкции контактного
аппарата показали, что направление газовой смеси сверху вниз стабилизирует
работу катализаторных сеток, уменьшает потери дорогостоящего дефицитного
платинового катализатора, способствует повышению степени конверсии на 1,0-1,5
% и позволяет применять двухступенчатый катализатор, в котором в качестве
второй ступени применяется оксидный неплатиновый катализатор.
При подаче газовой смеси в аппарат
сверху в нижней его части можно располагать слой изолирующего материала, а
также змеевики парового котла и пароперегревателя без опасности загрязнения
катализатора пылью огнеупоров и окалиной железа. Это позволяет снизить потери
тепла реакции в окружающую среду.
Исследование распределения
температур по поверхности катализатора показало, что края катализатора
примыкающего к стенкам, имеют более низкую температуру,
соответственно снижается и степень контактирования, уменьшая общий выход оксида
азота (II).
В связи с этим большое значение имеет геометрия подводящей части контактного
аппарата, она должна представлять собой плавно расходящийся конус с углом при
вершине не более 30°.
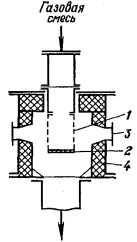
Рисунок 7 -
Аппарат Парсонса: 1
- цилиндрическая платиновая сетка; 2 кварцевое дно; 3 - смотровое окно; 4 -
изоляция
В США был создан аппарат Парсонса с
вертикальным расположением катализаторной сетки, свернутой в виде
четырехслойного цилиндра высотой 33 см и диаметром 29 см (рисунок
7). Платиновый цилиндр помещали в металлический
кожух, футерованный огнеупорным кирпичом, что обеспечивало хороший теплообмен с
раскаленным катализатором. Производительность такого аппарата составляла до 1 т
аммиака в сутки, степень конверсии 95-96
%.
Преимущество данного аппарата -
большая поверхность катализатора по сравнению с объемом апарата.
Недостатком
его является неравномерное поступление аммиачно-воздушной смеси на катализатор.
Через нижнюю часть сетчатого катализатора
проходит больше смеси, чем через верхнюю часть.
Испытывался ряд аппаратов различной
формы: в виде двух полусфер, конуса и полусферы при направлении потока газов
снизу вверх. Особыми преимуществами эти аппараты не обладали даже при
проведении процесса до 0,51 МПа,
степень конверсии не превышала 90 %.
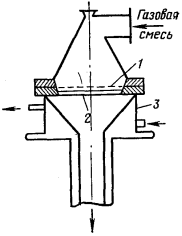
Рисунок 8 -
Аппарат фирмы Дюпон: 1 - платиновые сетки; 2 - колосники; 3 - водяная рубашка
При проведении процесса при
повышенном давлении получил распространение аппарат фирмы Дюпон (рисунок
8),
состоящий из конусов:
верхнего - из никеля и нижнего -
из жароупорной стали.
Нижний корпус был снабжен водяной рубашкой для охлаждения. Катализатор,
укладываемый на колосники , выполнен в виде пакета прямоугольных сеток.
Сейчас во всем мире проектируют и
строят агрегаты производства разбавленной азотной кислоты большой единичной
мощности - до 400-600
т/год. Контактные аппараты с плоскими слоями сеток или слоем зернистого
материала, располагаемого поперек хода газа, для таких агрегатов должны иметь
большой диаметр до 5-7
м. Однако с увеличением диаметра аппарата ухудшается равномерность
распределения аммиачно-воздушной смеси по сечению аппарата, увеличивается
металлоемкость на единицу производительности, возрастают трудности в уплотнении
фланцевых соединений. Аппараты больших диаметров (свыше 4 м) нельзя перевозить
по железным дорогам, изготовление их на заводской площадке связано с серьезными
трудностями.
В связи с этим наиболее
перспективным является конвертор с радиальным ходом газовой смеси через
катализатор, выполненный в виде цилиндра или конуса. При таком расположении
катализатора можно, не изменяя диаметр аппарата, увеличивать его высоту и
соответственно производительность.
Конструкции аппаратов с
цилиндрическим расположением катализатора известны давно (аппараты Парсонса),
но с увеличением их производительности от 4,5 кг/ч до 14,3 т/ч аммиака
возникали проблемы распределения потоков газовой смеси, теплообмена, крепления
катализатора и др.
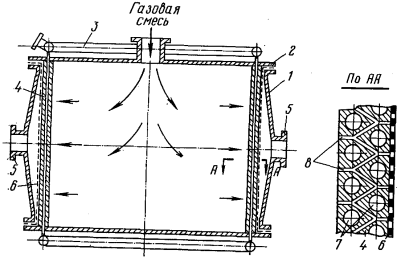
Рисунок 9 -
Усовершенствованный аппарат Парсонса: 1
- корпус; 2 - крышки; 3 - коллектор хладоагента; 4 - опорное устройство; 5 -
штуцер для вывода нитрозных газов; 6 - катализаторные сетки; 7 - каналы для
хладоагента; 8 - каналы для газов
Одним из новых аппаратов является
усовершенствованный аппарат Парсонса (рисунок
9).
Он
состоит из корпуса с крышками, штуцеров для ввода аммиачно-воздушной смеси и
вывода нитрозных газов. Катализатором являются платиновые сетки, располагаемые
вертикально по цилиндрической поверхности и закрепляемые под крышками. Сетки
натянуты на керамическое опорное устройство, в котором имеются горизонтальные
каналы для подачи аммиачно-воздушной смеси к контактным сеткам и вертикальные
каналы для подачи хладоагента. Недостатком такого опорного устройства является
распределение газа, поступающего на катализатор, в виде отдельных струй, в
результате чего площадь катализатора работает не полностью.
Рисуноу 10 -
Контактный аппарат с радиальным ходом газа: 1
- корпус; 2 - крышка; 3 - система опорных элементов; 4 - катализатор; 5 -
решетка; 6 - глухое днище
Предложен аппарат с радиальным ходом
газа (рисунок 10),
который состоит из корпуса 1 и крышки со штуцером для ввода аммиачно-воздушной
смеси. В нижней части корпуса расположен штуцер для ввода нитрозных газов.
Катализаторные сетки в виде цилиндра и конуса расположены вертикально. Однако
этот аппарат также не обеспечивает равномерного поступления газов на
катализатор.
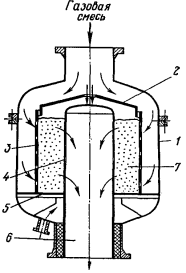
Рисунок
11
- Контактный аппарат с гранулированным
катализатором: 1 цилиндрический корпус; 2 - крышка с
центральным отверстием; 3, 4 - коаксильные цилиндрические
перфорированные распределительные решетки; 5 - кольцевое
днище; 6 - выходной штуцер
Предложен аппарат с радиальным ходом
газа и гранулированным катализатором.
В
качестве катализаторов применяются платиновые металлы, нанесенные на носитель,
или таблетки неплатинового катализатора (рисунок
11).
Аппарат на рисунке
11
состоит из цилиндрического корпуса 1, в верхнюю часть которого вводится
аммиачно-воздушная смесь, а в нижней выводятся нитрозные газы. Внутри
расположены две коаксиальные цилиндрические перфорированные распределительные
решетки 3 и 4, между которыми размещен слой гранулированного катализатора 7.
Внешний цилиндр закрыт сверху крышкой 2 с центральным отверстием, а снизу -
глухим кольцевым днищем 5. Внутренний цилиндр закрыт сверху крышкой, а в низу
соединен с выходным штуцером 6.
Аммиачно-воздушная смесь при входе в
аппарат делится на два потока. Основная часть проходит в кольцевой зазор между
стенками корпуса и внешним распределительным цилиндром и поступает радиально на
катализатор. Вторая, меньшая часть, проходит через отверстие в крышке и
поступает на катализатор по оси. Равномерное распределение газовой смеси в
катализаторе не обеспечивается.
Недостатком этих конструкций
является перегрев аммиачно-воздушной смеси более 200 вблизи глухого днища вследствие снижения скорости газа до нуля. Перегрев газа
вызывает перегрев катализаторных сеток и повышенный их износ.
вблизи глухого днища вследствие снижения скорости газа до нуля. Перегрев газа
вызывает перегрев катализаторных сеток и повышенный их износ.
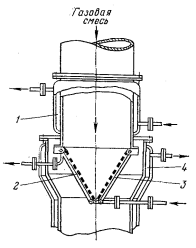
Рисунок 12
- Аппарат с катализатором в форме конуса: 1 -
рубашка для подогрева газа; 2 - катализатор; 3 - опорное трубное устройство; 4
- водяная рубашка
Аппарат (рисунок
12),
содержит катализатор в виде нескольких слоев платиновой сетки, сваренный из
кусков треугольной формы в конус с углом при вершине около 60°. Пакет сеток
опирается на конструкцию, состоящую из 6-12
труб по образующей конуса, по которым проходит теплоноситель. Такая форма
катализатора имеет большую удельную поверхность (по отношению к объему
аппарата) по сравнению с плоским катализатором, расположенным поперек хода
газа. Однако по сравнению с цилиндрическим катализатором его удельная
поверхность меньше.
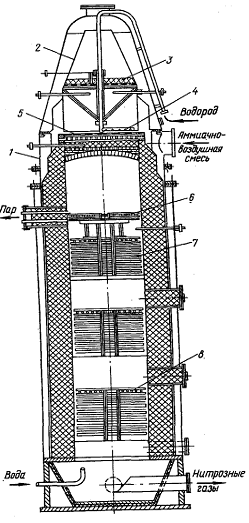

Рисунок 13
- Контактный аппарат для окисления аммиака под
высоким давленим: 1 - корпус; 2 -
внутренний конус; 3 - распределительное устройство; 4 - запальник;
5
- катализаторные сетки; 6 - пароперегреватель; 7 - пакеты парового котла; 8 -
экономайзер
На рисунке 13
изображен контактный аппарат для окисления аммиака под давлением 0,71 МПа.
Аппарат представляет собой два конуса, вставленных друг в друга.
Аммиачно-воздушная
смесь поступает снизу в пространство между внутренним и внешним конусом,
поднимается вверх и оттуда по внутреннему конусу опускается вниз. На пути к
платиновому катализатору, выполненному в виде сеток смесь хорошо перемешивается
в распределительном устройстве из колец Рашига.
Для измерения температур поступающей
газовой смеси и процесса конверсии аппарат снабжен термопарами: четыре
-
до катализатора и четыре после него. Для отбора проб газа имеются пароотборные
трубки: четыре до катализатора и четыре после него. Розжиг катализатора
производится азотоводородной смесью, подаваемой с помощью поворотной горелки
(запальника).
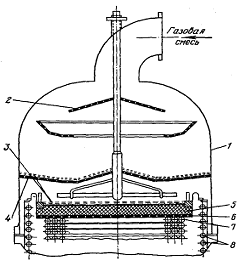
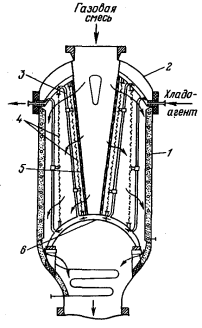
Рисунок 14
- Контактный аппарат фирмы Гранд Паруасс:
1
- корпус; 2 решетка; 3 - платиновый катализатор; 4 - панцирная сетка; 5 - слой
колец; 6 перфорированная пластина; 7 - пароперегреватель; 8 - котел-утилизатор
Среди аппаратов, работающих при
среднем давлении 0,40-0,50
МПа, представляет интерес аппарат фирмы Гранд Паруасс, изготовленной из
нержавеющей стали (рисунок
14).
Он
состоит из корпуса, закрытого сверху эллиптической крышкой, с входным штуцером
для ввода газовой смеси. Под крышкой расположен дырчатый конус, затем
отражательная перегородка. Над платиновыми сетками размещена распределительная
решетка, на которой лежит слой из шести сеток, выполняющих роль гасителя
пульсаций скорости потока. Недостатком аппарата является наличие застойных зон
в области высоких температур катализатора, где может разлагаться поступающий
аммиак
[14].
6. ВЫБОР И ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ
ПРОИЗВОДСТВА НЕКОНЦЕНТРИРОВАННОЙ АЗОТНОЙ КИСЛОТЫ
В зависимости от условий проведения
производственного процесса различают следующие типы азотнокислотных систем:
1) системы, работающие
при атмосферном давлении;
2) системы, работающие
при повышенном давлении (4-8 атм);
3) комбинированные системы,
в которых окисление аммиака проводится при более низком давлении, а абсорбция
окислов - при более высоком давлении.
Рассмотрим эти технологические
схемы.
1) системы, работающие
при атмосферном давлении;
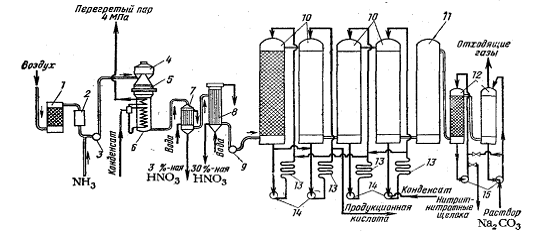
Рисунок 15
- Схема установки для получения разбавленной
азотной кислоты при атмосферном давлении: 1
- водяной скруббер; 2 - суконный фильтр; 3 - аммиачно-воздушный вентилятор;
4
- картонный фильтр; 5 - конвертор; 6 - паровой котел-утилизатор; 7 - скоростной
холодильник; 8 - холодильник-конденсатор; 9
- вентилятор для нитрозных газов; 10 - абсорбционные башни;
11
- окислительная башня; 12 - башня для поглощения окислов азота щелочами; 13 -
холодильник кислоты; 14, 15 - насосы
Данные системы (рисунок
15)
в настоящее время уже не эксплуатируются, вследствие громоздкости аппаратуры
(большое количество башен кислой и щелочной абсорбции), малой
производительности, а также накопления некоторого количества хлора, который в
системах кислой и щелочной абсорбции оказывает сильное коррозионной действие на
аппаратуру, которую постоянно приходиться заменять, а это за собой ведёт
большие экономические затраты.
2) комбинированные
системы;
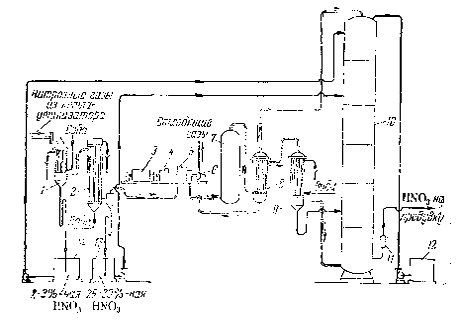
Рисунок 16
- Получение азотной кислоты комбинированным методом:
1
- скоростной холодильник; 2 - холодильник; 3 - двигатель турбокомпрессора; 4 -
редуктор; 5 - турбокомпрессор нитрозных газов; 6 - турбина для орошения
отходящих газов; 7 - окислитель; 8 - теплообменник; 9 - холодильник-конденсатор;
10 - абсорбционная колонна; 11 - кислотный клапан; 12 - сборник конденсата;
13,
14 - сборники азотной кислоты
Основными достоинствами данной схемы
являются:
2. Компактность
оборудования.
3. Производительность
таких агрегатов составляет 1360 т/сутки.
Недостатки схемы:
Основным недостатком данной схемы является
то, что при окислении аммиака под давлением 9
атм
степень конверсии на 2-3 %
меньше, чем при атмосферном давлении, а потери платинового катализатора в 2-3
раза больше. Таким образом, данный процесс выгоднее проводить под атмосферным
давлением. Но для современных мощных цехов, вырабатывающих азотную кислоту, в
этом случае потребуется большое количество крупногабаритных аппаратов и,
следовательно, увеличение затрат на строительно-монтажные работы. Эти
соображения вынуждают прибегать к повышению давления в процессе конверсии
аммиака. В этом отношении давление порядка 2,5
атм
приемлемо, так как объём аппаратуры сокращается в 2,5 раза по сравнению с
объёмом в системах, работающих при атмосферном давлении, при умеренных потерях
аммиака и катализатора.
3) системы, работающие
под повышенным давлением.
Достоинства схемы (рисунок
17):
1. Агрегат компактен,
все аппараты транспортабельны. Энергетический цикл агрегата автономен и при
отключении химического производства остаётся в работе до отключения его со щита
управления. Это позволяет при случайных отключениях химического процесса быстро
вводить агрегат в работу. Управление агрегатом в рабочем режиме
автоматизировано.
2. Фактическая
себестоимость и энергоёмкость азотной кислоты, выработанная на агрегатах единого
давления 0,716 МПа, остаётся самыми низкими по сравнению с агрегатом АК-72 и
агрегатом, работающим по комбинированной схеме.
3. Вместо
котла-утилизатора за контактным аппаратом устанавливается высокотемпературный
теплообменник для подогрева выхлопных газов перед турбиной до 1120 К. При этом
за счёт увеличения мощности газовой турбины выдача электроэнергии возросла на
274 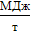 по сравнению с
агрегатом АК-72.
по сравнению с
агрегатом АК-72.
4. В схеме параллельно
технологическим аппаратам установлена постоянно включенная камера сгорания, что
позволяет сделать независимой работу машинного агрегата от технологической
линии, а также обеспечить плавный переход от работы машины на холостом режиме к
работе машины при включенном процессе технологии.
Недостатки схемы:
1. В агрегате
протекает процесс при повышенных температурах, что делает очень большие
нагрузки на палладиевый катализатор и он выходит из строя. По литературным
данным удельные безвозвратные потери на 1т азотной кислоты составляют для
процесса при атмосферном давлении 40-45 мг, при 0,3-1,6 МПа - 100 мг, при
0,7-0,9 МПа - 130-180мг. То есть увеличиваются потери платины на установках,
работающих под давлением за счёт более высоких температурах катализа по
сравнению с температурой на установках, работающих при атмосферном давлении.
2. Требуется очень
высокая степень очистки воздуха перед входом в ГТУ, так как производительность
компрессора по воздуху может снизиться до 10 % и КПД до 6 %.
В данном курсовом проекте детально
рассматривается схема производства азотной кислоты
под давлением с приводом компрессора от газовой турбины
(рисунок 17).
Мощность производства азотной
кислоты по схеме, работающей под давлением 0,716
МПа,
определяется числом агрегатов. Мощность одного агрегата составляет 120
тыс.т/г (100 %-ной HNO3).
Число агрегатов в схеме определяется потребностью в азотной кислоте цехов
переработки.
В каждом агрегате осуществляются:
подготовка аммиачно-воздушной смеси (очистка и сжатие воздуха, испарение
жидкого аммиака, очистка газообразного аммиака и аммиачно-воздушной смеси);
конверсия аммиака; утилизация тепла образования оксидов азота; охлаждение
нитрозных газов;
получение азотной кислоты; подогрев отходящих газов;
очистка их от оксидов азота и рекуперация энергии газа в газовой турбине и
котле-утилизаторе.
Кроме того, схема включает узлы
приготовления питательной воды для питания котлов-утилизаторов,
охлаждение конденсата или обессоленной воды для орошения абсорбционных колонн,
редуцирования пара до необходимых параметров,
хранения выработанной азотной кислоты и выдачи её потребителям.
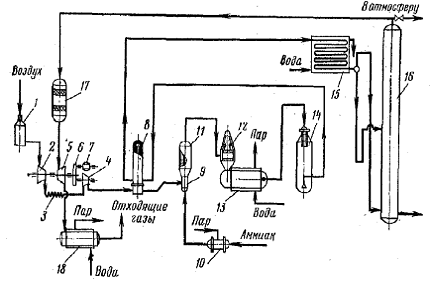
Рисунок 17 -
Схема производства азотной кислоты под давлением с приводом компрессора от
газовой турбины: 1 - фильтр воздуха; 2 - турбокомпрессор первой ступени; 3 -
промежуточный холодильник; 4 - турбокомпрессор второй ступени; 5 - газовая
турбина; 6 - редуктор; 7 - мотор-генератор; 8 - подогреватель воздуха; 9 -
смеситель аммиака с воздухом; 10 - подогреватель воздуха; 11 - поролитовый
фильтр; 12 - конвертор; 13 - котел-утилизатор; 14 - сосуд для окисления
нитрозных газов; 15 - холодильник - конденсатор; 16 - абсорбционная колонна; 17
- конвертор; 18 - котел-утилизатор
Атмосферный воздух засасывается
через фильтр 1 турбокомпрессором первой ступени 2 и сжимается до 0,2-0,35
МПа.
Вследствие
сжатия воздух нагревается до 175 . После охлаждения
до 30-45
. После охлаждения
до 30-45 в холодильнике 3 воздух поступает в турбокомпрессор второй ступени 4, где он
сжимается до конечного давления 0,73 МПа и нагревается до 125-135
в холодильнике 3 воздух поступает в турбокомпрессор второй ступени 4, где он
сжимается до конечного давления 0,73 МПа и нагревается до 125-135 .
Дальнейший подогрев воздуха до 270
.
Дальнейший подогрев воздуха до 270 происходит в подогревателе 8 за счет тепла горячих нитрозных газов, выходящих
из конвертора. Горячий воздух
поступает далее в смеситель 9.
происходит в подогревателе 8 за счет тепла горячих нитрозных газов, выходящих
из конвертора. Горячий воздух
поступает далее в смеситель 9.
Аммиак под давлением 1,0-1,2
МПа нагревается до 150 в
подогревателе 10 водяным паром и поступает в смеситель 9, где смешивается с
воздухом. Полученная аммиачно-воздушная смесь, содержащая 10-12
% NН3, фильтруется в
поролитовом фильтре 11 и поступает в конвертор 12, где на платино-родиевом
катализаторе при температуре 890-900
в
подогревателе 10 водяным паром и поступает в смеситель 9, где смешивается с
воздухом. Полученная аммиачно-воздушная смесь, содержащая 10-12
% NН3, фильтруется в
поролитовом фильтре 11 и поступает в конвертор 12, где на платино-родиевом
катализаторе при температуре 890-900 аммиак окисляется до окиси азота. Тепло газов, выходящих из конвертора,
используется в котле-утилизаторе 13 для получения пара, при этом газы
охлаждаются до 260
аммиак окисляется до окиси азота. Тепло газов, выходящих из конвертора,
используется в котле-утилизаторе 13 для получения пара, при этом газы
охлаждаются до 260 .
.
Далее газы проходят фильтр для
улавливания платины, расположенный в верхней части пустого сосуда 14. В сосуде
14 происходит окисление NО
до NО2 (степень
окисления 80 %), в результате этого газовая смесь разогревается до 300-310 и поступает в подогреватель воздуха 8, где охлаждается до 175
и поступает в подогреватель воздуха 8, где охлаждается до 175 .
Дальнейшее использование тепла нитрозных газов становится невыгодным, поэтому
они охлаждаются водой в холодильнике 16 до 50-55
.
Дальнейшее использование тепла нитрозных газов становится невыгодным, поэтому
они охлаждаются водой в холодильнике 16 до 50-55 .
Одновременно с охлаждением газа в холодильнике 16 происходит конденсация паров
воды и образование азотной кислоты в результате взаимодействия воды с двуокисью
азота. Концентрация образующейся кислоты не превышает 52 % НNО3,
выход составляет около 50 % всей производительности установки.
.
Одновременно с охлаждением газа в холодильнике 16 происходит конденсация паров
воды и образование азотной кислоты в результате взаимодействия воды с двуокисью
азота. Концентрация образующейся кислоты не превышает 52 % НNО3,
выход составляет около 50 % всей производительности установки.
Из холодильника 15 нитрозные газы
поступают в абсорбционную колонну 16 с ситчатыми тарелками, где NО2
поглощается водой с образованием азотной кислоты (концентрация до 55 %). На
тарелках абсорбционной колонны 16 уложены змеевики (холодильные элементы), по
которым циркулирует вода для отвода тепла, выделяющегося в процессе образования
азотной кислоты.
Для очистки отходящих газов от
окислов азота их подогревают до 370-420°С,
добавляют к ним небольшое количество природного газа и направляют в конвертор
(реактор) 17. Здесь в присутствии палладиевого катализатора протекают следующие
реакции:
СН4 + О2 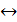 2СО
+ 4Н2 + Q (27)
2СО
+ 4Н2 + Q (27)
2NО2
+ 4Н2 = N2
+ 4Н2О + Q (28)
2NО
+ 2Н2 = N2
+ 2Н2О + Q (29)
Так как эти реакции идут с
выделением тепла, то температура газов повышается до 700-730 .
Эти газы поступают под давлением 0,5-0,6
МПа в турбину 5, которая приводит в движение турбокомпрессоры 2 и 4, сжимающие
воздух. После этого газы при температуре около 400
.
Эти газы поступают под давлением 0,5-0,6
МПа в турбину 5, которая приводит в движение турбокомпрессоры 2 и 4, сжимающие
воздух. После этого газы при температуре около 400 поступают в котел-утилизатор 19, в котором получают пар низкого давления.
поступают в котел-утилизатор 19, в котором получают пар низкого давления.
Турбокомпрессоры первой и второй
ступеней 2 и 4, а также газовая турбина 5 представляют собой единый агрегат.
Турбина первой ступени 2 и газовая турбина 5
находятся на общем валу и соединены редуктором 6 с турбиной второй ступени 4 и
электромотором 7. Такой агрегат позволяет использовать основную часть энергии,
затраченную на сжатие воздуха, и таким образом значительно снизить расход
электроэнергии [14].
7. РАСЧЕТ МАТЕРИАЛЬНОГО И ТЕПЛОВОГО БАЛАНСОВ
РЕАКТОРА
7.1
Расчет материального баланса реактора
1) Вычисляем
необходимый объем воздуха:
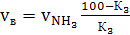 (30)
(30)
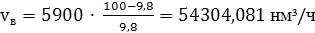
2) Объемы поступающих
с воздухом, нм3:
а) водяных паров
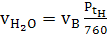 (31)
(31)
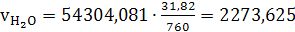
б) сухого воздуха
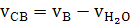 (32)
(32)
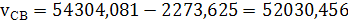
3) Вычислим
поступающие с воздухом объемы кислорода азота и аргона исходя из их процентного
содержания в воздухе
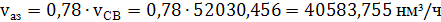 (33)
(33)
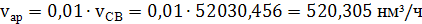 (34)
(34)
) Находим объемы
образующихся по реакции (14),
нм³/ч:
а) окиси азота
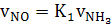 (35)
(35)
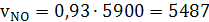
б) паров воды
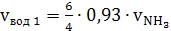 (36)
(36)
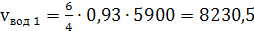
в) расходуемого при протекании этой
реакции кислорода
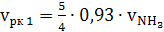 (37)
(37)
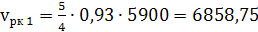
5) Определяем объемы
образующихся по реакции (15),
нм³/ч:
а) азота
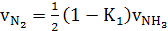 (38)
(38)
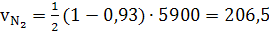
б) паров воды
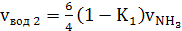 (39)
(39)
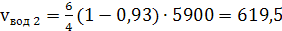
в) расходуемого при протекании этой
реакции кислорода
 (40)
(40)
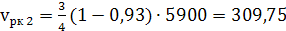
6) Вычисляем
находящиеся в газе после окисления аммиака объемы, нм³/ч:
а) кислорода
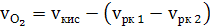 (41)
(41)
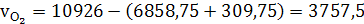
б) азота
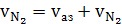 (42)
(42)
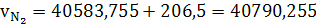
в) аргона
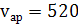
г) паров воды
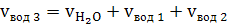 (43)
(43)
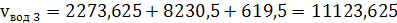
7) Собственно
материальный баланс можно рассчитать, если объемы потоков на входе в контактный
аппарат и на выходе из него пересчитать на массы, при этом должен соблюдаться
материальный баланс.
 (44)
(44)
Приход:
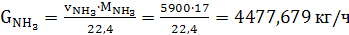 (45)
(45)
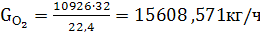 (46)
(46)
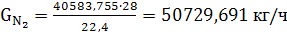 (47)
(47)
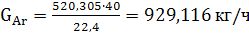 (48)
(48)
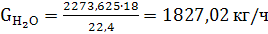 (49)
(49)
Расход:
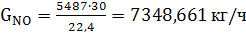 (50)
(50)
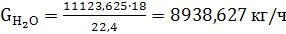 (51)
(51)
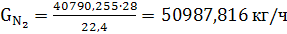 (52)
(52)
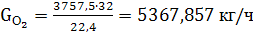 (53)
(53)
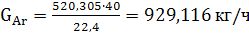 (54)
(54)
Заполним таблицу для материального
баланса
(таблица 6).
Таблица 6
|
Приход
|
Расход
|
|
Компонент
|
Количество
|
Компонент
|
Количество
|
|
кг/ч
|
м³/ч
|
|
кг/ч
|
м³/ч
|
|
NH3
|
4477,679
|
5900
|
NO
|
7348,661
|
5487
|
|
O2
|
15608,571
|
10926
|
O2
|
5367,857
|
3757,5
|
|
N2
|
50729,691
|
40583,755
|
N2
|
50987,816
|
40790,255
|
|
Ar
|
929,116
|
520,305
|
Ar
|
928
|
520
|
|
H2O
|
1827,02
|
2273,625
|
H2O
|
8938,627
|
11123,625
|
|
Всего
|
73572,077
|
60203,68
|
Всего
|
73570,961
|
61678,38
|
Невязка баланса
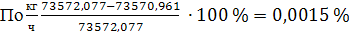
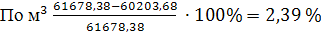
7.2 Расчет теплового
баланса реактора
Найдем температуру tx,
до которой необходимо нагревать аммиачно-воздушную смесь для обеспечения
автотермичности процесса окисления аммиака.
1) Вычисляем общий
объем аммиачно-воздушной смеси
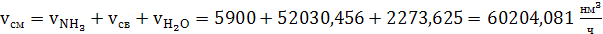 (55)
(55)
) Определяем
концентрацию компонентов аммиачно-воздушной смеси, % (об.):
а) аммиака
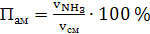 (56)
(56)
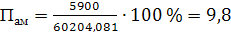
б) сухого воздуха
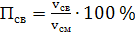 (57)
(57)
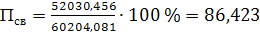
в) паров воды
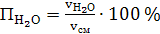 (58)
(58)
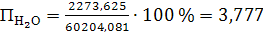
3) Рассчитываем
среднюю теплоемкость аммиачно-воздушной смеси
Сср = 0,01
·
(35,8
·
Пам
+ 28,7 ·
Псв
+ 32,6 ·
ПН2О) (59)
Сср = 0,01
·
(35,8
·
9,8
+ 28,7 ·
86,4
+ 32,6 ·
3,8)
= 29,544
кДж/(кмоль·К),
где 35,8; 28,7 и 32,6 - теплоемкости
аммиака, сухого воздуха и паров воды, кДж/(кмоль·К).
) Определяем теплоту,
вносимую аммиачно-воздушной смесью
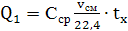 (60)
(60)
) Вычисляем теплоты,
выделяемые при протекании реакции (14)
и (16)
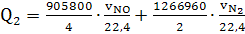 (61)
(61)
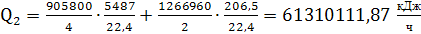
или 17030 кВт, где
905800 и 126660 - теплоты, выделяющиеся при образовании окиси азота и азота по
реакциям (14) и (16).
) Находим общий объем
нитрозного газа, поступающего в котел утилізатор
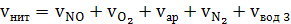 (62)
(62)
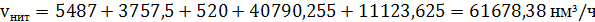
7) Определяем
концентрацию компонентов нитрозного газа, % (об.):
а) окиси азота
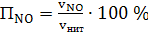 (63)
(63)
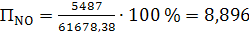
б) кислорода
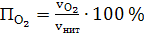 (64)
(64)
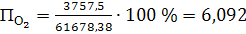
в) аргона
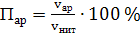 (65)
(65)

г) азота
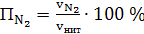 (66)
(66)
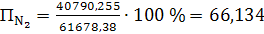
д) паров воды
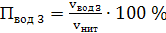 (67)
(67)
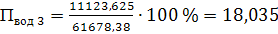
8) Вычисляем среднюю
теплоемкость нитрозного газа:
Снср =
0,01(31,68 ·
ПNO
+ 32,3 ·
ПО2
+ 20,78 ·
Пар
30,8 ·
ПN2
+ 37,4 ·
Пвод
3 (68)
Снср=0,01(31,68
·
8,9+32,3
·
6,1+20,78
·
0,84+30,8
·
66,1+37,4
·
18,0)
=
32,17
кДж/(кмоль·К)
где 31,68; 32,3; 20,78; 30,8 и 37,4
- теплоемкости компонентов нитрозного газа при температуре 900  ,
кДж/(кмоль·К).
,
кДж/(кмоль·К).
9) Для нагрева
водяного пара от 198 до 250
до 250 в пароперегревателе необходимо отнять теплоты:
в пароперегревателе необходимо отнять теплоты:
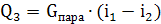 (69)
(69)
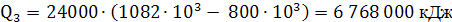 /ч
или
/ч
или
1880 кВт, где 800·10³
и 1082·10³
Дж/кг - удельные энтальпии перегретого пара при температурах 198 и 250
и 250 и давлениях 1,5 МПа и 3,98 МПа.
и давлениях 1,5 МПа и 3,98 МПа.
10) Температуру
нитрозных газов на выходе из контактного аппарата определяем из уравнения
теплового баланса этого участка:
6768
·
106
= 64631 ·
1,66
·
10³(900
- t2)
отсюда:
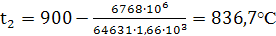
11) Рассчитываем
теплоту, уносимую нитрозными газами. Рассмотрим случай, когда контактный
аппарат и котел-утилизатор смонтированы в виде единого аппарата:
 (70)
(70)
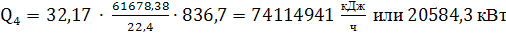
12) Определяем
теплопотери в окружающую среду
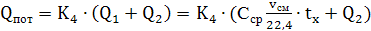 (71)
(71)
Приравнивая приход теплоты расходу,
составляем уравнение теплового
баланса и решаем его относительно tx:
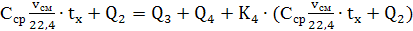 (72)
(72)
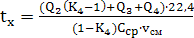 (73)
(73)
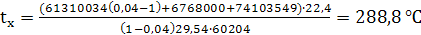
тогда:
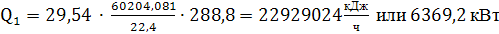
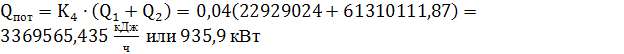 (74)
(74)
Заполним таблицу для теплового
баланса
(таблица 7).
Таблица 7
|
Приход, кВт
|
Расход, кВт
|
|
Теплота, вносимая аммиачно-воздушной смесью
|
6369,2
|
Теплота на нагрев водяного пара в
пароперегревателе
|
1880
|
|
|
Теплота, уносимая нитрозными газами
|
20584,3
|
|
Теплота, выделяемая при протекании реакции (14)
и (16)
|
17030,6
|
|
|
|
|
Потери в окружающую среду
|
935,9
|
|
Всего
|
23399,8
|
Всего
|
23400,2
|
Невязка баланса:
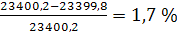
8. ОХРАНА ТРУДА И ПРОМЫШЛЕННАЯ ЭКОЛОГИЯ
Для обеспечения безопасного режима
работы в производстве неконцентрированной азотной кислоты под
повышенным
давлением необходимо строгое выполнение
технологического регламента, инструкций по охране труда по рабочим местам,
инструкции по охране труда и промышленной безопасности отделения, инструкций по
отдельным видам работ.
Обслуживающий персонал допускается к
работе в положенной по нормам спецодежде и спецобуви, обязан иметь при себе
исправные средства индивидуальной защиты. Средства защиты (индивидуальный
противогаз) обязательно проверяется ежесменно перед началом работы.
Лица, обслуживающие механизмы,
должны знать правила Госгортехнадзора, относящиеся к обслуживаемому оборудованию.
Лица, обслуживающие котлонадзорное оборудование, - правила котлонадзора.
Не допускать нарушения нормального
технологического режима на всех стадиях процесса.
Работы вести только на исправном
оборудовании, оснащенном всеми необходимыми и исправно действующими
предохранительными устройствами, контрольно-измерительными и регулирующими
приборами, сигнализациями и блокировками.
При сдаче в ремонт оборудования и
коммуникаций, в которых возможно скопление аммиака, производить продувку
оборудования и коммуникаций азотом до отсутствия в продувочном азоте горючих.
Перед заполнением аппаратов и
коммуникаций аммиаком после их ремонта производить продувку азотом до
содержания кислорода в продувочном азоте не более 3,0 % (об.).
Не допускать ремонт коммуникаций,
арматуры, оборудования, находящихся под давлением. Ремонт должен производиться
после сброса давления и отключения ремонтируемого участка заглушками.
Оборудование, коммуникации, подлежащие ремонту, должны быть продуты или
промыты.
Во избежание гидравлических ударов
подачу пара в холодные паропроводы производить медленно, обеспечив достаточный
их подогрев со сбросом конденсата по всей длине трубопровода. Выход сухого пара
из дренажа свидетельствует о достаточном прогреве трубопровода.
Не допускать включение электрооборудования
при неисправном заземлении.
Не допускать ремонт оборудования с
электроприводом, без снятия напряжения с электродвигателей.
Ремонт и наладку
контрольных и измирительных приборов и
электрооборудования производить только силами служб отдела
главного прибориста и электриками.
Пользоваться открытым огнем в
производственных и складских помещениях запрещается:
курение
разрешается в отведенных для этих целей местах.
Все вращающиеся части оборудования
(полумуфты), крыльчатки вращающихся вентиляторов, на валах электродвигателей
должны иметь надежное крепление и ограждены, и окрашены в красный цвет.
Фланцевые соединения кислотных линий
должны быть защищены защитными кожухами.
Подтягивание болтов фланцевых
соединений трубопроводов, а также производство работ на оборудовании,
находящемся под давлением, не допускается.
Аппараты, работающие под давлением,
должны удовлетворять требованиям, изложенным в технических условиях и правилах
устройства и безопасной эксплуатации сосудов и коммуникаций, работающих под давлением.
Работы в закрытых сосудах
производить при наличии наряда-допуска на проведение газоопасных работ.
Вентиляция должна быть в исправном
состоянии и находиться постоянно в работе.
Обслуживание грузоподъемных
механизмов, сосудов, работающих под давлением, производится только лицами,
специально обученными и имеющими специальное удостоверение.
Подходы к аварийным шкафам, пожарным
извещателям, телефонам, пожарному инвентарю не допускается загромождать
посторонними предметами, содержать их необходимо в чистоте и в исправном
состоянии.
Открытые проемы в перекрытиях,
площадках, переходные мостики должны иметь ограждения высотой 1 м. В нижней
части ограждения должен располагаться бортик или защитная полоса высотой 15 см.
Все контрольно-измерительные приборы
и системы автоматики и блокировки должны находится в исправном состоянии.
Для предотвращения отложения
нитрит-нитратных солей на внутренних поверхностях аппаратов и трубопроводов,
лопастях роторов, стенах компрессоров нитрозного газа и других деталях и аппаратах
не допускать длительного розжига контактных аппаратов (более 20 минут),
снижения температуры катализаторных сеток, разрыва их, приводящих к проскокам
аммиака, прекращения орошения поверхностей, что приводит к отложению
нитрит-нитратных солей.
Своевременно производить обтирку,
очистку оборудования от проливов технологических продуктов, доливку масла в
картеры насосов.
Рабочие места для проведения
ремонтных и других работ и проходы к ним на высоте 1,3 м и более должны быть
ограждены.
При невозможности или
нецелесообразности устройства ограждений работы на высоте 1,3 м и выше, а также
при работе с приставной лестницы на высоте более 1,3 м необходимо применять
предохранительные пояса, при этом у места производства работ должны находиться
вспомогательные рабочие, готовые оказать помощь работающему на высоте. Место
закрепления карабина определяет руководитель работ.
Предохранительные пояса проходят
испытания перед выдачей в эксплуатацию, а также в процессе эксплуатации через
каждые 6 месяцев. На предохранительном поясе должна быть бирка с указанием
регистрационного номера и даты следующего испытания.
При работе с азотной кислотой (отбор
проб, осмотр коммуникаций, пуск насосов продукционной кислоты и т.п.)
необходимо применять индивидуальные средства защиты органов дыхания и зрения
(фильтрующий противогаз с коробкой марки «М», защитные очки с резиновой
полумаской или защитный щиток из оргстекла, или шлем от противогаза), резиновые
кислотозащитные перчатки, специальную кислотозащитную одежду.
При выявлении каких-либо
неисправностей в работе оборудования, дефектов опор, стенок и т.п. своевременно
ставить в известность начальника отделения, механика цеха. При необходимости
остановить оборудование и подготовить его к сдаче в ремонт.
При каждой остановке агрегата в ремонт
производить вскрытие нижнего люка окислителя и при наличии солей аммония на
распределительной решетке, по стенкам и днищу производить пропарку его острым
паром, конденсат сдренировать.
Работы с паром, паровым конденсатом
производить в спецодежде, спецобуви, рукавицах.
Для предупреждения профессиональных
отравлений
и заболеваний в
отделении должны соблюдаться следующие санитарно-гигиенические требования:
а) температура воздуха должна быть:
-23 - переходной и зимний период;
- переходной и зимний период;
18-27 - летний период.
- летний период.
б) относительная
влажность воздуха:
летом
-
не более
75 %;
зимой - не более 65 %.
в) шум
-
не более 65 дБА в шумоизоляционных кабинах, в остальных местах не более 80 дБА;
г) вибрация - не
более 75 дБ в шумоизоляционных кабинах, в машинном и контактном отделениях не
более 92 дБ;
д) освещенность рабочих мест:
шумоизоляционные кабины - не менее
200 лк;
на площадках абсорбционных колонн -
не менее 50 лк;
в машинном и контактном отделениях -
не менее 75 лк.
е) предельно
допустимая концентрация вредных веществ в воздухе рабочей зоны помещений:
аммиак
-
не более 20 мг/м3;
оксидов азота - не более 5 мг/м3.
Кроме индивидуальных противогазов в
отделении находится аварийный запас фильтрующих и изолирующих противогазов.
Аварийные противогазы хранятся в
аварийных шкафах [17].
ЗАКЛЮЧЕНИЕ
В ходе курсовой работы был рассчитан
реактор каталитического окисления аммиака для получения оксидов азота в
производстве неконцентрированной азотной кислоты.
Были рассмотрены физико-химические
основы процесса. Приведена характеристика исходного сырья и готового продукта.
Был рассчитан
необходимый объем воздуха для окисления 5900 м³/ч
аммиака, он составил 54304 м³/ч.
Были
вычислены
поступающие с воздухом объемы кислорода, азота и аргона исходя из процентного
содержания их в воздухе. Так же были вычислены
находящиеся в газе после окисления аммиака объемы кислорода, азота, аргона,
паров воды.
Был произведен
расчет теплового баланса, в результате чего были рассчитаны все тепловые
потоки. Вычислена температура,
до которой необходимо нагревать аммиачно-воздушную смесь для обеспечения
автотермичности процесса окисления аммиака, она составила 288 .
Рассчитана
температура нитрозного газа
после пароперегревателя, она составила 836,7
.
Рассчитана
температура нитрозного газа
после пароперегревателя, она составила 836,7 .
Определены
теплопотери в окружающую среду.
.
Определены
теплопотери в окружающую среду.
Был произведен обзор литературы по
наиболее эффективной схеме производства неконцентрированной азотной кислоты.
Была выбрана система, работающая под высоким давлением,
так как данный агрегат компактен, все аппараты транспортабельны, энергетический
цикл агрегата автономен. В рассмотренной схеме электроэнергия не расходуется на
технологические нужды. Электроэнергия потребляется в незначительном количестве
только для привода насосов, необходимых для перекачивания кислоты, подачи
питательной воды в котлы. Работа по этой схеме идет без выбросов в атмосферу
вредных газов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.
Атрощенко В.И., Каргин С.И. Технология азотной кислоты: Учеб. Пособие для
вузов. - 3-е изд., перераб. и доп. - М.: Химия, 1970. - 496 с.
.
Егоров А.П. Шерешевский А.И., Шманенко И.В. Общая химическая технология
неорганических веществ: Учебное пособие для техникумов. - Изд. 4-е перераб. -
Москва, Ленинград: Химия, 1965 - 688с.
.
Караваев М.М., Засорин А.П., Клещев Н.Ф. Каталитическое окисление аммиака/Под
ред. Караваева М.М. - М.: Химия, 1983. - 232 с.
.
Катализаторы в азотной промышленности./Под ред. Атрощенко В.И. - Харьков: Вища
шк., 1977. - 144 с.
.
Общая химическая технология. Под редакцией проф. Амелина А.Г. М.: Химия,1977. -
400 с.
.
Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и
аппаратов химической технологии. Л.: Химия, 1976 - 552с.
.
Перлов Е.И., Багдасарян В.С. Оптимизация производства азотной кислоты. М.:
Химия, 1983. - 208 с.
.
Расчеты по технологии неорганических веществ: Учеб. Пособие для вузов/Позин
М.Е., Копылев Б.А., Бельченко Г.В. и др.; Под ред. Позина М.Е. 2-е изд.
перераб. и доп. - Л.: Химия. Ленингр. отд-ние, 1977 - 496 с.
.
Румянцев
О.В. Оборудование цехов синтеза высокого давления в азотной промышленности;
Учеб. для вузов.- М.: Химия, 1970 - 376 с.
10.
Соколов Р.С. Химическая технология: учеб. пособие для студ. высш. учеб.
заведений: В 2 Т. - М.: Гуманит изд. центр ВЛАДОС, 2000. - Т.1: Химическое
производство в антропогенной деятельности. Основные вопросы химической
технологии. Производство неорганических веществ. - 368 с.
.
Справочник азотчика./Под ред. Мельникова Е.Я. - Т.2: Производство азотной
кислоты. Производство азотных удобрений. Материалы и основное специальное
оборудование. Энергоснабжение. Техника безопасности. - М.: Химия - 1969. -
448с.
.
Химическая технология неорганических веществ: В 2 кн. Кн.1. Учебное пособие /
Т.Г. Ахметов, Р.Г. Порфирьева, Л.Г. Гайсин. - М.: Высш. шк., 2002. 688с.: ил.
.
Коробочкин В.В. Технология азотной кислоты. - Издательство томского
политехнического университета. 2012.