|
№ п\п
|
Наименование сырья,
материалов, полупродуктов, энергоресурсов
|
ГОСТ, СТП, ТУ, регламент
или методика на подготовку сырья
|
Показатели по стандарту,
обязательные для проверки
|
Регламентируемые показатели
с допустимыми отклонениями
|
|
1
|
2
|
3
|
4
|
5
|
|
1
|
Аммиак жидкий
|
ГОСТ 6221-90 марка А
|
Массовая доля аммиака (NH3)
|
не менее 99,6%
|
|
|
|
Массовая доля влаги (H2O)
|
не более 0,4%
|
|
|
|
Массовая концентрация масла
|
не более 2,0 мг/дм3
|
|
|
|
Массовая концентрация
железа
|
не более 1,0 мг/дм3
|
|
2.
|
Воздух атмосферный
|
Унифицированные нормы,
утвержденные В/О «СОЮЗ- АЗОТОМ» 01.07.82г.
|
Массовая концентрация серы
|
не более 2,3 мг/дм3
|
|
|
|
Массовая концентрация
фосфорных соединений
|
не более 0,3 мг/дм3
|
|
|
|
Массовая концентрация
фтористых соединений в пересчете на фтор
|
не более 0,1 мг/дм3
|
|
|
|
Массовая концентрация
механических примесей после нагнетателя
|
не более 0,007 мг/дм3
|
|
3.
|
Конденсат водяного пара
|
Унифицированные нормы от
01.07.82г.
|
Массовая концентрация хлор иона
|
не более 2,0 мг/дм3
|
|
|
|
Массовая концентрация масла
|
не более 1,0 мг/дм3
|
|
|
|
Массовая концентрация
железа
|
не более 100 мкг/дм3
|
|
|
|
Массовая доля взвесей
|
отсутствие
|
|
4.
|
Питательная вода
(химочищенная вода после деаэрации)
|
ГОСТ 20995-75
|
Массовая концентрация
|
не более 3,0 мг/дм3
|
|
|
|
Масла Жесткость общая
|
не более 0,01 ммоль/дм3
|
|
|
|
Массовая концентрация
соединений железа (в пересчете на железо/Fe)
|
не более 100 мкг/дм3
|
|
|
|
Массовая концентрация
растворенного кислорода
|
не более 30 мкг/дм3
|
|
|
|
Значение рН при Т=25 0С
|
8,5 - 9,5
|
|
|
|
Свободная
|
отсутствует
|
|
|
|
углекислота
|
|
|
|
|
Массовая концентрация солей
жесткости
|
не более 200 мг/дм3
|
|
|
|
Массовая доля относительной
щелочности котловой воды
|
не более 30 %
|
|
5.
|
Природный газ
|
ГОСТ 5542-87
|
Массовая концентрация сернистых
соединений (в пересчете на элементарную серу)
|
не более 0,036 г/м3
|
|
|
|
Низшая теплотворная
способность при Т = 20 0С и 101,325 кПа
|
не менее 7600 кКал/м3
|
|
6.
|
Вода оборотная
|
Нормы СЭВ ВНИИВОДГЕО
|
Жесткость карбонатная
Массовая концентрация взвешенных веществ Значение рН
|
не более 3,6 ммоль/дм3
не более 50 мг/дм3 8,5
|
|
|
|
|
|
|
|
|
|
3.
Технологическая часть
.1 Теоретические основы процесса
Абсорбция окислов азота
Нитрозные газы, полученные при контактном окислении аммиака, в основном
содержат оксид азота, кислород, азот, а также пары воды. Оксид азота не
реагирует с водой. Поэтому для получения азотной кислоты оксид азота окисляют
до диоксида азота, который, взаимодействуя с водой, образует азотную кислоту.
Реакция окисления оксида азота обратима, протекает с уменьшением объема и
выделением тепла и может быть представлена уравнением:
2NO + O2 = 2NO2 ΔrH0(298) = -124кДж/моль (1.1)
Скорость реакции окисления NO в NO2 зависит от концентрации NO в нитрозном газе, температуры и давления.
При низких концентрациях NO скорость
реакции окисления очень мала. Нитрозные газы в производстве азотной кислоты
имеют относительно небольшую объемную долю NO, поэтому для окисления NO в NO2 нужны огромные реакционные объемы.
С повышением температуры скорость реакции окисления NO в NO2 снижается. Следовательно, для повышения скорости окисления NO в NO2 и уменьшения реакционного объема аппаратуры необходимо вести
реакцию при более низких температурах.
С увеличением давления скорость реакции окисления NO в NO2 возрастает. Этот рост прямо пропорционален квадрату
давления, а время, требуемое для достижения заданной степени окисления,
изменяется обратно пропорционально квадрату давления. С повышением давления
возможность уменьшить реакционные объемы аппаратов для окисления NO в NO2 не только благодаря увеличению скорости этой реакции, но и
за счет уменьшения физического объема газовой смеси, который изменяется обратно
пропорционально давлению. Таким образом, требуемый реакционный объем аппарата
обратно пропорционален кубу давления: во второй степени вследствие увеличения
скорости окисления NO
в NO2 и в первой степени - за счет сокращения общего объема
газов.
Реакция (1.1) сопровождается двумя другими реакциями окисления оксида
азота в высшие окислы азота:
2NO2 = N2O4 ΔrH0(298) = -
56,9 кДж/моль (1.2)+ NO2 = N2O3
ΔrH0(298) = -
40,1 кДж/моль (1.3)
Равновесие этих реакций при низких температурах смещено вправо, поэтому в
нитрозном газе в условиях избытка кислорода и при достаточном времени
контактирования все оксиды азота после охлаждения могут быть превращены в
тетроксид азота (N2O4). В реальных условиях непрерывно протекающих
процессов окисления и кислотообразования равновесие не достигается, поэтому в
газах присутствуют все указанные оксиды азота - NO, NO2, N2O3,
N2O4. Соотношение между их количествами определяется в основном
температурными условиями.
Температурная зависимость константы равновесия реакции (1.1) может быть
вычислена с большей степенью точности по уравнению Боденштейна (для давления,
выраженных в Па):
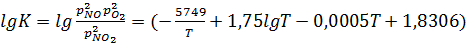
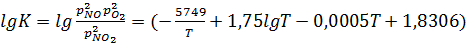 (1.4)
(1.4)
С
понижением температуры равновесие реакции сдвигается в сторону образования
диоксида азота. При атмосферном давлении в нитрозных газах, полученных
конверсией аммиака воздухом, при температуре около 150ºС в газе должен находиться один NO2, при 700ºС - один оксид азота II (NO). Повышение давления сдвигает равновесие в сторону
образования NO2.
Особенностью
реакции (1.1) является то, что скорость ее имеет отрицательный температурный
градиент - она увеличивается с понижением температуры. Объяснение этому
противоречащему обычным закономерностям явлению находят в двухстадийности
процесса. Большинство исследователей стало представлять процесс в целом как
двухстадийный в виде:
NO + O2 = NO3 (1.5)3
+ NO = 2NO2 (1.6)
Первая
стадия протекает быстро, с повышением температуры скорость увеличивается, но
равновесие смещается влево. Вторая стадия - медленная. Она и определяет
скорость суммарного процесса. Поскольку при понижении температуры будет
возрастать количество NO3, это
приводит к увеличению скорости второй стадии и реакции в целом. Такой механизм
объяснить отрицательный температурный градиент скорости реакции, однако в
литературе отсутствуют данные о наличии NO3 в газе в результате диссоциации NO2 при высоких температурах, что должно было бы
наблюдаться, если вторая стадия является равновесной.
Учеными
[4] установлено, что оксид азота II в определенных условиях, в том числе и в характерных
для производства азотной кислоты, окисляется в жидкой фазе растворенной в нем
кислородом.
С
появлением в газе NO2 при
температурах ниже 150 - 200ºС
начинают протекать реакции (1.2) и (1.3). Константа равновесия реакции (1.2)
может быть вычислена с большой точностью по следующей формуле (для давления в
МПа):
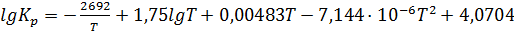
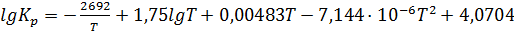 (1.7)
(1.7)
Имеются
сведения, что Кр этой реакции зависит не только от температуры, но и
от концентрации оксидов азота в газе [1]. В соответствии с равновесием реакции
(1.2) степень полимеризации диоксида азота увеличивается при понижении
температуры, повышения давления и концентрации оксидов азота в газе.
При
низких температурах и повышенных давлениях равновесие реакции (1.2) практически
полностью сдвинуто в сторону образования оксида азота IV.
Скорость
достижения равновесия реакции (1.3) велика - равновесие устанавливается за
время, менее 0,1 с.
.2 Описание технологической схемы
Технологический процесс получения неконцентрированной азотной кислоты по
схеме унифицированной комплексной линии УКЛ-7 под давлением 0,716 МПа состоит
из следующих стадий:
· подготовка и сжатие воздуха;
· подготовка газообразного аммиака;
· подготовка аммиачно-воздушной смеси;
· конверсия аммиака;
· охлаждение нитрозного газа с утилизацией тепла;
· абсорбция оксидов азота;
· каталитическая очистка выхлопных газов от остаточных оксидов
азота;
· рекуперация энергии очищенного выхлопного газа;
· хранение и выдача продукционной кислоты.
Подготовка и сжатие воздуха
Атмосферный воздух осевым компрессором поз. ОК газотурбинного агрегата
ГТТ-3М забирается через воздухозаборную трубу в аппарат очистки воздуха поз.
ФВ. Наиболее опасная зона работы аппарата, при которой создаются условия для
увлажнения и обмерзания фильтров, находится на границе колебания температур
наружного воздуха от +5°С до -8°С и его относительной влажности более 95%. Для
исключения обмораживания фильтрующих элементов и осевого компрессора
предусматривается подогрев всасываемого воздуха при снижении его температуры
ниже +7°С и при увеличении относительной влажности более 89%. Воздух,
поступающий в осевой компрессор, подогревается путем подачи в него горячего
воздуха от нагнетателя поз. ЦН не более чем на 5-7°С. Из аппарата поз. ФВ
очищенный воздух поступает в осевой компрессор поз. ОК, в котором сжимается до
давления 0,23-0,33 МПа, нагреваясь при этом до температуры не выше 175°С. Далее
воздух охлаждается оборотной водой в промежуточном воздухоохладителе поз. ВП до
температуры не выше 48°С и поступает в центробежный нагнетатель поз. ЦН, в
котором сжимается до 0,5-0,8 МПа и нагревается до температуры не выше 143°С.
Осевой компрессор поз. ОК и центробежный нагнетатель поз. ЦН
газотурбинной установки ГТТ-3М приводятся в движение газовой турбиной поз. ГТ,
объединенной конструктивно в одном корпусе с компрессором.
Из нагнетателя основная часть воздуха направляется на стадию окисления
аммиака. Кроме того, воздух используется:
· в качестве добавочного воздуха для окисления оксида азота в
диоксид и обдувки оксидов азота из продукционной кислоты;
· в камере сгорания реактора каталитической очистки хвостовых
газов от остаточных оксидов азота;
· в камере сгорания турбины;
· для подогрева всасываемого воздуха перед аппаратом очистки;
· в газовой турбине агрегата ГТТ-3М для охлаждения элементов
проточной части корпуса.
Подготовка газообразного аммиака
Жидкий аммиак с давлением 1,6-2,4 МПа и температурой не ниже +5°С из
общецехового коллектора поступает в испаритель поз. ИЖА. Испарение жидкого
аммиака производится при температуре не выше 30 0С и давлении Р=1,05-1,15 МПа
перегретым паром давлением 0,6-1,5 МПа. Из испарителя газообразный аммиак
поступает в фильтр поз. ФГА, где очищается от масла и механических примесей. Из
фильтра поз. ФГА газообразный аммиак поступает в подогреватель газообразного
аммиака поз. ПГА, где нагревается до 80-110°С перегретым паром давлением
0,6-1,5 МПа.
При использовании в качестве исходного сырья газообразного аммиака из
схемы подготовки аммиака путем установки заглушек исключаются испаритель
жидкого аммиака поз. ИЖА и подогреватель газообразного аммиака поз. ПГА. В этом
случае газообразный аммиак поступает в цех из заводской сети с давлением
1,0-1,2 МПа и температурой 100-180°С в фильтр газообразного аммиака поз. ФГА,
где очищается от механических примесей. Далее газообразный аммиак направляется
в смеситель поз. С на смешение с воздухом. Объемный расход газообразного
аммиака поддерживается автоматически регулятором соотношения таким образом,
чтобы концентрация аммиака в аммиачно-воздушной смеси была 9,5-10,6 % об.
Соотношение “аммиак-воздух” зависит от расхода воздуха и корректируется по
температуре на сетках контактного аппарата.
При повышении концентрации аммиака в аммиачно-воздушной смеси до
11,0-11,5 % об. Включается предупредительная светозвуковая сигнализация на
пульте управления агрегатом кислоты. Для предотвращения возможности образования
взрывоопасной концентрации аммиака в аммиачно-воздушной смеси предусмотрена
блокировка, срабатывающая при увеличении концентрации аммиака в
аммиачно-воздушной смеси до 11,6-12,0 %об.
По мере испарения жидкого аммиака концентрация масла, воды и
механических примесей в кубе испарителя увеличивается, поэтому загрязненный
аммиак непрерывно выводится из нижней части испарителя поз. ИЖА и периодически
из фильтра поз. ФГА на утилизацию.
Подготовка аммиачно-воздушной смеси
Воздух после нагнетателя поз. ЦН с давлением 0,5-0,8 МПа и температурой
не выше 143°С поступает в межтрубное пространство подогревателя воздуха поз.
ПВ, где нагревается до 180-240°С за счет тепла нитрозных газов. Далее воздух
подается в межтрубное пространство смесителя поз. С, по выходе из которого
смешивается с газообразным аммиаком, который направляется в трубную часть.
Образующаяся аммиачно-воздушная смесь через отверстия решетки поступает в
фильтр, расположенный в верхней части аппарата поз. С, где очищается от
механических примесей в патронных фильтрах с насадкой из ультрасупертонкого
стекловолокна УСТВ и с температурой 170-230°С подается в контактный аппарат
поз. КА.
Конверсия аммиака и охлаждение нитрозного газа с утилизацией тепла
В контактном аппарате поз. КА аммиак окисляется до оксида азота
кислородом воздуха на платино-родиевопалладиевом катализаторе, выполненном в
виде сеток, при температуре 880-910°С. Степень превращения окисляемого аммиака
в оксида азота (селективность катализатора) составляет не менее 93,5%.
Отклонение температуры под сетками контактного аппарата от регламентированного
значения и значение температуры 950°С сигнализируются.
Для розжига (прогрева) катализаторных сеток в контактном аппарате
применяется азото-водородная смесь (АзВС) с давлением 1,2-1,5 МПа, которая
перед подачей в контактный аппарат очищается от механических примесей. Схемой
предусмотрена возможность розжига катализаторных сеток электро-розжиговым
устройством.
Образующиеся при окислении аммиака горячие нитрозные газы поступают в
котел-утилизатор поз. КУ. В котле- утилизаторе за счет охлаждения нитрозных
газов с 880-910°С до 230-285°С происходит испарение питательной воды с
получением перегретого пара. При этом в газовом тракте котла-утилизатора
частично идет реакция окисления оксида азота II (NO) в оксид азота IV (NO2) с
выделением тепла. Питательная вода проходит стальной экономайзер (второй по
ходу газа) котла-утилизатора поз. Э, где подогревается очищенными хвостовыми
газами до температуры 130-180 °С и поступает в межтрубную часть
котла-утилизатора поз. КУ. В котле-утилизаторе происходит испарение питательной
воды с образованием пара. Пар, пройдя сепарационное устройство, встроенное в
выносном барабане поз. СКУ, поступает в пароперегреватель поз П, где нагревается
до 230-250 °С и с давлением 1,3-1,5 МПа выдается в цеховой коллектор пара. Для
предохранения котла от превышения давления пара, на барабане и после
пароперегревателя котла устанавливаются предохранительные клапаны. Газовые
камеры котла-утилизатора, во избежание конденсации влаги и образования азотной
кислоты на внутренних стенках, обогреваются паром, подаваемым в змеевики для
обогрева газовых камер. После котла-утилизатора нитрозные газы поступают в
окислитель поз. О. Нитрозные газы поступают в верхнюю часть аппарата, где
установлен фильтр для улавливания платины из газовой фазы. В объеме окислителя
поз. О происходит реакция окисления оксида азота II в оксид азота IV с
повышением температуры нитрозных газов не выше 340 °С.
Из окислителя поз. О нитрозные газы разделяются на 2 потока. Один,
проходит через подогреватель воздуха поз. ПВ, где за счет нагрева воздуха
охлаждается до температуры 185-195 °С. Второй поток байпасирует мимо
подогревателя воздуха. После окислителя поз. О и подогревателя воздуха поз. ПВ
нитрозный газ с температурой не выше 260 ºС направляется в подогреватель
хвостовых газов поз. ПХГ. В подогревателе хвостовых газов нитрозные газы
охлаждаются до температуры 155-185 ºС, нагревая при этом хвостовые газы
до температуры 100-145 ºС. Далее нитрозные газы направляются на стадию
абсорбции и далее на стадию каталитической очистки выхлопных (хвостовых) газов
от остаточных оксидов азота.
Рекуперация энергии очищенного выхлопного газа
Очищенные хвостовые газы с температурой 705- 730°С после реактора
каталитической очистки поз. РКО смешиваются с топочными газами камеры сгорания
турбины поз. КСТ агрегата ГТТ-3М и с температурой 550- 700°С поступают в
газовую турбину поз. ГТ. В газовой турбине внутренняя энергия газов
преобразуется в механическую (энергию вращения турбины). В турбине газы
расширяются, при этом охлаждаются до температуры 390- 410°С.
Далее очищенные хвостовые газы поступают в газотурбинный котел-утилизатор
поз. ГКУ и экономайзеры поз. Э, где охлаждаются до 125-185°С и через выхлопную
трубу высотой 150 метров выбрасываются в атмосферу.
В котле-утилизаторе за счет охлаждения очищенных газов до 125- 185°С
вырабатывается перегретый пар давлением не более 1,5 МПа. В качестве
питательной воды для котлов- утилизаторов применяется нагретая до температуры
102- 104°С деаэрированная химочищенная вода. Питательная вода проходит стальной
экономайзер поз. Э (первый по ходу газа), где подогревается очищенными
хвостовыми газами до температуры 130-195°С и поступает в котел- утилизатор поз.
ГКУ. В котле- утилизаторе за счет тепла очищенных хвостовых газов происходит
испарение питательной воды с образованием пара. Пар из барабана поступает в
пароперегреватель, где нагревается до температуры 230- 250°С и с давлением 1,3-
1,5 МПа и выдается в цеховой коллектор пара.
Расчеты технологических процессов.
3.3.1 Расчеты материальных балансов процессов
Суммарную реакцию получения азотной кислоты из аммиака и кислорода
воздуха (без учета побочных реакций, проходящих с образованием элементарного
азота и других соединений) можно выразить уравнением:
NH3 + 2O2 = HNO3 + H2O ∆rH0(298) = - 412,98 кДж /моль (1.8.)
Проектная производительность агрегата УКЛ-7 составляет 120 000 тонн в год
(в пересчете на моногидрат HNO3) или
,00 / 330 / 24 ∙ 1000,00 = 15151,52 кг/ч 100,00 %-й HNO3,
где 330- количество рабочих дней в году.
Массовый расход аммиака, теоретически необходимого для получения 15151,52
кг/ч 100,00 %-й азотной кислоты согласно суммарному уравнению реакции (1.8.):
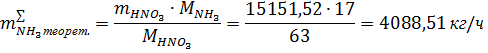
где
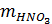
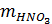 -
производительность установки по моногидрату азотной кислоты, кг/ч;
-
производительность установки по моногидрату азотной кислоты, кг/ч; 
 (17 и
63)- молярные массы аммиака и азотной кислоты соответственно, г/моль.
(17 и
63)- молярные массы аммиака и азотной кислоты соответственно, г/моль.
Практический массовый расход аммиака, подаваемого на стадию окисления
аммиака кислородом воздуха, согласно суммарному уравнению реакции (1.8.):
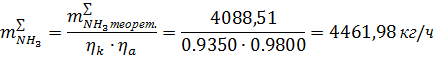
где
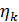
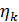 - степень
превращения аммиака в NO на катализаторе (селективность катализатора), д.е;
- степень
превращения аммиака в NO на катализаторе (селективность катализатора), д.е; 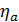
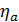 - степень
абсорбции оксидов азота, д.е.
- степень
абсорбции оксидов азота, д.е.
Практический объемный расход аммиака согласно суммарному уравнению
реакции (1.8.):
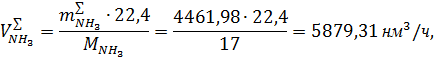
где 22,4- мольный объем газа при нормальных условиях, нл/моль.
Состав влажного воздуха может быть определен следующим образом. Уравнение
для расчета давления насыщенного водяного пара (упругости водяного пара), МПа:
Р= 4,073 - 1657,4 / (Т - 46,13).
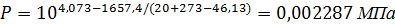
Остаточное давление определяется по формуле:
Рост. = Рб - Рр ,
где Рб - нормальное барометрическое давление, МПа; Рр-
разрежение в аппарате очистки воздуха (согласно регламентным данным составляет
до 2,00 кПа).
Рост. = 0,101325 - 0,002 = 0,099325 МПа.
Содержание водяных паров в воздухе определяется по формуле:
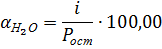
где i- упругость водяных паров в воздухе, МПа.
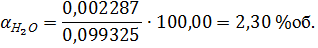
Содержание в воздухе N2 и О2:
,00 - 2,30 = 97,70 %об.
В сухом воздухе содержится 21,00 % об. О2 и 79,00 %об. N2.
Тогда кислорода во влажном воздухе:
,70 ∙ 0,21 = 20,52 % об.
Азота во влажном воздухе:
,70 ∙ 0,79 = 77,18 % об.
На катализаторных сетках контактного аппарата протекают процессы,
описываемые следующими уравнениями реакций:
4NH3 + 5O2 = 4NO + 6H2O ∆rH0(298)
= - 902,06 кДж/моль (1.9.)
NH3 + 3O2 = 2N2 + 6H2O
∆rH0(298) = - 1267,10 кДж/моль (1.10.)
В производственных условиях концентрацию аммиака в аммиачно-воздушной
смеси поддерживают в пределах 9,5 - 11,5 % об., т.е. мольное соотношение [O2
: NH3]≈ 1,7 ÷ 2. Поскольку эти значения выше 9,30 %
об. (т.е. значения, соответствующего суммарному уравнению реакции (1.8.)-
кислород воздуха вводится в недостатке), то в систему перед стадией абсорбции
через продувочную колонну подается добавочный воздух.
При концентрации аммиака в аммиачно-воздушной смеси 10,50 % об. ее расход
равен:
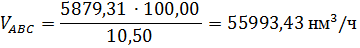
В контактный аппарат поступает воздуха:
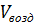
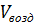 =55993,43
- 5879,31 = 50114,12 нм3/ч.
=55993,43
- 5879,31 = 50114,12 нм3/ч.
Необходимый
для производства воздух забирается из атмосферы через воздухозаборную трубу и
очищается от пыли и механических загрязнений в двухступенчатом фильтре.
С
воздухом в контактный аппарат поступает кислорода:
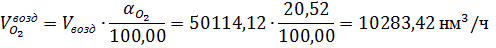
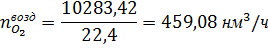
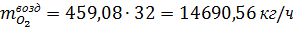
где
20,52- концентрация кислорода во влажном воздухе, % об.; 22,4- мольный объем
газа при нормальных условиях, нл/моль; 32- молярная масса кислорода, г/моль.
С
воздухом в контактный аппарат поступает азота:
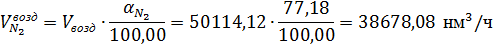
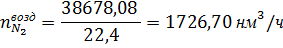
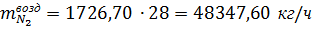
где 77,18- концентрация азота во влажном воздухе, % об.; 28- молярная
масса азота, г/моль.
С воздухом в контактный аппарат поступает водяных паров:
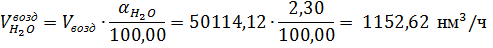
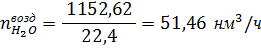
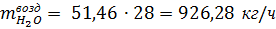
где 2,30- концентрация водяных паров во влажном воздухе, % об.; 18-
молярная масса водяных паров, г/моль.
Состав аммиачно-воздушной смеси, поступающей в контактный аппарат:
3
10,50 % об.;
О2 10283,42 / 55993,43 ∙ 100,00 = 18,37 % об.; 2
38678,08 / 55993,43 ∙ 100,00 = 69,08 % об.;
Н2О 1152,62 / 55993,43 ∙ 100,00 = 2,05 % об.;
ВСЕГО: 100,00 % об.
Массовый расход аммиачно-воздушной смеси, поступающей в контактный
аппарат:
mABC = 4461,98 + 14690,56 + 48347,60 + 926,28 = 68426,42 кг/ч.
Состав аммиачно-воздушной смеси, поступающей в контактный аппарат:
3
4461,98 / 68426,42 ∙ 100,00 = 6,52 % масс.;
О2 14690,56 / 68426,42 ∙ 100,00 = 21,47 % масс.; 2
48347,60 / 68426,42 ∙ 100,00 = 70,66 % масс.;
Н2О 926,28 / 68426,42 ∙ 100,00 = 1,35 % масс.;
ВСЕГО: 100,00 % масс.
Как отмечалось ранее, основными реакциями, протекающими в контактном
аппарате, являются (1.9.) и (1.10.). При этом, согласно практическим данным, по
реакции (1.9.) окисляется 93,50% аммиака, а оставшийся аммиак окисляется по
реакции (1.10.). Значение же предельной степени окисления аммиака в NO для
платиноидных сеток в интервале температур 850-1000 °С и давлений
0,5-3,0 МПа можно определить по уравнению:
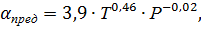
где Т- температура на сетках, К; Р- давление в системе, атм. Для агрегата
УКЛ- 7 давление в системе составляет 0,716 МПа. Температура нитрозного газа на
выходе с сеток контактного аппарата (согласно расчетам теплового баланса стадии
окисления аммиака кислородом воздуха, представленным ниже) равна 879 °С.
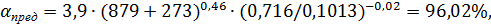
Тогда степень приближения реакции (1.9.) к равновесию:

В результате окисления аммиака по реакции (1.9.) образуется NO:
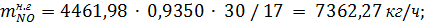
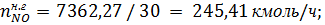
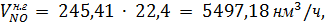
где 30- молярная масса оксида азота (II), г/моль.
В результате окисления аммиака по реакции (1.10.) образуется азота:
,98 ∙ (1 - 0,9350) ∙ 2 ∙ 28 / 4 / 17 = 238,85 кг/ч,
где 28 и 17- молярные массы азота и аммиака соответственно, г/моль.
Поскольку азот в контактный аппарат также вводится с воздухом, то в
нитрозном газе его содержится:
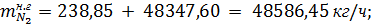
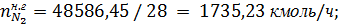
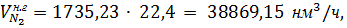
где 28- молярная масса азота, г/моль.
В результате окисления аммиака по реакциям (1.9.) и (1.10.) образуется
водяных паров:
4461,98 ∙ 6 ∙ 18 / 4 / 17 = 7086,67 кг/ч.
Поскольку водяные пары в контактный аппарат также вводится с воздухом, то
в нитрозном газе их содержится:
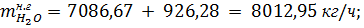
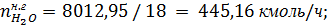
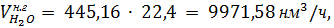
где 18- молярная масса водяных паров, г/моль.
В процессе окисления аммиака по реакциям (1.9.) и (1.10.) расходуется
кислорода:
по реакции (1.9.)
,98 ∙ 0,9350 ∙ 5 ∙ 32 / 4 / 17 = 9816,36 кг/ч;
по реакции (1.10.)
,98 ∙ (1-0,9350) ∙ 3 ∙ 32 / 4 / 17 = 409,45 кг/ч;
всего
,36 + 409,45 = 10225,81 кг/ч.
В нитрозном газе на выходе из контактного аппарата остается кислорода:
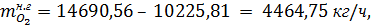
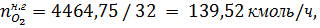
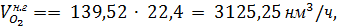
где 32- молярная масса кислорода, г/моль.
Таким образом, в процессе окисления аммиака образуется нитрозного газа:
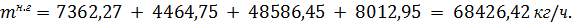
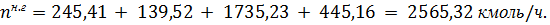
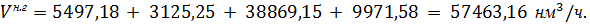
Состав нитрозного газа на выходе из контактного аппарата.
|
Компонент
|
% об.
|
% масс.
|
|
NO
|
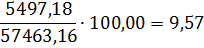
|
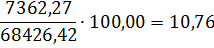
|
|
O2
|
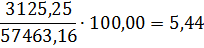
|
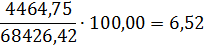
|
|
N2
|
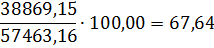
|
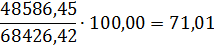
|
|
H2O
|
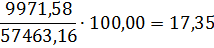
|
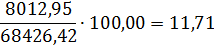
|
|
ВСЕГО:
|
100,00
|
100,00
|
Мольное соотношение [O2 : NH3]: 459,08 / 262,47 = 1,75.
Согласно стехиометрии реакций (1.9.) и (1.10.) для окисления 4461,98 кг/ч
аммиака в контактный аппарат с воздухом необходимо ввести 10225,92 кг/ч
кислорода. Избыток кислорода относительно стехиометрического количества:
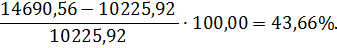
Коэффициент пересчета с часовой производительности на 1 т моногидрата
азотной кислоты составляет:
,00 / 15151,52 = 0,066,
где 15151,52- производительность установки, кг 100%-й HNO3/ч.
Результаты расчета материального баланса заносятся в таблицу 3.1.
От сеток контактного аппарата до окислителя температура газа понижается с
850 - 880°С до 250°С. Данный процесс сопровождается частичным окислением NO в NO2. Согласно практическим данным на данном участке степень
окисления NO в NO2 составляет 42%. Состав и количество нитрозного газа на входе
в окислитель представлены в таблицу 3.3.
Таблица 3.1. Материальный баланс стадии окисления аммиака кислородом
воздуха (в расчете на часовую производительность).
|
ПРИХОД (до окисления)
|
РАСХОД (после окисления)
|
|
Компонент
|
нм3/ч
|
% об.
|
кг/ч
|
% масс.
|
кмоль/ч
|
Компонент
|
нм3/ч
|
% об.
|
кг/ч
|
%масс.
|
кмоль/ч
|
|
1) NH3
|
5879,31
|
10,50
|
4461,98
|
6,52
|
Нитрозный газ в т.ч.
|
|
2) Воздух, в т.ч.
|
50114,12
|
89,50
|
63964,44
|
93,48
|
2237,24
|
NO
|
5497,18
|
9.57
|
7362,27
|
10,76
|
245,41
|
|
O2
|
10283,42
|
18,37
|
14690,56
|
21,47
|
459,08
|
O2
|
3125,25
|
5,44
|
4464,75
|
6,52
|
139,52
|
|
N2
|
38678,08
|
69,08
|
48347,60
|
70,66
|
1726,70
|
N2
|
38869,15
|
67,64
|
48586,45
|
71,01
|
1735,23
|
|
H2O
|
1152,62
|
2,05
|
926,28
|
1,35
|
51,46
|
H2O
|
9971,58
|
17,35
|
8012,95
|
11,71
|
445,16
|
|
ВСЕГО:
|
55993,43
|
100,00
|
68426,42
|
100,00
|
2499,71
|
ВСЕГО:
|
57463,16
|
100,00
|
68426,42
|
100,00
|
2565,32
|
Таблица 3.2. Материальный баланс стадии окисления аммиака кислородом
воздуха (в расчете на 1 т моногидрата азотной кислоты).
|
ПРИХОД (до окисления)
|
РАСХОД (после окисления)
|
|
Компонент
|
нм3/т
|
% об.
|
кг/т
|
% масс.
|
кмоль/т
|
Компонент
|
нм3/т
|
% об.
|
кг/т
|
%масс.
|
кмоль/т
|
|
1) NH3
|
388,03
|
10,50
|
294,49
|
6,52
|
17,32
|
Нитрозный газ в т.ч.
|
|
2) Воздух, в т.ч.
|
3307,53
|
89,50
|
4221,65
|
93,48
|
147,66
|
NO
|
362,81
|
9.57
|
485,91
|
10,76
|
16,20
|
|
O2
|
658,71
|
18,37
|
969,58
|
21,47
|
30,30
|
O2
|
206,27
|
5,44
|
294,67
|
6,52
|
9,21
|
|
N2
|
2552,75
|
69,08
|
3190,94
|
70,66
|
113,96
|
N2
|
2565,36
|
67,64
|
3206,71
|
71,01
|
114,53
|
|
H2O
|
76,07
|
2,05
|
61,13
|
1,35
|
3,40
|
H2O
|
658,12
|
17,35
|
528,85
|
11,71
|
29,38
|
|
ВСЕГО:
|
3695,57
|
100,00
|
4516,14
|
100,00
|
164,98
|
ВСЕГО:
|
3792,57
|
100,00
|
4516,14
|
100,00
|
169,31
|
Таблица 3.4. Материальный баланс окислителя (в расчете на часовую
производительность).
|
ПРИХОД (до окисления)
|
РАСХОД (после окисления)
|
|
Компонент
|
нм3/ч
|
% об.
|
кг/ч
|
% масс.
|
кмоль/ч
|
Компонент
|
нм3/ч
|
% об.
|
кг/ч
|
% масс.
|
кмоль/ч
|
|
Нитрозный газ в т.ч.
|
Нитрозный газ в т.ч.
|
|
NO
|
5497,18
|
9.57
|
7362,27
|
10,76
|
245,41
|
NO
|
3188,36
|
5,66
|
4270,12
|
6,24
|
142,34
|
|
|
|
|
|
|
|
NO2
|
2308,81
|
4,11
|
4741,30
|
6,94
|
103,07
|
|
|
O2
|
3125,25
|
5,44
|
4464,75
|
6,52
|
139,52
|
O2
|
1970,9
|
3,50
|
2815,60
|
4,11
|
87,99
|
|
N2
|
38869,15
|
67,64
|
48586,45
|
71,01
|
1735,23
|
N2
|
38869,15
|
69,03
|
48586,45
|
71,00
|
1735,23
|
|
H2O
|
9971,58
|
17,35
|
8012,95
|
11,71
|
445,16
|
H2O
|
9971,58
|
17,70
|
8012,95
|
11,71
|
445,16
|
|
ВСЕГО:
|
57463,16
|
100,00
|
68426,42
|
100,00
|
2565,32
|
ВСЕГО:
|
56308,8
|
100,00
|
68426,42
|
100,00
|
2513,79
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3.5. Материальный баланс окислителя (в расчете на 1 т моногидрата
азотной кислоты).
|
ПРИХОД (до окисления)
|
РАСХОД (после окисления)
|
|
Компонент
|
нм3/т
|
% об.
|
кг/т
|
% масс.
|
кмоль/т
|
Компонент
|
нм3/т
|
% об.
|
кг/т
|
% масс.
|
кмоль/т
|
|
Нитрозный газ в т.ч.
|
Нитрозный газ в т.ч.
|
|
NO
|
362,81
|
9,57
|
485,91
|
10,76
|
16,20
|
NO
|
210,43
|
5,66
|
281,82
|
6,24
|
9,39
|
|
|
|
|
|
|
NO2
|
152,38
|
4,11
|
312,93
|
6,94
|
6,80
|
|
O2
|
206,26
|
5,44
|
294,67
|
6,52
|
9,21
|
O2
|
130,08
|
3,50
|
185,83
|
4,11
|
5,81
|
|
N2
|
2565,33
|
67,64
|
3206,71
|
71,01
|
114,53
|
N2
|
2565,33
|
69,03
|
3206,71
|
71,00
|
114,53
|
|
H2O
|
658,12
|
17,35
|
528,85
|
11,71
|
29,38
|
H2O
|
658,12
|
17,70
|
528,85
|
11,71
|
29,38
|
|
ВСЕГО:
|
3792,52
|
100,00
|
4516,14
|
100,00
|
169,31
|
ВСЕГО:
|
3716,34
|
100,00
|
4516,14
|
100,00
|
165,91
|
Расчет равновесной степени окисления NO в NO2.
Процесс окисления NO протекает по уравнению реакции:
2NO + O2 = 2NO2 ∆rH°(298)
= - 114,14 кДж/моль (1.11)
Данная реакция протекает с уменьшением числа моль и имеет большой
экзотермический эффект. Согласно правилу Ле-Шателье для повышения степени
превращения и смещения равновесия в сторону продуктов эту реакцию желательно
проводить при повышенных давлениях и пониженной температуре.
Расчет равновесного состава газа при окислении NO в NO2 можно
провести, используя величину равновесной степени окисления xp, которая показывает отношение
количества прореагировавшего NO к его количеству в исходной смеси. Процесс
окисления оксида азота (II) кислородом (уравнение 1) характеризуется константой
равновесия, обычно выражаемой через парциальные давления компонентов:
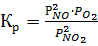
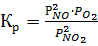 (1.12)
(1.12)
Температурная
зависимость константы равновесия реакции окисления оксида азота II (уравнение
1.11.) может быть вычислена с большой степенью точности по уравнению
Боденштейна (для давления, выраженного в МПа:
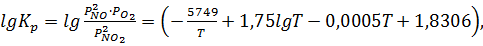
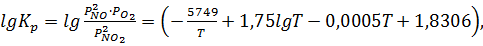 (1.13)
(1.13)
где
T- температура нитрозного газа, К.
Для расчета равновесной степени окисления оксида азота выразим парцальные
давления газов, входящие в уравнение равновесия, через общее давление в
зависимости от начальной концентрации газа.
Введем обозначения:
а- начальная концентрация NО, мол. доли; начальная концентрация О2,
мол. доли;
хр- равновесная степень окисления NО, доли единицы;
Pобщ- общее давление газа, МПа.
Общее количество исходного газа примем за единицу. Равновесные
концентрации компонентов газовой смеси согласно реакции (1.11.) составят:
|
Компонент
|
NO
|
O2
|
NO2
|
|
Концентрации, мол. доли
|
2а∙(1-xp)
|
b-a∙xp
|
2a∙xp
|
|
ВСЕГО:
|
2a∙(1-xp)+b-a∙xp+2a∙
xp 2a-2a∙ xp+b-a∙ xp+2a ∙xp
2a+b-a∙xp (т.к. 2a+b=1) 1-a∙xp
|
Тогда парциальные давления компонентов газа в момент равновесия будут
равны:
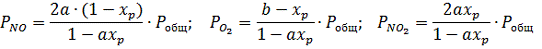
Подставляя значения парциальных давлений в уравнение равновесия (1.12.),
получим:
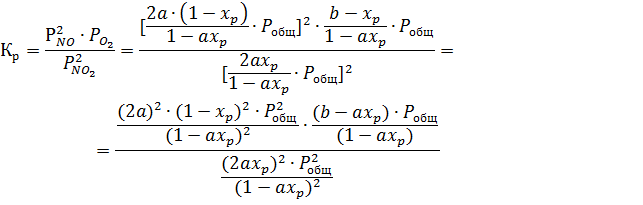
Откуда
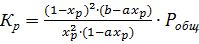
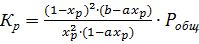 (1.14)
(1.14)
Расчет
равновесных концентраций газа по этой формуле дает правильные результаты лишь
при температуре выше 200° С, так как при более низких температурах происходит
образование оксида азота (IV) и оксида азота (III), ведущее к уменьшению
объема, не учитываемому данной формулой. Подставляя в данное уравнение значения
начальных концентраций исходных компонентов, общее давление газа, а также
константу равновесия, и решая его относительно хp, можно
определить равновесную степень превращения NO в NO2, а также
равновесный состав газовой смеси при заданных условиях.
Температура
нитрозных газов на входе в окислитель 250 °С, а на выходе из него 340°С.
Константа равновесия реакции окисления оксида азота (II) при средней
температуре, согласно уравнению (1.13.), составляет (для давления, выраженного
в МПа):
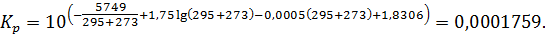
Определим
равновесную степень окисления NO при t=250 °С и Робщ.=0,716 МПа для
следующего состава газа: 5,66 % об. NO; 3,50 % об. O2; 69,03 % об. N2; 17,70 %
об. H2O; 4,11% об.NO2 .
а
= 0,0566 мол. доли а = 0,0283 мол. доли b = 0,035 мол. доли
Подставляя
в уравнение (1.14.) значения а, b, Робщ., Кр, и решая его относительно хр,
получаем значение равновесной степени окисления NO.
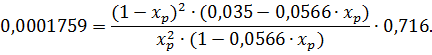
Из
этого уравнения определяем хр = 0,78 д.е.
Согласно практическим данным примем, что степень приближения к равновесию
процесса окисления NO в NO2 в окислителе составляет 85 %. Тогда
практическая степень окисления в аппарате составит:
,78 ∙ 0,85 = 0,66 д.е.
По реакции (1.11.) окисляется NO:
Остается NO:
,12 - 2818,28 = 1451,84 кг/ч;
,84 / 30 = 48,39 кмоль/ч;
,39 ∙ 22,4 = 1089,04 нм3/ч,
где 30- молярная масса NO, г/моль.
В результате окисления NO по реакции (1.11.) образуется NO2:
,28 ∙ 2 ∙ 46 / 2 / 30 = 4321,36+4741,30=9062,66 кг/ч;
,66 / 46 = 197,01 кмоль/ч;
,01 ∙ 22,4 = 4413,12 нм3/ч,
где 46- молярная масса NO2, г/моль.
По реакции (1.11.) расходуется кислорода:
,28 ∙ 32 / 2 / 30 =1503,08 кг/ч.
Остается кислорода:
,60 - 1503,08 = 1312,52 кг/ч;
,52 / 32 = 41,02 кмоль/ч;
,02 ∙ 22,4 = 918,85 нм3/ч.
где 32- молярная масса O2, г/моль.
Тогда расход газа на выходе из окислителя составит:
,04+4413,12+918,85+38869,15+9971,81=55256,97 нм3/ч.
,84+9062,66+1312,52+48586,45+8012,95=68426,42 кг/ч.
,39+197,01+41,02+1735,23+445,16=2466,81 кмоль/ч.
Состав нитрозного газа на выходе из окислителя.
|
Компонент
|
% об.
|
% масс.
|
|
NO
|
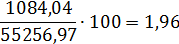
|
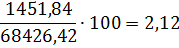
|
|
NO2
|
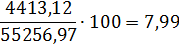
|
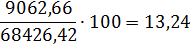
|
|
O2
|
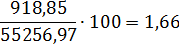
|
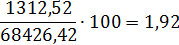
|
|
N2
|
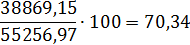
|
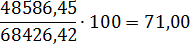
|
|
H2O
|
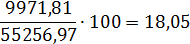
|
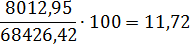
|
|
ВСЕГО:
|
100,00
|
100,00
|
Результаты расчетов заносим в таблицу 3.6.
Таблица 3.6. Материальный баланс процесса окисления NO кислородом в
окислителе (в расчете на часовую производительность).
|
ПРИХОД (до окисления)
|
РАСХОД (после окисления)
|
|
Компонент
|
нм3/ч
|
% об.
|
кг/ч
|
%масс.
|
кмоль/ч
|
Компонент
|
нм3/ч
|
% об.
|
кг/ч
|
% масс.
|
кмоль/ч
|
|
Нитрозный газ в т.ч.
|
Нитрозный газ в т.ч.
|
|
NO
|
3188,36
|
5,66
|
4270,12
|
6,24
|
142,34
|
NO
|
1084,04
|
1,96
|
1451,84
|
2,12
|
48,39
|
|
NO2
|
2308,81
|
4,11
|
4741,30
|
6,94
|
103,07
|
NO2
|
4413,12
|
7,99
|
9062,66
|
13,24
|
197,01
|
|
O2
|
1970,9
|
3,50
|
2815,60
|
4,11
|
87,99
|
O2
|
918,85
|
1,66
|
1312,52
|
1,92
|
41,02
|
|
N2
|
38869,15
|
69,03
|
48586,45
|
71,00
|
1735,23
|
N2
|
38869,15
|
70,34
|
48586,45
|
71,00
|
1735,23
|
|
H2O
|
9971,58
|
17,70
|
8012,95
|
11,71
|
445,16
|
H2O
|
9971,58
|
18,05
|
8012,95
|
11,72
|
445,16
|
|
ВСЕГО:
|
56308,8
|
100,00
|
68426,42
|
100,00
|
2513,79
|
ВСЕГО:
|
55256,74
|
100,00
|
68426,42
|
100,00
|
2466,81
|
Таблица 3.7. Материальный баланс процесса окисления NO кислородом в
окислителе (в расчете на 1 т моногидрата азотной кислоты).
|
ПРИХОД (до окисления)
|
РАСХОД (после окисления)
|
|
Компонент
|
нм3/т
|
% об.
|
кг/т
|
% масс.
|
кмоль/т
|
Компонент
|
нм3/т
|
% об.
|
кг/т
|
%масс.
|
кмоль/т
|
|
Нитрозный газ в т.ч.
|
Нитрозный газ в т.ч.
|
|
NO
|
210,43
|
5,66
|
281,82
|
6,24
|
9,39
|
NO
|
71,55
|
1,96
|
95,82
|
2,12
|
3,19
|
|
|
NO2
|
152,38
|
4,11
|
312,93
|
6,94
|
6,80
|
NO2
|
291,26
|
7,99
|
598,13
|
13,24
|
13,00
|
|
|
O2
|
130,08
|
3,50
|
185,83
|
4,11
|
5,81
|
O2
|
60,64
|
1,66
|
86,63
|
1,92
|
2,71
|
|
|
N2
|
2565,33
|
69,03
|
3206,71
|
71,00
|
114,53
|
N2
|
2565,33
|
70,34
|
3206,67
|
71,00
|
114,52
|
|
|
H2O
|
658,12
|
17,70
|
528,85
|
11,71
|
29,38
|
H2O
|
658,12
|
18,05
|
528,85
|
11,72
|
29,38
|
|
|
ВСЕГО:
|
3716,34
|
100,00
|
4516,14
|
100,00
|
165,91
|
ВСЕГО:
|
3646,90
|
100,00
|
4516,10
|
100,00
|
162,80
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.3.2 Расчеты тепловых балансов процессов
Целью теплового расчета окислителя является определение температуры
нитрозных газов на выходе из окислителя.
Схема тепловых потоков окислителя нитрозных газов.
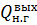
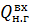
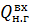
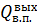
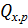
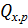
Qт/п
Приход тепла.
В окислитель на стадии утилизации тепла и окисления NO кислородом тепло
вносится нитрозными газами, а также выделяется в результате протекания
экзотермической реакции (1.11.). Тепло уносится нитрозными газами, а также за
счет теплопотерь.
Средние теплоемкости компонентов (Дж/(моль·К)) в интервале температур 0 ¸ t 0C могут быть
рассчитаны согласно следующим уравнениям:
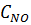
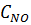 = 29,33 +
0,003855 · (t+273) - 58660 / (t+273)2
= 29,33 +
0,003855 · (t+273) - 58660 / (t+273)2
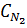
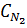 = 27,88 +
0,00427 · (t+273)
= 27,88 +
0,00427 · (t+273)
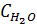
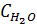 = 30,00 +
0,01071 · (t+273) + 33000 / (t+273)2
= 30,00 +
0,01071 · (t+273) + 33000 / (t+273)2
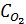
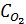 =31,46 +
0,00339(t+273)-377000/(t+273)2
=31,46 +
0,00339(t+273)-377000/(t+273)2

 =43,00 +
0,0085476(t+273)-674590/(t+273)2
=43,00 +
0,0085476(t+273)-674590/(t+273)2
где t - температура потока, 0С.
) Тепло, вносимое нитрозными газами в окислитель:
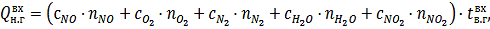
где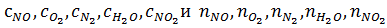
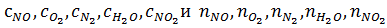 -
теплоемкости (Дж/(моль∙К)) и количества (кмоль/ч) NO, O2, N2, H2O и NО2
на входе в окислитель соответственно;
-
теплоемкости (Дж/(моль∙К)) и количества (кмоль/ч) NO, O2, N2, H2O и NО2
на входе в окислитель соответственно; 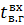
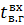 -
температура нитрозного газа на входе в окислитель, °С.
-
температура нитрозного газа на входе в окислитель, °С.
Теплоемкости
компонентов нитрозного газа на входе в окислитель при температуре 250ºС, Дж/(моль∙К) [3].
|
NO
|
NО2
|
N2
|
H2O
|
O2
|
|
31,132
|
45,004
|
30,113
|
35,722
|
31,855
|

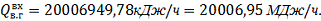
) Тепло, выделяющееся в окислителе, при окислении NO до NO2
кислородом по реакции (1.11.).
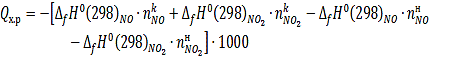
где
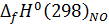
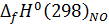 и
и 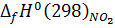
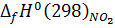 -
изменение стандартной энтальпии при образовании NO и NO2, кДж/моль;
-
изменение стандартной энтальпии при образовании NO и NO2, кДж/моль;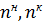
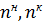 -
начальные и конечные количества вещества, кмоль/ч.
-
начальные и конечные количества вещества, кмоль/ч.
Изменение
стандартной энтальпии при образовании вещества.
|
Вещество
|
NO
|
NO2
|
|
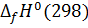 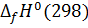 ,кДж/моль91,2634,19 ,кДж/моль91,2634,19
|
|
|
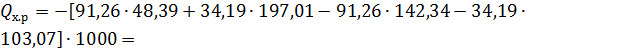
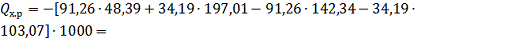
,4
кДж/ч=5362,07МДж/ч.
,39
и 197,01- количества NO и NO2 в нитрозном газе, выходящем из
окислителя, кмоль/ч; 142,34 и 103,07- количество NO и NO2 в
нитрозном газе, поступающем в окислитель, кмоль/ч.
Общий
приход тепла в аппарат составит:
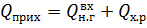
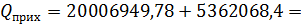
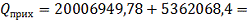 25369018,18
кДж/ч=25369,02МДж/ч.
25369018,18
кДж/ч=25369,02МДж/ч.
Расход
тепла
)
Тепло, уносимое нитрозными газами из окислителя.
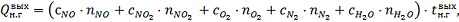
где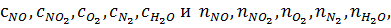
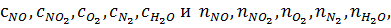 -
теплоемкости (Дж/(моль∙К)) и количества (кмоль/ч) NO, NO2,O2, N2 и
H2O на выходе из окислителя соответственно;
-
теплоемкости (Дж/(моль∙К)) и количества (кмоль/ч) NO, NO2,O2, N2 и
H2O на выходе из окислителя соответственно; 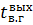
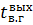 -
температура нитрозного газа на выходе из окислителя, °С.
-
температура нитрозного газа на выходе из окислителя, °С.
Qн.гвых=[(29,33+0,003855(tвых+273) - 58660/ (tвых+273)2) ∙ 48,39 + (43,00+ 0,0085476 (tвых+273) - 674590/ (tвых+273)2)∙197,01+(31,46+0,00339(tвых+273)-377000/ (tвых+273)2) ∙ 41,02+(27,88+0,00427(tвых+273)) ∙ 1735,23 + (30,00 + +0,01071(tвых+273) +33000 /(tвых+273)2) ∙ 445,16] ∙ tвых
Примем,
что теплопотери в окислителе равны 3 %, тогда общий расход тепла составит:
Qрас= [ (29,33 + 0,003855 (tвых+273) - 58660/(tвых+273)2) ∙ 48,39+ (43,00+0,0085476 (tвых+273) - 674590 / (tвых+273)2) ∙ 197,01 + (31,46+0,00339 (tвых+273) - 377000 / (tвых+273)2) ∙ 41,02+ (27,88+0,00427(tвых+273)) ∙ 1735,23 + (30,00+0,01071 (tвых+273)+33000 / (tвых+273)2)∙445,16]∙tвых∙100,00/97,00
В
общем виде уравнение теплового баланса окислителя может быть записано в виде:
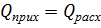


Решая
это уравнение относительно tвых,
определяем, что температура нитрозных газов на выходе из окислителя равна
305°С.
Тогда:
Qн.гвых=[(29,33+0,003855(305+273)
- 58660 / (305+273)2) ∙ 48,39+ (43,00+0,0085476(305+273) -
674590 / (305+273)2) ∙ 197,01 + (31,46+0,00339(305+273) -
377000 / (305+273)2) ∙ 41,02 + (27,88 + 0,00427 (305+273)) ∙
1735,23 + (30,00+0,01071(305+273 )+ 33000 / (305+273)2) ∙
445,16] ∙ 305 = 24607947,63 кДж/ч =24607,95 МДж/ч.
Теплопотери
составляют:
Qт/п =24607947,63∙3,00/97,00 = 761070,54
кДж/ч=761,07 МДж/ч.
Результаты
теплового расчета заносим в таблицу 3.8.
Таблица 3.8. Тепловой баланс окислителя (в расчете на часовую
производительность).
|
ПРИХОД
|
РАСХОД
|
|
Статьи прихода
|
МДж/ч
|
%
|
Статьи расхода
|
МДж/ч
|
%
|
|
1)Тепло, вносимое
нитрозными газами.
|
20006,95
|
78,81
|
1)Тепло, уносимое
нитрозными газами.
|
24607,95
|
97,00
|
|
2)Тепло химической реакции
|
5362,07
|
21,14
|
2)Теплопотери
|
761,07
|
3,00
|
|
ВСЕГО:
|
25369,02
|
100,00
|
ВСЕГО:
|
25369,02
|
100,00
|
Таблица 3.9. Тепловой баланс окислителя (в расчете на 1 т моногидрата
азотной кислоты).
|
ПРИХОД
|
РАСХОД
|
|
Статьи прихода
|
МДж/т
|
%
|
Статьи расхода
|
МДж/т
|
%
|
|
1)Тепло, вносимое
нитрозными газами.
|
1320,40
|
78,81
|
1)Тепло, уносимое
нитрозными газами.
|
1624,11
|
97,00
|
|
2)Тепло химической реакции
|
353,89
|
21,14
|
2)Теплопотери
|
50,23
|
3,00
|
|
ВСЕГО:
|
1674,29
|
100,00
|
ВСЕГО:
|
1674,34
|
100,00
|
.3.3 Конструктивный расчет окислителя
Средняя температура нитрозного газа в окислителе:
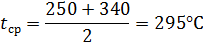
Секундный расход газа в рабочих условиях:
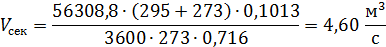
где 56308,8- расход нитрозного газа на входе в окислитель, нм3/ч;
295- средняя температура нитрозного газа в окислителе, °С; 0,716- рабочее
давление нитрозного газа в окислителе, МПа.
Как было установлено Боденштейном, окисление оксида азота протекает по
уравнению третьего порядка. Дифференциальное уравнение скорости окисления
оксида азота кислородом имеет следующий вид:
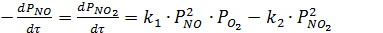
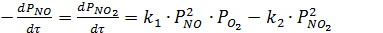 (1.15)
(1.15)
где
k1, k2- константы скорости прямой и обратной реакций, МПа-2∙с-1;
-
 парциальные
давления компонентов, МПа.
парциальные
давления компонентов, МПа.
Когда
окисление оксида азота протекает практически необратимо (что вполне правомерно
до температур примерно 300 °С), диссоциацией диоксида азота можно пренебречь. В
этом случае уравнение скорости окисления оксида азота примет следующий вид:
а-
начальная концентрация NО, мол. доли; начальная концентрация О2, мол. доли;
α- степень окисления NО, д.е.;
Робщ-
общее давление газа, МПа.
Отсюда
получим:
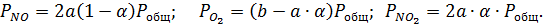
После
подстановки этих значений в уравнение (1.16.) оно примет следующий вид:
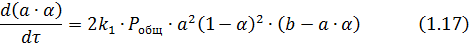
Приняв
2 k1= k , имеем:
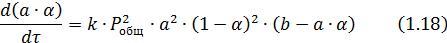
После
интегрирования получим:
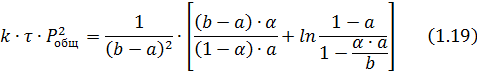
Обозначая
через γ
отношение концентрации кислорода к
половине концентрации оксида азота (γ = b/а) и подставляя в уравнение (1.19.) значение b=а∙γ, получим:
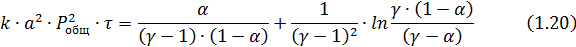
где
k- константа скорости реакции окисления NO в NO2, МПа-2∙с-1;
a- половина начальной концентрации NО, мол. доли;Pобщ - общее давление в системе, МПа; τ- время пребывания газа в окислительном объеме, с; α- степень окисления NО в NO2, д. е.; γ= b/а; b- начальная концентрация О2, мол. доли.
Выше
300 °С константа скорости стремится к постоянному значению (табл. 3.10.).
Таблица
3.10. Константы скорости окисления NO в NО2 кислородом при различных
температурах.
|
Температура, °С
|
k, (МПа-2∙с-1)
|
|
0 30 60 100 140 200 240 300
340 390
|
6753,64 4170,93 2845,10
1869,51 1313,12 846,10 663,46 496,58 422,35 355,03
|
Расчет времени пребывания газа в окислителе с целью достижения степени
окисления NO равной 66 %. Условия: начальная
концентрация NО 5,66 % об., начальная концентрация О2 3,50 % об.,
общее давление газа 0,716 МПа, средняя температура нитрозного газа 295°С.
Константа скорости реакции окисления NO в NO2 k при средней темпера- туре
газа в окислителе равной 295°С составляет 488,30 МПа-2∙с-1
(табл.3.10.). Подставляя значения k (МПа-2∙с-1), а
= 0,0283 мол. доли, P (МПа), , b = 0,035 мол. доли, γ= b/а = 0,035 / 0,0283 = 1,24 д.е. в
уравнение (1.20.), получаем:
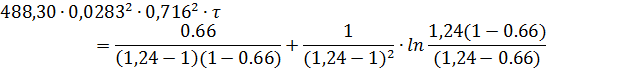
Из этого уравнения определяем = 12,8 с.
Объем окислителя:
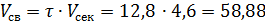
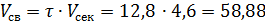 м3
м3
где
Vсек - секундный расход газа в рабочих условиях, м3/с,
τ - время пребывания газа в окислительном объеме окислителя.
Согласно
регламентным данным, температура нитрозного газа, выходящего из
котла-утилизатора, составляет 200-300°С. Рассмотрим, каким образом она будет
оказывать влияние на равновесную и практическую степень окисления NO в NO2. Расчетные данные представлены ниже на рис. 3.1.
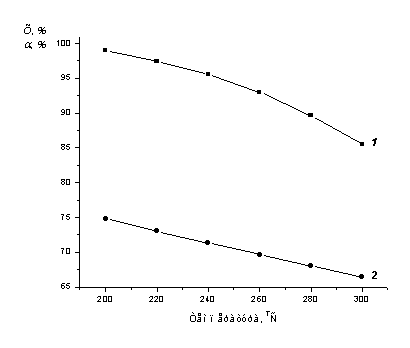
Рис 3.1. Зависимость равновесной и практической степени окисления от
температуры.
Согласно рис 3.1, повышение температуры с 200 до 300°С приводит к
уменьшению как равновесной степени окисления NO в NO2 с 99 до 85,49%, так и практической с
74,77 до 66,43%. Поэтому проводить данный процесс лучше при более низких
температурах.
4.
Аналитический контроль производства
Таблица 4. Методы аналитического контроля технологического процесса
|
№ п/п
|
Место отбора пробы
|
Контролируемый параметр
|
Регламентируемое значение
параметра
|
Метод химического анализа
|
|
1
|
2
|
3
|
4
|
5
|
|
1
|
Нитрозные газы после
катализаторных сеток контактного аппарата и после котла
|
Процент контактирования
|
не менее 93,5 %
|
Титриметрический метод
|
|
2
|
Аммиак под сетками
контактного аппарата
|
Объемная доля аммиака
|
не более 0,03 %
|
Фотоколориметрический метод
|
|
3
|
Аммиачно-воздушная смесь
над катализаторными сетками контактного аппарата
|
Объемная доля аммиака
|
9,5-10,6 %
|
Титриметрический метод
|
|
4
|
Паровой конденсат из
испарителя На трубопроводе
|
Массовая доля аммиака
|
отсутствие
|
Фотоколориметрический метод
|
|
5
|
Очищенные хвостовые газы
после реактора каталитической очистки. На трубопроводе.
|
Объемная доля СО
|
не более 0,01 %
|
Хроматографический метод
|
|
6
|
Котловая вода котлов. На
трубопроводе.
|
Солесодержание
|
не более 1500 мг/кг чувств.
0,2 мг/кг
|
Кондуктометрический метод
|
|
7
|
Паровой конденсат
котлов-утилизаторов На трубопроводе.
|
Солесодержание
|
не более 0,5 мг/кг чувств.
0,2 мг/кг
|
Кондуктометрический метод
|
|
8
|
Газообразный аммиак после
фильтра
|
Массовая концентрация масла
|
не более 0,5 мг/м3
чувств. 0,2 мг/м3
|
Спектрофотометрический
метод
|
|
|
Массовая концентрация
железа
|
не более 0,2 мг/м3
чувств. 0,005мг/м3
|
Фотоколориметрический метод
|
|
9
|
Паровой конденсат после
подогревателя газообразного аммиака На трубопроводе.
|
Массовая концентрация
аммиака
|
отсутствие
|
Фотоколориметрический метод
|
|
10
|
Жидкий аммиак на входе в
отделение.
|
Массовая доля аммиака
|
не менее 99,6 %
|
ГОСТ 28326-89
|
|
|
Массовая доля воды
|
не более 0,04 %
|
ГОСТ 28326-89
|
|
|
Массовая концентрация масла
|
не более 2,0 мг/дм3
|
Спектральный метод
|
|
|
Массовая концентрация
железа
|
не более 1 мг/дм3
|
Колориметрический метод.
|
|
11
|
Азотная кислота из хранилищ
|
Массовая доля азотной
кислоты
|
не менее 57 %
|
По плотности и температуре
|
|
12
|
Ап. Очищенные хвостовые
газы.
|
Массовая доля NОx
|
не более 0,005 %
|
Фотоколориметрический метод
|
|
|
Массовая доля NH3
|
не более 0,005 %
|
Фотоколориметрический метод
|
|
|
Массовая доля СО
|
не более 0,02 %
|
Хроматографический метод
|
Титриметрический
метод - метод количественного анализа, основанный на измерении объема раствора
реактива
<http://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5_%D1%80%D0%B5%D0%B0%D0%BA%D1%82%D0%B8%D0%B2%D1%8B>
известной концентрации, расходуемого для реакции с определяемым веществом.
Хроматографический
метод - метод основанный на измерении различных параметров хроматографического
пика, зависящих от концентрации хроматографируемых веществ - высоты, ширины,
площади и удерживаемого объема или произведения удерживаемого объема на высоту
пика.
Кондуктометрический
метод - метод, основанный на измерении электропроводности анализируемого
раствора.
Спектрофотометрический
метод - метод, основанный на измерении массовой концентрации масла по
интенсивности поглощения метиленовых групп в инфракрасном спектре.
Фотоколориметрический
метод - метод, основанный на измерении оптической плотности окрашенных в желтый
цвет растворов, содержащих комплексные соединения, которые образуются при
взаимодействии ионов двух-, трехвалентного железа с сульфосалициловой кислотой
в аммиачной среде.
Спектральный
метод - физический метод качественного и количественного определения атомного и
молекулярного состава вещества, основанный на исследовании его спектров.
Колориметрический
метод - метод химического анализа
<http://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B0%D0%BB%D0%B8%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%85%D0%B8%D0%BC%D0%B8%D1%8F>,
основанный на определении концентрации
<http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BD%D1%86%D0%B5%D0%BD%D1%82%D1%80%D0%B0%D1%86%D0%B8%D1%8F>
вещества по интенсивности окраски растворов (более точно - по поглощению света
<http://ru.wikipedia.org/w/index.php?title=%D0%AD%D0%BA%D1%81%D1%82%D0%B8%D0%BD%D0%BA%D1%86%D0%B8%D1%8F&action=edit&redlink=1>
растворами <http://ru.wikipedia.org/wiki/%D0%A0%D0%B0%D1%81%D1%82%D0%B2%D0%BE%D1%80>).
5. Автоматизация технологического процесса.
Таблица 5. Системы автоматического контроля и регулирования
технологического процесса
|
№ п/п
|
Контролируемый параметр
|
Значение параметра согласно
НТР
|
Способ регулирования
|
Датчик
|
Регулирующий орган
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
1. Котел-утилизатор
Перегретый пар
|
Давление
|
Не более 1,47 МПа (15,0
кгс/см2)
|
Показания и регистрация на
ЦПУ
|
Преобразователь
измерительный Сапфир 22ДИ Шк. 0-25 кгс/см2 Кл.т 0,5
|
-
|
|
2. Контактный Аппарат (под
сетками)
|
Температура
|
(860,0-910,0)
ºС (950,0 ± 12,3)
ºС (950,0 ± 12,3) ºС
|
Показания и регистрация на
ЦПУ, запись в рапорте 1 раз в час Сигнализация -макс. Блокировка (АТБ) -макс.
|
Термопара ТХА гр. ХА(К)
Шк. 0-1100 ºС, кл. доп.2
|
-
|
|
3. Стенки контактного
аппарата, нижняя часть
|
Температура
|
(360,0
± 4,9) ºС
|
Показания на щите КИПиА в
машзале, запись 2 раза в смену Сигнализация -макс.
|
Термоэлектрический
преобразователь КТХК (L), кл. допуска 2, Шкала 0-600 ºС Термометр многоканальный ТМ 5131, кл.т. 0,5,
шкала 0-600 ºС
|
-
|
|
4. Нитрозные Газы Котел
-420БПЭ
|
Температура
|
(310,0-380,0)
ºС
|
Показания и регистрация на
ЦПУ, запись в рапорте 1 раз в час
|
Термопара ТХК Гр. ХК (L)
Шк. 0-400 ºС, кл. доп. 2
|
-
|
|
5. Подогреватель хвостовых
газов ПХГ-1 нитрозные газы на входе
|
Температура
|
(240,0-280,0)
ºС
|
Показания и регистрация на
ЦПУ, запись в рапорте 1 раз в час
|
Термопара ТХА 9312 гр. ХА
(К) Шк.
0-600 ºС
|
-
|
|
6. Трубопровод питательной
воды на котлы-утилизаторы Г-420БПЭ
|
Расход Расход
|
Не более 10,3 м3/ч
Не более 28,6 м3/ч
|
Показания и регистрация на
ЦПУ, запись в рапорте 1 раз в час Показания и регистрация на ЦПУ, запись в
рапорте 1 раз в час
|
Диафрагма ДКС 25-50-II-А/Б-3
Дифманометр ДС-П4 Кл.т. 1,0 Шк. 0-0,4 кгс/см2 Диафрагма ДКС
25-80-II-А/Б-2 Преобразователь измерительный
|
- -
|
|
|
|
|
|
|
|
|
|
|
5.
Охрана труда и окружающей среды
В производстве слабой азотной кислоты под абсолютным давлением 0,716 МПа
(7,3 кгс/см2) имеется постоянный технологический выброс хвостовых
газов, прошедших селективную каталитическую очистку. Хвостовые газы
выбрасываются через выхлопную трубу высотой 150 м.
Имеется весьма незначительные вентиляционные выбросы от насосной склада
азотной кислоты и периодический выброс из установки регенерации платиновых
сеток.
Оборудование отделения конверсии и абсорбции расположено на открытых
площадках. Вредные вещества в вентиляционных выбросах машинного зала отделения
компрессии отсутствуют.
В производстве неконцентрированной азотной кислоты при нормальной работе
цеха химически грязные технологические стоки отсутствуют. Могут иметь место
аварийные проливы азотной кислоты через не плотности фланцевых и сварных
соединений на трубопроводах и аппаратах. Для ликвидации этих проливов, а также
для сброса смывных вод предусмотрен ряд мероприятий.
На складе азотной кислоты для сброса пролитой кислоты в поддоне
предусмотрен прямоток, откуда насосом кислота откачивается в одно из хранилищ.
При массовой концентрации азота нитратного менее 300 мг/дм3 и азота
аммония менее 25 мг/дм3 сточные воды направляются в химически
грязную канализацию.
В насосной склада кислоты азотная кислота через дренажные коллектора
поступает в дренажный бак, откуда погружным насосом передается в хранилища
склада. Освобождение коллекторов азотной кислоты производится при сдаче их в
ремонт.
Аварийные проливы азотной кислоты и смывные воды (при промывке полов)
собираются в металлические поддоны из нержавеющей стали и дренируются в
дренажный бак, из которого кислота или стоки погружным насосом откачивается в
хранилище азотной кислоты.
Периодически (при смыве полов или в случае аварийных проливов азотной
кислоты отделения абсорбции смывные воды собираются в дренажном канале,
разбавляются в нем до массовой концентрации азота нитратного не более 50 мг/дм3
и азота аммонийного не более 10 мг/дм3 и через пробковые затворы направляются
в химически грязную канализацию.
Таблица 6.1 Оценка степени опасности технологического процесса.
|
Наименование участка
|
Производительность
|
Технологические параметры
|
Перечень токсичных,
взрывопожароопасных веществ
|
Вредные и опасные факторы
|
Средства индивидуальной
защиты работающих
|
|
Охлаждение нитрозного газа
с одновременным окислением
|
120 тыс. т/год
|
Окислитель: tн.гвх =
250°С tн.гвых = 305°С Подогреватель воздуха: tн.г = 185-195°С Подогреватель хвостовых газов: tн.г = 155-185°С tх.г = 100-145°С
|
Оксид азота, диоксид азота,
оксид углерода, аммиак
|
Шум и вибрации
|
При работе с аммиаком
необходимо использовать фильтрующие противогазы марок «К», «КД» или «М»,
перчатки и резиновые сапоги. При работе в атмосфере азота, больших
концентраций газов или недостатке кислорода использовать только изолирующие
противогазы.
|
Таблица 6.2 Характеристика токсичности вредных веществ на производстве
|
Название вещества
|
Класс опасности
|
ПДКрз, мг/м3
|
ПДКмр, мг/м3
|
Токсикологическая
характеристика
|
|
Оксид азота
|
III
|
5
|
0,4
|
Оксид азота - кровяной яд ,
переводит оксигемоглобин в метгемоглобин.
|
|
Диоксид азота
|
II
|
2
|
0,085
|
Диоксид азота обладает
выраженным раздражающим действием на дыхательные пути, что может привести к
тяжелым случаям отека легких. Диоксид азота обладает и общетоксическим
действием.
|
|
Оксид углерода
|
IV
|
20
|
5,00
|
Оксид углерода по типу
своего патофизиологического действия- кровяной яд, который, взаимодействуя с
гемоглобином, превращает его в карбоксигемоглобин, вызывая гемический тип
гипоксии.
|
|
Аммиак
|
IV
|
20
|
0,2
|
Вызывает острое раздражение
слизистых оболочек, слезотечение, удушье. Порог восприятия обонянием 35 мг/м3.
Концентрация 350-700 мг/м3 опасна для жизни
|
Список использованных источников информации
1.
Производство азотной кислоты в агрегатах большой единичной мощности/Под ред.
В.М. Олевского. - М.: Химия, 1985. - 400 с., ил.
. Справочник
азотчитка. / Под. ред. Е.Я. Мельникова. 2-ое изд. перераб. - М.: Химия 1986. -
512 с.
. Краткий
справочник физико-химических величин. Изд. 8-е, перераб./ Под ред. А.А. Равделя
и А.М. Пономаревой: - Л.: Химия, 1983. - 232 с., ил.
. Атрощенко
В.И., Каркин С.И., Технология азотной кислоты. Издание 3-е, переработанное и
дополненное.
. Павлов
К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и
аппаратов химической технологии: Учебное пособие для вузов под ред. чл. - корр.
АН России П.Г. Романкова. - 12-е изд., стереотипное. Перепечатка с издания 1987
г. М.: ООО ТИД «Альянс», 2005. - 576 с.