Иммунология злокачественных новообразований
ГОУ ВПО
МОСКОВСКИЙ МЕДИКО-СТОМАТОЛОГИЧЕСКИЙ
УНИВЕРСИТЕТ
РОСЗДРАВА
Лечебный
факультет
Иммунология
и иммунотропная терапия злокачественных опухолей(проект)
КОНТРОЛЬНАЯ
РАБОТА
ПО
ТЕМЕ: ИММУНОЛОГИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Москва 2012
г.
СПИСОК СОКРАЩЕНИЙ
CD- кластер дифференцировки.CSF- гранулоцитарный
колониестимулирующий фактор.CSF - гранулоцитарно-макрофагальный
колониестимулирующий фактор.DR- второй класс главного комплекса
гистосовместимости.- интерферон(ы).- иммуноглобулин(ы).- иммуноглобулин А.-
иммуноглобулин Д.- иммуноглобулин Е.- иммуноглобулин G.- иммуноглобулин М., Th2
- соответственно Т-хелперы 1 и 2.- фактор некроза опухоли (ФНО).
СТОА - специфические трансплантационные
опухолевые антигены.
ОСА - опухолеспецифические антигены.
ХГ- Хорионический гонадотропин человека.
АФП -альфа-фетопротеин.
РЭА - раково-эмбриональные антигены.
ПСА- простата специфичный антиген.тканевой
полипептидный антиген.
ВВЕДЕНИЕ
Понятие «биотерапия» опухолей.
В настоящее время в эксперименте и клинике
активно изучается четвертый подход для лечения злокачественных опухолей,
которая, как следует из литературы, будет являться эффективным приложением к
существующим трем способам лечения: хирургическому лечению, лучевой терапии и
лекарственной терапии. Это направление терапии опухолевых заболеваний получило
название биотерапия, в рамках которой предусматривают не столько прямое
цитотоксическое действие на опухолевые клетки, сколько возможность воздействия
на компоненты противоопухолевой системы с целью снятия «эффекта ускользания», а
также блокирование различных этапов развития опухоли, служащие для
предупреждения развития метастазов и вторичных опухолей.
Биотерапия опухолей включает в себя приемы
генной терапии, вакцинотерапии, иммунотерапии, гемотерапии, эндокринотерапии.
Многие ведущие специалисты у нас в стране и за рубежом справедливо полагают,
что биотерапия будет одним из основных элементов в программах лечения
злокачественных новообразований в XXI веке.
В рамках данного направления разрабатывают
препараты для иммунотропной терапии, гемостимулирующей терапии, гормонотерапии,
антиангиогенные и антиметастатические средства, антиоксиданты, а также
препараты направленные на преодоление «ускользания» опухоли от иммунной
системы, или «escape» механизма.
ИММУНОЛОГИЯ ЗЛОКАЧЕСТВЕННЫХ
НОВООБРАЗОВАНИЙ
Попытки иммунизации против рака неоднократно
предпринимались со времен Эрлиха, однако незнание законов трансплантации тканей
до начала 1950-х гг. обесценивало эти попытки. Более успешными были начальные исследования
по антигенной специфичности опухолевых антигенов, проводимые в 1930-е гг. в
Польше и Германии, но они были прерваны второй мировой войной.
Начало современному этапу в иммунологии рака
было положено работами I. Gross середины 1940-х гг., получившего иммунный ответ
по отношению к канцерогенной саркоме мышей, индуцированной в сингенной системе,
а также Л.А. Зильбера у нас в стране и T. Gorer в Англии, обнаруживших в
опухолях антигены, отсутствующие в гомологичных нормальных тканях (конец 40-х -
начало 50-х гг.), то есть опухолеспецифические антигены (ОСА). Значительную
роль сыграли исследования группы G. Klein в 1961г., впервые показавшие
эффективный иммунный ответ против опухолей, вызванных вирусами полиомы и SV40,
у животных, иммунизированных этими вирусами. Эти исследования дали мощный
начальный стимул для современного этапа иммунологии рака. Давняя уверенность в
существовании иммунной защиты против злокачественного опухолевого роста
первоначально основывалась на представлениях об опухолях как о чужеродном для
организма новообразовании, источнике биологической агрессии изнутри.
В конце 60-х гг. P. Burnet сформулировал
концепцию иммунологического надзора организма над возникновением опухолей.
Созданию этой концепции предшествовали два важных обстоятельства: выяснение
роли Т-лимфоцитов в реакциях трансплантационного иммунитета и обнаружение
специфических трансплантационных опухолевых антигенов (СТОА) во многих типах
экспериментальных опухолей.. Burnet высказал предположение о том, что в
организме постоянно появляются мутантные клетки, обладающие потенциями
опухолевого роста. Однако, подавляющее большинство из них распознается как
чужое и элиминируется еще до формирования опухоли. Распознавание таких клеток
осуществляется Т-лимфоцитами и обусловлено антигенными отличиями опухолевых
клеток от нормальных клеток хозяина. Из концепции следовало, что рост антигенно
чужеродных опухолей должен приводить к развитию специфического Т-клеточного
противоопухолевого иммунного ответа, а иммуносупрессия (например, с помощью
тимэктомии) должна была бы приводить к увеличению частоты возникновения
опухолей.
Однако в дальнейшем оказалось, что частота
возникновения спонтанных опухолей у бестимусных мышей примерно также низка, как
и у мышей тех же линий с нормально функционирующим тимусом. Кроме того, у
пациентов, подвергавшихся иммуносупрессии, не возникали опухоли, относящиеся к
наиболее распространенным у человека нозологическим формам рака (рак легкого,
желудка и толстого кишечника, молочной железы). Постепенно стало ясно, что
Т-клеточная система иммунитета крайне важна для защиты против
вирус-индуцированных опухолей и опухолей, содержащих специфические опухолевые
антигены (СОА). Однако, её роль в контроле возникновения и роста спонтанных
опухолей животных не получила подтверждения (теория G.Klein), как не получила
подтверждения гипотеза о стимулирующем рост опухоли действии Т-лимфоцитов
(теория Р.Prehn,1972 г.). Постулаты противоопухолевого иммунитета тогда были
разработаны с учетом достижений инфекционной и трансплантационной иммунологии,
в соответствии с которыми отторжение опухоли рассматривалось исследователями
как адекватная реакция иммунной системы, а прогрессирование онкологического
заболевания - как проявление иммунодефицита. В настоящее время трактовка
опухолевой прогрессии как следствия иммунодефицита представляется упрощенной.
Если при генерализации онкологического
заболевания дисфункция иммунитета действительно имеет место, то на более ранних
стадиях роста опухоли иммунная система организма-хозяина сохраняет свою компетентность.
Факты свидетельствуют о том, что иммунная
система часто не только не отторгает растущую опухоль, но и активно помогает
опухолевой прогрессии. С другой стороны, раковые клетки в процессе своего
развития приобретают ряд признаков, характерных в норме для клеток иммунной
системы: способность к избирательной миграции в ткани, адгезивность и
инвазивность. На трансформированных клетках экспрессируются рецепторы,
свойственные клеткам иммунной системы. Нередко опухолевая прогрессия
сопровождается развитием аутоиммунных реакций. Это отмечается при
паранеопластических артритах, синдроме Шегрена, дерматомиозите и системной
склеродермии.
Все вышеназванное служит основанием для
коррекции наших представлений о взаимодействии между опухолью и иммунной системой.
Это взаимодействие не всегда является абсолютным антагонизмом.
Генетически лабильная злокачественная опухолевая
клетка в процессе опухолевой прогрессии также развивает различные механизмы
защиты и отбирается в организме по признакам, позволяющим ей выжить in vivo во
враждебном клеточном окружении.C.A. и Trovers P. показали, что варианты
опухолевых клеток отбираются в организме прежде всего по множеству связанных с
выживаемостью in vivo свойств,в том числе, по важнейшему свойству опухолевых
клеток - их собственной иммунодепрессивной способности. Она осуществляется
путем защиты самой себя от эффекторных механизмов системы врожденного
иммунитета хозяина, распознающих чужое с помощью макрофагов, нейтрофилов и
натуральных киллеров (NK), путем секреции факторов, которые подавляют иммунный
ответ. Такие опухолевые клетки не экспрессируют антигены тканевой совместимости
МНС 1 класса, необходимые для распознавания их цитотоксическими CD8 +
Т-лимфоцитами. Известный феномен «ускользания» («escape») состоит в постоянной
мутации опухолевых антигенов, когда в результате отбора сохраняются только те
опухолевые клетки, которые способны меняться постоянно и с большой скоростью.
Кроме того, J. Bradley и J. McClaskey, к феномену «ускользания» относят:
маскировку опухолевых антигенов избытком антител
или иммунных комплексов,
снижение или полную блокаду рецепторов Т
киллеров антителами к противоопухолевым антигенам,
снижение «уровня презентации» опухолевых
антигенов макрофагами, приводящее к угнетению продукции противоопухолевых
цитокинов (ФНО, интерфероны и т.д.) макрофагами.
Еще в 50-е годы был описан феномен усиления
опухолевого роста («enhancing»), который состоит в защите антителами хозяина
опухолевых клеток от действия иммунных Т-лимфоцитов. В результате такого отбора
выжившие варианты опухолевых клеток, как правило, более резистентны к
цитотоксическому действию активированных макрофагов, NK-клеток и Т-лимфоцитов.
Опухолевые клетки приобретают селективные преимущества in vivo, развивая и
используя для своей защиты против этих эффектов вполне адекватные и
специфические механизмы (например, усиленный катаболизм перекиси водорода в
ответ на его продукцию активированными макрофагами и нейтрофилами, а также
выброс иммуносупрессора ПГЕ2 при контакте с NK-клетками и макрофагами).
Кроме того, в последние годы показано, что
опухолевые клетки могут продуцировать специальные ганглиозиды GM1,GM2, GM3 и
GD3,способные блокировать сигнал проведения от ИЛ-2 и Ил-4 на Т клетках.
Экзогенные ганглиозиды действуют на лимфоциты двумя способами: как сорбируясь
на поверхности клеток, так и встраиваясь в клеточную мембрану. При этом
супрессия цитотоксического звена иммунитета при развитии опухолевого процесса
может развиваться как в результате перехвата опухолевыми ганглиозидами
цитокинов (и, тем самым, уменьшения их эффективной концентрации), так и путем
прямой индукции смерти цитотоксических Т-лимфоцитов(9).
Одним из механизмов самозащиты опухолей является
выраженная тканевая гипоксия внутри солидной опухоли.Это приводит к
значительному накоплению аденозина и ингибиции цитотоксичности Т лимфоцитов
через А2А аденозиновый рецептор.
Приведенные примеры не исчерпывают все
возможности опухолевых клеток для защиты против эффекторных систем организма и
для выживания in vivo, но позволяют лучше понять, в чем состоят биологические
отличия злокачественной опухолевой клетки от трансформированной. В процессе
отбора и прогрессии in vivo, трансформированные клетки перестают быть
пассивными мишенями для эффекторов систем защиты организма и отбираются in
vivo, в том числе и, по-видимому, в первую очередь, по способности к активной
локальной защите. Приобретенная опухолевыми клетками в процессе такого отбора
резистентность к эффекторам естественного противоопухолевого иммунитета
определяет их лучшую выживаемость in vivo и соответственно более высокий
уровень туморогенности.
Высказывается также предположение, что рак -
скорее результат хромосомных нарушений, чем горстки генных мутаций. Однако
именно мутационная теория является сегодня доминирующей. Эта идея привела его к
предположению, что раковые опухоли фактически обладают новыми хромосомными
кариотипами, что позволяет рассматривать их как самостоятельные виды, близкие к
паразитам и кардинально отличающиеся от своего хозяина - организма человека.
Новый взгляд на природу рака может привести к
новому пониманию процесса его роста и метастазирования и, возможно, к новым
подходам к лечению или новым мишеням для лекарственных препаратов. Кроме того,
так как поврежденные хромосомы вновь развившихся опухолей видны под микроскопом,
опухоль можно раньше диагностировать. Очень похожая процедура - мазок
Папаниколау - используется сегодня при подозрении на рак шейки матки.
Диагностика в этом случае основывается на изменениях формы цервикальных клеток
как на признаке имеющихся проблем с хромосомами.
Эти данные обнаруживают наличие важной для
иммунотерапии опухолей связи (обратной зависимости) между уровнем
злокачественности опухолевых клеток и возможностями иммунологического контроля
их роста in vivo.
Открытие в 60-70-е гг. цитотоксической
активности активированных макрофагов, а позднее естественных киллеров
(NK-клеток), идентификация последних как больших и средних гранулярных
лимфоцитов, отличающихся от T-лимфоцитов по морфологии и экспрессии некоторых
мембранных рецепторов, привлекли внимание многих исследователей к механизмам
иммунной защиты организма против опухоли.
К концу 70-х годов возникло представление о том,
что весьма существенную (и до настоящего времени недооцененную) роль в защите
организма против опухоли играет система врожденного естественного иммунитета.
Таким образом, теперь уже столетняя история
попыток создания клеточных, антигенных, вирусных и рекомбинированных вакцин
против рака с их, как правило, временным и частичным успехом, равно как и более
успешный, почти 50-летний опыт химио- и лучевой терапии новообразований
человека свидетельствует о том, что камнем преткновения при этих воздействиях
является биология злокачественной опухолевой клетки. Приобретаемая in vivo
злокачественными вариантами опухолевых клеток резистентность к макрофагам,
NK-клетками и Т-лимфоцитами, а также резистентность к химио- и лучевой терапии
во всех случаях имеет разные механизмы, но как явление, обусловленное отбором,
имеет общую биологическую природу.
ОНКОМАРКЕРЫ
На протяжении последних десятилетий
использование биохимических (клинико-химических по зарубежной терминологии)
лабораторных тестов в онкологической практике экспоненциально увеличивалось, и
этот рост продолжается в настоящее время. Новые технологические достижения на
каждом этапе приводили к замене старых лабораторных методик на более
совершенные, более точные и чувствительные. Созданы дополнительные тесты,
позволяющие диагностировать физическое присутствие опухоли, системные
проявления злокачественного новообразования, паранеопластические синдромы, а
также определять маркеры опухолей.
Для ранней диагностики первичной опухоли и ее
метастазов, а также мониторинга лучевой и химиотерапии, по мнению большинства
онкологов, определение онкомаркеров (веществ белковой природы, присутствующих в
биологических жидкостях организма при опухолях) является наиболее приемлемым
методом.
Как известно, онкомаркер позволяет
дифференцировать злокачественную опухоль от доброкачественной на основе
количественных отличий в содержании соответствующего антигена - опухолевого
маркёра в сыворотке крови вне зависимости от локализации опухолевого очага.
Опухолевая клетка способна выделять 1 пикограмм (10-12 г) онкомаркера в кровь 1
мг антигена, что в пересчете на концентрацию составляет около 200 нг/мл. Методы
тестирования, зачастую превосходят по своей чувствительности эту концентрацию.
Таким образом, повышенный уровень маркёров обнаруживается уже при малых
размерах опухоли.
Многолетний опыт использования этих
чувствительных и высокоспецифичных тестов в медицинской практике показал, что
внедрение онкомаркеров в практику значительно повышает эффективность работы
онколога.
Однако пока не удалось разработать ни одного
строго опухолеспецифичного серологического диагностикума, способного
детектировать только злокачественную опухоль данного гистологического типа и
обнаружить её локализацию на возможно более ранних этапах формирования. В
некоторой степени можно повысить эффективность диагностики используя сочетание
нескольких онкомаркеров в процессе тестирования.
В крови больного с не онкологической патологией
уровень онкомаркеров, как правило, не превышает нормальных значений
концентрации. Вместе с тем, при таких патологических состояниях, как
воспалительные заболевания печени, поджелудочной железы, легких и т.д. иногда встречается
неспецифическое, чаще незначительное, повышение уровня онкомаркеров
определенного типа.
Краткая характеристика некоторых опухолевых
маркёров
|
Онкомаркер
|
Краткая
характеристика
|
Рекомендованная
область применения
|
|
Бета-2-микроглобулин
(в моче и сыворотке)
|
Белок
бета-2-микроглобулин идентичен легкой цепи антигенов HLA (свободный и
связанный) в норме выявляется в биологических жидкостях лишь в незначительных
количествах.
|
Рекомендуется
использовать для подтверждения диагноза и мониторинга пациентов с множественной
миеломой, неходжкинскими лимфомами. Увеличение концентрации маркера зависит
от стадии заболевания, степени злокачественности, и типа клеток. Мониторинг
после трансплантации органов.
|
|
Хорионический
гонадотропин (ХГЧ)
|
ХГЧ-гормон
в норме синтезируется в синцитиотрофобласте плаценты.
|
У
мужчин и небеременных женщин повышение концентрации ХГ является достоверным
признаком злокачественного роста. Определение ХГ рекомендуется применять для
диагностики, мониторинга эффективности терапии и раннего выявления рецидивов
трофобластических опухолей, хорионкарциномы яичника или плаценты,
хорионаденом, семином. Наибольшую чувствительность про-являет по отношению к
карциноме яичника или плаценты.
|
|
Альфа-фетопротеин
(АФП)
|
Эмбриоспецифичный
гликопротеин (до 4% углеводов), по составу аминокислот сходен с альбумином.
При беременности вырабатывается клетками желточного мешка, позднее печенью
эмбриона, а также клетками ЖКТ плода.
|
Рекомендуется
для выявления и мониторинга течения и эффективности терапии первичной гепато-целлюлярной
карциномы, гермином, выявления пороков развития плода и мониторинга состояния
плода в течение беременности. Повышенный уровень АФП наблюдается при
тератокарциномах желточного мешка яичника или яичек.
|
|
Раковоэмбриональный
антиген (РЭА)
|
Гликопротеин
с высоким содержанием углеводов, вырабатывается в тканях пищеварительного
тракта эмбриона и плода. После рождения плода его синтез подавляется и
практически не выявляется ни в крови, ни в других биологических жидкостях
взрослого здорового человека.
|
Повышение
концентрации РЭА наблюдается при различных карциномах пищеварительного
тракта, а также при раке легких, молочной железы, головы и шеи,
злокачественных новообразованиях соединительнотканного происхождения. При
развитии опухолей различной локализации уровень РЭА повышается и достаточно
точно отражает состояние злокачест-венного процесса.
|
|
СА
125
|
Гликопротеин,
вырабатываемый клетками серозных злокачественных опухолей яичников.
|
Маркер
мониторинга течения и эффективности терапии при различных типах рака яичников
(серозные, эндометриальные, светлоклеточные), Тест позволяет выявить рецидив
заболевания за 3-4 месяца до его клинического проявления.
|
|
СА
15-3
|
Муциноподобный
гликопротеин.
|
|
СА19-9
|
Гликопротеин,
вырабатываемый зпителием ЖКТ плода, незначительные концентрации обнаруживают
в слизистых клетках взрослых людей, а также в поджелудочной железе, печени и
легких.
|
Применяют
для диагностики и мониторинга лечения, а также раннего обнаружения рака
поджелудочной железы, желудка, толстого кишечника, и прямой кишки.
|
|
Простата
специфичный антиген (ПСА)
|
ПСА-гликопротеин,
секретируемый клетками эпителия канальцев предстательной железы
|
Является
наиболее чувствительным и специфичным маркером. Применяется для диагностики и
мониторинга лечения рака предстательной железы.
|
|
TPA
cyk (цитокератин)
|
Является
циркулирующим комплексом фрагментов цитокератинов -8 и -18, попадает в кровь
в процессе некроза опухолевых клеток, а также в S,G2 и митотической фазах
нормального клеточного цикла, поэтому концентрация его в сыворотке отражает
скорость возобновления клеток.
|
Используется
для дифференциации стабильной и прогрессирующей стадий заболевания, а также
для прогнозирования и наблюдения за ходом болезни в процессе лечения
пациентов с эпителиально-клеточной карциномой.
|
|
UBC
11 (цитокератин)
|
Маркер
рака мочевого пузыря.
|
Чувствительный
индикатор пролиферации опухолевых клеток в мочевом пузыре, может быть
использован для оценки прогноза, мониторинга и контроля лечения
|
|
TPS
|
Тканевой
полипептид, цитокератин 18.
|
Уровень
TPS определяется у пациентов с эпителиально-клеточными карциномами, например,
раком груди, простаты, яичников и гастроинтестинальной карциномой. Особенно в
высоких концентрациях детектируется у пациентов с быстрым метастазированием.
Прогностическое значение имеет уровень до операции, высокий уровень после
химиотерапии коррелирует с однолетней выживаемостью.
|
|
Tumor
M2-PK
|
Метаболический
онкомаркер. Для большинства опухолей человека характерна продукция изомерной
формы пируваткиназы- Tumor M2-PK. Его концентрация указывает на переключение
клеток с нормального типа метаболизма на опухолевой, отмечена высокая
корреляция со степенью злокачественности (стадии опухоли.
|
Маркер
степени агрессивности злокачественной опухоли. Выявляет специфический тип
метаболизма опухолевых клеток независимо от их происхождения и локализации. В
отличие от других онкомаркеров, используемых в клинической практике, является
не накопительным, а метаболическим маркером, и наиболее рано и в достаточном
для определения количестве поступает в кровоток. Определение содержания Tu
M2-PK дает возможность ранней диагностики опухолей, возникновения метастазов
или рецидивов опухоли. (рак почки, легкого, молочной железы. Злокачественные
опухоли пищевода, желудка, поджелудочной железы, колоректальный рак).
|
Наиболее часто определяемые онкомаркеры:
Альфа-фетопротеин (AFP) - повышается у 2/3
пациентов с гепатоцеллюлярным раком (рак печени). Нормальная концентрация -
менее 20 нг/мл (нанограмм/мл). Уровень AFP повышается с ростом опухоли. Кроме
того, AFP повышается при острых и хронических гепатитах (редко более 100
нг/мл), некоторых видах раков яичников и яичек (в 5% случаев).
Бета - 2 -микроглобулин (B2M) - повышен при
множественной миеломе и некоторых видах лимфом (опухоли костного мозга и
кроветворной системы). Его определение играет важную роль в оценке прогноза
выживания - при уровне выше 3 нг/мл прогноз ухудшается.
СA 15-3, CA 27.29 - первоначально являются
маркерами рака молочных желез. Они повышаются незначительно (менее 10 %) на
ранних стадиях заболевания. При его прогрессировании степень повышения
онкомаркера достигает 75% и более. Возможно повышение данных онкомаркеров и при
других видах опухолей.125 - стандартный маркер рака яичников. Более 90%
пациентов, страдающих данным заболеванием, имеют уровень CA 125 более 30 Ед/мл,
а потому этот маркер использовали как скрининговый (просеивающий) метод
диагностики. Однако, в дальнейшем было обнаружено, что такая концентрация СА125
выявляется у многих здоровых женщин, а также у женщин с эндометриозом
(заболевание, характеризующееся появлением клеток, выстилающих внутреннюю
поверхность матки вне ее), выпотом в плевральную и брюшную полости, у лиц с
раком легких и перенесших ранее рак.72-4, LASA-P - маркеры рака яичников и
опухолей желудочно-кишечного тракта.19-9 - маркер рака поджелудочной железы,
чаще используемый в контроле его лечения. Ненормальным уровнем считают
показатель выше 37 ЕД/мл. CA 19-9 может повышаться при некоторых видах рака
кишечника, раке желчных проходов.
Карциноидоэмбриональный антиген (CEA) -
онкомаркер рака прямой кишки, но может использоваться в оценке рака легких и
молочных желез, а также иной локализации: щитовидной железы, печени, мочевого
пузыря, шейки матки, поджелудочной железы и даже у здоровых курильщиков. Именно
поэтому данный маркер отнесен к разряду неспецифических онкомаркеров.
Ненормальным уровнем считают значение выше 5 ЕД/мл. И все же, наиболее часто
CEA используется для подтверждения выявленного другими методами рака прямой
кишки.
Хромогранин А - продуцируется опухолями,
исходящими из клеток нервной и эндокринной систем.
Сывороточный гаммаглобулин - часто
обнаруживается при опухолях костного мозга (например, множественной миеломе,
макроглобулинемии). Однако диагноз должен быть подтвержден биопсией костного
мозга.
Сывороточный Her-2/neu - чаще всего используется
для оценки прогноза рака молочных желез. При его уровне более 450 fmol/ml
следует ожидать худший ответ на химиотерапию и менее благоприятный прогноз для
выживания.
Человеческий хорионический гонадотропин (ЧХГ,
HCG) - кроме указанных ранее заболеваний может обнаруживаться при некоторых
опухолях средостенья.- специфический белок, обнаруживаемый при раке мочевого
пузыря. Его чаще всего определяют для контроля эффективности лечения, нередко
вместо инструментальной диагностики (цистоскопии).
Нейрон-специфическая энолаза (NSE) - в ряде
случаев используют в оценке состояния пациентов с раком легких и опухолями,
исходящими из нервной и эндокринной ткани.
Простато-специфический антиген (PSA) - маркер
ранних стадий рака простаты и других заболеваний предстательной железы.
Отрицательным результатом считается PSA менее 4 нг/мл. В пользу рака простаты
указывает уровень PSA выше 10 нг/мл. Значения PSA от 4 -до 10 нг/мл считается
промежуточным результатом. Пациентам, имеющим такие уровни PSA, показано
проведение биопсии простаты. Кроме рака простаты, PSA повышается у пациентов с
доброкачественной гиперплазией предстательной железы, у пожилых людей. В таких
случаях полезным является измерение свободного (не связанного с белками крови)
PSA. Если его уровень составляет более 25% от общего PSA, то вероятность рака
простаты невелика. Кроме того, PSA является чувствительным тестом в оценке
качества лечения. После хирургического удаления или лучевой терапии уровень PSA
должен быть нулевым. Рост показателя после лечения свидетельствует о рецидиве
заболевания., PSMA - другие, менее чувствительные маркер рака простаты., TA-90
- онкомаркеры рака кожи (меланомы). В большинстве случаев его уровень
повышается при наличии метастазов.
Тиреоглобулин - белок, продуцируемый железами
щитовидной железы и повышающийся при многих ее заболеваниях. Используется в
качестве онкомаркера для ведения пациентов, перенесших хирургическое удаление
щитовидной железы по поводу рака. Повышение тиреоглобулина свыше 10нг/мл
является признаком рецидива опухоли.
Тканевой полипептидный антиген (TPA) - более
специфичный маркер рака легких.
Для лимфопролиферативных заболеваний можно
выделить ряд антигенных маркеров клеточных рецепторов:a (OMIM 188370) - острый
лимфолейкоз, миелолейкоз, кожные Т-лимфомы,b (OMIM 188360) - миелолейкозы,c
(OMIM 188340) - миелолейкозы, некоторые В клеточные опухоли и т.д. (6,10).
ИММУНОТЕРАПИЯ ОПУХОЛЕЙ
Исследования механизмов естественного и
адаптивного противоопухолевого иммунитета легли в основу нескольких серьезных
попыток иммунотерапии спонтанных опухолей человека и животных с помощью
активированных компонентов преимущественно системы врожденного иммунитета
(макрофаги, NK-клетки), но также в смеси с Т-лимфоцитами
(LAK-клетки-limphokin-activated killers, TIL-клетки - tumor-infiltrated
lymphocytes).клетки больных выращиваемые в огромных количествах in vitro в
присутствии ИЛ-2 или большие дозы только ИЛ-2 вводились пациентам с запущенными
формами рака. При этом в отдельных случаях наблюдалась частичная регрессия
первичной опухоли и её метастазов. Однако ограниченный и, как правило,
временный успех, тяжелейшие осложнения (почти непереносимость) такой терапии,
её индивидуальный характер и исключительная дороговизна сделали невозможным
дальнейшее использование этого метода. Затем в качестве альтернативного
источника более цитотоксичных эффекторных клеток позднее были предложены
TIL-клетки, размножаемые в присутствии ИЛ-2; такие клетки обладают в 100 раз
более высоким уровнем цитотоксического действия на опухоль и, следовательно, могут
быть введены в меньших дозах. Однако применение и этого материала для
иммунотерапии опухолей оказалось недостаточно эффективным.
Многочисленные попытки использования
активированных макрофагов, естественных и Т-киллеров, а также дендритных клеток
для иммунотерапии опухоли, начатые еще в 60-е гг., продолжаются и
усовершенствуются до настоящего времени. В последние годы для этих целей
предложены различные способы активации макрофагов, дендритных клеток и
NK-клеток in vivo.
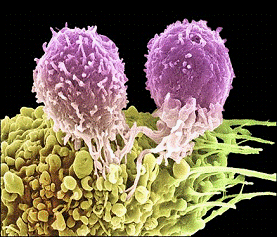
Рисунок 1 - Опухолевая клетка и Т-лимфоциты
киллеры
Несколько более широкое применение получило
сочетание неспецифической иммунотерапии опухоли (в частности, введение
некоторых цитокинов) с другими методами лечения онкологических больных. При
некоторых формах лейкоза у детей, а также при раке почки человека,
использование α-интерферона
отдельно, а также в сочетании с химиотерапией, оказалось эффективным у
некоторых из таких пациентов. Ряд ранних публикаций о классическом успехе
применения вакцины БЦЖ для неспецифической иммунотерапии опухолей человека не
были подтверждены при последующих испытаниях и, более того, в эксперименте на
животных было показано, что введение БЦЖ подавляет адаптивный противоопухолевый
иммунитет.
Специфическая иммунизация против опухоли может
быть эффективна лишь при определенных ограничивающих условиях: а) в период,
когда опухолевых клеток в организме очень мало и все они иммуночувствительны,
то есть экспрессируют СТОА; б) если в момент иммунизации иммунная система
хозяина не подавленна (способна к ответу); в) если имеется соответствующий
препарат для эффективной иммунизации. Очевидно, что такие условия в лучшем
случае складываются лишь до появления опухоли, на самом раннем этапе первичного
опухолевого процесса, индуцируемого известным онкогенным вирусом, что возможно
только в эксперименте на животных.
Для спонтанных опухолей эти условия реализовать
невозможно, поскольку этиология индивидуальных опухолей и стадия канцерогенеза
(до момента возникновения опухоли) остаются неизвестными. Для естественного
предотвращения таких опухолей представляется важным сохранение функциональной
активности всех типов эффекторов системы врожденного естественного
противоопухолевого иммунитета.
Таким образом, на сегодняшний день существует
два основных направления биотерапии опухолей: специфическая иммунотерапия и
неспецифическая иммунотерапия. К специфической иммунотерапии относится
использование противоопухолевых вакцин и моноклональных антител к конкретному
виду опухолей или факторов роста клеток.
Высокая эффективность моноклональной терапии
связана с механизмами действия антител. Оказалось, что МКА к определенным
антигенам способны не только вызывать иммуно-опосредованную (антитело- и
комплемент-зависимую) цитотоксичность, но и непосредственно вызывать апоптоз в
клетках-мишенях.
Примером подобного препарата является Эрбитукс(
Цетуксимаб), который представляет собой химерное моноклональное антитело IgGl,
направленное против рецептора эпидермального фактора роста (РЭФР).
Сигнальные пути РЭФР контролируют выживание
клетки, развитие клеточного цикла, ангиогенез, миграцию клеток и клеточные
инвазии/метастазы. Цетуксимаб связывается с РЭФР с афинностью, приблизительно в
5-10 раз превышающую характерную для эндогенных лигандов. Цетуксимаб блокирует
связывание эндогенных лигандов РЭФР, что приводит к ингибированию функций
рецепторов. Цетуксимаб также сенсибилизирует цитотоксические иммунные
эффекторные клетки по отношению к экспрессирующим РЭФР опухолевым клеткам
(зависимая от антител клеточно-опосредованная цитотоксичность (ЗАКЦ)).В опытах
in vitro и in vivo цетуксимаб ингибирует пролиферацию и индуцирует апоптоз
опухолевых клеток человека, которые экспрессируют РЭФР. In vitro цетуксимаб
ингибирует продукцию ангиогенных факторов в опухолевых клетках и блокирует
миграцию эндотелиальных клеток. In vivo цетуксимаб ингибирует продукцию
ангиогенных факторов в опухолевых клетках и снижает активность
неоваскуляризации и метастазирования опухолей.В настоящее время в арсенале
врача находятся более 10 препаратов на основе моноклональных антител. Наиболее
известные из них - Мабтера, Герцептин, Авастин и другие.
Успешные испытания препаратов направленного
действия на основе МКА и низкая токсичность большинства из них позволяют
надеяться на скорое появление в клинической практике высокоэффективных
препаратов, способных не только увеличить эффективность лечения и
продолжительность жизни, но и значительно улучшить качество жизни больных
злокачественными новообразованиями.
ИММУНОМОДУЛЯТОРЫ В ОНКОЛОГИИ
Активное использование иммуномодуляторов
началось в 70-х гг. XX века, когда использование ряда фармацевтических
препаратов способствовало восстановлению иммунологических показателей у
онкологияеских больных. Существует классификация этих препаратов, предложенная
Ярилиным А.А. и Пинегиным Б.В.
Выделяются следующие группы иммуномодуляторов:
препараты микробного происхождения (БЦЖ,
нуклеинат натрия, рибомунил, имудон и др.);
пептидные препараты (тактивин, миелопид, тимоген
и др.);
цитокины и препараты на их основе (интерфероны,
интерлейкины);
синтетические препараты (левамизол, полудан,
полиоксидоний, галавит, ликопид, имунофан и др.);
препараты на основе природных факторов
(препараты иммуноглобулинов, экстракты растений).
Самые ранние исследования относятся к применению
микробных иммуномодуляторов. В списке этих препаратов - БЦЖ, Corynebacterium
parvum, вирусы вакцины и болезни Ньюкасла, ОК-432, Lentinan, Krestin и
некоторые другие.
Однако, клиническое значение в сегодняшней
практике придается лишь БЦЖ, впервые примененной A. Morales в 1976 году. Ее
применяли интракутанно, субкутанно, интратуморально и перорально, но в виду
низкой эффективности и выраженных местных и системных реакций в настоящее время
иногда применяют для внутрипузырного лечения поверхностного рака мочевого
пузыря.
Считается, что БЦЖ при этой форме рака является
первой линией профилактики рецидивов болезни после трансуретральной резекции.
Хотя в настоящее время в арсенале врачей имеются более эффективные и намного
более безопасные препараты, успешно апробированные при данной патологии.
Имеются немногочисленные публикации о случаях, когда в ответ на внутрипузырную
БЦЖ - иммунотерапию развивались системные осложнения типа сепсиса с очагами
специфического туберкулезного воспаления в печени, легких, почках и др.
органах. В литературе опубликовано 4 случая, когда подобные осложнения
приводили к летальному исходу. Кроме того, у некоторых пациентов наблюдалось
усиление роста опухоли и более раннее возникновение метастазов.
Левамизол - Levamisol (Декарис) -
антигельминтный препарат и иммуномодулятор применяется как стимулятор
компонентов противоопухолевого иммунитета при ряде опухолей. В частности
доказано, что дополнительная терапия этим препаратом после радикальных операций
по поводу рака толстой кишки улучшает показатели выживаемости.
В России созданы и применяются несколько
препаратов, относящихся к группе тимомиметиков: тималин, тактивин,
тимостимулин. В действии этих препаратов много общего и четкое
дифференцирование показателей к применению каждого из них при онкологических
заболеваниях отсутствует. Преимуществом их является мягкость и корригирующий
характер их воздействия, но т.к. все они являются экстрактами, содержащими
комплекс полипептидов крупного рогатого скота, применять их следует с
осторожностью больным, имеющим в анамнезе бронхиальную астму атопической формы
и некоторые другие аллергические заболевания. Вышеперечисленных недостатков
лишен синтетический тимомиметик тимоген. Тимоген представляет собой
синтетический аналог природного иммуноактивного дипептида последовательности
L-Glu-L-Trp.
Кроме того, препаратом, также лишенным этих
недостатков, является имунофан представляющий собой гексапептид - аналог
активного фрагмента гормонов тимуса. Он оказывает регулирующее влияние на
иммунную систему, воздействуя на продукцию тимулина. В тесте Аз-РОК он по
активности в 1000 раз превосходил тактивин. Результаты доклинических испытаний
in vitro и in vivo и первые результаты клинических испытаний позволяют
утверждать, что как регуляторный фактор имунофан весьма эффективен. Так, его
введение пациентам приводит к нормализации количества и функционального
состояния CD2+, CD3+, CD4+ и CD8+ лимфоцитов и естественных киллеров-NK-клеток
при их исходном снижении.
Следует отметить, что имунофан оказывает
выраженное стресс-протективное действие как в эксперименте, так и в клинической
практике, в частности, при предоперационной подготовке больных. При этом
намного улучшаются все клинические показатели (сроки и характер заживления,
развитие осложнений, рубцов и т.д.) как в раннем послеоперационном периоде, так
и при наблюдении за пациентами в течение 1 - 2,5 лет.Это свойство препарата
трудно переоценить у онкологических пациентов недавно проинформированных о
своем диагнозе. Стресс-протекторный эффект позволяет врачу быстрее адаптировать
пациента к процессу терапии и усилить его мотивацию к лечению, а следовательно
и эффективность предпринимаемых лечебных мероприятий. Однако следует иметь в
виду, что тимомиметики в отдельных случаях даже в терапевтических дозах могут
приводить к стимуляции роста опухоли и метастазирования.
Выраженным детоксицирующим действием, весьма
важным для онкологических больных, обладает другой иммуномодулятор
полиоксидоний. Полиоксидоний является высокомолекулярной алифатической
N-окисью, благодаря чему способен проявлять более высокую сорбирующую
активность, чем её низкомолекулярные аналоги. Строение полиоксидония
предопределяет его основные биологические свойства - нейтрализация и вывод из
организма токсических соединений (включая металлы и различные токсины),
превосходя при этом гемодез, полиглюкин, альбумин и др. Полиоксидоний также
обладает иммунокорригирующей, противовоспалительной, антиоксидантной и
мембранопротекторной функциями.При этом, особенно ценны на фоне химиотерапии
его гепато- и ренопротекторные функции.
Иммунотропное действие полиоксидония направлено
преимущественно на макрофагальное звено и другие механизмы врожденного
иммунитета. При этом важно отметить, что до настоящего времени не выявлено
побочных эффектов при применении препарата, случаев нежелательной
перестимуляции или резкого угнетения иммунного статуса при длительном
применении у онкологических больных, не зарегистрировано также и
провоспалительных эффектов.
Восстанавливая сниженные реакции макрофагов,
нейтрофилов, а затем и Т- и В-лимфоцитов, полиоксидоний практически не влияет
на нормально функционирующие клетки и даже способен снизить активность
цитопатогенных иммунокомплексных реакций или аутоиммунных реакций. Показано,
что полиоксидоний, в отличие от стимуляторов иммунитета, не вызывает стимуляцию
роста опухолей или их метастазирования.
Как видно из приведенных данных, в последние
годы активность поиска и создания новых иммуномодулирующих активных субстанций
и препаратов на их основе чрезвычайно активизировалась не только за рубежом, но
и в нашей стране. Создание препаратов, обладающих возможностью повышать
способность нормальных клеток организма переносить повреждающее действие
цитостатических воздействий в процессе противоопухолевой терапии, при этом
обладая минимальными побочными эффектами, что крайне важно, учитывая высокую
токсичность применяемых в онкологии средств - все это характеризует препараты
нового поколения.
Иммуномодуляторы не проявляют прямого
противоопухолевого и антиметастатического действия, однако, при доклиническом
исследовании иммуномодулятора, представляющего собой натриевую соль
аминофталазина, была отмечена его способность не только усиливать
противоопухолевый иммунитет путем повышения и/или восстановления эффекторного
механизма, опосредованного через презентативную функцию макрофагов, регуляцию
синтеза интерлейкина-1 (ИЛ-1), фактора некроза опухоли (ФНО), интерлейкина-2
(ИЛ-2), NK-клеток и др., но и модификацией других биологических аспектов
взаимоотношений организма-носителя и опухоли.
Данный препарат был зарегистрирован под
названием «Галавит» в 1997г. Он разработан в ММА им. И.М. Сеченова и ЗАО ЦСМ
«Медикор» и представляет собой натриевую соль аминофталазина, которая
воздействует на механизмы, как на врожденного, так и приобретенного иммунитета.
Важнейшим механизмом осуществления эффектов
естественного врожденного иммунитета макрофагами является фагоцитоз с
адсорбцией, поглощением и деструкцией патогенного материала. Это процесс,
связанный с активацией дыхания клетки и синтезом активных форм кислорода (АФК),
которые и являются главным «оружием» макрофагов.
В развитии процессов адаптивного иммунитета
макрофаги также занимают важное место, находясь в самом начале активации
каскада иммунокомпетентных клеток. Без макрофагов иммунный ответ обычно не
развивается. Это связано с тем, что макрофаги являются абсолютно необходимыми
для процесса «презентации» антигена - представления его иммунокомпетентным Т- и
В-лимфоцитам в «удобном» виде - вместе с антигенами комплекса
гистосовместимости; одновременно макрофаги выделяют вещества-активаторы
иммунитета, прежде всего интерлейкин-1. Ингибирование таких эффектов может
вести к иммунодефициту, и к процессам иммунной толерантности к специфическому
антигену.
Адгезия макрофагов наблюдается как к чужеродным,
так и к собственным клеткам организма, поэтому они играют важную роль и в
процессах распознавания «свое-чужое», оберегая организм от развития
аутоагрессивных реакций, инициируя процесс иммунной элиминации измененных
клеток при их опухолевом перерождении.
Участие макрофагов, в так называемой, реакции
«сингенной смешанной культуры лимфоцитов» показывает их участие и в процессах,
обеспечивающих нормальную пролиферацию, рост и физическое замещение различных
типов клеток в организме при многих физиологических и патологических процессах.
Макрофаги как непосредственно «представляют»
антиген лимфоцитам, так и выделяют целый ряд цитокинов (ФНО,ИЛ-1 и т.д.),
влияющих на различные этапы иммунной реакции и на различные типы клеток.
Важнейшим, из них является интерлейкин-1 (ИЛ-1), специфически влияющий на
Т-хелперы, действующий на тимоциты и активированные В-клетки и Т-лимфоциты.
Известно также выделение макрофагами фактора дифференцировки Т-клеток, описано
выделение макрофагами ряда супрессорных факторов белковой и низко молекулярной
природы, например, простагландинов.
Простагландины, активные ферменты кислорода,
ИЛ-1, фактор некроза опухолей и ряд других веществ оказывают провоспалительный
эффект и могут играть значительную роль при формировании различных
патологических состояний.
Таким образом, эффекты макрофагов можно свести к
пяти группам:
эффекты врожденного иммунитета, прежде всего
фагоцитоз и выделение активных форм кислорода;
провоспалительные эффекты, связанные с
выделением ряда цитокинов и провоспалительных цитокинов, в том числе АФК;
представление антигенов антигенраспознающим
лимфоцитам;
иммунорегуляторные эффекты, связанные с
выделением целого ряда факторов-регуляторов иммунитета, как стимулирующего, так
и ингибирующего типа и влияющих на самые различные клетки иммунной системы;
эффекты «не иммунного типа», связанные, однако,
с участием лимфоидных клеток и макрофагов с регуляцией роста и деления самых
разных типов клеток непосредственно, а не через иммунные клетки-эффекторы (не
через В-продуценты антител и не через клетки - «киллеры»), в целом - это
адаптивные и биостимулирующие эффекты.
Доклинические испытания препарата Галавит
показали:
. Способность Галавита изменять скорость синтеза
биологических макромолекул в макрофагах - РНК, ДНК и белка. Иными словами
препарат способен регулировать активность генов синтеза цитокинов.При этом он
проявляет свою противовоспалительную активность вследствие способности обратимо
(на 6-8 часов) ингибировать синтез гиперактивированными макрофагами противовоспалительных
цитокинов ФНО и ИЛ-1 или стимулировать их при исходной недостаточности.
. Способность Галавита при воздействии in vitro
на нейтрофильные гранулоциты и лимфоциты человека вызывает активацию гликолиза,
пентозофосфатного цикла, липидного анаболизма и глутатион-зависимой
антиоксидантной системы. То есть препарат проявлял как антиоксидантные
свойства, так и прооксидантные свойства, поскольку стимулировал клеточное
дыхание как аэробным, так и анаэробным способом, увеличивая продолжительность
жизни и функции клеток в экстремальных условиях (воспаление, гипоксия,
интоксикация и т.д.).
. При этом Галавит способен восстановить
угнетенную фагоцитарную функцию макрофагов и нейтрофилов и, следовательно, их
противоинфекционную защиту. Одновременно восстанавливается антиген
представляющая функция макрофагов со снижением аутоагрессии, активизируются
процессы репарации поврежденных тканей, купируются клинические симптомы
интоксикации и диаррейного синдрома, восстанавливается адекватное
функционирование иммунной системы, снижается аггрегационная способность
тромбоцитов.
. Весьма важно, на наш взгляд, является
выраженное противовоспалительное действие Галавита, что выгодно отличает его от
стимуляторов иммунитета, для которых характерно выраженное провоспалительное
действие. Кроме того, в отличие от кортикостероидов и нестероидных
противовоспалительных препаратов, Галавит не только не оказывает повреждающего
воздействия на желудочно-кишечный тракт, но напротив, обладает противоязвенными
свойствами, что делает его применение предпочтительным у пациентов с эрозивными
или язвенными заболеваниями желудочно-кишечного тракта.
. Показана способность регулировать активность
некоторых молекул, определяющих жизнеспособность клеток, в частности
антиапоптотический белок Bcl2 и ангиогенный фактор VEGF(Vascular endothelial
growth factor).(11).
. Показано прямое действие Галавита на функцию
NK-клеток опухолевых больных. таким образом, галавит обладает прямым действием
на механизмы врожденного противоопухолевого иммунитета.В эксперименте было
изучено действие Галавита на опухолевый рост и метастазирование мышиной
меланомы В16, а также на продолжительность жизни животных-опухоленосителей.
Исследование проводилось лабораторией клеточной иммунопатологии и биотехнологии
НИИ Морфологии человека РАМН, а позднее было подтверждено доклиническими
исследованиями Киселева С.М. с соавт. в ГУ РОНЦ им.Н.Н.Блохина. Авторами
изучена способность препарата Галавит ингибировать инвазивную активность
опухолевых клеток. Исследование выполнено на модели искусственной базальной
мембраны: полимерной матрице, покрытой матригелем. Показано, что Галавит при
концентрациях, не оказывающих цитотоксического действия на опухолевые клетки,
на 45-50 % ингибирует их способность проходить через искусственную базальную мембрану.
Препарат проявил равную активность в отношении как клеток экспериментальных
опухолей мыши (меланома В16F10 и карцинома LLC), так и опухолей человека
(меланомы Mel-03 и фибросаркомы HP-1080). Выявленная активность характеризует
Галавит, по мнению авторов, как потенциальный ингибитор метастазирования с
патогенетической направленностью действия. В медицинском радиологическом
научном центре РАМН, г. Обнинск было проведено экспериментальное изучение
противоопухолевой активности влияния препарата Галавит на рост и
метастазирование карциномы Льюиса мышей. Исследована эффективность Галавита в
качестве средства монотерапии, а также сочетание его с известным
противоопухолевым препаратом циклофосфаном. Применение Галавита во всех
вариантах опытов вызывало умеренное уменьшение объема опухоли, сопоставимое по
эффекту с результатами использования циклофосфана. Лечение Галавитом в дозах 50
и 500 мкг/мышь обеспечивало снижение макроскопически видимых легочных
метастазов на 27% по сравнению с контролем (не леченные животные-опухоленосители).
Применение Галавита в дозе 50 мкг/мышь способствовало статистически
достоверному усилению антиметастатического действия циклофосфана - количество
легочных метастазов снижалось в 4 раза по сравнению с уровнем метастазирования
при применении только одного циклофосфана. Следует обратить внимание, что у 4
из 12 мышей группы «циклофосфан + Галавит 50 мкг/мышь» макроскопически видимые
метастазы отсутствовали вообще. В большинстве экспериментов Галавит в
определенной степени угнетал рост подкожного узла меланомы и увеличивал
продолжительность жизни мышей-опухоленосителей, но статистически значимых
различий с контролем выявлено не было. Следует отметить, что при режиме
введения препарата 1 раз в 3 дня Галавит проявлял большую тенденцию к замедлению
опухолевого роста (9%) и продлению жизни мышей с меланомой (15%), чем при
ежедневном применении (5 и 6%, соответственно).
Вполне вероятно, что препарат Галавит в
значительной мере может элиминировать «эффект ускользания» опухолей от
собственного иммунитета, снижая избыточный синтез аутоантител и других факторов
обеспечивающих перифокальное воспаление вокруг опухолей и улучшая
биодоступность и эффективность химио- и лучевой терапии. Возможно Галавит
снижает проявления клеточной гипоксии внутри опухолей, благодаря чему снижается
или полностью нивелируется аденозинзависимая блокада активности NK-клеток.
Клинические испытания препарата успешно
проведены при кишечных инфекциях, фурункулезе, распространённом герпесе. Опыт
применения препарата Галавит в терапии урогенитальной герпетической инфекции,
представленный на XXXVII научно-практическая конференция дерматовенерологов и
врачей смежных специальностей Санкт-Петербурга, а также постхирургических
гнойно-септичеких состояниях и простатите. Убедительные клинические результаты
показаны при использовании препарата при эндометриозе, миомах матки и других
гинекололгических заболеваниях. Весьма убедительными являются также результаты
клинического применения Галавита при лечении язвенной болезни желудка и
двенадцатиперстной кишки.
В Московском Государственном
Медико-стоматологическом Университете на кафедре онкологии проводились
исследования эффективности применения Галавита у больных диссеменированным
раком молочной железы при проведении полихимиотерапии. Отмечено, что у больных
получавших цитостатики и Галавит, количество полных регрессий было
зарегистрировано в два раза больше,чем в группе плацебо. Количество частичных
эффектов и стабилизации состояния было приблизительно одинаковым, а вот
прогрессирование заболевания было констатировано лишь в 5 случаях и в среднем
через 10-12 месяцев при терапии CAF плюс Галавит и в 16 случаях при терапии CAF
плюс плацебо через 4-6 месяцев наблюдения. Таким образом, при анализе
эффективности лечения больных раком молочной железы химиотерапией по схеме CAF
на фоне Галавита и в группе плацебо было отмечено значительное усиление
эффективности терапии у больных в группе с Галавитом в сравнении с группой
плацебо. При раке легкого отмечено значительное снижение в послеоперационном
периоде числа пневмоний, что определило положительный клинический эффект
комбинированной терапии.
В ВОНЦ закончены исследования по применению
этого препарата у больных раком молочной железы II - III стадии в
послеоперационном периоде и при раке мочевого пузыря. Получены положительные
результаты. Галавит не вызывал роста опухоли или метастазирования ни в одном из
случаев (1,2,7,12).
Полученные результаты создают предпосылки для
клинических испытаний других имеющихся иммуномодуляторов как корректоров
противоопухолевого иммунного ответа и расширения показаний их применения с
позиции новых знаний об иммунитете при опухолевом росте и практике
использования иммуномодуляторов.
В настоящее время показана клиническая
эффективность и безопасность применения препарата Галавит при раке легкого,
раке мочевого пузыря, раке молочной железы, раке желудка, гипернефроидном раке.
В соответствии с приказами МЗ и СР РФ от 2006 года Галавит входит в стандарты
медицинской помощи больным со злокачественными новообразованиями неба, грушевидного
синуса, полости носа и придатков пазух,
ротоглотки(№№805,811,814,816)новообразований печени и желчного
пузыря(№812),десны (№806), вилочковой железы и средостения (№804).
Перспективы иммунотропной терапии опухолей.
В нашей стране в последние десятилетия
разработаны новые подходы к лечению онкологических пациентов. Прежде всего
следует назвать таких ученых как Абелев Г.И., Черешнев В.А.,Северин Е.С. и
Северин С.Е.. В частности исследованы и предложены технологии по активации
лимфоцитов антигенами собственной опухоли Рисунок 2. Создана вакцина для
профилактики и лечения рака молочной железы Рисунок 3. Предложена методика
точной доставки химиопрепаратов в опухолевую клетку через рецептор для
альфафетопротеина (АФП) Рисунок 4. В РОНЦ им.Н.Н.Блохина РАМН разрабатывается
возможность использования препаратов на основе антител, в ряде институтов идут
поиски препаратов для активации гена р53 и др. Разработаны и продолжают
разрабатываться новые противоопухолевые препараты на основе моноклональных
антител (8).
Уже сейчас в арсенале врачей онкологов имеются
вполне эффективные препараты сопровождения базисной противоопухолевой терапии,
а проводимые в данном направления исследования свидетельствуют о больший
перспективах применения препаратов по элиминации механизмов ускользания
опухолей от иммунной системы. Именно в направлении создания патогенетической
терапии и профилактики опухолей, то есть восстановления механизмов
противоопухолевого иммунитета и находится будущее борьбы человечества с
онкологической патологией.
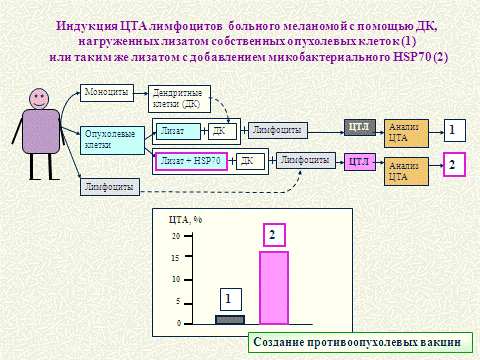
Рисунок 2 - Создание индивидуальных
цитотоксических клеток
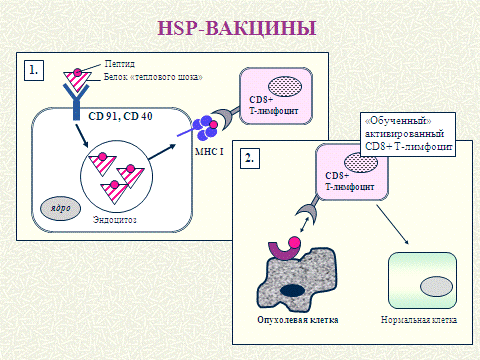
Рисунок 3 - Схема принципа действия вакцин на
основе белков теплового шока
опухоль макрофаг цитологический
клетка
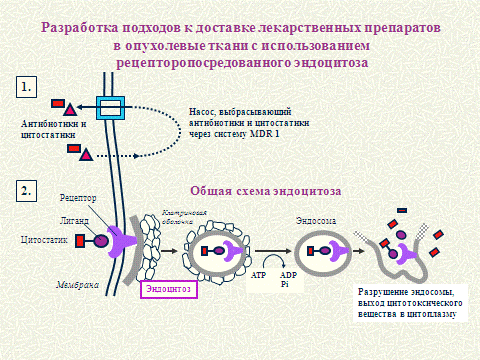
Рисунок 4 - Направленный транспорт препаратов в
опухолевую клетку
ЛИТЕРАТУРА
1. Барышникова
М.А., Орлова О.Л., Шпрах З.С. Разработка новой лекарственной формы Галавита в
виде сублингвальных таблеток // РБЖ. - 2006. - Т. 5, № 1. - С. 86-90.
2. Вельшер
Л.З., Габуния З.Р., Гришина Т.И., Германов А.Б., Коробкова Л.И., Платонов Д.А.,
Горчак Ю.Ю., Аргун В.М., Щепеляев Д.О., Генс Г.П.
"Клинико-иммунологическая эффективность применения иммуномодулятора
Галавиту больных немелкоклеточным раком легкого" Журнал"Эффективная
фармакотерапия в онкологии, радиологии и гематологии". 1 февраль 2006г.
Москва. стр.28-30.
. Галактионов
В.Г. Иммунитет к опухолям // Иммунология. - М.: Изд-во Московского
государственного университета, 1998. - Гл. 5. - С.348.
. Гришина
Т.И. Клиническое значение нарушения иммунитета при хирургических
вмешательствах. // Андрология и генитальная хирургия, // 2000, № 2, с. 35-38.
. Киселев
С.М., Лабурдова Е.В., Козлов А.М. «Влияние препарата галавит на инвазивную
активность опухолевых клеток «Российский биотерапевтический журнал, 2006, №3,
том.5,стр.61-66.
. Ковальчук
Л.В. «Антигенные маркеры клеток иммунной системы. CD
система
(Clasters Differentiations)-,РГМУ
МЗСР
РФ,
2005, - 85 с.
7. Коробкова
Л.И., Велъшер Л.З., Германов А.Б., Гришина Т.И., Станулис А.И., Генс Г.П.,
Щепеляев Д. О., Израилов Р.Е., «Роль иммуномодулятора Галавит в онкологической
и хирургической практике» Российский биотерапевтический журнал.
2004,№3,том3,стр.28-33.
. Личиницер
М.Р., Степанова Е.В. «Новые противоопухолевые препараты на снове моноклональных
антител», РМЖ, 2002, №14, 609.
. Молотковская
И.М. «Механизмы ганглиозид-индуцированной иммуносупрессии Т-лимфоцитов.»
автореферат докт. Дисс., Москва,
2011,
с.
49.
. Руководство
по иммуногистохимической диагностике опухолей/под. ред. С.В. Петрова, Н.Т.
Райхлина-3-е изд., - Казань: РИЦ «Титул», 2004 г.
11. Y.
Jiang, V.I. Scofild, M. Yan etc. “Retrovirus-indused oxidative stress with
neuroimmunodegeneration is suppressed by antioxidant treatment with a refind
monosodium α-luminol(Galavit)”,
Jornal of Virology,May 2006,p.4557-45-69.
. E.
Nemtsova, T. Karmakova, O. Bezborodova, V. Scripnik, A. Amiraliev, V. Sobolev,
Oleg Pikin, R. Yakubovskaya «Prophilaxis of suppurative and inflammatory
postoperative complications in lung cancer patients using antioxidant and
immunomodulating drugs.,»abstr.book of 19- th European Conference of General
Thoracis Surgery, June 2011,p.39.