Основы термодинамики
Курсовая работа
тема: "Основы
термодинамики"
Москва 2013
Содержание
Введение
1. Первый закон термодинамики
2. Теплоемкость газа
3. Термодинамические процессы
4. Круговые циклы
5. Энтропия
6. Второй и третий законы термодинамики
7. Цикл Карно
8. Основные формулы термодинамики
Список использованной литературы и источников
Введение
Термодинамикой называется раздел физики, в котором
изучаются общие свойства макроскопических систем с позиций термодинамических
законов. Сами термодинамические законы являются обобщением опытных данных. В
термодинамике не учитывается молекулярная структура вещества, и ее выводы
справедливы для всех макроскопических систем.
В основе термодинамики лежат три закона (начала)
термодинамики. Они были открыты в период создания тепловых машин и имеют
различные формулировки.
1. Первый
закон термодинамики
Первый закон термодинамики представляет собой закон
сохранения энергии, сформулированный для термодинамической системы.
Термодинамические законы часто называют началами термодинамики.
Первый закон термодинамики: Теплота, сообщаемая
системе, расходуется на изменение ее внутренней энергии и на совершение ею
работы против внешних сил.
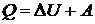 .
.
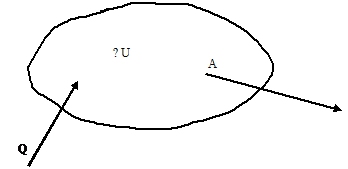
Здесь Q -
количество тепла, сообщаемое системе, А - работа, производимая системой,
ΔU=U2 - U1 - изменение энергии системы. Отсюда
видно, что теплота, энергия и работа имеют одинаковые размерности. Они
измеряются в джоулях (Дж). Отметим, что при открытии первого закона
термодинамики закон сохранения энергии еще не был известен, а для работы и
количества тепла использовали различные единицы измерения (джоуль и калорию).
Схематически первый закон термодинамики можно изобразить так, как показано на
рисунке.
Если рассматривать бесконечно малые величины, то первый закон
термодинамики принимает вид
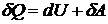 .
.
Можно показать, что при этом 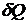 и
и 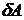 являются малыми величинами, а dU - полный дифференциал.
являются малыми величинами, а dU - полный дифференциал.
Рассмотрим периодическую термодинамическую систему, т.е. такую,
которая после совершения термодинамического цикла может возвращаться в исходное
состояние. Для такой системы имеем
 .
.
Следовательно
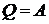
и все тепло переходит в работу. После многочисленных попыток
создать машину, производящую работы больше, чем количество получаемого тепла,
была дана другая формулировка первого закона термодинамики:
Нельзя построить вечный двигатель первого рода, т.е. такой
двигатель, который выполнял бы больше работы, чем получал тепла.
Выразим входящие в уравнение 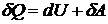 величины через параметры уравнения состояния. Для этого
рассмотрим работу, совершаемую системой при изменении объема. Для простоты
найдем выражение для работы, рассматривая движение поршня
величины через параметры уравнения состояния. Для этого
рассмотрим работу, совершаемую системой при изменении объема. Для простоты
найдем выражение для работы, рассматривая движение поршня
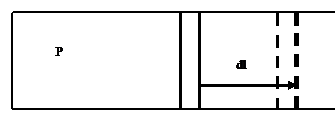
Используя принятое в механике выражение для работы, получим
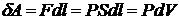
Полную работу получим, интегрируя это выражение
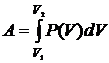
Формула для работы справедлива для любых термодинамических систем
с известной зависимостью 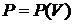 . Для определения энергии используем
представления идеального газа. Средняя энергия одной молекулы определяется
выражением
. Для определения энергии используем
представления идеального газа. Средняя энергия одной молекулы определяется
выражением
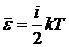 .
.
Для энергии одного моля можно записать
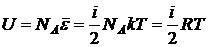 ,
,
для ν молей
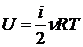 .
.
термодинамика закон энтропия формула
2.
Теплоемкость газа
Введем важное в термодинамике понятие теплоемкости.
Теплоемкостью называется физическая величина, численно
равная количеству теплоты, которое надо сообщить телу, чтобы нагреть его на
один градус Кельвина
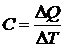 ,
,
или в более общей форме
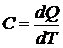 .
.
Размерность теплоемкости
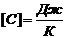 .
.
Удельной теплоемкостью называется физическая величина, численно равная количеству
теплоты, которое надо сообщить единице массы тела, для увеличения ее
температуры на один градус Кельвина
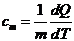 .
.
Молярной теплоемкостью называется величина, численно равная количеству теплоты, которое
надо сообщить одному молю вещества, чтобы нагреть его на один градус Кельвина
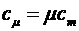 .
.
Можно записать
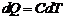 ,
,
где под С следует понимать ту теплоемкость, которая следует
из контекста. В дальнейшем будем рассматривать, главным образом, молярные
теплоемкости.
Используя первый закон термодинамики
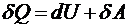
и полученные выражения для работы и количества тепла, можно
записать
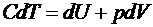 .
.
Теплоемкость зависит от характера термодинамического процесса,
т.е. от условий, при которых осуществляется передача тепла. Рассмотрим простейшие
термодинамические процессы.
Молярная теплоемкость при постоянном объеме (изохорическая, 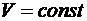 ) определяется формулой
) определяется формулой
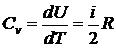 .
.
Здесь использована формула
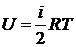 .
.
Для одноатомного газа получим 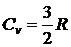 . Молярная теплоемкость при постоянном давлении (изобарическая,
. Молярная теплоемкость при постоянном давлении (изобарическая, 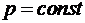 ) может быть получена следующим образом:
) может быть получена следующим образом:
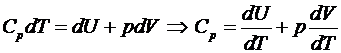 .
.
Используем уравнение состояния
Учитывая формулу
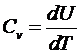 , получим
, получим 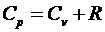 .
.
Это выражение называется уравнением Майера для идеального
газа.
Если
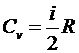 , то
, то 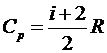 .
.
В качестве характеристики тепловых свойств газа часто используется
отношение теплоемкостей
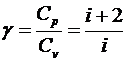 .
.
Для одноатомного газа 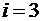 ,
, 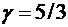 .
.
Для идеальных газов теплоемкости не зависят от температуры. В
реальных газах такая зависимость наблюдается. Например, для молекул водорода
зависимость теплоемкости от температуры имеет вид
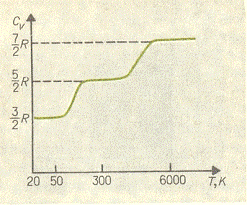
Объяснение такого вида зависимости теплоемкости дается в рамках
квантовой механики и связано с тем, что при понижении температуры различные
степени свободы могут вырождаться или "замораживаться".
3.
Термодинамические процессы
Рассмотрим простейшие термодинамические процессы для
идеального газа и определим для них основные термодинамические характеристики:
работу, энергию, теплоемкость.
1) Изохорный процесс: 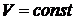 .
.
Схематически график изохорного процесса показан ниже.

Работа
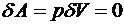 , следовательно
, следовательно 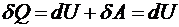 .
.
Учитывая, что
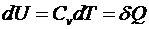
для одного моля. Для ν молей получим
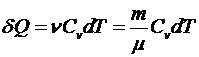 .
.
Выражение для изохорной теплоемкости мы получили ранее
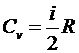 .
.
) Изобарный процесс: р=const.
Схематически график изобарного процесса показан ниже.

Работа при изобарном процессе:
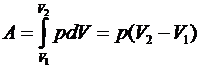 .
.
Используя уравнение состояния, можем записать эту формулу
по-другому:
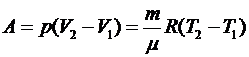 .
.
Для одного моля 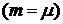 при
при 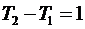 получим
получим 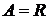 , т.е. газовая постоянная R равна работе изобарного расширения 1 моля идеального газа при
нагревании его на
, т.е. газовая постоянная R равна работе изобарного расширения 1 моля идеального газа при
нагревании его на 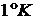 .
.
Изобарная теплоемкость была получена ранее и определяется формулой
Майера:
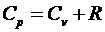 .
.
) Изотермический процесс: 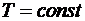 .
.
Из уравнения Клапейрона-Менделеева получим
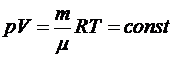 ,
,
т.е. в p - V координатах изотерма представляет собой
гиперболу. Ниже приведены графики изотермы и адиабаты, которая будет
рассмотрена ниже.
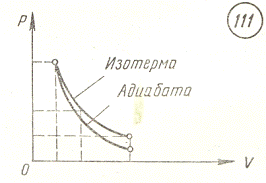
Работа при изотермическом процессе:
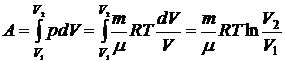 .
.
Учитывая условие
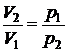 ,
,
формулу для работы можно выразить через давление:
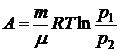 .
.
При изотермическом процессе внутренняя энергия не изменяется:
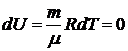 ,
,
поэтому 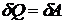 , т.е. все тепло расходуется на работу.
, т.е. все тепло расходуется на работу.
Для теплоемкости при изотермическом процессе формально можно
записать:
 .
.
) Адиабатический процесс: 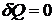 .
.
Адиабатическим называется процесс, при котором
отсутствует теплообмен между термодинамической системой и окружающей средой.
Обычно адиабатическими являются быстропротекающие процессы (распространение
звука, электризация, перемагничивание и др.).
Опишем адиабатический процесс, используя первый закон
термодинамики:
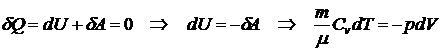 .
.
Из уравнения состояния идеального газа следует:
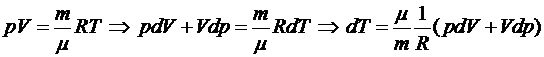 .
.
Имеем
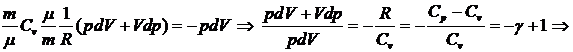
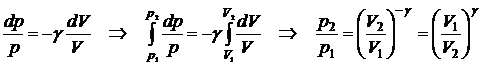 .
.
Последнее уравнение можно записать в виде
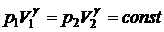 .
.
Это уравнение называют уравнением адиабаты или уравнением
Пуассона. Параметр 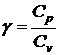 называют показателем адиабаты или
показателем Пуассона. График адиабатического процесса на p-V диаграмме показан выше. Из графика видно, что для адиабаты
давление уменьшается с объемом быстрее, чем для изотермы.
называют показателем адиабаты или
показателем Пуассона. График адиабатического процесса на p-V диаграмме показан выше. Из графика видно, что для адиабаты
давление уменьшается с объемом быстрее, чем для изотермы.
Используя уравнение Клапейрона-Менделеева, можно записать
уравнение адиабаты в других переменных:
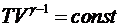 ,
, 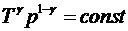 .
.
Найдем выражение для работы при адиабатическом процессе.
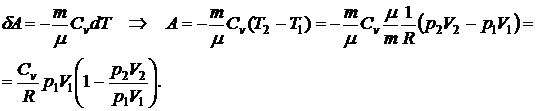
Используя уравнение адиабаты в виде
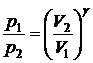 ,
,
запишем выражение для работы в виде
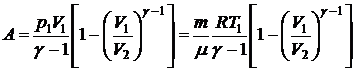 .
.
Для теплоемкости при адиабатическом процессе можно записать
) Политропный процесс: 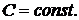
Политропным называется процесс, в котором теплоемкость
остается постоянной.
Можно показать, что политропный процесс описывается
уравнением
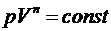 , где
, где 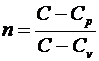
показатель политропы. Из последнего уравнения получим выражение
для теплоемкости, которая остается неизменной в термодинамическом процессе
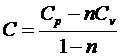 .
.
Рассмотрим некоторые частные случаи политропных процессов.
) 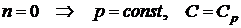 - изобарный процесс;
- изобарный процесс;
) 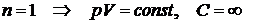 - изотермический процесс;
- изотермический процесс;
) 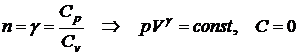 - адиабатический процесс;
- адиабатический процесс;
) 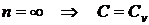 - изохорный процесс.
- изохорный процесс.
Из приведенных примеров видно, что политропный процесс является
обобщением ранее рассмотренных процессов.
4. Круговые циклы
Круговым процессом называется процесс, при
котором система, пройдя через ряд состояний, возвращается в исходное состояние.
Говорят, что система совершает круговой цикл. На p-V диаграмме круговой цикл
представляется в виде замкнутой кривой. На приведенном графике система
переходит из состояния 1 в состояние 2, затем возвращается в исходное состояние
1. Ниже мы рассмотрим различные циклы, состоящие из нескольких кривых, в
частности, цикл Карно, состоящий из двух изотерм и двух адиабат.
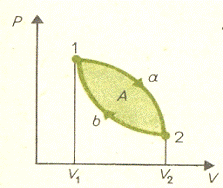
Работа на участке 1а2:
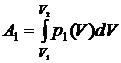 .
.
Соответственно, работа на участке 2b1:
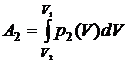 .
.
Полная работа за весь цикл:
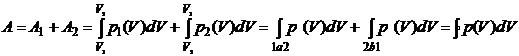 ,
,
т.е. полная работа за цикл равна значению криволинейного интеграла
по замкнутому контуру, образующему этот цикл. Значение работы может быть как
положительным, так и отрицательным, в зависимости от направления обхода цикла.
При выбранном на рисунке направлении обхода работа будет положительной. Если А>0
цикл называют прямым, при А<0 - обратным.
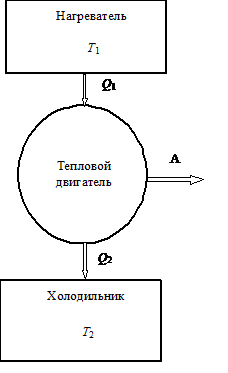
Тепловым двигателем называют периодически действующую установку, совершающую работу
за счет полученной извне теплоты. Тепловыми машинами являются паровые машины,
двигатели внутреннего сгорания, теплосиловые установки ТЭЦ и пр.
Холодильной машиной называют периодически действующие установки, в которых за счет
внешних сил тепло переносится от менее нагретого тела к более нагретому.
Согласно первому закону термодинамики
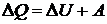 .
.
В круговых процессах 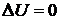 , следовательно
, следовательно 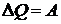 , где
, где 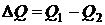 ,
, 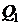 - количество тепла, полученное системой,
- количество тепла, полученное системой, 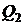 - количество тепла, отданного системой.
- количество тепла, отданного системой.
Термическим коэффициентом полезного действия (КПД) кругового цикла называется величина
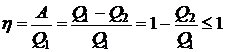 .
.
Термодинамический процесс называется обратимым, если он
может происходить как в прямом, так и в обратном направлениях. В противном
случае процесс называют необратимым. Отметим, что все равновесные
процессы являются обратимыми.
5. Энтропия
Одним из важнейших понятий термодинамики является понятие
энтропии. На самом деле это понятие используется не только в термодинамике, но
и в других науках: информатике, социологии и пр. Рассмотрим процесс передачи
тепла от тела 1 к телу 2.

Приведенным количеством теплоты называется величина 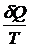 . Можно показать, что во всех обратимых термодинамических
процессах
. Можно показать, что во всех обратимых термодинамических
процессах
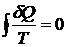 .
.
Отсюда следует, что величина 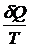 является полным дифференциалом:
является полным дифференциалом:
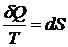 .
.
Энтропией называется
функция состояния, дифференциалом которой является величина 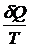 . Из опыта известно, что для обратимых
процессов изменение энтропии за цикл равно нулю
. Из опыта известно, что для обратимых
процессов изменение энтропии за цикл равно нулю 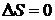 , для необратимых процессов
, для необратимых процессов 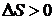 . В общем случае справедливо неравенство
. В общем случае справедливо неравенство 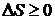 .
.
Это неравенство называют неравенством Клаузиуса.
Рассмотрим изменение энтропии при различных термодинамических
процессах. При переходе из состояния 1 в состояние 2 изменение энтропии
определяется криволинейным интегралом:
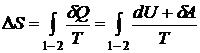 .
.
Учитывая формулы
 и
и
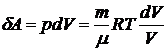 , можем записать
, можем записать
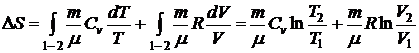 .
.
Отсюда видно, что изменение энтропии не зависит от вида
термодинамического процесса, а определяется начальными и конечными значениями
термодинамических параметров.
Рассмотрим некоторые частные случаи.
) Адиабатический процесс: 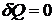 .
.
 .
.
При адиабатических процессах энтропия не изменяется, поэтому такие
процессы называют изоэнтропийными.
) Изотермический процесс: 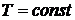
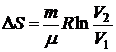 .
.
) Изохорический процесс: 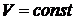
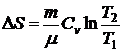 .
.
В статистической физике выясняется физический смысл понятия
энтропии.
Термодинамической вероятностью состояния системы называется число способов,
которыми может быть достигнуто это состояние. Если W - термодинамическая вероятность состояния, то энтропия
определяется формулой
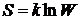 ,
,
где k - постоянная Больцмана. Последнюю формулу
называют формулой Больцмана. Эта формула выясняет статистический смысл понятия
энтропии. Термодинамическая система в состоянии равновесия стремится перейти в
наиболее вероятное состояние. Таким состоянием обычно является самое
неупорядоченное состояние.
Рассмотрим, например, сосуд, содержащий 100 атомов. Рассмотрим
состояние 1, когда все атомы сосредоточены в левой половине сосуда и состояние
2, когда атомы поровну распределены в левой и правой частях сосуда.
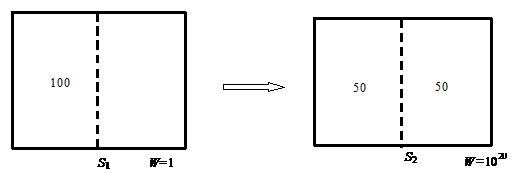
Для состояния 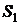 имеем:
имеем: 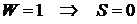 .
.
Для состояния 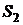 получим после соответствующих вычислений
получим после соответствующих вычислений 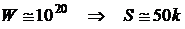 .
.
Можно сказать, что энтропия является мерой неупорядоченности
термодинамической системы. Все системы стремятся перейти от упорядоченного
состояния к неупорядоченному, поэтому энтропия при таких переходах возрастает.
6. Второй и
третий законы термодинамики
Второй закон термодинамики является фундаментальным законом
природы, не имеющим аналога в механике и связан с тем, что статистический
ансамбль состоит из большого числа частиц. Второе начало термодинамики имеет
вероятностный характер и имеет несколько различных формулировок. Приведем эти
формулировки и обсудим их.
1.
Любой
необратимый процесс в системе происходит так, что энтропия системы при этом
возрастает. С вероятностных позиций это означает, что система переходит из
менее вероятного состояния в более вероятное.
2.
Невозможен
круговой процесс, единственным результатом которого является превращение
теплоты, полученной от нагревателя, в работу (Клаузиус). По-другому: тепло
передается от более нагретого тела к менее нагретому.
3.
Невозможен
круговой процесс, единственным результатом которого является передача теплоты
от менее нагретого тела к более нагретому. По-другому: не существует вечного двигателя
второго рода.
Существуют и другие формулировки второго закона
термодинамики. Проанализируем приведенные формулировки. Введем понятия вечного
двигателя первого и второго рода.
Вечным двигателем первого рода называется замкнутая
система, которая может неограниченно производить энергию и передавать ее
наружу.

Такой двигатель противоречит закону сохранения энергии и в природе
существовать не может
Вечным двигателем второго рода называется двигатель, который совершает работу только за
счет охлаждения источника теплоты.
Здесь закон сохранения энергии не нарушается, однако,
многочисленные попытки построить такой двигатель заканчивались неудачей. Позже
в рамках статистической физики выяснилось, что создание двигателя второго рода
эквивалентно самопроизвольному переходу неупорядоченной системы в упорядоченное
состояние, и такие процессы практически неосуществимы.
Аналогично можно показать, что самопроизвольная передача теплоты
от менее нагретого тела к более нагретому позволила бы построить вечный
двигатель второго рода. Существование вечного двигателя второго рода позволило
бы иметь практически неисчерпаемый источник энергии, отбирая, например, теплоту
из океанов.
Первый и второй законы термодинамики можно представить, как
невозможность построить вечные двигатели первого и второго рода.
Третий закон термодинамики: Энтропия равновесной термодинамической системы стремится к
нулю при нулевой абсолютной температуре
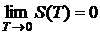 .
.
Этот закон называют теоремой Нернста. Его можно доказать в рамках
статистической физики.
Используя третий закон термодинамики, можно записать
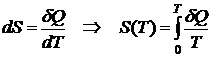 .
.
В частности при изобарном процессе 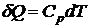 и
и
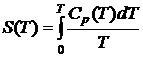 .
.
7. Цикл Карно
Рассмотрим простейшую схему работы теплового двигателя и
холодильной установки. Схематически работу теплового двигателя можно
представить в виде следующей схемы.
Теорема Карно: Из всех периодически действующих тепловых машин, имеющих
температуру нагревателя Т1 и холодильника Т2,
наибольшим КПД обладают обратимые машины. При заданных Т1 и Т2
все обратимые машины имеют один и тот же КПД, независимо от природы рабочего
вещества.
Рассмотрим цикл, состоящий из двух изотерм и двух адиабат
(изоэнтроп). Этот цикл называют циклом Карно. На S - T диаграмме этот цикл имеет вид

Отметим, что на p - V диаграмме график цикла Карно имеет другой
вид.
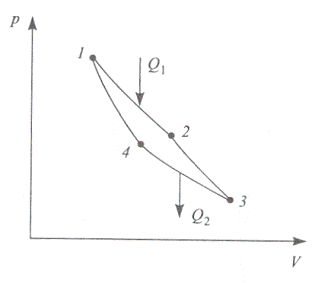
Здесь 1-2 и 3-4 - изотермы, 2-3 и 1-4 - адиабаты. Рассматривая
кривую 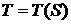 на диаграмме
на диаграмме 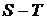 , имеем для элемента площади
, имеем для элемента площади 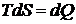 , т.е. площадь под кривой представляет
собой количество тепла, получаемое или выделяемое при заданном процессе. Полное
количество теплоты, получаемое при изменении энтропии от
, т.е. площадь под кривой представляет
собой количество тепла, получаемое или выделяемое при заданном процессе. Полное
количество теплоты, получаемое при изменении энтропии от 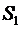 до
до 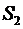 , определяется интегралом
, определяется интегралом
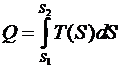 .
.
В цикле Карно количество тепла, получаемое на первой изотерме,
определяется выражением
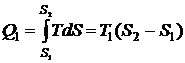 .
.
Аналогично, на участке 3 - 4 выделяется количество тепла
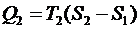 .
.
Найдем КПД цикла Карно. Изменение энтропии на участке 1-2:
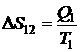 .
.
Соответственно, на участке 3-4:
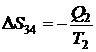 .
.
Минус указывает на то, что тепло система отдает.
Полное изменение энтропии в замкнутом обратимом цикле равно нулю,
следовательно
 .
.
Для КПД можно записать
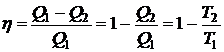 ,
,
т.е. КПД для всех рабочих веществ зависит только от температур
нагревателя и холодильника.
8. Основные
формулы термодинамики
1. Первый закон термодинамики
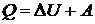 .
.
2. Работа, совершаемая термодинамической системой
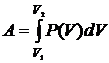 .
.
3. Теплоемкость
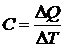 .
.
4. Изохорическая молярная теплоемкость идеального газа
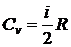 .
.
5. Формула Майера
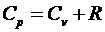 .
.
6. Уравнение адиабаты
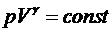 , где
, где
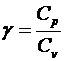 .
.
7. Уравнение политропы
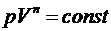 , где
, где 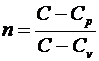 .
.
8. КПД кругового цикла
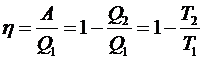 .
.
. Энтропия
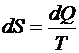 .
.
. Изменение энтропии
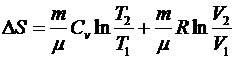 .
.
. Формула Больцмана для энтропии
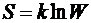 .
.
Список
использованной литературы и источников
1.
Трофимова Т.И. Курс физики, М.: Высшая школа, 1998, 478 с.
.
Трофимова Т.И. Сборник задач по курсу физики, М.: Высшая школа, 1996, 304с
.
Волькенштейн В.С. Сборник задач по общему курсу физики, СПб.: "Специальная
литература", 1999, 328 с.
.
Трофимова Т.И., Павлова З.Г. Сборник задач по курсу физики с решениями, М.:
Высшая школа, 1999, 592 с.
.
Все решения к "Сборнику задач по общему курсу физики" В.С.
Волькенштейн, М.: Аст, 1999, книга 1, 430 с., книга 2, 588 с.
.
Красильников О.М. Физика. Методическое руководство по обработке результатов
наблюдений. М.: МИСиС, 2002, 29 с.
.
Супрун И.Т., Абрамова С.С. Физика. Методические указания по выполнению
лабораторных работ, Электросталь: ЭПИ МИСиС, 2004, 54 с.