Отримання кислот
Вступ
Біотехнологія є однією з
найбільш перспективних і прогресуючих галузей науково-технічної і промислової
діяльності. З її розвитком пов′язано вирішення ряду важливих соціальних,
сировинних, продовольчих і екологічних проблем. Світовий бізнес в біотехнологічній
галузі переживає період підвищення інвес-тиційної активності в науковій,
освітянській та промисловій сферах, стрімко зростає ринок біотехнологічної
продукції медичного, сільськогосподарського та харчового призначення.
Органічні кислоти,
зокрема, лимонна, оцтова та ітаконова є одними з основ-них підкислювачів у
харчовій промисловості, їх частка становить близько 95% обсягу з всіх
вироблених підкислювачів. Особливо широко вони використо-вуються у виробництві
консервних продуктів, безалкогольних напоїв тощо.
Розширюється сфера
застосування лимонної та ітаконової кислот в технічних цілях - в хімічній,
текстильній, шкіряній, металургійній та інших галузях промисловості. Попит на
них безперервно зростає, але в колишніх соціалістичних країнах він задовольняється
вкрай слабко, тому в даний час організовуються нові виробничі потужності з
випуску цих цінних продуктів.
Лимонну, оцтову та
ітаконову кислоту виробляють головним чином шляхом мікробного синтезу, який є
важливою галуззю біотехнології. Актуальними на сьогодні є питання модифікації
існуючих та знаходження нових продуцентів лимонної, оцтової та ітаконової
кислот, впровадження сучасних досягнень біотехнології в область біосинтезу
органічних кислот.
На сьогодні описані
теоретичні і практичні основи мікробного синтезу і механізми регуляції
біосинтезу органічних кислот, їх зв’язок із загальною фізіологією мікробних
клітин.
У роботах ряду авторів
висвітлено багаторічний досвід промислового біосинтезі лимонної, оцтової та
ітаконової кислот. Так, загальнотеоретичні аспекти біологічного синтезу
органічних кислот представлені у працях А. І. Божкова [4], У.Е. Вієстура, І. А.
Шміте та А.В. Жилевича [7], Л.М Гінодмана [9], В.П. Беже-нара й О.М. Хацевича
[12], М.Н. Маненкова і Д.Г. Победенського [15] та інших. Мікробіологічному
процесу отриманню власне лимонної кислоти присвя-чені роботи таких вчених, як
В.М. Фалес, О.В. Хіврич і А.М. Литвиненко [1], О.А. Васильченко та О.О.
П’янкова [6], Л.М. Глазунова і Т.В. Фіногенова [10]. Виробництво оцтової
кислоти шляхом біосинтезу розглянуте С.С. Левушем та Ю.В. Кіт [11], Я.В.
Ластов’яком у співавторстві з Н.С. Караман, М.С. Полутаренко, Ю.А. Паздерським
[20], П.П. Борисовим та М.Д. Пукишем [23]. Проблем біоло-гічного синтезу
ітаконової кислоти у своїх роботах торкалися Л.І. Воробйова [8], Р.Я. Каркліньш
та A.K. Пробок [13], Є.І. Муратова [16], Л.Л. Товажнянський [22] та ін.
Мета дослідження - вивчити особливості процесів біологічного синтезу
лимонної, оцтової та ітаконової кислот, які є характерними для сучасних
промислових процесів.
Об’єкт дослідження - лимонна, оцтова й
ітаконова кислоти як продукти біологічного синтезу.
Предмет дослідження - особливості процесів
біологічного синтезу лимонної, оцтової та ітаконової кислот.
Відповідно до мети, об’єкта і
предмета дослідження визначено наступні його завдання:
− проаналізувати способи, процес і методи біологічного синтезу
лимонної кислоти, її продуцентів;
− охарактеризувати циркуляційний, глибинний та неперервний
комбінований способи біосинтезу оцтової кислоти;
− дослідити продуценти та основні стадії біосинтезу ітаконової
кислоти.
Методи дослідження. У процесі виконання поставлених у роботі завдань
використовувалися методи аналізу наукової і методичної літератури, синтетичний
і дедуктивний методи та метод порівняння.
Структура роботи. Курсова робота складається зі вступу, двох розділів, висновків і
списку використаної літератури, обсяг роботи складає 31 аркуш.
1. Теоретичні засади
біологічного синтезу органічних кислот
1.1 Характеристика
лимонної кислоти та способів її отримання
кислота біологічний
синтез оцтовий
До
початку двадцятих років минулого століття лимонну кислоту отримували з соку
лимонів, таким чином задовольнялося близько трьох чвертей світової потреби в
ній (вихід лимонної кислоти з однієї тонни лимонів становить 25 кг).
Виробництво лимонної кислоти методом ферментації за участю грибів - давно
відомий (з 1893 р.) біотехнологічний процес. Як продукт ферментації лимонна кислота
займає друге місце за об’ємом виробництва у світі (400 тис. тонн на рік, що в
грошовому еквіваленті становить близько 325 млн євро), поступаючись лише промисловому спирту [6, c. 100].
Незважаючи
на значний прогрес у сфері органічного синтезу, на сьогодні лимонну кислоту
отримують мікробіологічним синтезом, а саме шляхом лимонно-кислого
бродіння солодких відходів цукрового виробництва - патоки (меляси),
спричиненого пліснявими грибами роду Aspergillus niger, тому виробництво часто
розташовують спільно з виробництвом цукру. Харчова промисло-вість традиційно є
основним споживачем виробленої таким чином кислоти, оскільки продукти
природного бродіння мають переваги порівняно з хімічно синтезованими та не
містять токсичних для організму людини домішок. Лимонна кислота є
широко-вживаною нешкідливою харчовою добавкою (Е330), крім того, її
застосовують у медицині, кондитерській промисловості, друкарській справі тощо
[1, c. 92].
Одним з
головних завдань у виробництві лимонної кислоти є досягнення її високого
виходу.
Технологія
виробництва кислоти застосовує різні джерела вуглецю та способи культивування
мікроорганізмів (поверхневий та глибинний, періодичний та неперіодичний).
Багато мікроорганізмів нагромаджує лимонну кислоту, зокрема види Aspergillus awamori, A. fenicis, A. fonsecaeus, A. luchensis, A. fumaricus, A. wentii, A. saitoi, A. usami, A. phoenicus, A. lanosus, A. foetidus, A. flavus. У промисловому
виробництві лимонної кислоти широко застосовують гриби A. niger, оскільки цей вид
дає високий вихід цільового продукту, з ним легко працювати, він відносно
недорогий і цим самим робить виробничий процес економічно вигідним. Проте
необхідно взяти до уваги, що до A. niger належить багато штамів, що відрізняються один від одного за своєю
морфологією та біохімічними характеристиками: кольору спор та міцелію, розміру
та кількістю спор, розміру міцелію, утилізації субстрату, ферментаційному часу,
здатності продукувати ли-монну кислоту на різних субстратах [6, c. 103].
Промислове
виробництво лимонної кислоти можна розглядати як процес, що складається з двох
етапів - росту міцелію гриба та синтезу лимонної кислоти. На кожному з етапів
культура чутлива до різних фізико-хімічних факторів, таких як склад та
співвідношення компонентів середовища, аерація, pH середовища, температура тощо. Ефективний вплив тих або інших
факторів, що стимулюють утворення лимонної кислоти грибом А.niger, значною мірою
визначається фізіолого-біохімічними особливостями самої культури, а також
технологічними параметрами процесу культивування [6, c. 106].
Пригнічення
синтезу в повноцінних поживних середовищах, що містять всі необхідні для росту
і розвитку культури компоненти мінерального живлення, та активування синтезу в
умовах лімітації середовища за певними компонентами свідчать про великі
можливості культури до саморегуляції метаболізму залежно від умов
культивування.
Біотехнологія
отримання лимонної кислоти за участю мікроорганізмів охоплює такі основні
етапи:
) отримання
посівного матеріалу;
) підготовка
сировини до ферментації;
) підготовка
та стерилізація повітря;
) ферментація;
) відокремлення
біомаси продуцента від культуральної рідини;
) екстракція
лимонної кислоти з культуральної рідини та отримання її у вигляді кристалів [10, с. 446].
Промислове
виробництво лимонної кислоти можна здійснювати трьома різними способами:
поверхневим культивуванням грибів, глибинним культивуванням і твердофазною
ферментацією, що має назву «процес Коджі».
Поверхневий
спосіб культивування є найпростішим. Він передбачає застосування стерильного
рідкого середовища. Приготування середовища відбувається у спеціальних чанах.
Після стерилізації та охолодження середовище подається насосами до кювет
завтовшки 12-18 см. Кювети розташовуються на стійках в асептичних ферментаційних
камерах, де контролюються такі параметри: температура, початкове та кінцеве
значення рН, час проростання спор, час ферментації, вологість повітря. За
допомогою спеціального обладнання шляхом розпилювання до середовища додають
посівний матеріал - спори A. niger. Спори проростають і
утворюють плівку міцелію. Через добу тонка плівка міцелію набуває сіро-білого
кольору. За декілька днів вона стає товстішою. Початкова температура
підтримується в діапазоні 28-30°С, відносна вологість становить 40-60%. У період активного росту
міцелію температура повинна бути в діапазоні 34-35°С за помірної аерації. У
період активного утворення лимонної кислоти температура знижуєть-ся до 32-34°С, а подача кисню
збільшується в 3-4 рази. Початкове значення рН середовища становить 5,0-6,0, а
кінцеве - 1,0-2,0. Процес ферментації становить 8-12 днів, після чого
культуральна рідина відділяється від біомаси гриба та використовується для
екстракції лимонної кислоти [10, с. 448].
За
глибинного культивування процес ферментації відбувається у спеціальних
біореакторах з мішалкою (ферментерах). Низьке значення рН під час ферментації
та сама лимонна кислота спричинюють корозію, тому внутрішня частина біореактора
виготовляється з матеріалу, стійкого до корозії.
Важливою
умовою у виборі біореактора для виробництва лимонної кислоти є забезпечення
системою аерації, що здатна підтримувати високий рівень роз-чинного кисню [17, c. 327].
Процес
отримання лимонної кислоти з використанням A. niger проводиться в ферментерах об’ємом 100 м3.
Як посівний матеріал використовують конідії гриба в об’ємі 10 м3. Попередньо
до ферментера подають стерильне та охолоджене поживне середовище. Після
проростання спор підсилюють аерацію. За оптимальних умов процес ферментації
становить 5-10 днів за постійної аерації та температури 31-32°С. Необхідним є
додавання піногасника, оскільки під час перемішування утворюється піна.
Твердофазну
ферментацію, або процес Коджі, було розроблено в Японії і вона є найпростішим
способом у виробництві лимонної кислоти порівняно з іншими методами. Як
сировину використовують рисові та пшеничні висівки, фруктові та овочеві
відходи. Зволожений субстрат стерилізується, розливається у кювети та інокулюється спорами гриба. На початку
ферментації рН становить 5,5. Ферментація триває 4-5 днів [10, c. 449].
Поверхневий
та глибинний методи продовжують співіснувати, але на сьогодні значну увагу
надають глибинному методу. Глибинний метод дає змогу застосовувати широкий
набір вуглецевмісної сировини. До того ж ферментація ведеться в стерильних
умовах, що є важливою передумовою для переходу на безперервний, повністю
механізований процес.
За
глибинного методу швидкість ферментації є високою - в одному апараті
(біореакторі) одразу утворюється велика кількість культуральної рідини, а за
поверхневого - вона збирається по численних кюветах. Поверхневий спосіб має
такі переваги: висока концентрація лимонної кислоти у культуральній рідині;
значно менше утворюється побічних кислот, внаслідок чого зменшуються затрати
меляси на ферментацію та легше виділити лимонну кислоту в чистому вигляді, і як
наслідок - низька собівартість лимонної кислоти, низькі затрати енергії на
виробничий процес [6, c. 109].
Витрати
на обслуговуючий персонал більші за поверхневого способу, оскільки підготовка
камер і зняття міцелію з кювет потребує значних затрат ручної праці. Перевагами
твердофазної ферментації є низькі затрати на утилізацію відходів та низькі
енергозатрати, високий вихід продукту, низький рівень контамінації через
високий рівень вологості в біореакторі, використання поживного середовища
спрощеного складу.
Вадами
такого методу ферментації є труднощі, які виникають під час контролю рН та
складу поживного середовища, високі затрати на виділення кислоти в чистому
вигляді через високий вміст домішок у продукті.
Поживне
середовище для біосинтезу лимонної кислоти має містити джерела вуглецю, азоту,
фосфору та мікроелементів, що є необхідними для росту продуцента-мікроорганізму
та для самого процесу нагромадження лимонної кислоти.
Вид
джерела вуглецю та його концентрація мають великий вплив на вихід лимонної
кислоти. Зазвичай, лимонну кислоту виготовляють шляхом ферментації з
використанням дешевої та неочищеної природної сировини, такої як гідролізат
крохмалю, бульйон цукрової тростини, меляси, рослинних відходів сільського
господарства і механічного перероблення деревини. Переважно як джерело вуглецю
для мікробного виробництва лимонної кислоти використовують мелясу завдяки її
низькій вартості та високому вмісту цукру (40-55%), достатньої кількості
мікроелементів, амінокислот та вітамінів, необхідних для нормальної
життєдіяльності продуцента. Меляса - побічний продукт цукрового виробництва, що
утворюється внаслідок відділення кристалів сахарози на центрифугах під час її
кристалізації [27, c. 98].
Меляса
переважно (на 65-80%) складається з сухих речовин, а 20-25% становить вода.
Якісний та кількісний склад меляси значно варіює, тому не всі види меляси
придатні для виробництва лимонної кислоти. Склад меляси залежить від різновиду
цукрових буряків, технології виробництва цукру, умов зберігання та
транспортування (виду транспорту, температури).
У
мелясі є мікроелементи, кількість яких сильно коливається, що може впливати як на ріст
продуцента, так і на вихід лимонної кислоти. Вміст мікроелементів у мелясі
залежить від різновиду цукрових буряків. Алюміній, залізо та стронцій можуть
міститися як в макро-, так і мікрокількостях.
Вміст
амінокислот у мелясі залежить від клімату, типу ґрунтів, умов культивації
цукрового буряку [27, c. 99].
Вітаміни
важливі для стимуляції росту продуцента та біосинтезу ли-монної кислоти.
У
мелясі є також інші речовини, що містяться в малих кількостях, але дос-татніх
для того, щоб мати негативний вплив на синтез кислоти. Це пестициди, фунгіциди
та гербіциди, що використовуються у вирощуванні цукрових буряків, а також
речовини, які застосовуються як піногасник у процесі виробництва цукру. Ці
речовини є токсичними, тому перед використанням меляси як сировини її очищують
хімічним шляхом.
Через
високий вміст глюкози (40-45%) як субстрат можливе застосування гідролю. Це
побічний продукт, що утворюється під час виробництва кристалічної глюкози з
крохмалю.
За
концентрації метанолу 1,5% та етанолу 1% у середовищі продуцентом A. niger М-101 отримується 49,33 г./л та 40,85 г./л лимонної кислоти відповідно. Мета-нол та етанол в оптимальних
умовах збільшують проникність клітинної мембрани A. niger М-101, що призводить до нагромадження лимонної кислоти в середовищі.
Використання
відходів сільського господарства є економічно вигідним та дає змогу вирішувати
екологічні проблеми. У табл. 1 наведено вихід лимонної кислоти різними штамами Aspergillus niger з використанням
відходів сільського господарства та харчової промисловості [8, c. 52].
Таблиця 1. Біосинтез лимонної кислоти з використанням відходів
сільського господарства та харчової промисловості
|
Субстрат (харчові відходи)
|
Продуцент A.
niger (UV 60)
|
Вихід лимонної кислоти 45,5 г/л
|
|
Пшеничні висівки
|
A. niger CFTRI 30
|
85 г./кг
|
|
Меляса
|
A. niger ATCC 942
|
35 г./л
|
|
Жом цукрової тростини
|
A. niger CFTRI 30
|
174 г./кг
|
|
Рисові висівки
|
A. niger CFTRI 30
|
127 г./кг
|
Оскільки
число біодизельних заводів у світі, зокрема в Україні, росте, гліцерин як
відхід виробництва біопалива стає легко доступним у великому промисловому
масштабі. Низька ціна неочищеного гліцерину робить його привабливою сировиною для виробництва
лимонної кислоти. Виключно важлива роль у процесі мікробіологічного синтезу
лимонної кислоти належить азоту, що є важливим не тільки для підтримки певного
рівня метаболізму клітини, а й входить до складу клітинних білків. Його дефіцит
є одним із основних чинників, що зумовлює нагромадження в середовищі лимонної
кислоти, оскільки за цих умов затримується ріст міцелію і формування біомаси.
У разі
використання меляси, потреба в додаванні азоту до середовища відпадає, оскільки
меляса містить достатню кількість органічних і неорганічних сполук азоту. Азот
меляси існує у вигляді бетаїну (близько 60-70% від загального азоту),
амінокислот (20-30% азоту), білків (3-4% азоту), а також у вигляді нітрату
амонію та аміду. Оптимальна концентрація азоту в середовищі, необхідного для
синтезу лимонної кислоти, становить 0,1-0,4 г/л [8,
c. 54].
Високий
вихід лимонної кислоти (89,64 г./л) можна отримати за
концентрації NH4NO3 у середовищі 0,2%. У разі збільшення або зменшення цієї концентрації
відбувалося пригнічення росту гриба і, як наслідок - низький вихід лимонної
кислоти [8, c. 59].
Фосфор,
як і азот, - один із основних елементів харчування. Фосфор відіграє важливу
роль у метаболізмі мікроорганізму. Він входить до складу нуклеїнових кислот,
фосфопротеїнів, фосфоліпідів та ряду коферментів, що беруть участь у синтезі
АДФ та АТФ, у розмноженні клітин і продукуванні первинних та вторинних
метаболітів. Джерелом фосфору може бути ортофосфорна кислота, її солі та
фосфоровмісні сполуки. Під час виробництва лимонної кислоти до поживних
середовищ зазвичай додають гідрофосфат калію у концентрації 0,06-0,32 г./л, що,
своєю чергою, слугує ще й джерелом калію. За нестачі фосфору в середовищі
порушується засвоєння грибом азоту та сповільнюється синтез вітамінів (тіаміну,
рибофлавіну та нікотинової кислоти). Надлишок фосфору зумовлює посилення
газообміну та зниження активності кислотоутворення. Оптимальна концентрація
фосфору в середовищі для гриба становить від 0,5 до 5,0 г/л [1, c. 94].
.2 Аналіз принципів і
способів отримання оцтової кислоти
Світове виробництво
оцтової кислоти складає близько 8,8 млн т (станом на 2010 р.). В основному вона
виробляється синтетично: карбонуванням метанолу (більше 60%) і окисленням
ацетальдегіду або етилену. Головними напрямками використання оцтової кислоти є
одержання вінілацетату, ацетатів целюлози складних ефірів (ацетатів), очищеної
терефталевої кислоти. Важливою областю застосування оцтової кислоти є харчова
промисловість, потреба якої задово-льняється ферментативно одержуваною оцтовою
кислотою - оцтом [23, с. 64].
Біохімічний оцет -
продукт життєдіяльності оцтовокислих бактерій. Розрізняють спиртовий (білий),
яблучний (сидровий) та винний оцти. Світове виробництво оцту становить близько
1 млн л.
Спиртовий оцет виготовляють
на основі суміші води й етанолу з додаванням у середовище солей фосфору, азоту,
калію та біологічних стимуляторів (витяжки солодових паростків, дріжджової
витяжки тощо). Яблучний натуральний оцет одер-жують на основі зброженого яблучного соку. Органолептичні
показники і поживна цінність яблучного оцту набагато вища, ніж спиртового.
Винний оцет має найкращі смакові якості; його випускають на основі сухих
виноградних вин [20, c. 47].
Крім того, оцет
одержують з ячмінного сусла (сусловий), зброженої сироватки (сироватковий),
зброжених цукрових розчинів (цукровий), зброжених глюкозних розчинів
(глюкозний), зброженого оцукрованого рисового крохмалю (рисовий).
Оцтову кислоту при
біологічному синтезі можна отримати 4 способами.
. Окислювання етанолу
оцтовокислими бактеріями. Бактерії родів Acetobacter (A.aceti; A.xylinum;
A.peroxydans) і Gluconobacter (G.oxydans) здатні асимілювати вуглеводвмісні та
спиртовмісні субстрати, накопичуючи в культуральній рідині значну кількість
ацетату. Вони характеризуються специфічними культуральними та фізіологічними
властивостями:
− висока ацидофільність, ростуть при рН 4,0; оптимум 5,0-6,0;
− бактерії - строгі анаероби, підвищена чутливість до дефіциту кисню
пов’язана з активністю ферменту апірази, під дією якого АТФ швидко
гідролізується і стає недоступною для метаболізму клітин;
− виражена здатність окислювати органіку у частково окислені
продукти, найбільш характерна здатність окислювати етанол в оцтову кислоту.
Схема
біосинтезу оцтової кислоти:

На першому етапі етанол
окислюється до ацетальдегіду при участі НАД (НАДФ) - залежної
алкагольдегідрогенази, далі відбувається гідратація ацетальдегіду і повторне
окислення, каталізоване НАД (НАДФ) - залежною ацетальдегідрогеназою.
Оптимальними умовами
біосинтезу оцтової кислоти бактеріями Acetobacter aceti є:
− температура
30є; рН 5,0-6,0;
− інтенсивна
аерація середовища;
− відношення
вихідного субстрату - етанол і оцтова кислота в співвідношенні 5,5%:7,5% [11, c. 207].
. Бактерії Cl.aceticum,
Cl.thermoautofrophicim, Eubacterium limosum та інші види здатні в анаеробних
умовах утилізувати гексози, пентози і молочну кислоту, утворюючи ацетат як
єдиний продукт метаболізму. Деякі види цієї групи, наприклад Acetoanaerobicum
woodii, Cl. thermoaceticum та Cl. formiaceticum, здатні синте-зувати оцтову
кислоту в результаті асиміляції мурашиної кислоти й фіксації СО2.
Оптимальні умови
біосинтезу оцтової кислоти Cl. thermoaceticum:
− температура
60є;
− рН
6,7-7,4;
− умови
строго анаеробні [11, c. 208].
. Біосинтез оцтової
кислоти молочнокислими бактеріями за механізмом гетероферментативного
молочнокислого шумування з фіксацією СО2, однак цей метод не
перспективний для одержання оцтової кислоти як цільового продукту [12, c. 133].
. Біосинтез оцтової кислоти
за механізмом пропіоновокислого шумування. Каталізаторами пропіоновокислого
шумування є бактерії роду Propionibacterium (P. shermanii; P. pentosaceum; P.
prendenreichii) і деякі види клостридій (Cl.propionicum). Специфічною
властивістю даної групи факультативно анаеробних мікроорганізмів є здатність
асимілювати гексози і, рідше, пентози з утворенням пропіонової та оцтової
кислот [17, c. 241]:
3С6Н12О6
+ 8АДФ +8Н3РО4 4СН3СН2СООН + 2СН3СООН
+ 2СО2+ 8АТФ
1.3 Властивості і
застосування ітаконової кислоти
Ітаконова кислота
(метиленбутандіова кислота, метиленянтарна кислота, 3-карбокси-3-бутенова
кислота, пропілендикарбонова кислота) є однією з перспективних сполук, які
відносяться до класу дикарбонових кислот.
Фізико-хімічні
характеристики ітаконової кислоти (C5H4O4)
наступні: M=130,1, Тплав=167-168°С, Ткип=268°С,
розчинність у воді 83,1 г/л, рН водяного розчину (80 г./л), рKа 3,84
ы 5,5.
Ітаконова кислота може
розглядатися як б-заміщена акрилова або метакрилова кислота, вона є ізомером
цитраконовоъ і мезаконовоъ кислот. Сполука стабільна в кислому, нейтральному і
слаболужному середовищах при помірних температурах [3, c. 219].
Внаслідок наявності двох
карбоксильних груп, використання її як сомономера навіть за низької
концентрації приводить до утворення латексного сополімера з ефективною
кислотністю а, отже, з кращою адгезією і підвищеною стабільністю.
Ітаконова кислота
використовується або як кислота, або у вигляді ефірів для поліпшення
властивостей вінілових полімерів.
Значна частка ітаконової
кислоти використовується у вигляді складних ефірів, одержання яких ґрунтується
на реакції зі спиртами самої кислоти або її ангідриду в присутності кислотного
каталізатора з виходами до 80%, властивості деяких з них наведені в табл. 3.
Таблиця 3.
Фізико-хімічні властивості ефірів ітаконової кислоти
|
Сполука
|
Ткип,°С/мм рт. ст.
|
Тплав,°С
|
nD
|
d20
|
|
б-Монометилітаконат
|
131/10
|
-
|
1,4532
|
1,0980
|
|
в-Монометилітаконат
|
149/10
|
64
|
-
|
-
|
|
б - Моноетилітаконат
|
140/10
|
-
|
1,4444
|
1,0574
|
|
в - Моноетилітаконат
|
156-160/12
|
41
|
-
|
-
|
|
б - Монопропилітаконат
|
146-148/10
|
-
|
1,4440
|
1,0566
|
|
в - Монопропилітаконат
|
140-143/13
|
-
|
1,4530
|
1,0605
|
153-154/10
|
-
|
1,4557
|
1,0539
|
|
в - Монобутилітаконат
|
156-159/13
|
-
|
1,4550
|
1,0503
|
|
Диметилітаконат
|
108,5/10
|
29
|
1,4480
|
1,1240 (30°С)
|
|
Диетилітаконат
|
136/10
|
-
|
1,4413
|
1,0607
|
|
Дипропілітаконат
|
117,5/11
|
-
|
1,4307
|
1,0043
|
|
Дибутилітаконат
|
135,5/10
|
-
|
1,4430
|
0,9865
|
|
Метилетилітаконат
|
120,5/13
|
-
|
1,4450
|
1,1354
|
|
Дициклогексилітаконат
|
170/50
|
-
|
1,4840
|
1,0590
|
|
N-Бутилітаконамід
|
-
|
107-108
|
-
|
-
|
|
N-Бутилітаконимід
|
115-120/15
|
-
|
-
|
-
|
|
N-Фенілітаконимід
|
-
|
96-97
|
-
|
-
|
|
N-Бензилітаконимід
|
170-173/20
|
59-60
|
-
|
-
|
Оскільки кислотність
СООН в б-положенні нижча (Кб = 3,56 · 10-6), ніж у
в-положенні (ДОб = 1,4 · 10-4), що пов’язано з впливом
подвійного зв’язку, при етерифікації ітаконової кислоти спиртом утворюються
лише в-моно- і диефіри ітаконової кислоти [3, c. 223].
Полімеризовані метилові,
етилові або вінілові ефіри використовуються у якості пластиков, адгезивів і
покриттів.
Сополімери ітаконової
кислоти дають гумоподібні смоли високої міцності й еластичності, а також
водонепроникні покриття з високими електроізоляційними властивостями.
Сополімери
бутадієн-стиролу з добавкою 1-5% ітаконової кислоти показують підвищену адгезію
і використовуються при виробництві килимових і паперових покриттів [27, c. 191].
Акрилові полімери з
додаванням ітаконової кислоти використовуються при виробництві нетканих
матеріалів.
Невеликі кількості
(<2%) ітаконової кислоти, які додають до покриттів на основі
вініліденхлориду, надають поліпшену адгезію паперу, целофану і
поліетилентерефталатним плівкам, які використовуються як пакувальні матеріали і
в фотографії.
Сополімери
поліакрилонітрилу, які мають низький вміст ітаконової кислоти, поліпшують
сприйнятливість до фарбування, що важливо при використанні їх у текстильній
промисловості [15, c. 164].
Ітаконова кислота може
також використовуватися як зміцнюючий агент в органосилоксанових полімерах, які
застосовуються у виробництві контактних лінз.
Сполуки на основі
моноефірів ітаконової кислоти мають дуже високу твердість, стійкі щодо
стискання і довговічні, тому вони є гарним матеріалом у стоматології.
Деякі моно- і диефіри
ітаконової кислоти мають істотні антизапальні або болезаспокійливі властивості.
Ряд моноефірів впливають на ріст рослин.
Важливою є реакція
ітаконової кислоти з амінами, яка приводить до утворення N-заміщених
піролідонів, що можуть використовуватися як загущувачі в мастилах і мийних
засобах, фармацевтичних препаратах і гербіцидах.
.1 Біологічний синтез
лимонної кислоти
Продуцент
лимонної кислоти повинен мати певні характеристики, а саме:
− високу
швидкість кислотоутворення;
− високий
ступінь трансформації джерела вуглецю у лимонну кислоту;
− генетичну
однорідність та стабільність;
− толерантність
до зміни температури та контамінантів середовища, зокрема до високих
концентрацій вуглеводів [14, c. 74].
Під час
культивування продуценту має бути низький вихід побічних продуктів (щавлевої,
глюконової кислот, невикористаних вуглеводів). Перерахованим критеріям, крім Aspergillus niger, відповідають
гриби Triho-derma viride, Penicillium janthinellum, дріжджі Candida tropicalis, C. olephila, C. citroformans, Yarrowia lipolytica, бактерії Corynebactreium, Arthrobacterium, Brevibacterium, Bacillus licheniformis [1, c. 94].
Біосинтез
лимонної кислоти - це регульований процес, який значною мірою залежить від складу
поживного середовища та його фізико-хімічних параметрів. Лимонна кислота є
первинним метаболітом A. niger. Зазвичай, первинні метаболіти необхідні для росту та
життєдіяльності продуценту.
Метаболічним
шляхом вироблення лимонної кислоти в аеробних організмів є цикл трикарбонових
кислот (ЦТК). Внаслідок гліколізу з глюкози формується дві молекули
піровиноградної кислоти (пірувату). Далі відбувається ферментативне зв’язування
однієї молекули пірувату з діоксидом вуглецю з утворенням оксалацетату
(щавлевооцтової кислоти):

Внаслідок
окисного декарбоксилювання іншої молекули пірувату утворюється ацетил-КоА:
CH3COCOOH + NAD+ + HSКoA CH3CO~SКoA
+ NADH + H+ + CO2
ЦТК
починається з реакції конденсації оксалацетату з ацетил-КоА, внаслідок якої за
участі ферменту цитратсинтази утворюється лимонна кислота:

Вплив
різних концентрацій нітрату амонію (як джерела азоту для росту міцелію) на
синтез лимонної кислоти штамом Aspergillus niger GCBT7 показано на рис. 1.
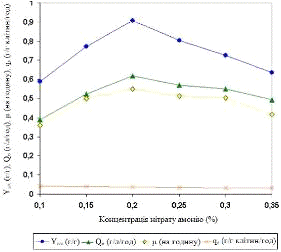
Рис. 1.
Вплив різних концентрацій нітрату амонію на синтез лимонної кислоти штамом Aspergillus niger GCBT 7
(процес
ферментації проводять за температури 30°С
та первинного вмісту
цукру 150 г./л. Ферментаційний період - 6 год.
Yв/с = г вихід
лимонної кислоти / г спожитого субстрату, Qo = г отриманої лимонної кислоти /
л / год, µ (год-1) =
питома швидкості росту, qs= г
спожитого субстрату / г клітин / год.
Окрім
фосфору необхідними елементами в мікрокількостях є сірка, калій, кальцій.
Певний вплив на процес синтезу лимонної кислоти мають марганець, залізо та
фосфор, магній та мідь. Марганець у концентрації 3 мг/л сильно зменшує вихід
лимонної кислоти. Міцелій гриба, що росте на середовищі з цинком, продукує
більше лимонної кислоти, ніж у середовищі без цинку. Вміст цинку має
підтримуватися на рівні 1,5·10-4% (у розрахунку на ZnSO4).
Достатня
для росту гриба та синтезу лимонної кислоти концентрація заліза становить 2·10-6%.
За високого вмісту заліза в середовищі відбувається гальмування біосинтезу
лимонної кислоти. Магній необхідний як для росту гриба, так і для нагромадження
лимонної кислоти. Оптимальною концентрацією сульфату магнію є 0,02-0,025% [6, c. 106].
Значний
вплив на синтез лимонної кислоти та самого продуцента має рН. Початкове
значення рН має бути чітко визначеним та оптимізованим залежно від
мікроорганізму, середовища та технології виробництва. Процес ферментації
розпочинається з проростання спор гриба, тому оптимальним рН середовища на
початку ферментації має бути 5,0. Для продукування лимонної кислоти рН має бути
низьким (рН≤2), що знижує ризик зараження продуцента та фермен-таційного
середовища патогенними мікроорганізмами, інгібує виробництво небажаних
органічних кислот (глюконової, щавлевої) та значно полегшує процес виділення
лимонної кислоти з маточного розчину. Оптимальне рН для синтезу лимонної
кислоти становить 1,0-2,0. Збільшення рН до 4,5 на стадії синтезу лимонної
кислоти знижує вихід кислоти на 80%. рН мо-же змінюватися у відповідь на метаболічну активність продуцента. Aspergillus niger, Penicillium sp., Rhizopus sp. швидко знижують рН (рН<3). Для інших родів грибів (Trichoderma, Sporotrichum, Pleurotus) рН є стабільним у
межах 4,0-5,0 [6, c. 107].
Рівень
аерації може мати згубний вплив на вихід продукту. Оскільки виробництво
лимонної кислоти - це аеробний процес, тому постачання кисню має значний вплив на
виробничий процес. Аерація має відбуватися протягом всього ферментаційного
процесу з однаковою інтенсивністю. Високий рівень аерації призводить до
утворення піни, особливо у період росту міцелію, тому необхідно застосовувати
піногасники. СО2 є субстратом для ферменту піруваткарбоксилази, який поповнює пул
оксалацетату в ЦТК. Підвищений рівень СО2
має негативний вплив на кінцеву концентрацію цитрату та біомаси.
Протягом
всього процесу ферментації необхідно підтримувати оптимальну температуру. Вища
за оптимальну температура призводить до денатурації ферментів, надмірної втрати
вологи, пригнічує ріст продуцента, тоді як низька температура призводить до
зниження метаболічної активності. Більшість гіфоміцетів, до яких належить A. niger, є мезофілами, і тому оптимальною температурою для них є 25-35°С [6, c. 107].
Час
ферментаційного процесу залежить від штаму, що використовується, хімічного
складу середовища, ферментаційної системи і, зазвичай, від умов, за яких
відбувається ферментація. За поверхневого способу виробництва процес
ферментації завершується через 10-20 днів, тоді як за глибинного способу -
через 5-10 днів. Збільшення періоду ферментації не підвищує виходу лимонної
кислоти.
Отже,
біосинтез лимонної кислоти охоплює реакції гліколізу та низку реакцій,
замкнених в ЦТК, що у еукаріотів, зокрема й A. niger, відбувається в
мітохондріях. Після синтезу цитрат може бути виділений з клітини, якщо
перешкоджати наступному етапу ЦТК - утворенню ізолимонної кислоти.
.2 Характеристика
способів біосинтезу оцтової кислоти
Циркуляційний, або
періодичний, спосіб. Спиртовмісна рідина безупинно (протягом доби - до повного
окислювання спирту) циркулює в окислювальному апарату, заповненому носієм. При
досягненні вмісту спирту 0,15-0,3% готовий оцет відкачують з окислювача.
Переваги циркуляційного способу: заміна багаточанової системи одним великим
окислювачем, збільшення продуктивності до 6-8 кг оцтової кислоти/1 м3
наповнювача [5, c. 83].
Для підтримки
оптимального температурного режиму (29-31°С) апарати обладнують виносними
теплообмінниками типу «труба в трубі» або внутрішніми змієвиковими
теплообмінниками, розташованими в збірнику окислювача.
Носієм (наповнювачем) у
циркуляційному способі можуть бути деревна стружка з букової, грабової або
березової деревини, деревне вугілля, пемза, кокс, рубані кукурудзяні качани
(табл. 2). Найкращий наповнювальний матеріал - букова стружка.
Таблиця 2. Вбираюча
здатність наповнювачів
|
Наповнювач
|
Маса 1 м3, кг
|
Вбираюча здатність, л/м3
|
|
Букова стружка
|
180-225
|
360-450
|
|
Березова стружка
|
160
|
200
|
|
Деревне вугілля
|
270
|
280
|
|
Пемза
|
430
|
260-370
|
|
Кокс
|
450
|
80
|
|
Зв’язування хмизу
|
50-60
|
25-30
|
|
Рубані кукурудзяні качани
|
130-160
|
350-430
|
Розміри стружки залежать
від об’єму наповнювача, завантаженого в апарат (табл. 3). Укладати стружку в
апарат бажано не горизонтально, а вертикально - у вигляді «троянд» з 5-10
зв’язаних спіралей, що підвищує її опір стисненню [5, c. 84].
Таблиця 3. Залежність
розмірів стружки від об’єму окисного апарата
|
Об’єм наповнювача в апараті, м3
|
Характеристика стружки, мм
|
Заготівля дошки, мм
|
|
довжина
|
діаметр
|
товщина зрізу
|
довжина
|
товщина
|
|
1
|
35
|
20-23
|
0,8-0,9
|
400
|
35
|
40
|
30
|
0,8-1,0
|
450
|
40
|
|
15
|
40-45
|
35
|
1,0-1,2
|
500
|
45
|
|
30
|
45-50
|
40-42
|
1,0-1,2
|
600
|
50
|
Оптимальна величина
протоку циркулюючої рідини становить 400-500 л/м3 стружки на годину.
При більш інтенсивному зрошенні починається вимивання бактерій з наповнювача.
Концентрація етанолу в
суслі становить 10,6-11,0%. Сусло змішують із ПС (поживним середовищем) і після
підігріву (25-26°С) подають у зрошувальний пристрій, розташований у верхній
частині окислювача над стружкою. Температуру (у верхній частині 28-30°С, у
нижньої 30-32°С) підтримують охолодженням циркулюючої рідини в теплообміннику.
Повітря надходить під нижнє псевдоднище, проходить через наповнювач,
насичується парами етанолу і оцтової кислоти і йде в рекуператор-абсорбер, де
він промивається водою, яка використовується для приготування поживного
середовища [20, c. 77].
Тривалість циклу
окислювання - 3-4 доби. При досягненні концентрації спирту 0,2-0,3% роблять
знімання готового оцту з масовою часткою оцтової кислоти 9,0-9,5 мас.%.
Сирий оцет направляється
в пастеризатор для термічної обробки (85°С) з метою інактивації ОКБ і
сторонньої мікрофлори. Потім оцет прохолоджується, фільтрується, і вміст
кислоти в ньому доводить до 9,0%.
Глибинний спосіб. Процес
одержання оцту глибинним безперервним способом здійснюється у послідовно
з’єднаних культиваторах, у яких підтримуються оптимальні умови життєдіяльності
ОКБ.
При глибинному
культивуванні необхідно безперервне перемішування ПС для підтримки потрібної
концентрації кисню в рідкій фазі.
Для засіву робочих
культиваторів використовують чисту культуру (ЧК) ОКБ, вирощену в лабораторних
умовах, яких розмножують послідовно в культиваторах ЧК об’ємом 0,03 й 1,0-1,5 м3 [20, c. 79].
Культуральну рідину
вносять в апарати батареї з корисним об’ємом 6 або 10 м3. У перший
апарат безупинно подають поживне середовище зі швидкістю, яка забезпечує
підтримку концентрації оцтової кислоти 4,0-4,5%. Після засіву останнього
культиватора і заповнення поживним першим середовищем апарата здійснюють
перетік ПС у наступні культиватори батареї.
По моменту перетоку з
першого культиватора в останній концентрація оцтової кислоти в об’ємах по
апаратах батареї становить, про.%: I - 4,0-4,2; II - 6,2-6,5; III - 7,6-8,0; IV
- 8,5-8,6; V - 9,0-9,2.
У перший апарат
подається поживне середовище з сумарною концентрацією етанолу й оцтової кислоти
6%. В інші культиватори вводять поживну суміш, що містить 40% етанолу та
1,0-2,0% оцтової кислоти. З останнього культиватора батареї виводиться повітряно-водна
емульсія сирого оцту, після відділення повітря в циклоні суміш збирається у
збірнику [20, c. 84].
Далі сирий оцет
освітлюється за допомогою бентоніту, очищується фільтруванням і направляється
на купаж, після чого проводиться розлив.
Безперервний
комбінований спосіб - одночасно застосовуються циркуляційний і глибинний
способи культивування ОКБ, одна частина яких імобілізована на буковій стружці
циркуляційної секції окислювача, а друга перебуває в ПС нижнього відділення
апарата.
Аерація ПС забезпечує
життєдіяльність ОКБ у глибинних шарах. При циркуляції ці ОКБ разом з рідиною
знову повертаються у верхню частину апарату і повторно беруть участь в
окислювальному процесі. У даному способі застосовується типове лабораторне
обладнання циркуляційної схеми, а в збірнику кожного окислювача розміщується
кільцевий барботажний аератор. Одночасно працюють 4 окислювачі, об’єднані в
батарею переточними трубами, по яких ПС переміщається з апарата в апарат.
Сусло має наступний
склад (%): этанол - 10,2-10,6, гідроортофосфат амонію - 0,1, карбонат калію -
0,01, сульфат амонію - 0,05, витяжка солодових паростків - 0,8, сульфат магнію
- 0,01, хлорид магнію - 0,003 [20, c. 85].
Технологічний процес
підтримують при температурі 30-32°С, витраті повітря на аерацію 3-5 м3/год
на 1 м3 букової стружки та інтенсивності циркуляції ПС в окислювачах
0,4-0,5 м3/год на 1 м3 букової стружки. Батарея
окислювачів працює в режимі, наведеному в табл. 4.
Таблиця 4. Режим роботи
апаратів батареї окислювачів при безперервному комбінованому режимі
|
Апарати
|
Коефіцієнт розведення сусла, ч-1
|
Концентрація кислоти, мас.%
|
Концентрація етанолу, %
|
|
I
|
0,008-0,010
|
7,6-7,8
|
1,5-1,75
|
|
II
|
0,007-0,008
|
8,4-8,5
|
1,10-1,20
|
|
III
|
0,005-0,007
|
8,6-8,7
|
0,65-0,68
|
|
IV
|
-
|
9,0-9,2
|
0,15-0,20
|
У I окислювач батареї
безупинно подають сусло зі швидкістю 60 л/год. Зі збірника I окислювача частина
культуральної рідини передається в II окислювач у кількості, рівній припливу в
I окислювач. Додатково в цей окислювач подають 50 л/год сусла. Зі збірника II
окислювача ПС зі швидкістю 110 л/год надходить на циркуляцію у всмоктувальний
трубопровід відцентрового насоса III окислювача. З останнього апарата
періодично (через 18-19 год.) відкачують сирий оцет для фільтрації, купажу і
розливу [20, c. 86].
Технологічні показники
роботи комбінованої схеми: знімання безводної оцтової кислоти з 1 м3
букової стружки - 13 кг на добу, витрати етанолу - 103 дал/1000 дал оцту з
концентрацією 9,0 мас.%, вихід сирого оцту - 87-88 мас.%.
2.3 Аналіз біосинтезу
ітаконової кислоти
Ітаконова (метиленянтарна)
кислота - ненасичена двоосновна кислота, яка може бути отримана хімічним (з
лимонної або аконітової кислоти) або мікробіологічним способом.
Ітаконова кислота є
продуктом метаболізму вуглеводів грибами роду Aspergillus. Продуцентами кислоти
у промисловості є спеціально селекціоно-вані штами A. terreus, які, на відміну
від A. itaconicus, не розкладають ітаконову кислоту [16, c. 8].
Ітаконова кислота, на
відміну від лимонної, є токсичним для мікроорганізмів продуктом. При
концентрації її в середовищі близько 70 г./л спостерігається пригнічення росту
продуцента і синтезу продукту. Уникнути токсичної дії при накопиченні кислоти
можна нейтралізацією її за допомогою NH4OH. Періодичне введення NH4OH
і підтримка значення рН середовища на рівні 3,8 забезпечує нагромадження до
150-200 г./л ітаконової кислоти.
Характерна особливість
процесу синтезу ітаконової кислоти за допомогою A. terreus - необхідність
внесення в середовище високих концентрацій іонів таких металів, як Zn2+,
Mg2+ і Cu2+ [25, c. 479].
Для приготування
інокуляту спори грибів пророщують у рідкому або щільному середовищі, яке
містить мелясу з кінцевою концентрацією 15%, ZnSO4 - 1,5 моль, MgSO4
· 7H2ПРО - 5,0 моль, CuSO4 · 5H2O - 0,02 моль,
соєве масло - 0,25 моль, воду - до 1 л. Інкубацію проводять з аерацією (0,25
об’єму повітря на 1 об’єм рідини) і сильним перемішуванням. У таких умовах
спори проростають, утворюється міцелій, рН знижується з 7,5 до 4,0.
В Україні розроблена
технологія виробництва ітаконової кислоти методами поверхневого і глибинного культивування.
У результаті багатоступінчатої обробки природного штаму мутагенами і наступним
відбором селекціоновано ряд високоактивних мутантів A. terreus, один з них
(ЕУУ-417) використовується для виробництва ітаконової кислоти на підприємствах
[8, c. 90].
Для одержання високого
виходу ітаконової кислоти необхідним є лімітування середовища за фосфат-іонами.
Процес синтезу
ітаконової кислоти аналогічний процесу одержання лимонної кислоти. Найкращими
субстратами для культивування є глюкоза і сахароза, однак у промисловості
використовують, в основному, мелясу, попередньо оброблену іонітами або
фероціанідом, а також гідролізований крохмаль. Процес проводять в умовах
обмеження росту гриба мінеральними компонентами середовища (залізом і фосфором)
при низькому рН середовища і достатньому забезпеченні киснем. Оптимальна
температура культивування складає 37°С. Найчастіше використовується глибинний
метод.
У якості посівного
матеріалу при поверхневому і глибинному методах ферментації у промисловості
використовують сухі конідії гриба, відокремлені від міцелію і змішані з
активним вугіллям або стерильним грунтом.
При поверхневому способі
процес ферментації здійснюється у кюветах за беззмінним варіантом без долива
або з доливом. Як джерело вуглецю використовують бурячну мелясу або гідролізат
деревини - подвійне з’єднання глюкози з NaCl. Раціональна концентрація цукру
становить 8%. Крім того, середовище містить NH4NO3, MgSO4
· 7H20, ZnSO4 · 7H2O, K4Fе(СN)6
і кукурудзяний екстракт. Початкове значення рН середовища - 5,0. Важливим
фактором є повітряний режим в «бродильній камері»
[80, c. 91].
При глибинному способі
процес здійснюється послідовно у двох ферментаторах. Середовище в посівному
ферментаторі засівається спорами гриба. Наприкінці експонентної фази росту
міцелій передається з посівного в основний апарат. Ферментаційне середовище
містить 15% цукру меляси (склад солей той же, що і при поверхневому методі), рН
середовища підтримується на оптимальному для синтезу ітаконової кислоти рівні
2,1-2,3. Протягом ферментації здійснюється інтенсивне перемішування та аерація
середовища. Наприкінці процесу концентрація кислоти досягає 85 г./л. Біосинтез
ітаконової кислоти в глибинних умовах відбувається набагато інтенсивніше, ніж
при поверхневому культивуванні.
Після закінчення процесу
ферментації поживне середовище звільняють від міцелію, освітлюють активованим
вугіллям і упарюють під вакуумом. Ітаконова кислота кристалізується з упареного
розчину. Маточний розчин можна обробити активним вугіллям і екстрагувати
залишок ітаконової кислоти, наприклад, за допомогою амілового спирту.
Висновки
Не
зважаючи на значний прогрес у сфері органічного синтезу, на сьогодні багато
органічних кислот, у тому числі й лимонну, оцтову та ітаконову отримують
мікробіологічним синтезом, а саме шляхом бродіння солодких відходів цукрових та
інших виробництв. Харчова промисловість традиційно є основним споживачем
вироблених таким чином органічних кислот, оскільки продукти природного бродіння
мають переваги порівняно з хімічно синтезованими та не містять токсичних для
організму людини домішок.
Продуцент
лимонної, оцтової та ітаконової кислот повинні мати наступні спільні
характеристики: високу швидкість кислотоутворення, високий ступінь
трансформації джерела вуглецю у лимонну кислоту, генетичну однорідність та
стабільність, толерантність до зміни температури та контамінантів середовища,
зокрема до високих концентрацій вуглеводів. Під час культивування продуцентів
має бути низький вихід побічних продуктів.
Біосинтез
лимонної кислоти - це регульований процес, який значною мірою залежить від складу
поживного середовища та його фізико-хімічних параметрів. Лимонна кислота є
первинним метаболітом A. niger. Зазвичай, первинні метаболіти необхідні для росту та
життєдіяльності продуценту.
Біотехнологія
отримання лимонної, оцтової та ітаконової кислот за участю мікроорганізмів
охоплює такі основні етапи: отримання посівного матеріалу; підготовка сировини
до ферментації; підготовка та стерилізація повітря; ферментація; відокремлення
біомаси продуцента від культуральної рідини; екстракція кислоти з культуральної
рідини.
З огляду на збільшення
попиту на лимонну кислоту, необхідно постійно удосконалювати технологічний
процес її отримання: застосовувати різноманітні джерела вуглецю, проводити
селекцію штамів мікроорганізмів-продуцентів, впроваджувати сучасні способи
культивування, розробляти нову апаратуру. Потрібно детально знати механізм
синтезу лимонної кислоти, що є метаболітом мікроорганізмів-продуцентів, одним з
яких є Aspergillus niger. Залежно від умов культивування (складу поживного середовища, рН,
температури, аерації, часу та методу ферментації) змінюється вихід лимонної
кислоти. Значний економічний ефект можна отримати завдяки мо-дернізації
біотехнологічного процесу.
Оцтову кислоту при
біологічному синтезі можна отримати 4 способами: окисленням етанолу
оцтовокислими бактеріями родів Acetobacter (A.aceti; A.xylinum; A.peroxydans) і
Gluconobacter (G.oxydans); за допомогою бактерій Cl.aceticum,
Cl.thermoautofrophicim, Eubacterium limosum, які здатні в анаеробних умовах
утилізувати гексози, пентози і молочну кислоту, утворюючи ацетат як єдиний
продукт метаболізму; біосинтез оцтової кислоти молочнокислими бактеріями за
механізмом гетероферментативного молочнокислого шумування з фіксацією СО2
та за механізмом пропіоновокислого шумування.
Основними при цьому є
циркуляційний, глибинний та неперервний комбінований способи біосинтезу оцтової
кислоти. Перевагами циркуляційного способу є заміна багаточанової системи одним
великим окислювачем, збільшення продуктивності до 6-8 кг оцтової кислоти/1 м3
наповнювача.
Ітаконова кислота є
продуктом метаболізму вуглеводів грибами роду Aspergillus. Продуцентами кислоти
у промисловості є спеціально селекціо-новані штами A. terreus, які, на відміну
від A. itaconicus, не розкладають ітако-нову кислоту. Для одержання високого
виходу ітаконової кислоти необхідним є лімітування середовища за фосфат-іонами.
Процес синтезу
ітаконової кислоти аналогічний процесу одержання лимонної кислоти. Найкращими
субстратами для культивування є глюкоза і сахароза, однак у промисловості
використовують, в основному, мелясу, попередньо оброблену іонітами або
фероціанідом, а також гідролізований крохмаль. Процес проводять в умовах
обмеження росту гриба мінеральними компонентами середовища (залізом і фосфором)
при низькому рН середовища і достатньому забезпеченні киснем. Оптимальна
температура культивування складає 37°С. Найчастіше використовується глибинний
метод.
Список використаних
джерел
кислота біологічний
синтез оцтовий
1. Аналіз виробництва
та застосування лимонної кислоти / В.М. Фалес, О.В. Хіврич, А.М. Литвиненко //
Харч. пром-сть. - 2009. - №8. - С. 91-94.
2. Биотехнология
/ Под ред. акад. А.А. Баева. - М.: Наука, 1984. - 310 с.
. Біологічна
хімія: підруч. для студ. ВНЗ / Л.Ф. Павлоцька, Н.В. Дуденко, Є. Я. Левітін. -
Суми: Унів. кн., 2011. - 509 с.
. Божков
А.И. Биотехнология. Фундаментальные и промышленные аспекты. - Харьков: Федорко,
2008. - 364 с.
. Быков
В.А., Крылов, Манаков М.Н., Марквичев Н.С., Орлова Л.М., Биотехнология: Учеб. пособие.
Микробиологическое производство биологи-чески активных веществ и препаратов. -
М.: Высш. шк., 1988. - 208 с.
. Васильченко
О.А., П’янкова О.О. Біотехнологічні аспекти отримання лимонної кислоти //
Науковий вісник НЛТУ України. - 2012. - Вип. 22.1. - С. 100-110.
. Виестур
У.Э., Шмите И.А., Жилевич А.В. Биотехнология. Биологические агенты, технология,
аппаратура. - Рига: Зинатне, 1987. - 263 с.
. Воробьева
Л.И. Техническая микробиология: Учебн. пособие. - М.: Изд. Моск. ун-та, 1987. -
168 с.
. Гинодман
Л.М. Биогенез природных соединений / Гинодман Л.М. - М.: Мир, 1965. - 724 с.
. Глазунова
Л.М., Финогенова Т.В. Активность ферментов цитратного, глиоксилатного и
пентозофосфатного циклов при синтезе лимонных кислот Candida lipolytica И
Микробиология. 1976. - Т. 35. - №3. - С. 444-449.
. Дослідження
регенерації оцтової кислоти виробництва вінілацетату / С.С. Ле-вуш, Ю.В. Кіт //
Вісн. Нац. ун-ту «Львів. політ.». - 2008. - №609. - С. 207-209.
. Загальна
хімічна технологія: навч.-метод. посіб. / В.П. Беженар, О.М. Хаце-вич. -
Івано-Франківськ: Прикарпат. нац. ун-т ім. В. Стефаника, 2011. - 203 с.
. Карклиньш
Р.Я., Пробок A.K. Биосинтез органических кислот. - Рига, 1972. - 200 с.
. Карпов
А.М., Саруханов А.В. Теплофизические и физико-химические харак-теристики продуктов
микробиологического синтеза: Справочник / Карпов А.М., Саруханов А.В. - М.:
Агропромиздат, 1987. - 224 с.
. Маненков
М.Н., Победенский Д.Г. Теоретические основы технологии микробиологических
производств. - М.: Мир, 1990. - 272 с.
. Муратова
Е.И. Биотехнология органических кислот и белковых препаратов: учебн. пособ. /
Е.И. Муратова, О.В. Зюзина, О.Б. Шуняева. - Тамбов: Изд-во Тамб. гос. тех.
ун-та, 2007. - С. 8-10.
. Органічна
хімія та основи статичної біохімії / Н.І. Штеменко, З.П. Соломко, В.І. Авраменко;
Дніпропетр. нац. ун-т. - Д., 2003. - 665 с.
. Органічна
хімія: Навч. підруч. / Л.М. Романишина, Р.О. Сабадишин, І.М. Хмеляр, М.М.
Лукащук. - Рівне: Рівнен. друк., 2006. - 503 с.
. Органічна
хімія: підручник / В.Я. Чирва, С.М. Ярмолюк, Н.В. Толкачова, О.Є. Земляков. -
Л.: БаК, 2009. - 996 с.
. Оцтова
кислота. Властивості, використання, виробництво: Моногр. / Я.В. Лас-тов’як,
Н.С. Караман, М.С. Полутаренко, Ю.А. Паздерський; Нац. ун-т «Львів.
політехніка». - Л.: Вид-во Нац. ун-ту «Львів. політехніка», 2004. - 166 с.
. Промышленная
биотехнология / Под ред. Егорова Н.С. - М.: Высш. шк., 1989. - 688 с.
. Расчеты по
технологии органических альдегидов и кислот / Л.Л. Товажнянский, В.Г. Новиков,
С.И. Бухкало, В.Е. Ведь, В.М. Фрумин; Нац. техн. ун-т «Харьк. политехн. ин-т».
- Х., 2006. - 88 с.
. Уксусная
кислота: проблемы и перспективы / П.П. Борисов, М.Д. Пукиш та ін. // Хім.
пром-сть України. - 2000. - №1-2. - С. 63-67.
. Ферментация
и технология ферментов: Пер. с англ. / Уонг Д., Кооней Ч., Демайн А. и др. -
М.: Легкая и пищевая промышленность, 1983. - 336 с.
. Финогенова
Т.В. Перспективы производства органических кислот дрожжами Yarrowia lipolytica
// Прикл. биохим. микробиол. - 2005. - №5. - с. 478-486.
. Хиччинс
И., Бест Д., Джонс Дж. Биотехнология: Принципы и применение. - М.: Наука - 479
с.
. Яворська
Г.В., Ґудзь С.П., Гнатуш С.О. Промислова мікробіологія. - Львів, вид. центр
Львів. нац. ун-ту ім. І Франка, 2008. - 256 c.