Обобщение и систематизация знаний по теме: 'Водород'
План урока
Русакова Е.В. МБОУ «Гимназия №2» г. Курчатов
Курской области
Аннотация. Активизация познавательной
деятельности есть по сути систематическое и целенаправленное взаимодействие
учителя и учащегося, направленное на совершенствование содержания, форм,
методов, приёмов средств обучения и самообучения.
Роль дидактического условия повышения
эффективности учебного процесса выполняют межпредметные связи. Они вырабатывают
умение учиться, развивают ответственность, активность; повышают практическую и
научно-теоретическую подготовку учащихся и являются конкретными выражениями
интеграционных процессов, происходящих сегодня в науке и обществе.
Интеграция с теми предметами, которые кажутся
школьникам достаточно привлекательными, позволяет успешно проявлять интерес к
химии и развивать мотивацию её учения; раскрывает возможности практического
применения приобретаемых химических знаний. Конечная цель интеграции - дать
учащимся целостное представление об окружающем мире с целью использования его в
дальнейшей жизни.
Я хочу предложить вашему вниманию свою
разработку урока по теме: «Водород», изучаемой в 9 классе по учебнику: И.И.
Новошинский, Н.С. Новошинская «Химия 9 класс» Москва изд. «Русское слово».
Тема урока: Обобщение и систематизация знаний по
теме: «Водород».
Тип урока: Обобщение и систематизация знаний.
Вид Занятия: Комбинированный урок.
Дидактическая цель: Создать условия для усвоения
изученного материала посредством осуществления межпредметных связей.
Цели урока:
а) образовательные: организовать обобщение и
систематизацию знаний о водороде (строении атома и молекулы водорода,
распространённости водорода в природе, физических и химических свойствах
водорода, его применении, получении, биологической роли в природе и особенности
обращения с ним) с использованием средств ИКТ.
б) развивающие: развивать умения выделять
главное, делать обобщающие выводы; продолжать развивать умения самоанализа
усвоенных знаний и их корректировки, используя приёмы «что не знаю, что нового
узнал(а), очень интересно»; устанавливать причинно-следственные связи; навык
логического изложения своих мыслей; решения химических задач.
в) воспитательные: воспитание положительного
отношения к получению знаний, самостоятельности, ответственности и
дисциплинированности.
Задачи урока: обобщить и расширить знания о
водороде, его распространённости в природе, строении атома водорода и составе
его молекулы, физических и химических свойствах водорода, получении,
применении, мерах предосторожности при работе с водородом и его биологической
роли в природе. Сориентировать учащихся на решение задач с участием водорода в
химических реакциях. Развивать умения делать логические выводы о
причинно-следственных связях. Продолжать осуществлять межпредметные связи.
Методы и приёмы обучения: метод
программированных заданий, диалогический.
Оборудование: компьютер, проектор с экраном,
таблица «Периодическая система химических элементов Д.И.Менделеева»,
распечатанные таблицы для самоанализа усвоенных знаний для каждого ученика.
Литература и средства обучения:
. И.И. Новошинский Н.С. Новошинская Химия 9
класс - М.: «Русское слово», 2013.
. Русакова Е.В. Урок-презентация по теме
«Водород» в электронном виде.
. И.И. Новошинский, Н.С. Новошинская
Самостоятельные работы по химии 9 класс - М.: «ОНИКС 21 век» «Мир и образование»
2011.
План урока.
Вводное слово учителя о цели и задачах урока.
Обобщение и систематизация знаний по теме:
«Водород».
Рефлексия: решение химических задач, самоанализ
таблицы по пройденному материалу и обсуждение последней колонки таблицы «очень
интересно».
Домашнее задание.
Ход урока.
Актуализация прежних знаний. Вводное слово
учителя о цели и задачах урока. Учитель: Сегодня на уроке мы с вами обобщаем и
расширяем знания о водороде как химическом элементе и простом веществе,
продолжаем учиться решать расчётные задачи на закон Авогадро и
самоанализировать полученные знания».
Индуктор. Учитель: « Ребята, вы знаете, что
водород определяет, кому родиться людьми, кому - бабочками, а кому -
растениями? Хотите узнать, как это происходит? Тогда - за работу!»
Формирование новых понятий и способов действия.
Обобщение и систематизация знаний по теме: «Водород». До начала урока на столы
учащихся раскладываются заранее распечатанные таблицы: «Самоанализ полученных
знаний по теме: «Водород»». (См. Приложение №1). Учитель: «Ознакомьтесь
внимательно с первой колонкой в таблице (Что о водороде не знаю или забыл(а)) и
во второй колонке поставьте отметку (например, галочку или крестик) напротив
тех пунктов, которые вызывают у вас затруднения.(учащиеся делают пометки).
По ходу урока вы будете в следующей колонке (Что
нового узнал (а) о водороде) делать записи.
Если же какой-нибудь факт вас особенно
заинтересует, то в последней колонке (очень интересно) напротив соответствующих
пунктов ставьте восклицательный знак».

Рис. 1
Слайд №2 Водород как химический элемент. На
слайде - информация: 1. Химический элемент водород обозначается химическим
знаком H; имеет порядковый №1; находится в I группе, главной подгруппе I
периода ПСХЭ им. Менделеева. Ar(H) = 1. Отражены состав атома и его строение.
Валентность = I; степень окисления = +1, 0 (редко, в гидридах = -1)).
Вопросы для обсуждения:
Что можно сказать о строении атома водорода
исходя из его положения в ПСХЭ Д.И.Менделеева?
Как скажется на окислительно-восстановительных
свойствах атома такое заполнение атомной орбитали единственным электроном?
Почему химический знак водорода присутствует в
ПСХЭ Д.И. Менделеева и в I группе и в VII группе?
Составьте формулы бинарных соединений, где
водород проявляет степени окисления а) +1; б) - 1; в) 0. Назовите вещества,
формулы которых вы составили. К каким классам неорганических веществ они
относятся?
Учащиеся заполняют третью и четвёртую колонки в
таблице самоанализа.

Рис. 2
Слайд №3 Водород в природе. (На слайде -
информация: Водород - самый распространённый элемент в космосе, он составляет
примерно 50% массы Солнца и звёзд. Повсеместно, в составе воды он занимает 11%
по массе. Ещё водород входит в состав кислот, солей, минералов, каменного угля,
нефти, органических веществ, в том числе живых организмов - до 10% по массе. Он
занимает девятое место среди всех элементов в составе земной коры - это 1% по
массе).

Рис. 3
Вопросы для обсуждения:
Назовите примеры веществ, в составе которых
присутствует водород как химический элемент?
К каким классам неорганических соединений они
относятся?
Учащиеся продолжают заполнять третью и четвёртую
колонки в таблице самоанализа.
Слайд №4. Физические свойства водорода. (На
слайде - информация: Водород - простое вещество (Состав молекулы Н2) - газ без
цвета, вкуса и запаха, не ядовит, но пожаро- и взрывоопасен. Это самый лёгкий
из всех газов, он в 14,5 раз легче воздуха. Растворимость в воде водорода плохая:
в 1л воды его растворяется всего 18г. Он сжижается при t = -252,8°С, образуя
самую лёгкую жидкость, а замерзает при t = -259,15°С.)
Вопросы для обсуждения:
Каков состав молекулы водорода? Сколько
химических связей образуют атомы водорода в молекуле?
Почему при обычных условиях молекула водорода
химически малоактивна?
Почему водород плохо растворяется в воде?
Как рассчитать относительную плотность газа
водород по гелию? По азоту? По кислороду?

Рис. 4
Слайды № 5, 6,7,8. Химические свойства водорода.
(На слайде №6 - информация: Взаимодействие с галогенами: уравнения реакций
взаимодействия водорода со фтором, хлором, бромом и йодом и условия их
протекания. Уравнения взаимодействия водорода с азотом и серой. На слайде №7 -
информация: Взаимодействие водорода с оксидами металлов, а именно: уравнение
взаимодействия водорода с оксидом меди, рисунок реактора со всеми обозначениями
и пояснение где применяют этот процесс. На слайде №8 - информация:
взаимодействие водорода с металлами, где есть схема взаимодействия водорода с
металлами с примером взаимодействия кальция с водородом.

Рис. 5
Вопросы для обсуждения:
Что такое гремучий газ?
Поясните фразу: Водород обладает
окислительно-восстановительной двойственностью.
Составьте уравнения реакций взаимодействия
водорода с фосфором, углеродом, кальцием. В каких реакциях водород является
окислителем, а в каких - восстановителем.

Рис. 6
Ещё трое учащихся составляют уравнения реакций
на доске с последующей проверкой. Затем остальные ребята проверяют правильность
составления уравнений у себя в тетрадях. Продолжается заполнение третьей и
четвёртой колонок в таблице самоанализа.
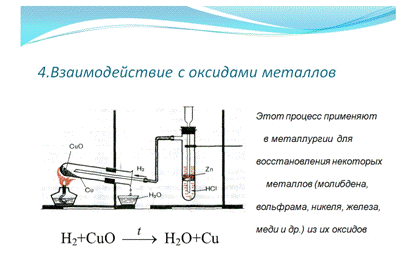
Рис. 7
Какие кислоты и металлы можно использовать для
получения водорода в реакции замещения? Вспомните условия взаимодействия
металлов с растворами кислот.
Составьте уравнения взаимодействия магния с
серной кислотой, алюминия с соляной кислотой.
Обсудите реакции взаимодействия воды со
щелочными металлами. Определите тип этих химических реакций.
Ещё двое учащихся составляют учащихся составляют
уравнения реакций на доске с последующей проверкой. Затем остальные ребята
проверяют правильность составления уравнений у себя в тетрадях. Продолжается
заполнение третьей и четвёртой колонок в таблице самоанализа.
Слайд №11. Меры предосторожности при работе с
водородом. (На слайде - информация: рисунок, изображающий последовательность
действий при проверке водорода на чистоту и фотография взрыва дирижабля,
заполненного водородом). Учитель: «Смесь водорода с кислород или воздухом,
когда объёмное соотношение водорода с кислородом = 2:1 называется гремучим
газом. Такие смеси сильно взрываются от огня и даже от одной искры. Вот почему
перед проведением опытов с газообразным водородом его предварительно проверяют
на чистоту. Для этого пробирку, перевёрнутую вверх дном, наполняют водородом,
отверстие закрывают пальцем и поднимают пробирку отверстием в огонь (см. на
рисунок на слайде). Чистый водород загорается почти неслышно, водород с
примесью воздуха занимается с характерным громким звуком.
Известно немало тяжёлых и трагических случаев,
вызванных неосторожным, если не легкомысленным обращением с водородом. Опасно
для демонстрации горения водорода поджигать его струю, вытекающую из аппарата
Киппа, без предварительной проверки на чистоту. Если прибор собран негерметично
или водород не успевает полностью вытеснить из него воздух, при поджигании
газовой струи раздаются оглушительные взрывы, которые способны разнести аппарат
Киппа вдребезги. Острые осколки стекла калечат людей.
Не повезло огромному немецкому дирижаблю
«Гинденбург», наполненным водородом объемом 200 000 м3. Произошло это в мае
1937 г., когда дирижабль пришвартовался к причальной мачте в нью-йоркском
аэропорту. Неожиданно дирижабль вспыхнул, взорвался и упал на землю. При этом
образовалась колоссальное количество водяного пара, которая от внезапного
расширения в воздухе охладилась. Это и способствовало появлению небольшого
дождя, пролился с ясного неба над аэродромом. Из 99 человек пассажиров и членов
экипажа «Гинденбурга» 48 погибло, а остальные покалечились и получили сильные
ожоги».
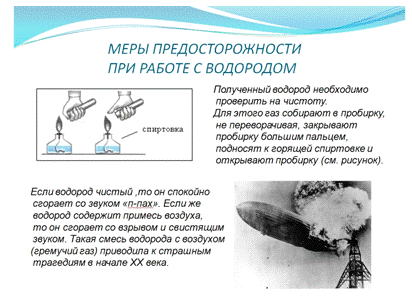
Рис. 8
Ученики продолжают работать с третьей и
четвёртой колонками таблицы самоанализа.
Слайд №12. Применение водорода. (На слайде -
информация: схема применения водорода с фотографиями в промышленных объёмах:
синтез хлороводорода, метанола, аммиака, удобрений и азотной кислоты, как
топлива в двигателях и для превращения растительных массе в жиры). Беседа
фронтальная с учащимися с использованием схемы, представленной на слайде и
текстом учебника на стр. 40.
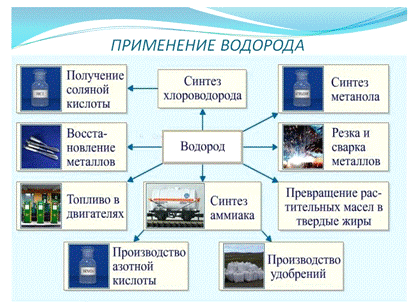
Рис. 9
Продолжение работы с таблицей самоанализа.
Слайд №13. Это интересно. Сообщение учащегося о
водороде как экологически чистом топливе будущего, о том, что продуктом
сгорания такого топлива является вода. Первые попытки человека использовать это
топливо в промышленных объёмах показало, что такой процесс рентабелен, если
водород получать, используя теплоту, выделяемую тепловыми элементами на атомных
станциях. А это нам, живущим в городе-спутнике АЭС, особенно интересно! Так что
решение вопроса о таком топливе не за горами; и может быть кто-нибудь из вас,
находящихся сейчас в классе как раз и решит эту проблему планетного масштаба.

Рис. 10
Продолжение работы с таблицей самоанализа.
Слайд №14. Биологическая роль водорода. Учитель:
«А теперь наступил момент ответа на вопрос, поставленный в самом начале урока:
как же водород определяет, кому родиться человеком, а кому растением? Так вот
оказывается, что атомы водорода, образуя водородные связи, обусловливают
структуру белков и нуклеиновых кислот, то есть хранит и реализует
наследственную информацию, Он также участвует в биологическом окислении (то есть
обеспечивает живые клетки энергией), процессе фотосинтеза у растений,
поддерживает гомеостаз у живых организмов. Вместе с углеродом и кислородом
водород образует структурную и функциональную основы жизни».

Рис. 11
водород применение авогадро закон
Учащиеся заполняют до конца третью и четвёртую
колонки таблицы самоанализа.
Формирование умений и навыков. Рефлексия.
Учитель просит каждого сравнить первую и третью колонки своих таблиц
самоанализа и задать вопросы по тем моментам, которые остались непонятыми;
ученики, усвоившие учебный материал отвечают на эти вопросы. Затем желающие по
очереди озвучивают последнюю колонку таблицы самоанализа (колонка «очень
интересно»).

Рис. 12
Затем решается задача на закон Авогадро (см.
Слайд №15): вычислите объём кислорода, который потребуется для сжигания 200л
водорода (Ответ-100л). Учитель вызывает к доске ученика, кто раньше всех решает
задачу и получает правильный ответ для записи хода решения этой задачи на
доске.
Учитель подводит итоги работы на уроке и
выставляет оценки ученикам.

Рис. 13
IV. Домашнее задание: повторить § 11 учебника,
решить задачу №4 на стр. 50 и найти материал: интересные факты о воде.
Приложение
Самоанализ полученных знаний по теме: «Водород».
|
Что
о водороде не знаю или забыл(а).
|
Поставь
знак - или галочку
|
Что
нового узнал(а) о водороде.
|
Очень
интересно!
|
|
Строение
атома водорода. Содержание водорода в природе. Физические свойства водорода.
Химические свойства водорода. Получение водорода: а)в лаботатории, б)в
промышленности Проверка водорода на чистоту Применение водорода Водород как
топливо Биологическая роль водорода
|
|
|
|