Техническая термодинамика
Контрольная
1
Задача №5
Воздушный баллон, рассчитанный на предельное абсолютное давление ррасч
= 25 МПа, заполнен воздухом с избыточным давлением pизб = 14,9 МПа. При пожаре в помещении, где находился баллон,
температура воздуха в нем повысилась до t2 = 500°С (Рисунок 1.5.1). Выдержит ли баллон возросшее
давление, если известно, что температура воздуха в баллоне до пожара была t1 = 0°C, а
барометрическое давление В = 750 мм рт. ст.? (Задачу решить в единицах СИ.)
Дано:
ррасч = 25 МПа
pизб = 14,9 МПа
Т2 = 500 0С = 773.15 K
Т1 = 0 0С = 273.15 К
В = 750 мм.рт.ст. = 99991.5 Па
рабс 2 - ?

Рисунок 1.5.1 - Изображение изохорного процесса в Ts- и pv-диаграммах
Решение:
Так как объем баллона постоянный, процесс, проходящий в баллоне -
изохорный:
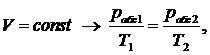 (1.5.1)
(1.5.1)
Найдем
абсолютное давление для первого случая:
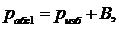 (1.5.2)
(1.5.2)
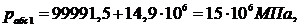
Из
формулы (1.5.1) получим:
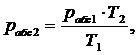 (1.5.3)
(1.5.3)
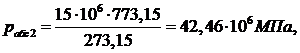
Из
расчета мы видим, что 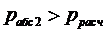 , т.е. баллон не выдержит возросшее давление.
, т.е. баллон не выдержит возросшее давление.
Ответ:
Баллон не выдержит
Задача №16
Смесь состоит из 7 кг водорода и 93 кг окиси углерода. Определить газовую
постоянную и плотность смеси, а также парциальные давления водорода и окиси
углерода, если абсолютное давление смеси рабс = 0,4 МПа, а
температура t =15° С.
Дано:
m(H2) =7кг
m(CO) = 93кг
pабс
=0,4 МПа
t=150С=288,15
К
Rсм,
ρсм - ?
рн, рсо - ?
Решение:
Газовая постоянная для данной смеси определяется по формуле:
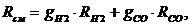 (1.16.1)
(1.16.1)
где
массовая доля определяется по формуле:
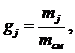 (1.16.2)
(1.16.2)
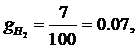
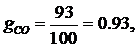
а
газовые постоянные компонентов смеси равны:
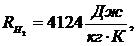
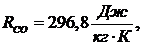
По
формуле (1.16.1) найдем газовую постоянную смеси:
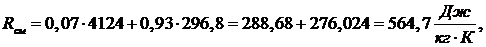
Уравнение
Клапейрона - Менделеева:
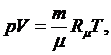 (1.16.3)
(1.16.3)
или:
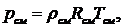 (1.16.4)
(1.16.4)
Из
уравнения (1.16.4) следует:
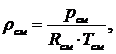 (1.16.5)
(1.16.5)
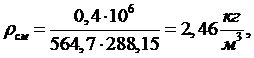

Давление
смеси газов равно сумме их парциальных давлений:
 (1.16.6)
(1.16.6)
Из
формулы (1.16.3) для Н2 и СО следует соотношение:
 (1.16.7)
(1.16.7)
Из
соотношения (1.16.7) следует:
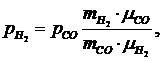 (1.16.8)
(1.16.8)
Подставив
выражение (1.16.7) в формулу (1.16.5) получим:
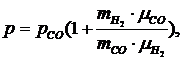 (1.16.9)
(1.16.9)
Отсюда
получим выражение для парциального давления СО:
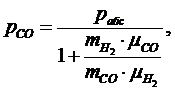 (1.16.10)
(1.16.10)
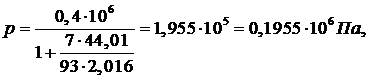
Парциальное
давление Н2 равно:
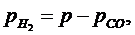 (1.16.11)
(1.16.11)
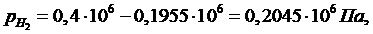
Ответ:
Rсм=564,704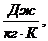 ρсм=2,46
ρсм=2,46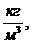
рН2=0,2045
МПа, рСО=0,1955 МПа
Задача №21
кг азота с начальными температурой t1 = 100°С и абсолютным давлением p1 = 0,5 МПа нагреваются при постоянном объеме до температуры t2=500°С (Рисунок 1.21.1). Определить конечное давление
газа, количество подводимого к нему тепла и изменение его энтропии.
Дано:
mN2 = 2 кг
t2 =500 0С=773,15 К
p1 =0,5 МПа
V=const
µ=28,9 кг/кмоль
P2, Q, ∆s - ?

Рисунок 1.21.1 - Изображение изохорного процесса в Ts- и pv-диаграммах
Решение:
Количество теплоты рассчитывается по формуле:
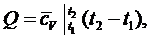 (1.21.1)
(1.21.1)
Средняя
изохорная теплоемкость в интервале температур от t1 до t2:
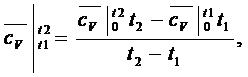 (1.21.2)
(1.21.2)
где:
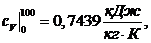
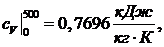
тогда:
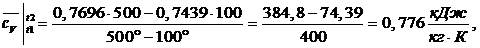
По
формуле (1.21.1) рассчитаем количество теплоты:
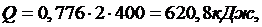
Из
определения энтропии имеем формулу:
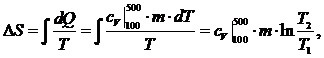 (1.21.3)
(1.21.3)
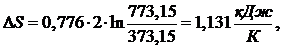
Из
уравнения :
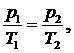 (1.21.4)
(1.21.4)
найдем
р2:
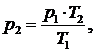 (1.21.5)
(1.21.5)
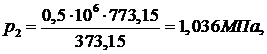
Ответ:
∆S=1,131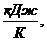 р2=1,036 МПа, Q=620,8 кДж.
р2=1,036 МПа, Q=620,8 кДж.
Вопрос №5
Что такое параметр состояния? Какие параметры приняты в технической
термодинамике за основные и почему? Являются ли основные параметры
независимыми?
Ответ: Параметр состояния - физическая величина, характеризующая состояние
термодинамической системы в условиях термодинамического равновесия. В
термодинамике приняты за основные следующие параметры: температура, давление,
объем, энтропия. Эти величины не являются независимыми. Связь между
термодинамическими параметрами для конкретной системы называется уравнением
состояния.
Вопрос №16
Что такое кажущаяся (фиктивная) молекулярная масса смеси идеальных газов?
Как она подсчитывается?
Ответ: При расчетах с идеально-газовыми смесями удобно пользоваться так
называемой кажущейся молекулярной массой смеси, являющейся отношением массы
смеси к суммарному количеству молей компонентов:
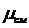 =Gсм/ Mсм,
=Gсм/ Mсм,
где
Gсм - масса
всей смеси; Mсм - молекулярная
масса смеси;
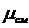 =1/
=1/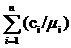 ,
,
где
ci - массовая
доля i-го компонента смеси (ci= Gi/G);
µi
- кажущаяся молекулярной масса i-го компонента смеси;
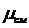 =
=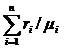 ,
,
где
ri- приведенный объем i-го компонента
смеси (ri= Vi/ Vсм);
µi - кажущаяся молекулярной
масса i-го компонента смеси.
Вопрос №21
Почему теплоемкость при постоянном давлении больше, чем теплоемкость при
постоянном объеме? Какова связь между этими теплоемкостями?
Ответ: Если нагревание газа происходит при постоянном давлении, то газ будет
расширяться, совершая над другими телами положительную работу. Следовательно,
для повышения температуры газа на один кельвин в этом случае понадобится больше
тепла, чем при нагревании при постоянном объеме, так как часть тепла будет
затрачиваться на совершение работы. Поэтому теплоемкость при постоянном
давлении больше, чем теплоемкость при постоянном объеме. Соотношение
теплоемкостей можно описать формулой Майера:
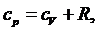
где
R - газовая постоянная вещества.
Контрольная
2
Задача №5
кг окиси углерода сжимаются изотермически при температуре t=60°С так, что его объем уменьшается
в 2,3 раза, а давление становится равным р2=0,25 МПа (Рисунок
2.5.1). Определить начальный и конечный объемы газа, количество отводимого от
газа тепла и изменение его энтропии.
Дано:
m(CO)=6 кг=const
T=600C=333,15 K2 = 0,25 МПа1=2,3V2
R=296,8 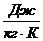
V1, V2, Q, ∆s - ?

Рисунок 2.5.1 - Изображение изотермического процесса в Ts- и pv-диаграммах
Решение:
Так как процесс изотермический, то для него применимо уравнение
Бойля-Мариотта:
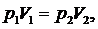 (2.5.1)
(2.5.1)
По
условию V1=2,3V2, тогда запишем уравнение (1) в следующем виде:
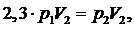 (2.5.2)
(2.5.2)
Из
уравнения (2.5.2) найдем р1:
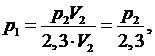 (2.5.3)
(2.5.3)
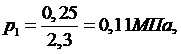
Из
уравнения Клапейрона - Менделеева:
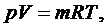 (2.5.4)
(2.5.4)
найдем
объемы V1 и V2:
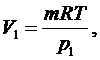 (2.5.5)
(2.5.5)
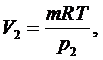 (2.5.6)
(2.5.6)
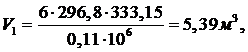
Поскольку
рассматриваемый процесс - изотермическое сжатие, то количество теплоты и
изменение энтропии будут иметь знак «-».
Для
изотермического процесса изменение энтропии равно:
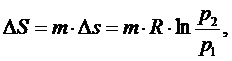 (2.5.7)
(2.5.7)
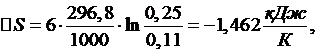
Найдем
количество теплоты по формуле:
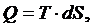 (2.5.8)
(2.5.8)
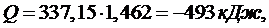
Ответ: V1=5,39 м3,
V2=2,37 м3,
Q=-1,462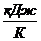 , ∆S=-439
кДж
, ∆S=-439
кДж
Задача №16
В процессе политропного сжатия кислорода затрачивается работа L = 400 кДж, причем в одном случае от
кислорода отводится 600 кДж, а в другом - кислороду сообщается 100 кДж тепла
(Рисунок 2.16.1). Определить показатели обеих политроп. Процессы изобразить в
pv- и Ts-диаграммах.
Дано:
L=-400
кДж
Q1=-600 кДж
Q2=-100 кДж
k=1,4
n1, n2 - ?
а)
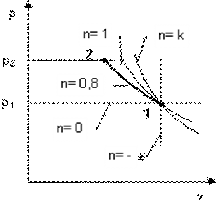
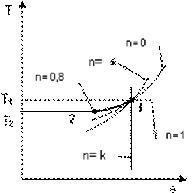
б)
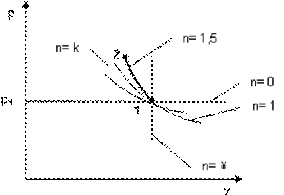
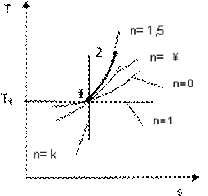
Рисунок 2.16.1 - Изображение политропного процесса в Ts- и pv-диаграммах: а - при n=0.8; б - при n=1.5
Решение:
Из данного соотношения найдем показатели политроп для обоих процессов:
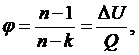 (2.16.1)
(2.16.1)
Из
уравнения (2.16.1) выразим n:
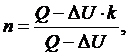 (2.16.2)
(2.16.2)
Из
второго закона термодинамики изменение внутренней энергии равно:
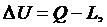 (2.16.3)
(2.16.3)
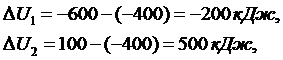
Тогда,
подставив ∆U в формулу (2.16.2) вычислим показатели политроп:
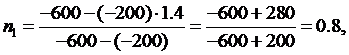
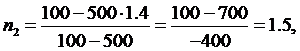
Ответ:
n1=0.8, n2=1.5.
Вопрос №5
Покажите на основании аналитического выражения первого закона
термодинамики q=∆u+l, в каких процессах сжатия и расширения
температура идеального газа будет увеличиваться и уменьшаться.
Ответ: На основании аналитического выражения первого закона термодинамики:
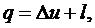
температура
идеального газа будет увеличиваться при адиабатном сжатии и изобарном
расширении, а уменьшаться - при адиабатном расширении и изобарном сжатии.
Вопрос №16
Почему
энтропия является параметром состояния? Покажите, что для обратимых круговых
процессов 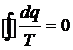 , а для необратимых
, а для необратимых 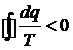 .
Запишите аналитическое выражение второго закона термодинамики.
.
Запишите аналитическое выражение второго закона термодинамики.
Ответ: Энтропия - это параметр состояния, так как энтропия
зависит от температуры. Любому состоянию можно сопоставить вполне определенное
значение энтропии.
Из
выражения КПД цикла Карно для обратимого цикла получим:
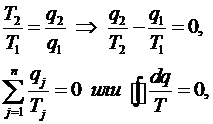
Для
необратимого цикла:
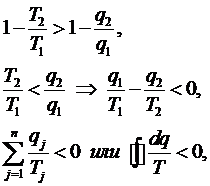
Аналитическое
выражение второго закона термодинамики: 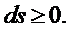
Контрольная
5
Задача №5
Сравнить теоретический расход энергии на сжатие 1 кг воздуха в
одноступенчатом и двухступенчатом компрессорах при политропном сжатии (n=1,3) если начальные параметры p1=0,1 МПа и t1=15°С, а конечное давление p2=1,0
МПа. Изобразить процессы в pv-и
Ts-диаграммах (Рисунок 5.5.1).
Дано:
M=1
кг, m=2
n=1,3
p1=0,1МПа
t1=15°C=288,15 К2=1 МПа
R=287,7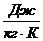
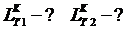

Рисунок 5.5.1 - Изображение многоступенчатого сжатия в компрессоре в Ts- и pv-диаграммах
Решение:
Работа компрессора при одноступенчатом сжатии равна:
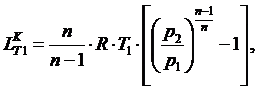 (5.5.1)
(5.5.1)
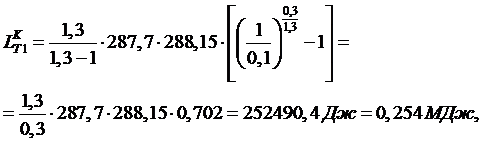
Для
двухступенчатого компрессора работа сжатия равна:
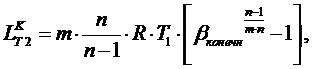 (5.5.2)
(5.5.2)
где:

m -число
ступеней сжатия в компрессоре. В нашем случае m=2.
Тогда
работа равна:
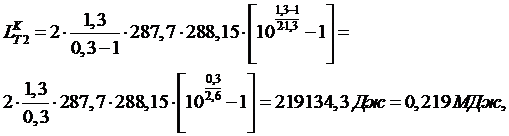
Ответ: 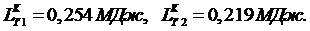
Задача №16
Для
идеального цикла поршневого двигателя внутреннего сгорания со смешанным
подводом тепла (Рисунок 5.16.1), определить размеры рабочего тела в характерных
точках, термический К.П.Д., количество отведённого тепла, полезную работу и
степень заполнения цикла, если начальные параметры рабочего тела p1=0,1 МПа и t1=40° С, степень сжатия 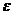 =5,количество тепла, проведённого по изохоре, qv=800 кДж/кг, а количество тепла, подведённого по изобаре qp=400 кДж/кг. Рабочие тело - воздух.
=5,количество тепла, проведённого по изохоре, qv=800 кДж/кг, а количество тепла, подведённого по изобаре qp=400 кДж/кг. Рабочие тело - воздух.
Дано:
p1
= 0.1 МПа1 = 40° C=313.15
К
qv=800 , qp=400
, qp=400 , R=287.7
, R=287.7
k = 1.4
lц, q2, СЗЦ, ηt
- ?
параметры
- ?
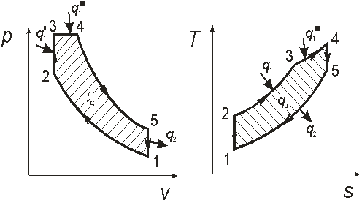
Рисунок 5.16.1 - Изображение цикла Тринклера в Ts- и pv-диаграммах
Решение:
Рассчитаем параметры p, v, T в характерных точках:
Точка 1:
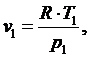 (5.16.1)
(5.16.1)
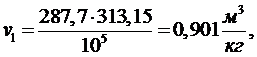
Точка 2:
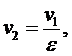 (5.16.2)
(5.16.2)
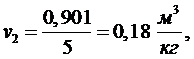
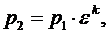 (5.16.3)
(5.16.3)
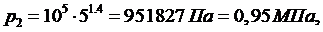
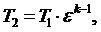 (5.16.4)
(5.16.4)
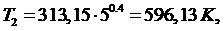
Точка 3:
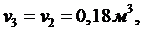
Степень
дополнительного увеличения давления:
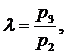 (5.16.5)
(5.16.5)
Поскольку
процесс 2-3 изохорный, то справедлив закон Шарля:
 (5.16.6)
(5.16.6)
Теплота,
полученная в процессе 2-3:
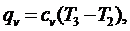 (5.16.7)
(5.16.7)
где
cv - изохорная теплоемкость, которую принимаем не
зависящей от температуры:
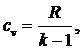 (5.16.8)
(5.16.8)
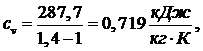
Из
выражения (5.16.7) выразим T3:
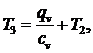 (5.16.9)
(5.16.9)
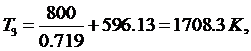
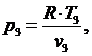 (5.16.10)
(5.16.10)
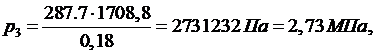
Тогда
λ из выражения (5.16.5) равна:
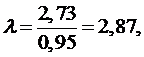
Точка 4:

Степень
предварительного расширения:
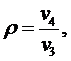 (5.16.11)
(5.16.11)
Поскольку
процесс 3-4 изобарный, то справедлив закон Гей-Люссака:
 (5.16.12)
(5.16.12)
Теплота,
полученная в процессе 3-4:
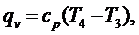 (5.16.13)
(5.16.13)
где
cр -
изобарная теплоемкость, которую принимаем не зависящей от температуры:
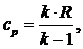 (5.16.14)
(5.16.14)
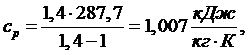
Из
выражения (5.16.13) выразим T3:
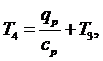 (5.16.15)
(5.16.15)
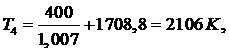
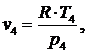 (5.16.16)
(5.16.16)
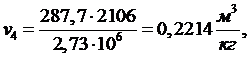
Тогда
ρ из выражения (5.16.11) равна:
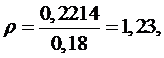
Точка 5:
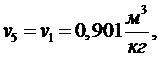
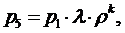 (5.16.17)
(5.16.17)
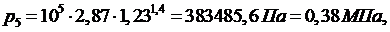
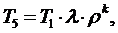 (5.16.18)
(5.16.18)
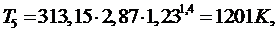
Отвод
теплоты q2
происходит в процессе 5-1:
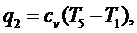 (5.16.19)
(5.16.19)
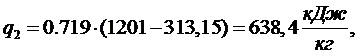
Подвод
теплоты происходит в процессах 2-3 и 3-4:
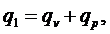 (5.16.20)
(5.16.20)
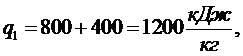
Следовательно
работа цикла равна:
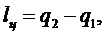 (5.16.21)
(5.16.21)

Термический
КПД равен:
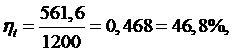
Определим
степень заполнения цикла, которая равна отношению работы данного цикла к работе
цикла Карно:
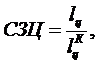 (5.16.23)
(5.16.23)
Работа
цикла Карно:
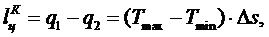 (5.16.24)
(5.16.24)
где
∆s - изменение энтропии:
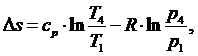 (5.16.25)
(5.16.25)
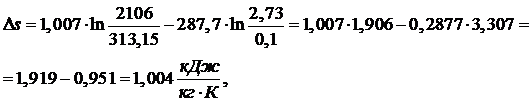
Подставив
значение ∆s в выражение для определения работы в цикле Карно,
получим:
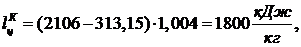
По
формуле (5.16.23):
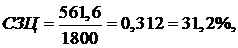
Ответ:
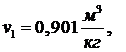

Вопрос №8
Изобразите в Ts-диаграмме
процесс политропного сжатия газа в многоступенчатом компрессоре при показателе
политропы 1<n<k. Покажите на графике тепло,
отводимое от газа в цилиндрах компрессора и в промежуточных холодильниках.
Ответ: Как видно из рисунка тепло от цилиндров компрессора отводится в процессах
1-а, б-в, а от промежуточных холодильников - а-б, в-2

Вопрос №16
Изобразите индикаторную диаграмму четырёхтактного двигателя со сжиганием
топлива при постоянном объёме и постройте в pv-диаграмме соответствующий ему идеальный цикл.
Ответ:
Поршень I совершает возвратно-поступательные
движения в цилиндре II, снабженном
всасывающим III и выхлопным IV клапанами. В процессе а-1 поршень движется слева направо, в
цилиндре создается разрежение, открывается всасывающий клапан III и в цилиндр подается рабочая смесь,
приготовленная в специальном устройстве- карбюраторе.
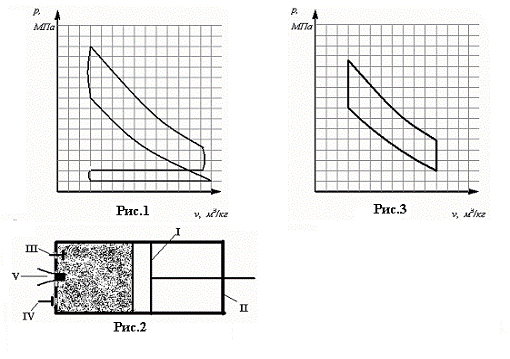
Рис. 5.16.1 - индикаторная диаграмма цикла Отто (цикл со сгоранием при V=const) для четырехтактного двигателя;
Рис. 5.16.2 - принципиальная схема четырехтактного двигателя;
Рис. 5.16.3 - p,V-диаграмма идеализированного цикла.
После того как поршень дойдет до крайнего правого положения, процесс
заполнения цилиндра горючей смесью заканчивается и всасывающий клапан
закрывается, поршень начинает двигаться в обратном направлении - справа налево.
При этом горючая смесь сжимается и ее давление возрастает (процесс 1-2). После
того как давление смеси в цилиндре достигает определенного значения,
соответствующего точке 2 на индикаторной диаграмме, с помощью электрической
свечи V производится поджигание рабочей
смеси. Процесс сгорания происходит почти мгновенно, поршень не успевает
переместиться, и поэтому процесс сгорания можно считать изохорным. В процессе
сгорания выделяется теплота, за счет которой рабочее тело, находящееся в
цилиндре, нагревается и давление его повышается. Под действием этого давления
поршень вновь перемещается вправо, совершая работу расширения, отдаваемую
внешнему потребителю. После того как поршень дойдет до правой мертвой точки, с
помощью специального устройства открывается выхлопной клапан IV и давление в цилиндре снижается до
значения, немного превосходящего атмосферное (процесс 4-5); при этом часть газа
выходит из цилиндра. Затем поршень вновь движется влево, выталкивая из цилиндра
в атмосферу оставшуюся часть отработавших газов.
После этого начинается новый цикл и т.д.
Термодинамический анализ цикла Отто (цикл со сгоранием при V=const) удобно проводить, рассматривая идеализированный
цикл, соответствующий рассмотренной индикаторной диаграмме. Такой
идеализированный цикл Отто изображен в p,V-диаграмме на
рис.3, поостренный для единицы массы рабочего тела.
Контрольная
6
Задача №16
давление плотность термодинамика политропный
Воздушная холодильная установка (Рисунок 6.16.1) должна обеспечить в
охлаждаемом помещении температуру t1=-5°С при температуре окружающей среды t3=20° C.
Холодопроизводительность установки Q0=150 кДж/с,
давление воздуха перед компрессором p1=0,1 МПа,
на выходе из компрессора p2=0,5 МПа. Определить расход мощности
на установку, расход хладагента, холодильный коэффициент и количество тепла,
передаваемое окружающей среде. Считать, что установка работает по идеальному
циклу (Рисунок 6.16.2).
Дано:
t1=-5° С, t3=20°
Q0=150 кДж/с
p1=0,1 МПа, p2=0,5 МПа
М, N=?
ɛ=?
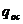 =?
=?

Рисунок 6.16.1 - Воздушная холодильная машина

Рисунок 6.16.2 - Изображение идеального цикла холодильной машины в Ts-диаграмме
Решение:
Температуру
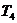 воздуха,
поступающего в холодильную камеру, определяем из соотношения параметров адиабатного
процесса 3-4:
воздуха,
поступающего в холодильную камеру, определяем из соотношения параметров адиабатного
процесса 3-4:
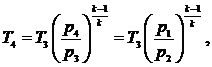 (6.16.1)
(6.16.1)
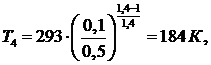
Температуру
 сжатого воздуха, выходящего из компрессора,
определяем из соотношения параметров процесса 1-2:
сжатого воздуха, выходящего из компрессора,
определяем из соотношения параметров процесса 1-2:
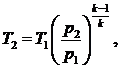 (6.16.2)
(6.16.2)
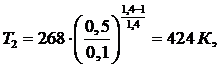
Работу,
затраченную в компрессоре, определяем по формуле:
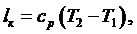 (6.16.3)
(6.16.3)
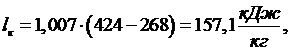
Работу,
полученную в детандере, находим по формуле:
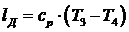 (6.16.4)
(6.16.4)
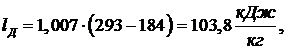
Работа
цикла:
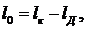 (6.16.5)
(6.16.5)
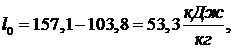
Удельная
холодопроизводительность воздуха по формуле:
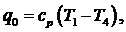 (6.16.6)
(6.16.6)
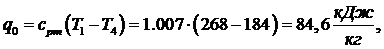
Холодильный
коэффициент установки:
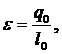 (6.16.7)
(6.16.7)
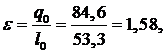
Расход
хладагента М:
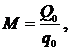 (6.16.8)
(6.16.8)
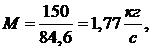
Расход
мощности на установку:
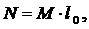 (6.16.9)
(6.16.9)
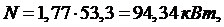
Количество
тепла, передаваемое окружающей среде:
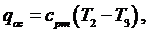 (6.16.10)
(6.16.10)
Ответ: М=1,77 кг/с; N=94,34 кВт; 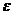 =1,58;
=1,58; 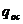 =131,92
кДж/кг.
=131,92
кДж/кг.
Литература
1. Хрусталев
Б.М., Несенчук А.П., Романюк В.Н. Техническая термодинамика - Мн.: УП
«Технопринт», 2004 - 487 с.
2. Андрианова
Т.Н. Сборник задач по технической термодинамике - М.: «Энергоиздат», 1981 - 240
с.
. Нащокин
В.В. Техническая термодинамика и теплопередача - М.: «Высшая школа», 1980. -
469 с.
. Кириллин
В.А., Сычев В.В., Шейндлин А.Е. Техническая термодинамика - М.:
«Энергоатомиздат», 1983 - 416 с.
. Рабинович
О.М. Сборник задач по технической термодинамике - М.: «Машиностроение», 1973 -
342 с.