Клинико-биохимические исследования
ПРЕДИСЛОВИЕ
Практикум по биологической химии, изданный в 1986 году, подвергся
существенной переработке, а также дополнен новыми лабораторными работами в
разделах белки, липиды, биохимия пищеварения, обмен углеводов, белков,
молекулярной патологии и особенно в разделе исследований биологических
жидкостей.
Практикум содержит лабораторные работы разной степени сложности,
позволяющие студентам приобрести навыки самостоятельного биохимического анализа
материала. Ряд работ можно использовать при проведении студентами
учебно-исследовательской и научной работы.
Каждый раздел имеет краткое введение и ссылки на учебник Е.А.Строева
«Биологическая химия».
В начале каждой работы приведен перечень реактивов, оборудования и
материалов, требуемых для ее выполнения. Прописи приготовления некоторых
многокомпонентных реактивов, буферных растворов и перечень биохимических
констант вынесены в приложение.
В практикуме представлено значительное число унифицированных методов,
применяемых в клинике для диагностики заболеваний, приведены скрининг-тесты,
для выявления молекулярных болезней, биохимические методы анализа
лекарственного растительного сырья и биогенных препаратов. Кроме того, при
описании лабораторных работ кратко излагается практическое использование
данного метода в медицинской, фармацевтической и биохимических исследованиях.
При переработке практикума авторы руководствовались опытом преподавания
биохимии на лечебном, фармацевтическом факультетах Рязанского государственного
медицинского университета имени академика И.П. Павлова.
ВВЕДЕНИЕ В БИОХИМИЧЕСКИЙ ПРАКТИКУМ
Биохимические исследования проводятся для получения информации о
многочисленных химических и физико-химических процессах, протекающих в клетках и тканях живых организмов в
норме и при патологии.
В зависимости от цели исследования используются специальные приемы
обработки биологического материала и соответствующие физико-химические методы, которыми студенты
овладевают при выполнении биохимического практикума. Однако прежде чем
приступить к изучению конкретных методик исследования, необходимо познакомиться
с некоторыми общими положениями и приемами практической биохимии.
I. Материал и его подготовка для биохимических
исследований
Объект биохимических исследований. В экспериментальных условиях можно
получить любой биологический материал для биохимических исследований. В клинике
такие возможности ограничены. Для клинико-биохимических анализов используют:
а) биологические жидкости внутренних сред организма - плазму (или
сыворотку) крови, спинно-мозговую жидкость, лимфу, амниотическую,
внутрисуставную и внутриглазную жидкости, а также эксудат и транссудат;
б) биологические выделения (экскреты) - мочу, желчь, слюну, желудочный и
кишечный соки, кал, пот, слезную жидкость, женское молоко и молозиво, семенную
жидкость, слизистые выделения.
Получение этих жидкостей и экскретов относительно несложно и безвредно. В
то же время изучение биохимических процессов непосредственно в клетках, тканях
и органах человека сопряжено с большими трудностями. Прижизненное взятие
кусочков тканей и органов - биопсия - осуществляется во время операции или с
помощью специального инструментария, что позволяет получить материал для
исследований - биоптат. Ввиду сложности, а порой и небезвредности получения
биоптатов их используют для биохимических анализов в клинике относительно
редко. Лишь клетки крови, процедура получения которых проста, все чаще служат
объектом обстоятельных клинико-биохимических лабораторных исследований. В
судебно-медицинских целях и для более обстоятельного изучения причин и исхода
болезни проводятся посмертные биохимические анализы тканей и органов.
Объектом биохимических исследований в фармацевтической практике служит
биологический материал животных и сами лекарственные препараты. Взятие для
анализа биологического материала экспериментальных животных используется при
стандартизации и контроле качества лекарств. Например, по концентрации глюкозы
в крови проводится стандартизация и контроль качества препаратов инсулина. В то
же время анализ таких биологических препаратов, как ферментные, проводится
только биохимическими методами.
Получение и хранение проб для биохимических исследований. Точность
биохимического анализа зависит от правильного отбора и при необходимости
хранения проб биологического материала. Остановимся на ряде общих положений
этого раздела.
Моча чаще всего исследуется в клинико-биохимических лабораториях. Для
этой цели, как правило, собирают в стеклянную или полиэтиленовую бутыль
суточную мочу (для специальных случаев собирают ее порционно) и хранят в
холодильнике. Иногда анализируют отдельно ночную и дневную порции мочи.
Бактериальные загрязнения обычно мало влияют на результаты исследования мочи,
но если необходимо задержать рост микроорганизмов, то добавляют консервант,
например, толуол. При некоторых специальных исследованиях, например, при
определении стероидных гормонов и их метаболитов, в мочу добавляют
концентрированную HCl (из расчета 10мл на 1 л мочи) и т.д. При определении
ферментов целесообразно проводить анализ свежевыпущенной мочи.
Для сбора мочи у мелких лабораторных животных (белые крысы или мыши) их
помещают в стеклянные выделительные воронки (рис.1), обычно на 12 или 24 ч.
Моча через стеклянную воронку для фильтрования, в отверстие которой вставлен
стеклянный «гвоздик» (для задержки фекалий), стекает в мерный цилиндр.
Кровь для исследования берут утром натощак.
Капиллярную кровь получают чаще всего из пальца руки, у маленьких детей
ее берут путем прокола мочки уха, большого пальца ноги или пятки. На
лабораторных занятиях обычно используется для биохимических исследований
капиллярная кровь.
Техника взятия крови из пальца для лабораторного анализа. Как правило,
кровь берут из безымянного пальца левой руки. Если по каким-то причинам это
сделать невозможно, то ее получают из любого другого пальца. Сначала участок
кожи пальца обследуемого очищают ватным тампоном, смоченным этиловым спиртом, а
затем эфиром. Левой рукой захватывают безымянный палец левой руки обследуемого
и слегка сдавливают мякоть пальца в месте предполагаемого укола. Наиболее
удобно делать укол в мякоть пальца слева от срединной линии, несколько отступя
от ногтя. Прокол кожи производят стерильной иглой одноразового пользования,
причем иглу располагают строго перпендикулярно относительно места укола и
вводят почти на всю длину ее острия, рассекая кожу поперек папиллярных линий
(это способствует большему зиянию ранки и более длительному кровотечению).
Появившуюся каплю крови удаляют ватным тампоном. Затем кровь, свободно
выделяющуюся из ранки или после легкого надавливания на мякоть пальца, берут
для анализа с помощью микропипетки, обычно предварительно смоченной
антикоагулянтом (противосвертывающим веществом). Кончиком микропипетки следует
касаться капель выступающей крови, избегая попадания в нее пузырьков воздуха.
Кончик микропипетки, куда забирают кровь, должен располагаться несколько выше,
чем другой ее конец, что помогает лучшему поступлению крови в микропипетку.
После того как кровь будет взята, к ранке прикладывают ватный тампон, смоченный
настойкой иода, и прижимают палец к ладони до остановки кровотечения.
Для получения большого количества крови ее берут из локтевой вены (у
маленьких детей из подкожных вен головы) обязательно с соблюдением необходимых
мер предосторожности. В зависимости от целей биохимическому исследованию может
подвергаться цельная кровь или ее составные части - форменные элементы
(клетки), плазма или сыворотка. Если для анализа необходимы плазма и клетки
крови, то взятую из вены кровь смешивают в пробирке с подходящим
антикоагулянтом, который предотвращает ее свертывание. В качестве
антикоагулянта обычно используют раствор оксалата или цитрата натрия
(концентрации 0,1 моль/л), который связывает ионы кальция в крови и не дает ей
свернуться. В тех же целях применяется и гепарин, которого добавляют около 2 мг
на 10 лмл крови. Благодаря большому отрицательному заряду он взаимодействует с
белками, участвующими в свертывании крови, и препятствует образованию сгустка.
Взятую цельную кровь с добавлением антикоагулянтов используют для получения
плазмы и форменных элементов путем центрифугирования.
Для получения сыворотки кровь собирают в сухую пробирку без
антикоагулянта и оставляют свертываться, помещая пробирку в холодильник на
ночь. Выделившуюся после образования сгустка сыворотку отсасывают пипеткой и
используют для анализа. Сыворотка отличается от плазмы тем, что в ней
отсутствуют фибриноген и другие белки крови, участвующие в ее свертывании и
вошедшие в сгусток. Взятую кровь хранят в холодильнике.
Другие биологические жидкости и экскреты берут, как правило, с помощью
специального инструментария и хранят в холодильнике.
Биоптаты получают с помощью скальпеля или специальных игл для биопсии,
или с помощью специальной эндоскопической техники, снабженной инструментом для
взятия кусочков ткани. Хранить ткани можно в замороженном состоянии при -20°С. Перед исследованием их
размораживают.
Обработка биологического материала. В зависимости от вида биохимического
исследования полученный биологический материал обычно подвергают
предварительной обработке. Как правило, при проведении исследования требуется
определить содержание какого-нибудь нормального или патологического компонента
в биологическом материале или изучить отдельные биохимические реакции,
катализируемые ферментами.
Плазма или сыворотка крови и другие биологические жидкости (включая
экскреты) представляют собой смесь различных природных веществ, растворенных в
водной среде. При определении ферментов биологическую жидкость используют для
исследования целиком, не подвергая какой-либо обработке. Лишь при высокой
концентрации фермента в средах их перед определением разводят. В то же время
присутствие ферментов часто мешает определению в биологических жидкостях тех
веществ, превращение которых они катализируют. Поэтому полученный материал
сразу обрабатывают реактивом, прекращающим действие ферментов, и осаждающим как
ферментные, так и любые другие белки. Для осаждения используют трихлоруксусную,
хлорную, азотную, фосфорно-вольфрамовую, серную и другие кислоты, гидроксид
бария с сульфатом цинка или просто термическую обработку биологического
материала.
При биохимическом исследовании клеток, тканей и органов приемы их
обработки усложняются, поскольку изучаемый компонент может быть локализован в
каком-либо органоиде или даже его части, например, в мембране. Поэтому сначала
клетки или ткань подвергают разрушению различными способами. Чаще всего
применяют механическое разрушение ткани с помощью гомогенизатора. Он
представляет собой стеклянный стакан, форма которого и размеры могут быть
различны. В этот стакан помещают кусочек ткани, измельченный ножницами, и
соответствующую жидкую среду (обычно раствор сахарозы, хлорида калия),
позволяющую сохранить интактность выделяемых структурных образований клетки.
Растирание ткани осуществляется при движении вверх и вниз вращающегося в
стакане гомогенизатора пестика, который соединен через привод с осью
электромоторчика. На время гомогенизации стакан гомогенизатора помещают в лед,
чтобы избежать нагревания и повреждения субклеточных структур.
В простейшем случае гомогенат получают, растирая ткань с толченым стеклом
или кварцевым песком в фарфоровой ступке.
Возможно также разрушение ткани и клеток высокочастотными ультразвуковыми
колебаниями и с помощью «осмотического шока». Последний метод используют при
разрушении эритроцитов и других клеток крови. Он заключается в том, что при
добавлении дистиллированной воды мембрана клеток разрывается от избыточного
внутриклеточного осмотического давления.
Гомогенизация ткани и разрушение клеток - стадия обработки,
предшествующая разделению клеточных компонентов.
2. Основные методы разделения и выделения
веществ при биохимиеских иследованиях
Гомогенаты представляют собой сложную смесь частиц, отличающихся по
размеру, форме и химическому составу. Для разделения и выделения этих частиц, а
также молекул, содержащихся в биологическом материале, используются различные
методы, которые суммированы в табл.1.
Таблица 1. Основные методы разделения и выделения веществ, применяемые
при биохимических исследованиях (по В.В.Меньшикову, с дополнениями)
|
Свойство, используемое для
разделения
|
Методы разделения и
выделения
|
|
Различие температур
перехода
|
1.Перегонка (дистилляция)
|
|
веществ из одного состояния
в другое
|
2.Микродиффузия
(изотермическая дистилляция)
|
|
3.Озоление
|
|
4.Выпаривание (высушивание)
|
|
5.Лиофилизация
|
|
Различие растворимости
веществ
|
6.Экстракция
|
|
7.Противоточное
распределение
|
|
8.Фракционное осаждение (по
видам осаждающих агентов и средств):
|
|
8.1.Нейтральными солями
(высаливание)
|
|
8.2.Кислотами
|
|
8.3.Гидрофильными
органическими растворителями
|
|
8.4.Водорастворимыми
недиссоциирующими высокомолекулярными полимерами
|
|
8.5.Тяжелыми металлами и их
гидроксидами
|
|
8.6.Органическими катионами
|
|
8.7.Анионами и полианионами
|
|
8.8.Иммунопреципитацией
|
|
Различие скорости
седиментации
|
9.Седиментационный анализ:
|
|
(осаждения)
|
9.1.Центрифугирование
|
|
9.2.Ультрацентрифугирование
|
|
Различие в размерах молекул
|
10.Диализ:
|
|
10.1.При равном давлении
|
|
10.2.При повышенном
давлении
|
|
10.3.При пониженном
давлении (ультрафильтрация)
|
|
10.4.Электродиализ
|
|
Различие распределения
между подвижной и неподвижной фазами, основанное на неодинаковой
растворимости, сорбируемости,
|
11.Хроматография (по
технике осуществления подразделяется на колоночную, тонкослойную и бумажную):
|
|
на разнице в значениях
электрического заряда, в размерах молекул
|
11.1.Адсорбционная (жидкостно-адсорбционная,
ионообменная, газо-адсорбционная)
|
|
11.2.Распределительная
(жидкостно-жидкостная, газо-жидкостная)
|
|
11.3.Гель-хроматография и
гель-фильтрация
|
|
11.4.Аффинная
(биоспецифическая) хроматография
|
|
Различие в электрическом
заряде молекул
|
12.Электрофорез:
|
|
12.1.Свободный
|
|
12.2.На носителях: а) на
бумаге (простой и высоковольтный) б) на гелях (агар, агароза, крахмал,
полиакриламид) в) на пленке (ацетилцеллюлоза)
|
|
13.Комбинированный
электрофорез:
|
|
13.1.Электрофорез+иммунодиффузия
(иммуноэлектрофорез)
|
|
13.2.Электрофорез+хроматография
(техника «отпечатков пальцев»)
|
|
Различие в электрическом
заряде молекул при определенном рН
|
14.Изоэлектрическое
фокусирование в градиенте рН:
|
|
14.1.Свободное
|
|
14.2.Зональное
|
|
14.3.В геле
|
|
14.4.Иммуноэлектрофокусирование
|
3. Основные приборы, используемые в практикуме
При проведении биохимических исследований используются различные приборы
и оборудование, позволяющие выделить изучаемое вещество и определить его
содержание в биологическом материале.
Фотометрические
приборы
Фотометрия (абсорбциометрия) - метод качественного и количественного
анализа, основанный на измерении интенсивности поглощения или рассеяния
веществом светового потока.
Светопоглощение или экстинкция, согласно закону фотометрии Ламберта-Бугера-Бера
прямо пропорционально концентрации поглощающего вещества, толщине слоя раствора
и молярному коэффициенту экстинкции (Е). Последний представляет собой
поглощение раствора вещества концентрацией 1моль/л, помещенного в кювету с
толщиной слоя 1см, и измеряется в л·моль-1·см-1.
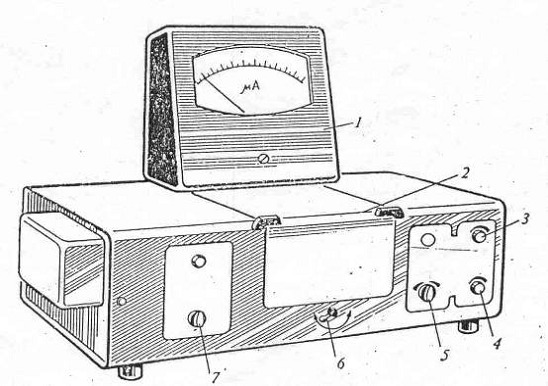
Рис. 1. Общий
вид колориметра фотоэлектрического концентрационного
1 - гальваномер; 2 - крышка кюветного отделения; 3 - ручка установки
«грубо»; 4 - ручка установки «точно»; 5 - ручка чувствительности; 6 - ручка
кюветодержателя; 7 - переключатель светофильров.
Часто используют и другой показатель - удельный коэффициент экстинкции
Е1см1%, т.е. поглощение света 1%-ным раствором вещества в кювете с толщиной
слоя 1см. Для определения содержания какого-либо компонента биологического
материала строят калибровочный график, отражающий зависимость между экстинкцией
(Е) и концентрацией (С) этого вещества в растворе и представляющий собой прямую
линию в прямоугольной системе координат.
Для фотометрического анализа используют фотоэлектроколориметры,
фотоэлектроколориметры-нефелометры и спектрофотометры.
Фотоэлектроколориметры (ФЭК) различных моделей применяют для анализа
светопоглощения окрашенных растворов веществ в видимой области спектра (рис.1).
Фотоэлектроколориметры-нефелометры применяют для измерения интенсивности
светорассеивания или ослабления светового потока изучаемых веществ в мутных
средах.
Колориметр фотоэлектрический концентрационный позволяет благодаря
большому набору узкополосных светофильтров проводить измерения в определенной
области спектра в диапазоне длин волн 315-980 нм. Этот прибор используют для
определения светопоглощения веществ, а также коэффициент пропускания
рассеивающих взвесей, эмульсий и коллоидных растворов в проходящем свете.
Порядок работы изложен в инструкции.
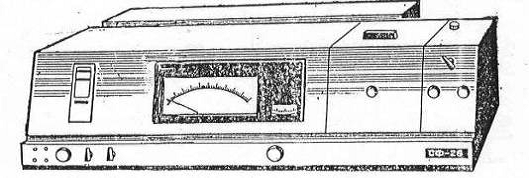
Рис. 2. Общий вид спектрофотометра
Спектрофотометры (рис.2) используют для изучения строения, качественного
и количественного анализа вещества по интенсивности поглощения его в
монохроматическом свете. В клинико-биохимических и научных исследованиях широко
применяются спектрофотометры СФ-16, СФ-26, СФ-46 и их современные модификации,
работающие в области спектра от 186 до 1100 нм.
Правила работы на спектрофотометре изложены в инструкциях к прибору.
Флуориметрические
приборы
Для качественного и количественного анализа веществ, которые, поглощая
энергию, способны к люминисценции (флуоресценции) применяются флуороскопы и
флуориметры.
Флуороскоп позволяет проводить полуколичественный анализ путем
визуального сравнения интенсивности флуоресценции опытного раствора со
стандартным, где концентрация вещества известна.
Флуориметры позволяют проводить количественный анализ. В этих приборах
выделение области спектра, необходимого для возбуждения данного вещества,
осуществляется первичными светофильтрами, а пропускание характерного для него
участка излучения (свечения) - с помощью вторичных светофильтров.
Центрифуги
Центрифугирование - метод разделения смеси компонентов жидких сред под
действием центробежной силы. Его используют для отделения форменных элементов
крови от плазмы, для осаждения и выделения клеток из мочи, спинно-мозговой
жидкости и других сред организма, а также для отделения осадков от жидкой фазы
(надосадочная жидкость, или супернатант). В клинико-биохимических лабораториях
для этой цели используют малогабаритные центрифуги общего назначения. Они дают
максимальную скорость около 6000 об·мин-1.
Для специальных биохимических исследований применяют ультрацентрифуги с
охлаждением (рефрижераторные), например ЦР-2-25, УЦП-1-75 и др. Они позволяют
проводить дифференциальное центрифугирование, т.е. разделение частиц,
отличающихся друг от друга размерами и плотностью.
Скорость осаждения частиц определяется центробежным ускорением, которое
обычно выражают в единицах g (гравитационная постоянная, равная 980 см·с-2).
Величину g обозначают как относительное центробежное ускорение. Она зависит от
скорости вращения ротора (п, об·мин-1) и расстояния (r, см) от оси вращения
ротора до середины столбика жидкости в пробирке и определяется по формуле
= 1,11∙10-5n2r
На практике g устанавливают по номограмме, прилагаемой к инструкции для
каждой ультрацентрифуги. С помощью дифференциального центрифугирования выделяют
субклеточные частицы - ядра, митохондрии, лизосомы, микросомы и др.
Приборы для
электрофореза
Электрофорез - метод разделения заряженных частиц под действием внешнего
электрического поля. Электрофорез проводят в специальных аппаратах разной
конструкции (рис.3). Поддерживающий материал располагается в них на лотках,
специальных кюветах, стеклянных трубочках, стеклах и может находиться в
горизонтальном (горизонтальный электрофорез) или вертикальном (вертикальный
электрофорез) положении. Для электрофоретического разделения используют
пористый поддерживающий материал (фильтровальная бумага, ацетилцеллюлоза),
различные гели (агар, крахмал, полиакриламид, декстран) и т.д. Перед помещением
в камеру аппарата для электрофореза бумагу смачивают буферным раствором, а гель
заранее готовят на нем. Смесь веществ, наносимая микропипетками на
горизонтально расположенный материал или на столбик геля, разделяется при
электрофорезе на фракции. Условия электрофореза зависят от целей разделения и
подбираются заранее.
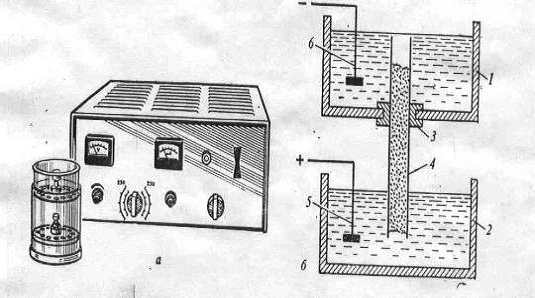
Рис. 3. Прибор (а) и камера (б) для электрофореза:
- верхняя камера; 2 - нижняя камера; 3 - уплотнительные кольца;
- трубочка с гелем; 5 - анод; 6 - катод
Электрофореграммы фиксируют, окрашивают специальными красителями для
выявления локализации на них разделенных веществ. Если вещество флуоресцирует,
то его положение устанавливают при просмотре фореграммы в ультрафиолетовом
свете. Количественное определение производят по содержанию красителя,
связавшегося с разными фракциями веществ на электрофореграмме, или путем прямого
измерения светопоглощения этих зон на специальных приборах - денситометрах.
4. Применение единиц СИ для выражения
результатов клинико-биохимических исследований
Общие
положения
В биохимии и клинической химии используются основные и производные единицы
СИ.
Основные единицы СИ. К основным единицам относятся семь единиц СИ: метр,
килограмм, секунда, моль, ампер, кельвин и кандела (табл.2).
Таблица 2. Основные единицы СИ.
|
Величина
|
Наименование единицы
|
Обозначение единицы
|
|
Длина
|
Метр
|
м
|
|
Масса
|
Килограмм
|
кг
|
|
Время
|
Секунда
|
с
|
|
Количество вещества
|
Моль
|
моль
|
|
Термодинамическая
температура
|
Кельвин
|
К
|
|
Сила света
|
Кандела
|
кд
|
Первые четыре из них широко применяются в клинической химии.
Производные единицы СИ представляют собой сочетание основных единиц (табл.3).
Например, производной единицей является скорость химической (ферментативной)
реакции. Так, активность фермента выражается в единицах количества вещества,
превращенного (имеется в виду убыль субстрата или накопление продукта реакции)
в единицу времени.
Таблица 3. Производные единицы СИ
|
Величина
|
Наименование единицы
|
Обозначение единицы
|
|
Площадь
|
Квадратный метр
|
м2
|
|
Объем, вместимость
|
Кубический метр
|
м3
|
|
Давление (парциальное
осмотическое)
|
Паскаль
|
Па
|
|
Плотность
|
Килограмм на кубический
метр
|
кг/м3
|
|
Массовая концентрация
компонента
|
Килограмм на кубический
метр
|
кг/м3
|
|
Молярная концентрация
компонента
|
Моль на кубический метр
|
моль/м3
|
|
Активность компонента
|
Моль превращенного вещества
в секунду
|
моль/с
|
|
Скорость химической
(ферментативной) реакции
|
Моль превращенного вещества
в секунду на кубический метр
|
моль/(с·м3)
|
Кратные и дольные значения единиц СИ. Довольно часто выражение
результатов клинико-биохимических исследований в единицах СИ оказывается
неудобным, потому что получаемые значения бывают либо очень малы, либо велики.
Для этого система СИ предусматривает использование кратных и дольных значений
единиц СИ. Их названия образуют от исходных названий единиц СИ, добавляя к ним
соответствующие приставки (табл.4). Например, одна тысячная доля моля (10-3
моль) называется миллимоль и обозначается ммоль.
Единицы, допустимые к применению наравне с единицами СИ. Некоторые
единицы хотя и не относятся к единицам СИ, но используются наравне с ними. Из
них для выражения результатов биохимических исследований особенно важны единица
объема - литр (л) и единицы времени - минута (мин), час (ч), сутки (сут),
которые используются при выражении результатов биохимических исследований.
Таблица 4. Множители и приставки, применяемые для обозначения десятичных
кратных и дольных единиц СИ
|
Множитель
|
Приставка
|
Обозначение приставки
(символ)
|
Множитель
|
Приставка
|
Обозначение приставки
(символ)
|
|
1012
|
гера
|
Т
|
10-3
|
милли
|
м
|
|
109
|
гига
|
Г
|
10-6
|
микро
|
мк
|
|
106
|
мега
|
М
|
10-9
|
нано
|
н
|
|
103
|
кило
|
к
|
10-12
|
пико
|
п
|
|
10-1
|
деци
|
д
|
10-15
|
фемто
|
ф
|
|
10-2
|
санти
|
с
|
|
|
|
Некоторые рекомендации по применению единиц СИ в клинико биохимических
исследованиях
Выражение концентрации вещества. Концентрацию веществ, молекулярная масса
которых известна (например, концентрацию глюкозы, мочевины, мочевой кислоты в
биологических жидкостях), выражают в единицах молярной, но не массовой
концентрации (т.е. в молях на литр или в дольных единицах - миллимоль на литр,
микромоль на литр и т.д.).
Вещества, у которых не установлена или точно не известна молекулярная
масса, выражаются в единицах массовой концентрации или в массовых долях. Так,
массовая концентрация может быть выражена в кг/л, г/л, мг/л, мкг/л и т.д. В
этих единицах выражаются результаты определения содержания белков (альбумин,
фибриноген, общий белок, гаптоглобин), общих липидов, так называемого сахара
(под которым понимается сумма восстанавливающих моно- и дисахаридов) и других
компонентов в биологических жидкостях (плазме крови, спинно-мозговой жидкости,
моче и др.). Хотя для некоторых белков плазмы крови, например, для гаптоглобина,
церулоплазмина, альбумина, известна относительная молекулярная масса, тем не
менее пока сохраняется правило выражать содержание всех белков в единицах
концентрации (по массе) или в массовых долях. Содержание гемоглобина, согласно
рекомендации международного комитета по стандартизации в гематологии, также
пока выражают не в миллимолях на литр (ммоль/л), а в граммах на литр (г/л).
Содержание веществ в тканях. При биохимических исследованиях в клинике
требуется иногда определить содержание тех или иных веществ в биоптатах.
Результаты определения также выражаются в единицах массы (если молекулярная
масса неизвестна) и в молях (если молекулярная масса известна) в расчете на 1
кг сырой или высушенной ткани, т.е. в г/кг, мг/кг, мкг/кг или в моль/кг,
ммоль/кг, мкмоль/кг.
Не рекомендуется:
а) выражать результаты на единицы объема, дольные от литра: на миллилитр,
микролитр и т.д., а также на единицы массы, дольные от килограмма: грамм,
миллиграмм и т.д., т.е. нельзя использовать такие единицы, как мг/мл, мкг/мл
или мг/г, мкг/г и т.д.;
б) использовать понятие «миллиграмм-процент» для выражения концентрации
веществ, поскольку оно отражает отношение разнородных величин;
в) применять качественную или полуколичественную оценку результатов
знаками «+» или «-» (в некоторых случаях, например, при оценке проб на
коллоидную устойчивость белков плазмы - проба Вельтмана, тимоловая проба, можно
пользоваться числовыми значениями: 0, 1, 2, 3 и т.д.).
Концентрация ионов водорода. Концентрацию ионов водорода в биологических
жидкостях можно выражать двояко: через молярную концентрацию веществ (моль/л)
или через шкалу рН.
Парциальное давление газов. При исследовании парциального давления газов,
например ро2 и рсо2, в крови следует выражать результаты в килопаскалях (кПа).
При исследовании кислотно-щелочного равновесия парциальное давление газов тоже
должно выражаться в кПа.
Результаты анализа мочи. Содержание веществ в моче (точнее выделение
веществ с мочой) выражают в молях на сутки или, если неизвестна молекулярная
масса, в единицах массы на сутки.
Результаты исследования ферментов. При исследовании ферментов активность
ферментов рекомендуется выражать в моль/с (или моль·с-1), а также в моль/мин.
моль/ч. При определении активности учитывается конкретно используемый субстрат,
превращенный в ходе реакции. Поэтому в результатах определения активности
ферментов следует давать ссылку на использованный метод определения.
Практически при определении в биологических жидкостях активность
ферментов относят к единице объема - литру (напомним, что на дольные единицы
литра выражать результаты нельзя). Так, активность ферментов выражают в молях в
секунду на литр (моль·с-1·л-1). Для удобства выражения результатов в каждом
конкретном случае применяют дольные единицы моля (ммоль, мкмоль, нмоль) или
другие единицы времени (минута, час).
В тех случаях, когда молекулярная масса субстрата неизвестна (например,
при использовании белка как субстрата при определении активности
протеолитических ферментов или крахмала при определении активности α-амилазы), активность фермента
выражают в единицах массы превращенного субстрата. Например, активность α-амилазы выражают в мг/(ч·л).
По рекомендации комиссии по ферментам Международного биохимического союза
вводится единица активности ферментов, получившая название катал, сокращенно
кат. Она соответствует скорости превращения 1 моль субстрата за 1 с, а также
может быть выражена в дробных единицах: миллимолях (10-3)- милликатал,
микромолях (10-6)- микрокатал, наномолях (10-9)- нанокатал, пикомолях (10-12)-
пикокатал и т.д. Однако пока эти рекомендации не получили широкого
распространения.
БЕЛКИ
Белки - высокомолекулярные азотсодержащие органические соединения,
состоящие из аминокислот, соединенных пептидными связями, и имеющие сложную
структурную организацию.
Белки делятся на две группы: простые, или протеины, и сложные, или
протеиды. Протеины состоят только из аминокислот, связанных в полипептидную
цепь пептидными связями, а протеиды содержат кроме аминокислот небелковый
компонент, или простетическую группу (углевод, липид, нуклеиновую кислоту,
кофактор и т.д.). Белки имеют несколько уровней структурной организации:
первичный, вторичный, третичный и в большинстве случаев четвертичный.
1. Химическая природа простых белков
Присутствие веществ белковой природы в биологическом материале и
лекарственных препаратах можно обнаружить с помощью качественных реакций на
структурные компоненты белка и его функциональные группы. Все известные реакции
выявления белков и пептидов можно разделить на три типа.
1. Реакция на пептидную группу,
характерную для полипетидной цепи и нетипичную для прочих биологических
веществ. Она специфична для белков и пептидов.
2. Реакции на концевые α-амино- или α-карбоксильные группы. Эти реакции
дают также свободные α-аминокислоты и некоторые другие соединения.
3. Реакции на отдельные боковые радикалы
или группы аминокислот, входящих в полипептиды. Эти реакции специфичны также и
для свободных α-аминокислот и других веществ, содержащих соответствующую
функциональную группу в молекуле.
Работа 1. Качественные (цветные) реакции на
функциональные группы белков и аминокислот
Реактивы. Биуретовый реактив* (содержит NaOH и ионы Cu2+), нингидрин,
0,5%-ный водный раствор; азотная кислота, конц.; гидроксид натрия, 20%-ный
раствор; реактив Миллона*; уксусная кислота, ледяная; серная кислота, конц.;
ацетат свинца, 5%-ный раствор; нитропруссид натрия, 5%-ный раствор.
Оборудование. Штатив с простыми пробирками; капельницы; пипетки
вместимостью 1 мл; водяная баня.
Материалы для исследования.
1. Раствор яичного белка (белок одного
куриного яйца отделяют от желтка, растворяют в 20-кратном объеме
дистиллированной воды, фильтруют через несколько слоев марли и хранят в
холодильнике).
2. Неразбавленный свежий яичный белок.
3. 1%-ные растворы глицина,
глицилглицина, α-аланина, β-аланина.
4. 0,1%-ные растворы фенилаланина,
тирозина, триптофана, гистидина, цистеина гидрохлорида, метионина.
а. Биуретовая реакция на пептидную группу (реакция Пиотровского). Метод
основан на способности пептидной группы белков и полипептидов образовывать в щелочной
среде с ионами Cu2+ комплексное соединение фиолетового цвета с красным или
синим оттенком в зависимости от числа пептидных связей в белке.
Биуретовая реакция положительна с белками и пептидами, имеющими не менее
двух пептидных связей ( ─ С ─NH ─ ). С ди- и трипептидами она
неустойчива.
║
О
Биуретовую реакцию дают небелковые вещества, содержащие не менее двух
пептидных групп, например, производное мочевины - биурет
N ─ C ─ NH ─C ─ NH2
давший название этой реакции, и некоторые
║ ║О
другие. В сильнощелочной среде пептидные группы полипептидов переходят в
енольную форму, в которой и взаимодействуют с ионом Cu2+, образуя окрашенный
биуретовый комплекс примерно следующего строения:
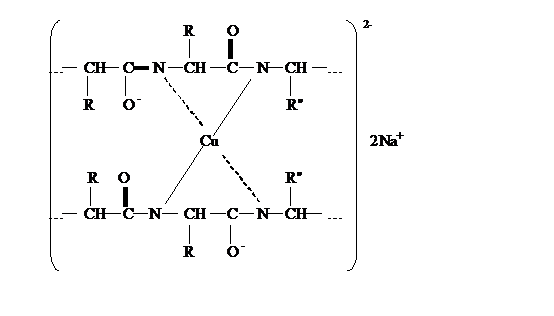
На
свободные аминокислоты биуретовая реакция обычно отрицательна. Исключение
составляют гистидин, серин, треонин, аспарагин, которые при больших
концентрациях в растворе могут образовывать окрашенный биуретовый комплекс
Cu2+.
Ход
определения. В одну пробирку вносят 5 капель ратсвора яичного белка, в другую -
глицилглицина и в третью - глицина.
Добавляют
в каждую пробирку по две капли биуретового реактива, слегка сбалтывают и
наблюдают за появлением окрашивания.
б.
Нингидриновая реакция на α-аминогруппу. Метод основан на взаимодействии нингидрина
с α-аминогруппой аминокислот, пептидов, белков с
образованием окрашенного комплекса синего или сине-фиолетового цвета.
При
нагревании в присутствии нингидрина происходит окислительное дезаминирование α-аминогрупп аминокислот и пептидов, а молекула
нингидрина при этом восстанавливается:
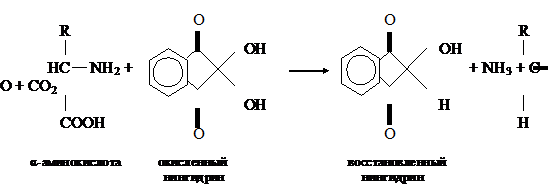
Восстановленный
нингидрин реагирует с аммиаком и другой молекулой окисленного нингидрина, в
результате образуется окрашенное соединение (сине-фиолетовый комплекс Руэмана):
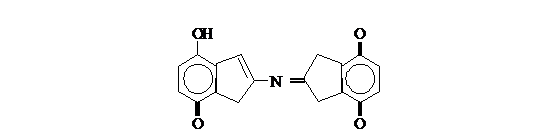
Пролин
и оксипролин дают с нингидрином окрашенный продукт желтого цвета. Нингидриновая
реакция может быть положительна с некоторыми аминами, амидами кислот и
некоторыми другими соединениями.
Ход
определения. В одну пробирку вносят 5 капель раствора яичного белка, в другую -α-аланина и в третью - β-аланина.
Добавляют
в каждую пробирку по 2 капли раствора нингидрина, нагревают до кипения и через
1-3 мин наблюдают появление окрашивания.
в.
Ксантопотеиновая реакция на ароматическое кольцо циклических аминокислот
(реакция Мульдера). Метод основан на способности аминокислот и аминокислотных
остатков полипептидов, содержащих ароматическое кольцо, образовывать при
взаимодействии с концентрированной азотной кислотой динитропроизводные
соединения желтого цвета. В щелочной среде они переходят в хиноидные структуры,
имеющие оранжевое окрашивание.
Ксантопротеиновая
реакция характерна для фенилаланина, тирозина и триптофана, имеющих
ароматическое (бензольное) кольцо. Эти аминокислоты или содержащие их белки при
нагревании с концентрированной азотной кислотой дают нитросоединения желтого
цвета.
Например,
в реакции с тирозином образуется динитротирозин; добавление гидроксида натрия
приводит к образованию натриевой соли хиноидной структуры динитротирозина.
белок сыворотка кровь биохимический
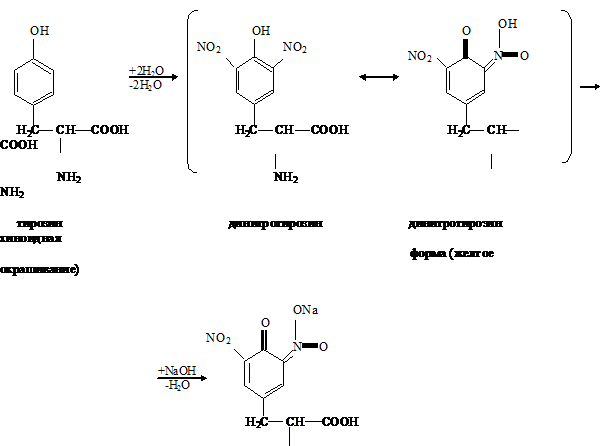
Ксантопротеиновая реакция положительна со многими ароматическими
соединениями (бензол, фенол и др.).
Ход определения. 1.В одну пробирку вносят 5 капель раствора яичного белка,
в другую - фенилаланина, в третью - тирозина и в четвертую - гистидина.
В каждую пробирку добавляют по 3 капли концентрированной азотной кислоты,
нагревают до кипения (осторожно! В защитных очках!) и наблюдают за появлением
окрашивания.
Содержимое пробирок охлаждают под струей водопроводной воды, затем в
каждую по каплям добавляют раствор гидроксида натрия, пока не начнется переход
окраски.
г. Реакция Миллона на тирозин. Метод основан на способности тирозина (как
свободного, так и входящего в состав белка) при нагревании с реактивом Миллона
образовывать ртутную соль нитротирозина, окрашенную в пурпурно-красный цвет

Эта
реакция положительна также для фенольных соединений.
Ход
определения. В одну пробирку вносят 5 капель раствора яичного белка, в другую -
тирозина и в третью - фенилаланина. В каждую из них добавляют по 3 капли
реактива Миллона и осторожно нагревают на водяной бане (не выше 50˚С),
наблюдая за появлением окрашивания.
д.
Реакция Адамкевича на триптофан. Метод основан на способности триптофана в
кислой среде реагировать с глиоксиловой кислотой с образованием соединения,
окрашенного в красно-фиолетовый цвет.
При
нагревании две молекулы триптофана взаимодействуют с глиоксиловой кислотой с
образованием окрашенного соединения
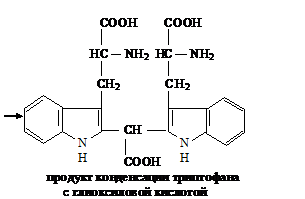
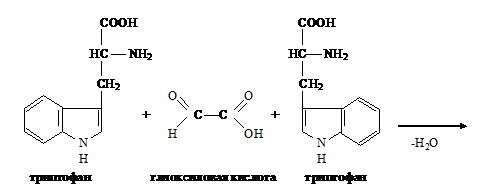
Для
проведения реакции используют ледяную уксусную кислоту, в которой как примесь
содержится глиоксиловая кислота. В качестве водоотнимающего средства в реакции
используется концентрированная серная кислота.
Ход
определения. В одну пробирку вносят 2 капли неразбавленного свежего яичного
белка, а в другую - раствор триптофана.
Добавляют
в каждую из них по 10 капель ледяной уксусной кислоты и осторожно нагревают до
растворения выпавшего осадка белка в первой пробирке, после чего содержимое ее
охлаждают.
Очень
осторожно, по стенке, наклонив пробирку, подслаивают в каждую из пипетки около
1 мл концентрированной серной кислоты, следя за тем, чтобы жидкости не
смешались. На границе двух слоев возникает характерное окрашенное кольцо,
которое постепенно распространяется на весь раствор.
е.
Реакция Фоля на аминокислоты, содержащие слабосвязанную серу (цистеин, цистин).
Метод основан на способности белков, в состав которых входят серусодержащие
аминокислоты (цистеин, цистин), в щелочной среде при нагревании образовывать
сульфид натрия, который с плюмбитом натрия дает черный или бурый осадок
сульфида свинца:
CH2
─ SH CH2 ─ OH
│
│─ NH2 + 2NaOH → CH ─ NH2 + Na2S + H2O
│
│COOH(CH3COO)2 + 2 NaOH → Pb(OH)2 + 2CH3COONa(OH)2 + 2 NaOH →
Na2PbO2 + 2H2OS + Na2PbO2 + H2O → PbS↓ + 4NaOH
Ход
определения. В три пробирки наливают по 10 капель раствора ацетата свинца и по
каплям в каждую из них прибавляют раствор гидроксида натрия до растворения
первоначально образующегося осадка. В одну пробирку добавляют 5 капель раствора
яичного белка, в другую - цистеина, в третью - метионина, смеси кипятят 1-2 мин
и наблюдают за изменением их цвета и выпадением осадка.
ж.
Нитропруссидная реакция на серусодержащие аминокислоты. Метод основан на
способности сульфида натрия, образующегося щелочном гидролизе серусодержащих
аминокислот, давать с нитропруссидом натрия окрашенное комплексное соединение
красно-фиолетового цвета:
1. H2C ─ SH H2C ─ OH
│ кипячение │─ NH2 + 2NaOH H C ─
NH2 + 2Na2S + H2O
│ │COOH
цистеин серинS + Na2[Fe(CN)5NO] → Na4[Fe(CN)5NOS]
нитропруссид окрашенный натрия комплекс
Ход определения. В одну пробирку вносят 5 капель неразбавленного свежего
яичного белка, в другую - раствор цистеина, в третью - метионина. Добавляют в
каждую пробирку по 10 капель раствора гидроксида натрия, кипятят 3 мин и затем
охлаждают их содержимое.
В каждую пробирку прибавляют 2-3 капли раствора нитропруссида натрия и
наблюдают за появлением окрашивания.
Оформление работы. После каждой реакции сделать вывод о ее специфичности
для исследуемого вещества и присутствии соответствующих функциональных групп в
яичном белке. Результаты оформить в виде таблицы, отмечая знаками «плюс» или
«минус» результат реакции.
|
№№п/п
|
Исследуемый материал
|
Реакция
|
|
|
Биуретовая
|
Нингидриновая
|
Ксантопротеиновая
|
Фоля
|
Миллона
|
Адамкевича
|
Нитропруссидная
|
|
|
|
|
|
|
|
|
|
Практическое значение работы. Качественные реактивы (или, как их часто
называют, цветные реакции) используются в клинико-биохимических лабораториях,
фармацевтической практике и биохимических исследованиях для обнаружения
присутствия белка и аминокислот в биологических средах, качественного анализа
белковых лекарственных средств, препаратов гидролизатов белков и аминокислот,
пептидов и белков на хроматограммах и электрофореграммах. Многие качественные
реакции положены в основу методов количественного определения белков и
аминокислот.
Работа 2. Качественный анализ некоторых белковых
препаратов
Реактивы и оборудование те же, что и в работе 1.
Материалы.
1. Аминопептид или другой гидролизат
белков - препарат для парентерального питания.
2. Желатиноль (препарат из пищевого
желатина) или желатин, 1%-ный раствор.
Метод анализа основан на использовании качественных реакций, рассмотренных
в предыдущей работе, для выявления присутствия отдельных аминокислот в составе
белковых препаратов.
Ход определения. С белковыми препаратами проводят качественные реакции -
биуретовую, нингидриновую, ксантопротеиновую, Миллона, Фоля, Адамкевича и
нитропруссидную. Для проведения каждой реакции используют по 5 капель
гидролизата белков и препарата желатина.
Оформление работы. Полученные данные оформить в виде таблицы, приведенной
в работе 1.
В выводе показать наличие, согласно проведенному анализу, отдельных
аминокислот и сравнительную полноценность исследуемых белковых препаратов.
Практическое значение работы. Состав аминокислот определяет не только
свойства белка, но и его питательную и лекарственную ценность. Биологически
полноценными считаются белки, содержащие все незаменимые аминокислоты. Поэтому
представляет интерес наличие именно этих аминокислот в белковых гидролизатах.
Гидролизаты белков различной природы используются в медицине как лекарственные
препараты для парентерального обмена. В лечебных целях применяются различные
белки плазмы крови, желатина и др.
В практике контроль качества и количественный анализ таких лекарственных
средств, как гидролизаты белков и препаратов, содержащих смеси аминокислот или
отдельные аминокислоты, основываются на качественном и количественном анализе
конкретных аминокислот. Так, одним из основных показателей качества
гидролизатов белков является содержание триптофана, которое составляет в
аминопептиде и в фибриносоле около 0,5 г/л, а в растворах гидролизина и гидролизата
казеина не менее 0,15 г/л.
Работа 3. Хроматографический метод разделения
аминокислот
Хроматография - один из эффективных и широко применяемых в биохимических
исследованиях методов разделения аминокислот. Наиболее простой и доступной
является распределительная хроматография на бумаге. Для проведения ее
используют систему растворителей, составляющих подвижную и неподвижную фазы, от
правильного подбора которых зависит эффективность разделения аминокислот. В
частности, применяют фенол, насыщенный водой. При обработке хроматографической
бумаги этой смесью растворителей вода с небольшим количеством фенола
впитывается в бумагу и образует неподвижную фазу, а фенол, насыщенный водой,
служит подвижной фазой.
В зависимости от направления фронта передвижения растворителя различают
следующие виды хроматографии: восходящую, нисходящую, одномерную, двухмерную и
радиальную. Расположение отдельных аминокислот обнаруживают путем проявления
хроматограмм. Для этого высушенную бумагу обрабатывают раствором нингидрина и
затем нагревают ее в сушильном шкафу при 100°С, т.е. проводится качественная
нингидриновая реакция на аминокислоты, находящиеся на бумаге.
Скорость перемещения аминокислот выражают коэффициентом Rf, который
представляет собой отношение расстояния, пройденного данной аминокислотой, к
пути, пройденному фронтом растворителя:
= a/b,
где a - расстояние от места нанесения раствора смеси аминокислот (линия
старта) до центра пятна конкретной аминокислоты;- путь, пройденный
растворителем от линии старта до его фронта окончания хроматографии, мм.
Для каждой аминокислоты характерно свое значение Rf, которое зависит от
сорта хроматографической бумаги, системы растворителей, температуры, рН среды и
т.д.
Реактивы. Фенол, насыщенный водой*; нингидрин, 0,2%-ный раствор в
ацетоне.
Оборудование. Термостат, отрегулированный на температуру 37-38°С;
сушильный шкаф, отрегулированный на температуру 100-105°С и имеющий перекладины
с крючками для подвешивания хроматограмм; большие пробирки (диаметр 2,0-2,5 см,
длина 18-20 см) с плотно подогнанными пробками и штатив для них; полоски
хроматографической бумаги (ленинградская, лучше марки «быстрая», 12х150 мм);
простой карандаш и линейка; игла с ниткой; микропипетка; чашка Петри или
пульверизатор; пинцет; ножницы; пипетка вместимостью 5 мл.
Материалы. Раствор смеси L-аланина, лейцина и глутаминовой кислоты, 0,04
моль/л.
Метод основан на разной скорости передвижения аминокислот по бумаге в
зависимости от коэффициента распределения их между неподвижной (вода с примесью
фенола) и подвижной (фенол, насыщенный водой) фазами растворителя.
Ход определения. Берут пинцетом за конец полоску бумаги (не касаться
бумаги пальцами!), прокалывают его иглой с ниткой, которую завязывают петлей
длиной 5-6 см. На противоположном конце полоски, отступив от края 2 см,
проводят простым карандашом линию старта и в центре ее очерчивают кружок
диаметром 3-4 мм для нанесения раствора смеси аминокислот.
Полоску укладывают на лежащие стеклянные пробирки и наносят 0,2 мл
раствора смеси аминокислот, но не сразу, а порциями. После нанесения каждой
порции пятно подсушивают, чтобы оно не расплывалось за пределы очерченного
карандашом кружка.
В сухую пробирку с помощью пипетки вносят 2 мл фенола, насыщенного водой
(при работе с фенолом соблюдать осторожность: вызывает ожоги! Не насасывать его
в пипетку ртом!), следя за тем, чтобы не смочить стенки пробирки.
Ставят пробирку в штатив строго вертикально. Осторожно, держа за нитку,
опускают в пробирку полоску бумаги, погружая ее нижний конец в растворитель не
более чем на 2-3 мм, и закрепляют ее в висячем положении, прижав петлю плотно
закрытой пробкой (рис.4).
Помещают штатив с пробиркой в термостат (при 37-38°С) на 1,5 ч.
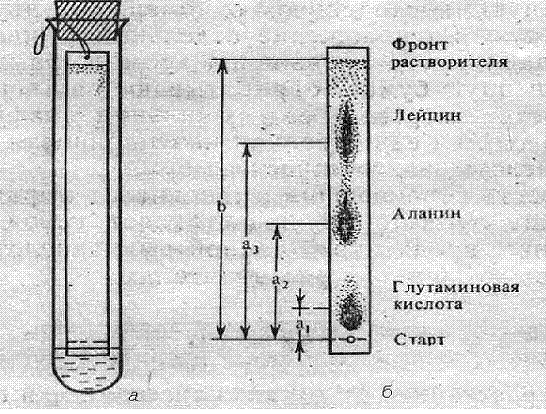
Рис.
4. Прибор для хроматографии (а) и хроматограмма аминокислот (б)
Затем
вынимают полоску, подвешивают ее за петлю в сушильном шкафу и выдерживают при
100-105°С в течение 10 мин.
Для
проявления хроматограммы полоску переносят в чашку Петри, в которую налито 15
мл раствора нингидрина, держа ее пинцетом, проводят через раствор и вновь
помещают в сушильный шкаф на 5 мин при той же температуре.
Оформление
работы. Зарисовать в рабочем состоянии прибор, отметив положение аминокислот на
хроматограмме. Измерить линейкой расстояния (в мм) a и b для каждой
аминокислоты и рассчитать их Rf. В выводе отметить возможность разделения
хроматографией на бумаге разных аминокислот.
Практическое
значение работы. Хроматографический анализ свободных аминокислот в сыворотке
крови, моче и других жидких средах применяется в клинике для диагностики
наследственных заболеваний обмена аминокислот, патологии печени, почек, а также
при оценке степени тяжести сахарного диабета: в фармации - для контроля
качества белковых гидролизатов и препаратов смеси аминокислот, а в научных
экспериментах - для изучения аминокислотного состава гидролизатов очищенных
белков.
2. Исследование физико-химических свойств белков
Физико-химические свойства белка определяются особенностями его
структурной организации, которая придает ему новые качества, отсутствующие у
составляющих полипептидную цепь мономеров. Особенности физико-химических
свойств белка лежат в основе многих приемов и методов, применяемых в
клинико-биохимических лабораториях, фармацевтической практике и в
экспериментальной биохимии для его выделения и очистки, качественного и
количественного анализа.
Работа 4. Диализ белков
Диализ демонстрирует макромолекулярную природу белка. Как и все
высокомолекулярные соединения, белок не проникает через искусственные
(например, целлофан, пергамент и др.) и биологические мембраны, что позволяет
использовать диализ как метод очистки белка от низкомолекулярных органических и
неорганических примесей. С этой целью применяется специальный прибор -
диализатор (или электродиализатор). Простейший из них представляет собой
сделанный из целлофана или другого подобного ему материала мешочек, наполненный
раствором очищаемого белка и погруженный в стакан с дистиллированной водой.
Реактивы. Сульфат аммония, насыщенный раствор; хлорид бария, 5%-ный
раствор; биуретовый реактив*.
Оборудование. Целлофан, предварительно разрезанный на куски размером
125х125 мм (можно применять заводской диализаторный материал); стакан с
дистиллированной водой; стеклянные палочки; резиновые колечки; штатив с
пробирками; пипетки.
Метод основан на способности мембран задерживать макромолекулы белка и
пропускать неорганические ионы.
Ход определения. К 5 мл раствора яичного белка (или сыворотки крови)
добавляют каплю насыщенного раствора сульфата аммония и перемешивают. Отбирают
в две пробирки по 10 капель раствора и проделывают в одной из них биуретовую
реакцию, а в другой - пробу на сульфаты. При проведении пробы на сульфаты
добавляют 2-3 капли раствора хлорида бария.
Целлофану, предварительно замоченному в дистиллированной воде, придают
форму мешочка, который примерно на 1/3 заполняют исследуемым раствором белка.
Края мешочка зажимают между двумя стеклянными палочками, которые прижимают друг
к другу с помощью надетых с двух концов резиновых колечек.
Мешочек погружают в стакан с дистиллированной водой, положив зажимающие
его стеклянные палочки на края стакана. Уровень жидкости в мешочке не должен
быть выше уровня жидкости в стакане (рис.5).
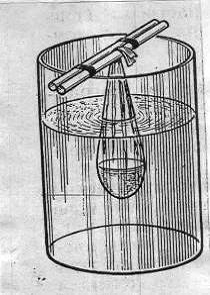
Рис. 5. Диализатор
в рабочем состоянии
Через час после начала диализа берут две пробы (по 10 капель) наружной
жидкости (диализат). С одной стороны из них проводят биуретовую реакцию на
белок, а с другой - реакцию на сульфаты, добавляя 2-3 капли хлорида бария.
Проделывают пробы на белок и сульфаты с жидкостью внутри мешочка.
Оформление работы. Результаты оформить в виде таблицы, отметив знаками
«плюс» или «минус» наличие реакции:
|
Определяемые компоненты
|
До диализа
|
После диализа
|
|
внешняя жидкость
|
внутренняя жидкость
|
внешняя жидкость
|
внутренняя жидкость
|
|
Белок SO42-
|
|
|
|
|
В выводах отметить, какое свойство белка демонстрирует метод диализа и
возможность его применения.
Практическое значение работы. Метод анализа используется для отделения
низкомолекулярных органических примесей и неорганических ионов при очистке
белков, нуклеиновых кислот, полисахаридов и т.д. в биохимических исследованиях
или при получении лечебных препаратов (например, белковых). Способ диализа
положен в основу работы аппарата «искусственная почка», который применяется для
очищения крови от природных низкомолекулярных «шлаков» и токсических
соединений.
Работа 5. Определение изоэлектрической точки белка
Белок как амфотерный полиэлектролит содержит положительные и
отрицательные заряды, соотношение которых определяется количеством кислых и
основных аминокислот в его макромолекуле. Заряженность молекулы белка является
одним из факторов его устойчивости в растворах, так как мешает слипанию
белковых частиц и выпадению их в осадок. На общий заряд макромолекулы белка
влияет рН среды. Для каждого белка существует значение рН, при котором сумма
положительных и отрицательных зарядов его равна нулю. Это состояние белка
называется изоэлектрическим, а соответствующее такому состоянию значение рН
называется изоэлектрической точкой (ИЭТ). В ИЭТ растворы белков неустойчивы и
белки легко выпадают в осадок особенно в присутствии водоотнимающих веществ
(этиловый спирт, ацетон и т.д.).
Реактивы. Уксусная кислота, 0,2 М раствор; ацетат натрия, 0,2 М раствор;
этиловый спирт, 96%-ный.
Оборудование. Пипетки вместимостью 1 и 2 мл; штатив с пробирками.
Материал. Казеин, 0,1%-ный раствор.
Метод основан на способности растворенного белка (казеина) в
изоэлектрической точке переходить в неустойчивое состояние и выпадать в осадок,
что проявляется в выраженном помутнении раствора. При добавлении этилового
спирта (водоотнимающее средство) процесс осаждения белка ускоряется.
Ход определения. В шести пронумерованных пробирках готовят буферные смеси
с разным значением рН. Содержимое пробирок взбалтывают и в каждую добавляют по
0,5 мл раствора казеина.
Приготовление
буферных систем для определения ИЭТ казеина
|
№ пробирки
|
Состав буферной смеси, мл
|
рН смеси
|
|
0,2 М CH3COOH
|
0,2 М CH3COONa
|
|
|
1
|
1,9
|
0,1
|
3,4
|
|
2
|
1,8
|
0,2
|
3,8
|
|
3
|
1,4
|
0,6
|
4,4
|
|
4
|
1,0
|
1,0
|
4,7
|
|
5
|
0,6
|
1,4
|
5,1
|
|
6
|
0,2
|
1,8
|
5,7
|
После этого смесь в пробирках снова встряхивают и отмечают помутнение
раствора. В каждую пробирку добавляют по 2 мл этилового спирта и оценивают
степень мутности проб.
Оформление работы.
Результаты оформить в виде таблицы, отмечая степень мутности раствора до
и после добавления этилового спирта по пятибальной шкале: 1 - отсутствие
помутнения, 2 - слабое, 3 - умеренное, 4 - сильное, 5 - очень сильное.
|
рН
|
Степень мутности раствора
казеина
|
|
до добавления спирта
|
после добавления спирта
|
|
3,4
|
|
|
|
3,8
|
|
|
|
4,4
|
|
|
|
4,7
|
|
|
|
5,1
|
|
|
|
5,7
|
|
|
В выводе отметить ИЭТ казеина и возможность ее практического
использования для выделения этого белка.
Практическое значение работы. Нахождение изоэлектрической точки для
индивидуальных белков позволяет подобрать условия для осаждения их из
биологических экстрактов, содержащих смесь разных белков, и при очистке
белковых препаратов в фармации.
Работа 6. Исследование денатурации белков
Вещества, нарушающие структурную организацию белковой молекулы (т.е.
четвертичную, третичную и даже вторичную структуры), приводят к изменению
физико-химических и биологических свойств белка. Это явление называется
денатурацией.
Денатурирующие факторы делятся на химические, физические и биологические.
Наиболее обширны группы химических факторов (кислоты, тяжелые металлы,
алкалоиды, поверхностно-активные вещества и т.д.) и физических факторов
(температура, ионизирующая радиация, ультразвук и т.д.). Биологическую
денатурацию могут вызвать протеолитические ферменты (например, трипсин),
которые разрушают высшие уровни организации молекулы белка перед тем, как
гидролизовать ее пептидные связи.
Денатурация изменяет физико-химические свойства белка, в частности, его
растворимость. При этом белок становится менее гидрофильным и легко осаждается.
Денатурация чаще всего необратима, но в ряде случаев удаление денатурирующих
агентов приводит к восстановлению исходной конформации молекулы белка и его
природных свойств - ренатурация.
Реактивы. Азотная кислота, конц.; сульфат меди, 5%-ный раствор; сульфат
свинца, 5%-ный раствор; трихлоруксусная кислота, 10%-ный раствор; хлорная
кислота, 10%-ный раствор; этиловый спирт, 96%-ный; ацетон.
Оборудование. Штатив с простыми пробирками; пипетки; водяная баня.
Материал. Раствор яичного белка (приготовление см. работу 1).
а. Денатурация белка концентрированными минеральными кислотами. Метод
основан на способности минеральных кислот вызывать нейтрализацию зарядов и
разрушение пространственной структуры белка, что приводит к его денатурации и
осаждению.
Ход определения. В пробирку наливают 10 капель концентрированной азотной
кислоты и осторожно, держа пробирку под углом 45˚, наслаивают на кислоту 5
капель раствора яичного белка. Отметить изменения на границе двух слоев
жидкостей (кольцо денатурированного белка).
б. Денатурация белка органическими кислотами. Метод основан на
способности органических кислот нейтрализовать заряд молекулы белка и разрушать
ее пространственную структуру, что приводит к денатурации и осаждению белка.
Ход определения. В две пробирки наливают по 10 капель раствора яичного
белка. Добавляют в одну из них 2 капли трихлоруксусной кислоты, а в другую - 2
капли хлорной кислоты, отмечают произошедшие изменения.
в. Денатурация белка солями тяжелых металлов. Метод основан на связывании
ионов тяжелых металлов с функциональными группами боковых радикалов аминокислот
в молекулу белка, в результате чего разрушается ее пространственная структура и
происходит осаждение денатурированного белка. При добавлении избытка солей
тяжелых металлов (кроме AgNO3 и HgCl2) происходит растворение первоначально
образующегося осадка из-за адсорбции иона металла и приобретении вследствие
этого белковой молекулой положительного заряда.
Ход определения. В две пробирки вносят по 10 капель раствора яичного
белка. В первую из них добавляют 1-2 капли раствора сульфата меди, а во вторую
- 1-2 капли раствора ацетат свинца. Наблюдают за выпадением осадка белка.
Прибавляют в каждую из пробирок по несколько капель соответствующего осадителя
и наблюдают за растворением осадка.
г. Денатурация белка органическими растворителями. Метод основан на
способности органических растворителей (спирт, хлороформ) нарушать гидрофобные
взаимодействия внутри белковой молекулы и вызывать ее денатурацию, что приводит
к снижению растворимости и выпадению денатурированного белка.
Ход определения. В три пробирки наливают по 10 капель раствора белка и
добавляют равные объемы органических растворителей: в первую - этиловый спирт,
во вторую - ацетон, в третью - хлороформ. Наблюдают за выпадением белка.
Оформление работы. Особенности действия денатурирующих веществ указать в
протоколах по каждой реакции осаждения. В выводах отметить причину денатурации
белка.
Практическое значение работы. Явление денатурации белков используется в
клинике, фармации и биохимических исследованиях:
а) для осаждения белка в изучаемом биологическом материале с целью
дальнейшего определения в нем низкомолекулярных субстратов;
б) для выявления присутствия белка в различных биологических экстрактах и
жидкостях и количественного его анализа (в частности, качественное и
количественное определение белка в моче основано на реакции денатурации белка
азотной кислотой);
в) для связывания солей тяжелых металлов белком при лечении отравлений
или их профилактике на производстве;
г) для обеззараживания отходов в санитарно практике;
д) для дезинфекции кожи и слизистых покровов.
Работа 7. Исследование высаливания белков (на
примере белков сыворотки крови)
Высаливание - процесс осаждения белков солями щелочных и
щелочно-земельных металлов, который является обратимым и сохраняет нативные
свойства белков. Высаливание можно проводить не только солями щелочных и
щелочно-земельных металлов (Na2SO4, NaCl, KCl, MgSO4, MgCl2 и др.), но и
нейтральными солями, например (NH4)2SO4. Все вещества этого типа нейтрализуют
заряд белковых частиц и вызывают их дегидратацию, что ведет к осаждению белка.
При растворении осажденного белка в воде происходит восстановление его исходных
физико-химических и биологических свойств.
Белки отличаются друг от друга зарядом и гидрофильностью, поэтому можно
разделить белки, используя для их осаждения разные концентрации солей или
органических растворителей в среде.
Реактивы. Сульфат аммония, насыщенный раствор; сульфат аммония,
кристаллический, тонко измельченный; биуретовый реактив*.
Оборудование. Штатив с пробирками; пипетки; воронки для фильтрования;
бумажные фильтры.
Материал. Сыворотка крови.
Метод основан на способности сульфата аммония нейтрализовывать заряд
молекул белков и вызывать их дегидратацию, что приводит к осаждению белка
(высаливанию); при полунасыщении осаждаются глобулины, а при полном насыщении -
альбумины сыворотки крови. Это связано с тем, что глобулины менее гидрофильны и
имеют большую молекулярную массу, чем альбумины.
Ход определения. В пробирку вносят 20 капель сыворотки крови и добавляют
равный объем насыщенного раствора сульфата аммония (получается полунасыщенный
раствор). Выпадает осадок глобулинов. Через 5 мин осадок отфильтровывают.
К фильтрату прибавляют тонко измельченный порошок сульфата аммония до тех
пор, пока он не перестает растворяться (полное насыщение). Выпадает осадок
альбуминов. Осадок отфильтровывают. Фильтрат проверяют на отсутствие белка,
проделывая биуретовую реакцию (см. работу 1).
Оформление работы. Результаты оформить в виде таблицы
|
Высаливающее вещество
|
Степень насыщения раствора
сульфатом аммония
|
Осаждаемая фракция белков
сыворотки крови
|
В выводе указать на возможность разделения белков методом высаливания,
принцип его и отличия от осаждения путем денатурации.
Практическое значение работы. Метод высаливания используют в клинических
лабораториях для разделения альбуминов и глобулинов и определения их
соотношения в сыворотке крови. Осажденную фракцию белка можно отделить
центрифугированием, растворить и количественно определить содержание ее с
помощью различных методов. В норме соотношение альбумин/глобулин в сыворотке
крови человека колеблется в пределах 1,5-2,3 и может меняться при патологии,
например, при воспалительных заболеваниях, когда увеличивается содержание
глобулинов.
Высаливание применяют также для очистки и получения кристаллических
препаратов белков.
. Количественный анализ белков
Для количественного определения белков в биологическом материале или
лекарственных препаратах чаще всего употребляются азотометрия, фотоколориметрия,
фотонефелометрия и спектрофотометрия.
Азотометрия основана на определении содержания азота белка после
минерализации исследуемого образца. Поскольку белки содержат в среднем 16%
азота, то найденное количество его умножают на 6,25 (так как 100:16=6,25) и
получают содержание белка в пробе. Эти методы (к ним относится классический
метод Кьельдаля и его модификации) очень трудоемки и не всегда надежны, так как
процентное содержание азота в разных белках колеблется от 14 до 19.
Фотоколориметрические методы основаны на так называемых «цветных»
реакциях на функциональные группы белков. Среди них наибольшее применение нашли
биуретовая реакция на пептидные группы и реакция Фолина на ароматические
радикалы аминокислот (тирозин, триптофан). Биуретовый метод более специфичен,
так как пептидные связи имеются только в белках и пептидах. Он широко
применяется в клинико-биохимических исследованиях. Метод Лоури, основанный на
реакции Фолина, высокочувствительный, но малоспецифичный, поскольку сходную
окраску дают свободные ароматические аминокислоты и многие другие соединения,
содержащие фенольную группу.
Фотонефелометрические методы определения содержания белка основываются на
оценке степени мутности его взвеси в растворах. Эти методы не получили широкого
распространения.
Спектрофотометрические методы делятся на прямые и косвенные. Последние
представляют собой боле чувствительный и точный вариант фотоколориметрического.
После проведения цветной реакции на белки проводят спектрофотометрию
окрашенного раствора и по светопоглощению его в монохроматическом свете
рассчитывают содержание белка.
Прямой метод состоит в измерении светопоглощения раствора белка в
ультрафиолетовой области при 200-220 нм (в этой области абсорбируют пептидные
группы белка) и при 280 нм (зона поглощения ароматических радикалов
аминокислот, в основном триптофана и тирозина).
Эти методы весьма удобны и не требуют предварительного образования
окрашенных комплексов.
Более специфична спектрофотометрия при 200-220 нм, чем при 280 нм, так
как в последнем случае мешает светопоглощение различных низкомолекулярных
ароматических соединений, содержащихся в биологическом материале.
Работа 8. Количественное определение белка в сыворотке крови
Реактивы. Биуретовый реактив*; хлорид натрия, 0,9%-ный раствор.
Оборудование. Микропипетки и пипетки вместимостью 1 и 5 мл; штатив с
пробирками; стеклянные палочки; фотоэлектроколориметр (ФЭК); спектрофотометр
(СФ).
Материалы. Сыворотка крови; альбумин, 10%-ный раствор.
а. Биуретовый метод определения содержания белка в сыворотке крови.
Метод основан на способности пептидных связей белков и полипептидов
образовывать с ионами Cu2+ в щелочной среде комплексное соединение фиолетового
цвета, интенсивность окраски которого пропорциональна содержанию белка в среде.
Ход определения.
Для определения содержания белка в сыворотке крови или в других объектах,
содержащих белок, необходимо построить калибровочный график.
Для этого применяют стандартный белок - кристаллический альбумин
сыворотки крови.
Схема разведения альбумина для построения калибровочного графика
приведена в таблице
|
№ пробирки
|
Стандартный 10%-ный раствор
альбумина, мл
|
0,9%-ный раствор хлорида
натрия, мл
|
Концентрация белка, г/л
|
Экстинкция
|
|
1
|
0,4
|
0,6
|
40
|
|
|
2
|
0,6
|
0,4
|
60
|
|
|
3
|
0,8
|
0,2
|
80
|
|
|
4
|
1,0
|
-
|
100
|
|
Из каждой пробирки с разведенным стандартным раствором альбумина берут по
0,1 мл раствора и добавляют по 5 мл биуретового реактива. Содержимое смешивают
встряхиванием.
Через 30 мин измеряют экстинкцию каждой пробы на ФЭКе против контрольного
раствора (0,1 мл 0,9%-ного раствора NaCl + 5,0 мл биуретового реактива) в
кювете толщиной 1 см, длина волны 540-560 нм (светофильтр зеленый).
По полученным данным строят калибровочную кривую, откладывая по оси
ординат значения экстинкции, по оси абсцисс - концентрацию белка.
Берут 2 пробирки - в одну наливают 0,1 мл исследуемой сыворотки, в другую
(контрольную) - 0,1 мл раствора хлорида натрия. В обе пробирки добавляют по 5
мл биуретового реактива. Содержимое смешивают встряхиванием.
Через 30 мин измеряют экстинкцию исследуемого раствора на ФЭКе в кювете
толщиной 1 см при длине волны 540-560 нм (зеленый светофильтр) против
контрольного раствора.
Содержание белка в сыворотке крови находят по калибровочной кривой.
б. Спектрофотометрический метод определения содержания белка в сыворотке
крови. Метод основан на светопоглощении при 280 нм ароматических радикалов
тирозина, триптофана и в меньшей степени фенилаланина, содержащихся в белке.
Однако при данной длине волны поглощают и нуклеиновые кислоты, хотя их максимум
абсорбции приходится на 260 нм. Поэтому измерение экстинкции раствора проводят
при 260 и 280 нм, чтобы сделать поправку на примесь нуклеиновых кислот и
нуклеотидов. Метод неприменим к материалу, где содержание нуклеиновой кислоты
превышает 20%.
Ход определения. В пробирку вносят 0,1 мл сыворотки крови и добавляют 9,9
мл раствора хлорида натрия. Содержимое перемешивают стеклянной палочкой.
Измеряют экстинкцию исследуемого раствора против контрольного раствора
хлорида натрия на спектрофотометре в кювете толщиной 1 см при двух длинах волн
- 260 и 280 нм.
Расчет можно проводить по формуле, эмпирически полученной Калькаром
(поэтому можно не прибегать к калибровочному графику):
х = 1,45Е280 - 0,74Е260,
где х - концентрация белка в растворе, г/л.
Оформление работы. По калибровочной кривой рассчитать содержание белка.
Сравнить результаты, полученные биуретовым методом и спектрофотометрическим.
Сделать вывод о наличии отклонения концентрации белка в исследуемой сыворотке
крови от нормы и о возможных его причинах.
Практическое значение работы. Сыворотка крови содержит смесь белков,
различных по физиологическому значению, структуре и физико-химическим свойствам
(более 100 различных белков плазмы крови). Нормальное содержание белка в
сыворотке крови (нормопротеинемия) составляет 65-85 г/л. Определение общего
белка в сыворотке крови находит широкое применение в практической медицине, так
как по изменению его нормального содержания можно судить о различных нарушениях
в организме. Повышенное содержание белка (гиперпротеинемия) относительно редко:
при сгущении крови из-за потери жидкости (длительная рвота, усиленное
потоотделение, холера, тяжелые ожоги и т.п.), при некоторых хронических
воспалительных процессах вследствие образования антител (ревматизм,
полиартрит). Пониженное содержание белка в крови (гипопротеинемия): при
недостаточном поступлении белка с пищей (голодание, нарушение проходимости
кишечного тракта), при нарушении образования белка в органах (при поражении
печени химическими веществами, опухолями, микроорганизмами и т.д.), при потере
белка организмом (кровотечения, повышенная проницаемость сосудов, заболевания
почек, беременность и т.д.).
В фармацевтической практике количественные методы определения белка
необходимы для контроля белковых лекарственных средств (вакцин, сывороток, γ-глобулина, белковых препаратов крови
и т.д.).
4. Состав и свойства сложных белков
Сложные белки являются представителями смешанных макромолекул, которые
содержат как минимум два разных химических компонента, соединенных ковалентными
или слабыми (ионными, водородными, вандерваальсовыми) связями. К сложным белкам
относят кофакторпротеиды (гемпротеиды, хлорофиллпротеиды, флавопротеиды и др.),
гликопротеиды и протеогликаны, липопротеиды и протеолипиды, металлопротеиды,
фосфопротеиды и нуклеопротеиды.
Особенность строения этих макромолекул позволяет использовать при
обнаружении и количественном определении их в биологическом материале методы
анализа как на белковый фрагмент молекулы, так и на простетическую группу.
Поскольку последняя специфична для каждого класса сложных белков, реакции на
нее применяются чаще.
Работа 9. Химическая природа гемпротеидов
К гемпротеидам относят гемоглобин, миоглобин, цитохромы и ферменты -
каталазу и пероксидазу. Они состоят из белковой части и гема, представляющего
собой тетрапиррольное соединение, связанное с атомом железа (II).
При действии на гемоглобин концентрированной уксусной кислоты в
присутствии NaCl гем переходит в гемин, в котором железо трехвалентно и его
третья валентность связана с хлором. При действии на гемоглобин щелочей гем
переходит в гематин, в котором атом железа также трехвалентен, и третья его
валентность связана с гидроксильной группой.
Гем, входящий в гемоглобин, ускоряет реакцию окисления субстратов (S·H2)
пероксидом водорода, т.е. действует подобно ферменту пероксидазе: S·H2 + H2O2 -
S + 2H2O. Это объясняется сходством строения простетических групп гемоглобина и
пероксидазы. Однако в отличие от фермента гемоглобин сохраняет каталитические
свойства при кипячении и действии сильных кислот, которые вызывают денатурацию
белка.
Если в исследуемом материале содержится кровь, то ее присутствие можно
обнаружить по способности геминовой группы катализировать окисление подходящих
субстратов (бензидин, гвояковая смола) пероксидом водорода.
Реактивы. Пероксид водорода, 3%-ный свежеприготовленный раствор;
бензидин, 5%-ный свежеприготовленный раствор в ледяной уксусной кислоте;
гваяковая смоляная кислота, 1%-ный раствор на 95%-ном этиловом спирте,
свежеприготовленный; азотная кислота, конц.; соляная кислота, не содержащая
железа, 10%-ный раствор; гексацианоферрат (II) калия, 2,5%-ный раствор; роданид
аммония, 1%-ный раствор; гидроксид натрия, 3%-ный раствор; биуретовый реактив*;
ацетон, подкисленный соляной кислотой (3 мл 2 М раствора HCl на 1 л ацетона, рН≈2),
охлажденный в холодильнике.
Оборудование. Полоски фильтровальной бумаги шириной 1 см; глазные
пипетки; пипетки вместимостью 1 и 10 мл; штатив; простые и центрифужные
пробирки; водяная и песчаная бани; центрифуга с центрифужными весами; тигель
фарфоровый и тигельные щипцы.
Материал.
1. Цельная кровь, разведенная в 5000 раз
дистиллированной водой.
2. Кровь дефибринированная.
3. Гемоглобин кристаллический, 1%-ный
водный раствор.
а. Бензидиновая проба на геминовую группу гемоглобина. Метод основан на
способности геминовой группы гемоглобина катализировать реакцию окисления
бензидина в дифенохинондиимин пероксидом водорода
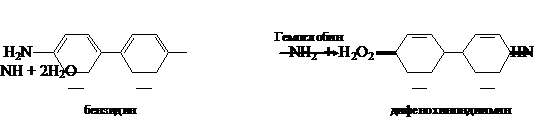
Дифенохинондиимин
конденсируется с молекулой неокисленного бензидина с образованием окрашенного
комплекса сине-зеленого цвета.
В
пробирку наливают 1 мл цельной крови, разведенной в 5000 раз, кипятят несколько
минут на водяной бане, охлаждают и добавляют по 2 капли раствора бензидина и
пероксида водорода. Отмечают появление окрашивания.
б.
Гваяковая проба на геминовую группу гемоглобина. Метод основан на способности
геминовой группы гемоглобина катализировать реакцию окисления гваяковой
смоляной кислоты пероксидом водорода до ее озонида, окрашенного в синий цвет.
Ход
определения. В пробирку вносят несколько капель цельной крови (разведенной в
5000 раз) и кипятят ее в течение 1 мин на водяной бане. После охлаждения
приливают к пробе 1-2 капли спиртового раствора гваяковой смоляной кислоты и 3
капли раствора пероксида водорода. Отмечают развитие окрашивания.
в.
Проба с гексацианоферратом (II) калия и роданидом аммония на железо
гемоглобина. Метод основан на способности железа, входящего в гемоглобин,
образовывать с гексацианоферратом (II) калия в присутствии соляной кислоты
сине-зеленое комплексное соединение - берлинскую лазурь:
FeCl3
+ 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3 + 12KCl ,
гексацианоферрат
(II) берлинская калия лазурь
а
с роданидами - роданид железа розового или красного цвета
+
3NH4CNS → Fe(CNS)3 + 3KCl
роданид
роданид аммония железа
Ход
определения. Несколько капель дефибринированной крови помещают в фарфоровую
чашечку (тигель) и выпаривают досуха на песчаной бане. Сухой остаток озоляют,
добавляют 2-3 капли концентрированной азотной кислоты и продолжают нагревание
(под тягой). При этом железо гемоглобина переходит в состав золы.
Сухой
остаток переносят в пробирку, добавляют 10 капель раствора соляной кислоты до
растворения золы. Разливают содержимое примерно поровну в две пробирки. В одну
из них добавляют 2 капли раствора гексацианоферрата (II) калия. Наблюдают за
появлением характерного окрашивания. Во вторую пробирку приливают 2 капли
раствора роданида аммония и отмечают развитие специфического окрашивания.
г.
Разделение гемоглобина на гем и глобин. Метод основан на способности ацетона,
подкисленного соляной кислотой, разрывать связи между гемом и глобином, причем
отщепившийся гем растворяется в ацетоне, а глобин выпадает в осадок.
Ход
определения. В пробирку наливают 10 мл подкисленного ацетона и медленно
добавляют 10 капель раствора гемоглобина. Наблюдают появление беловатой взвеси
(глобин), которая постепенно оседает. Содержимое пробирки перемешивают
стеклянной палочкой, переливают в центрифужные пробирки и центрифугирую при
1500 об/мин в течение 5 мин.
После
центрифугирования в верхний слой (ацетоновый) осторожно опускают две полоски
фильтровальной бумаги и проделывают реакции на наличие геминовой группировки.
Для этого на одну полоску наносят по капле бензидина и раствора пероксида
водорода (бензидиновая проба), на вторую -по две капли спиртового раствора
гваяковой смоляной кислоты и раствора пероксида водорода (гваяковая проба).
Отмечают постепенное появление характерного окрашивания на обеих полосках
бумаги.
Верхний
слой жидкости осторожно сливают, а к оставшемуся осадку добавляют 1 мл 3%-ного
раствора гидроксида натрия. Перемешивают содержимое и добавляют 10 капель
биуретового реактива. Наблюдают появление характерного окрашивания.
Оформление
работы. Результаты оформить в виде таблицы.
|
Компонент гемоглобина
|
Вид реакции
|
Характер окрашивания
|
В выводах указать на возможность обнаружения гемоглобина в исследуемом
материале с помощью проделанных качественных реакций и разделения его
компонентов действием кислых растворов ацетона; отметить значение реакций для
практики.
Практическое значение работы. Основная часть гемпротеидов крови находится
в виде гемоглобина эритроцитов. В сыворотке или плазме крови содержится лишь
незначительное количество гемпротеидов, появляющихся при значительном распаде
эритроцитов (гемолизе). В сыворотке крови железо находится в виде
ферротрансферина, являющегося сложным белком (металлопротеидом), который
переносит железо между тканями и органами.
Качественные реакции на простетические группы протеидов позволяют выявить
структурные компоненты: геминовую группировку и входящее в состав гема железо.
Для обнаружения следов крови очень чувствительные бензидиновая и гваяковые
пробы используются в клинике и судебно-медицинских исследованиях.
Работа 10. Выявление углеводного компонента гликопротеидов
Гликопротеиды - это сложные белки, содержащие углеводный компонент. Он
составляет, как правило, примерно 10-20% от массы всей макромолекулы.
Исключение представляют так называемые вещества групп крови, содержащиеся в
эритроцитах. У этих гликопротеидов углеводная часть составляет до 80% от массы
макромолекулы.
В гликопротеидах углевод с белком соединен ковалентной связью. В состав
небелкового фрагмента гликопротеидов входят разнообразные моносахариды и их
производные: глюкоза, галактоза, манноза, ксилоза, арабиноза, фукоза, рамноза,
глюкозамин, ацетилглюкозамин, нейраминовая кислота, глюкуроновая кислота и др.
Гликопротеиды широко распространены в организме человека и животных и
выполняют многочисленные биологические функции. Например, гликопротеидами
являются транспортные белки плазмы (гаптоглобин, трансферрин, транскортин и др.),
факторы свертывания крови (протромбин, фибриноген), иммуноглобулины, ферменты
(холинэстераза, рибонуклеаза В), гормоны (гонадотропины, кортикотропин). Эта
группа сложных белков содержится во внутрисуставной жидкости, где они выполняют
механическую функцию. Гликопротеиды входят в состав слизистых секретов - слюны,
желудочного и кишечного соков, облегчая движение пищи по кишечнику.
Особенность моносахаридного состава углеводной части гликопротеидов
определяет методы их качественного и количественного анализа.
Реактивы. Уксусная кислота, конц.; α-нафтол, 1%-ный спиртовой раствор;
серная кислота, конц.
Оборудование. Штатив с пробирками; глазные пипетки; пипетки вместимостью
5 мл; стеклянные палочки; фильтровальная бумага.
Материал.
1. Слюна (для получения слюны
прополаскивают ротовую полость водой, затем набирают в рот 10 мл
дистиллированной воды и держат ее около 2 мин, смешивая с выделяющейся слюной.
Жидкость выпускают в стаканчик, профильтровывают через марлю и используют для
исследования).
2. Кортикотропин, во флаконах.
3. Хорионический гонадотропин, в
ампулах.
Метод основан на способности гидроксиметилфурфурола, образующегося из
гексоз гликопротеидов под влиянием концентрированной серной кислоты, давать с α-нафтолом продукт конденсации
красно-фиолетового цвета:
Ход определения. В пробирку вносят 2 мл слюны и прибавляют по каплям
половинный объем концентрированной уксусной кислоты, помешивая содержимое
стеклянной палочкой. Муцин слюны осаждается в виде комочка. Жидкость осторожно
сливают, придерживая комочек муцина стеклянной палочкой. Обсушивают сгусток
полоской фильтровальной бумаги.
К муцину добавляют 10-20 капель спиртового раствора α-нафтола и по стенке пробирки,
наклонив ее, осторожно наслаивают 20 капель концентрированной серной кислоты.
Образуется окрашенное кольцо. При осторожном встряхивании пробирки постепенно
окрашивается ее содержимое.
Ту же реакцию, что и с муцином, проделывают с препаратами кортикотропина
и хорионического гонадотропина, используя для этих целей по 5 капель
исследуемых веществ.
Оформление работы. Результаты оформить в виде таблицы.
|
Вещество
|
Реакция
|
Наличие окраски
|
В выводе отметить наличие соответствующих простетических групп в
изучаемых объектах.
Практическое значение работы. Качественные реакции на простетическую
группу гликопротеидов используются для выявления их в различном биологическом
материале и лекарственных препаратах. Эти реакции лежат в основе методов
количественного определения гликопротеидов.
Работа 11. Качественные реакции на фосфопротеиды (на примере казеина
молока)
Простетической группой фосфопротеидов является остаток фосфорной кислоты,
который эфирной связью соединен с гидроксилом серина или треонина белковой
части. Фосфорная кислота составляет 0,4-0,9% от массы молекулы фосфопротеида. К
фосфопротеидам относятся казеиноген (казеин) молока, вителлин, вителленин и
витин яичных желтков, ферменты - фосфорилаза, фосфоглюкомутаза и многие другие.
Казеиноген является полноценным белком, содержащим все незаменимые
аминокислоты. В молоке он связан не только с остатком фосфорной кислоты, но и с
ионами кальция. Свертывание молока при подкислении объясняется выпадением
осадка казеиногена. Под действием пищеварительных ферментов (пепсин, химозин)
казеиноген превращается в казеин, что сопровождается свертыванием (створаживанием)
молока.
Присутствие фосфопротеидов в материале можно обнаружить реакциями на
фосфаты.
Реактивы. Биуретовый реактив*; молибдат аммония в азотной кислоте*;
азотная кислота, конц.; гидроксид натрия, 10%-ный раствор; аскорбиновая
кислота, 1%-ный раствор на 1 М растворе соляной кислоты.
Оборудование. Весы аптечные с разновесом; штатив с пробирками; стеклянные
палочки; пипетки вместимостью 5 мл; водяная баня.
Материал. Казеин, сухой порошок.
Метод основан на обнаружении в гидролизатах казеина белкового компонента
по биуретовой реакции, а фосфорной кислоты - по реакции с молибдатом аммония, в
результате которой образуется фосфомолибденовый комплекс:
PO4 + 12(NH4)2MoO4 + 21HNO3 → (NH4)3(PO4∙12MoO3) + 21NH4NO3 +
12H2O
Под действием восстановителей (аскорбиновая кислота) фосфомолибдат
аммония переходит в молибденовую синь.
Ход определения. В пробирку отвешивают 0,1 г сухого порошка казеина.
Добавляют 5 мл раствора гидроксида натрия и ставят в кипящую водяную баню на 30
мин.
После охлаждения отбирают в пробирку 10 капель гидролизата и проводят
реакцию с биуретовым реактивом, добавляя его 3-5 капель. Отмечают появление
характерного окрашивания.
В другую пробирку вносят 20 капель гидролизата и нейтрализуют его,
прибавляя по каплям концентрированную азотную кислоту до слабой реакции (по
лакмусовой бумаге, кусочек которой заранее помещают в пробирку). Затем
добавляют 10 капель раствора молибдата аммония, перемешивают содержимое
встряхиванием и наливают 10 капель раствора аскорбиновой кислоты. Вновь
перемешивают и оставляют стоять пробы до развития специфического окрашивания.
Оформление работы. Отметить результат проведенных качественных реакций, в
выводе указать химическую природу казеина молока.
Практическое значение работы. Качественные реакции на фосфатную группу используются
для обнаружения фосфопротеидов в исследуемых образцах.
Работа 12. Количественное определение содержания
сиаловых кислот в сыворотке крови методом Гесса
Реактивы. Раствор трихлоруксусной кислоты, 10%-ный раствор;
уксусно-сернокислый реактив (95 мл ледяной кислоты и 5 мл концентрированной
серной кислоты).
Оборудование. Штатив с пробирками; пипетки вместимостью 1,0; 5,0;
центрифуга; водяная баня; ФЭК.
Материал. Сыворотка крови.
Метод основан на способности нейраминовой кислоты, освобождающейся при
гидролизе сывороточных гликопротеидов, образовывать окрашенные соединения при
нагревании с уксусно-сернокислым реактивом.
Ход определения. В центрифужную пробирку вносят 1,0 мл сыворотки крови и
добавляют 1,0 мл 10% раствора трихлоруксусной кислоты. Пробирку помещают в
кипящую водяную баню точно (!) на 5 минут. Охлаждают под струей воды в течение
5 минут. Встряхивают и центрифугируют 5 минут при 3000 об/мин. Отбирают 0,4 мл
надосадочной жидкости, переносят в пробирку, наливают 5,0 мл
уксусно-сернокислого реактива и помещают на 30 минут в кипящую водяную баню.
Охлаждают до комнатной температуры и интенсивность окраски определяют на ФЭКе
при длине волны 500-560 нм (зеленый светофильтр) в кювете толщиной 10 мм против
контроля. Контролем служит уксусно-сернокислый реактив.
Расчет. Определите количество сиаловых кислот по калибровочному графику и
рассчитайте содержание по формуле:
а∙5∙100
Х = ----- ,
1000∙1000
где а - содержание сиаловых кислот в исследуемой пробе в мкг, найденное
по калибровочному графику;
- расчет на 1 мл сыворотки;
(в числителе) - для перевода на 1 л сыворотки;
(в знаменателе) - для пересчета в мг и г.
Оформление работы. По полученным значениям экстинкций сделать расчет
содержания сиаловых кислот в г/л. Пересчитать их содержание в ммоль/л согласно
формуле:
а∙103
Х = ---- ,
309
где а - количество сиаловых кислот в г/л;
- перевод г в мг;
- молекулярный вес сиаловых кислот.
Практическое значение работы. В норме содержание сиаловых кислот в
сыворотке крови колеблется от 2,0 до 2,36 ммоль/л (0,62-0,73 г/л). Их
количество значительно возрастает при заболеваниях, связанных с деструкцией
соединительной ткани, при туберкулезе, инфаркте миокарда, опухоли головного
мозга. Снижение содержания отмечается при пернициозной анемии, болезни
Вильсона, дегенеративных процессах центральной нервной системы.
Работа 13. Химическая природа нуклеопротеидов
Нуклеиновые кислоты присутствуют во всех клетках (за исключением
эритроцитов) организма человека в виде комплекса с белками, т.е. образуют
нуклеопротеиды. Они в большом количестве содержатся в селезенке, зобной железе,
печени и других органах и тканях, богатых ядрами. Из этих органов проще
выделять и изучать нуклеопротеиды и нуклеиновые кислоты. Нуклеопротеиды делятся
на дезоксирибонуклеопротеиды (ДНП) и рибонуклеопротеиды (РНП), в которых
фосфатные группы ДНК или РНК электростатически взаимодействуют с белками.
Нуклеиновые кислоты - высокомолекулярные соединения, состоящие из
мононуклеотидов, соединенных 3’, 5’- фосфодиэфирными связями. Они плохо
растворимы в воде, образуя вязкие гелеподобные растворы. Хорошо растворимы в
щелочах, растворах минеральных кислот и солей.
Реактивы. Хлорид натрия, 5%-ный раствор, содержащий 0,04% трехзамещенного
цитрата натрия; гидроксид натрия, 0,4%-ный раствор; дифениламиновый реактив*;
биуретовый реактив*.
Оборудование. Штатив с пробирками; ступка с пестиком; стеклянный порошок;
пипетки; мерные цилиндры вместимостью 50 и 300 мл; пипетки вместимостью 1 мл;
кристаллизатор; деревянные палочки с насечками; водяная баня; круглодонная
колба с обратным холодильником; марля для фильтрования.
Материал.
1. Селезенка, свежая или замороженная.
2. Выделенный из селезенки
дезоксирибонуклеопротеид.
3. РНК дрожжевая, свежеприготовленный
0,1%-ный раствор.
а. Выделение дезоксирибонуклеопротеида из ткани селезенки. Метод основан
на способности дезоксирибонуклеопротеидов растворяться в солевых растворах
большой ионной силы и выпадать в осадок при снижении их концентрации.
Ход определения. 2/3 г ткани селезенки тщательно растирают в ступке со
стеклянным порошком, приливая постепенно небольшими порциями 35-40 мл раствора
хлорида натрия. Полученный вязкий раствор фильтруют через 2 слоя марли в малый
кристаллизатор.
Отмеряют цилиндром шестикратный (по отношению к фильтру) объем
дистиллированной воды и медленно выливают ее в фильтрат. Образовавшиеся нити
дезоксинуклеопротеида осторожно наматывают на деревянную палочку, переносят в
пробирку для использования в последующей работе.
б. Качественная реакция на ДНК (реакция Дише). Метод основан на
способности дезоксирибозы, входящей в ДНК дезоксирибонуклеопротеида,
образовывать соединение синего цвета с дифениламином при нагревании в среде,
содержащей смесь ледяной уксусной и концентрированной серной кислот. С рибозой
РНК аналогичная реакция дает зеленое окрашивание.
Ход определения. К ¼ части осадка дезоксирибонуклеопротеида приливают 1 мл
0,4%-ного раствора гидроксида натрия (до растворения). Добавляют 0,5 мл
дифениламинового реактива. Содержимое пробирки перемешивают и ставят на кипящую
водяную баню на 15-20 мин.
Аналогичную реакцию выполняют в другой пробирке с 1 мл раствора РНК.
Отмечают характерное окрашивание в пробах.
в. Выявление белкового компонента дезоксирибонуклеопротеида (ДНП). Метод
основан на биуретовой реакции (описана в работе 1).
Ход определения. Переносят часть полученных ранее нитей ДНП в пробирку,
добавляют 0,5 мл раствора гидроксида натрия до растворения нитей и 5 капель
биуретового реактива. Наблюдают за появлением окрашивания.
г. Гидролиз дезоксирибонуклеопротеидов.
Ход определения. Оставшуюся часть осадка дезоксирибонуклеопротеидов,
полученных из ткани селезенки, помещают в колбочку для гидролиза, добавляют
30-40 мл 5%-ного раствора серной кислоты.
Закрывают колбочку пробкой с обратным холодильником и осторожно кипятят
содержимое на асбестовой сетке на медленном огне в течение 30-40 мин.
Полученный гидролизат охлаждают и используют для определения составных
компонентов ДНК в последующей работе (гидролизат хранить в холодильнике).
Оформление работы. В выводе отметить возможность выделения
нуклеопротеидов с помощью солевых растворов и их идентификации с помощью
реакций на нуклеиновый компонент.
Практическое значение работы. Выделение и очистку
дезоксирибонуклеопротеидов из гомогенатов и ядер клеток с помощью растворов
хлорида натрия разной концентрации используют в экспериментальной биохимии.
Дифениламиновая проба лежит в основе методов качественного и количественного
определения нуклеопротеидов и нуклеиновых кислот в биологическом материале. В
клинической цитологии эти реакции применяют при нативной окраске нуклеиновых
кислот, например, в мазках клеток крови.
НУКЛЕИНОВЫЕ КИСЛОТЫ
При гидролизе нуклеопротеиды и нуклеиновые кислоты распадаются на
составные части. Обнаружение и методы количественного определения нуклеиновых
кислот и их мономеров (нуклеотидов) в биологическом материале и препаратах
основаны на особенностях химической природы этих соединений.
1. Исследование химической природы нуклеиновых
кислот
ДНК и РНК, имея сходство в строении, несколько отличаются по составным
компонентам: в ДНК содержится тимин, а в РНК - урацил. Кроме того, углеводная
часть в ДНК представлена дезоксирибозой, а в РНК - рибозой. Поэтому по
специфическим реакциям на эти моносахариды можно выявить соответствующие
нуклеиновые кислоты и нуклеотиды.
Работа 14. Качественные реакции на компоненты
нуклеиновых кислот
Реактивы. Нитрат серебра, 2%-ный аммиачный раствор*; раствор аммиака,
конц.; аскорбиновая кислота, 1%-ный раствор; молибдат аммония, раствор в
азотной кислоте*; орциновый реактив*; дифениламиновый реактив*.
Оборудование. Глазные пипетки; пипетки вместимостью 1 мл; штатив с
пробирками; водяная баня.
Материал.
1. Гидролизат дезоксирибонуклеопротеида
(см. работу 13, г).
2. Лекарственные препараты нуклеотидной
природы: фосфаден (аденозинмонофосфат), 2%-ный раствор в ампулах, и
аденозинтрифосфат натрия, 1%-ный раствор в ампулах.
а. Проба на пуриновые основания. Метод основан на способности пуриновых
оснований с аммиачным раствором нитрата серебра образовывать осадок серебряных
солей пуриновых оснований (аденина, гуанина), окрашенных в светло-коричневый
цвет.
Ход определения. В пробирку вносят 10 капель гидролизата, помещают в него
кусочек лакмусовой бумаги и приливают по каплям примерно 10 капель
концентрированного раствора аммиака до щелочной реакции по лакмусу. Добавляют
10 капель аммиачного раствора нитрата серебра. При стоянии образуется осадок с
характерной окраской.
б. Дифениламиновая проба на пентозы. Принцип метода см. работу 13, б.
Ход определения. Для определения берут 5 капель гидролизата и проделывают
реакцию, как описано в работе 13, б.
в. Молибденовая проба на фосфорную кислоту. Принцип метода см. работу 11.
Ход определения. Берут 10 капель гидролизата и проделывают реакцию, как
описано в работе 11.
г. Качественные реакции на лекарственные препараты нуклеотидной природы.
Метод основан на обнаружении рибозы в препаратах нуклеотидной природы с помощью
дифениламиновой реакции и пробы с орциновым реактивом. Последняя состоит в том,
что фурфурол, образующийся из рибозы при нагревании в среде с соляной кислотой,
дает с орцином окрашенное соединение зеленого цвета.
Ход определения. В две пробирки добавляют по 5 капель соответственно
раствора фосфадена и аденозинтрифосфата натрия. К ним приливают по 10 капель
дифениламинового реактива, нагревают 10 мин на кипящей водяной бане. Отмечают
результат реакции.
В две другие пробирки вносят по 5 капель тех же веществ и добавляют по 5
капель орцинового реактива. Нагревают в течение 20 мин на кипящей водяной бане.
Отмечают результат реакции.
Оформление работы. По результатам работы сделать вывод о возможности
использования реакции для обнаружения компонентов нуклеиновых кислот и
нуклеотидов и их применения в практике. Данные оформить в виде таблицы.
|
Материал
|
Выявляемый компонент
|
Реакция
|
Результат реакции
|
Практическое значение работы. Реакции на компоненты нуклеиновых кислот и
нуклеотиды могут применяться для их идентификации и количественного анализа в
биохимических исследованиях, а в фармации - для контроля качества препаратов
нуклеотидной и нуклеозидной природы.
2. Количественные методы
определения нуклеиновых кислот
Для количественного определения нуклеиновых кислот используют методы,
основанные на регистрации их светопоглощения или на специфических реакциях на
отдельные компоненты этих соединений. Нуклеиновые кислоты имеют максимум
поглощения света при 260 нм, который обусловлен присутствием в них азотистых
оснований. Все основания полинуклеотидов обладают тем же максимумом абсорбции,
за исключением цитозина, зона наибольшего поглощения которого находится при 270
нм. Поэтому по интенсивности светопоглощения азотистых оснований нуклеотидов
можно определить содержание нуклеиновой кислоты в экстрактах из биологического
материала или растворах. Однако светопоглощение природной ДНК на 40-50% ниже,
чем составляющих ее нуклеотидов. Этот так называемый «гипохромный эффект»
связан с двуспиральной структурой природной ДНК. Гипохромный эффект характерен
также и для РНК, содержащих спиральные участки или петли.
Учитывая эти особенности нуклеиновых кислот, А.С.Спирин разработал метод
измерения светопоглощения гидрализатов ДНК и РНК при двух длинах волн - 270 и
290 нм, поскольку при этих условиях на определение концентрации нуклеиновых
кислот практически не влияют различия в их нуклеотидном составе.
Количество нуклеиновых кислот в пробах можно измерить, используя реакции
на пентозы с дифениламином и орцином. Однако следует учитывать, что при
кислотном гидролизе ДНК разрушается N-гликозидная связь в пуриннуклеотидах, но
не в пиримидиннуклеотидах. Поэтому только часть дезоксирибозы становится
реакционноспособной, причем величина ее определяется нуклеотидным составом
(отношением пуринов к пиримидинам) ДНК.
Практическое значение работ по количественному определению нуклеиновых
кислот. Количественное определение нуклеиновых кислот, выделяемых при
биохимических исследованиях тканей и клеток, можно проводить прямой
спектрофотометрией в ультрафиолетовой области или с помощью специфических
реакций на пентозы: дифениламиновой - на дезоксирибозу, а с орциновой - на рибозу.
Эти же методы можно использовать и при хроматографическом разделении пуриновых
и пиримидиновых нуклеозидов или нуклеотидов. Количественные методы определения
нуклеиновых кислот применяются в экспериментальной и клинической биохимии, а
также для количественного анализа лекарственных средств нуклеотидной или
нуклеозидной природы в контрольно-аналитических лабораториях.
Работа 15. Спектрофотометрический метод
количественного определения нуклеиновых кислот по А.С. Спирину
Реактивы. Хлорная кислота, 1 М раствор.
Оборудование. Штатив с пробирками и капельницами; пипетки вместимостью 2
мл; водяная баня; спектрофотометр.
Материал.
1. Гидролизат дезоксирибонуклеопротеидов
ткани селезенки (полученный в работе 13, г).
2. РНК дрожжевая, свежеприготовленный
раствор.
Метод основан на измерении светопоглощения нуклеиновых кислот при 270 и
290 нм, интенсивность которого пропорциональна их количеству в пробах.
Ход определения. В одну пробирку вносят 1,0 мл гидролизата ДНК, в другую
- тот же объем раствора РНК и доводят дистиллированной водой до 1,5 мл.
Добавляют в каждую пробу по 1,5 мл раствора хлорной кислоты, закрывают
пробирки капельницами и ставят на гидролиз в кипящую водяную баню на 20 мин.
Гидролизаты охлаждают. Определяют экстинкцию содержимого каждой пробы на спектрофотометре
в кювете с толщиной слоя 1 см при 270 и 290 нм.
Расчет. Содержание ДНК рассчитывают по формуле
(Е270 - Е290) · 10,1
х1 = ---------- ,
0,19
а РНК - по формуле
(Е270 - Е290) · 10,5
х2 = ---------- ,
0,19
где х1 и х2 - концентрации ДНК и РНК, мг/л;
Е270 - экстинкция исследуемого гидролизата при 270 нм;
Е290 - экстинкция исследуемого гидролизата при 290 нм;
,19 - удельная экстинкция фосфора нуклеиновых кислот в концентрации 1
мг/л;
,1 и 10,5 - коэффициенты пересчета содержания фосфора на концентрацию
нуклеиновых кислот исходя из теоретического содержания фосфора в ДНК 9,9% и в
РНК 9,5%.
Примечание. Предварительно проверяют чистоту образца. Для этого измеряют
экстинкцию исследуемых растворов ДНК и РНК при 260, 270 и 290 нм. Отношение
Е260/Е270 не должно быть выше 1,2, а отношение Е270/Е290 не меньше 2,0. Если
эти условия не соблюдаются, то пробы содержат примеси нуклеиновой природы.
Оформление работы. По результатам измерений отметить чистоту образцов
нуклеиновых кислот, рассчитать их концентрацию в исследуемых пробах. В выводе
указать возможности данного метода определения содержания нуклеиновых кислот.
Работа 16. Фотоколориметрические методы
количественного определения нуклеиновых кислот
Реактивы. Хлорная кислота, 1 М раствор; дифениламиновый реактив*;
орциновый реактив*.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 2 мл; водяная
баня; ФЭК.
Материал.
1. Гидролизат ДНК ткани селезенки (см.
работу 13, г).
2. ДНК, стандартный свежеприготовленный
раствор концентрации 1 г/л.
3. РНК дрожжевая, опытный раствор.
4. РНК, стандартный свежеприготовленный
раствор концентрации 1 г/л.
а. Определение содержания ДНК (по Дише). Метод основан на образовании
окрашенного комплекса дезоксирибозы с дифениламином (см. работу 13, б),
интенсивность которого пропорциональна концентрации этой пентозы в гидролизатах
ДНК.
Ход определения. В пробирку наливают 0,5 мл стандартного раствора ДНК и
равный объем раствора хлорной кислоты. Ставят пробирку в кипящую водяную баню
на 10 мин. Затем охлаждают содержимое.
Во вторую пробирку вносят 1 мл гидролизата ДНК ткани селезенки (опытная
проба), затем прибавляют в обе пробирки по 2 мл дифениламинового реактива Дише.
Пробы перемешивают стеклянной палочкой и ставят пробирки в кипящую водяную баню
на 10 мин для развития окраски. Затем содержимое пробирок охлаждают.
Опытную и стандартные пробы фотометрируют против контрольной пробы на
ФЭКе при красном светофильтре (длина волны 595 нм) в кювете с толщиной слоя 0,5
см.
Контрольную пробу готовят перед фотометрией. Она содержит 0,5 мл
дистиллированной воды, 0,5 мл раствора хлорной кислоты, 2 мл реактива Дише.
Кипятят содержимое пробирки в течение 10 мин на водяной бане. Охлаждают.
Расчет. Содержание ДНК в опытной пробе х (г/л) рассчитывают по формуле
Еоп
х = ----
Ест
где Еоп - экстинкция опытной пробы против контрольной;
Ест - экстинкция стандартной пробы против контрольной.
Оформление работы. По экстинкции рассчитать концентрацию опытного образца
ДНК, указать в выводе возможность использования дифениламиновой реакции для
количественного определения ДНК.
б. Определение содержания РНК. Метод основан на образовании окрашенного
комплекса рибозы, входящей в состав РНК, с орцином. Интенсивность окрашивания
пропорциональна концентрации РНК в растворе.
Фотометрию опытной и стандартной проб проводят против контрольной на ФЭКе
при красном светофильтре (длина волны 670 нм) в кювете с толщиной слоя 0,5 см.
Контрольная проба обрабатывается так же, только вместо раствора РНК
используется такое же количество дистиллированной воды.
Расчет. Концентрацию РНК в опытном образце х (г/л) рассчитывают по
формуле
Еоп
х = ------
Ест
где Еоп - экстинкция опытной пробы против контрольной;
Ест - экстинкция стандартной пробы против контрольной.
Оформление работы. По экстинкциям рассчитать концентрацию опытного
образца РНК, указать в выводе возможность количественного определения РНК по
орциновой реакции на пентозы.
ЛИПИДЫ
Липиды - разнородная по химическому строению группа органических веществ
биологического происхождения, практически нерастворимых в воде и легко
растворимых в органических неполярных (хлороформ, эфир, бензол, дихлорэтан и
др.) и полярных (этанол, метанол, ацетон и др.) жидкостях. Разнообразие
химического строения липидов затрудняет их классификацию. Эту группу веществ
можно разделить на липидные мономеры (жирные кислоты, высшие алифатические и
аминоспирты и др.), простые липиды (ацилглицерины, воска, диольные липиды),
сложные липиды (фосфолипиды и гликолипиды) и стероиды (наиболее
распространенный из них - холестерин и его эфиры). Биологические функции
липидов в живых организмах многообразны. Они содержатся в жидких средах и
входят в состав биологических мембран клеток организма. Ввиду плохой
растворимости в воде липиды образуют соединения с гидрофильными молекулами -
белками, углеводами. Образование липид-белковых комплексов (липопротеидов)
придает липидам растворимость в воде и позволяет транспортироваться с кровью и
лимфой в организме. Своеобразие растворимости используется при исследовании
липидов, поскольку позволяет отделить их от других веществ, которые находятся в
биологическом материале. Поэтому подбор растворителей в ходе извлечения липидов
из образцов имеет большое значение при их анализе.
Для обнаружения и количественного определения отдельных представителей
липидов, экстрагированных из биологического материала, существуют различные
физико-химические методы и реакции на функциональные группы. Анализ липидов
проводят путем постановки специфических реакций на составные части в целой
молекуле или после ее гидролиза.
Работа 17. Исследование фосфолипидов
Фосфолипиды содержат высшие насыщенные и ненасыщенные жирные кислоты и их
альдегиды, которые соединены эфирной связью с глицерином или сфингозином,
фосфорную кислоту и остаточный спирт (холин, этаноламин, серин, инозит). В
зависимости от строения различают фосфатидилхолины, фосфатидилинозиты,
ацетальфосфатиды, кардиолипин и сфингофосфатиды. Особенно богаты фосфолипидами
нервная ткань, желток яиц.
Реактивы. Этиловый спирт; 96%-ный; сульфат кальция (гипс, порошок);
ацетон; хлорид калия, насыщенный раствор в 96%-ном этаноле; гидроксид натрия,
10%-ный раствор; соляная кислота, 10%-ный раствор; гидросульфит калия,
безводный порошок; реактив молибдата аммония*; нитрат калия, порошок; карбонат
калия, порошок; азотная кислота, 10%-ный раствор; лакмусовая бумага.
Оборудование. Весы аптечные; ступка с пестиком; стеклянные пластинки
(100х50 мм); стеклянные палочки; скальпель; глазные пипетки; пипетки
вместимостью 2 и 5 мл; воронки с бумажными фильтрами; водяная баня; тигли;
сушильный шкаф, отрегулированный на 60˚С.
Материал. Головной мозг лабораторного животного.
а. Извлечение фосфатидилхолинов из ткани мозга. Метод основан на
экстракции горячим этанолом фосфатидилхолинов из мозга, осаждении их ацетоном и
гидролизе в среде с гидроксидом натрия на составные части (жирные кислоты,
глицерин, холин и фосфорная кислота).
Ход определения. Помещают навеску 1 г ткани мозга в ступку и тщательно
растирают с 2-3 г гипса до получения густой кашицы. Кашицу распределяют тонким
слоем на стеклянной пластинке при помощи скальпеля и высушивают в сушильном
шкафу при 60˚С досуха.
Сухую массу соскабливают со стекла скальпелем в сухую ступку, растирают и
затем переносят в сухую пробирку. Приливают 5 мл этанола, пробирку закрывают
пробкой с обратным холодильником (стеклянная трубка длиной 70-80 см). Пробирку
ставят в водяную баню и нагревают 10-15 мин при 70˚С (для экстракции).
Затем спиртовой экстракт отфильтровывают через бумажный фильтр. Если
раствор будет мутным, то фильтрование повторяют через тот же фильтр. Фильтрат
используют для анализа.
б. Обнаружение фосфатидилхолинов в экстрактах. Метод основан на
нерастворимости фосфатидилхолинов в ацетоне, способности их образовывать
эмульсии в воде и давать комплексное соединение с хлоридом кадмия, выпадающее в
виде хлопьевидного осадка.
Ход определения. Наливают в сухую пробирку 2 мл ацетона и по каплям
прибавляют спиртовой фильтрат, полученный в предыдущем опыте. Наблюдают за
помутнением жидкости и выпадением осадка.
В пробирку вносят 20 капель дистиллированной воды и постепенно приливают
5 капель спиртового фильтрата мозга. Встряхивают содержимое и наблюдают за
образованием устойчивой белой эмульсии.
К смеси добавляют 1 мл спиртового фильтрата мозга и прибавляют 0,5 мл
спиртового раствора хлорида кадмия. Отмечают выпадение хлопьевидного осадка.
в. Выявление составных компонентов фосфатидилхолинов. Метод основан на
гидролизе выделенных фосфатидилхолинов в растворе гидроксида натрия и
постановке качественных реакций на составные части их молекул: жирные кислоты,
глицерин, холин и фосфорную кислоту. Жирные кислоты обнаруживают добавлением
соляной кислоты к гидролизату, содержащему растворимые натриевые соли жирных
кислот; в результате образуются нерастворимые свободные жирные кислоты,
всплывающие на поверхность.
Холин при нагревании превращается в триметиламин, имеющий запах
селедочного рассола нагревание
- CH2 - N+(CH3)3 → N(CH3)3 + НО - CH2 - CH2 - OH
Триметиламин обладает выраженными основными свойствами, поэтому
выявляется по посинению лакмусовой бумажки. Акролеин обнаруживается по
характерному раздражающему запаху. Реакция, на которой основано обнаружение
фосфорной кислоты, изложена в работе 11.
Ход определения.
1. Гидролиз фосфатидилхолинов. Спиртовой
экстракт (фильтрат) из ткани мозга упаривают в пробирке на водяной бане и
добавляют 3 мл раствора гидроксида натрия. Кипятят в течение 10 мин.
2. Открытие холина. В ту же пробирку
вносят 20 капель гидролизата и нагревают. Образующийся из холина триметиламин
обнаруживают по появлению запаха селедочного рассола. К отверстию пробирки
подносят влажную красную лакмусовую бумажку и наблюдают изменение ее окраски.
3. Открытие жирных кислот. К оставшемуся
гидролизату прибавляют по каплям раствор соляной кислоты до кислой реакции
среды, обнаруживаемой по лакмусовой бумаге. На поверхность жидкости всплывают в
виде хлопьевидной массы высшие жирные кислоты. Содержимое пробирки фильтруют
через складчатый бумажный фильтр, на котором задерживаются жирные кислоты.
Фильтрат нейтрализуют (по лакмусовой бумажке), прибавляя по каплям раствор
гидроксида натрия, и упаривают на водяной бане досуха. Сухой остаток используют
для реакций на глицерин и фосфорную кислоту.
4. Открытие глицерина. Часть сухого
остатка переносят в сухую пробирку, добавляют несколько кристаллов безводного
гидросульфата калия и осторожно нагревают. Появляется характерный запах
акролеина.
5. Открытие фосфорной кислоты.
Оставшийся сухой остаток сплавляют в тигле с небольшим количеством (одна
глазная лопатка или на кончике скальпеля) порошка нитрата калия и карбоната
натрия (сплавление проводят в вытяжном шкафу!). После охлаждения тигля к сплаву
добавляют раствор азотной кислоты, смесь сливают в пробирку. К 2 мл реактива
молибдата аммония приливают небольшими порциями испытуемый раствор. Смесь
нагревают до кипения. При стоянии образуется желтый осадок фосфомолибдата
аммония.
Оформление работы. Результаты оформить в виде таблицы и описать признаки,
по которым обнаруживается соответствующее вещество.
|
Материал
|
Исследуемый компонент
|
Реакция (проба)
|
Результат реакции
|
В выводе указать на присутствие анализируемых фосфолипидов в ткани мозга
и практическую значимость проведенного исследования.
Практическое значение работы. В клинико-биохимических исследованиях
качественные реакции на фосфолипиды и их компоненты используются для
обнаружения их в экстрактах биологического материала, а в фармации - при
анализе лекарственных препаратов, содержащих фосфолипиды. При разделении
фосфолипидов эти реакции применяются для проявления хроматограмм, а также для
разработки методов количественного определения фосфолипидов.
Работа 18. Качественные реакции на стероиды
Стероидные соединения - стерины и стериды, широко распространены в
животных и растительных организмах. Типичным представителем стероидов организма
животных (зоостеринов) является холестерин, который находится в тканях и
жидкостях в свободном виде или в виде холестеридов, т.е. эфиров пальмитиновой,
стеариновой или олеиновой кислот. Особенно богата холестерином нервная ткань,
где его содержится до 20-30 г/кг, причем больше всего холестерина в белом
веществе головного и спинного мозга, где его концентрация достигает 40-55 г/кг.
Высоко содержание холестерина в ланолине, который используется в фармации для
приготовления мазей.
Холестерин извлекается из биологического материала хлороформом, горячим
этиловым спиртом, диэтиловым эфиром, ацетоном и др. На практике чаще всего
используют смеси органических растворителей. В воде холестерин набухает и
образует эмульсии; в отличие от других липидов он не разрушается под действием
концентрированных щелочей.
К растительным стеринам (фитостерины) относятся эргостерин, стигмастерин,
β-ситостерин, фукостерин, которые
содержатся в растительных маслах, плодах, водорослях и т.д. В лекарственных
растениях (наперстянка, горицвет, ландыш, кендырь и др.) имеются сердечные
гликозиды, агликоны которых представляют собой тоже скелет стерана.
Реактивы. Сульфат кальция (гипс), порошок; хлороформ; серная кислота,
конц.; уксусный ангидрид; смесь формалина с конц. серной кислотой (1:50).
Оборудование. Штатив с пробирками; весы аптечные; ступка с пестиком;
стеклянная пластинка (100х100 мм); лопаточка; воронка с бумажным фильтром;
сушильный шкаф, отрегулированный на 60˚С; скальпель; пипетка вместимостью
5 мл; глазные пипетки.
Материал.
1. Мозг лабораторного животного.
2. Растительное масло.
Для выделения холестерина 3 г ткани мозга тщательно растирают с
двукратным количеством гипса. Густой гомогенат распределяют лопаточкой по
стеклянной пластинке и высушивают в сушильном шкафу при 60˚С. Высушенную
массу счищают скальпелем в сухую ступку, растирают и переносят в сухую
пробирку. В пробирку добавляют 6 мл хлороформа и содержимое взбалтывают 5 мин.
Отфильтровывают хлороформный экстракт через сухой бумажный фильтр в сухую
пробирку и проделывают с ним перечисленные ниже реакции.
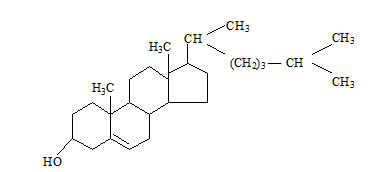
а.
Реакция Гупперт-Сальковского. Метод основан на дегидратации молекулы
холестерина под действием концентрированной серной кислоты с образованием
холестерилена, имеющего красную окраску.
Ход определения. В пробирку наливают 1 мл хлороформного экстракта мозга и
осторожно подслаивают по стенке пробирки 1 мл концентрированной серной кислоты.
Пробирку легко встряхивают. На границе двух жидкостей появляется кольцо
красного цвета, затем вся жидкость принимает последовательно красную, оранжевую
и красно-фиолетовую окраску.

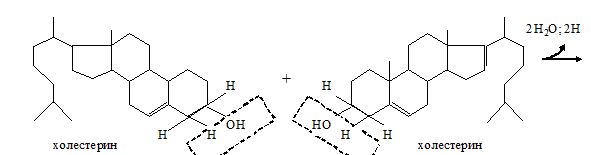
б. Реакция Либермана-Бурхарда. Метод основан на дегидратации холестерина
с последующим соединением двух образовавшихся молекул холестерина в
бихолестадиен:
Бихолестадиен в присутствии уксусного ангидрида и сульфокислоты дает
сульфопроизводные зеленого цвета.
Ход определения. В сухую пробирку наливают 2 мл хлороформного экстракта
мозга и добавляют в нее 10 капель уксусного ангидрида и 2 капли
концентрированной серной кислоты. Появляется вначале красное окрашивание,
переходящее затем в сине-зеленое и зеленое.
в. Реакция Витби. Метод, как и в предыдущих реакциях, основан на
образовании окрашенных производных дегидратированного и окисленного холестерина
под действием серной кислоты.
Ход определения. В одну пробирку вносят 2 мл хлороформного экстракта
мозга, в другую - 2-3 капли растительного масла и 1 мл хлороформа. В обе пробы
добавляют по 20 капель смеси формалина с серной кислотой и встряхивают.
Растворы делятся на два слоя - верхний (хлороформный) окрашивается в яркий
вишневый цвет, нижний (кислотный) - в тусклый буро-красный с зеленой
флуоресценцией.
Из хлороформного слоя обеих пробирок отбирают пипеткой несколько капель,
переносят в другие (сухие!) пробирки и прибавляют по 2 капли уксусного
ангидрида. Вишневая окраска переходит в сине-зеленую.
Оформление работы. Результаты оформить в виде таблицы, отмечая их знаками
«+» или «-».
В выводе указать на присутствие в исследуемом материале соответствующих
стероидов, специфичность использованных реакций и их практическое значение.
|
Материал
|
Исследуемый компонент
|
Реакция
|
Окраска раствора
|
Результат
|
Практическое значение работы. Реакции на холестерин используются для
обнаружения холестерина при гистохимическом и цитохимическом исследовании
тканей, клеточных мазков и биологических жидкостей. Это имеет значение при
нарушениях обмена холестерина, сопровождающихся отложением его в сосудах
(атеросклероз), в коже (ксантоматоз) и т.д. Эти реакции характерны и для
родственных холестерину соединений - стероидных гормонов, желчных кислот,
растительных стеринов, поэтому применяются для качественного анализа
лекарственных препаратов, содержащих указанные вещества, и для разработки
методов их количественного определения.
ФЕРМЕНТЫ
Ферменты (энзимы) - биологические катализаторы белковой природы. Они
содержатся во всех тканях, клетках, внутриклеточных органоидах и биологических
жидкостях. Без них не осуществляется ни один химический процесс в организме.
Разработка методов выделения и очистки ферментов дала возможность получить их в
чистом и кристаллическом виде. Это позволило изучить структуру ферментов,
активные и регуляторные центры их молекул, механизм действия, роль
простетических групп в катализе и т.д. Как любые белки, ферменты подвержены
денатурации, поэтому процедура их получения из биологического материала (ткани
животных и растений, микроорганизмы, жидкости) должна быть щадящей, т.е.
вестись при температуре 0-4˚С, при рН 5-9 (за исключением особых случаев).
Среда для извлечения ферментов не должна содержать примесей тяжелых металлов,
которые инактивируют ферменты.
Ферменты делятся на простые и сложные. У простых ферментов функцию
контактного и каталитического участков активного центра выполняют только
радикалы аминокислот; у сложных - в состав активного центра входят также
коферменты и ионы металлов. Сложные ферменты без кофакторов не активны, что
нужно учитывать при их идентификации.
1. Сравнительное действие ферментов и
небиологических катализаторов
Ферменты в отличие от небиологических катализаторов (металлы, кислоты и
т.д.) обладают высокой эффективностью катализа, специфичностью действия,
способностью ускорять реакции в мягких условиях.
Работа 19. Сравнение действия α-амилазы слюны и соляной кислоты на
реакцию гидролиза крахмала
Реактивы. Крахмал, 1%-ный раствор в 0,3%-ном растворе хлорида натрия,
свежеприготовленный; раствор иода в иодиде калия*; реактив Фелинга*; пероксид
водорода, 10%-ный раствор.
Оборудование. Штатив с пробирками; воронка с ватой; стеклянные палочки;
глазные пипетки; водяная баня с термометром; пипетки вместимостью 5 мл.
Материал.
1. Разбавленная слюна. Для ее получения
промывают рот водой от остатков пищи. Набирают в рот порцию дистиллированной
воды около 20 мл и держат ее примерно 2 мин, смешивая языком со слюной.
Жидкость со слюной выпускают в стаканчик и профильтровывают через вату в
пробирку. Фильтрат используют для работы.
2. Соляная кислота, 10%-ный раствор.
Метод основан на изучении скорости гидролиза крахмала, определяемого по
убыли субстрата (крахмал) реакцией с раствором иода или по приросту продукта
(мальтоза), выявляемого реакцией Фелинга (образование красного осадка оксида
меди). Реагентом на крахмал и декстрины служит иод, образующий с ними
окрашенные комплексные соединения (табл.6). Амилоза крахмала при этом дает с
иодом комплекс синего цвета, гликоген - красно-бурого, а декстрины в
зависимости от молекулярной массы окрашиваются в красно-бурый или желтоватый
цвет. Последний обусловлен не образованием комплекса, а находящимся в среде
иодом.
Мальтоза как восстанавливающий дисахарид выявляется реакцией Фелинга,
которая основана на способности углеводов в щелочной среде восстанавливать ионы
Cu2+, содержащиеся в жидкости Фелинга в виде комплексного соединения с
тартратами, до оксида меди красного цвета, выпадающего в осадок.
Таблица 6.
Проба с иодом на крахмал и продукты его гидролиза
|
Крахмал и продукты его
гидролиза
|
Окрашивание с иодом
|
|
Крахмал
|
Синее
|
|
Амилодекстрины
|
Фиолетовое
|
|
Эритродекстрины
|
Красное
|
|
Ахродекстрины
|
Желтое (окраска раствора
иода) или бесцветное
|
|
Мальтодекстрины
|
То же
|
|
Мальтоза
|
То же
|
Чем выше скорость катализа, тем быстрее исчезает (положительная
иод-крахмальная проба) синее окрашивание и усиливается реакция Фелинга на
мальтозу.
Ход определения. Берут три пробирки: в первую вносят 1 мл воды, во вторую
- 1 мл раствора соляной кислоты, в третью - 1 мл разбавленной слюны. Добавляют
во все пробы по 5 мл раствора крахмала, перемешивают их стеклянной палочкой и ставят
первую и третью пробирки в водяную баню при 38˚С, а вторую - в кипящую
водяную баню. Через 15 мин пробирки охлаждают. Из каждой пробирки отбирают по 5
капель в другие пробирки, добавляют по 1-2 капли раствора иода и сравнивают
окрашивание проб.
Для определения мальтозы отбирают по 3 мл из каждой пробирки, прибавляют
по 1 мл реактива Фелинга и нагревают верхний слой смеси до кипения. Отмечают
появление в пробах красного осадка оксида меди (I).
Оформление работы. Результаты заносят в таблицу.
|
Катализатор
|
Субстрат реакции
|
Продукт реакции
|
Выявление
|
Результат
|
|
|
|
субстратов
|
продуктов
|
|
|
|
|
|
|
|
В выводах указать разницу в действии катализаторов на скорость гидролиза
крахмала.
2. Выявление ферментов, относящихся к разным
классам
Все ферменты в зависимости от типа катализируемых химических реакций
делятся на шесть классов: оксидоредуктазы, трансферазы, гидролазы, лиазы,
изомеразы, лигазы (синтетазы). Внутри каждого класса ферменты подразделяются на
подклассы, подподклассы, которые уточняют природу ферментативной реакции
(номенклатуру и систему нумерации ферментов см. учебник, с.125-129).
Для обнаружения ферментов каждого класса в биологическом материале
имеются свои особенности, поэтому необходимо определить условия для протекания
ферментативной реакции. Качественные реакции на ферменты используются в клинике
для обнаружения ферментов в мазках крови, биоптатах и микропрепаратах при
энзимоцитохимических исследованиях, а также в гигиенической практике при
постановке проб на присутствие ферментов в продуктах питания (молоко, картофель
и т.д.). При разделении ферментов методом электрофореза их идентификацию также
производят с помощью качественных реакций.
Работа 20. Обнаружение оксидоредуктаз в биологическом материале
В реакциях, катализируемых оксидоредуктазами, окисляемый субстрат
рассматривается как донор водорода или электронов, а акцептором могут быть
природные вещества (коферменты - НАД, НАДФ, ФМН, ФАД, КоQ, кислород,
органические соединения, цитохромы и др.) и ксенобиотики.
Для большинства ферментов этого класса рекомендуются названия:
дегидрогеназы и редуктазы. В тех случаях, когда акцептором служит О2,
используется термин оксидаза, а если кислород в ходе реакции включается в
состав субстрата, то фермент называется оксигеназа. Пероксидаза является
ферментом, использующим Н2О2 в качестве акцептора, а каталаза - ферментом,
катализирующим реакции, где донорно- акцепторную пару составляют две молекулы
Н2О2.
Реактивы. Формальдегид, 0,4%-ный раствор; метиленовый синий, 0,01%-ный
раствор.
Оборудование. Штатив с пробирками; водяная баня; лабораторный термометр;
пипетки вместимостью 1 и 5 мл.
Материал.
1. Картофельный сок (сырой картофель
натирают на терке и отжимают через два слоя марли).
2. Свежее коровье молоко.
а. Выявление альдегидоксидазы (альдегид: кислород оксиредуктаза; КФ
1.2.3.1) в молоке.
Метод основан на визуальном наблюдении за обесцвечиванием метиленового
синего (МС), связывающего водород, который отщепляется с участием
альдегидоксидазы от субстрата.
Альдегидоксидаза катализирует реакцию дегидрирования различных
альдегидов, например, формальдегида.
Водород переносится на ФАД+, являющийся коферментом данного фермента, а
затем на конечный акцептор - кислород - по уравнению
Альдегидоксидаза
НС ═ О + Н2О + ФАД+ Н ─ С ═ О + ФАД∙Н2
│ │
Н ОН
Альдегидоксидаза
ФАД∙Н2 + О2 ФАД+ + Н2О2
При добавлении МС - искусственного акцептора водорода - в бескислородных
условиях образуется его восстановленная форма (лейкоформа) МС∙Н2.
Если бесцветный раствор метиленового синего встряхнуть, то он вновь
приобретет синюю окраску:
МС∙Н2 + О2 → МС + Н2О2
Ход определения. В две пробирки вносят по 5 мл свежего молока и добавляют
в первую 1 мл воды, а во вторую такой же объем раствора формальдегида. В обе
пробы приливают по 1 мл раствора метиленового синего, содержимое перемешивают и
приливают 3-4 капли вазелинового масла (для предохранения жидкой смеси от
контакта с кислородом воздуха).
Пробирки ставят в водяную баню, нагретую до 37˚С. Через 5-10 мин
сравнивают изменение окрашивания в пробах. Сильно встряхнув, вновь отмечают
переход окраски.
б. Выявление пероксидазы (донор: Н2О2 оксидоредуктаза; КФ 1.11.1.7) в
картофеле и в молоке. В основе метода лежит реакция с бензидином (см. работу 9,
а).
Ход определения. В две пробирки наливают по 1 мл соответственно сырого
молока и картофельного сока. Добавляют в обе пробы по 5 капель спиртового
раствора бензидина и по капле раствора пероксида водорода. Отмечают характерное
окрашивание.
Оформление работы. Результаты занести в таблицу и отметить характерное
окрашивание индикатора реакции.
|
Материал
|
Выявленный фермент
|
Субстрат (донор)
|
Акцептор
|
Индикатор реакции
|
Результат
|
В выводах указать на присутствие в биологическом материале изучаемых
ферментов и практическое значение работы.
Работа 21. Обнаружение холинэстеразы
(ацетилхолинацилгидролаза; КФ 3.1.1.7) в сыворотке крови экспресс-методом
Херцфельда и Штумпфа
Реактивы. Полоски фильтровальной бумаги, смоченные
субстратно-индикаторным раствором (0,2 г ацетилхолина-бромида и 0,1 г
дибромсульфофталеина растворить в 7 мл 96%-ного этанола).
Оборудование. Предметные стекла; пинцеты; микропипетки; часы; водяная
баня.
Материал. Сыворотка крови.
Метод основан на изменении окраски индикатора дибромсульфофталеина (от
синей до зеленой и желтой), происходящем в результате освобождения уксусной
кислоты при гидролизе ацетилхолина холинэстеразой:
O
║ холинэстераза
(CH3)3N+―CH2―CH2―O―C― CH3 + H2O
(CH3)3N+―CH2―CH2OH +
CH3COOH
ацетилхолин холин уксусная кислота
Ход определения. На чистое предметное стекло наносят каплю сыворотки
крови, на нее пинцетом опускают полоску бумаги, которая тут же окрашивается в
синий цвет. Засекают время. Пробу накрывают вторым предметным стеклом и
отмечают время появления желтого окрашивания бумаги.
Оформление работы. Занести результаты (время появления желтого
окрашивания индикаторной бумаги от момента помещения ее на каплю сыворотки
крови) и сравнить их с нормой, которая колеблется от 5 до 20 мин. Сделать вывод
о присутствии изучаемой гидролазы в сыворотке крови.
Работа 22. Определение активности
фруктозо-1,6-бисфосфатальдолазы в сыворотке крови по методу В.И. Товарницкого и
Е.Н. Волуйской
Реактивы. Фруктозо-1,6-бисфосфата, натриевая соль, 1%-ный раствор*; смесь
на альдолазу*, раствор 2,4-динитрофенилгидразина 0,1%-ный раствор,
трихлоруксусная кислота 10%-ный раствор, едкий натрий 3%-ный раствор, калибр.
раствор*.
Оборудование. Штатив с пробирками, пипетки на 0,2; 0,1; 1,0; 2,0; 5,0 мл;
центрифуга; термостатирующая водяная баня; фотоэлектроколориметр.
Материал. Исследуемая сыворотка крови.
Метод основан на определении дигидроксиацетонфосфата (ДОФ), образующегося
в ходе расщепления фруктозобисфосфата с участием альдолазы:

Дигидроксиацетонфосфат
при взаимодействии с 2,4-динитрофенилгидразином образует гидразон, который в
щелочной среде имеет коричнево-бурую окраску:
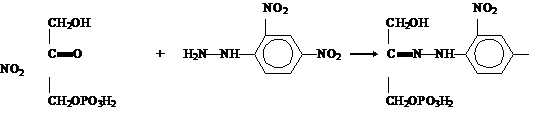
Ход
определения. В центрифужную пробирку (опытная проба) к 0,2 мл смеси на
альдолазу с фруктозо-1,6-бисфосфатом (смешать 1,75 мл смеси на альдолазу с 0,25
мл фруктозо-1,6-бисфосфата) внести 0,1 мл сыворотки крови. В другую
центрифужную пробирку (контрольная проба) взять 0,175 мл смеси на альдолазу без
фруктозо-1,6-бисфосфата и добавить 0,1 мл сыворотки крови. Обе пробирки
поместить в термостат при температуре 37˚С на 1 час. По истечении времени
пробирки вынуть из термостата и добавить к контрольной пробе 0,025 мл раствора
фруктозо-1,6-бисфосфата. Для осаждения белков в обе пробирки внести по 0,3 мл
10% раствора трихлоруксусной кислоты. Центрифугировать 10 минут при 3000об/мин,
слить центрифугат в другую пробирку и, добавив по 0,6 мл 3% раствора едкого
натрия, оставить стоять на 10 минут при комнатной температуре. Затем прилить по
0,6 мл раствора 2,4-динитрофенилгидразина и пробы поместить на 10 минут в
термостат или водяную баню при температуре 37˚С, затем добавить 4,2 мл 3%
раствора едкого натрия. Фотометрировать на ФЭКе при длине волны 530-540 нм
(зеленый светофильтр) в кювете на 0,5 см против контрольной пробы.
Примечание.
Так как окраска неустойчива, то фотометрировать следует сразу после добавления
едкого натрия.
Расчет.
По полученной величине экстинкции по калибровочному графику находят активность
фермента в мкмоль/ч∙л.
Построение
калибровочного графика
В ряд пробирок (см. приложение) разливают калибровочный раствор
диоксиацетона, доливают водой и далее проводят реакцию также, как и при
определении активности фермента.
|
№ пробирки
|
Калибровочный раствор
диоксиацетона, мл
|
Дистил. вода, мл
|
Диоксиацетон в пробе,
мкмоль
|
Фруктозо-1,6-бис-фосфат в
пробе, мкмоль
|
|
1
|
0,05
|
0,45
|
0,5
|
0,25
|
|
2
|
0,10
|
0,40
|
1,0
|
0,50
|
|
3
|
0,20
|
0,30
|
2,0
|
1,0
|
|
4
|
0,30
|
0,20
|
3,0
|
1,5
|
|
5
|
0,40
|
0,10
|
4,0
|
2,0
|
Оформление работы. После определения активности фермента по полученным
данным сделать вывод о возможных изменениях активности фермента и причинах этих
отклонений.
Практическое значение работы. В норме активность
фруктозо-1,6-бис-фосфатальдолазы составляет 3,6-21,8 мкмоль/ч∙л.
Повышение активности фермента наблюдается при заболеваниях печени, поражении ее
гепатотропными ядами, а также в случае нарушений со стороны сердечной и
скелетной мышц (инфаркт миокарда, прогрессирующая мышечная дистрофия, миозит и
т.д.).
Работа 23. Определение глюкозофосфат-изомеразы
(D-глюкозо-6-фосфат кетол-изомераза; КФ 5.3.1.9) в сыворотке крови
Реактивы. Субстратная смесь для выявления глюкозофосфат-изомеразы*,
трихлоруксусная кислота, 10%-ный раствор; резорцин, 0,1%-ный раствор в 3,6%-ной
соляной кислоте; соляная кислота, 36%-ный раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 5 мл; водяная
баня; лабораторный термометр.
Материал. Сыворотка крови.
Метод основан на определении фруктозо-6-фосфата, образующегося в ходе
изомеризации глюкозо-6-фосфата под действием глюкозофосфат-изомеразы
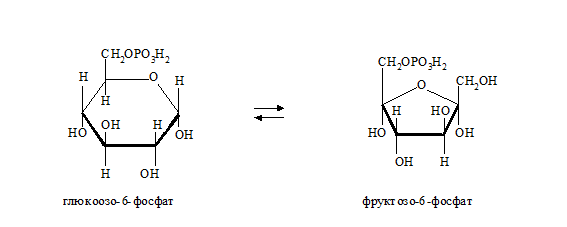
Фруктозо-6-фосфат
образует с резорцином в присутствии соляной кислоты соединение красного цвета.
Ход
определения. В две пробирки вносят по 0,5 мл сыворотки крови. В одну из них
(опытную) добавляют 1 мл субстратной смеси и перемешивают. Помещают обе
пробирки на 30 мин в водяную баню при 37˚С, а по окончании инкубации в них
приливают по 1,5 мл раствора трихлоруксусной кислоты (для остановки реакции). В
контрольную пробу доливают 1 мл субстратной смеси.
После
перемешивания содержимое каждой пробирки фильтруют через складчатый бумажный
фильтр. Отбирают по 1 мл фильтрата в чистые пробирки, приливают по 1 мл
резорцина и по 3 мл раствора соляной кислоты. Смеси энергично встряхивают и
оставляют для развития окраски. Отмечают разницу окрашивания в пробах.
Оформление
работы. Отметить различие окраски проб и сделать вывод о присутствии фермента в
сыворотке крови.
3. Изучение кинетических свойств ферментов
Кинетика ферментативных реакций - это раздел энзимологии, который изучает
зависимость скорости реакций, катализируемых ферментами, от химической природы
реагирующих веществ (т.е. субстратов и ферментов) и от условий их
взаимодействия, т.е. от температуры, концентрации компонентов, рН среды,
состава среды, присутствия модификаторов и т.д. Изучение кинетики
ферментативных реакций показывает не только их отличия от небиологических
катализаторов, обусловленные прежде всего белковой природой ферментов, но и
многообразие условий, от которых зависит правильное определение активности
любого фермента.
Скорость реакции, т.е. убыль субстрата или прирост количества продукта за
определенные промежутки времени, является мерой каталитической активности
фермента или просто активностью фермента.
Использование методов качественного анализа субстратов и продуктов
реакции позволяет выявить присутствие фермента в биологическом материале, а
количественное определение их дает возможность определить содержание фермента
или его активность в расчете на единицу массы или объема исследуемого образца.
Работа 24. Кинетика ферментативных реакций на
примере α-амилазы слюны
Реактивы. Крахмал, 1%-ный раствор, свежеприготовленный; раствор иода в
иодиде калия*; фосфатно-цитратный буфер, 0,1 М с рН 5,6; 6,4; 6,8; 7,2 и 8,0*.
Оборудование. Штатив с пробирками; водяная баня; лабораторный термометр;
пипетки вместимостью 1 и 5 мл; бюретка вместимостью 25 мл; химические стаканы
(для льда или снега).
Материал. Слюна разбавленная (см. работу 18).
а. Зависимость скорости реакции от количества фермента. Метод основан на
определении скорости гидролиза крахмала, выявляемого пробой с иодом, в
зависимости от количества добавленной α-амилазы слюны.
Ход определения. Разводят исходную разбавленную слюну водой в пробирках в
20, 40, 80 и 160 раз. Берут четыре пробирки и вносят в каждую 1 мл одного из
полученных разведений слюны. В пробирки из бюретки добавляют по 4 мл раствора
крахмала, быстро помещают их в водяную баню при 38˚С и засекают время
начала реакции.
Через каждые 1-2 мин отбирают по 2 капли жидкости из каждой пробы и
приливают к ним по 1 капле раствора иода в иодиде калия. Вначале пробы дают
синее, затем красно-фиолетовое и, наконец, красное окрашивание.
Отмечают с точностью до 0,5 мин время от начала опыта до появления в
каждой из четырех пробирок красного окрашивания - стадия образования
эритродекстринов из крахмала.
Оформление работы. Результаты изобразить графически, откладывая по оси
ординат v - скорость реакции (величина, обратная времени образования
эритродекстринов), а по оси абсцисс [C] - относительную концентрацию амилазы
(разведение). Сделать вывод о зависимости скорости реакции от концентрации фермента
и сравнить с той же зависимостью для небиологических катализаторов.
б. Зависимость скорости ферментативной реакции от температуры. Метод
основан на определении скорости гидролиза α-амилазой слюны крахмала в зависимости
от температуры.
Ход определения. В пробирку помещают 5 капель слюны, кипятят 1-2 мин на
водяной бане и остужают. В две другие помещают по 5 капель некипяченой слюны.
Вносят во все пробы по 10 капель раствора крахмала и ставят первую и
вторую пробирки в водяную баню при 38˚С, а третью - в воду со льдом или
снегом на 3 мин. Затем прибавляют в каждую пробирку по 1 капле раствора иода в
иодиде калия и сравнивают развивающуюся окраску.
Оформление работы. Данные оформляют в виде таблицы, делают вывод о
зависимости ферментативной реакции от температуры и причинах этой зависимости.
|
Фермент
|
Субстрат
|
Окрашивание с иодом
|
Температура
|
в. Зависимость скорости ферментативной реакции от рН среды. Метод основан
на сравнении скорости гидролиза крахмала, определяемого пробой с иодом, под
действием α-амилазы слюны при разных рН среды. В результате
устанавливается оптимум рН действия α-амилазы.
Ход определения. В пять пробирок отмеривают по 10 капель растворов
фосфатно-цитратного буфера со следующими значениями рН: 5,6; 6,4; 6,8; 7,2;
8,0. Прибавляют во все пробы по 5 капель разведенной в 10 раз слюны и по 10
капель раствора крахмала и ставят пробирки в водяную баню при 38˚С. Через
1-2 мин отбирают по 1 капле содержимого в другие пробирки и приливают по 1
капле раствора иода в иодиде калия. Отмечают время наступления красного
окрашивания (стадия образования эритродекстринов) в каждой из пяти проб.
Оформление работы. Данные оформить графически, откладывая по оси абсцисс
значения рН среды и по оси ординат - время (в мин), которое необходимо для
гидролиза крахмала до стадии эритродекстринов. Сделать вывод об оптимуме рН
действия α-амилазы слюны.
Практическое значение работы. Кинетические свойства ферментов изучаются
для подбора оптимальных условий (концентрация субстрата, оптимум рН среды и
температуры, ионный состав среды), определения активности ферментов в научных и
клинических исследованиях, а также при стандартизации ферментных препаратов.
Неверно подобранные стандартные условия определения конкретного фермента
приводят к ошибкам в диагностике заболеваний и контроле качества ферментных
препаратов.
4. Специфичность действия ферментов
Ферменты в отличие от небиологических катализаторов обладают высокой
специфичностью. Однако степень специфичности разных энзимов неодинакова, что
позволяет клеткам живых организмов приспосабливаться к изменениям среды.
Работа 25. Демонстрация абсолютной субстратной
специфичности уреазы (карбамидамидогидролаза; КФ 3.5.1.5.)
Реактивы. Мочевина, 1%-ный раствор; тиомочевина, 1%-ный раствор;
ацетамид, 1%-ный раствор; фенолфталеин, 0,5%-ный спиртовой раствор; лакмусовая
бумага.
Оборудование. Аптечные весы с разновесами; штатив с пробирками; глазные
пипетки; пипетки вместимостью 1 мл.
Материал. Соевая мука.
Метод основан на определении аммиака, образующегося под действием уреазы
соевой муки на мочевину:
уреаза
H2N ― C ― NH2 + H2O 2NH3↑ + CO2↑
║
мочевина
Выделение аммиака обнаруживается по запаху и по изменению окраски
фенолфталеина и красной лакмусовой бумаги. Сравнивают возможность гидролиза
уреазой веществ, сходных по строению с мочевиной:
H2N ― C ― NH2
║
Тиомочевина
CH3 ― C ― NH2
║
ацетамид
Ход определения. В одну пробирку помещают 1 мл раствора мочевины, во
вторую - тиомочевины, в третью - ацетамида.
В каждую пробирку добавляют примерно 100 мг соевой муки и 2 капли
раствора фенолфталеина, тщательно перемешивают стеклянной палочкой и оставляют
стоять при комнатной температуре.
Следят за появлением розовой окраски содержимого в пробирках. Выделение
аммиака обнаруживают также по запаху и с помощью влажной лакмусовой бумажки,
которую подносят к отверстию пробирок. Сравнивают результаты выявления аммиака
в трех пробах.
Оформление работы. Данные оформить в виде таблицы, сделать вывод о
специфичности уреазы и ее практическом значении.
|
Фермент
|
Субстрат
|
Пробы на аммиак
|
|
|
Фенолфталеин
|
Запах
|
Лакмусовая бумага
|
Практическое значение работы. Ферменты с абсолютной субстратной
специфичностью, к которым относится уреаза, катализируют превращение только
одного вещества. Эти ферменты используют в клинической биохимии и фармации как
аналитические реагенты для определения веществ, к которым они имеют абсолютную
специфичность. Например, уреаза используется для определения мочевины в
биологическом материале и лекарственных препаратах.
Работа 26. Специфичность действия амилазы (α-1,4-глюкан-4-глюкангидролаза; КФ
3.2.1.1.) и сахаразы (β-D-фруктофуранозид-фруктогидролаза;
КФ 3.1.1.26)
Реактивы. Крахмал, 1%-ный раствор; сахароза, 2%-ный раствор; реактив
Фелинга*.
Оборудование. Штатив с пробирками; водяная баня; лабораторный термометр;
глазные пипетки.
Материал.
1. Слюна, разбавленная (см. работу 19).
2. Сахараза, извлеченная из дрожжей.
(Для получения сахаразы из дрожжей 2 г дрожжей размять в ступке, растереть,
добавив 10-12 мл дистиллированной воды. Содержимое из ступки перенести в
пробирку и поставить в водяную баню при 37˚С на 10-15 мин.
Отцентрифугировать смесь при 3000 об/мин в течение 10 мин. Надосадочную
жидкость, которая содержит фермент сахаразу, слить и использовать в работе).
Метод основан на сравнительном изучении гидролиза α-амилазой и сахаразой разных
субстратов, содержащих гликозидные связи: крахмала и сахарозы. Гидролиз
крахмала и сахарозы оценивают пробой Фелинга на восстанавливающие сахара
(мальтоза, глюкоза).
Ферменты катализируют реакции по схеме:
α-Амилаза
Крахмал + nH2O Декстрины + Мальтоза
Сахараза
Сахароза + H2O Глюкоза + Фруктоза
Ход определения. В одну пробирку вносят 10 капель раствора крахмала, в
другую - такой же объем раствора сахарозы. Для выявления специфичности α-амилазы в обе пробы добавляют по 5
капель разбавленной слюны, перемешивают встряхиванием и ставят в водяную баню
при 38˚С на 10 мин. Затем с жидкостью в обеих пробирках проделывают пробу
с реактивом Фелинга (см. работу 19) и сравнивают окраску.
Для выявления специфичности сахаразы в одну пробирку наливают 10 капель
раствора крахмала, а в другую - сахарозы и прибавляют к ним по 5 капель
экстракта сахаразы дрожжей. Пробы перемешивают встряхиванием и помещают в
водяную баню при 38˚С на 10 мин, после чего с жидкостью обеих пробирок
проделывают пробу с реактивом Фелинга. Сравнивают окраску.
Оформление работы. Данные занести в таблицу, сделать вывод о
специфичности изученных ферментов и обозначить, к какому типу специфичности они
относятся.
|
Фермент
|
Субстрат
|
Проба с реактивом Фелинга
|
Специфичность действия
|
Практическое значение работы. Ферменты с абсолютной и относительной
групповой субстратной специфичностью, обладающие меньшей избирательностью
действия на субстраты, участвуют, как правило, в гидролизе питательных веществ
или превращении чужеродных соединений. В частности, α-амилаза и сахараза проявляют
специфичность не к структуре субстрата в целом, а к типу гликозидных связей,
находящихся в соответствующих углеводах.
5. Модификаторы активности ферментов
Вещества, изменяющие активность ферментов (модификаторы), делятся на
активаторы и ингибиторы. Они стимулируют или угнетают активность фермента,
влияя на его активный или аллостерический центры. Модифицирующее влияние
различных соединений на активность фермента устанавливают путем кинетических
исследований.
Работа 27. Активаторы и ингибиторы α-амилазы слюны
Реактивы. Крахмал, 0,5%-ный раствор; хлорид натрия, 1%-ный раствор;
сульфат меди (II), 1%-ный раствор; фенилтиомочевина. 0,02%-ный раствор; раствор
иода в иодиде калия*.
Оборудование. Штатив с пробирками; глазные пипетки; водяная баня с
лабораторным термометром; часы.
Материал. Слюна, полученная, как в работе 18, и разведенная водой в 10
раз.
Метод основан на сравнении скорости гидролиза крахмала (продукт гидролиза
крахмала обнаруживают пробой с иодом) под действием α-амилазы слюны до и после добавления
фенилтиомочевины, ионов Cl‾ и Cu2+.
Ход определения. Берут четыре пробирки и наливают по 10 капель: в первую
- дистиллированной воды, во вторую - раствора хлорида натрия, в третью -
раствора сульфата меди и в четвертую - раствора фенилтиомочевины, а затем по 20
капель раствора крахмала и по 1 капле разведенной слюны. Содержимое
перемешивают встряхиванием, помещают пробирки в водяную баню при 38˚С и
засекают время начала инкубации.
Через каждые 1-2 мин из проб отбирают в другие пробирки по 1 капле
жидкости и добавляют 1 каплю раствора иода в иодиде калия. Отмечают время
появления красного окрашивания (стадия образования эритродекстринов) при
проведении реакции с иодом в каждой из пробирок.
Оформление работы. Результаты занести в таблицу, сделать вывод о действии
изученных веществ и о предполагаемом типе ингибиторов.
|
Фермент
|
Модификатор активности
|
Субстрат
|
Время образования
эритродекстринов, мин (проба с иодом)
|
Работа 28. Действие конкурентных ингибиторов на
сукцинат-дегидрогеназу (сукцинат: акцептор оксидоредуктаза; КФ 1.3.99.1)
мышечной ткани
Реактивы. Малоновая кислота, 1%-ный раствор, нейтрализованный NaOH;
сукцинат натрия, 1%-ный раствор; метиленовый синий, 1%-ный раствор; вазелиновое
масло.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 мл; водяная
баня; лабораторный термометр.
Материал. Мышечная кашица, полученная после забоя животного.
Метод основан на сравнительном определении активности
сукцинатдегидрогеназы по обесцвечиванию в ходе реакции метиленовой сини (МС)
как акцептора водорода в присутствии и в отсутствии малоновой кислоты.
Образующийся ФАД∙Н2 восстанавливает метиленовую синь (МС∙Н2),
в результате чего происходит обесцвечивание раствора. Сравнивая визуально
уменьшение интенсивности синего окрашивания с пробами, содержащими разные
количества малоновой кислоты (НООС - СН2 - СООН), делают вывод о типе действия
ее на фермент.
Ход определения. В три пробирки помещают по 3-4 г мышечной кашицы и
добавляют в первую пробирку 0,8 мл воды, во вторую 0,2 мл раствора малоновой
кислоты и 0,6 мл воды, а в третью - 0,8 мл раствора малоновой кислоты.
Во все пробирки приливают по 1 мл раствора сукцината натрия, по 1 капле
раствора метиленового синего и после перемешивания по 3-4 капли вазелинового
масла. Пробирки ставят в водяную баню при 37˚С. Через 3-5 мин наблюдают
обесцвечивание раствора.
Оформление работы. Сравнить интенсивность голубого окрашивания в трех
пробирках и сделать вывод о механизме действия малоновой кислоты на активность
сукцинатдегидрогеназы.
Практическое значение работы. Конкурентные ингибиторы различных ферментов
широко применяются в биохимических исследованиях и в практической медицине как
лекарственные препараты. В частности, малоновая кислота как конкурентный ингибитор
сукцинатдегидрогеназы используется в экспериментах на животных для того, чтобы
изучить изменения в обмене веществ в тканях при блокаде этого фермента, а также
для исследования самого механизма конкурентного торможения.
Работа 29. Неконкурентное ингибирование каталазы крови
Реактивы. Пероксид водорода, 3%-ный раствор; азид натрия, 1%-ный раствор.
Оборудование. Штатив с пробирками; глазные пипетки.
Материал. Цельная кровь, разведенная водой в 10 раз.
Метод основан на визуальном сравнении интенсивности выделения пузырьков
газа (кислорода) при разложении пероксида водорода с участием каталазы крови в
отсутствии и в присутствии азида натрия NaN3.
Ход определения. В две пробирки вносят по капле крови и добавляют в одну
их них 2 капли воды, а в другую - такой же объем раствора азида натрия. Пробы
встряхивают.
Через 2 мин прибавляют в обе пробирки по 2 мл раствора пероксида водорода
и сравнивают интенсивность выделения пузырьков газа.
Оформление работы. По полученным данным сделать вывод о действии азида
натрия на каталазу крови и указать на практическое значение работы.
Практическое значение работы. Неконкурентными ингибиторами геминовых
ферментов (цитохромы, цитохромоксидаза, каталаза и пероксидаза) являются азиды
и цианиды, которые взаимодействуют с железом гема, входящего в активный центр,
подавляя тем самым каталитическую активность этих ферментов. Благодаря этому
азиды и цианиды являются сильными ядами. Учитывая, что они неконкурентные
ингибиторы, снять их действие можно только теми веществами, которые связывают
их и освобождают из активного центра фермента.
6. Количественное определение активности
ферментов
В клинико-биохимических лабораториях широко используется количественное
определение активности ферментов для диагностики заболеваний, а также для контроля
за проводимым лечением. В фармации оно необходимо для контроля качества
ферментных препаратов, а в научных биохимических исследованиях - для наблюдения
за процедурой очистки фермента.
Об активности фермента судят по количеству превращенного субстрата или
образовавшегося продукта реакции за определенный промежуток времени. Скорость
ферментативной реакции графически описывается в виде гиперболы - кривая
Михаэлиса-Ментен, поэтому для правильного измерения активности ферментов
необходимо соблюдать ряд правил. Определение следует вести в стандартных
условиях, т.е. при насыщающих концентрациях субстрата или субстратов, оптимуме
рН среды и постоянной температуре, которые должны поддерживаться весь период
наблюдения. При изучении сложных ферментов в среду добавляют необходимые
кофакторы. Эти условия обеспечивают нулевой порядок реакции, при которой ее
скорость лимитируется только концентрацией исследуемого фермента. Измерять
активность фермента нужно не за любой отрезок времени, а только за начальный,
когда скорость реакции протекает линейно, т.е. за единицу времени превращается
одно и то же количество субстрата (это так называемая начальная скорость
реакции).
В зависимости от способа регистрации все методы определения
ферментативной активности можно подразделить на два типа: метод отбора проб и
непрерывного наблюдения. В первом случае перед инкубацией и через определенные
отрезки времени в ходе реакции отбирают пробы раствора, осаждают белок и
определяют в безбелковой жидкости содержание субстратов или продуктов реакции.
По полученным данным строят кривую зависимости образования продуктов реакции от
времени и рассчитывают активность фермента. Во втором случае наблюдение ведут
непрерывно или автоматически регистрируют ход реакции, если субстрат (или
продукт реакции) поглощает в определенной области спектра или флуоресцирует,
что позволяет постоянно следить за изменением его концентрации в среде за
выбранные промежутки времени.
Метод непрерывной регистрации очень чувствителен, удобен и экономичен,
так как для него требуются небольшие количества биологического материала или
ферментного препарата. Он широко применяется при количественном измерении
активности окислительных ферментов, для действия которых необходимы
никотинамидные коферменты. Окисленные формы их (НАД+ и НАДФ+) не поглощают при
340 нм, а восстановленные (НАД∙Н2 и НАДФ∙Н2) имеют максимум
абсорбции при этой длине волны. Поэтому скорость ферментативной реакции
определяют по степени восстановления окисленных форм данных коферментов или по
степени окисления восстановленных форм.
Для выражения активности таких ферментов используют молярный коэффициент
экстинкции восстановленных форм НАД и НАДФ, который при 340 нм равен 6,22∙106
см2/моль, или 6,22∙103л∙моль-1∙см-1. Это означает, что если в
процессе реакции произошло изменение экстинкции на 6,22∙106, то это
указывает на образование (или убыль) 1 моля восстановленного кофермента в
расчете на 1 мл реакционной смеси. Если экстинкция изменяется на 6,22∙103
или на 6,22, то соответственно образуется (или расходуется) в ходе реакции 1
ммоль или 1 мкмоль восстановленных коферментов на 1 мл среды. Можно также
наблюдать за скоростью ферментативной реакции по поглощению восстановленного
НАД и НАДФ при 366 нм. Молярный коэффициент экстинкции в этом случае равен 3,3∙106
см2/моль.
Концентрацию исследуемого фермента подбирают таким образом, чтобы
обеспечить изменение экстинкции на 0,010-0,100 за 1 мин. Если этот показатель
выше, то проба, содержащая фермент, разводится, если ниже, то берется больший
объем изучаемого образца.
Для непрерывного наблюдения за ходом реакции по светопоглощению
восстановленных форм НАД (НАДФ) или других субстратов при определенной длине
волны требуются спектрофотометры. Однако, современный фотоэлектроколориметр
типа КФК-2 позволяет проводить измерения ферментативной активности, например,
при 366 нм (расчет производится по экстинкции раствора НАД∙Н или НАДФ∙Н
с известной концентрацией).
При невозможности наблюдать за реакцией непрерывно активность фермента
измеряют методом отбора проб, причем содержание субстратов и продуктов реакции
определяют разными способами. Наиболее распространены колориметрические методы.
Правила выражения активности ферментов в единицах СИ были изложены ранее
(см. с.11). Температура, при которой проводится определение, указывается при выражении
активности фермента.
Работа 30. Количественное исследование
активности препарата лактатдегидрогеназы по Корнбергу
Реактивы. Фосфатный буфер, 0,1 М с рН 7,4*; пируват натрия, раствор 2∙10-2
М на 0,1 М фосфатном буфере с рН 7,4; НАД∙Н динатриевая соль,
свежеприготовленный 6∙10-3 М раствор в дистиллированной воде.
Оборудование. Пипетки вместимостью 0,1; 1 и 5 мл; стеклянная палочка;
секундомер; СФ или ФЭК типа КФК-2.
Материал. Разведенный продажный препарат фермента 0,2 мкг/мл.
Кристаллический препарат в виде суспензии в 2,2 М растворе сульфата аммония,
имеющий активность около 200 ФЕ/мг белка, разводят в 1000 раз 0,1 М фосфатным
буфером с рН 7,4 перед опытом (1 ФЕ соответствует 1 мкмоль превращенного
субстрата за 1 мин).
Метод основан на непрерывном измерении скорости окисления НАД∙Н2,
используемого на восстановление пирувата в реакции, катализируемой ЛДГ. По
уменьшению экстинкции НАД∙Н2 при 340 нм рассчитывают количество
превращенного субстрата за единицу времени. Лактатдегидрогеназа (ЛДГ)
катализирует обратимое превращение пирувата в лактат:
Н
│
СН3―С―СООН + НАД·Н2 НАД+ + СН3―С―СООН
║ │
О ОН
пируват лактат
Равновесие реакции сдвинуто вправо, поэтому при изучении ЛДГ удобнее
использовать в качестве субстрата пируват и НАД∙Н2 и по скорости
окисления последнего рассчитать активность этого фермента.
Ход определения. В кювету спектрофотометра последовательно вносят 2,4 мл
фосфатного буфера, 0,2 мл раствора НАД∙Н2 и 0,1 мл образца фермента.
Перемешивают стеклянной палочкой и ставят в кюветодержатель.
Устанавливают шкалу отсчета экстинкции на 0,400 и ручкой «щель» выводят
стрелку гальванометра (при открытой шторке) на нуль. В течение 1 мин проверяют
отсутствие неферментативного окисления НАД∙Н2 (в этом случае экстинкция
не падает).
Добавляет в кювету 0,3 мл раствора пирувата натрия (запускают реакцию),
быстро перемешивают, ручкой «щель» при открытой шторке возвращают стрелку
гальванометра к нулевой отметке и включают секундомер.
Снимают показания экстинкции (падение ее, начиная от отметки 0,400) через
каждые 30 с в течение 2-3 мин. Если условия реакции подобраны верно, то за
каждые 30 с наблюдается примерно одинаковое уменьшение экстинкции.
Расчет. Удельную активность ЛДГ х (мкмоль∙мин-1∙мг-1)
рассчитывают по формуле
∆Емин3,0∙1000
х = ------- ,
6,22∙0,02
где ∆Емин - изменение экстинкции в ходе реакции за 1 мин;
,22 - коэффициент экстинкции 1 мкмоль НАД∙Н2 в 1 мл среды;
,0 - объем инкубационной смеси, мл;
,02 - количество белка в кювете, мкг;
- коэффициент пересчета количества белка в миллиграммы.
Оформление работы. Рассчитать удельную активность ферментного препарата,
молекулярную активность ЛДГ (учитывая, что ее молекулярная масса 135000).
Сделать вывод о качестве исследуемого препарата (сохранность исходной
активности, %).
Практическое значение работы. Принципы измерения активности
лактатдегидрогеназы спектрофотометрическим методом непрерывного наблюдения
используются при исследовании других ферментных препаратов, очищенных ферментов
и в клинико-биохимических лабораториях при количественном определении
активности ферментов в биологических жидкостях и биоптатах в норме и при
патологии.
Работа 31. Фотоколориметрический метод
исследования активности лактатдегидрогеназы в сыворотке крови по Севелу и
Товареку
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1 и 5 мл;
ФЭК; водяная баня с лабораторным термометром.
Материал. Сыворотка крови.
Метод основан на определении скорости образования пирувата в ходе
окисления лактата с участием лактатдегидрогеназы сыворотки крови:

СН3―СН―СООН + НАД+ СН3― С―СООН + НАД·Н2
│ ║
ОН О
лактат пируват
Пируват с 2,4-динитрофенилгидразином образует соответствующий гидразон,
имеющий красно-бурое окрашивание в щелочной среде, интенсивность которого прямо
пропорциональна содержанию кетокислоты:
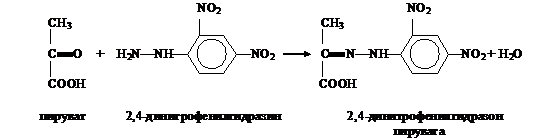
Ход
определения. Сыворотку крови разводят в 3 раза дистиллированной водой. Вносят в
пробирку 0,1 мл разведенной сыворотки, 0,3 мл раствора НАД+ и ставят на 5 мин в
водяную баню при 37˚С (для прогревания смеси).
Во
вторую пробирку добавляют 0,8 мл раствора пирофосфата натрия и 0,2 мл раствора
лактата натрия и нагревают на водяной бане при 37˚С.
Выливают
содержимое второй пробирки в первую, быстро перемешивают стеклянной палочкой,
не вынимая пробирки из бани, и отмечают время начала инкубации. Через 25 мин
реакцию останавливают, прибавляя 0,5 мл раствора 2,4-ДНФГ, и оставляют пробирку
на 20 мин при комнатной температуре (для образования гидразона).
К
смеси приливают 5 мл раствора гидроксида натрия, содержимое перемешивают
стеклянной палочкой и через 10 мин (после развития окраски) измеряют экстинкцию
опытной пробы против контрольной на ФЭКе при длине волны 520-560 нм
(светофильтр зеленый) в кювете с толщиной слоя 1 см.
Контрольную
пробу готовят как опытную, но разведенную сыворотку добавляют после инкубации.
Расчет.
Активность фермента рассчитывают по калибровочному графику, условия построения
которого приведены в таблице.
|
№ пробы
|
Пируват натрия, мл
|
Пирофосфат натрия, мл
|
Дистиллированная вода, мл
|
Содержание пирувата в
пробе, мкмоль
|
Единицы активности ЛДГ,
ммоль/ч∙л
|
Экстинкция
|
|
1
|
0,1
|
0,8
|
0,5
|
0,01
|
1,2
|
|
|
2
|
0,2
|
0,8
|
0,4
|
0,02
|
2,4
|
|
|
3
|
0,4
|
0,8
|
0,2
|
0,04
|
4,8
|
|
|
4
|
0,6
|
0,8
|
-
|
0,06
|
7,2
|
|
|
5
|
0,8
|
0,6
|
-
|
0,08
|
9,6
|
|
По оси ординат откладывают значения экстинкции, а по оси абсцисс -
соответствующие им единицы активности ЛДГ, выраженные в ммоль/(ч∙л).
Оформление работы. Рассчитать активность фермента в исследуемой сыворотке
крови, сделать вывод о возможном изменении активности и его причинах.
Практическое значение работы. Определение активности лактатдегидрогеназы
используется в клинико-биохимических лабораториях для диагностики и
установления прогноза заболевания. В норме активность фермента составляет
0,8-4,0 ммоль/(ч∙л) и возрастает, как правило, у больных с повреждением
миокарда, скелетных мышц, почек, а также при анемиях, опухолевых поражениях,
остром гепатите и т.д.
Работа 32. Определение активности щелочной
фосфатазы в сыворотке крови по Боданскому
Фосфатазы - ферменты, отщепляющие фосфат от различных субстратов. Среди
них имеются энзимы с неодинаковой специфичностью по отношению к субстратам.
Щелочная фосфатаза действует в щелочной среде (чем отличается от фосфатаз,
осуществляющих катализ в нейтральной или кислой средах) и является
малоспецифичной.
Реактивы. β-Глицерофосфат, щелочной раствор на мединаловом буфере
с рН 8,6*; трихлоруксусная кислота, 10%-ный раствор; реактив молибдата
аммония*; аскорбиновая кислота, 1%-ный раствор на 0,1 М растворе соляной
кислоты; дигидрофосфат калия (навеску 0,4394 г KH2PO4, предварительно
высушенного в эксикаторе над серной кислотой, взвешивают на аналитических весах
и растворяют в колбе вместимостью 100 мл; затем этот раствор разводят в 100 раз
и используют для построения калибровочной кривой).
Оборудование. Штатив с пробирками; центрифуга лабораторная с
центрифужными весами; пипетки вместимостью 0,2; 1 и 5 мл; водяная баня с
лабораторным термометром; ФЭК.
Материал. Сыворотка крови.
Метод основан на фотоколориметрическом определении неорганического
фосфора, отщепляемого от β-глицерофосфата под действием фосфатазы сыворотки крови
в щелочной среде:
СН2ОН СН2ОН
│ Фосфатаза │
НС―О―РО3Н2 + Н2О НС―ОН + Н3РО4
│ рН 8,6 │
СН2ОН СН2ОН
β-глицерофосфат глицерин
Неорганический фосфат определяют по образованию фосфомолибдата аммония с
последующим восстановлением его в молибденовую синь аскорбиновой кислотой (см.
работу 11).
Ход определения. В две пробирки вносят по 1 мл раствора β-глицерофосфата и помещают на 5 мин в
водяную баню при 37˚С. Затем в опытную пробирку добавляют 0,2 мл сыворотки
крови, перемешивают и отмечают время начала инкубации в водяной бане.
Через 1 час приливают в обе пробирки по 1,8 мл раствора трихлоруксусной
кислоты, а в контрольную - еще 0,2 мл сыворотки крови. Перемешивают пробы, оставляют
стоять 5 мин для осаждения белка. Центрифугируют содержимое обеих проб в
течение 5 мин при 3000 об/мин.
Отбирают в чистые пробирки по 1,5 мл надосадочной жидкости (для
определения в ней неорганического фосфата Фн) и приливают по 1 мл реактива
молибдата аммония и по 1 мл раствора аскорбиновой кислоты. Через 10 мин
измеряют экстинкцию опытной и контрольной проб на ФЭКе, при длине волны 630-690
нм (красный светофильтр) в кювете с толщиной слоя 0,5 см против раствора
реактивов (1,5 мл раствора трихлоруксусной кислоты и 1,5 мл дистиллированной
воды).
Расчет. Активность фермента рассчитывают по калибровочному графику,
условия построения которого приведены в таблице.
|
№ пробы
|
Раствор KH2PO4, мл
|
Н2О, мл
|
Трихлоруксусн. кислота, мл
|
Молибдат аммония, мл
|
Аскорбиновая кислота, мл
|
Фн в пробе, мг
|
Активность фермента,
ммоль/(ч∙л)
|
|
1
|
0,1
|
0,9
|
0,5
|
1,0
|
1,0
|
0,001
|
0,32
|
|
2
|
0,2
|
0,8
|
0,5
|
1,0
|
1,0
|
0,002
|
0,64
|
|
3
|
0,4
|
0,6
|
0,5
|
1,0
|
1,0
|
0,004
|
1,29
|
|
4
|
0,6
|
0,4
|
0,5
|
1,0
|
1,0
|
0,006
|
1,93
|
|
5
|
1,0
|
-
|
0,5
|
1,0
|
1,0
|
0,010
|
3,22
|
По оси ординат откладывают значения экстинкции, а по оси абсцисс -
соответствующие единицы щелочной фосфатазы, выраженные в ммоль/(ч∙л).
Оформление работы. По полученным значениям экстинкции найти активность
фермента. На основании этого сделать вывод о возможности изменения активности в
исследуемой сыворотке и указать на предполагаемые причины.
Практическое значение работы. В клинике используется определение
активности щелочной фосфатазы в сыворотке крови в основном у больных с
поражениями костной ткани и печени, особенно с явлениями задержки оттока желчи.
В норме активность фермента составляет 0,5-1,3 ммоль/(ч∙л). Повышение
активности в сыворотке крови наблюдается при рахите (гиповитаминозе D),
опухолях костной ткани, гиперпаратиреозе, механической желтухе, вирусном
гепатите и т.д., а снижение - при гипотиреозе, гиповитаминозе С и др.
7. Исследование изоферментов
Изоферменты отличаются друг от друга несколькими физико-химическими
признаками и, в частности, зарядом молекул, поэтому электрофорез издавна
используется для их разделения. Изоферменты лактатдегидрогеназы были открыты
одними из первых.
Различают пять типов изоферментов ЛДГ, которые в порядке подвижности к
аноду обозначаются: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5.
Каждый из них представляет собой тетрамер, отличающийся составом
субъединиц (см. учебник, с.226, 438).
Работа 33. Разделение изоферментов
лактатдегидрогеназы сыворотки крови методом электрофореза в полиакриламидном
геле по Дитцу и Лубрано
Использование в качестве среды геля полиакриламида позволяет добиться
высокого разрешения при электрофорезе белков и ферментов, поскольку этот гель
играет роль молекулярного сита, что обеспечивает дополнительное разделение
частиц по молекулярной массе.
Реактивы. Раствор № 1 для полимеризации геля с рН 8,9 (1,0 М соляная
кислота - 48 мл, трис-основание - 36,6 г, N,N,N,N-тетраметилэтилендиамин, или
ТЕМЕД - 0,23 мл и дистиллированная вода до 100 мл); раствор № 2 (акриламид -
30,0 г, N,N-метиленбисакриламид - 0,8 г и дистиллированная вода до 100 мл);
персульфат аммония, 0,14%-ный свежеприготовленный раствор; сахароза, 40%-ный
раствор; электродный буфер с рН 8,9 (трис-основание - 6,0 г, глицин - 28,8 г,
дистиллированная вода до 1 л; перед употреблением разводят в 10 раз); уксусная
кислота, 7%-ный раствор; фосфатный буфер, 0,5 М с рН 7,4; лактат натрия, 1 М
раствор; НАД, 10 г/л раствор; нитротетразолиевый синий (НС), 1 г/л раствор;
феназинметасульфат (ФМС), 1 г/л раствор; хлорид магния, 0,005 М раствор; хлорид
натрия, 0,1 М раствор.
Оборудование. Колба коническая вместимостью 25 мл; пипетки с оттянутым
тонким концом; фильтровальная бумага; стеклянные палочки; штатив с пробирками;
пипетки вместимостью 0,1; 1,5 и 10 мл; резиновые колпачки; аппарат для
электрофореза со стеклянными трубочками; источник постоянного напряжения;
микроденситометр; спектрофотометр или ФЭК.
Материал. Сыворотка крови.
Метод основан на разной электрофоретической подвижности изоферментов ЛДГ,
положение которых на столбиках полиакриламидного геля выявляется с помощью
веществ, переносящих водород от лактата через феназинметасульфат на
нитротетразолиевый синий. В результате в месте нахождения фракции ЛДГ выпадает
фиолетово-синий осадок диформазана.
Ход определения. Для полимеризации геля берут сухие чистые стеклянные
трубочки, закрывают их с одного конца резиновыми колпачками, устанавливают в
штативе строго перпендикулярно и вносят в них каплю раствора сахарозы. Затем
готовят полимеризующую смесь, состоящую из растворов № 1, № 2, персульфата
аммония и дистиллированной воды в соотношении 1:2:4:1. Смеси готовят из расчета
2 мл на одну трубочку.
Приготовленную полимеризующую смесь разливают в стеклянные трубочки,
используя по 2 мл на каждую. Затем на поверхность этого раствора осторожно
наслаивают 0,2-0,3 мл дистиллированной воды пипеткой с тонким оттянутым концом
(это улучшает полимеризацию геля в трубочках, которая протекает без доступа
кислорода воздуха, и формирует гладкую поверхность геля). Через 30 мин обычно
полимеризация завершается, о чем свидетельствует ясно различимая граница между
полиакриламидным гелем и водой. После этого переворачивают трубочки и осторожно
стряхивают с геля наслоенную воду, а остатки воды удаляют из трубочки с помощью
фильтровальной бумаги.
Стеклянные трубочки с заполимеризованным гелем закрепляют в гнездах
верхней камеры для электрофореза. На поверхность геля в трубочке наносят
сначала 0.1 мл сыворотки крови, затем такой же объем раствора сахарозы и
перемешивают нанесенные жидкости стеклянной палочкой. Осторожно наслаивают на
эту жидкость разведенный в 10 раз электродный буфер, заполняя им пространство
до верхнего края трубочки.
Нижнюю камеру аппарата заливают тем же электродным буфером, устанавливают
верхнюю камеру над нижней так, чтобы нижние концы трубочек были погружены в
электродный буфер. Затем верхнюю камеру тоже заполняют электродным буфером.
Аппарат для электрофореза ставят в холодильник. Электроды подключают к
источнику постоянного напряжения: нижний электрод к аноду, верхний к катоду
(см. рис. 3). В течение первых 10 мин электрофорез проводят при силе тока 2 мА
на каждую трубочку. Затем силу тока увеличивают до 4 мА. Длительность
электрофореза около 90 мин.
Пока идет электрофорез, для выявления изоферментов ЛДГ готовят в колбе
инкубационную смесь следующего состава: растворы лактата натрия, хлорида
магния, НАД - по 1 мл, фосфатного буфера и НС - по 2,5 мл и ФМС- 0,25 мл.
Перемешивают содержимое колбочки.
По окончании электрофореза гели извлекают из трубочек. Для этого
используют шприц на 10-20 мл с тонкой длинной иглой. Вводят иглу между стенкой
трубочки и гелем. Круговыми движениями отслаивают гель, постоянно выдавливая
воду из шприца и продвигая иглу к противоположному концу трубки. При этом
столбик геля легко выскакивает из трубки.
Столбик геля помещают в пробирки диаметром 7-8 мм и наливают в них
инкубационную смесь так, чтобы весь столбик геля был погружен в проявляющую
жидкость. Пробирки ставят в термостат при 37˚С на 40-60 мин. Изоферменты
ЛДГ выявляются в виде сине-фиолетовых колец на столбике геля.
По истечении инкубации столбики геля промывают водой, переносят в
пробирки, содержащие раствор уксусной кислоты, и хранят в темноте.
Количественную обработку гелевых изоэнзимограмм проводят
спектрофотометрическим методом или посредством денситометрии. В первом случае
лезвием вырезают окрашенные участки геля, помещают их в пробирки и заливают 1 мл
подогретого до +80-85˚С раствора диметилформамида. Затем окрашенную
жидкость сливают в микрокюветы и измеряют экстинкцию на спектрофотометре или
ФЭКе при 540 нм против раствора диметилформамида.
Второй способ обработки заключается в сканировании гелей на
микроденситометре. Денситограммы подвергаются количественной обработке.
Расчет. Относительную активность каждого изофермента х (%) выражают в
процентах от суммы экстинкций всех изоферментов ЛДГ:
ЕА100% Е100
х = ------ , или, упрощенно, х = --- ,
∑Е ∑Е
где Е - экстинкция элюата изофермента из зоны геля, относящаяся к данному
изоферменту;
∑Е - сумма экстинкций всех изоферментов;
А - активность ЛДГ сыворотки крови, ммоль/(ч·л).
Оформление работы. Зарисовать полученную изоэнзимограмму и рассчитать
относительную активность изоферментов ЛДГ (в %). Сделать вывод о сдвигах
спектра изоферментов ЛДГ в исследуемой сыворотке и указать на вероятные причины
этого явления.
Практическое значение работы. Состав изоферментов ЛДГ имеет
внутриклеточную, тканевую и видовую специфичность. Тканевые различия
изоферментного спектра ЛДГ явились предпосылкой для использования его в
диагностике и прогнозе ряда заболеваний, сопровождающихся некрозом органов и
тканей. Известно, что в сердечной мышце, нервной ткани, почках высокая
активность ЛДГ1 и ЛДГ2 (изоферменты Н-типа), в поджелудочной железе и легочной
ткани преобладает ЛДГ3, а в скелетной мышце и печени - ЛДГ4 и ЛДГ5 (изоферменты
М-типа). При некрозе этих тканей находящиеся в них изоферменты поступают в
кровь и изменяют ее нормальный спектр. В норме сыворотка крови имеет примерно
следующие соотношения изоферментов (в % от общей активности): ЛДГ1 - 32, ЛДГ2 -
47, ЛДГ3 - 12, ЛДГ4 - 5, ЛДГ5 - 4. При инфаркте миокарда в сыворотке крови
увеличивается доля ЛДГ1 и ЛДГ2 (спектр смещается в сторону изоферментов
Н-типа), причем этот сдвиг определяется размерами очага некроза в сердце.
Заживление сопровождается нормализацией состава изоферментов в сыворотке крови.
При инфекционном гепатите повышена относительная активность ЛДГ4 и ЛДГ5.
Если она сохраняется при клиническом выздоровлении, то это свидетельствует о
незавершенности восстановительных процессов в печени.
При поражении поджелудочной железы (панкреатит), легочной ткани
увеличивается относительная активность ЛДГ3 в сыворотке крови.
Работа 34. Определение активности γ-глутамилтрансферазы в сыворотке
крови
Реактивы. L-γ-глутамил-п-нитроанилид; натрия хлорид; глицил-
глицин*; субстратно-буферный раствор*; уксусная кислота ледяная, раствор 100
г/л; основной калибровочный раствор п-нитроанилида*.
Оборудование. Пипетки на 0,1; 1,0 и 5,0 мл; термостатирующая водяная
баня; спектрофотометр или фотоэлектроколориметр.
Материал. Сыворотка крови.
Метод основан на определении п-нитроанилида, образующегося из L-γ-глутамил-п-нитроанилида при
ферментативном переносе L-γ-глутамилового остатка на
глицил-глицин.
ГТФ
γ-глутамил-п-нитроанилид +
глицил-глицин
γ-глутамил-глицилглицид + п-нитроанилин
Ход определения. В опытную пробирку вносят 0,5 мл раствора субстрата и
помещают в водяную баню при температуре 37°С. Через 5 минут приливают 0,05 мл
сыворотки крови, содержимое перемешивают и инкубируют точно 15 минут при
температуре 37°С. Затем прибавляют 3 мл раствора уксусной кислоты и
перемешивают. Контрольную пробу ставят также как опытную, но сыворотку
добавляют после инкубации. Измеряют на спектрофотометре при длине волны 410 нм
или на ФЭКе при длине волны 400-500 нм (фиолетовый или синий светофильтр) в
кювете с толщиной слоя 10 мм против контрольной пробы. Окраска стабильна в
течение нескольких часов.
Расчет. Активность фермента рассчитывают по калибровочному графику.
Оформление работы. По полученным значениям экстинкции найти активность
фермента. На основании этого сделать вывод о возможности изменения активности в
исследуемой сыворотке и указать на предполагаемые причины.
Практическое значение работы. В клинике используется определение
активности γ-глутамилтрансферазы в сыворотке крови в основном при
заболеваниях печени и желчных путей. В норме активность составляет для мужчин
250-1767 нмоль/с·л (15-106 МЕ), для женщин - 167-1100 нмоль/с·л или 10-66 МЕ.
Повышение активности фермента наблюдается при заболеваниях желчных путей с
явлениями обтурации, при гепатитах, опухолях и метастазах в печень. Следует
отметить, что увеличение γ-глутамилтрансферазы, как правило, увеличивается
параллельно активности щелочной фосфатазы, но активность γ-глутамилтрансферазы возрастает
раньше, остается повышенной более длительное время и относительное увеличение
активности фермента в несколько раз выше, чем щелочной фосфатазы. Следует
отметить, что наркотики, седативные средства, этанол, стимулируют активность
фермента, что используется для диагностики алкогольно-токсических заболеваний
печени.
БИОХИМИЯ ПИЩЕВАРЕНИЯ
Пищеварение - это ферментативный гидролиз компонентов пищи. Для оценки
его используются методы исследования активности ферментов и других компонентов
пищеварительных соков, играющих вспомогательную роль в переваривании
питательных веществ, например, соляная кислота, желчные кислоты, ионы кальция и
т.д. Отклонения в составе пищеварительных соков или появление в них
компонентов, не содержащихся в физиологических условиях, дают важную информацию
о патологии пищеварения.
Работа 35. Исследование кислотных компонентов
желудочного сока
Реактивы. Гидроксид натрия, 0,1 М раствор; n-диметиламиноазобензол,
0,5%-ный раствор в 36%-ном этаноле; фенолфталеин, 0,5%-ный раствор в 70%-ном
этаноле; фенол, 1%-ный раствор; хлорид железа (III), 1%-ный раствор.
Оборудование. Колбы конические вместимостью 25 мл; микробюретка; пипетки
вместимостью 1,5 и 10 мл; штатив с пробирками.
Материал. Желудочный сок нормальный и патологический*.
а. Определение содержания соляной кислоты и общей кислотности желудочного
сока. Метод основан на определении кислотных веществ желудочного сока путем
титрования их раствором гидроксида натрия с использованием двух разных
индикаторов: n-диметиламиноазобензола (имеющего зону перехода окраски при рН
2,3-4,2) и фенолфталеина (имеющего зону перехода окраски при рН 8,2-10,0). По
изменению окраски (от красной к оранжевой) индикатора n-диметиламиноазобензола
определяется свободная соляная кислота, а по переходу окраски фенолфталеина (от
бесцветной к розовой) - общая кислотность желудочного сока.
Ход определения. В одну колбу для титрования вносят 5 мл исследуемого
нормального, в другую - патологического желудочного сока. Добавляют 1-2 капли
раствора n-диметиламиноазобензола и 2 капли раствора фенолфталеина.
Пробы оттитровывают раствором гидроксида натрия до появления
оранжево-красной окраски и отмечают объем щелочи (в мл), пошедший на титрование
свободной соляной кислоты (I пункт титрования).
Продолжают титрование до появления лимонно-желтой окраски (II пункт
титрования) и снова отмечают объем щелочи, израсходованный с начала титрования
до II пункта.
Затем титрование продолжают до появления розовой окраски (III пункт
титрования) и отмечают количество щелочи, пошедшее на титрование от начала до
III пункта.
Расчет. За единицу кислотности желудочного сока принимается объем 0,1 М
раствора гидроксида натрия (в мл), пошедший на титрование 100 мл желудочного
сока. Поэтому расчеты кислотности даются на 100 мл.
Например, на титрование 5 мл желудочного сока до I пункта пошло 1,5 мл
раствора гидроксида натрия, тогда количество свободной соляной кислоты равно:
1,5 · 100
--- = 30 ммоль/л, или 30 ед.
5
Для вычисления связанной соляной кислоты необходимо знать общую соляную
кислоту. Последнюю определяют на основании данных титрования. Известно, что
количество щелочи, необходимое для связывания всей соляной кислоты, равно
среднему арифметическому количеству щелочи, пошедшему на титрование до II и III
пунктов
Следовательно, если до II пункта титрования пошло, например, 2 мл, а до III
- 3 мл щелочи, то среднее арифметическое равно
2+3
--- = 2,5 мл.
2
Отсюда содержание общей соляной кислоты в 100 мл желудочного сока
составит
2,5∙100
---- = 50 ед.
5
Связанная с белками соляная кислота определяется по разнице между
количествами общей и свободной соляной кислоты:
ед. - 30 ед. = 20 ед.
Кроме того, III пункт титрования служит для определения общей
кислотности. Если на титрование 5 мл желудочного сока пошло 3 мл раствора
гидроксида натрия, то общая кислотность равна:
3∙100
---- = 60 ед.
5
б. Качественная реакция на молочную кислоту в желудочном соке (проба
Уфельмана). Метод основан на способности молочной кислоты в присутствии
фенолята железа (III) образовывать малодиссоциирующую соль лактата железа
желто-зеленого цвета.
Ход определения. Для приготовления фенолята железа в пробирку вносят 10
мл раствора фенола и добавляют к нему 3 капли раствора хлорида железа FeCl3.
Содержимое перемешивают стеклянной палочкой (развивается фиолетовое
окрашивание).
Берут еще две пробирки: в одну наливают 2 мл нормального желудочного
сока, а в другую - такой же объем желудочного сока, взятого у больного.
Приливают к содержимому обеих проб по 3 мл приготовленного фенолята железа и
перемешивают их встряхиванием. Отмечают наличие характерного окрашивания в
пробирках.
Оформление работы. Результаты оформить в виде таблицы.
|
Образцы желудочного сока
|
Индикатор
|
Количество NaOH, пошедшее
на титрование
|
Пункты титрования
|
Окрашивание
|
Соляная кислота
|
Общая кислотность
|
Проба на молочную кислоту
|
|
|
|
|
|
Свободная
|
Общая
|
Связанная
|
|
|
|
Нормальный
|
|
|
|
|
|
|
|
|
|
|
Патологический
|
|
|
|
|
|
|
|
|
|
Сделать вывод о характере изменений кислотности желудочного сока. Указать
причины появления молочной кислоты в желудочном соке и практическое значение
определения исследуемых веществ.
Практическое значение работы. Переваривание белков во многом зависит от
кислотности желудочного сока. В норме общая кислотность равна 40-60 ед.,
содержание свободной соляной кислоты - 20-40 ед., связанной - 5-20 ед. При
патологии кислотность желудочного сока может быть нулевой, повышенной или
пониженной. Отсутствие соляной кислоты и пепсина (ахилия) часто наблюдается при
злокачественных новообразованиях желудка. Пониженная кислотность
(гипохлоргидрия) встречается при гипоацидном гастрите, иногда при язвенной
болезни желудка. Повышенная кислотность (гиперхлоргидрия) имеет место при
гиперацидном гастрите и часто сопровождается язвенной болезнью желудка и
двенадцатиперстной кишки. Присутствие молочной кислоты указывает обычно на
гипоацидный гастрит или рак желудка. В связи с этим определение кислотности
желудочного сока и наличие молочной кислоты в нем имеет важное значение для
диагностики желудочно-кишечных заболеваний.
Работа 36. Определение кислотности желудочного
сока диагностическим набором «Ацидотест»
Реактивы. 25% соляная кислота, набор «Ацидотест».
Оборудование. Штатив с пробирками (диаметр 11-13 мм), пипетки на 5 мл,
мерные колбы на 200 мл.
Материал. Контрольная и опытная моча.
Метод основан на освобождении из принятого тест-драже красящего вещества,
количество которого зависит от кислотности желудочного сока.
Ход определения. После опорожнения мочевого пузыря обследуемый принимает
1-2 таблетки кофеина, который повышает диурез и усиливает желудочную секрецию.
Через 1 час проводится опорожнение мочевого пузыря и полученная моча
обозначается как «контрольная». После этого с небольшим количеством воды, без
разжевывания, принимается 3 тест-драже. Через 1,5 часа повторно следует
опорожнение мочевого пузыря и моча обозначается как «1,5-часовая». Как
контрольная моча, так и полученная через 1,5 часа, разбавляется водой до 200
мл. Разбавленную мочу (контрольная и опытная) вносят в количестве 5 мл,
добавляют 5 мл 25% раствора соляной кислоты. В пробирке, содержащей 1,5-часовую
мочу (опытная проба) в присутствии красящего вещества, появляется окрашивание
алого цвета. Интенсивность окрашивания тут же сравнивают с цветной шкалой, т.к.
при стоянии цвет изменяется.
Оценка результатов. Совпадение развившегося окрашивания разделению,
обозначенному буквой «А» на цветной шкале указывает на наличие свободной
соляной кислоты и нормальную кислотность желудочного сока, при более
интенсивной окраске - гиперацидность, при окрашивании, соответствующему между
разделениями «А» и «В» обозначает гипоацидность.
Оформление работы. Сопоставить развившееся окрашивание с цветной шкалой и
сделать вывод о характере кислотности желудочного сока.
Работа 37. Гидролиз белка ферментами пищеварительного тракта
Переваривание белка происходит с участием протеолитических ферментов желудка
(пепсин и гастриксин) и кишечника (трипсин, химотрипсин, карбоксипептидазы А и
В, аминопептидаза, эластаза и др.). Каждый из ферментов специфически
гидролизует пептидные связи, образуемые определенными аминокислотами в
полипептидной цепи перевариваемого белка (см. учебник, с.178-181). Оптимум рН
действия протеиназ желудка находится в кислой области и равен 1,5-2,0 для
пепсина и 3,0-3,5 для гастриксина, в то время как протеолитическая активность
ферментов кишечника максимальна при рН 7,6-8,5.
Исследование активности протеолитических ферментов проводится путем
анализа скорости гидролиза добавленного белка или определения количества
образующихся в ходе реакции пептидов и свободных аминокислот.
Реактивы. Фибрин*; соляная кислота, 0,05 и 0,1 М растворы; гидроксид
натрия, 0,4%-ный раствор; карбонат натрия, 0,4%-ный раствор; лакмусовая бумага.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 2 мл;
термостат, отрегулированный на 38˚С.
Материал.
1. Пепсин, свежеприготовленный 0,1%-ный
раствор в 0,05 М соляной кислоте.
2. Трипсин, кристаллический препарат во
флаконах, или панкреатин, порошок. Перед употреблением готовят 0,1%-ный
раствор.
а. Демонстрация гидролиза белка под действием пепсина. Метод основан на
визуальном наблюдении скорости гидролиза белка пепсином, определяемой по
растворению кусочков фибрина.
Ход определения. Берут пять пробирок и вносят в первую 1 мл раствора
пепсина, во вторую - предварительно прокипяченного раствора пепсина, в третью -
раствора соляной кислоты (0,05 М), в четвертую и пятую предварительно
нейтрализованного гидроксидом натрия раствора пепсина.
Во все пробирки, кроме пятой, помещают одинаковые небольшие кусочки
фибрина и ставят пробы на 20-30 мин в термостат при 38˚С, после чего
отмечают изменения, произошедшие с волокнами фибрина в первых четырех
пробирках.
Пятую пробирку охлаждают и нейтрализуют ее содержимое раствором соляной
кислоты по лакмусовой бумажке. Затем приливают в пробирку 1 мл 0,1 М раствора
соляной кислоты и добавляют небольшой кусочек фибрина. Пробу вновь помещают в
термостат при 38˚С и через 20-30 мин отмечают изменения волокон фибрина.
б. Демонстрация гидролиза белка под действием трипсина. Основа метода та
же, что и при изучении действия пепсина.
Ход определения. Берут три пробирки и наливают в одну из них 2 мл
раствора карбоната натрия, в другую - дистиллированной воды и в третью -
раствор соляной кислоты (0,1 моль/л). В первую и третью пробирки добавляют по 1
мл раствора трипсина (или панкреатина) и во вторую - 1 мл предварительно
прокипяченного трипсина (или панкреатина). Перемешивают пробы встряхиванием.
В каждую пробирку помещают по одинаковому кусочку фибрина и ставят их в
термостат при 38˚С на 10 мин, следя за растворением фибрина. Отмечают
изменения, происходящие с фибриновыми волокнами в ходе инкубации.
Оформление работы. Результаты опытов оформить в виде таблицы.
|
№ пробы
|
Препарат фермента
|
Субстрат
|
Условия опыта
|
Изменения фибрина
|
|
|
|
рН среды
|
кипячение
|
|
|
|
|
|
|
|
В выводах указать оптимальные условия для действия изученных
протеолитических ферментов и практическое значение исследований.
Практическое значение работы. Переваривание белка в желудочно-кишечном
тракте зависит не только от количества образующихся протеолитических ферментов,
но и от условий среды, в которых они действуют. При гипохлоргидрии или
анацидном гастрите имеются неблагоприятные условия (недостаток соляной кислоты)
для гидролиза пищевого белка пепсином. Применение щелочных растворов (питьевая
сода) при данных патологических состояниях приводит к разрушению выделяющегося
клетками желудка пепсина. Напротив, гиперхлоргидрия обусловливает более
медленную нейтрализацию кислого желудочного содержимого, поступающего в
кишечник, и как следствие этого менее эффективную активацию проферментов и
переваривающего их действия на белки и пептиды пищи.
Работа 38. Изучение динамики гидролиза
триацилглицеринов под действием панкреатической липазы
Основную часть пищевых липидов составляют триацилглицерины, поэтому в
переваривании жира наиболее важны условия для действия панкреатической липазы
(триацилглицерол-ацилгидролаза; КФ 3.1.1.3). Этот фермент гидролизует только
эмульгированный жир в слабощелочной среде. Активатором фермента служат желчные
кислоты. Липаза гидролизует преимущественно концевые ацилы молекулы
триацилглицерина. Образующийся 2-моноацилглицерин расщепляется
карбоксиэстеразой.
В качестве субстрата для изучения активности липазы используют
приготовленную жировую эмульсию или молоко, в котором липиды находятся в
эмульгированном состоянии.
Реактивы. Коровье молоко; желчь; гидроксид натрия, 0,1 М раствор;
фенолфталеин, 0,5%-ный раствор в 76%-ном этаноле.
Оборудование. Колбы вместимостью 100 мл для титрования; микробюретка;
водяная баня с лабораторным термометром.
Материал. Панкреатин, свежеприготовленный 5%-ный раствор на 1%-ном
растворе гидрокарбоната натрия (рН≈8,0).
Метод основан на титриметрическом определении с помощью гидроксида натрия
жирных кислот, освобождающихся из триацилглицеринов молока в процессе их
гидролиза панкреатической липазой в присутствии и в отсутствие желчи. Реакция
протекает по уравнению

Количество образующихся жирных кислот определяется титрованием раствором
гидроксида натрия с индикатором фенолфталеином.
Ход определения. В три колбы отмеряют цилиндром по 25 мл коровьего молока
и добавляют в первую 2 мл дистиллированной воды, во вторую и третью по 2 мл
раствора панкреатина. Кроме того, в третью колбу добавляют 5 капель желчи (1
мл).
Содержимое колб перемешивают и сразу отбирают по 5 мл в другие колбы для
титрования (определяют исходный уровень свободных жирных кислот).
Колбы с оставшейся смесью помещают в водяную баню при 37˚С и через
каждые 15 мин берут по 5 мл их содержимого, переносят в колбы для титрования
проб.
К отобранным 5 мл инкубационной смеси в колбы прибавляют по 10 мл
дистиллированной воды и по 2 капли раствора фенолфталеина. Оттитровывают их
содержимое 0,1 М раствором гидроксида натрия до слабо-розовой окраски жидкости.
Отмечают объем гидроксида натрия, пошедший на титрование всех проб.
Оформление работы. Результаты оформить графически: по оси ординат
отложить объем раствора гидроксида натрия, пошедший на титрование всех проб, а
по оси абсцисс - время. По полученным на графике трем кривым (1 - без липазы; 2
- с липазой; 3 - липаза и желчь) сделать вывод об относительной скорости
гидролиза триацилглицеринов под действием липазы и роли желчи в этом процессе.
Практическое значение работы. При заболеваниях поджелудочной железы, в
которой образуется липаза, может нарушаться переваривание жиров, и они
выводятся в неизменном виде. Однако чаще всего наблюдается нарушение
переваривания жиров при патологии печени и желчевыводящих путей, когда желчь
либо не вырабатывается, либо не поступает в кишечник в силу препятствий в
желчевыводящих путях. Поскольку желчные кислоты являются активаторами липазы,
эмульгаторами жиров, а также участвуют в процессе всасывания жирных кислот, то
при их отсутствии резко нарушается процесс переваривания липидов с выделением
их в большом количестве с фекалиями (стеаторея). Определение активности липазы
применяется в клинике после взятия кишечного сока с помощью зонда для
установления причины патологии переваривания липидов. В фармации метод
исследования активности липазы необходим для контроля качества лекарственных
препаратов (панкреатин, фестал, панзинорм и др.), содержащих этот фермент.
ЭНЕРГЕТИЧЕСКИЙ ОБМЕН (биоэнергетика)
Существует два основных типа энергетики живых организмов - фототрофный и
хемотрофный. Первым обладают растения и фотосинтезирующие микроорганизмы,
которые преобразуют энергию солнечного света в энергию фосфатных связей АТФ, а
вторым - клетки организмов, в том числе человека и животных, использующие для
образования АТФ энергию окислительно-восстановительных реакций.
Основная часть энергии в тканях человека и животных образуется аэробным
путем в ходе окислительного фосфорилирования в митохондриях. Анаэробное
образование энергии происходит в процессе гликолиза (гликогенолиза). Однако он
играет вспомогательную роль.
Упрощенно аэробное образование энергии можно представить следующей схемой
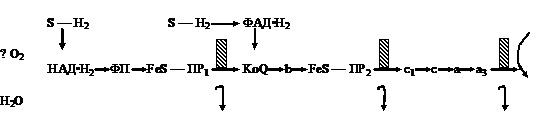
Эффективность
этого процесса зависит от активности дегидрогеназного звена (т.е. от наличия
субстратов окисления S·H2 и активности дегидрогеназ), которое обеспечивает
поступление водорода, связанного с НАД или ФАД, на дыхательную цепь митохондрий,
а также от сопряжения дыхания и фосфорилирования (см. учебник с.204-214).
1. Исследование процессов биологического окисления в
животных тканях
Работа 39. Обнаружение цитохромоксидазы в мышечной ткани
Цитохромоксидаза, или комплекс цитохромов а + а3, является заключительным
компонентом дыхательной цепи митохондрий животных и растительных клеток. Этот
фермент переносит электроны на кислород. Он прочно связан с внутренней
мембраной митохондрий и извлекается только при ее разрушении. Цитохромоксидаза
может окислять ряд синтетических субстратов, например, α-нафтол и N,N΄-диметил-n-фенилендиамин (реактив
НАДИ, названный по первым слогам обоих соединений). Реактив НАДИ используется
для обнаружения этого фермента в тканях.
Реактивы. Реактив «НАДИ»*.
Оборудование. Ступка с пестиком; воронка для фильтрования; фильтровальная
бумага; ножницы; стеклянные палочки; марля или бинт; пипетки вместимостью 1 мл;
мерный цилиндр; водяная баня; аптечные весы с разновесами.
Материал. Мышечная ткань (свежая) забитого животного.
Метод основан на образовании в ходе реакции окисления
диметил-n-фенилендиамина и α-нафтола цитохромоксидазой
индофенолового голубого, интенсивность синей окраски которого пропорциональна
активности фермента.
Ход определения. 5 г мышечной ткани измельчают ножницами и тщательно
растирают в ступке, добавляя порциями 20 мл дистиллированной воды. Мышечную
кашицу фильтруют через двойной слой марли и многократно промывают
дистиллированной водой до бесцветной окраски промывных вод.
Бесцветную массу, которая содержит цитохромоксидазу, комплекс цитохромов
и некоторые дегидрогеназы, отжимают между листами фильтровальной бумаги.
Полученный остаток кашицы делят на три части: одну переносят в пробирку, а две
другие оставляют на фильтровальной бумаге.
К кашице в пробирке приливают 1 мл дистиллированной воды и кипятят
содержимое на водяной бане 1 мин. Пробирку охлаждают, осторожно сливают
жидкость и мышечную кашицу с помощью стеклянной палочки переносят на другой
лист фильтровальной бумаги.
На первую порцию мышечной кашицы (кипяченую) и вторую (некипяченую)
наносят по 2-3 капли реактива НАДИ, третью (тоже некипяченую) - сначала
смачивают раствором азида натрия, а через 3 мин на нее наносят 2-3 капли
реактива НАДИ. Сравнивают характерные окраски проб.
Оформление работы. Результаты оформить в виде таблицы.
|
№ пробы
|
Материал
|
Фермент
|
Субстраты
|
Условия опыта
|
Окраска пробы
|
|
|
|
|
температурная обработка
|
ингибиторы
|
|
|
|
|
|
|
|
|
Практическое значение работы. Цитохромоксидаза как гемсодержащий белок
очень чувствительна к действию цианидов, сульфидов, азидов и прочих веществ,
взаимодействующих с железом гема. При отравлении этими соединениями происходит
угнетение цитохромоксидазы и развивается гистотоксическая гипоксия, т.е.
кислородное голодание тканей, связанное с невозможностью использовать кислород
как акцептор электронов и протонов в дыхательной цепи митохондрий. Метод
выявления цитохромоксидазы реактивом НАДИ используется в клинике и цитологии
для выявления этого фермента в биоптатах и мазках клеток крови с целью
диагностики нарушений тканевого дыхания.
Работа 40. Демонстрация процесса окислительного
фосфорилирования и действия на него разобщителей
Для исследования окислительного фосфорилирования определяют величину
поглощения кислорода в тканях и одновременно убыль добавленного в среду неорганического
фосфата. Это позволяет вычислить коэффициент фосфорилирования - Р/О.
Потребление кислорода тканями при окислении субстратов не является достоверным
показателем интенсивности окислительного фосфорилирования, поскольку кислород
расходуется и в других, немитохондриальных, реакциях. Кроме того, активная
утилизация его еще не означает аналогичного по интенсивности фосфорилирования,
т.е. эти два процесса могут быть в той или иной степени разобщены.
Использование неорганического фосфата в реакции этерификации: Фн+АДФ→АТФ
происходит не только в ходе окислительного фосфорилирования, но и в гликолизе.
При отсутствии в среде субстратов гликолиза или при ингибировании его и при
создании необходимых условий для функции дыхательной цепи митохондрий можно считать,
что почти весь Фн расходуется в ходе окислительного фосфорилирования и его
убыль является индикатором этого процесса.
Реактивы. Хлорид калия, 0,15 М раствор; К-фосфатный буфер (рН 7,4),
приготовленный из KH2PO4 (содержание неорганического фосфора 0.1 моль/л); малат
натрия, 0,16 М раствор; хлорид магния, 0,6 М раствор; фторид натрия, 5,7 М
раствор; АДФ, динатриевая соль, 9,1∙10-2 М раствор; сукцинат натрия, 0,3
М раствор; 2,4-динитрофенол, 0,01 М раствор; азид натрия, 1 М раствор;
трихлоруксусная кислота, 10%-ный раствор; реактив молибдата аммония*;
аскорбиновая кислота, 1%-ный раствор на 0,1 М растворе соляной кислоты.
Оборудование. Штатив с пробирками; гомогенизатор с пестиком из тефлона;
моторчик для гомогенизации; пипетки вместимостью 1 мл; бюретка вместимостью 25
мл; стеклянные палочки; воронка со складчатым бумажным фильтром; водяная баня с
лабораторным термометром или баня аппарата Варбурга; часы; ФЭК.
Материал. Печень белой крысы.
Метод основан на измерении расхода добавленного неорганического фосфата
Фн в ходе реакции окислительного фосфорилирования в митохондриях, содержащихся
в гомогенатах печени.
Использование Фн в гликолизе блокируется содержащимся в среде инкубации
фторидом натрия.
О действии разобщителя (2,4-динитрофенол) и ингибитора (азид натрия)
окислительного фосфорилирования также судят по убыли неорганического фосфата в
присутствии малата как субстрата окисления.
Неорганический фосфат утилизируется по схеме
PO4 + АДФ → АТФ + H2O
Определение содержания Фн до и после инкубации основано на реакции,
приведенной в работе 11.
Ход определения. Животное забивают, извлекают печень и погружают ее в
чашку Петри с раствором хлорида калия, стоящую на льду или на снегу. Тщательно
промывают печень от крови средой выделения и промокают фильтровальной бумагой.
Навеску около 2 г отмытой ткани печени переносят на часовое стекло или в
чашку Петри, стоящую на льду, и мелко измельчают ножницами. Измельченную ткань
помещают в стакан гомогенизатора, куда предварительно налито 18 мл охлажденного
раствора хлорида калия.
Стакан гомогенизатора помещают в лед или снег, находящийся в мешочке.
Ткань гомогенизируют в течение 40-50 с при вращении пестика 800-1200
об/мин, делая 40-50 движений стаканчика вверх-вниз.
В пять пробирок наливают по 1 мл инкубационной смеси следующего состава.
|
Компоненты
|
Состав смеси (в мл) в
пробирках
|
|
1
|
2
|
3
|
4
|
5
|
|
К-фосфатный буфер (рН 7,4)
|
0,3
|
0,3
|
0,3
|
0,3
|
0,3
|
|
Малат натрия
|
0,1
|
-
|
-
|
0,1
|
0,1
|
|
Сукцинат натрия
|
-
|
0,1
|
-
|
-
|
-
|
|
Хлорид магния
|
0,1
|
0,1
|
0,1
|
0,1
|
0,1
|
|
Фторид натрия
|
0,1
|
0,1
|
0,1
|
0,1
|
0,1
|
|
АДФ∙Na2
|
0,1
|
0,1
|
0,1
|
0,1
|
0,1
|
|
Дистиллированная вода
|
0,3
|
0,4
|
0,2
|
0,2
|
|
2,4-Динитрофенол
|
-
|
-
|
-
|
0,1
|
-
|
|
Азид натрия
|
-
|
-
|
-
|
-
|
0,1
|
Вносят во все пробы по 2 мл полученного гомогената печени, перемешивают
стеклянной палочкой и помещают в штатив водяной бани при 37˚С, снабженной
устройством для встряхивания пробирок. Отмечают время начала инкубации.
Через 30 мин инкубации реакции во всех пробах останавливают, добавляя к
каждой по 1 мл раствора трихлоруксусной кислоты. Содержимое их перемешивают и
фильтруют в другие пробирки через складчатый бумажный фильтр.
Из каждой пробы отбирают по 1 мл безбелкового фильтрата в чистые пробирки
и приливают к ним по 1 мл реактива молибдата аммония и по 1 мл раствора
аскорбиновой кислоты. Перемешивают содержимое стеклянной палочкой, затем из
бюретки добавляют по 7 мл дистиллированной воды и вновь перемешивают. Оставляют
стоять 5 мин для развития окрашивания.
Перед фотометрией готовят стандартную пробу, для чего в пробирку вносят
0,1 мл фосфатного буфера, 0,9 мл трихлоруксусной кислоты, 1 мл реактива
молибдата аммония и 1 мл раствора аскорбиновой кислоты. Содержимое
перемешивают, затем добавляют из бюретки 7 мл дистиллированной воды и опять
перемешивают. Оставляют стоять 5 мин для развития окрашивания.
Фотометрируют опытную и стандартную пробы против контрольной (1 мл
трихлоруксусной кислоты и 9 мл дистиллированной воды) на ФЭКе при 630-690 нм
(красный светофильтр) в кювете с толщиной слоя 0,5 см.
Расчет. Содержание неорганического фосфора х (в мкмоль) в пробах
рассчитывают по формуле
Еоп∙10
х = -----
Ест
где Еоп - экстинкция опытной пробы;
Ест - экстинкция стандартной пробы;
- количество неорганического фосфора в стандартной пробе, мкмоль.
Убыль Фн рассчитывают по разнице между количеством его в стандартной и
соответствующей опытной пробах.
Оформление работы. Полученные данные внести в таблицу.
|
№ пробы
|
Субстрат окисления
|
Разобщители и ингибиторы
|
Содержание Фн в пробе,
мкмоль
|
Убыль Фн, мкмоль
|
В выводе указать возможность протекания окислительного фосфорилирования без
субстрата окисления и особенность действия на него разобщителей и ингибиторов;
отметить практическое значение обнаруженных феноменов.
Практическое значение работы. Клетки и ткани организма человека
отличаются друг от друга скоростью дыхания и связанного с ним
фосфорилированием. Наиболее активное окислительное фосфорилирование отмечается
в тканях, богатых митохондриями, например, в почках, сетчатке глаза, корковом
веществе головного мозга, сердце, печени; менее развит этот процесс в скелетных
мышцах, коже, а в эритроцитах человека он вообще отсутствует. В
клинико-биохимических исследованиях используются методы определения
окислительного фосфорилирования в лейкоцитах крови и биоптатах для оценки
энергетического обмена при различных патологических состояниях, а также для
изучения действия лекарств и ядов, которые могут проявлять свойства
разобщителей или ингибиторов.
Работа 41. Выявление гликолиза в мышечной ткани
Для оценки вклада гликолиза в энергетику клеток измеряют скорость этого
процесса при оптимальных условиях. С этой целью добавляют в среду, содержащую
исследуемый материал (клетки, срезы или кусочки тканей, гомогенат ткани), один
из субстратов гликолиза (гликогенолиза), чаще всего глюкозу, гликоген,
фруктозобисфосфат и др., необходимые кофакторы и создают анаэробные условия.
Обязательным компонентом при изучении скорости гликолиза является
неорганический фосфат, который расходуется в этом процессе на образование АТФ
из АДФ. Индикаторами гликолиза служат скорость убыли глюкозы или накопления
молочной кислоты, а также потребление Фн при анаэробном распаде углеводов в
тканях.
Реактивы. Фосфатный буфер, 0,1 М раствор с рН 8,0*; глюкоза, 10 г/л
раствор, свежеприготовленный; трихлоруксусная кислота, 100 г/л раствор; сульфат
меди (II), 100 г/л раствор; серная кислота, конц.; гваякол, 1,0 г/л раствор в
70%-ном этаноле; о-толуидиновый реактив*; фторид натрия, 3 М раствор;
вазелиновое масло; оксид кальция, порошок, навески по 0,25 г в бумажных
пакетиках.
Оборудование. Водяная баня с лабораторным термометром; штатив с
пробирками; пипетки вместимостью 1 и 2 мл; глазные пипетки; воронки со
складчатыми бумажными фильтрами; стеклянные палочки; аптечные весы с
разновесами.
Материал. Мышечная ткань (свежая) забитого животного.
Метод основан на выявлении убыли глюкозы и накопления молочной кислоты в
среде под действием ферментов гликолиза мышечной ткани в присутствии и в
отсутствие фторида натрия, являющегося ингибитором гликолиза. Глюкоза
обнаруживается по реакции с о-толуидином, в результате чего образуется
окрашенное соединение зеленого цвета при нагревании в среде с уксусной
кислотой. Молочная кислота при нагревании с концентрированной серной кислотой
превращается в ацетальдегид, дающий с гваяколом характерное красное
окрашивание.
Ход определения. В три пробирки отмеривают по 2 мл фосфатного буфера и по
1 мл раствора глюкозы. Затем в первую пробу добавляют 1 мл раствора
трихлоруксусной кислоты, а во вторую - 0,2 мл раствора фторида натрия.
Мышечную ткань мелко измельчают ножницами и вносят во все пробирки по 1 г
мышечной кашицы, содержимое тщательно перемешивают стеклянной палочкой и
приливают 10 капель вазелинового масла (для защиты от кислорода воздуха).
Пробирки выдерживают на водяной бане при 37˚С в течение 30 мин. После
инкубации во вторую и третью пробы добавляют по 1 мл раствора трихлоруксусной
кислоты и перемешивают.
Содержимое всех пробирок фильтруют через бумажный фильтр в чистые
пробирки. С фильтратом проделывают реакции на глюкозу и молочную кислоту.
Для проведения реакции на глюкозу берут по 0,1 мл фильтрата, переносят
его в чистые пробирки и добавляют в них по 0,4 мл воды и по 2,0 мл
о-толуидинового реактива. Помещают пробирки в водяную кипящую баню на 8 мин,
после чего охлаждают под струей холодной воды. Сравнивают интенсивность окраски
исследуемых проб.
Для проведения реакции на молочную кислоту к оставшемуся фильтрату в
обеих пробах добавляют по 5 капель раствора сульфата меди и по 0,25 г оксида
кальция (для осаждения углеводов, которые мешают обнаружению молочной кислоты).
Пробы оставляют стоять 10 мин при комнатной температуре, периодически
встряхивая их. Затем содержимое пробирок фильтруют через бумажный фильтр в две
чистые пробирки, помещенные в лед или снег. Отбирают по 10 капель фильтрата и
осторожно добавляют в каждую из них по 30 капель концентрированной серной
кислоты. Все пробирки помещают на 5 мин в кипящую водяную баню (для превращения
молочной кислоты в ацетальдегид). Затем пробирки охлаждают и добавляют по 2
капли спиртового раствора гваякола. Через 20 мин сравнивают интенсивность
окрашивания в пробах.
Оформление работы. Результаты оформить в виде таблицы.
|
Исследуемая проба
|
Субстрат
|
Ингибитор
|
Реакция на глюкозу
|
Реакция на молочную кислоту
|
Сделать вывод о наличии гликолиза в мышечной ткани и о методических
подходах к его изучению.
Практическое значение работы. При анаэробном распаде углеводов образуется
две молекулы АТФ на одну молекулу расщепленной глюкозы, что является важным
дополнительным источником образования энергии. В эритроцитах гликолиз является
единственным способом производства энергии. В анаэробных условиях, когда
организм испытывает недостаток кислорода, этот путь образования энергии
является основным для сохранения жизнедеятельности тканей. В эксперименте и
клинике определение скорости гликолиза в клетках крови и биоптатах широко используется
для оценки образования энергии анаэробным путем. Кроме того, этот метод
позволяет изучить механизм действия различных лекарственных препаратов и ядов,
которые могут оказывать отрицательное действие, блокируя одну из стадий
ферментативного процесса.
Работа 42. Анализ адениннуклеотидов методом
ионообменной тонкослойной хроматографии
Реактивы. Стеклянные пластинки (9х12 см) с нанесенным тонким слоем
диэтиламиноэтилцеллюлозы (ДЭАЭ-целлюлоза), являющейся анионообменной смолой;
соляная кислота, 0,02 М раствор.
Оборудование. Химический стакан; глазная пипетка; лист белой бумаги;
вентилятор; хроматоскоп.
Материал. Аденозинтрифосфат натрия, 1%-ный раствор для инъекций.
Метод основан на эффекте ионного обмена, состоящего в том, что
адениннуклеотиды, имеющие отрицательный заряд, взаимодействуют с положительными
группами ДЭАЭ-целлюлозы (неподвижная фаза), а при прохождении по адсорбенту
раствора соляной кислоты нуклеотиды замещаются на анионы Clˉ. При этом
легче всего вытесняется АМФ, из-за чего он продвигается дальше всех, затем АДФ
и АТФ, который остается рядом с линией старта. Просматривают хроматограмму в
ультрафиолетовом свете, в котором нуклеотиды, вследствие поглощения при 260 нм,
выглядят в виде темных пятен.
Ход определения. Стеклянную пластину с ДЭАЭ-целлюлозой кладут адсорбентом
вверх на лист белой бумаги и, отступив от края пластинки на 2 см, проводят
простым карандашом линию старта, а в центре очерчивают кружок диаметром 3-4 мм
для нанесения исследуемой пробы. Наносят глазной пипеткой каплю раствора натрия
аденозинтрифосфата в центр кружка и подсушивают пятно на воздухе в течение 5
мин с помощью вентилятора.
В химический стакан, который используют как хроматографическую камеру,
наливают раствор соляной кислоты так, чтобы слой жидкости был высотой примерно
1 см. Опускают конец пластинки с нанесенной пробой в раствор соляной кислоты.
Для герметичности стакан закрывают лоскутом резиновой перчатки, натянув его и
закрепив с помощью резинового колечка.
После того как фронт растворителя достигает верхнего края пластинки, ее
вынимают из стакана и подсушивают на воздухе с помощью вентилятора.
Хроматограмму помещают в хроматоскоп и в ультрафиолетовом свете очерчивают
простым карандашом темные пятна разделившихся адениннуклеотидов.
Оформление работы. Зарисовать положение пятен адениннуклеотидов на
хроматограмме и сделать вывод о качестве исследуемого препарата АТФ для
инъекций.
Практическое значение работы. Разделение нуклеотидов методом тонкослойной
ионообменной хроматографии используется для изучения состава нуклеотидов и
определения их содержания в тканях, а также для расчета энергетического заряда
адениловой системы в норме и при различных патологических состояниях. В
фармации этот метод используется для контроля качества препаратов, содержащих
адениннуклеотиды.
Работа 43. Определение активности
креатинфосфокиназы в сыворотке крови по Эннору и Розенбергу
Реактивы. Креатинфосфат, 0,006 М раствор; аденозиндифосфат динатриевая
соль, 6,0 г/л раствор; трис-буфер, 0,1 М раствор с рН 7,2, содержащий 0,1
моль/л хлорида магния; сульфат цинка, 50 г/л раствор; гидроксид бария, 50 г/л
раствор; щелочной реактив, содержащий 160 г/л карбоната натрия и 60 г/л
гидроксида натрия; диацетил, рабочий раствор; α-нафтол, 10 г/л раствор; креатин,
стандартный раствор концентрации 0,1 ммоль/л.
Примечание. Все перечисленные реактивы, кроме трис-буфера, готовят перед
употреблением.
Оборудование. Штатив с пробирками; стеклянные палочки; пипетки
вместимостью 1 мл; водяная баня с лабораторным термометром; центрифуга
лабораторная с центрифужными весами.
Материал. Сыворотка крови.
Метод основан на определении креатина, образующегося из креатинфосфата
под действием креатинфосфокиназы, об активности которой судят по количеству
выявляемого креатина.
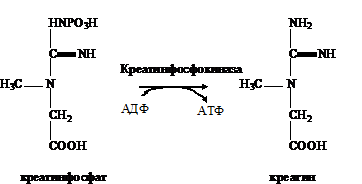
Креатин образует с диацетилом и α-нафтолом комплексное соединение,
интенсивность розовато-желтой окраски которого пропорциональна концентрации
креатина.
Ход определения. В две пробирки последовательно вносят следующие реактивы
(объемы растворов указаны в миллилитрах):
|
Реактив
|
Опытная пробирка
|
Контрольная пробирка
|
|
Трис-буфер
|
0,2
|
0,2
|
|
Дистиллированная вода
|
0,2
|
0,3
|
|
Креатинфосфат
|
0,1
|
0,1
|
|
Сыворотка крови
|
0,1
|
-
|
Обе пробирки помещают на 3 мин в водяную баню при 37˚С, не вынимая
из бани, прибавляют в них по 0,2 мл раствора АДФ (запускают креатинкиназную
реакцию). Отмечают время начала инкубации.
Через 30 мин реакцию останавливают, последовательно добавляя в обе пробы
по 0,2 мл гидроксида бария и сульфата цинка. Содержимое пробирок охлаждают и
оставляют стоять 10 мин (для осаждения белка). Затем осадок отделяют
центрифугированием при 3000 об/мин в течение 5-10 мин.
Отбирают по 0,5 мл надосадочной жидкости в две чистые пробирки и
приливают в них по 3 мл дистиллированной воды, по 1 мл раствора α-нафтола и по 0,5 мл рабочего раствора
диацетила. Пробы тщательно перемешивают стеклянной палочкой и помещают на 20
мин в темное место для развития окрашивания.
Перед фотометрией готовят стандартную пробу и контроль стандарта. Для
этого в одну пробирку (стандартная проба) вносят 0,5 мл раствора креатина, 3 мл
дистиллированной воды, 1 мл α-нафтола и 0,5 мл рабочего раствора
диацетила, а в другую (контроль стандарта) - те же реактивы, только вместо
раствора креатина добавляют 0,5 мл дистиллированной воды. Обе пробирки
выдерживают в темноте 20 мин.
Измеряют экстинкцию опытной пробы против контрольной и стандартной против
контроля стандарта на ФЭКе при 520-540 нм (светофильтр зеленый) в кювете с
толщиной слоя 1,0 см.
Расчет. Активность креатинфосфокиназы рассчитывают по формуле
0,00005Еоп1,2∙2∙10000
х = ------------ ,
Ест0,5
где х - активность креатинфосфокиназы, ммоль/(ч∙л);
,00005 - содержание креатина в стандартной пробе, ммоль;
Еоп - экстинкция опытной пробы против контроля;
Ест - экстинкция стандартной пробы против контроля стандарта;
- коэффициент пересчета на час инкубации;
,2 - объем проб до центрифугирования;
,5 - объем надосадочной жидкости, взятой на исследование;
- коэффициент пересчета на литр сыворотки крови.
После сокращения формула приобретает следующий вид:
2,4Еоп
х = ----
Ест
Оформление работы. Рассчитать активность креатинфосфокиназы в сыворотке
крови и по полученным данным сделать вывод о возможных изменениях активности
фермента и причинах этих отклонений.
Практическое значение работы. Больше всего креатинфосфокиназы в мышечной
(скелетная мышца и сердце) и нервной тканях, в которых она участвует в переносе
энергии. В остальных тканях и органах ее активность в 100-1000 раз ниже.
Поэтому при повреждении мышечной и нервной тканей или при заболеваниях,
вызывающих повышение их проницаемости, имеет место «утечка» фермента из тканей
и повышение его количества в крови. В норме активность креатинфосфокиназы в
сыворотке крови составляет 0,30-0,70 ммоль/(ч∙л). В клинической практике определение
активности этого фермента используется при диагностике инфаркта миокарда
(причем повышение активности его наблюдается через 3 ч после начала
некротического процесса и достигает максимума через 24 ч), а также при
дистрофии скелетных мышц, поражении нервной ткани.
2. Анализ пигментов и окислительных процессов
фотосинтезирующих организмов
В клетках фотосинтезирующих организмов имеется система пигментов
(хлорофиллы, фикобилины, каротиноиды) избирательно улавливающие кванты света в
видимой области спектра, которые затем трансформируются в энергию фосфатных
связей АТФ. В темновой период суток эти организмы преобразуют энергию
окислительно-восстановительных реакций в энергию АТФ как хемотрофы.
В митохондриях животных и растительных клеток функционируют сходные
ферменты биологического окисления и системы трансформации энергии в дыхательной
цепи. Исследование этих процессов проводится аналогичными методами, что и в
гетеротрофных организмах. В то же время в растениях отмечается высокая
активность ряда оксидаз (пероксидаза, полифенолоксидаза и др.), принимающих
участие в окислении вторичных продуктов обмена.
Работа 44. Качественные реакции на пигменты растений
Реактивы. Этанол, 96%-ный; бензин; гидроксид бария, насыщенный раствор;
аскорбиновая кислота, кристаллическая; соляная кислота, 10%-ный раствор.
Оборудование. Водяная баня с лабораторным термометром; штатив с
пробирками; капельницы; пипетки вместимостью 5 мл; аптечные весы с
разновесками; ступка с пестиком.
Материал. Листья крапивы, сушеные.
а. Экстрагирование пигментов из листьев крапивы. Метод основан на
способности хлорофилла и других пигментов под действием горячего спирта
переходить в раствор, при этом хлорофилл при взаимодействии со спиртом
превращается в этилхлорофиллид - сложный эфир, в котором остаток фитола замещен
остатком этилового спирта.
Ход определения. 0,5 г сушеной крапивы растирают в ступке с 5,0 мл
этилового спирта, переносят в пробирку и нагревают на водяной бане при 90-100˚С
до закипания спирта. Содержимое фильтруют через бумажный фильтр в другую
пробирку. Фильтрат, содержащий хлорофиллид, ксантофилл и другие пигменты, имеет
зеленый цвет с интенсивной красной флюоресценцией. Его используют для
исследования.
б. Разделение пигментов по Краусу. Метод основан на различной способности
пигментов растворяться в бензине: хлорофилл, хлорофиллид растворимы, а
ксантофилл нерастворим в нем.
Ход определения. К 10 каплям полученного фильтрата прибавляют равный
объем бензина, содержимое тщательно встряхивают, постукивая пальцем по дну
пробирки. Наблюдают за окраской пигментов, содержащихся в разных растворителях.
в. Осаждение хлорофилла. Метод основан на способности эфирных групп при
омылении раствором гидроксида бария образовывать бариевые соли хлорофиллидов А
и В, нерастворимых в воде; жидкость над осадком имеет желтую окраску вследствие
присутствия в вытяжке каротина и ксантофилла.
Ход определения. К 10 каплям фильтрата добавляют 20 капель раствора
гидроксида бария и тщательно взбалтывают. Наблюдают за происходящими
изменениями.
г. Восстановление хлорофилла аскорбиновой кислотой. Метод основан на
способности аскорбиновой кислоты восстанавливать хлорофилл, приобретающий
вследствие этого желтое окрашивание.
Ход определения. К 10 каплям фильтрата добавляют 2 капли воды, несколько
кристалликов аскорбиновой кислоты и в течение 3-5 мин нагревают в водяной бане
при 70-80˚С. Наблюдают за изменением окраски.
д. Получение феофитина из хлорофилла. Метод основан на способности
соляной кислоты связывать ион магния, входящий в состав хлорофилла, с
образованием феофитина, имеющего оливково-бурый цвет.
Ход определения. К 5 каплям фильтрата прибавляют 1 каплю раствора соляной
кислоты. Наблюдают за изменением окраски.
Оформление работы. Дать оценку качественным реакциям на пигменты
растений. В выводах обосновать значение хлорофилла и других пигментов для
фотосинтетических процессов.
Практическое значение работы. Методы разделения и анализа пигментов
фотосинтетического аппарата растений используются для изучения
физико-химических свойств, фотохимической активности и характеристики их
состава на разных стадиях онтогенеза растений и влияния на него факторов
внешней среды.
Работа 45. Определение активности пероксидазы в
растительном материале по методу А.Н. Бояркина
Реактивы. Ацетатный буфер, 0,1 М раствор с рН 5,4*; пероксид водорода,
0,03%-ный раствор; бензидин, 0,92 г/л раствор на ацетатном буфере*.
Оборудование. Колбы вместимостью 25 мл; пипетки вместимостью 5 мл;
центрифуга лабораторная с центрифужными весами; ФЭК.
Материал. Листья растений, свежие.
Метод основан на непрерывном измерении светопоглощения бензидиновой сини,
образующейся при окислении бензидина под действием пероксидазы.
Реакция описывается уравнением.
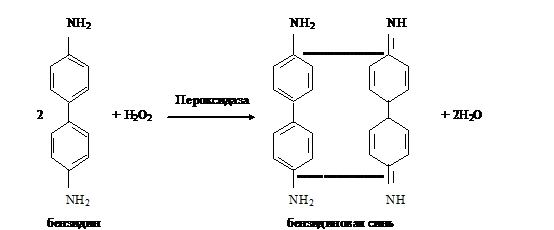
Ход
определения. Навеску 100 мг растительного материала помещают в ступку и
растирают, прибавляя порциями 10 мл дистиллированной воды. Растертую массу
переносят в мерную колбу вместимостью 25 мл и доводят водой до метки.
Содержимое колбы настаивают 10 мин, затем сливают в центрифужные пробирки и
центрифугируют 10 мин при 3000 об/мин.
Для определения активности фермента берут кювету с толщиной слоя 2 см и
наливают в нее по 2 мл водной вытяжки из листьев, ацетатного буфера и раствора
бензидина. Ставят кювету в кюветодержатель и устанавливают стрелку прибора на
нулевую отметку, затем добавляют 2 мл раствора пероксида водорода пипеткой с
широким носиком (чтобы сильная струя перемешала жидкость в кювете) и
одновременно с добавлением пероксида включают секундомер. Раствор в кювете
начинает синеть и по мере нарастания интенсивности окраски стрелка прибора
отклоняется. Отмечают время от начала приливания раствора пероксида водорода до
достижения стрелкой гальванометра отметки 0,250. Повторяют определение трижды и
берут среднее значение времени.
Расчет. Активность фермента рассчитывают по формуле
∆Е 25∙1000
х = --------
t∙d 0,1∙2
где х - активность пероксидазы, Е∙с-1∙кг-1 (Е - единица
экстинкции);
∆Е - изменение
экстинкции, равное 0,250;- время реакции, с;- толщина слоя кюветы, равная 2;
- коэффициент пересчета
граммов в килограммы;
,1 - навеска, г;
- объем пробы, мл.
После сокращений формула
принимает вид
15625
х = -----
t
Оформление работы. Рассчитать
и сравнить активность пероксидазы в исследуемом материале; в выводе отметить
биологическое значение фермента.
Практическое значение работы.
Пероксидаза выполняет две функции: собственно пероксидазную, т.е. окисляет
вещества с участием пероксида водорода, и оксидазную, т.е. катализирует
окисление субстратов за счет молекулярного кислорода без участия пероксида
водорода. Этот фермент проявляет перокисдазную активность в отношении
практически всех фенолов (пирокатехин, пирогаллол, галловая кислота, гваякол и
др.), ароматических аминов (бензидин, n-фенилендиамин и др.), аскорбиновой
кислоты, нитритов и т.д.
В то же время пероксидаза,
обладая оксидазной функцией, способна участвовать в окислении флороглюцина, НАД∙Н2,
НАДФ∙Н2, индолилуксусной кислоты, оксалата, фенилпирувата и т.д.
В практике широко используют
определение активности пероксидазы для оценки метаболизма ростовых веществ,
лигнина и других вторичных продуктов обмена при физиологических и
патологических процессах. Пероксидаза, выделенная из хрена, широко используется
как аналитический реагент при проведении клинико-биохимических исследований.
Поэтому метод измерения активности фермента необходим для контроля качества
продажного препарата фермента.
ОБМЕН
УГЛЕВОДОВ
Методы исследования обмена углеводов необходимы для диагностики сахарного
диабета и других эндокринных заболеваний, энзимопатий, функции печени, почек и
т.д. Одним из информативных показателей состояния углеводного обмена является
уровень глюкозы в крови, исследование которого чаще всего проводится в клинике.
Реже прибегают к изучению содержания других сахаров и гликогена, а также к
определению концентрации молочной и пировиноградной кислот. При наследственных
нарушениях метаболизма углеводов известную диагностическую ценность
представляет определение активности участвующих в нем ферментов.
Работа 46. Определение содержания глюкозы в
крови о-толуидиновым методом
Реактивы. Трихлоруксусная кислота, 30 г/л раствор; о-толуидиновый
реактив*; глюкоза, основной стандартный 27,8 мМ раствор, свежеприготовленный.
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1, 1 и 5 мл;
водяная баня; центрифуга с центрифужными весами; ФЭК.
Материал. Кровь, взятая из пальца.
Метод основан на способности глюкозы при нагревании с о-толуидином в
растворе уксусной кислоты давать зеленое окрашивание, интенсивность которого
пропорциональна концентрации глюкозы.
Ход определения. В центрифужную пробирку отмеряют 0,9 мл раствора
трихлоруксусной кислоты. Из пальца обследуемого берут микропипеткой 0,1 мл
крови и выдувают в пробирку с трихлоруксусной кислотой. Смесь в пробирке
перемешивают встряхиванием и центрифугируют 10 мин при 3000 об/мин.
Отбирают 0,5 мл центрифугута в другую пробирку и добавляют в нее 2 мл
о-толуидинового реактива. Пробирку помещают в кипящую водяную баню на 8 мин,
после чего охлаждают под струей холодной воды.
Для постановки стандартной пробы вместо крови берут 0,1 мл разведенного в
5 раз стандартного раствора глюкозы, добавляют 0,9 мл раствора трихлоруксусной
кислоты и с 0,5 мл полученной смеси проводят реакцию с о-толуидиновым
реактивом.
Фотометрируют опытную и стандартные пробы на ФЭКе при 590-650 нм (красный
светофильтр) в кювете с толщиной слоя 0,5 см в сравнении с дистиллированной
водой.
Расчет. Содержание глюкозы в крови х (моль/л) рассчитывают по формуле
Еоп Сст
х = ----- ,
Ест
где Еоп - экстинкция опыта,
Ест - экстинкция стандарта;
Сст - концентрация глюкозы в стандартной пробе, равная 5,55 ммоль/л.
Оформление работы. Рассчитать концентрацию глюкозы в крови обследуемого и
сделать вывод о причинах возможных изменений ее уровня.
Практическое значение работы. Методы, применяемые для определения
глюкозы, не всегда дают истинное содержание ее в крови, поэтому существуют
понятия - «истинная» глюкоза и сахар крови. Последний показатель включает всю
сумму восстанавливающих углеводов и некоторые редуцирующие вещества
неуглеводной природы (глутатион, креатин, мочевая кислота). Поэтому содержание
сахара в крови выше, чем показатель истинной глюкозы.
Среди методов, позволяющих определить концентрацию истинной глюкозы в
биологическом материале, следует отметить о-толуидиновый и глюкозооксидазный.
В норме содержание сахара в крови составляет 0,8-1,2 г/л, а глюкозы -
2,8-4,0 ммоль/л. Увеличение уровня сахара в крови (гипергликемия) наблюдается
при сахарном диабете, при избытке в организме глюкокортикоидов - гормонов коры
надпочечников, при стрессовых состояниях, при употреблении с пищей большого
количества углеводов и т.д. Низкое содержание сахара в крови (гипогликемия)
имеет место при голодании, нарушении всасывания глюкозы в тонком кишечнике
(малосорбция), при избытке инсулина в организме (гиперинсулинизм) и т.д.
Работа 47. Количественное определение содержания
глюкозы в крови глюкозооксидазным методом
Реактивы. 5%-ный раствор трихлоруксусной кислоты; натрий фосфат
двузамещенный, 0,25 моль/л*; раствор глюкозооксидазы*; фенолфталин 0,5%;
рабочий реактив*.
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1,0; 2,0 мл;
центрифуга с центрифужными весами; ФЭК.
Материал. Кровь, взятая из пальца.
Метод основан на способности глюкозооксидазы при определенном оптимуме рН
действия катализировать распад глюкозы с образованием перекиси водорода.
Образующаяся перекись водорода в присутствии ионов меди окисляет фенолфталин до
фенолфталеина, который в нейтральной области бесцветен, а в щелочной области
окрашен в красный цвет.
Ход определения. 0,03 мл крови выливают в 1,5 мл 5% раствора
трихлоруксусной кислоты, перемешивают и центрифугируют. К 1 мл надосадочной
жидкости добавляют 2 мл 0,25 моль/л фосфата натрия и 2 капли (приблизительно
0,1 мл) раствора глюкозооксидазы. Перемешивают и оставляют стоять при комнатной
температуре на 1 час, затем добавляют 2 мл рабочего реактива и через 30 мин
фотометрируют в кювете на 10 мм при длине волны 530 нм (зеленый светофильтр).
Одновременно ставят контрольную пробу, в которую берут 1 мл 5% раствора
трихлоруксусной кислоты и далее проводят как и опытную пробу.
Расчет. Расчет проводят по калибровочному графику.
Оформление работы. По экстинкции рассчитывают содержание глюкозы в крови,
сравнивают ее содержание с нормой и делают вывод о возможных отклонениях.
Практическое значение работы. (См. определение содержания глюкозы в крови
орто-толуидиновым методом).
Работа 48. Определение содержания молочной
кислоты в крови по Баркеру и Саммерсону
Реактивы. Трихлоруксусная кислота, 20%-ный раствор; сульфат меди (II),
20%-ный и 4%-ный растворы; оксид кальция, порошок, навеска 0,5 г; серная
кислота, конц.; n-гидроксидифенил, свежеприготовленный щелочной раствор (50 мг
n-гидроксидифенила растворяют в 3 мл 3%-ного раствора гидроксида натрия).
Оборудование. Водяная баня с лабораторным термометром; штатив с
пробирками; пипетки на 0,1 и 1 мл; стеклянные палочки; центрифуга с
центрифужными весами; ФЭК.
Материал. Кровь, взятая из пальца.
Метод основан на способности молочной кислоты при нагревании с
концентрированной серной кислотой переходить в ацетальдегид, дающий с
n-гидроксидифенилом характерную фиолетовую окраску, интенсивность которой
пропорциональна концентрации молочной кислоты:
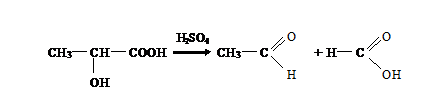

Ход
определения. В центрифужную пробирку отмеривают 0,5 мл дистиллированной воды и
вносят в нее 0,1 мл крови, взятой микропипеткой из пальца обследуемого.
Микропипетку промывают той же водой.
К
содержимому пробирки добавляют 1 мл раствора уксусной кислоты и помещают ее на
10 мин в лед (для лучшего осаждения белков), после чего центрифугируют 5 мин
при 3000 об/мин.
Надосадочную жидкость сливают в чистую центрифужную пробирку, добавляют
0,5 мл 20%-ного раствора сульфата меди и 0,5 г порошка оксида кальция и
тщательно перемешивают стеклянной палочкой. Появляется голубое окрашивание
(если окрашивание зеленоватое, то проба дальнейшей обработке не подвергается).
Смесь оставляют стоять на 30 мин, периодически помешивая стеклянной палочкой.
Затем ее центрифугируют 5 мин при 100 об/мин.
Надосадочную жидкость сливают в чистую пробирку, приливают 1 каплю
4%-ного сульфата меди и осторожно наслаивают 3 мл концентрированной серной
кислоты, погрузив при этом пробирку в лед и непрерывно помешивая содержимое
стеклянной палочкой. После этого пробирку помещают в кипящую водяную баню на 5
мин и затем охлаждают ее в водяной бане до 20˚С.
К охлажденной смеси приливают 1 каплю (0,05 мл щелочного раствора
n-гидроксидифенила и ставят пробирку в водяную баню при 30˚С на 30 мин,
время от времени взбалтывая содержимое. В пробирке за это время развивается
голубое окрашивание. Пробирку помещают на 90 с (точно!) в бурно кипящую водяную
баню. За это время голубая окраска переходит в фиолетовую. Затем смесь
охлаждают и фотометрируют на ФЭКе при 540 нм (светофильтр зеленый) в кювете с
толщиной слоя 1,0 см против воды.
Расчет. Содержание молочной кислоты х (ммоль/л) рассчитывают по формуле
с1000
х = ----- ,
0,1∙1000
где с - количество молочной кислоты в пробе, найденное по калибровочному
графику, ммоль;
,1 - объем крови, взятый на исследование, мл;
в числителе - коэффициент пересчета на 1 л крови;
в знаменателе - коэффициент перевода микромолей в миллимоли.
Оформление работы. Рассчитать содержание молочной кислоты в крови
обследуемого. В выводе указать на возможные сдвиги концентрации молочной
кислоты и их причины.
Практическое значение работы. В норме содержание молочной кислоты в крови
составляет 0,50-2,0 ммоль/л. Увеличение ее содержания может наблюдаться при
усиленной мышечной работе, при заболеваниях, сопровождающихся развитием
гипоксии (недостаточность сердечной деятельности, хронические бронхиты, анемия
и т.д.).
Работа 49. Определение содержания
пировиноградной кислоты в крови по Фридеману и Хаугену
Реактивы. Трихлоруксусная кислота, 5%-ный раствор;
2,4-динитрофенилгидразин (2,4-ДНФГ), 0,1%-ный раствор в 2 М растворе соляной
кислоты; толуол; карбонат натрия, 10%-ный раствор; гидроксид натрия, 1,5 М
раствор.
Оборудование. Пенициллиновые флакончики с полиэтиленовыми пробками;
штатив с пробирками; пипетки вместимостью 1 и 5 мл; бюретка вместимостью 25 мл;
пипетка с резиновой грушей; центрифуга с центрифужными весами; ФЭК.
Материал. Кровь.
Принцип метода см. работу 31.
Ход определения. В центрифужную пробирку вносят 1 мл крови, приливают 4
мл раствора трихлоруксусной кислоты, перемешивают встряхиванием и
центрифугируют 10 мин при 3000 об/мин.
В пенициллиновый флакон отбирают 1 мл центрифугата, прибавляют 2 мл воды
и 1 мл раствора 2,4-ДНФГ, перемешивают встряхиванием, закрывают пробкой и
ставят в темное место на 20 мин.
К содержимому флакона добавляют 5 мл толуола, закрывают флакон пробкой и
встряхивают 3 мин. После расслоения фаз отсасывают пипеткой с резиновой грушей
нижний слой и отбрасывают его.
К оставшемуся во флаконе слою толуола приливают 4 мл раствора карбоната
натрия, закрывают флакон пробкой и встряхивают 3 мин. После расслоения
жидкостей отбирают из нижнего слоя 3 мл в пробирку и добавляют в нее 3 мл
раствора гидроксида натрия (появляется красно-бурое окрашивание).
Через 5 мин фотометрируют пробу на ФЭКе при 415 нм (светофильтр синий) в
кювете с толщиной слоя 1 см против воды.
Расчет. Содержание пировиноградной кислоты х (ммоль/л) рассчитывают по
формуле
с 1000∙3
х = ------ ,
4∙1000
где с - количество пировиноградной кислоты в пробе, найденное по
калибровочному графику, мкмоль;
в числителе - коэффициент пересчета на литр крови;
в знаменателе - коэффициент пересчета мкмоль в ммоль;
- объем добавленного раствора карбоната натрия, мл;
- объем раствора карбоната натрия, отобранного для проведения реакции,
мл.
Оформление работы. По полученному значению экстинкции рассчитать
содержание пировиноградной кислоты в крови и сделать вывод о причине возможных
его изменений.
Практическое значение работы. В норме содержание пирувата в крови
составляет 0,1-0,13 ммоль/л. Его уровень повышается при недостатке в организме
тиамина (витамина В1), а также в результате действия ингибиторов
пируватоксидантного комплекса (арсенат, люизит и др.).
ОБМЕН ЛИПИДОВ
Для изучения состояния липидного обмена в организме используется
определение содержания липидных компонентов в биологических жидкостях. Разные
липиды входят в состав сложноорганизованных комплексов - липопротеидов - или
адсорбируются белками, в основном альбуминами, плазмы или сыворотки крови. В
крови содержатся хиломикроны, образующиеся в слизистой тонкого кишечника и
поступающие в нее с лимфой, пре-β-липопротеиды (липопротеиды очень
низкой плотности), β-липопротеиды (липопротеиды низкой плотности) и α-липопротеиды (липопротеиды высокой
плотности). Апопротеиды трех последних классов липопротеидов синтезируются в
печени, поэтому по содержанию липопротеидов в крови судят не только о липидном
обмене, но и функции печени.
При исследовании обмена липидов в клинике определяют содержание
липопротеидов, общих липидов, включающих сумму всех липидных веществ сыворотки
или плазмы крови, а также отдельные их фракции - триацилглицерины,
неэтерифицированные жирные кислоты, свободный и этерифицированный холестерин,
фосфолипиды.
Работа 50. Определение содержания суммарных
липидов в сыворотке крови по реакции с сульфофосфованилиновым реактивом
Реактивы. Серная кислота, конц.; фосфованилиновый реактив*.
Оборудование. Штатив с пробирками; пипетки для отмеривания сильных
кислот; пипетки вместимостью 0,1; 1 и 10 мл; стеклянные палочки; водяная баня;
ФЭК.
Материал. Сыворотка крови.
Метод основан на способности продуктов распада ненасыщенных липидов
образовывать с фосфованилиновым реактивом соединение, интенсивность окраски
которого пропорциональна содержанию общих липидов в сыворотке крови.
Ход определения. В опытную пробирку (сухую!) вносят 0,1 мл сыворотки
крови и 2,9 мл концентрированной серной кислоты (осторожно! Специальными
пипетками!), а в контрольную - 0,1 мл дистиллированной воды и 2,9 мл
концентрированной серной кислоты. Содержимое обеих пробирок тщательно
перемешивают стеклянной палочкой и помещают в кипящую водяную баню на 10 мин (осторожно!).
Затем обе пробирки быстро охлаждают под струей холодной воды до комнатной
температуры. Из опытной и контрольной пробирок отбирают по 0,2 мл охлажденного
содержимого в другие пробирки, в которые предварительно наливают
фосфованилинового реактива по 3 мл в обе пробирки.
После тщательного перемешивания стеклянной палочкой пробы ставят на 45
мин в темное место при комнатной температуре (для развития окрашивания).
Фотометрируют опытную пробу против контрольной на ФЭКе при 500-560 нм
(зеленый светофильтр), в кювете с толщиной слоя 0,5 см.
Расчет. Содержание общих липидов в сыворотке крови х (г/л) рассчитывают
по формуле
m10000∙3
х = ------- ,
0,2∙1000
где m - масса общих липидов в пробе, найденная по калибровочному графику
(рис.6), мг;
- коэффициент пересчета на 1 л сыворотки крови;
- коэффициент пересчета миллиграммов в граммы;
- общий объем исходной смеси (0,1 мл сыворотки крови + 2,9 мл
концентрированной серной кислоты), мл;
,2 - объем смеси, взятой для проведения цветной реакции, мл.

Оформление
работы. По найденному значению экстинкции рассчитать содержание общих липидов в
крови, указав на возможные изменения в их содержании и причину этих изменений.
В выводах отметить практическое использование метода определения общих липидов
в клинической лаборатории для выявления нарушений липидного обмена.
Практическое значение работы. Нормальное содержание общих липидов в
сыворотке крови (нормолипемия) составляет 4,0-8,0 г/л. При физиологических условиях
увеличение содержания липидов в крови (гиперлипемия) наблюдается через 1-4 ч
после принятия богатой жирами пищи. Натощак уровень общих липидов снижается
(гиполипемия). Гиперлипемия проявляется при многих патологических состояниях: у
больных сахарным диабетом отмечается резко выраженная гиперлипемия (до 20,0
г/л), при заболеваниях почек (липоидном нефрозе), при поражении печени (циррозе
печени и остром гепатите), при ожирении, при врожденной гиперлипемии,
атеросклерозе и у лиц, злоупотребляющих алкоголем.
Работа 51. Определение содержания β- и пре- β-липопротеидов сыворотки крови турбидиметрическим
методом по Бурштейну и Самай
Реактивы. Хлорид кальция, 0,025 М раствор; гепарин, содержащий 1000
единиц в 1 мл.
Оборудование. Микропипетки; ФЭК.
Материал. Сыворотка крови.
Метод основан на способности гепарина образовывать с β-
и пре-β-липопротеидами сыворотки крови
комплекс, который под действием хлорида кальция выпадает в осадок. Степень
помутнения раствора пропорциональна содержанию этих липопротеидов в сыворотке
крови.
Ход определения. В контрольную и опытную кюветы ФЭКа с толщиной слоя 0,5
см наливают по 2 мл хлорида кальция. Устанавливают шкалу прибора на нулевую
отметку при 720 нм (красный светофильтр).
В опытную кювету приливают микропипеткой 0,2 мл сыворотки, несколько раз
промывая пипетку. Отмечают исходное значение экстинкции (Е1). Затем добавляют
микропипеткой 0,04 мл гепарина, несколько раз промывая ее, и перемешивают
содержимое кюветы. Ровно через 4 мин (по секундомеру) вновь измеряют экстинкцию
(Е2).
Расчет. Содержание β- и пре-β-липопротеидов х (г/л) в сыворотке
крови рассчитывают по формуле
х = (Е2 - Е1)11,65 ,
где 11,65 - эмпирический коэффициент пересчета содержания β-
и пре-β-липопротеидов на г/л.
Оформление работы. По полученным значениям экстинкции рассчитать
содержание определяемых липопротеидов в сыворотке крови и сделать вывод о
возможных их изменениях.
Практическое значение работы. В норме содержание липопротеидов в
сыворотке крови составляет 3,6-6,5 г/л. Наиболее часто наблюдается увеличение
содержания β-липопротеидов в сыворотке крови. Повышение уровня
липопротеидов тесно связано с повышением содержания холестерина в крови; им
наиболее богаты β-липопротеиды. Повышение β- и пре-β-липопротеидов имеет место при
заболеваниях, связанных с нарушением липидного обмена (атеросклероз, сахарный
диабет и др.). Концентрация β- и пре-β-липопротеидов в сыворотке крови имеет
значение не только для выявления нарушений липидного обмена, но и как
показатель функции печени (гепатиты).
Работа 52. Определение содержания холестерина в
сыворотке крови по методу Илька
Реактивы. Реактив Илька*.
Оборудование. Пипетка для отмеривания концентрированных кислот;
термостат, отрегулированный на 37˚С; микропипетки; штатив с пробирками;
ФЭК.
Материал. Сыворотка крови.
Метод основан на реакции Либермана-Бурхарда (см. работу 18, б).
Интенсивность изумрудно-зеленой окраски пропорциональна содержанию холестерина.
Ход определения. В пробирку вносят 2,1 мл реактива Илька и приливают 0,1
мл негемолизированной сыворотки крови, которую добавляют медленно, так чтобы
она стекла по стенке пробирки. Пробирку энергично встряхивают 10-12 раз и
помещают в термостат на 20 мин при 37˚С. Фотометрируют на ФЭКе при 630-690
нм (красный светофильтр) в кювете с толщиной слоя 0,5 см против реактива Илька.
Расчет. Содержание холестерина определяют по калибровочному графику (рис.
7).
Примечание. При проведении реакции нужно пользоваться абсолютно чистыми и
сухими пробирками и пипетками. Соотношение компонентов реактива Илька
рассчитано так, что белки сыворотки крови не выпадают в осадок. Появление мути
может быть вызвано лишь наличием воды в реактиве или посуде.

Оформление
работы. Рассчитать содержание холестерина в исследуемой сыворотке крови и по
результатам сделать вывод о возможных нарушениях в обмене холестерина.
Практическое
значение работы. Содержание холестерина в сыворотке крови у здоровых людей,
определенное методом Илька, составляет 3,0-6,2 ммоль/л. Повышенная концентрация
холестерина в сыворотке крови (гиперхолестеринемия) наблюдается при
атеросклерозе, сахарном диабете, врожденных нарушениях обмена, заболеваниях
печени и т.д.
Работа 53. Определение содержания общих фосфолипидов
в сыворотке крови
Метод
основан на определении концентрации органического фосфата, освободившегося при
кислотном гидролизе. Измерение содержания неорганического фосфата проводится
реакцией с молибдатом аммония, принцип которой см. работу 11.
Реактивы.
Трихлоруксусная кислота, 0,6 М раствор; реактив молибдата аммония*; хлорная
кислота, конц.; восстанавливающий реактив*.
Оборудование.
Фильтровальная бумага; центрифуга с центрифужными весами; штатив с пробирками;
пипетки для забора концентрированных кислот; пипетки вместимостью 0,1; 1 и 5
мл; песчаная баня; ФЭК.
Материал.
Сыворотка крови.
Ход
определения. В опытную пробирку вносят 0,2 мл сыворотки и 2,8 мл
дистиллированной воды, в контрольную - 3 мл дистиллированной воды. Добавляют в
обе пробирки по 3 мл раствора трихлоруксусной кислоты и встряхивают для
перемешивания содержимого.
Центрифугируют
опытную пробу 15 мин при 3000 об/мин. Надосадочную жидкость сливают, пробирку
переворачивают на фильтровальную бумагу до полного стекания жидкости. Затем в
обе пробирки приливают по 1 мл концентрированной хлорной кислоты (специальной
пипеткой, осторожно!), помещают в каждую из них по две стеклянные бусинки и
встряхивают их содержимое. Пробы ставят на гидролиз в песчаную баню при 180˚С
на 20-30 мин (до обесцвечивания раствора).
Пробирки
охлаждают на воздухе до комнатной температуры, прибавляют по 3 мл
дистиллированной воды, по 1 мл реактива молибдата аммония и по 1 мл
свежеприготовленного восстанавливающего реактива. Тщательно перемешивают
содержимое пробирок и оставляют на 10 мин при комнатной температуре.
Фотометрируют
опытную пробу против контрольной на ФЭКе при 630 нм (красный светофильтр) в
кювете с толщиной слоя 0,5 см.
Расчет.
Содержание общих фосфолипидов х (г/л) в сыворотке крови рассчитывают по формуле
m5000∙25
х
= ------ ,
10
где
m - масса неорганического фосфата в пробе, найденная по калибровочному графику
(рис. 8), мг;
-
коэффициент пересчета на литр сыворотки крови;
-
коэффициент пересчета миллиграммов в граммы;
-
коэффициент пересчета (липидный фосфор составляет 4% относительной молекулярной
массы фосфолипидов).
Для
пересчета липидного фосфора на ммоль/л необходимо полученные результаты
умножить на коэффициент 0,323.

Оформление
работы. По полученному значению экстинкции рассчитать содержание общих
фосфолипидов и липидного фосфора в сыворотке крови. Сделать вывод относительно
полученных данных.
Практическое
значение работы. Фосфолипиды сыворотки (плазмы) крови входят в состав
липопротеидов, обусловливая вместе с белком полярные свойства этих смешанных
макромолекул и их растворимость. В норме содержание общих фосфолипидов
составляет 1,5-3,6 г/л, или 2,0-3,5 ммоль/л липидного фосфора. Важным
показателем является индекс фосфолипиды/холестерин, который в физиологических
условиях равен 1-1,5. Этот индекс снижается при атеросклерозе, гипертонической
болезни, заболеваниях печени. Повышение концентрации фосфолипидов в сыворотке
крови (гиперфосфолипидемия) наблюдается при сахарном диабете, гипотиреозе, при
поражении почек и т.д. Пониженный уровень их встречается при тяжелых формах острого
гепатита, жировом перерождении печени, тиреотоксикозе.
Работа 54. Разделение липидов сыворотки крови
методом тонкослойной хроматографии
Метод основан на различной скорости перемещения липидных фракций
сыворотки крови (фосфолипиды, свободные жирные кислоты, холестерин, глицериды)
в тонком слое адсорбента при движении через него органического растворителя.
Скорость разделения фракций зависит от их относительной полярности, и для их
обнаружения полученные хроматограммы обрабатывают парами иода.
Реактивы. Этанол - диэтиловый эфир (3:1); хлороформ; растворитель для
хроматографии: н-гексан - диэтиловый эфир - уксусная кислота (73:25:2); иод
металлический.
Оборудование. Пластинки хроматографические Силуфол УФ254; камера для
хроматографии; водяная баня; камера для проявления хроматограмм; хроматоскоп.
Материал. Сыворотка крови.
Ход определения. В мерной колбе вместимостью 25 мл смешивают 1 мл
исследуемой сыворотки крови с 10 мл приготовленной спирто-эфирной смеси. Колбу
с содержимым помещают на 30 с в кипящую водяную баню, охлаждают под струей
холодной воды и доводят объем спирто-эфирной смесью до 25 мл. Полученный
липидный экстракт отфильтровывают через обезжиренный бумажный фильтр в
широкогорлую пробирку, выпаривают досуха в кипящей водяной бане, а осадок растворяют
в 0,2 мл хлороформа.
В хроматографическую камеру наливают 2-3 мл растворителя. Пастеровской
пипеткой наносят на хроматографическую пластину, отступя 1 см от края,
0,01-0,02 мл хлороформного экстракта, помещают пластину в камеру этим концом
вниз, погрузив его на 3-5 мм в растворитель. Камеру закрывают крышкой для
поддержания равномерной концентрации паров. Хроматографию проводят при
комнатной температуре до тех пор, пока фронт растворителя не приблизится к
верхнему краю, не доходя до него 0,5 см.
Полученную хроматограмму извлекают из камеры, высушивают на воздухе и
вносят в камеру для проявления, на дно которой предварительно насыпают
кристаллы металлического иода. Сосуд закрывают и подогревают в водяной бане при
60˚С. Возгоняющийся иод вступает в реакцию с липидными фракциями.
Через 1 мин хроматограмму извлекают и просматривают в ультрафиолетовом
свете на хроматоскопе. Фракции липидов обнаруживают в виде коричневых пятен.
Ближе к линии старта расположены фосфолипиды, затем неидентифицированные соединения,
холестерин, моноглицериды, свободные жирные кислоты, триглицериды и эфиры
холестерина.
Оформление работы. Зарисовать полученную хроматограмму, указав на ней
соответствующие липидные фракции сыворотки крови. Указать в выводах возможность
дальнейшего количественного определения липидных компонентов.
ОБМЕН БЕЛКОВ
И АМИНОКИСЛОТ
В обмене белков можно условно выделить два этапа: первый - распад белков
(в том числе апопротеинов сложных белков) до аминокислот и второй превращение
аминокислот до конечных продуктов метаболизма (мочевина, СО2 и Н2О) или до
некоторых азотсодержащих производных (биогенные амины, креатин, порфирины и
т.д.). Для оценки состояния белкового обмена организма исследуют содержание
белков и отдельных их фракций в сыворотке крови, аминокислот, а также
активность ферментов, катализирующих отдельные стадии превращения белков и
аминокислот.
Работа 55. Определение содержания белковых
фракций сыворотки крови турбидиметрическим методом
Реактивы. Основной фосфатный буферный раствор и его рабочие растворы №
1-4*.
Оборудование. Штатив с пробирками; пипетки вместимостью 1; 2,5 и 10 мл;
палочки стеклянные; ФЭК.
Материал. Сыворотка крови.
Метод основан на способности отдельных белковых фракций сыворотки крови
осаждаться в виде мелкой взвеси в фосфатных растворах определенной
концентрации. Степень мутности раствора пропорциональна содержанию белковых
фракций.
Ход определения. Нумеруют шесть пробирок: 0, 1, 2, 3, 4, 5 и ставят их в
штатив. В пробирку «0» (контрольная) вносят 5 мл дистиллированной воды, а в
пробирки 1-4 по 5 мл соответствующих рабочих буферных растворов.
В пробирку № 5 наливают 0,5 мл сыворотки крови, 0,75 мл дистиллированной
воды и 3,75 мл основного раствора фосфатного буфера, содержимое тщательно
перемешивают.
Из пробирки № 5 переносят 0,5 мл в контрольную пробирку и по 0,5 мл в
пробирки № 1-4, после чего содержимое их перемешивают стеклянной палочкой.
Через 15 мин определяют степень мутности (экстинкцию) растворов № 1-4
против контрольной (нулевая проба) на ФЭКе при 610-640 нм (светофильтр красный)
в кювете с толщиной слоя 1 см (перед фотометрией пробирки встряхивают).
Расчет. Подобранные концентрации растворов фосфатного буфера позволяют
осаждать разные фракции белков в зависимости от их изоэлектрической точки. В
пробирке № 1 осаждаются все фракции; № 2 - все фракции глобулинов; № 3 -β-
и γ-глобулины и № 4 - только γ-глобулины. Исходя из этого,
рассчитывают содержание отдельных белковых фракций в процентах или в абсолютных
величинах (в г/л).
В процентах расчет проводят следующим образом. Вычисляют Е для каждой
фракции:
для альбуминов Е = Е1 - Е2;
для α-глобулинов Е = Е2 - Е3;
для β-глобулинов Е = Е3 - Е4;
для γ-глобулинов Е = Е4
Полученные значения Е для каждой белковой фракции складывают и условно
принимают за 100%, после чего находят содержание для каждой фракции х (в %) по
формуле
Еоп 100%
х = ----- ,
Еобщ
где Еоп - экстинкция данной фракции,
Еобщ - сумма экстинкций всех фракций.
Для расчета содержания белковых фракций в абсолютных значениях
предварительно определяют концентрацию белка в сыворотке крови биуретовым
методом (см. работу 8) и затем делают расчеты по формуле
Еоп С
х = ----- ,
Еобщ
где х - содержание данной фракции, г/л;
С - концентрация белка в сыворотке крови, определенная биуретовым
методом, г/л.
Оформление работы. Рассчитать процентное и абсолютное содержание белковых
фракций в сыворотке крови (для расчета в абсолютных единицах можно использовать
данные содержания белка в сыворотке крови, полученные в работе 8), а также
альбумин/глобулиновый индекс и сделать вывод.
Практическое значение работы. В норме содержание белковых фракций в
сыворотке крови следующее: альбумины 35-60 г/л и глобулины 25-35 г/л, из них α1-глобулины 2,5-5%, α2-глобулины 7-13%, β-глобулины 8-14% и γ-глобулины 12-22%. В абсолютных
единицах концентрация α1-глобулинов равна 2,0-5,0, α2-глобулинов 4,0-7,0, β-глобулинов 5,0-9,0 и γ-глобулинов 8,0-17,0 г/л. Индекс
альбумины/глобулины колеблется от 1,5 до 2,3. При различных патологических
состояниях происходит изменение протеинограммы. Острый воспалительный процесс
характеризуется уменьшением содержания альбуминов и возрастанием содержания α-глобулинов, а в более поздние сроки -
увеличением концентрации γ-глобулинов. Для хронического воспаления более типично
выраженное повышение уровня α2 и γ-глобулинов и умеренное снижение
альбуминов в сыворотке крови; при злокачественных новообразованиях резко
снижается содержание альбуминов с одновременным существенным увеличением всех
глобулиновых фракций. Поражения печени (гепатиты, цирроз печени) сопровождаются
снижением альбуминов, которые образуются в печеночной ткани, и относительным
увеличением γ-глобулинов.
Работа 56. Определение активности катепсинов в
сыворотке крови по А.А. Покровскому, А.И. Арчакову и О.Н. Любимцевой
Реактивы. Ацетатный буфер, 0,1 М раствор с рН 4,0; гемоглобин, 4%-ный
раствор на ацетатном буфере с рН 4,0*; трихлоруксусная кислота, 8%-ный раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 5 мл;
центрифуга с центрифужными весами; спектрофотометр.
Материал. Сыворотка крови.
Метод основан на спектрофотометрическом определении при 280 нм
кислоторастворимых продуктов гидролиза гемоглобина, образующихся под действием
катепсинов сыворотки крови.
Реакция протекает по уравнению
Катепсины
Глобин ------- (n + 1) Фрагменты глобина
+ nН2О
Экстинкцию кислоторастворимых продуктов гидролиза глобина (пептиды,
свободные аминокислоты) измеряют при 280 нм на спектрофотометре. В этой области
спектра в основном поглощает тирозин и в меньшей степени триптофан и
фенилаланин.
Ход определения. В опытную пробирку вносят 1 мл раствора гемоглобина и
0,5 мл сыворотки крови, а в контрольную - те же вещества в том же объеме и 2 мл
раствора трихлоруксусной кислоты. Пробы перемешивают встряхиванием.
Ставят пробирки на 60 мин в водяную баню при 37˚С, после этого
приливают к опытной пробе 2 мл раствора трихлоруксусной кислоты и перемешивают
содержимое встряхиванием. Центрифугируют пробы 10 мин при 3000 об/мин,
надосадочную жидкость сливают в чистые пробирки.
Измеряют экстинкцию опытной пробы против контрольной на спектрофотометре
при 280 нм в кювете с толщиной слоя 1 см.
Расчет. Проводят с использованием калибровочного графика на тирозин или
молярного коэффициента экстинкции тирозина:
Е5000
0,436
где х - активность катепсинов, ммоль тирозина/(ч∙л);
Е - экстинкция опытной пробы против контрольной;
- коэффициент пересчета на 1 л сыворотки крови;
,436 - коэффициент экстинкции 1 ммоля тирозина.
Оформление работы. По экстинкции рассчитать активность катепсинов в
сыворотке крови, сделать вывод и отметить практическое значение определения
данного фермента.
Практическое значение работы. Катепсины, гидролизующие белки в кислой
зоне рН, специфичны для лизосом тканей, поэтому в научных исследованиях их
определяют как индикаторы чистоты лизосомальной фракции. При поражении органов,
особенно при некрозах, активность катепсинов в сыворотке крови увеличивается.
Это явление отмечено при инфаркте миокарда, причем степень повышения
ферментативной активности в сыворотке крови зависит от глубины и
распространенности некротического очага в сердце.
Работа 57. Определение активности аспартат- и
аланин- аминотрансферазы в сыворотке крови по Райтману и Френкелю
Реактивы. Субстратные растворы № 1 и № 2*; 2,4-динитрофенилгидразин,
0,1%-ный раствор на 2 М растворе соляной кислоты; гидроксид натрия, 0,4 М
раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 0,2; 1 и 5 мл;
водяная баня; ФЭК.
Материал. Сыворотка крови.
Метод основан на определении пировиноградной кислоты, которая является
одним из продуктов реакции, катализируемой аланинаминотрансферазой, или
продуктом декарбоксилирования оксалацетата, образующегося в реакции,
катализируемой аспартатаминотрансферазой. Образовавшаяся пировиноградная
кислота определяется по цветной реакции с 2,4-динитрофенилгидразином (см.
работу 31).
Ход определения. Определение активности ферментов проводят по схеме
|
Последовательность операций
|
АлАТ
|
АсАТ
|
|
опыт
|
контроль
|
опыт
|
контроль
|
|
Внесение субстратных
растворов
|
Раствор № 1 - 0,5мл
|
Раствор № 1 - 0,5мл
|
Раствор № 2 - 0,5мл
|
Раствор № 2 - 0,5мл
|
|
Нагревание
|
5 мин при 37˚С
|
5 мин при 37˚С
|
|
Добавление 2,4-ДНФГ
|
-
|
1,0 мл
|
-
|
1,0 мл
|
|
Добавление сыворотки
|
0,1 мл
|
0,1 мл
|
0,1 мл
|
0,1 мл
|
|
Инкубация
|
30 мин при 37˚С
|
60 мин при 37˚С
|
|
Добавление 2,4-ДНФГ
|
0,5 мл
|
-
|
0,5 мл
|
-
|
|
Экспозиция
|
20 мин при 18-20˚С
|
20 мин при 18-20˚С
|
|
Добавление гидроксида
натрия
|
5,0 мл
|
5,0 мл
|
5,0 мл
|
5,0 мл
|
|
Экспозиция
|
10 мин при 18-20˚С
|
10 мин при 18-20˚С
|
Фотометрируют опытные пробы против контрольной на ФЭКе при 500-560 нм
(зеленый светофильтр) в кювете с толщиной слоя 1 см.
Расчет производят по формулам:
m10000∙2
х(АсАТ) = ---- или х(АлАТ) = ---- ,
1000 1000
где х - активность ферментов, ммоль/(ч∙л);- количество
пировиноградной кислоты в пробе, найденное по калибровочному графику (рис. 9),
мкмоль;
- коэффициент пересчета на 1 л сыворотки;
- коэффициент пересчета мкмоль в ммоль;
- для пересчета на 1 ч.

Практическое
значение работы. В норме активность аланинаминотрансферазы составляет 0,1-0,68,
а аспартатаминотрансферазы 0,1-0,45 ммоль/(ч∙л).
Определение
активности АсАТ и АлАТ и их отношения широко используется в клинической
практике для выявления патологических процессов в различных органах. В миокарде
более высокая активность АсАТ, чем АлАТ, в печени обратное соотношение
активности этих ферментов. При инфаркте миокарда значительно увеличивается
активность АсАТ в сыворотке крови с одновременным повышением коэффициента
АсАТ/АлАТ. При поражении печени (цирроз, сывороточный гепатит и т.д.) более
выраженно повышается активность АлАТ и снижается коэффициент АсАТ/АлАТ.
Работа 58. Определение активности гистидазы в
сыворотке крови по Табору и Мелеру в модификации В.А. Буробина
Реактивы. L-гистидина моногидрохлорид, 0,2 М раствор (418 мг в 100 мл),
доведенный с помощью 1 М раствора NaOH до рН 8,2; пирофосфатный буфер, 0,1 М
раствор с рН 8,2*; трихлоруксусная кислота, 20%-ный раствор; активирующий
раствор, содержащий восстановленный глутатион и альбумин*; уроканиновая
кислота, 0,001 М раствор для построения калибровочного графика (8,7 мг
дигидрата уроканиновой кислоты растворяют в 0,001 М растворе NaOH в мерной
колбе вместимостью 50 мл).
Оборудование.
Штатив с пробирками; пипетки вместимостью 1 и 5 мл; водяная баня с
лабораторным термометром; термостат, отрегулированный на 37˚С; центрифуга
с центрифужными весами; спектрофотометр.
Материал. Сыворотка крови.
Метод основан на измерении экстинкции уроканиновой кислоты, образующейся
из гистидина под действием гистидазы, в зоне ее максимального поглощения при
264 нм в кислой среде.
Ферментативная реакция протекает по уравнению

Ход
работы. В две пробирки - контрольную и опытную - вносят по 0,3 мл
пирофосфатного буфера, по 0,5 мл исследуемой сыворотки и по 1 мл активирующего
раствора. В опытную пробирку приливают 1 мл раствора гистидина и доводят объем
пробы до 3 мл дистиллированной водой. Перемешивают содержимое встряхиванием.
Обе пробирки помещают на 2 ч в водяную баню или термостат при 37˚С,
затем добавляют в пробирки по 1 мл раствора трихлоруксусной кислоты.
После этого в контрольную пробу приливают 1 мл активирующего раствора,
объем ее доводят до 3 мл дистиллированной водой и перемешивают содержимое
встряхиванием.
Пробы центрифугируют 5 мин при 3000 об/мин, после чего надосадочную
жидкость сливают в чистые пробирки.
Измеряют экстинкцию опытной работы против контрольной на спектрофотометре
при 264 нм в кювете с толщиной слоя 1 см.
Для построения калибровочного графика в семь пронумерованных пробирок
вносят компоненты, перечисленные в приведенной ниже таблице, в указанных
количествах.
Для приготовления рабочего раствора уроканиновой кислоты берут ее
исходный 0,001 М раствор и разбавляют в 10 раз дистиллированной водой.
Доводят объем всех проб до 3 мл дистиллированной водой, добавляют во все
пробирки по 1 мл раствора трихлоруксусной кислоты, перемешивают содержимое.
Центрифугируют пробы 5 мин при 3000 об/мин, надосадочную жидкость сливают в
чистые пробирки и измеряют экстинкцию, как указано выше.
|
№№ пробы
|
Рабочий раствор
уроканиновой кислоты, мл
|
Пирофосфатный буфер, мл
|
Активирующий раствор, мл
|
Раствор гистидина, мл
|
Содержание уроканиновой
кислоты в пробе, мкмоль
|
|
1
|
0
|
0,3
|
1,0
|
1,0
|
0
|
|
2
|
0,05
|
0,3
|
1,0
|
1,0
|
0,005
|
|
3
|
0,10
|
0,3
|
1,0
|
1,0
|
0,010
|
|
4
|
0,15
|
0,3
|
1,0
|
1,0
|
0,015
|
|
5
|
0,20
|
0,3
|
1,0
|
1,0
|
0,020
|
|
6
|
0,30
|
0,3
|
1,0
|
1,0
|
0,030
|
|
7
|
0,40
|
0,3
|
1,0
|
1,0
|
0,040
|
Расчет производят по формуле
Е200
х = ----- ,
2
где х - активность гистидазы в сыворотке крови, мкмоль/(ч∙л);
Е - содержание уроканиновой кислоты в пробе, найденное по калибровочному
графику, мкмоль;
- коэффициент пересчета на 1 л сыворотки крови;
- коэффициент пересчета на 1 ч.
Оформление работы. По полученным экстинкциям рассчитать активность
гистидазы в сыворотке крови, сравнить ее с нормой и указать причины возможных
отклонений.
Практическое значение работы. Гистидаза содержится преимущественно в
печени и коже человека и относится к органоспецифичным для них ферментам. При
поражении этих органов, главным образом печени, наблюдается поступление этого
фермента в кровь. В норме активность гистидазы в сыворотке крови определяется в
виде следов примерно у 1-2% здоровых пациентов. Лишь у грудных здоровых детей
регистрируется активность этого фермента в сыворотке крови. При заболеваниях
печени в сыворотке крови выявляется гистидазная активность, причем степень ее
увеличения характеризует тяжесть патологического процесса.
Работа 59. Определение содержания свободного
гидроксипролина в моче по Нейману и Логану в модификации П.Н. Шараева
Реактивы. Сульфат меди (II), 0,01 М раствор; пероксид водорода, 6%-ный
раствор; серная кислота, 6 М раствор; реактив Эрлиха (5%-ный раствор
n-диметиламинобензальдегида в н-пропаноле или изопропаноле); гидроксид натрия,
2,5 М раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 мл; стеклянные
палочки; термостат; вода со льдом (или снегом) в стакане; водяная баня; ФЭК.
Материал. Моча, предварительно профильтрованная.
Метод основан на взаимодействии продукта окисления и декарбоксилирования
гидроксипролина с n-диметиламинобензальдегидом, в результате чего образуется
окрашенное соединение розового цвета. Интенсивность окраски пропорциональна
концентрации гидроксипролина в пробе.
Ход работы. В две пробирки вносят по 1 мл профильтрованной мочи, раствора
сульфата меди (II), раствора гидроксида натрия и раствора пероксида водорода.
Содержимое обеих пробирок перемешивают стеклянной палочкой в течение 5 мин,
затем их ставят в термостат при 70˚С на 5 мин, периодически встряхивая до
полного прекращения выделения пузырьков. Затем пробы охлаждают в воде со льдом
или снегом. К охлажденным пробам приливают по 4 мл раствора серной кислоты и по
2 мл реактива Эрлиха и перемешивают содержимое пробирок стеклянной палочкой.
После этого опытную пробирку помещают в кипящую водяную баню на 80 с, а
контрольную - на то же время в воду со льдом или снегом.
Измеряют экстинкцию опытной и контрольной проб против воды на ФЭКе при
зеленом светофильтре в кювете с толщиной слоя 1 см. Из экстинкции опытной пробы
вычитают экстинкцию контрольной пробы и полученную величину используют для
нахождения содержания гидроксипролина в пробе по калибровочному графику.
Для построения калибровочного графика отмеривают в одну пробирку 1 мл
воды («слепая» проба), а в пять других (стандартные пробы) - по 1 мл раствора
гидроксипролина с концентрацией его 1, 10, 15, 20 и 25 мкг/мл.
Далее пробы обрабатывают так же, как и описанные выше опытные, измеряют
экстинкцию стандартных проб против «слепой» при тех же условиях.
Расчет производят по формуле
ЕV
х = ----- ,
1000
где х - содержание гидроксипролина в моче, мг/сут;
Е - содержание гидроксипролина в пробе, найденное по калибровочному
графику по разнице экстинкций опытной и контрольной проб, мкг;- суточный объем
мочи, мл;
- коэффициент пересчета микрограммов в миллиграмы.
Практическое значение работы. Гидроксипролин входит в состав только
белков соединительной ткани - коллагена и эластина, в которых содержание данной
аминокислоты составляет соответственно 10-15 и 1,5%. Выделение гидроксипролина
с мочой, а также концентрация его в плазме или сыворотке крови зависит, в
основном, от скорости синтеза коллагена, образования коллагеновых фибрилл и
интенсивности распада коллагена в тканях.
В норме экскреция свободного гидроксипролина с мочой у взрослого человека
составляет 1-8 мг, или 7,6-61,0 мкмоль в сутки. Повышенное выделение его с
мочой отмечается при повреждении соединительной ткани, сопровождающемся
распадом коллагена (например, при ревматизме, системной склеродермии, поражении
костей и др.). Динамическое наблюдение за экскрецией гидроксипролина с мочой
может дать информацию о формировании рубца в постинфарктном очаге миокарда.
ОБМЕН
АЗОТСОДЕРЖАЩИХ НЕБЕЛКОВЫХ ВЕЩЕСТВ
Основную часть азотсодержащих небелковых соединений составляют
нуклеиновые кислоты, нуклеотиды, порфирины и ряд других веществ, которые
образуются в процессе их обмена. В широком смысле к азотсодержащим небелковым
компонентам относят пептиды, аминокислоты и некоторые продукты обмена
последних. Однако исследование пептидов и аминокислот более информативно для
состояния белково-аминокислотного обмена, а некоторые продукты их метаболизма,
определяемые в клинике (так называемый остаточный азот, мочевина и др.), характеризуют
в целом состояние азотистого обмена.
1. Исследование общих продуктов азотистого
обмена
Некоторые продукты обмена азотистых соединений являются общими как для
белковых, так и небелковых веществ. В клинико-биохимических лабораториях с
целью диагностики нарушений обмена азотсодержащих соединений чаще всего
определяют такие показатели, как остаточный азот, мочевину, аммиак. Остаточный
азот - это азот небелковых соединений, остающихся в экстракте после полного
осаждения белков крови. В состав остаточного азота входит азот мочевины,
пептидов, аминокислот, аммиака, креатина, креатинина, индикана, билирубина и
других азотсодержащих низкомолекулярных веществ.
Работа 60. Количественное определение
остаточного азота в крови фотоколориметрическим методом
Реактивы. Реактив Несслера*; трихлоруксусная кислота, 10%-ный раствор;
серная кислота, конц.; пероксид водорода, 30%-ный раствор; гидроксид натрия,
0,4 М раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 1, 5 и 10 мл;
глазные пипетки; центрифуга с центрифужными весами; песчаная баня; ФЭК.
Материал. Кровь, взятая из пальца.
Метод основан на способности аммиака, образующегося в результате
минерализации безбелковых азотсодержащих соединений крови, давать с реактивом
Несслера соединение желтого цвета, интенсивность которого пропорциональна
концентрации остаточного азота.
Ход определения. В центрифужную пробирку наливают 0,5 мл дистиллированной
воды, берут из пальца обследуемого микропипеткой 0,2 мл крови и вносят ее в
пробирку, несколько раз промывая микропипетку содержимым.
В пробу добавляют 1,3 мл раствора трихлоруксусной кислоты, содержимое
перемешивают стеклянной палочкой и оставляют осаждаться белки в течение 20 мин,
затем центрифугируют 10 мин при 3000 об/мин и сливают в чистую пробирку
надосадочную жидкость.
Отбирают 1 мл безбелкового центрифугата в другую пробирку, приливают к
нему 3 капли концентрированной серной кислоты и 2 капли раствора пероксида
водорода. Ставят пробирки примерно на 30 мин в песчаную баню для минерализации
содержимого (до полного просветления раствора).
После охлаждения пробирки до комнатной температуры в нее вносят 10 мл
дистиллированной воды, тщательно снимают со стенок минерализат стеклянной
палочкой и перемешивают.
Приливают в пробирку по 0,5 мл раствора гидроксида натрия и реактива
Несслера. После появления желтого окрашивания фотометрируют опытную пробу
против контрольной (10 мл дистиллированной воды и 0,5 мл реактива Несслера) на
ФЭКе при 610-650 нм (красный светофильтр) в кювете с толщиной слоя 2 см.
Расчет производят по формуле
m2∙5000
х = ----- ,
1∙1000
где х - концентрация остаточного азота в крови, г/л;- содержание азота в
пробе, найденное по калибровочному графику (рис.10), мг;
- коэффициент пересчета на 1 л крови;
- объем уксусного экстракта, мл;
- объем безбелкового центрифугата, взятого на анализ, мл.
х = m10.
После упрощения формула приобретает следующий вид:

Оформление
работы. По экстинкции рассчитать содержание азота в крови, сравнить его с
нормой и сделать вывод о возможных отклонениях.
Практическое
значение работы. За норму принимается содержание остаточного азота в крови в
пределах 0,2-0,4 г/л. Повышение остаточного азота в крови - азотемия - бывает
абсолютная и относительная. Абсолютная вызывается задержкой азотистых шлаков
или повышенном образованием их в организме; относительная наблюдается при
обезвоживании организма (неукротимая рвота, усиленное потоотделение и др.).
Различают
почечную и внепочечную азотемию. Первая наблюдается при нарушении выделительной
способности почек (острые и хронические нефриты), причем степень азотемии
соответствует тяжести патологического процесса. Внепочечная является следствием
повышенного распада белков в организме при лихорадочных состояниях, ожогах,
диабете, тяжелых поражениях печени и т.д.
Работа 61. Количественное определение мочевины в
сыворотке крови и моче
Реактивы. Цветной реактив*; мочевина, стандартный раствор 1 г/л, или
16,65 ммоль/л; набор «Уреатест».
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1, 2 и 5 мл;
алюминиевая фольга; водяная баня; ФЭК.
Материал.
1. Сыворотка крови.
2. Моча, собранная за сутки,
профильтрованная и разведенная перед анализом водой в 25 раз.
а. Определение содержания мочевины в сыворотке крови. Метод основан на
способности мочевины в присутствии тиосемикарбазида и солей железа в
сильнокислой среде образовывать с диацетилмонооксимом соединение красного
цвета, интенсивность окраски которого пропорциональна содержанию мочевины в
исследуемой жидкости.
Ход определения. В опытную пробирку отмеривают 0,1 мл разведенной в 10
раз сыворотки крови, в стандартную - такой же объем стандартного раствора
мочевины и в контрольную - 0,1 мл дистиллированной воды. Добавляют во все
пробирки по 2 мл цветного реактива и тщательно перемешивают их содержимое
встряхиванием.
Все пробирки закрывают крышечкой из алюминиевой фольги и нагревают в
кипящей водяной бане в течение 10 мин (точно!). Затем охлаждают их под струей
холодной воды.
Измеряют экстинкцию стандартной и опытной проб против контрольной на ФЭКе
при 540-560 нм (светофильтр зеленый) в кювете с толщиной слоя 0,5 см.
Примечание. Окраска неустойчива, поэтому измерение необходимо провести в
течение 15 мин.
Расчет. Содержание мочевины х (ммоль/л) в сыворотке крови рассчитывают по
формуле
Еоп16,65∙10
х = ----- ,
Ест
где Еоп - экстинкция опытной пробы против контрольной;
Ест - экстинкция стандартной пробы против контрольной;
,65 - концентрация мочевины в стандартной пробе, ммоль;
Азот мочевины (в ммоль/л) рассчитывают, разделив полученное значение
содержания мочевины в сыворотке на 2,14 (число, выражающее отношение
молекулярной массы азота мочевины к массе всей молекулы мочевины).
б. Определение содержания мочевины в моче. Принцип метода тот же, что и в
предыдущей работе.
Ход определения. Для анализа используют 0,1 мл разведенной мочи и 0,1 мл
стандартного раствора мочевины и обрабатывают эти пробы так же, как и сыворотку
крови.
Расчет проводят по формуле
ЕопV25∙1,665
х = ----- ,
Ест0,1∙1000
где х - количество мочевины, ммоль/сут;- объем суточной мочи;
,665 - содержание мочевины в 0,1 мл стандартной пробы, мкмоль;
Еоп - экстинкция опыта;
Ест - экстинкция стандарта;
,1 - объем мочи, взятый на исследование, мл;
- коэффициент пересчета мкмоль в ммоль.
в. Определение содержания мочевины в сыворотке крови экспресс-методом с
помощью набора «Уреатест». Метод основан на способности уреазы разлагать
мочевину с образованием аммиака, который окрашивает полоску реактивной
хроматографической бумаги в голубой цвет. Высота окрашенной зоны
пропорциональна концентрации мочевины, которую рассчитывают по калибровочному
графику.
Ход определения. Сыворотку крови разводят водой в отношении 1:1. На
пропитанный ферментом конец бумажной полоски в 3 мм от красной парафиновой
полосы наносят специальной пипеткой 0,03 мл разведенной сыворотки крови.
Полоску тотчас помещают в чистую сухую пробирку, герметически закрывают ее
пробкой и ставят в термостат при 37˚С. Через 20 минут полоску извлекают,
измеряют высоту окрашенной в голубой цвет зоны.
Расчет. По калибровочному графику, входящему в набор «Уреатест», находят
концентрацию мочевины в сыворотке крови.
Оформление работы. Сделать расчет содержания мочевины и азота мочевины в
исследуемой сыворотке и моче. В выводе отметить возможные изменения в азотном обмене.
Практическое значение работы. В норме содержание мочевины в сыворотке
крови человека составляет 3,0-7,0 ммоль/л, а азота мочевины - 1,2-3,7 ммоль/л.
Содержание мочевины в сыворотке крови значительно колеблется в зависимости от
приема белков с пищей. Повышение уровня мочевины в крови (азотемия) отмечается
при заболеваниях почек (когда нарушена их выделительная функция), при усиленном
распаде белков, избыточном белковом питании, а также в случае обезвоживания
организма (в данном случае имеет место относительная, а не абсолютная форма
азотемии). Снижение уровня мочевины в крови и выделения ее с мочой (в сутки в
норме выделяется 333-582,8 ммоль/сут) наблюдается при заболевании печени
(паренхиматозная желтуха, дистрофия печени, цирроз), что связано с нарушением
мочевинообразовательной функции.
Работа 62. Количественное определение креатина и
креатинина по методу Брауна
Реактивы. Пикриновая кислота, насыщенный раствор*; соляная кислота, 0,1
моль/л; основной калибровочный раствор креатинина*; 12,5% раствор едкого
натрия.
Оборудование. Штатив с пробирками; пипетки на 0,2; 1,0; 2,0 и 5,0 мл;
ФЭК; водяная баня.
Материал. Исследуемая моча.
Принцип метода. Основан на способности креатинина в щелочной среде с
пикриновой кислотой образовывать комплекс оранжевого цвета, интенсивность
которого пропорциональна концентрации креатинина. Определение креатина
проводится после перевода его в креатинин при нагревании мочи в солянокислой
среде.
Ход определения. В три меченные обычные пробирки внести по 0,2 мл
концентрированной соляной кислоты (осторожно, только пипеткой с резиновой
грушей!). В 1-ю и 2-ю пробирки добавить по 0,2 мл исследуемой мочи,
предварительно разведенной в 5 раз: 1 пробирка служит для определения
креатинина, 2 - креатина, 3 - контрольная. Вторую пробирку нагреть в течение 5
минут на бурно кипящей водяной бане, после чего охладить под струей
водопроводной воды. Во все пробирки внести дистиллированную воду в следующих
количествах: первая пробирка - 2,0 мл, вторая - 2,0 мл, третья - 2,2 мл и в
каждую добавить по 0,6 мл насыщенного раствора пикриновой кислоты и по 1,0 мл
12,5% раствора гидроксида натрия, тщательно перемешивают. Оставляют стоять на
10 минут при комнатной температуре, после чего во все три пробирки добавляют по
6,0 мл дистиллированной воды. Оптическую плотность исследуемых растворов
определяли на ФЭКе с длиной волны 507 нм в кювете на 10 м против контрольной
пробы (третья пробирка). Количество определялось по калибровочному графику.
Расчет. Находят содержание свободного креатинина в первой пробирке по
калибровочному графику, а затем, используя нижеприведенную формулу, проводят
расчет:
a∙5∙1000∙5
х = ------- ,
1000∙1000
где х - количество креатинина в г на 1 л мочи;
а - количество креатинина в мкг в 0,2 мл разведенной мочи, взятой для
анализа;
- разведение мочи;
- для перевода количества креатинина с 0,2 мл мочи на 1 мл;
- перерасчет на 1 л, числитель;
- для перевода мкг в мг, знаменатель;
- для перевода мг креатинина в г, знаменатель.
Расчет креатина - вторая пробирка содержит сумму свободного креатинина и
креатинина, переведенного из креатина при нагревании в солянокислой среде. Из
количества креатинина, полученного при определении суммы креатин-креатинин,
вычитают количество параллельно исследуемого свободного креатинина и полученную
разность умножают на 1,16 - коэффициент перевода креатинина в креатин.
Построение калибровочного графика: из рабочего калибровочного раствора
креатинина готовят разведение, как указано ниже:
|
№№ пробы
|
Рабочий калибр. р-р
креатинина, мл
|
Раствор пикриновой кислоты,
мл
|
2,5 моль/л раствора NaOH,
мл
|
Дистиллированная вода, мл
|
Концентр. креатинина в
пробе, ммоль/л
|
|
1
|
0,4
|
3,0
|
0,2
|
До объема 10 мл
|
40
|
|
2
|
0,8
|
3,0
|
0,2
|
|
80
|
|
3
|
1,6
|
3,0
|
0,2
|
|
160
|
|
4
|
2,4
|
3,0
|
0,2
|
|
240
|
|
5
|
3,2
|
3,0
|
0,2
|
|
320
|
Оформление работы. Рассчитать содержание креатина и креатинина в
исследуемой пробе и в выводах дать оценку полученным результатам, сравнивая с
нормой.
Практическое значение работы. Креатинин, наряду с мочевиной и солями
аммония являются нормальными продуктами азотистого обмена и на его долю
приходится около 2,5-7% всего азота мочи. Креатинина в норме выделяется с
мочой: 4,4-17,7 ммоль/сутки или 0,5-2,0 г/сутки. В норме моча взрослых людей
креатина не содержит. У детей имеет место физиологическая креатинурия, поэтому
в моче он обнаруживается в небольших количествах. Появление креатина в моче
взрослого человека связано с нарушением обмена креатина и наиболее часто
встречается при поражении мышечной ткани (мышечная дистрофия, мышечная атрофия,
миастения, миозит, миотония), Е-авитаминозе, при тонических судорогах,
усиленном распаде тканевых белков. При этом содержание креатинина в моче
понижается.
2. Изучение обмена нуклеиновых кислот и
нуклеотидов
Распад нуклеиновых кислот и их мономеров до конечных продуктов можно
выразить следующей схемой:
Нуклеиновые → Нуклеотиды → Пурины, → Мочевая кислота,
кислоты пиримидины β-аланин и аммиак
О состоянии нуклеинового и нуклеотидного обмена судят по активности
ферментов, участвующих на разных стадиях их распада и превращения, а также по
содержанию мочевой кислоты - конечного продукта обмена пуриновых оснований.
Работа 63. Определение активности кислой
дезоксирибонуклеазы (ДНКазы) в сыворотке крови по А.А. Покровскому, А.И.
Арчакову и О.Н. Любимцевой
Реактивы. ДНК, 1 г/л раствор в ацетатном буфере, 0,1 М с рН 5,0; хлорная
кислота, 0,5 М раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 2 мл;
термостат, отрегулированный на 37˚С; холодильник; центрифуга с
центрифужными весами; часы; спектрофотометр.
Материал. Сыворотка крови.
Метод основан на спектрофотометрическом измерении при 260 нм
кислоторастворимых продуктов гидролиза ДНК, образующихся под действием ДНКазы,
содержащейся в исследуемом материале:
ДНК, ДНКаза
высокополимерная ---- (n + 1) фрагментов ДНК
+ nН2О
Ход определения. В опытную и контрольную пробирки отмеривают по 1,2 мл
раствора ДНК. Затем в опытную пробу добавляют 0,2 мл сыворотки крови и
перемешивают содержимое встряхиванием.
Помещают обе пробы на 30 мин в термостат при 37˚С, после чего в
контрольную пробирку приливают 1,6 мл хлорной кислоты и 0,2 мл сыворотки крови,
а в опытную - такой же объем хлорной кислоты. Содержимое проб перемешивают.
Ставят пробирки на 30 мин в холодильник при 4˚С, а затем обе пробы
центрифугируют 10 мин при 3000 об/мин (для осаждения негидролизованной ДНК).
Надосадочную жидкость сливают в чистые пробирки и измеряют экстинкцию опытной
пробы против контрольной на спектрофотометре при 260 нм в кювете с толщиной
слоя 1 см.
Расчет проводят по формуле
х =Е2602∙500 ,
где х - активность ДНКазы в Е260/г∙л;
- коэффициент пересчета на 1 час;
- коэффициент пересчета на 1 л сыворотки крови;
Оформление работы. Рассчитать активность фермента в исследуемом
материале, сделать вывод о присутствии кислой ДНКазы в сыворотке крови и
практическом значении работы.
Практическое значение работы. Кислая ДНКаза сосредоточена в лизосомах
клеток различных тканей, поэтому в научных исследованиях определение этого
энзима используют для контроля чистоты выделяемой фракции лизосом. Кроме того,
кислая ДНКаза является индикатором повреждения или повышенной проницаемости
мембран лизосом, что имеет практическое значение при оценке действия
лизосомотропных препаратов и патологического процесса.
Работа 64. Определение содержания мочевой
кислоты в сыворотке крови по методу Мюллера и Зейферта
Реактивы. Реактив Фолина*; трихлоруксусная кислота, 20%-ный раствор;
карбонат натрия, насыщенный раствор; мочевая кислота, стандартный раствор 0,02
мг/мл, свежеприготовленный.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 2 мл;
центрифуга с центрифужными весами; ФЭК.
Материал. Сыворотка крови.
Метод основан на способности мочевой кислоты восстанавливать
фосфорновольфрамовый реактив (реактив Фолина) с образованием соединений, интенсивность
окраски которых пропорциональна концентрации данной кислоты.
Ход определения. В центрифужную пробирку вносят по 1,5 мл сыворотки
крови, дистиллированной воды и трихлоруксусной кислоты. Содержимое пробирки
перемешивают, через 5 мин центрифугируют в течение 10 мин при 3000 об/мин.
Берут две чистые градуированные пробирки: опытную и стандартную;
добавляют в них реактивы в соответствии с таблицей.
|
Реактив
|
Опыт
|
Стандарт
|
|
Центрифугат,
соответствующий 0,5 мл сыворотки
|
1,5 мл
|
-
|
|
Стандартный раствор мочевой
кислоты
|
-
|
0,5 мл
|
|
Трихлоруксусная кислота
|
-
|
0,5 мл
|
|
Дистиллированная вода
|
-
|
0,5 мл
|
|
Насыщенный раствор
карбоната натрия
|
0,7 мл
|
0,7 мл
|
|
Реактив Фолина (осторожно!)
|
1 капля
|
1 капля
|
Через 10 мин обе пробы фотометрируют против воды на ФЭКе при 510-560 нм
(зеленый светофильтр) в кювете с толщиной слоя 0,5 см.
Расчет проводят по формуле
Еоп0,01∙2000
х = ----- ,
Ест168
где х - содержание мочевой кислоты в сыворотке крови, ммоль/л;
Еоп - экстинкция опытной пробы;
Ест - экстинкция стандартной пробы;
,01 - масса мочевой кислоты в пробе стандартного раствора, взятого для
реакции, мг;
- коэффициент пересчета на 1 л сыворотки крови;
- молекулярная масса мочевой кислоты.
Оформление работы. Рассчитать содержание мочевой кислоты в сыворотке крови
и сделать вывод о возможных изменениях пуринового обмена.
Практическое значение работы. В норме содержание мочевой кислоты в
сыворотке крови составляет 0,10-0,40 ммоль/л, а с мочой выделяется 2,36-5,9
ммоль в сутки. Повышенное содержание мочевой кислоты наблюдается в крови и моче
при многих патологических состояниях, связанных с усиленным распадом
нуклеопротеидов (лейкозах, диабете, аллергии и др.). Резко увеличивается
концентрация мочевой кислоты при подагре, это сопровождается отложением солей
мочевой кислоты в суставах и различных тканях организма. Понижение содержания
мочевой кислоты в сыворотке крови отмечается при анемии, после приема
пиперазина, атофана, салицилатов и кортикотропина (АКТГ).
3. Исследование порфиринового (пигментного)
обмена
Для оценки состояния порфиринового обмена используют определение пигмента
билирубина, являющегося продуктом распада гемпротеидов. Существуют два типа
билирубина: неконъюгированный (свободный, который с диазореактивом дает
непрямую реакцию, т.е. после растворения в этаноле) и конъюгированный
(связанный с глюкуроновой кислотой, который сразу реагирует с диазореактивом).
По соотношению фракций билирубина судят об изменении пигментного обмена.
Работа 65. Определение билирубина и его фракций
в сыворотке крови по Йендрашику, Клеггорну и Грофу
Реактивы. Кофеиновый реактив*; хлорид натрия, 9 г/л раствор;
диазореактив*.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 2 мл; ФЭК.
Материал. Сыворотка крови.
Метод основан на способности связанной и диссоциированной формы
свободного билирубина давать при взаимодействии с диазофенилсульфоновой
кислотой азобилирубин розовато-фиолетового цвета. Свободный билирубин
переводится в растворимое диссоциированное состояние кофеиновым реактивом,
благодаря чему в этой пробе определяется общий билирубин. По разнице между
общим и связанным билирубином находят концентрацию свободного билирубина.
Ход определения. В три пробирки вносят согласно таблице необходимые
ингредиенты и тщательно перемешивают.
|
Реактивы
|
Общий билирубин, мл
|
Связанный билирубин, мл
|
|
Сыворотка
|
0,50
|
0,50
|
0,50
|
|
Кофеиновый реактив
|
1,75
|
-
|
1,75
|
|
Раствор хлорида натрия
|
-
|
1,75
|
0,25
|
|
Диазореактив
|
0,25
|
0,25
|
-
|
При определении общего билирубина пробы оставляют стоять на 20 мин для
развития окраски, а связанного - на 5-10 мин (при длительном стоянии в реакцию
вступает свободный билирубин).

По
истечении указанного времени фотометрируют каждую пробу против воды на ФЭКе при
520-560 нм (зеленый светофильтр) в кювете с толщиной слоя 0,5 см.
Расчет.
Из полученных экстинкций общего и связанного билирубина вычитают экстинкцию
контрольной пробы (контроль на мутность сыворотки) и находят по ним содержание
общего и связанного билирубина (в мкмоль/л) по калибровочному графику (рис. 11).
Свободный (неконъюгированный) билирубин рассчитывают по разнице между
величинами общего и связанного билирубина.
Оформление
работы. Рассчитать содержание общего билирубина и его фракций в сыворотке крови
и сделать вывод о причине возможных отклонений этих показателей в исследуемом
материале.
Практическое
значение работы. В норме концентрация общего билирубина в сыворотке крови
составляет 8,0-20,0 мкмоль/л; из этого количества 75% приходится на долю
неконъюгированного (свободного) билирубина (6,0-15,0 мкмоль/л) и 25% - на долю
конъюгированного (связанного) билирубина (2,0-5,0 мкмоль/л). Исследование
содержания билирубина проводится в клинике для дифференциальной диагностики
желтух. Желтушная окраска кожных покровов проявляется при уровне билирубина в
крови выше 27 мкмоль/л. При надпеченочных желтухах (гемолитические анемии,
желтуха новорожденных и др.) увеличивается содержание свободного билирубина в
крови, при печеночных желтухах, возникающих вследствие поражения собственно
клеток печени, повышается концентрация связанного билирубина в крови, а при
подпеченочных желтухах, к которым относится механическая, наблюдается
возрастание уровня как свободного, так и, в большей степени, связанного
билирубина.
МОЛЕКУЛЯРНАЯ
ПАТОЛОГИЯ
Биохимические исследования с целью выявления молекулярных болезней
чрезвычайно важны в педиатрии, поскольку своевременная диагностика их помогает
раннему лечению с более благоприятным исходом. При ферментопатии блокируется
цепь биохимических превращений в тканях, поэтому ранним признаком такого
заболевания является накопление в крови и повышенное выделение с мочой веществ,
служащих субстратом для поврежденного ферментного белка. В то же время
концентрация продуктов данной ферментативной реакции в биологических жидкостях
понижена. Поэтому первоначально у больных с подозрением на молекулярную
патологию ставят качественную реакцию на вещества, накопления которых ожидают.
При положительных пробах проводят их количественное определение. Для уточнения
энзимопатии исследуется качественно и количественно соответствующий фермент в
сыворотке и клетках крови, а также в биоптатах.
1. Экспресс-диагностика патологии
аминокислотного обмена
Работа 66. Выявление гипераминоацидурии
Реактивы. Нингидрин, 0,5%-ный раствор в ацетоне с добавлением 1 мл
концентрированной уксусной кислоты на 100 мл жидкости; глицин, стандартный 20
мМ раствор.
Оборудование. Полоски фильтровальной бумаги 10х40 мм; сушильный шкаф,
отрегулированный на 60˚С; глазные пипетки.
Материал. Моча, нормальная и патологическая*.
Принцип метода см. работу 1, б.
Ход определения. В трех пробирках готовят серию разведений стандартного
раствора глицина в 2,5 и 10 раз, при этом концентрация азота глицина в пробах
составляет соответственно 10,4 и 2 ммоль/л.
На две полоски фильтровальной бумаги наносят по 1 капле соответственно
нормальной и патологической мочи, а еще на четыре - по 1 капле неразведенного и
разведенного в 2,5 и 10 раз стандартного раствора глицина. Пятна подсушивают на
воздухе.
На высушенные пятна наносят по 1-2 капли раствора нингидрина, подсушивают
на воздухе и затем помещают полоски на 15 мин в сушильный шкаф при 60˚С,
подвешивая их на крючках.
Сравнивают интенсивность окраски проб нормальной и патологической мочи с
окраской глицина на полосках фильтровальной бумаги. Цветная шкала соответствует
следующим концентрациям глицина: 20. 10, 4, 2 ммоль/л.
Оформление работы. Оценить примерное содержание азота аминокислот в
нормальной и патологической моче. Сделать вывод о наличии гипераминоацидурии у
больного ребенка и указать возможные ее причины.
Практическое значение работы. В норме экскреция азота аминокислот
составляет 0,29-5,35 ммоль/сут. У ребенка его выделяется 0,07-0,15 ммоль/кг
массы тела в сутки, причем 2/3-3/4 этого количества экскретируется в ночное
время. Гипераминоацидурия наблюдается при молекулярных болезнях, возникающих
вследствие дефекта белков эпителия канальцев почек, переносящих аминокислоты и
способствующих их реабсорбции, или в результате нарушения обмена аминокислот в
тканях. Окончательно наследственная причина гипераминоацидурии устанавливается
после исключения ряда заболеваний (цирроз печени, гепатиты, дистрофия, рахит и
т.д.), тоже приводящих к повышенному выделению аминокислот с мочой.
Работа 67. Экспресс-методы диагностики
фенилкетонурии
Фенилкетонурия, или фенилпировиноградная олигофрения, связана с дефектом
фермента фенилаланингидроксилазы, вследствие чего нарушается превращение
фенилаланина в тирозин. При этом увеличивается содержание фенилаланина и
продуктов его обмена (в частности, фенилпировиноградной кислоты) в крови и
моче.
Реактивы. Фенилаланин, стандартный раствор 0,06 г/л; растворитель
(бутанол, уксусная кислота и вода в соотношении 15:15:10); нингидрин, 0,5%-ный
раствор в ацетоне; хлорид железа (III), 10%-ный раствор; набор «Биофан П»
(ГДР), содержащий индикаторную бумагу с цветной шкалой.
Оборудование. Хроматографическая бумага 11х11; микропипетки; чашка Петри;
ножницы; сушильный шкаф, отрегулированный на 90-100˚С; фильтровальная
бумага; штатив с пробирками; пипетки вместимостью 1 мл; глазные пипетки.
Материал.
1. Моча, нормальная и патологическая,
содержащая фенилпировиноградную кислоту.
2. Плазма крови здорового и больного
человека с повышенным содержанием фенилаланина.
а. Экспресс-определение фенилаланина в плазме крови методом бумажной
радиальной хроматографии. Метод основан на различной скорости передвижения
фенилаланина по хроматографической бумаге вследствие разности коэффициентов
распределения его между неподвижной и подвижной фазами растворителя. Положение
аминокислот на хроматограмме, которая представлена в виде концентрических
кругов, выявляется нингидриновой реакцией.
Ход определения. Складывают квадрат хроматографической бумаги вчетверо и
делают вырез в центре его диаметром около 1 см.
Квадрат хроматографической бумаги простым карандашом делят на секторы,
нумеруют их от 1 до 4, отступив от центра выреза на 1 см, и намечают карандашом
в каждом секторе кружки для нанесения проб. Помещают квадрат на ножку,
сделанную из фильтровальной бумаги в виде трубочки высотой 2 см и вставленную в
центральный вырез.
Наносят микропипеткой в обведенный кружок 1-го сектора 0,02 мл
стандартного раствора фенилаланина, затем подсушивают пятно с помощью
вентилятора и на высушенное место наносят 0,02 мл плазмы крови здорового
человека; в кружок 2-го сектора наносят 0,02 мл плазмы здорового человека и 3-й
сектор - 0,02 мл плазмы обследуемого больного пациента. Оставляют бумагу на
воздухе до полного высыхания нанесенных проб.
В чашку Петри наливают растворитель, кладут бумажный квадрат на края
чашки Петри, при этом конец ножки погружается в растворитель. Закрывают чашку
крышкой и оставляют при комнатной температуре, пока фронт растворителя не
достигает диаметра около 5 см (отметку карандашом сделать заранее). После этого
хроматограмму высушивают в сушильном шкафу при 90-100˚С, опрыскивают ее
раствором нингидрина и вновь помещают в сушильный шкаф на 10 мин.
В отрицательных пробах (содержание фенилаланина ниже 0,07 г/л)
окрашивается пятно нанесенной плазмы и небольшая окружающая часть. Пятно со
стандартным раствором фенилаланина (0,06 г/л) и плазмой здорового человека
(0,01 г/л) содержит в сумме 0,07 г/л фенилаланина. Исследуемые образцы, дающие
такой же или больший ореол, считают положительными. В пробах, взятых у больных
фенилкетонурией, обнаруживается четкий ореол диаметром около 3,5 см.
Оформление работы. Зарисовать полученную хроматограмму, сравнить величину
окрашенных зон в трех секторах и сделать вывод относительно изменений у
больного пациента.
б. Обнаружение фенилпировиноградной кислоты в моче. Метод основан на
взаимодействии енольной формы фенилпировиноградной кислоты с хлоридом железа
FeCl3 с образованием комплексного соединения сине-зеленого цвета.
Ход определения. В одну пробирку наливают 0,5 мл мочи здорового, а в
другую - больного человека, добавляют по 5 капель раствора хлорида железа (III)
и наблюдают за появлением окрашивания.
Эту реакцию дают различные вещества, хотя окраска их соединений с
хлоридом железа FeCl3 неодинакова. При наличии в моче достаточных количеств
фенилпировиноградной кислоты развивается сине-зеленое или темно-зеленое
окрашивание, исчезающее через 5-10 мин. Сходное окрашивание может давать
билирубин мочи.
в. Обнаружение фенилпировиноградной кислоты в моче с помощью набора
«Биофан П».
Ход определения. Индикаторную бумажку смочить мочой и через 30 с сравнить
окраску индикатора с цветной шкалой.
Оформление работы. Сравнить характер окрашивания в нормальной и
патологической моче, сделать вывод о предполагаемой молекулярной болезни и
указать причины.
Практическое значение работы. В норме содержание фенилаланина в плазме
крови составляет у детей до 1 месяца 75-100 мкмоль/л (0,025-0,05 г/л) и от 2
месяцев до 14 лет 25-75 мкмоль/л. С мочой его экскретируется у детей до года
6,0-24,0 и от года до 14 лет 6,0-72,0 мкмоль/сут. Применяемые пробы на
присутствие фенилпировиноградной кислоты в моче здорового ребенка отрицательны.
При фенилкетонурии содержание фенилаланина в крови повышается до 600-2400
мкмоль/л, а выделение с мочой составляет до 3,0-12,0 мкмоль/сут. Пробы на
фенилпировиноградную кислоту в моче становятся положительными. Причем
содержание ее в суточной моче составляет 0,05-3,0 г или 0,3-18 ммоль.
При поражениях печени (вирусный гепатит, отравление гепатотропными ядами)
нарушается гидроксилирование фенилаланина, который вследствие трансаминирования
превращается в фенилпировиноградную кислоту. Поэтому у таких больных
увеличивается содержание фенилаланина в сыворотке крови и выделение
фенилпировиноградной кислоты с мочой соответственно тяжести течения
заболевания.
Работа 68. Диагностика тирозиноза пробой Миллона
на тирозин и 4-гидроксифенилпировиноградную кислоту
Тирозиноз связан с недостатком фермента
4-гидроксифенилпируватдиоксигеназы, вследствие чего тормозится превращение
4-гидроксифенилпировиноградной кислоты и тирозина. При этом содержание их в
биологических жидкостях увеличивается.
Реактивы. Реактив Миллона*; L-тирозин, стандартные растворы 0,3; 0,4;
0,5; 0,6 г/л.
Оборудование. Полоски фильтровальной бумаги 10х20 мм; глазные пипетки.
Материал. Моча, нормальная и патологическая.
Принцип метода см. работу 1, г.
Ход определения. На одну полоску фильтровальной бумаги наносят 1 каплю
мочи здорового, а на другую - больного пациента и высушивают полоски на
воздухе. На каждое пятно наносят 1 каплю реактива Миллона. Через 2 мин отмечают
появление характерного оранжевого окрашивания.
Для полуколичественной оценки результатов на четыре полоски
фильтровальной бумаги наносят по 1 капле стандартных растворов тирозина,
соответствующих концентраций 0,3; 0,4; 0,5 и 0,6 г/л. Подсушивают полоски на
воздухе и в эти же зоны вносят по капле реактива Миллона.
Нижняя граница чувствительности реакции при содержании исследуемых
субстанций 0,3 г/л. Сравнивают интенсивность окраски исследуемых проб мочи с
цветной шкалой стандартных растворов тирозина и устанавливают примерное содержание
определяемых субстанций в моче.
Оформление работы. Зарисовать цветную шкалу тирозина и окраску
исследуемых проб мочи, дать полуколичественную оценку последним. В выводе
указать на возможность применения пробы Миллона для экспресс-диагностики
тирозиноза.
Практическое значение работы.
В норме содержание тирозина в плазме крови у детей до 1 месяца составляет
90-140 и у детей от 2 месяцев до 14 лет - 55-110 мкмоль/л; экскреция с мочой
этой аминокислоты у детей до года равна 4-30 и от года до 14 лет - 5-88
мкмоль/сут. При тирозинозе концентрация в этих биологических жидкостях
увеличивается в 2 раза и более и пробы на присутствие их становятся
положительными.
Работа 69. Выявление алкаптонурии пробой на
гомогентизиновую кислоту
Алкаптонурия - наследственное заболевание, связанное с дефектом
гомогентизинатоксидазы, осуществляющей превращение гомогентизиновой кислоты в
фумарилацетоуксусную. Пи этом заболевании накапливается в средах организма
гомогентизиновая кислота.
Реактивы. Гидроксид натрия, 10%-ный раствор; реактив молибдата аммония*;
дигидрофосфат калия, 1%-ный раствор.
Оборудование. Штатив с пробирками; глазные пипетки.
Материал. Моча, нормальная и патологическая*.
а. Проба на гомогентизиновую кислоту со щелочью. Метод основан на
окислении гомогентизиновой кислоты кислородом воздуха в щелочной среде с
образованием пигментного продукта сине-фиолетового цвета.
Ход определения. В одну пробирку вносят 10 капель нормальной, а в другую
- патологической мочи, добавляют по 2 капли раствора гидроксида натрия, встряхивают
и наблюдают за изменением окраски 1-2 мин.
Проба положительна при наличии сине-фиолетового окрашивания,
свидетельствующего о присутствии гомогентизиновой кислоты.
б. Проба на гомогентизиновую кислоту с молибденовым реактивом. Метод
основан на способности гомогентизиновой кислоты восстанавливать молибдат
аммония с образованием молибденовой сини (см. работу 11).
Ход определения. В одну пробирку вносят 2 капли мочи здорового, в другую
- 2 капли мочи больного пациента. В каждую пробирку добавляют по 10 капель воды
и по 4 капли раствора однозамещенного фосфата калия. Пробирки встряхивают.
Проба положительна при наличии синего окрашивания, обусловленного
присутствием в моче гомогентизиновой кислоты.
Оформление работы. Отметить наличие гомогентизиновой кислоты в
исследуемой моче; в выводе указать на возможность использования применяемых
проб для диагностики.
Практическое значение работы. Пробы на гомогентизиновую кислоту
используются для диагностики алкаптонурии, так как в норме эта кислота в моче
отсутствует.
Работа 70. Выявление цистинурии иод-азидной
пробой на цистин и гомоцистин в моче
Реактивы. Иод-азидный реактив (1,5 г азида натрия растворяют в 50 мл 0,1
М раствора иода и доводят объем до 100 мл этанолом); L-цистин, стандартные
растворы концентрации 0,3; 0,4; 0,5; 0,6 г/л.
Оборудование. Полоски фильтровальной бумаги 10х20 мм; глазные пипетки.
Материал. Моча, нормальная и патологическая*.
Метод основан на способности иод-азидного реактива обесцвечиваться в
присутствии цистина или гомоцистина.
Ход определения. На две полоски фильтровальной бумаги наносят по 1 капле
нормальной и патологической мочи, высушивают на воздухе и на высушенные пятна
добавляют по 1 капле иод-азидного реактива.
На четыре полоски фильтровальной бумаги наносят по 1 капле стандартных растворов
цистина, высушивают на воздухе и добавляют на высушенные участки по 1 капле
иод-азидного реактива.
Проба считается положительной, если окраска реактива выцветает в течение
5 мин. Нижняя граница чувствительности метода 0,3 г/л. Реакцию оценивают по
шкале стандартов цистина от 0,3 до 0,6 г/л.
Оформление работы. Сравнить пробы с нормальной и патологической мочой; по
шкале стандартов цистина определить примерное содержание его в моче больного
пациента.
Практическое значение работы. Цистинурия - молекулярная патология,
возникающая из-за недостатка белка, участвующего в транспорте и реабсорбции в
канальцах почек цистина и гомоцистина. В норме с мочой цистина выделяется 4-350
мкмоль/сут. При цистинурии его экскреция повышается до 1-4 ммоль/сут. Для обнаружения
наследственной или приобретенной цистинурии используется иод-азидная проба во
время массовых обследований детского контингента. Своевременная диагностика
позволяет снизить осложнения, наблюдающиеся при этом заболевании, а именно:
образование цистиновых камней в почках. При проведении иод-азидной пробы
следует учитывать ложно-положительную реакцию ангидрида аргининоянтарной
кислоты, ацетона, некоторых лекарственных средств.
2. Экспресс-диагностика патологий углеводного
обмена
Работа 71. Выявление пентозурии пробой Биаля
Пентозурия возникает из-за недостатка белка, участвующего в транспорте
пентоз и способствующего их реабсорбции в канальцах почек.
Реактивы. Орциновый реактив*.
Оборудование. Штатив с пробирками; водяная баня; пипетки вместимостью 5
мл.
Материал. Моча, нормальная и патологическая*.
Принцип метода см. работу 16, б.
Ход определения. В две пробирки отмеривают по 5 мл орцинового реактива и
по 1 мл соответственно нормальной и патологической мочи. Затем осторожно
нагревают на водяной бане до закипания. При наличии в моче пентоз развивается
яркая желто-зеленая окраска.
Оформление работы. Сравнить окраску проб нормальной и патологической мочи
и сделать вывод о возможности использования данной реакции для диагностики
пентозурии.
Работа 72. Выявление фруктозурии пробой Селиванова
Реактивы. Резорцин, 0,05%-ный раствор в 20%-ной соляной кислоте.
Оборудование. Штатив с пробирками; пипетки вместимостью 2 мл; водяная
баня.
Материал. Моча, нормальная и патологическая*.
Метод основан на превращении фруктозы при нагревании и в присутствии
соляной кислоты в гидроксиметилфурфурол, который конденсируется с резорцином,
образуя соединение красного цвета.
Ход определения. В две пробирки наливают по 1 мл раствора резорцина и
добавляют в одну из них 2 мл нормальной, а в другую - патологической мочи. Обе
пробирки нагревают в водяной бане до закипания. При наличии в моче фруктозы
появляется интенсивное красное окрашивание. Оценку пробы производят в момент
закипания; при более длительном нагревании положительную реакцию может дать и
глюкоза.
Оформление работы. Сравнить окраску исследуемых проб и сделать вывод о
практическом применении пробы Селиванова.
Работа 73. Выявление мукополисахаридозов пробой с толуидиновым синим
на мукополисахариды
Мукополисахаридозы - врожденное нарушение обмена кислых
гетерополисахаридов. При этом заболевании появляются мукополисахариды в моче.
Аналогичное явление наблюдается также при ревматоидном артрите и других
повреждениях соединительной ткани.
Реактивы. Толуидиновый синий, 0,1%-ный раствор в водном ацетоне,
разведенном с водой в соотношении 4:1; уксусная кислота, 10%-ный раствор.
Оборудование. Полоски фильтровальной бумаги 10х20 мм; глазные пипетки.
Материал. Моча, нормальная и патологическая*.
Метод основан на образовании окрашенных продуктов (пурпурного цвета) при
взаимодействии мукополисахаридов с толуидиновым синим в кислой среде.
Ход определения. На одну полоску фильтровальной бумаги наносят каплю
нормальной мочи, на вторую - каплю патологической. Полностью высушивают их при
комнатной температуре и помещают в раствор толуидинового синего. Через 1 мин
бумажки вынимают из красящего раствора и отмывают в растворе уксусной кислоты.
Проба положительна при развитии пурпурной окраски, говорящей о наличии
мукополисахаридов в моче.
Оформление работы. Отметить наличие окрашивания, сделать вывод о
возможности практического использования данной пробы.
Практическое значение работы. Полуколичественные методы анализа
субстанций называются «просеивающими» или скрининг-тестами. Они позволяют
осуществлять отбор больных с предполагаемыми наследственными или приобретенными
дефектами обмена; их применяют при массовом обследовании больших контингентов
детей для выявления наиболее распространенных и новых молекулярных болезней,
при которых повышено выделение углеводов и продуктов их обмена. Эти вещества
дают положительные реакции при проведении скрининг-тестов. В дальнейшем при
выявлении молекулярной патологии проводится тщательное биохимическое
обследование с помощью точных количественных методов.
Работа 74. Определение содержания порфобилиногена в моче
Реактивы. Реактив Эрлиха*, насыщенный раствор натрия ацетата; хлороформ;
бутиловый спирт; бумага индикаторная для измерения рН (в интервале 4,0-5,0).
Оборудование. Пипетки на 5,0 и 10 мл; штатив с пробирками; центрифуга
лабораторная с центрифужными пробирками.
Материал. Моча (подвергается исследованию в течение 2-3-х часов после
мочеиспускания).
Метод основан на взаимодействии порфобилиногена с
п-диметиламинобензальдегидом с образованием соединения, окрашенного в красный
цвет.
Ход определения. В пробирке смешивают 2,5 мл реактива Эрлиха и 2,5 мл
мочи. Добавляют 5 мл насыщенного раствора ацетата натрия и перемешивают
стеклянной палочкой. Затем измеряют рН индикаторной бумагой, значение рН должно
быть в интервале 4,5-5,0, если рН меньше 4,0 добавляют раствор ацетата натрия
для установления нужного рН. Если окраска не образуется - результат
отрицательный. При образовании розовой или красной окраски добавляют 5 мл
хлороформа и встряхивают. Если окраска переходит в слой хлороформа, а верхний
водный слой становится бесцветным или желтым - результат отрицательный. При
сохранении окрашивания водной фазы переносят 6-8 мл водного слоя в другую
пробирку, добавляют бутиловый спирт в соотношении 2:1 и встряхивают. Обычно
фазы разделяются быстро, в противном случае смесь центрифугируют. При переходе
окраски в бутиловый слой результат отрицательный, а если водная фаза остается
окрашенной - результат положительный для порфобилиногена.
Примечание. При хранении мочи свыше 3-х часов при комнатной температуре
реакция может быть ложноотрицательной, что, по-видимому, связано с превращением
порфобилиногена в порфирины и образованием ингибиторов реакции. Если нет
возможности исследовать мочу в первые 2-3 часа, ее хранят в холодильнике при 4˚С
или в замороженном состоянии. При хранении в холодильнике и доведении рН мочи
до 6,0-7,0 порфобилиноген стабилен длительное время.
Оформление работы. Отметить характер развившегося окрашивания, сделать
вывод о возможности практического использования данного определения.
Практическое значение работы. В норме порфобилиноген в моче не
обнаруживается (0,2 мг/л). Данным методом он выявляется при концентрации,
превышающей 6 мг/л ) при различных формах печеночных порфирий - острая
перемежающая, копропротопорфирия, наследственная копропорфирия).
Работа 75. Количественное определение содержания
дельта-аминолевулиновой кислоты в моче
Реактивы. Уксусная кислота ледяная; хлорная кислота 57%; натрия ацетат
3-х водный; дельта-аминолевулиновая кислота гидрохлорид; уголь активированный с
дисперсностью 0,25-1 мм; ацетил-ацетон; п-диметиламинобензальдегид; ацетатный
буфер рН 3,6*; взвесь угля*; реактив Эрлиха*; беззольные фильтры (синяя лента),
калибровочный раствор*.
Оборудование. Штатив с пробирками, пипетки вместимостью 0, 1, 2,0 и 10
мл; пробирки с притертыми пробками; спектрофотометр.
Материал. Моча. Хранится в холодильнике, рН мочи должен быть равен 6,0,
для чего добавляют на 10 мл мочи 0,1 мл ледяной уксусной кислоты.
Метод основан на способности дельта-аминолевулиновой кислоты
взаимодействовать с п-диметиламинобензальдегидом после удаления порфобилиногена
и других мешающих определению веществ с помощью активированного угля.
Интенсивность окрашивания пропорциональна концентрации данной кислоты в пробе.
Ход определения. К 1 мл мочи в пробирке с притертой пробкой добавляют 9
мл взвеси активированного угля в ацетатном буфере рН 3,6. Суспензию взбалтывают
1 минуту и фильтруют через бумажный фильтр. В две пробирки (контрольную и
опытную) отбирают по 2 мл фильтрата. В опытную пробу добавляют 0,05 мл
ацетилацетона, в контрольную - такое же количество ацетатного буфера.
Содержимое обеих пробирок тщательно перемешивают стеклянной палочкой. Затем
пробирки помещают на 20 минут в кипящую водяную баню, охлаждают, доводят объем
жидкости ацетатным буфером до 2 мл и в каждую пробирку добавляют по 2 мл
реактива Эрлиха, перемешивают. Через 15 минут спектрофотометрируют опытную
пробу против контрольной при длине волны 553 нм в кювете с толщиной слоя 1 см.
Окраска раствора стабильна в течение часа.
Расчет. Содержание дельта-аминолевулиновой кислоты проводят по
калибровочному графику, условия построения которого представлены в таблице.
|
№№ пробирки
|
Рабочий калибровочный
раствор, мл
|
Ацетатный буфер рН 3,6, мл
|
АЛК в пробе (2 мл)
|
|
|
|
мкг
|
мкмоль
|
|
1
|
0,1
|
4,9
|
0,04
|
0,0003
|
|
2
|
0,3
|
4,7
|
0,12
|
0,0009
|
|
3
|
0,5
|
4,5
|
0,20
|
0,0015
|
|
4
|
0,7
|
4,3
|
0,28
|
0,0021
|
|
5
|
1,0
|
4,0
|
0,40
|
0,0030
|
|
6
|
2,0
|
3,0
|
0,80
|
0,0060
|
Из каждой пробы отбирают по 2 мл раствора в две пробирки (контрольную и
опытную), которые обрабатывают как указано выше. По полученным данным строят
калибровочный график.
Расчет. При расчете рекомендуется проводить пересчет на 1 г креатинина,
т.к. диурез за сутки может быть различным.
Содержание АЛК в моче рассчитывают по формуле с использованием
калибровочного графика:
С·10
АЛК = ----- ,
А·2
где С - количество АЛК в пробе (мкмоль), найденное по калибровочному
графику;
А - содержание креатинина в пробе (г);
- коэффициент разведения мочи;
- объем фильтрата (мл).
Коэффициент пересчета микрограмм АЛК в микромоли - 0,0076.
Оформление работы. По полученным экстинкциям сделать расчет содержания
дельта-аминолевулиновой кислоты и вывод о причине возможных изменений.
Практическое значение работы. В норме содержание АЛК в моче 3,9-19
мкмоль/г креатинина (0,52-2,5 мг/г креатинина). Выделение аминолевулиновой
кислоты с мочой увеличивается при патологических процессах, связанных с
нарушением порфиринового обмена, а также при интоксикации свинцом, бензолом и
другими токсическими веществами.
Работа 76. Количественное определение содержания
копропорфирина в моче по методу Соулсби в модификации Римингтона
Реактивы. Уксусная кислота ледяная; эфир медицинский; соляная кислота 1,4
моль/л; йод, спиртовой раствор 0,039 моль/л; раствор йода в соляной кислоте
(200 объемов соляной кислоты и 1 объем спиртового раствора йода).
Оборудование. Штатив с пробирками; пипетки вместимостью 0,2; 2,0 и 5,0;
делительные воронки, спектрофотометр.
Материал. Свежевыделенная моча (срок хранения не более 3-х часов).
Метод основан на способности йода переводить копропорфириноген в
копропорфирин, который определяется спектрофотометрически по разнице оптической
плотности при трех длинах волн.
Ход определения. В делительную воронку вносят 2 мл мочи, 0,2 мл ледяной
уксусной кислоты, 5 мл эфира и встряхивают в течение 1 минуты. После разделения
фаз нижний водный слой отбрасывают. К эфирному слою, содержащему копропорфирин
и копропорфириноген, добавляют 5 мл раствора йода в соляной кислоте для
перевода копропорфириногена в копропорфирин, встряхивают в течение 1 минуты.
После разделения фаз нижний слой переносят в пробирку, термостатируют при 37˚С,
в течение 5 минут. Затем содержимое пробирки встряхивают и измеряют оптическую
плотность раствора в кюветах с толщиной слоя 1 см при трех длинах волн: 380,
402 и 430 нм против 1,41 моль/л раствора соляной кислоты.
Расчет проводят по формуле:
[2·E402 - (E430 + E380)] ∙ 2,093·1,52 нмоль/г креатинина
КП = --------------------------
А
где Е402, Е430, Е380 - оптическая плотность раствора при соответствующих
длинах волн;
А - содержание креатинина в пробе (г);
,52 - коэффициент пересчета микрограмм КП в наномоль;
,093 - коэффициент для расчета содержания КП, предложенный Римингтоном.
Оформление работы. По полученным результатам сделать расчет содержания
копропорфирина и сделать вывод о причине возможных изменений.
Практическое значение работы. В норме содержание копропорфирина в моче
30,5-122 нмоль/г креатинина (20-80 мкг/г креатинина). Повышение содержания
копропорфириа в моче наблюдается при наследственной копропорфирии, острой
перемежающейся порфирии, эритропоэтической уропорфирии, а также при циррозе,
гепатите, свинцовой интоксикации.
РЕГУЛЯТОРЫ
ОБМЕНА ВЕЩЕСТВ
К регуляторам метаболизма можно отнести витамины, гормоны,
гормоноподобные вещества и медиаторы. Свою функцию они осуществляют посредством
модификации активности ферментов или влияния на их количество в клетках.
Поэтому при исследовании данной группы биологических соединений применяют как
методы качественного и количественного анализа этих веществ и продуктов их
обмена, так и оценку состояния системы регуляторов организма по их действию на
соответствующие звенья метаболизма.
1. Исследование витаминов
Работа 77. Качественные реакции на витамины
Реактивы. Хлороформ; серная кислота, конц.; сульфаниловая кислота, 1%-ный
раствор; нитрит натрия, 5%-ный раствор, свежеприготовленный; карбонат натрия,
10%-ный раствор; азотная кислота, конц.; диэтилдитиокарбамат натрия, 2%-ный
спиртовой раствор; гидроксид натрия, 4%-ный спиртовой раствор; гидросульфит
натрия, порошок; хлорид железа (III), кристаллический; тиомочевина,
кристаллическая.
Оборудование. Штатив с пробирками; скальпель; весы аптечные с
разновесами; беззольные фильтры; флуороскоп.
Материал.
1. Рыбий жир.
2. Токоферол, 0,1%-ный спиртовой
раствор.
3. Витамин К, насыщенный раствор в
70%-ном этаноле.
4. Тиамин, порошок.
5. Рибофлавин, 0,002%-ный раствор.
6. Рибофлавинмононуклеотид, 0,1%-ный
раствор в ампулах, из которого готовят 0,002%-ный раствор.
7. Флавинат, лекарственный препарат в
ампулах, содержащий ФАД, 0,002%-ный раствор.
8. Чай сухой.
9. Витамин В12, раствор в ампулах.
а. Проба Друммонда на ретинол (витамин А). Метод основан на способности
концентрированной серной кислоты отнимать воду от ретинола с образованием
окрашенных продуктов.
Ход определения. В пробирку вносят 2 капли рыбьего жира, 5 капель
хлороформа и 1-2 капли концентрированной серной кислоты. Появляется голубое
окрашивание, переходящее в буро-красное.
б. Обнаружение кальциферола (витамин Д). Метод основан на взаимодействии
кальциферола с гидрохлоридом анилина с образованием окрашенных продуктов.
Ход определения. В сухую пробирку помещают 10 капель анилинового реактива
и прибавляют 5 капель рыбьего жира. Содержимое пробирки осторожно при
постоянном перемешивании нагревают до кипения и кипятят в течение 30 с. В
присутствии витамина Д желтая эмульсия приобретает вначале грязно-зеленое, а
затем буро-красное или красное окрашивание.
в. Качественная реакция на токоферол (витамин Е). Метод основан на
образовании соединений хиноидной структуры, окрашивающихся в красный цвет, при
действии сильных окислителей (концентрированной азотной кислоты) на токоферол.
Ход определения. В сухую пробирку вносят 5 капель спиртового раствора
токоферола и добавляют 10 капель концентрированной азотной кислоты.
Встряхивают. Наблюдают за развитием красного окрашивания.
г. Качественная реакция на нафтохинон (витамин К). Метод основан на
взаимодействии диэтилдитиокарбамата с витамином К в щелочной среде с
образованием комплекса голубого цвета.
Ход определения. В пробирку вносят 4 капли спиртового раствора
диэтилдитиокарбамата натрия и 4 капли раствора гидроксида натрия. Встряхивают и
наблюдают за развитием окраски.
д. Обнаружение тиамина (витамин В1). Метод основан на способности тиамина
образовывать с диазофенилсульфоновой кислотой комплекс оранжево-красного цвета
в щелочной среде.
Ход определения. В пробирку вносят 5 капель раствора сульфаниловой
кислоты и прибавляют 5 капель раствора нитрита натрия. К полученному
диазореактиву добавляют на кончике скальпеля порошок тиамина и 5 капель
раствора карбоната натрия. Встряхивают. Появляется оранжево-красное
окрашивание.
е. Обнаружение рибофлавина (витамин В2 и флавиновых коферментов. Метод
основан на способности окисленных форм рибофлавина и флавиновых коферментов
(ФМН и ФАД) давать в ультрафиолетовом свете желто-зеленую флуоресценцию,
интенсивность которой зависит от их концентрации. Восстановленные формы
флавинов не флуоресцируют.
Ход определения. В одну пробирку вносят 10 капель раствора рибофлавина, в
другую - рибофлавинмононуклеотида, в третью - флавината, приливают в каждую из
них по 5 мл воды и перемешивают встряхиванием. Ставят пробирки в штатив
флуороскопа и сравнивают интенсивность флуоресценции трех проб.
Прибавляют в каждую пробирку на кончике скальпеля порошок гидросульфита
натрия (восстановитель) и наблюдают за гашением флуоресценции.
ж. Качественная реакция на рутин (витамин Р). Метод основан на
взаимодействии рутина с хлоридом железа (III) с образованием комплексного
соединения зеленого цвета.
Ход определения. На аптечных весах берут навеску 100 мг чая, добавляют 15
мл дистиллированной воды и кипятят в течение 3 мин. Дают остыть, отбирают в
пробирку 1 мл жидкости и добавляют несколько кристалликов хлорида железа (III).
Перемешивают и разводят в 2-3 раза дистиллированной водой. Развивается зеленое
окрашивание.
з. Качественная реакция на цианкобаламин. Метод основан на способности
кобальта, входящего в состав витамина В12, при высокой температуре взаимодействовать
с тиомочевиной с образованием комплекса зеленого цвета.
Ход определения. На беззольный фильтр наносят 2-3 капли 10%-ного раствора
тиомочевины, высушивают на газовой горелке, после чего наносят 1-2 капли
раствора витамина В12 и снова высушивают. Образуется зеленое кольцо.
Оформление работы. Все результаты качественных реакций на витамины
оформить в виде таблицы.
|
№ опыта
|
Материал
|
Исследуемый витамин
|
Реакция
|
Наблюдаемая окраска
|
Практическое значение работы. Качественные реакции на витамины позволяют
обнаружить их наличие в лекарственных препаратах и после экстракции в пищевых
продуктах и лекарственных растениях. Принцип, положенный в основу качественных
реакций на витамины, используется при разработке количественного определения их
в различных природных объектах и лекарствах.
Работа 78. Определение содержания тиамина и
рибофлавина флуориметрическим методом в поливитаминных препаратах
Реактивы. Соляная кислота, 0,1 М раствор; окислительная смесь*;
Н-бутанол; этанол, 96%-ный; тиамин, стандартный раствор концентрации 10 мкг/мл;
уксусная кислота, ледяная; перманганат калия, 4%-ный раствор; гидроксид
водорода, 3%-ный раствор; гидросульфит натрия, порошок; рибофлавин, стандартный
раствор концентрации 0,005 мг/мл.
Оборудование. Штатив с пробирками; пенициллиновые флакончики с
полиэтиленовыми пробками; пипетки вместимостью 1 и 5 мл; мерный цилиндр
вместимостью 50 мл; ступка с пестиком; флуориметр ЭФ-3 или БИАН.
Материал. Драже поливитаминов.
а. Определение содержания тиамина. Метод основан на способности тиамина
окисляться гексацианоферратом (III) калия в щелочной среде в тиохром, который
после извлечения его из раствора бутиловым спиртом дает в ультрафиолетовом
свете сине-голубую флуоресценцию:
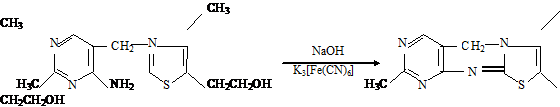
Ход
определения. Драже поливитаминов разминают в ступке, добавляя 30 мл раствора
соляной кислоты, и тщательно перемешивают.
В
один флакончик (контроль) вносят 5 мл соляной кислоты, во второй (опыт) - 1 мл
водного экстракта драже витаминов и 4 мл дистиллированной воды, в третью (стандарт)
- 5 мл раствора тиамина.
Во все флакончики приливают по 1,5 мл окислительной смеси и осторожно
встряхивают их до полного перемешивания. Затем добавляют в них по 5 мл
бутанола, плотно закрывают пробками и интенсивно встряхивают 5 мин. После
расслоения жидкости осторожно прибавляют по 0,5 мл этанола (для просветления
бутанола).
Осторожно сливают просветленный бутанольный слой в кювету флуориметра и
измеряют интенсивность флуоресценции опытной и контрольной проб со стандартным
раствором тиамина.
Расчет проводят по формуле
(Еоп - Ек)0,01·1·5,5
х = ---------- ,
Ест30
где х - содержание тиамина в драже, мг;
Еоп - показания флуориметра для опытной пробы;
Ек - показания флуориметра для контрольной пробы;
Ест - показания флуориметра для стандартной пробы;
,01 - концентрация тиамина в стандартном растворе, мг/мл;
- объем экстракта драже, мл;
- объем экстракта, взятого на исследование, мл;
,5 - объем пробы, просветленной этанолом, мл.
б. Определение содержания рибофлавина. Принцип метода см. работу 73, е.
Ход определения. Драже поливитаминов разминают в ступке, добавляя 30 мл
раствора соляной кислоты, и тщательно перемешивают.
В одну пробирку вносят 7 мл дистиллированной воды, во вторую (опытную) -
2 мл экстракта драже и 5 мл дистиллированной воды, в третью (стандартная) - 1
мл стандартного раствора рибофлавина и 6 мл воды.
Во все пробирки приливают по 10 капель ледяной уксусной кислоты и по 1,5
мл раствора перманганата калия (для окисления посторонних флуоресцирующих
веществ).
Содержимое пробирок встряхивают и добавляют по каплям (примерно 5 капель)
гидроксид водорода при постоянном помешивании стеклянной палочкой до полного
просветления жидкости. Растворы отстаивают 5 мин, до прекращения выделения
пузырьков газа. Сливают жидкость в кюветы флуориметра и измеряют интенсивность
флуоресценции всех проб.
Расчет проводят по формуле
(Еоп - Ек)2·0,005·7
х = ---------- ,
Ест30
где х - содержание рибофлавина в драже, мг;
Еоп - показания флуориметра для опытной пробы;
Ек - показания флуориметра для контрольной пробы;
Ест - показания флуориметра для стандартной пробы;
- объем экстракта драже, мл;
- объем экстракта драже, взятого на исследование, мл;
,005 - концентрация рибофлавина в стандартном растворе, мг/мл;
- объем флуориметрируемых проб, мл.
Оформление работы. Рассчитать содержание исследуемых витаминов в драже и
сделать вывод о возможности практического использования флуориметрического
метода.
Практическое значение работы. Флуориметрические методы определения
тиамина и рибофлавина применяются для определения этих витаминов в пищевых
продуктах, лекарственных растениях и готовых лекарственных препаратах, а также
для изучения обеспеченности ими организма. Обеспеченность этими витаминами
может быть определена по их уровню в крови и по экскреции с мочой. Низкое
содержание витаминов в организме наблюдается при гиповитаминозах, болезнях
печени, сердечно-сосудистых заболеваниях, заболеваниях желудочно-кишечного
тракта и других патологических состояниях.
Работа 79. Количественное определение
аскорбиновой кислоты в лекарственных растениях
Реактивы. Соляная кислота, 2%-ный раствор; 2,6 дихлорфенолиндофенол,
0,001 М раствор.
Оборудование. Пипетки вместимостью 5 и 10 мл; мерная колба вместимостью
100 мл; воронка; вата; аптечные весы с разновесами; микробюретка; скальпель;
ступки с пестиком; стаканчики для титрования.
Материал.
1. Лекарственное сырье (цветы бузины и
тысячелистника, лист крапивы и сенны, кора крушины, витаминный чай, плоды
шиповника).
2. Таблетки из плодов аронии
черноплодной.
Метод основан на способности аскорбиновой кислоты к
окислительно-восстановительным превращениям. В ходе окисления аскорбиновой
кислоты происходит восстановление 2,6-дихлорфенолиндофенола с образованием его
лейкоформы. На полное окисление аскорбиновой кислоты в растворе указывает
появление розового окрашивания при небольшом избытке 2,6-дихлорфенолиндофенола
в кислой среде
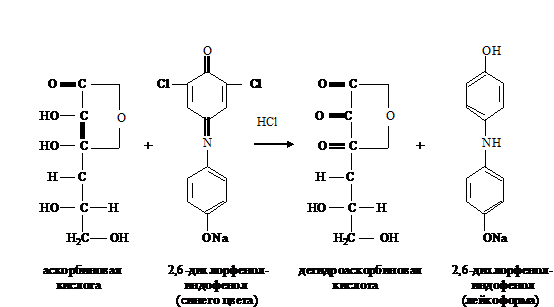
Ход
определения. На аптечных весах берут навески лекарственного сырья: цветы
бузины, лист крапивы, цветы тысячелистника, кора крушины, лист сенны,
витаминный чай и плоды аронии черноплодной (или таблетки) по 0,5 г; шиповник,
очищенный от семян, - 0,2 г. Исследуемый материал переносят в ступку,
измельчают скальпелем и растирают в ступке с 5 мл раствора соляной кислоты.
Вытяжку фильтруют через тонкий слой ваты в мерную колбу, вместимостью 100
мл.
Извлечение витамина С из той же навески повторяют три раза с таким же
объемом соляной кислоты, фильтруя каждый раз полученную вытяжку в ту же мерную
колбу. Содержимое колбочки доводят до метки дистиллированной водой,
перемешивают.
Для определения отбирают 10 мл вытяжки в стаканчик и титруют содержимое
раствором 2,6-дихлорфенолиндофенола, налитого в микробюретку, до появления
розового окрашивания, не исчезающего в течение 30 с.
Расчет проводят по формуле:
0,088V100·1000
х = ---------- ,
10b
где х - содержание аскорбиновой кислоты, мг/кг;
,088 - масса аскорбиновой кислоты, соответствующая 1 мл 0,001 М раствора
2,6-дихлорфенолиндофенола, мг;
- разведение взятой пробы;
- коэффициент пересчета на 1 кг сырья;
- объем жидкости, взятый для титрования, мл;- объем
2,6-дихлорфенолиндофенола, пошедший на титрование, мл;- навеска исследуемого
материала, г.
Оформление работы.
Полученные данные оформить в виде таблицы и сделать вывод о значении
исследованного растительного материала как источника аскорбиновой кислоты.
Указать в выводе о целесообразности применения растительного сырья с
целью профилактики С-витаминной недостаточности.
|
Материал
|
Навеска, г
|
Объем
2,6-дихлорфенолиндофенола, пошедшего на титрование, мл
|
Содержание аскорбиновой
кислоты, мг/кг
|
Практическое значение работы. Определение содержания аскорбиновой кислоты
в пищевых продуктах и лекарственных растениях необходимо для составления
правильного рациона, удовлетворяющего потребность организма в этом витамине.
Богаты витамином С плоды шиповника, черной смородины, цитрусовых и т.д.
Аскорбиновая кислота применяется для профилактики гиповитаминоза и простудных заболеваний,
для лечения воспалительных процессов, атеросклероза. Она способствует усилению
регенеративных процессов. Определение аскорбиновой кислоты в крови и моче
используется для выявления состояния гиповитаминоза. Аскорбиновая кислота
участвует в окислительно-восстановительных процессах при синтезе стероидных
гормонов, обмене ароматических аминокислот, образовании соединительной ткани.
2. Исследования гормонов, медиаторов и их
метаболитов
В клинико-биохимических лабораториях и фармации используются методы
качественного и количественного анализа для определения гормонов, включая и
гормоноиды, и медиаторов в биологическом материале и лекарствах.
В то же время отклонения в содержании гормонально-медиаторных соединений
регистрируют по нарушению регулируемых ими звеньев в обмене веществ.
Работа 80. Качественные реакции на
белково-пептидные гормоны
Реактивы. Биуретовый реактив*; нингидрин, 0,5%-ный водный раствор;
гидроксид натрия, 20%-ный раствор; ацетат свинца, 5%-ный раствор.
Оборудование. Глазные пипетки; штатив с пробирками.
Материал.
1. Инсулин для инъекций.
2. Окситоцин для инъекций.
Принцип метода и ход определения см. работу 1, а, б, е.
Берут шесть пробирок и вносят в три из них по 5 капель инсулина, а в три
другие - по 5 капель окситоцина. Проделывают с ними биуретовую, нингидриновую
реакции и реакцию Фоля, как описано в работе 1, а, б, е.
Оформление работы. Данные занести в таблицу.
|
Препараты гормонов
|
Реакции
|
Выявляемая группа
|
Результат
|
В выводах отметить присутствие соответствующих групп и аминокислот в
исследуемых гормональных препаратах.
Работа 81. Качественные реакции на гормоны -
производные аминокислот
Реактивы. Хлорид железа (III), 0,15 М раствор; сульфаниловая кислота,
1%-ный раствор; нитрит натрия, 5%-ный раствор; карбонат натрия, 10%-ный
раствор; гексацианоферрат (III) калия K3[Fe(CN)6] 0,2%-ный раствор; гидроксид
натрия, 5 М раствор; аскорбиновая кислота, кристаллическая; азотная кислота,
конц.; иодат калия KIO3, 1%-ный раствор; хлороформ.
Оборудование. Штатив с пробирками; глазные пипетки; стеклянные палочки;
водяная баня; флуороскоп.
Материал.
1. Адреналин, 0,1%-ный раствор в
ампулах.
2. Тиреоидин, порошок.
а. Реакция на адреналин с хлоридом железа (III). Метод основан на
способности пирокатехиновой группировки адреналина образовывать с хлоридом
железа (III) комплексное соединение изумрудно-зеленого цвета.
Ход определения. В пробирку приливают 10 капель раствора адреналина и
добавляют 1 каплю раствора хлорида железа (III). Наблюдают появление
характерного окрашивания.
б. Реакция на адреналин с диазобензолсульфокислотой. Метод основан на
способности адреналина образовывать с диазобензолсульфокислотой соединение
красного цвета.
Ход определения. Для получения диазобензолсульфокислоты в пробирку
наливают по 3 капли раствора сульфаниловой кислоты и нитрита натрия,
перемешивают встряхиванием. Затем в пробирку добавляют 5 капель раствора
адреналина и 3 капли раствора карбоната натрия. Содержимое перемешивают
встряхиванием и наблюдают за развитием характерной окраски.
в. Обнаружение адреналина по образованию флуоресцирующего продукта его
окисления - адренолютина. Метод основан на способности адреналина окисляться
под действием K3[Fe(CN)6] в адренохром, из которого в щелочной среде образуется
адренолютин, имеющий желто-зеленую флуоресценцию:
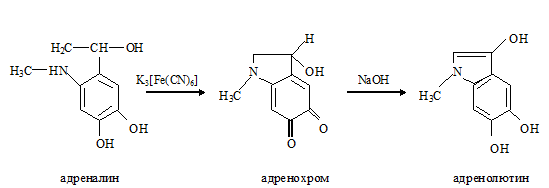
Ход
определения. В две пробирки вносят по 1 капле исходного раствора адреналина и
добавляют в одну из них 5, а во вторую 10 мл воды. Перемешивают стеклянной
палочкой.
В
две другие пробирки отмеривают по 4 мл разведенных растворов адреналина,
приливают по 0,3 мл раствора K3[Fe(CN)6] и оставляют стоять 5 мин (при этом
адреналин окисляется в адренохром).
В
каждую пробирку прибавляют на кончике скальпеля кристаллической аскорбиновой
кислоты и по 4 мл раствора гидроксида натрия. Содержимое перемешивают
стеклянной палочкой (аскорбиновая кислота препятствует дальнейшему окислению
адренохрома, а гидроксид натрия способствует превращению его в адренолютин).
Пробирки
помещают в штатив флуороскопа и сравнивают интенсивность характерной
флуоресценции в пробах.
г.
Обнаружение иодтиронинов. Метод основан на отщеплении при кислотном гидролизе
тиреоидных гормонов (иодтиронины) иодистоводородной кислоты
Иодтиронины
HIO3
(тироксин,
HI + Продукты гидролиза
трииодтиронин)
нагревание
при
взаимодействии которой с иодатом калия выделяется свободный иод:
HI
+ KIO3 + HNO3 → 3I2 + KNO3 + 3H2O
В
хлороформе иод имеет фиолетовую окраску.
Ход
определения. В пробирку помещают несколько кристаллов тиреоидина, добавляют 10
капель концентрированной азотной кислоты и нагревают 3-5 мин в кипящей водяной
бане. Затем приливают 20 капель раствора иодата калия. Содержимое перемешивают
и охлаждают.
В
пробирку добавляют 15 капель хлороформа. Встряхивают и отмечают характерную
окраску хлороформа.
Оформление
работы. Данные занести в таблицу.
|
Исследуемый гормон
|
Реакция
|
Результат
|
В выводе отметить возможность практического использования этих реакций.
Работа 82. Качественные реакции на стероидные
гормоны и их метаболиты
Реактивы. Серная кислота, конц.; гидроксид натрия, 30%-ный раствор;
реактив Фолина; м-динитробензол, 2%-ный раствор в 96%-ном этаноле.
Материал. Фолликулин (эстрон), 0,1%-ный масляный раствор для инъекций в
ампулах. (Для приготовления спиртового раствора содержимое 5 ампул фолликулина
выливают в делительную воронку, содержащую 50 мл этанола. Воронку встряхивают и
после расслоения фаз нижний, масляный слой отбрасывают, а для исследования
используют верхний - спиртовой раствор).
а. Реакция на фенольную группу эстрона (фолликулин) с серной кислотой.
Метод основан на взаимодействии эстрона и серной кислоты с образованием
соединения, имеющего соломенно-желтый цвет, переходящий при нагревании в
оранжевый.
Ход определения. В сухую пробирку вносят 5 капель спиртового раствора
фолликулина и помещают ее на 5 мин в кипящую водяную баню (для испарения
спирта).
Добавляют в пробирку 1 мл концентрированной серной кислоты и ставят ее на
5-10 мин в кипящую водяную баню. Наблюдают за изменением окрашивания
содержимого пробирки.
б. Реакция на фенольную группу эстрона (фолликулин) с реактивом Фолина.
Принцип метода см. работу 58.
Ход определения. В пробирку вносят 5 капель спиртового раствора
фолликулина и добавляют по 2 капли раствора гидроксида натрия и реактива
Фолина. Наблюдают за появлением синего окрашивания, обусловленного наличием
фенольной группы в молекуле эстрона.
в. Реакция на 17-кетогруппу эстрона (фолликулин) и на 17-кетостероиды,
содержащиеся в моче. Метод основан на способности 17-кетостероидов образовывать
с м-динитробензолом в щелочной среде продукты конденсации вишнево-красного
цвета.
Ход определения. В одну пробирку вносят 5 капель спиртового раствора
фолликулина, в другую - 5 капель мочи и добавляют в них по 5 капель растворов
гидроксида натрия и м-динитробензола. Перемешивают содержимое встряхиванием и
наблюдают за развитием характерного окрашивания.
Оформление работы. Данные занести в таблицу. В выводе указать на
возможность использования реакции для определения стероидных гормонов.
|
Материал
|
Выявляемая группа
|
Реакция
|
Окрашивание
|
Практическое значение работы. Специфические реакции на гормоны разной
структуры используются для их количественного определения и при анализе
гормональных препаратов в контрольно-аналитических лабораториях. Определение
продуктов обмена стероидных гормонов 17-кетостероидов используется в клинике
для оценки функционального состояния коры надпочечников и половых желез. К
17-кетостероидам относятся эстрон и андростерон; часть их образуется из
17-гидроксистероидов (кортизол, кортизон) в коре надпочечников. В норме
содержание 17-кетостероидов в суточной моче составляет у мужчин 0,10-0,16 г, у
женщин 0,06-0,13 г. В состоянии стресса (напряжения) повышается содержание кортикостероидов
в крови и увеличивается выделение их с мочой.
Работа 83. Регуляция инсулином и адреналином
уровня глюкозы в крови животных
Реактивы. Цитрат натрия, 10%-ный раствор; хлорид натрия, 9 г/л раствор;
этанол, 70%-ный.
Оборудование. Шприцы; инъекционные иглы; ножницы; вата; микропипетки;
весы. Остальные реактивы и оборудование как в работе 46.
Материал.
1. Инсулин во флаконах для инъекций, 40
ЕД/мл.
2. Адреналин, 0,1%-ный раствор для
инъекций.
Объект исследования. Кролики.
Метод основан на определении в динамике содержания глюкозы в крови после
введения инсулина или адреналина. Концентрация глюкозы в крови измеряется
о-толуидиновым методом, описанным в работе 48.
Ход определения. Для взятия крови берут двух кроликов, голодавших 12 ч.
Их взвешивают, выстригают шерсть на ухе, находят краевую вену, зажимают ее
пальцем у основания уха. После того, как вена наполнится кровью, ее прокалывают
инъекционной иглой и вытекающие капли крови собирают на часовом стекле,
смоченном раствором цитрата натрия (чтобы кровь не свернулась). Набирают
примерно 0,5 мл крови, ранку на ухе кролика зажимают ватным тампоном, смоченным
этанолом, в течение полминуты.
Одному кролику вводят раствор инсулина, разведенный хлоридом натрия из
расчета 1,5 ЕД на 1 кг массы тела, а другому - раствор адреналина из расчета
0,35 мл на 1 кг массы тела. Через 30 и 60 мин у обоих кроликов забирают кровь,
как описано выше.
Микропипеткой отбирают по 0,1 мл крови, взятой перед опытом и через 30 и
60 мин после введения инсулина и адреналина. Определяют содержание глюкозы в
крови по методике, описанной в работе 46.
Примечание. После введения инсулина постоянно наблюдают за кроликом, так
как большая доза инсулина может вызвать резкое снижение содержания сахара в
крови и привести к смерти. Если у кролика начнутся признаки судорог, следует
немедленно ввести 1 мл адреналина. По окончании опыта кролику вводят 20 мл
20%-ного стерильного раствора глюкозы под кожу.
Оформление работы. Полученные результаты занести в таблицу и построить
график зависимости содержания глюкозы в крови от вводимых гормонов и времени их
действия.
|
Гормон
|
Доза гормона
|
Время взятия крови после
введения гормона
|
Содержание глюкозы в крови
|
В выводах отметить разницу в действии инсулина и адреналина на уровень
глюкозы в крови животных и практическое значение работы.
Практическое значение работы. Инсулин и адреналин регулируют содержание
глюкозы в крови, что позволяет по изменению ее концентрации судить об эффекте
данных гормональных препаратов. В фармации это используют для стандартизации заводских
препаратов инсулина и контроля его качества. Гипогликемическое действие
инсулина используют для лечения больных сахарным диабетом, а адреналин
применяют при гипогликемических состояниях, в частности, вызванных
передозировкой инсулина.
Работа 84. Количественное определение гистамина
в крови с диазотированным n-нитроанилином по Н.В. Климкиной и С.И. Плитману
Реактивы. Диазотированный n-нитроанилин (готовят перед употреблением из
0,1%-ного раствора n-нитроанилина в 0,1 М соляной кислоте, добавляют к 10 мл
охлажденного на льду раствора n-нитроанилина 1 мл 4%-ного раствора нитрита
натрия); гистамин, стандартный раствор концентрации 200 мкмоль/л; карбонат
натрия, 20%-ный раствор; гидроксид натрия, 5 М раствор; трихлоруксусная
кислота, 10%-ный раствор; универсальная индикаторная бумага.
Оборудование. Штатив с пробирками; воронка с бумажным фильтром;
стеклянные палочки; водяная баня; пипетки вместимостью 1 и 5 мл; ФЭК.
Материал. Цельная кровь крысы или кролика, осажденная 10%-ным раствором
трихлоруксусной кислоты в отношении 1:9 для экстракции гистамина (выдерживается
в холодильнике в течение суток).
Метод основан на взаимодействии между гистамином и диазотированным
n-нитроанилином с образованием соединения оранжево-красного цвета.
Ход определения. Трихлоруксусный экстракт крови фильтруют через бумажный
фильтр. В одну пробирку отмеривают 2 мл фильтрата (опыт), в другую - 0,2 мл
стандартного раствора гистамина и 1,8 мл дистиллированной воды (стандарт). В
обе пробы прибавляют по 3 мл дистиллированной воды и 1 мл раствора нитрита
натрия. Пробирки тщательно встряхивают и ставят на 2 мин в кипящую водяную
баню.
Затем пробирки охлаждают под струей водопроводной воды и к охлажденным
пробам добавляют по 1 мл диазотированного n-нитроанилина. Тщательно
перемешивают пробы и доводят их рН до 10,0 по универсальной индикаторной
бумаге, прибавляя сначала 1,5 мл, а затем 0,5 мл раствора карбоната натрия.
Содержимое пробирок перемешивают, охлаждают под струей водопроводной воды и
прибавляют 2-3 капли раствора гидроксида натрия до развития окрашивания.
Экстинкцию опытной и стандартной проб измеряют на ФЭКе при 520-540 нм
(зеленый светофильтр) в кювете с толщиной слоя 0,5 см против контроля на
реактивы (10 мл дистиллированной воды, по 2 мл растворов нитрита натрия и
диазотированного n-нитроанилина, 4 мл раствора карбоната натрия перемешивают и
приливают 0,6 мл раствора гидроксида натрия).
Расчет проводят по формуле
Еоп200
х = ----- ,
Ест
где х - концентрация гистамина в цельной крови, мкмоль/л;
Еоп - экстинкция опытного раствора;
Ест - экстинкция стандартного раствора;
- концентрация стандартного раствора гистамина, мкмоль/л.
Оформление работы. Рассчитать содержание гистамина в крови и сделать
вывод о возможных причинах изменения его уровня. В выводе отразить практическое
значение определения гистамина в крови.
Практическое значение работы. Гистамин относится к биогенным аминам. Он
играет роль тканевого регулятора и медиатора в нервной системе. Гистамин
усиливает проницаемость стенок кровеносных сосудов, стимулирует функцию желез
желудка (выработку соляной кислоты), сократительную деятельность матки и т.д.
Избыточное содержание гистамина в организме ведет к вегетативным нарушениям и
аллергическим реакциям. Определение гистамина в практике используется для исследования
уровня его в крови и тканях животных при действии на них аллергенных веществ.
Содержание гистамина в крови имеет видовые колебания. В крови лабораторных
животных (крысы, кролики) его концентрация составляет 90-220 мкмоль/л, а у
здорового человека его содержится 0,02-0,04 мкмоль/л.
В контрольно-аналитических лабораториях этот метод применяется для
контроля качества заводских препаратов гистамина в ампулах, выпускаемых в виде
0,1%-ного раствора.
ИССЛЕДОВАНИЕ
БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ
Состояние биохимических процессов в тканях и органах оценивается прямым и
косвенным способом. В первом случае для этой цели берутся на исследование
кусочки ткани (биоптаты), а во втором, который более приемлемым для клиники, -
биологические жидкости, главным образом кровь и моча.
Кровь является жидкой тканью организма, состоящей из клеток и плазмы.
Обмен веществ клеток крови частично отражает общие закономерности метаболизма,
по которым можно судить о его сдвигах в других тканях. Однако форменные
элементы крови выполняют также специальные функции, для оценки которых изучают
соответствующие биохимические показатели. Составные компоненты плазмы (белки,
небелковые органические и минеральные вещества) дают необходимую информацию о
функциях собственно крови (транспортной, регуляторной и т.д.) и об изменениях
метаболизма, произошедших в разных тканях.
Биохимические исследования мочи позволяют судить об изменениях не только
в выделительной и мочеобразовательной функциях почек, но и об обмене веществ в
других органах и организме в целом.
1. Биохимические исследования крови
Работа 85. Определение содержания гемоглобина в
крови по его светопоглощению
Реактивы. Гидроксид аммония, 0,4 г/л раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1 и 10 мл; ФЭК.
Материал. Кровь, взятая из пальца обследуемого.
Метод основан на измерении при 450 нм светопоглощения содержащегося в
крови гемоглобина, которое пропорционально его концентрации.
Ход определения. В пробирку отмеривают 8 мл раствора гидроксида аммония.
Микропипеткой берут из пальца обследуемого 0,05 мл крови и вносят ее в
пробирку. Микропипетку трижды ополаскивают этим же раствором, тщательно
перемешивают содержимое, при этом происходит полный гемолиз эритроцитов и
просветляется жидкость. Пробирку встряхивают 2-3 мин для полного
оксигенирования гемоглобина.
Определяют экстинкцию гемолизированной крови против воды на ФЭКе при 540
нм (светофильтр зеленый) в кювете с толщиной слоя 0,5 см.
Расчет. Содержание гемоглобина в крови определяют по калибровочному
графику, построенному по серии растворов кристаллического гемоглобина с
известными концентрациями.
Оформление работы. По полученным экстинкциям определить содержание
гемоглобина в крови (в г/л), сделать вывод о возможном изменении количества
гемоглобина и указать вероятные его причины.
Практическое значение работы. Нормальное содержание гемоглобина у
взрослого человека составляет у мужчин 130-160 г/л, у женщин 120-140 г/л. У
новорожденных концентрация гемоглобина выше, чем у взрослых, а к концу первого
года жизни она уменьшается до 110 г/л и вновь достигает уровня взрослого
человека в период половой зрелости. Пониженное содержание гемоглобина (анемия)
наблюдается при кровопотерях, недостатке железа в организме, дефиците витамина
В12 и фолиевой кислоты, при отравлении лекарствами и токсическими веществами,
вызывающими гемолиз эритроцитов (гемолитическая анемия) и т.д. Высокое
содержание гемоглобина (200 г/л и выше) имеет место при повышенном количестве
эритроцитов в крови (полицитемия).
Работа 86. Определение содержания фетального
гемоглобина в эритроцитах крови человека
Реактивы. Раствор ферриацетонциангидрата*; раствор ацетонциангидрина*;
денатурирующий раствор едкого натрия*; осаждающий раствор сульфата аммония
(3,28 моль/л)*.
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 0,2 и 5,0
мл; центрифуга с центрифужными весами; секундомер; обеззоленные фильтры;
спектрофотометр или фотоколориметр.
Материал. Гепаринизированная кровь.
Метод основан на способности ацетонциангидрина в присутствии раствора
гемоглобина образовывать цианметгемоглобин (гемоглобинцианид), интенсивность
окрашивания которого пропорциональна содержанию гемоглобина в пробе.
Ход определения. Кровь в количестве 1-2 мл, полученную при наличии
гепарина, центрифугируют при 3000 об/мин в течение 10 минут. После
центрифугирования плазму сливают и оставшийся осадок эритроцитов отмывают 8-10
объемами изотонического раствора хлористого натрия. Центрифугируют при 3000
об/мин в течение 10 минут и отсасывают супернатант. Из полученных эритроцитов
готовят эритроцитарную массу путем разведения физиологическим раствором в
отношении 1:1, которая и используется для получения гемолизата. С этой целью к
0,2 мл эритроцитарной взвеси добавляют 5 мл раствора ферриацетонциангидрина. В
полученном гемолизате проводят определение содержания общего и фетального
гемоглобина. При определении общего гемоглобина через 15 минут к 0,1 мл
полученного гемолизата добавляют 5 мл раствора ацетонциангидрина. При
определении фетального гемоглобина к 3,0 мл гемолизата добавляют 0,2 мл гидроксида
натрия (для денатурации нормального гемоглобина) и выдерживают точно 2 минуты
(по секундомеру) при температуре 22-24˚С и затем добавляют 3,2 мл раствора
сульфата аммония. Пробирку встряхивают несколько раз и через 10 минут
содержимое фильтруют через двойной обеззоленный фильтр диаметром 9 см.
Растворы общего и фетального гемоглобина фотометрируют на
спектрофотометре при длине волны 420 нм.
В качестве контроля служат: для определения общего гемоглобина - раствор
ацетонциангидрина, для определения фетального гемоглобина - 0,2 мл гидроксида
натрия и 3,2 мл сульфата аммония.
Расчет проводится по формуле
фетал.Нв∙(6,4/3,0)∙100
%Нв = -------------- ,
общий Нв∙51
где 6,4 - конечный объем фетального гемоглобина после денатурации
гидроксидом натрия и осаждения сульфатом аммония;
,0 - исходный объем гемолизата, содержащий общий гемоглобинцианид;
- фактор разбавления общего гемоглобинцианида;
- перевод в проценты.
Оформление работы. По экстинкции рассчитать содержание фетального
гемоглобина, сравнить с нормой и сделать вывод о возможных отклонениях.
Практическое значение работы. В норме содержание фетального гемоглобина в
эритроцитах составляет 0,75-0,97%. Повышение фетального гемоглобина является
важным критерием для диагностики бета-талассемии, при которой одновременно
повышается и содержание гемоглобина А2. Особенно высокое содержание фетального
гемоглобина может быть при гомозиготной бета-талассемии до 20-90%. При
гетерозиготной форме бета-талассемии содержание фетального гемоглобина может
быть нормальным или умеренно повышенным - 2,57%.
Следует отметить, что увеличение содержания фетального гемоглобина однако
не является специфичным для бета-талассемии. Оно встречается и при других
состояниях: гемолитических анемиях, железодефицитной гипопластической анемии,
лейкозах и других состояниях, сопровождающих гипоксией, что вероятно, связано с
компенсаторными процессами.
Работа 87. Определение содержания
гликозилированного гемоглобина в эритроцитах крови фотоколориметрическим методом
Реактивы. 40%-ный раствор трихлоруксусной кислоты; 1 М раствор щавелевой
кислоты; 0,05 М раствор тиобарбитуровой кислоты; 0,04%-ный раствор гидроксида
аммония; 0,9%-ный раствор хлорида натрия.
Оборудование. Центрифуга лабораторная; ФЭК (спектрофотометр); водяная
баня; термостат; пробирки с плотно притертыми пробками.
Материал. Кровь забирают натощак из локтевой вены. Добавляют гепарин из
расчета 5ед/1мл для предотвращения свертывания. Эритроциты отделяют от плазмы
центрифугированием 3000 об/мин в течение 10 минут и трехкратно отмывают
физиологическим раствором. Затем к суспензии эритроцитов добавляют
дистиллированную воду и 1-2 капли хлороформа для гемолиза.
Метод основан на способности 5-гидроксиметилфурфурола, образующегося из
углеводного компонента гликозилированного гемоглобина при его кислотном
гидролизе, образовывать с тиобарбитуровой кислотой окрашенное соединение,
интенсивность окраски которого пропорциональна содержанию гликозилированного
гемоглобина в эритроцитах.
Ход определения.
1. Определение концентрации гемоглобина
в гемолизате.
В пробирку внести 8 мл раствора аммиака и добавить 0,05 мл гемолизата
(микропипеткой, многократно промывая ее раствором аммиака). Встряхивать 2
минуты, после чего определить экстинкцию на ФЭКе (длина волны 540 нм, зеленый
светофильтр) против раствора аммиака. Содержание гемоглобина в гемолизате в г/л
определяют по калибровочному графику.
2. Определение процентного содержания
гликозилированного гемоглобина.
В пробирку внести объем гемолизата, содержащего 10 мг гемоглобина,
довести до 1 мл 0,9% раствором хлорида натрия, добавить 1 мл 1 М щавелевой
кислоты, плотно закрыть пробкой и инкубировать в термостате при 100˚С в
течение 5 часов.
Пробирку охладить, внести 1 мл 40% раствора трихлоруксусной кислоты,
тщательно перемешать и центрифугировать 10 минут при 3000 оборотов в минуту.
В чистую пробирку отобрать 2 мл надосадочной кислоты, перемешать и
инкубировать 40 минут на водяной бане при 40˚С, после чего фотометрируют
при длине волны 443 нм против дистиллированной воды.
Содержание гликозилированного гемоглобина (в % от общего) определяют по
калибровочному графику.
Практическое значение работы. Содержание гликозилированного гемоглобина в
норме составляет от 3 до 5,5% от общего. Известно, что уровень
гликозилированного гемоглобина может являться показателем уровня гликемии за
предшествующие 2-3 месяца. В связи с этим определением уровня
гликозилированного гемоглобина в настоящее время применяют для ранней
диагностики и оценки компенсации сахарного диабета. Помимо сахарного диабета,
повышение уровня гликозилированного гемоглобина может наблюдаться при кистозном
фиброзе, заболеваниях, сопровождающихся укорочением жизни эритроцитов,
хронической почечной недостаточности.
Работа 88. Определение концентрации
гаптоглобинов в сыворотке крови фотоколориметрическим методом
Реактивы. Гемоглобин, 5 г/л раствор; риванол, 3 г/л раствор; сульфат
аммония, 10%-ный раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 2 мл;
центрифуга с центрифужными весами; ФЭК.
Материал. Сыворотка крови.
Метод основан на осаждении риванолом образующегося комплекса
гемоглобин-гаптоглобин. Избыток добавленного к сыворотке крови гемоглобина
после осаждения риванолом определяется фотоколориметрически.
Ход определения. В центрифужную пробирку вносят 0,5 мл сыворотки, 0,2 мл
раствора гемоглобина и 0,3 мл дистиллированной воды. В контрольную пробирку
вносят те же вещества, только вместо раствора гемоглобина приливают 0,2 мл
дистиллированной воды.
Содержимое обеих пробирок тщательно перемешивают взбалтыванием, через 10
мин прибавляют в них по 2 мл раствора риванола и оставляют стоять 5 мин.
Пробы центрифугируют 10 мин при 3000 об/мин. Прозрачную или слегка
опалесцирующую надосадочную жидкость сливают в две чистые пробирки, добавляют
по 0,2 мл 10%-ного раствора сульфата аммония (для просветления жидкости) и
оставляют стоять при комнатной температуре 20 мин.
В стандартную пробирку помещают 2,8 мл дистиллированной воды, 0,2 мл
раствора гемоглобина и 0,2 мл сульфата аммония.
Измеряют экстинкцию всех трех проб против воды на ФЭКе при 540 нм
(светофильтр зеленый) в кювете с толщиной слоя 1 см.
Расчет проводят по формуле
[Ест - (Еоп - Ек)]2000∙0,003
х = --------------- ,
Ест
где х - содержание гаптоглобинов в сыворотке крови, г/л;
Еоп - экстинкция опытной пробы;
Ек - экстинкция контрольной пробы;
Ест - экстинкция стандартной пробы;
- пересчет на литр сыворотки;
,003 - содержание гемоглобина в стандартной пробе, г/л.
Оформление работы. По значениям экстинкции рассчитать содержание
гаптоглобинов в сыворотке крови. Сделать вывод о возможных изменениях
количества гаптоглобинов.
Практическое значение работы. В сыворотке крови взрослого здорового
человека концентрация гаптоглобинов составляет 0,28-1,90 г/л. Гаптоглобины входят
в состав фракции α-глобулинов сыворотки крови. У новорожденных
гаптоглобины, как правило, отсутствуют. Они начинают появляться в возрасте
один-два месяца и достигают уровня взрослых к первому полугодию. Гаптоглобины
связывают внеэритроцитарный гемоглобин, образуя с ним комплекс. Тем самым
гаптоглобин выполняет в организме защитную функцию, например, при разрушении
эритроцитов (гемолизе). При гемолизе гаптоглобин препятствует экскреции
гемоглобина почками, предотвращая нарушение функции канальцев.
Работа 89. Проба Вельтмана в модификации Тейфеля
на коллоидную устойчивость белков сыворотки крови
Реактивы. Хлорид кальция, 5 г/л раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1 и 5 мл.
Материал. Сыворотка крови.
Метод основан на разной устойчивости отдельных белковых фракций сыворотки
крови к коагуляции под действием определенных концентраций хлорида кальция и
нагревания.
Ход определения. В пробирку вносят 0,1 мл сыворотки крови и 4,9 мл
дистиллированной воды и перемешивают встряхиванием. К содержимому добавляют 0,1
мл раствора хлорида кальция, пробирку встряхивают и осторожно нагревают раствор
над пламенем до закипания. После этого пробирку охлаждают и смотрят на свет.
Равномерное помутнение жидкости, независимо от его интенсивности, не свидетельствует
об окончании реакции. Она завершается только при появлении хлопьев. Если же они
не образуются, то вновь приливают в ту же пробирку 0,1 мл хлорида кальция,
нагревают ее до закипания жидкости и так повторяют, пока не выпадет
хлопьевидный осадок.
Отмечают объем хлорида кальция, пошедший на образование хлопьевидного
осадка белков, и определяют состояние коагуляционной ленты Вельтмана по схеме
|
№ пробы
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
CaCl2
|
1,0
|
0,9
|
0,8
|
0,7
|
0,6
|
0,5
|
0,4
|
0,3
|
0,2
|
0,1
|
|
Изменения
|
Сдвиг влево
|
Норма
|
Сдвиг вправо
|
|
Патология
|
Острые воспалительные и
экссудативные состояния, опухоли
|
|
|
Повреждения печени,
фиброзы, гемолиз, хронические воспалительные заболевания
|
|
|
|
|
|
|
|
|
|
|
|
|
Оформление работы. Отмечают объем хлорида кальция (в мл), пошедший на
образование хлопьевидного осадка. В выводах указать изменения коагуляционной
ленты Вельтмана.
Практическое значение работы. Нарушение соотношения белковых фракций
крови (диспротеинемия) при ряде патологических процессов приводит к нарушению
коллоидной устойчивости белков. Сдвиг коагуляционной ленты вправо (на
образование хлопьевидного осадка пошло менее 0,4 мл CaCl2), обусловленный
повышением содержания γ-глобулинов в сыворотке крови, наблюдается при
повреждении печени (гепатит, цирроз, дистрофия), гемолизе и хронических
воспалительных процессах (пневмония, туберкулез, остеомиелит, пиелонефрит,
ревматизм и др.). Сдвиг коагуляционной ленты влево (на образование
хлопьевидного осадка пошло более 0,5 мл CaCl2), обусловленный увеличением
содержания сывороточных α- и β-глобулинов, отмечается при острых
воспалительных и экссудативных процессах (ревматизм, туберкулез), сахарном
диабете, поражении почек и злокачественных опухолях.
Работа 90. Определение активности α-амилазы в сыворотке крови
амилокластическим методом
Реактивы. Крахмал, 20 г/л раствор; фосфатный буфер, 0,1 М раствор с рН
7,2; натрия хлорид, 30 г/л раствор; соляная кислота, 1 М раствор; иод, 0,1 М
раствор в 30 г/л растворе иодида калия.
Оборудование. Водяная баня; термостат, отрегулированный на 37˚С;
штатив с пробирками; пипетки вместимостью 1 мл; мерные колбы вместимостью 50
мл; ФЭК.
Материал. Сыворотка крови.
Метод основан на фотометрическом определении убыли крахмала в ходе
реакции гидролиза его α-амилазой сыворотки крови. Разница концентраций
крахмала до и после гидролиза пропорциональна активности фермента.
Ход определения. В две пробирки, опытную и контрольную, вносят по 0,5 мл
растворов крахмала, по 0,3 мл фосфатного буфера и по 0,1 мл раствора хлорида
натрия. Содержимое перемешивают встряхиванием и помещают на 10 мин в водяную
баню при 37˚С.
В опытную пробу добавляют 0,1 мл сыворотки крови, а в контрольную 0,1 мл
раствора соляной кислоты и затем 0,1 мл сыворотки крови. Тщательно перемешивают
смесь в пробирках и ставят пробы на 30 мин в термостат при 37˚С.
По окончании инкубации в опытную пробирку прибавляют 0,1 мл раствора
соляной кислоты и быстро перемешивают содержимое встряхиванием - реакция
останавливается.
Отбирают по 0,2 мл содержимого обеих пробирок и переносят в две мерные
колбы на 50 мл. Приливают в них по 40 мл дистиллированной воды и по 0,5 мл
раствора иода в иодиде калия. Перемешивают и доводят объем до метки
дистиллированной воды.
Полученные растворы тотчас фотометрируют на ФЭКе против воды при 630-690
нм (красный светофильтр) в кювете с толщиной слоя 1 см.
Примечание. Опытные и контрольные пробы должны иметь одинаковую
температуру, так как ее изменение сказывается на интенсивности окраски
иод-крахмального раствора.
Расчет проводят по формуле
(Ек - Еоп)0,01∙2∙1000
х = ----------
Ек0,1
где х - активность амилазы сыворотки крови, г/(ч∙л);
Ек - экстинкция контрольной пробы;
Еоп - экстинкция опытной пробы;
,01 - масса крахмала в пробе, г;
- пересчет на 1 ч инкубации;
- коэффициент пересчета на 1 л сыворотки крови;
,1 - объем сыворотки крови, взятой на исследование, мл.
Оформление работы. Рассчитать активность фермента, сравнить ее с нормой и
сделать вывод.
Практическое значение работы. В норме активность амилазы сыворотки крови,
определенная амилокластическим методом, составляет 15-30 г/(ч∙л).
Источником сывороточной амилазы служат поджелудочная железа и слюнные железы. У
здорового человека количество слюнной и панкреатической амилазы примерно
одинаково. Возрастание активности амилазы крови (гиперамилаземия) наблюдается
при остром панкреатите, когда она повышается в 10-30 раз, достигая максимума
через 24 ч после начала заболевания, и затем постепенно приходит к норме на
2-6-й день. При хронических панкреатитах гиперамилаземия умеренная. Она
встречается также при поражении слюнных желез. Гипоамилаземия отмечается при
недостатке внешнесекреторной функции поджелудочной железы, заболеваниях печени
(гепатит, цирроз, интоксикации), расстройствах питания (токсические диспепсии),
сахарном диабете и т.д.
Работа 91. Определение содержания кальция в сыворотке
крови мурексидным методом
Реактивы. Комплексон III, 0,665 г/л раствор; гидроксид натрия, 9 М
раствор; мурексид, растертый в тонкий порошок с NaCl в соотношении 1:50.
Оборудование. Конические колбочки вместимостью 50 мл; микробюретка.
Материал. Сыворотка крови.
Метод основан на способности мурексида образовывать с ионами кальция в
щелочной среде комплексные соединения, окрашенные в красно-фиолетовый или
бледно-розовый цвет (в зависимости от концентрации). При титровании раствором
более сильного комплексообразователя (комплексон III) это комплексное
соединение разрушается и связанный мурексид вновь освобождается, что приводит к
появлению его натуральной окраски (фиолетовой или бледно-сиреневой). Объем
комплексона III, пошедший на титрование, пропорционален содержанию кальция в
сыворотке крови.
Ход определения. В коническую колбочку вносят 50 мл дистиллированной
воды, 0,4 мл раствора гидроксида натрия, на кончике скальпеля мурексид и
тщательно перемешивают стеклянной палочкой. Появляется бледно-сиреневая окраска,
обусловленная цветом самого индикатора.
Отбирают 25 мл полученного раствора в колбочку для титрования (оставшийся
раствор служит эталоном сравнения) и добавляют 0,5 мл сыворотки крови, при этом
появляется бледно-розовое окрашивание, обусловленное образованием
кальциево-мурексидного комплекса.
Смесь титруют раствором комплексона III до первоначальной окраски
индикатора. Конец титрования контролируют, сопоставляя окраску опытной пробы с
эталоном (неиспользованная часть раствора).
Расчет. Содержание кальция рассчитывают по формуле
V72
х = ---------- ,
40∙0,5
где х - содержание кальция в сыворотке крови, ммоль/л;- объем раствора
комплексона III, пошедший на титрование, мл;
,5 - объем сыворотки, взятый на исследование, мл;
- коэффициент пересчета количества кальция на 1 л сыворотки с учетом
эквивалентности комплексообразователя;
- молекулярная масса кальция.
Оформление работы. Рассчитать содержание кальция в сыворотке крови (в
ммоль/л), сравнить с нормой и сделать вывод.
Практическое значение работы. В норме содержание кальция в сыворотке
крови составляет 2,25-2,75 ммоль/л. Гиперкальциемия наблюдается при
гипервитаминозе D, гиперпаратиреоидизме, при сердечной недостаточности,
желтухе. Гипокальциемия встречается при спазмофилии, рахите, хронических
заболеваниях почек, гипопаратиреоидизме и т.д.
Работа 92. Тимоловая проба по Хуэрго и Поппер
Реактивы. 10%-ный спиртовой раствор тимола*; буферный раствор*;
тимолововероналовый буфер*; стандартный раствор*.
Оборудование. Штатив с пробирками; пипетки на 0,2 и 10 мл;
фотоэлектроколориметр.
Материал. Исследуемая сыворотка крови.
Метод основан на взаимодействии белков сыворотки крови с
тимолово-вероналовым буфером, при этом появляется мутность вследствие
образования глобулино-тимоло-фосфолипидного комплекса.
Ход определения. К 6,0 мл тимолово-вероналового буферного раствора
прибавляют 0,1 мл негемолизированной сыворотки, оставляют стоять 30 минут,
затем фотометрируют при 660 нм против буферного раствора в кюветах с толщиной
10 мм. Реакцию проводят при температуре +25˚С. Расчет ведут по
калибровочной кривой.
Примечание. Для получения точных данных важным является взятие крови
натощак: алиментарная гиперлипемия существенно влияет на результаты
исследования. При постановке пробы может использоваться сыворотка, хранившаяся
в течение нескольких дней. Умеренный гемолиз не отражается на результатах
исследования.
Расчет. По полученной величине экстинкции по калибровочному графику
проводят определение величины тимоловой пробы.
Построение калибровочного графика. Из стандартного раствора готовят
разведение, соответствующее единицам помутнения по S-H. Так, 1,35 мл суспензии
и 4,65 мл 0,2 н серной кислоты соответствует 5 S-H помутнения; 2,70 мл
суспензии и 3,30 мл кислоты - 10 S-H; 5,40 мл суспензии и 0,60 мл кислоты - 20
S-H помутнения.
Разведения смешивают, хорошо встряхивают и фотометрируют при длине волны
660 нм (630-690 нм - красный светофильтр) против воды в кюветах на 10 мм. По
полученным данным строят калибровочную кривую
Оформление работы. После определения величины тимоловой пробы по
полученным данным сделать вывод о возможных изменениях и причинах их
отклонений.
Практическое значение работы. В норме составляет 0-4 ед (SH). Тимоловая
проба более пригодна для функционального исследования печени. Она положительна
при болезни Боткина, при токсическом гепатите, коллагеновых заболеваниях,
малярии и вирусных инфекциях. При механической желтухе проба отрицательна, что
имеет дифференциально-диагностическое значение.
Работа 93. Сулемово-осадочная реакция (сулемовая
проба по Гринседту)
Реактивы. 0,1% раствор сулемы (готовят из кристаллической сулемы,
растворяя соль в горячей дистиллированной воде); 0,85% раствор хлорида натрия.
Оборудование. Штатив с пробирками, пипетки на 1,0 и 2,0 мл.
Материал. Исследуемая сыворотка крови.
Метод основан на способности сулемы образовывать с мелкодисперсными
белками коллоидный раствор солей ртути. Нарушение дисперсности белковых фракций
сыворотки крови вызывает осаждение грубодисперсных частиц.
Ход определения. К 0,5 мл негемолизированной сыворотки крови добавляют 1
мл физиологического раствора и титруют 0,1% раствором сулемы из микробюретки
или пипетки емкостью 2 мл. В начале раствор приливают по каплям в быстрой
последовательности до первоначального образования помутнения, затем медленно до
появления стойкого помутнения. Результаты сулемовой реакции выражают
количеством мл раствора сулемы, израсходованного на титрование.
Расчет. Проводят на основании количества сулемы, пошедшей на титрование
исследуемой пробы.
Оформление работы. После определения величины сулемовой пробы по
полученным данным сделать вывод о возможных изменениях и причинах их
отклонений.
Практическое значение работы. В норме у здоровых людей на титрование идет
1,6-2,2 мл сулемы.
Положительная проба встречается при ряде патологических состояний:
заболеваниях печени (при болезни Боткина сулемовая проба составляет около 1 мл,
приходя к норме при выздоровлении), хроническом нефрите, нефрозе, пневмонии,
туберкулезе легких, миеломе, инфекционных заболеваниях и т.д.
Работа 94. Количественное определение содержания
железа в сыворотке крови
Реактивы. Трихлоруксусная кислота, 20% раствор; уксуснокислый аммоний,
70% раствор; насыщенный раствор сульфата гидразина (2,5 г соли растворяют в 100
мл воды); раствор батофенантролина*; стандартный раствор*.
Оборудование. Штатив с пробирками; пипетки вместимостью на 1,0; 2,0 и 5,0
мл; водяная баня на 100˚С; центрифуга лабораторная; фотоколориметр.
Материал. Сыворотка, не содержащая следов гемолиза.
Метод основан на способности бато-фенантролина в сульфатированной форме
образовывать с ионами двухвалентного железа окрашенный комплекс, интенсивность
которого определяется фотометрически.
Ход определения. К 2 мл исследуемой сыворотки прибавляют 2,5 мл воды, 1,5
мл 20% раствора трихлоруксусной кислоты, перемешивают и ставят на 15 минут на
водяную баню при температуре 90-95˚С. Центрифугируют 20 мин при 2000
об/мин и отбирают 4 мл надосадочной жидкости, к которой добавляют 0,35 мл 70%
раствора ацетата аммония и 0,3 мл раствора сульфата гидразина. Смесь
фотометрируют при длине волны 535 нм в кювете 10 мм. Затем добавляют 0,4 мл
раствора сульфонированного бато-фенантролина, оставляют стоять на 1 час, после
чего фотометрируют при тех же условиях. Фотометрию проводят против контрольной
пробы, в которую вместо исследуемой сыворотки вносят 2 мл воды.
Калибровку проводят так же как и основной опыт, но вместо сыворотки берут
2 мл стандартного раствора.
Расчет проводят по формуле:
Еоп-1 - Еоп-2
------ ∙30 (мкмоль/л)
Ек-1 - Ек-2
где Еоп-1 и Еоп-2 - экстинкции опытной пробы до и после прибавления
раствора бато-фенантролина;
Ек-1 - Ек-2 - результаты фотометрии калибровочной пробы;
- содержание железа в калибровочном растворе, мкмоль/л.
Примечание.
1. Железо определяется в сыворотке без
следов гемолиза.
2. Следить за содержанием в
дистиллированной воде и реактивах, лучше использовать бидистиллированную воду.
3. Посуду следует промывать 5н раствором
соляной кислоты и ополаскивать бидистиллированной водой.
4. При взятии крови на анализ больной не
должен принимать препаратов железа по меньшей мере в течение 5 дней.
Оформление работы. Рассчитать содержание железа по представленной формуле
и сделать вывод его в соответствии норме.
Практическое значение работы. В норме содержание негеминового железа у
мужчин 12-32 мкмоль/л, у женщин - на 10-15% ниже.
Содержание железа сыворотки значительно снижается при железодефицитной
анемии, независимо от причины ее вызывающей. При воспалительных, инфекционных,
септических состояниях, интоксикации, опухолях анемии обусловлены не столько
дефицитом железа, сколько его недостаточным освобождением из РЭС, вследствие
чего снижается синтез гемоглобина.
2. Биохимическое исследование мочи
Моча образуется и выделяется почками. Первичная моча представляет собой
ультрафильтрат крови. Она содержит все компоненты крови, кроме форменных
элементов и белков, масса которых превышает 50000. В результате реабсорбционных
и секреторных процессов в канальцах и собирательных трубках почек формируется
окончательная моча. Изменения функции и повреждения различных органов
отражаются на химическом составе крови, а следовательно, на компонентах ее
ультрафильтрата (первичная моча) и затем на составе окончательной мочи.
Нарушения деятельности почек непосредственно сказываются на физико-химических
свойствах выделяемой мочи и содержании в ней различных веществ. Поэтому
биохимические исследования мочи играют важную роль в клинике для диагностики и
определения прогноза заболевания, а также для контроля за эффективностью
проводимого лечения.
В состав мочи входят вода, органические и минеральные соли, всего около
150 веществ. В клинико-биохимических лабораториях проводят общий и специальный
анализ мочи. Общий анализ включает исследование физико-химических свойств мочи
и определение в ней ряда патологических компонентов: белок, сахар, кетоновые
(ацетоновые) тела, гемоглобин, пигменты и индикан. При необходимости
подсчитывают также количество эритроцитов и лейкоцитов в моче. Общий анализ
обязателен при первичном обследовании пациента и диспансерном наблюдении.
Специальный анализ, т.е. определение прочих компонентов мочи (метаболиты,
ферменты, отдельные минеральные вещества и т.д.) проводится при подозрении на
поражение конкретного звена обмена или определенного органа.
Работа 95. Исследование физико-химических свойств мочи
Оборудование. Мерный цилиндр вместимостью 1 или 2 л; урометры с делениями
от 1,000 до 1,030 кг/л и от 1,030 до 1,060 кг/л; термометр; фильтровальная
бумага; стеклянные цилиндры вместимостью 50 или 100 мл; универсальная
индикаторная бумага; стаканчик.
Материал. Суточная моча, взятая у обследуемого.
а. Характеристика суточного объема мочи (диурез). Суточный объем мочи
замеряют с помощью мерного цилиндра на 1 или 2 л. В норме он составляет в
среднем 1500 мл у мужчин и 1200 мл у женщин. Объем мочи выше 2200 мл и ниже 500
мл в сутки указывают на патологию.
б. Характеристика цвета мочи. Цвет мочи оценивают визуально. В норме он
соломенно-желтый и обусловлен присутствием пигментов: урохрома (темно-желтый),
уробилина (бледно-розовый), уроэритрина (бледно-красный).
При патологии или приеме с пищей красящих веществ цвет мочи меняется.
Бледно-желтая или почти бесцветная моча характерна для полиурии (сахарный и
несахарный диабет), почечные заболевания.
Красная окраска бывает при гемоглобин- и миоглобинурии или от пищевых
красителей, содержащихся в конфетах, чернике, смородине, свекле и т.д.
Коричнево-темный цвет наблюдается при алкаптонурии или меланинурии.
Зелено-синяя окраска отмечается при бактериальном загрязнении мочи или
избытке в ней индикана, который превращается в синее индиго.
Желто-зеленая окраска (цвет пива) мочи обусловлена присутствием в ней
желчных кислот и пигментов.
в. Оценка прозрачности мочи. Прозрачность мочи оценивается визуально. В
норме моча прозрачна; при стоянии из нее осаждается рыхлая слизистая масса,
состоящая из слущенного эпителия мочевых путей и слизистых телец.
Помутнение мочи может быть вызвано присутствием в ней избытка солей
(ураты, фосфаты, оксалаты, карбонаты) или слизи, гноя, микробов и слущенных
клеток.
г. Определение запаха мочи. В норме запах мочи ароматический,
напоминающий запах мясного бульона или миндаля. Пахучие пищевые вещества или
лекарства могут придавать моче свойственный им запах. Загнившая моча имеет
запах аммиака, при разложении клеток в мочевых путях моча приобретает
гнилостный запах, а присутствие большого количества кетоновых тел (сахарный
диабет) придает ей плодовый запах.
д. Исследование плотности мочи. Стеклянный цилиндр ставят строго
вертикально и наливают в него мочу. Если образуется пена, ее снимают
фильтровальной бумагой. Осторожно погружают в мочу сухой урометр так, чтобы он
свободно плавал, не касаясь стенок цилиндра, и производят отсчет по отметке
шкалы урометра, совпадающей с нижним мениском жидкости.
Измеряют температуру мочи.
По шкале урометра сразу находят плотность мочи (в кг/л), но так как он
откалиброван при определенной температуре (чаще всего при 15˚С),
необходимо внести поправку на температуру мочи. Для этого на каждые 3˚С
выше 15˚С прибавляют по 0,001 кг/л к измеренной плотности и, наоборот,
если температура ниже 15˚С,на каждые 3˚С вычитают по 0,001 кг/л.
е. Определение рН мочи. Полоску универсальной индикаторной бумаги
погружают в исследуемую мочу, вынимают ее и определяют по цветной шкале рН.
В норме рН мочи колеблется от 5,0 до 7,0. Сдвиг рН в кислую сторону
отмечается при выделении ацетоновых тел (сахарный диабет, голодание) или при
тяжелой недостаточности почек. Смещение рН в щелочную сторону наблюдается при
употреблении с пищей гидрокарбонатов, щелочных минеральных вод, молочно-растительных
продуктов, воспалении слизистой мочевого пузыря и после длительной рвоты.
Оформление работы. Занести полученные данные анализа в тетрадь, сделать
вывод о характерных изменениях и указать причины.
Работа 96. Определение кетоновых тел и глюкозы в моче
К кетоновым (ацетоновым) телам относятся ацетон, ацетоуксусная и β-гидроксимасляная кислоты.
Реактивы. Нитропруссид натрия, 10%-ный раствор свежеприготовленный;
уксусная кислота, конц.; гидроксид натрия, 10%-ный раствор; хлорид железа
(III), 10%-ный раствор.
Оборудование. Глазные пипетки; штатив с пробирками; набор «Глюкотест».
Материал. Моча, нормальная и патологическая.
а. Проба Легаля на ацетон и ацетоуксусную кислоту мочи. Метод основан на
способности ацетона и ацетоуксусной кислоты в щелочной среде образовывать с
нитропруссидом натрия комплексы оранжево-красного цвета, а при подкислении
раствора - соединений вишнево-красного цвета.
Ход определения. В одну пробирку вносят 10 капель нормальной, в другую -
10 капель патологической мочи и добавляют в обе пробы по 2 капли раствора
нитропруссида натрия и по 4 капли раствора гидроксида натрия. Появляется
оранжево-красное окрашивание.
Вносят в обе пробирки по 10 капель концентрированной уксусной кислоты,
при этом возникает вишнево-красное окрашивание.
Примечание. Креатинин мочи с нитропруссидом натрия также дает
оранжево-красное окрашивание, но при добавлении концентрированной уксусной
кислоты жидкость окрашивается в желтый цвет.
б. Проба Герхарда на ацетоуксусную кислоту мочи. Метод основан на
взаимодействии железа с енольной формой ацетоуксусной кислоты с образованием
комплекса красно-фиолетового цвета.
Ход определения. В одну пробирку вносят 20 капель нормальной, а в другую
- 20 капель патологической мочи и прибавляют по 5 капель раствора хлорида железа
(III) в обе пробы. Развивается красно-фиолетовое окрашивание.
в. Экспресс-тест на ацетон мочи.
Ход определения. На каждую из таблеток наносят по 2 капли нормальной и
патологической мочи. Через 2 мин сравнивают окраску таблеток с цветной шкалой,
приложенной к набору. При отсутствии ацетона окраска не развивается.
г. Определение глюкозы в моче с помощью набора «Глюкотест». Метод основан
на визуальной оценке изменения цвета красителя (о-толидин), которым пропитана
полоска бумаги «Глюкотест»; по цветной шкале устанавливают примерное содержание
глюкозы в моче.
Ход определения. Одну полоску бумаги «Глюкотест» смачивают нормальной, а
другую - патологической мочой. Сравнивают через несколько минут окраску полосок
с цветной шкалой, имеющейся в комплекте. Содержание глюкозы в моче определяют
по наиболее совпадающему со шкалой цвету полоски.
Оформление работы. Результаты занести в таблицу.
|
Исследуемая моча
|
Название пробы
|
Выявляемое вещество
|
Результат
|
Сделать вывод о присутствии ацетоновых тел и глюкозы в образцах нормальной
и патологической мочи и указать на вероятные их причины.
Практическое значение работы. В норме пробы на ацетоновые тела и глюкозу
в моче отрицательны.
Одновременное выделение ацетоновых тел и глюкозы с мочой наблюдается
наиболее часто при сахарном диабете, реже при действии глюкокортикоидов
(стероидный диабет), соматотропина и кортикотропина. Глюкозурия без ацетонурии
имеет место при употреблении большого количества углеводов с пищей, а
ацетонурия без глюкозурии - при голодании.
Работа 97. Определение белка в моче по методу
Бранденберга-Робертса-Стольникова
Реактивы. Азотная кислота, конц.
Оборудование. Штатив с пробирками; пипетка для концентрированных кислот;
пипетка вместимостью 2 мл.
Материал. Моча, нормальная и патологическая*.
Метод основан на пробе Геллера, состоящей в том, что при наслаивании
мочи, содержащей белок, на концентрированную азотную кислоту образуется мутное
белое кольцо денатурированного белка. Экспериментально установлено, что
растворы, содержащие 0,033 г/л белка, дают это кольцо между 2-й и 3-й минутами
после наслаивания.
Ход определения. Проводят пробу Геллера с нормальной и патологической
мочой, для чего вносят в пробирку 20 капель концентрированной азотной кислоты и
осторожно из пипетки наслаивают мочу. Если в моче содержится белок, то через
2-4 мин образуется белая муть в виде кольца.
Мочу с положительной пробой Геллера используют для количественного
определения белка, для чего готовят разведение мочи. В пять пробирок наливают
по 2 мл дистиллированной воды. В первую вносят 2 мл мочи, перемешивают и
отбирают 2 мл смеси и переносят во вторую и т.д. Из последней пробирки 2 мл
набранной жидкости отбрасывают. Получается моча, разведенная в 2, 4, 8, 16 и 32
раза.
В другие пять пробирок отмеривают по 2 мл концентрированной азотной кислоты
и осторожно с помощью пипетки наслаивают на кислоту соответствующую пробу
разведенной мочи.
Отмечают максимальное разведение мочи, при котором появляется мутное
колечко между второй и третьей минутами.
Расчет. Найденное разведение мочи умножить на 0,033 г/л. Например, кольцо
денатурированного белка образовалось в четвертой пробирке, где разведение равно
16. Следовательно, содержание белка в исследуемой моче 0,033·16 = 0,528 г/л.
Оформление работы. Рассчитать содержание белка в патологической моче и указать
на использование метода в практике.
Работа 98. Качественное определение индикана в моче
Реактивы. Свинца ацетат (100 г/л); железо хлорное; кислота соляная
концентрированная, пл. 1,19; реактив Обермейера; 0,2-0,4 хлорного железа и 100
мл концентрированной соляной кислоты; хлороформ.
Материал. Моча свежевыпущенная.
Принцип метода основан на способности индикана с реактивом Обермейера в
присутствии хлороформа окрашиваться в синий или красный цвет.
Ход определения. 1 мл мочи смешивают с раствором ацетата свинца в
отношении 1:10, фильтруют. Смешивают 1-2 мл фильтрата с реактивом Обермейера в
соотношении 1:1, прибавляют 0,5-1,0 мл хлороформа и опрокидывают пробирку
несколько раз. Если слой хлороформа окрашивается в синий или красный цвет, то
проба положительная.
Оформление работы. По полученному окрашиванию сделать вывод о возможности
использования данной реакции в диагностике патологических процессов.
Практическое значение работы. В норме индикан содержится в моче в
незначительном количестве и не обнаруживается качественными пробами.
Индиканурия встречается при интенсивном гниении белковых веществ в кишечнике, а
также при усиленном распаде белков в организме.
Работа 99. Обнаружение некоторых пигментов в
моче
Реактивы. Бензидин, 1%-ный раствор в 32%-ной уксусной кислоте; пероксид
водорода, 3%-ный раствор; иод, 1%-ный спиртовой раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 5 мл.
Материал. Моча, нормальная и патологическая*.
а. Бензидиновая проба на кровяные пигменты в моче. Принцип метода см.
работу 9, а.
В одну пробирку вносят 5 капель нормальной, а в другую - патологической
мочи и добавляют по 3 капли бензидинового реактива и раствора пероксида
водорода. При наличии пигментов появляется сине-зеленая окраска.
б. Проба Розина на желчные пигменты в моче. Метод основан на образовании
из билирубина под действием иода биливердина, окрашенного в зеленый цвет.
Ход определения. В одну пробирку вносят 5 мл нормальной, а в другую
патологической мочи и осторожно наслаивают раствор иода. Если в моче присутствует
билирубин, на границе двух жидкостей появляется зеленое кольцо.
МЕТАБОЛИЗМ
КСЕНОБИОТИКОВ
Метаболизм ксенобиотиков осуществляется с участием ферментов,
содержащихся в тканях и жидкостях организма. Их состав определяет специфичность
превращения любого чужеродного соединения. Метаболизм ксенобиотиков зависит от
пути поступления их в организм. В пищеварительном тракте возможен
гидролитический распад чужеродных веществ, в биологических жидкостях они
подвергаются и некоторым другим превращениям (оксидоредукции, конъюгации), а в
клетках происходят самые разнообразные реакции биотрансформации ксенобиотиков
(см. учебник, с.444-455).
Наиболее активно ферментативные превращения ксенобиотиков осуществляются
в клетках печени. Среди них следует отметить реакции окисления веществ,
осуществляемые монооксигеназной ферментативной системой мембран
эндоплазматической сети (микросом) печени. В микросомальной цепи протекают
окислительные реакции двух типов: реакции гидроксилирования природных
(аутобиогенных) и чужеродных соединений и реакции пероксидного окисления
ненасыщенных жирных кислот (А.И.Арчаков, 1975).
Для исследования метаболизма ксенобиотиков возможны два подхода:
1) определение состава и содержания
метаболитов введенных ксенобиотиков в биологических жидкостях и экскретах;
2) определение активности ферментов,
участвующих в превращении ксенобиотиков, и изучение кинетики действия данных
ферментов на различные соединения.
В экспериментах применяют оба подхода; в клинике метаболизм
лекарственного средства оценивают, как правило, по содержанию в биологических
жидкостях изучаемого вещества и его продуктов обмена.
1. Исследование процессов окисления и конъюгации
ксенобиотиков
Работа 100. Выявление дыхательной активности микросом
Дыхание микросом - процесс окисления веществ кислородом с образованием
воды - можно изучать или по скорости потребления кислорода, или по
использованию восстановленного НАДФ, или НАД, участвующих в этих реакциях.
Реактивы. Хлорид калия, 1,15%-ный раствор; трис-буфер, 0,1 М раствор с рН
7,4*; хлорид кальция, 0,04 М раствор; НАДФ·Н, 1,0 мМ раствор,
свежеприготовленный; НАД·Н, 1,0 мМ раствор, свежеприготовленный.
Оборудование. Пипетки вместимостью 0,1; 1; 5; 10 мл; штатив с пробирками;
стеклянные палочки; чашки Петри; мерный цилиндр вместимостью 25 мл;
фильтровальная бумага; шприц с иглой; гомогенизатор с пестиком из тефлона;
аптечные весы с разновесами; моторчик для гомогенизации; флуороскоп; центрифуга
ЦЛР.
Материал. Печень (свежая) забитого животного.
а. Выделение микросомальной фракции из печени крысы. Метод основан на
разной скорости осаждения субклеточных частиц печени при центрифугировании в
зависимости от их размера и плотности. Для уменьшения фактора осаждения
микросом добавляется хлорид кальция, вызывающий их преципитацию.
Ход определения. После забоя животного печень отмывают от крови раствором
хлорида калия из шприца, обсушивают ее фильтровальной бумагой и помещают в
чашку Петри, стоящую на льду.
г ткани печени измельчают ножницами и переносят в стакан гомогенизатора,
куда предварительно наливают 9 мл охлажденного раствора хлорида калия. Стакан
помещают в лед и размельчают ткань с помощью тефлонового пестика при 1000
об/мин, делая 15-20 движений стаканом вверх-вниз.
Гомогенат разливают в две центрифужные гильзы и центрифугируют на ЦЛР при
10000g в течение 20 мин при 0-4˚С. Надосадочную жидкость сливают в другие
центрифужные гильзы, прибавляют к ней раствор хлорида кальция в соотношении 1:5
по объему. Перемешивают и вновь центрифугируют при 3000g в течение 15 мин при
0-4˚С.
Надосадочную жидкость сливают. К осадку, содержащему обогащенную фракцию
микросом, добавляют 3 мл раствора трис-буфера и с помощью пипетки, втягивая и
выдувая жидкость, получают взвесь микросом.
б. Обнаружение дыхательной активности микросом печени флуориметрическим методом.
Метод основан на наблюдении за скоростью падения флуоресценции НАДФ·Н или НАД·Н
в процессе их окисления препаратами микросом.
Ход определения. В две пробирки наливают по 2,8 мл трис-буфера. Затем в
одну из них добавляют 0,1 мл полученной взвеси микросом, а в другую - 0,1 мл
дистиллированной воды (контрольная проба).
Ставят обе пробирки в штатив предварительно включенного флуороскопа,
вносят в них по 0,1 мл раствора НАДФ·Н или НАД·Н и быстро перемешивают
стеклянной палочкой.
Наблюдают за изменением флуоресценции в обеих пробах.
Оформление работы. По изменению флуоресценции указать на наличие
дыхательной функции микросом.
Практическое значение работы. Выделение микросом используется в научных
исследованиях для изучения их функций, в том числе дыхательной, при различных
физиологических состояниях и при патологии, а также для исследования действия
лекарств и ядов.
Работа 101. Исследование окислительного
N-деметилирования в микросомах печени по Нашу
Реактивы. Гидроксид натрия, 3%-ный раствор; биуретовый реактив*;
трис-буфер, 0,1 М раствор с рН 7,4*; НАДФ·Н, 1 мМ раствор, свежеприготовленный;
хлорид магния, 2,5 мкМ раствор; амидопирин, 80 мМ раствор; сульфат цинка,
25%-ный раствор; гидроксид бария, насыщенный раствор; реактив Наша*.
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1; 2 и 5 мл;
спектрофотометр.
Материал. Взвесь микросом печени, полученная в работе 85, а.
Метод основан на измерении содержания в среде формальдегида,
образующегося при окислительном N-деметилировании амидопирина в микросомах:
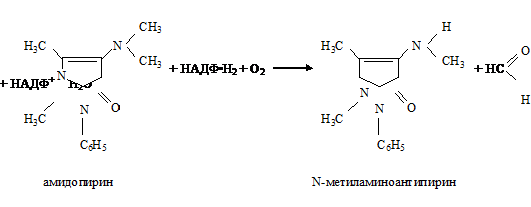
Формальдегид
дает с реактивом Наша комплекс желтого цвета.
Ход
определения. Проверяют содержание белка в микросомальной фракции, для чего
помещают в пробирку 0,05 мл взвеси микросом, добавляют 3,95 мл раствора
гидроксида натрия и 0,2 мл биуретового реактива. Смесь перемешивают и через 30
мин измеряют экстинкцию опытной пробы против контрольной (4 мл раствора NaOH и
0,2 мл биуретового реактива) на СФ при 330 нм в кювете с толщиной слоя 1 см.
Экстинкции 0,30-0,60 примерно соответствует содержание белка 2-4 мг в 0,1 мл
взвеси микросом. Если экстинкция выше, то необходимо взвесь микросом разбавить
трис-буфером так, чтобы получилась нужная концентрация белка.
В
опытную и контрольную пробирки вносят по 0,4 мл растворов трис-буфера и хлорида
магния, по 0,2 мл НАДФ·Н и по 0,1 мл взвеси микросом. Перемешивают содержимое
пробирок.

В
опытную пробу добавляют 0,11 мл раствора амидопирина, а в контрольную - сначала
по 0,25 мл растворов сульфата цинка и гидроксида бария, а затем 0,11 мл
амидопирина. Содержимое перемешивают.
Помещают
обе пробирки на 20 мин в водяную баню при 37˚С, периодически встряхивая
пробы. По окончании инкубации реакцию в опытной пробе останавливают, добавив по
0,25 мл растворов сульфата цинка и гидроксида бария. Содержимое перемешивают.
Центрифугируют
обе пробы при 3000 об/мин в течение 10 мин.
Отбирают
по 1 мл надосадочной жидкости в две другие пробирки и приливают в них по 2 мл
реактива Наша. Ставят пробы на 45 мин в водяную баню при 37˚С.
Измеряют
экстинкцию опытной пробы против контрольной на СФ при 412 нм в кювете с
толщиной слоя 1 см.
Расчет
проводят по формуле:
аV1,71·333
х
= ---------- ,
где
х - скорость N-деметилирования амидопирина, мкмоль/(мин·кг печени);
а - количество формальдегида, найденное по калибровочному графику
(рис.12), нмоль;- объем взвеси микросом в трис-буфере, мл;
,71 - объем инкубационной смеси, мл;
,1 - объем взвеси микросом, взятый на исследование, мл;
- время инкубации, мин;
- коэффициент пересчета на 1 кг ткани печени;
- коэффициент пересчета нмоль в мкмоль.
Оформление работы. Рассчитать скорость микросомального окисления
амидопирина. В выводе указать на значение этого процесса.
Практическое значение работы. Исследование окисления ксенобиотиков
монооксигеназной цепью микросом дает возможность оценить функцию этого процесса
в норме и патологии, а также изучить особенности превращения различных
соединений, токсичность и действие их продуктов на организм.
Работа 102. Определение гидроксилазной
активности микросом печени по Като и Жилете
Реактивы. Трис-HCl буфер, 0,08 М раствор с рН 7,4*; хлорид магния, 0,16 М
раствор; анилин перегнанный, 0,03 М раствор; трихлоруксусная кислота, 15%-ный
раствор; карбонат натрия, 10%-ный раствор; фенол, 2%-ный раствор в 0,2 М
растворе гидроксида натрия; НАДФ∙Н, 0,03 М раствор; биуретовый реактив*;
гидроксид натрия, 3%-ный раствор; реактивы для выделения микросом, как в работе
86; 4-аминофенол, свежеприготовленный раствор для построения калибровочного
графика. (5,45 мг/л).
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 0,2; 1 и 5
мл; водяная баня; лабораторная центрифуга с центрифужными весами; центрифуга
рефрижераторная ЦЛР; ФЭК типа КФК-2 или спектрофотометр.
Материал. Печень животного после забоя.
Метод основан на определении содержания 4-аминофенола, образующегося при
гидроксилировании анилина в монооксигеназной цепи микросом и с участием
цитохрома Р450:
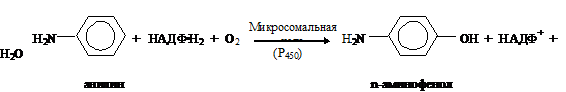
-аминофенол
при взаимодействии с фенолом и в присутствии карбоната натрия образует
окрашенный индофенольный комплекс синего цвета:
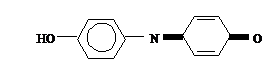
Ход
определения. Выделяют фракцию микросом печени, как указано в работе 100, затем
определяют содержание белка в полученной микросомальной фракции; для этого
отбирают 0,05 мл взвеси микросом в пробирку, добавляют 3,95 мл раствора
гидроксида натрия и 0.2 мл биуретового реактива.
Перемешивают
содержимое стеклянной палочкой и через 30 мин измеряют экстинкцию этого
раствора против контрольного (4 мл гидроксида натрия и 0,2 мл биуретового
реактива) на ФЭКе и СФ при 330 нм в кювете с толщиной слоя 1 см. Рассчитывают
концентрацию белка по калибровочному графику (содержание белка в 0,1 мл взвеси
микросом должно составлять примерно 2-4 мг).
Для изучения гидроксилирования анилина берут две чистые пробирки и
готовят контрольную и опытную пробы. Последовательность внесения компонентов и
их объем приведены в таблице.
|
Контроль
|
Опыт
|
|
вещество
|
объем
|
вещество
|
объем
|
|
Трис-HCI буфер
|
0,4
|
Трис-HCI буфер
|
0,4
|
|
Хлорид магния
|
0,4
|
Хлорид магния
|
0,4
|
|
Взвесь микросом
|
0,1
|
НАДФ∙Н
|
0,2
|
|
Трихлоруксусная кислота
|
0,5
|
Взвесь микросом
|
0,1
|
|
Анилин
|
0,11
|
Анилин
|
0,11
|
|
НАДФ∙Н
|
0,2
|
|
|
Обе пробирки помещают на 20 мин в водяную баню при 37˚С, после чего
в опытной пробе останавливают реакцию, приливая 0,5 мл трихлоруксусной кислоты.
Далее обе пробы центрифугируют 10 мин при 3000 об/мин.
Отбирают из каждой пробы по 1 мл надосадочной жидкости, переносят их в
две другие пробирки. Затем приливают к ним по 0,5 мл карбоната натрия и по 1,5
мл раствора фенола. Перемешивают содержимое встряхиванием.
Для развития окраски пробирки помещают на 30 мин в водяную баню при 37˚С.
Затем измеряют экстинкцию опытной пробы против контрольной на ФЭКе или СФ при
630 нм (светофильтр красный).
Серию растворов для построения калибровочного графика готовят согласно
таблице.
|
№ пробирки
|
4-аминофенол, мл
|
Вода, мл
|
Nа2СО3, мл
|
Фенол, мл
|
Содержание 4-аминофенола в
пробе, нмоль
|
|
1
|
0,1
|
0,9
|
0,5
|
1,5
|
5,0
|
|
2
|
0,2
|
0,8
|
0,5
|
1,5
|
10,0
|
|
3
|
0,3
|
0,7
|
0,5
|
1,5
|
15,0
|
|
4
|
0,4
|
0,6
|
0,5
|
1,5
|
20,0
|
|
5
|
0,5
|
0,5
|
0,5
|
1,5
|
25,0
|
|
6
|
0
|
1,0
|
0,5
|
1,5
|
0 (контроль)
|
Затем пробирки ставят на 30 мин в водяную баню при 37˚С. Измеряют
экстинкцию проб против контроля, как описано выше, и строят калибровочный
график.
Расчет проводят по формуле
АV
х = --- ,
20m
где х - гидроксилазная активность нмоль/(мин∙мг белка);
А - содержание 4-аминофенола в пробе, найденное по калибровочному
графику, нмоль;- объем пробы, равный 1,71 мл;
- время инкубации, мин;- содержание белка в пробе, мг.
Практическое значение работы. Для изучения функции микросомальной цепи
окисления печени в норме и особенно при патологических состояниях используют
различные методические подходы. В частности, исследования проводят с разными
субстратами, превращение которых происходит на цитохроме Р450. При
взаимодействии с цитохромом Р450 разные субстраты дают неодинаковые спектры
поглощения. По этому признаку их условно делят на субстраты I типа (к ним
относятся, например, амидопирин, бензфетамин, этилморфин и др.) и II типа
(анилин), что связано, возможно, с некоторыми различиями в механизме
гидроксилирования данных соединений.
Скорость реакций гидроксилирования изменяется при действии многих внешних
факторов (радиации, гипероксии, гипоксии, интоксикации четыреххлористым
углеродом и т.д.), под влиянием ряда регуляторов (витаминов, гормонов). Для
получения более полной информации о деятельности гидроксилазной активности
микросом печени при действии многих факторов и при патологии используют разные
ксенобиотики - субстраты цитохрома Р450.
Работа 103. Метод оценки активности
монооксигеназ эндоплазматической сети клеток печени по выделению метаболитов
амидопирина с мочой по Т.А. Попову и О.Д. Леоненко
Метаболизм амидопирина осуществляется с помощью ферментативных реакций
окисления и конъюгации. Первая из них (N-деметилирование) катализируется
монооксигеназной ферментной системой эндоплазматической сети печени по
уравнению
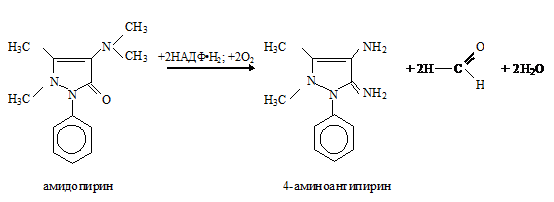
Далее
4-аминоантипирин с участием соответствующей N-ацетилтрансферазы и ацетил-КоА
подвергается ацетилированию:
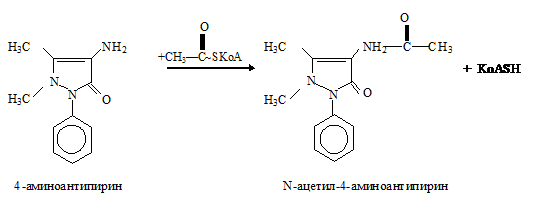
Реактивы.
Фенол перекристаллизованный, 0,02%-ный раствор; аммиачный буфер с рН 10,5-10,6
(20 г хлорида аммония растворяют в 100 мл 25%-ного раствора аммиака); трихлоруксусная
кислота, 12,5%-ный раствор; соляная кислота, 36%-ная; гексацианоферрат (III)
калия, 1%-ный раствор; 4-аминоантипирин, свежеприготовленный стандартный
раствор 1 мг/мл для построения калибровочного графика.
Оборудование.
Штатив с пробирками; пипетки вместимостью 0,2; 1; 2 и 5 мл; пробирки, обернутые
фольгой; воронки с бумажными фильтрами; воронки со стеклянным мелкопористым
фильтром; водяная баня; ФЭК или спектрофотометр.
Материал.
Моча, содержащая метаболиты амидопирина. Для получения мочи белым крысам
внутрибрюшинно вводят раствор амидопирина из расчета 20 мг на 1 кг массы тела,
затем отсаживают их в стеклянные выделительные воронки и собирают мочу в мерные
цилиндры в течение 12 или 24 ч. Перед исследованием мочу фильтруют через
бумажные фильтры.
Метод
основан на способности 4-аминоантипирина, являющегося метаболитом амидопирина,
при взаимодействии с фенолом в щелочной среде и в присутствии гексацианоферрата
(III) калия образовывать соединение типа индофенола, имеющее розовую окраску.
Ход
определения. В две пробирки вносят по 1,5 мл профильтрованной мочи. В первую
(для определения свободного 4-аминоантипирина) приливают 0,3 мл аммиачного
буфера, а во вторую (для определения суммы метаболитов, т.е. 4-аминоантипирина
и N-ацетил-4-аминоантипирина) 0,3 мл соляной кислоты. Перемешивают пробы,
осторожно встряхивая пробирки.
Содержимое первой пробирки через 15 мин фильтруют через бумажный фильтр;
вторую пробирку закрывают пробкой, обернутой фольгой, и помещают на 15 мин в
кипящую водяную баню, после чего сразу охлаждают пробу в воде со льдом до
комнатной температуры. Охлажденный гидролизат фильтруют через мелкопористый
стеклянный фильтр в другую пробирку.
Отбирают из первой пробы 0,6 мл фильтрата в чистую пробирку и добавляют
последовательно 0,5 мл раствора трихлоруксусной кислоты, 2 мл раствора фенола и
0,1 мл раствора гексацианоферрата (III) калия. Содержимое перемешивают и через
10 мин (но не позже чем через час) измеряют экстинкцию опытной пробы на ФЭКе
(светофильтр зеленый) или на спектрофотометре при 510 нм в кювете с толщиной
слоя 1 см против контрольной, содержащей все компоненты, кроме фенола, который
заменяется 2 мл дистиллированной воды. Полученная экстинкция (Е1) соответствует
содержанию в моче 4-аминоантипирина.
К профильтрованному гидролизату второй пробы приливают 0,6 мл аммиачного
буфера, смесь перемешивают и вновь профильтровывают через бумажный фильтр.
Отбирают в чистую пробирку 0,8 мл прозрачного фильтрата и добавляют
последовательно 0,2 мл дистиллированной воды, 2 мл раствора фенола и 0,1 мл
раствора гексацианоферрата (III) калия.
Содержимое пробирки перемешивают и через 10 мин (но не позже чем через
час) измеряют экстинкцию второй опытной пробы на ФЭКе или на спектрофотометре
при тех же условиях, что и для первой пробы. Полученное значение экстинкции
(Е2) соответствует содержанию в моче суммы метаболитов (4-аминоантипирин и
N-ацетил-4-аминоантипирин).
Расчет. Содержание метаболитов амидопирина в моче и показатели активности
ферментных систем печени, участвующих в превращении ксенобиотиков, рассчитывают
по калибровочному графику. Для его построения в 5 пробирок вносят
соответственно 0,05; 0,1; 0,2; 0,3 и 0,4 мл стандартного раствора
4-аминоантипирина. Затем в каждой пробирке доводят общий объем пробы до 5 мл
дистиллированной водой и приливают в них по 1 мл аммиачного буфера. Содержимое
перемешивают, фильтруют, отбирают в другие пробирки по 0,6 мл фильтрата и
обрабатывают его так же, как и при определении свободного 4-аминоантипирина в
моче (первая опытная проба). Полученные значения экстинкции соответствуют
концентрации 4-аминоантипирина 5, 10, 20, 30 и 40 мкг/л (примерный
калибровочный график показан на рис. 13).
По Е1 находят общее количество выделенного 4-аминоантипирина, умножая
содержание его в пробе на суточный объем мочи (в мл).

По
Е2 определяют аналогичным образом сумму метаболитов амидопирина, выделенных за
сутки с мочой.
Относительную активность монооксигеназы печени рассчитывают в % от
введенного количества амидопирина по формуле
А100%
-----
В
где А - сумма метаболитов, выделенных с мочой за сутки;
В - количество введенного животному амидопирина.
Ацетилирующую активность ферментных систем организма х (в %) находят по
формуле
(Е2 - Е1)100%
х = -------
Е1
где Е1 и Е2 - соответствующие экстинкции опытных проб.
Оформление работы. Рассчитать относительную активность ферментных систем
N-деметилирования и ацетилирования у исследуемых животных и сделать вывод о
практическом значении данного теста.
Практическое значение работы. Обстоятельное изучение ферментов печени,
осуществляющих реакции гидроксилирования многих соединений и их конъюгацию,
открывает возможности косвенной оценки активности изучения состава и
соотношения метаболитов разных ксенобиотиков, поступающих в организм.
Демонстративность и относительная простота выполнения позволяют использовать
эти тесты не только в эксперименте, но и в клинической практике для выявления
ранних нарушений различных токсических веществ, производственных факторов и
различных лекарств на ферментативные системы гидроксилирования и ацетилирования
ксенобиотиков в организме.
Работа 104. Определение активности
алкогольдегидрогеназы в сыворотке крови по Шкурски и др. с дополнениями И.В.
Бокия, М.С. Усатенко и В.Ф. Трюфанова
Реактивы. Пирофосфатный буфер, 0,1 М раствор, рН 8,5*;
n-нитрозодиметиланилин, 26 мкМ раствор*; н-бутанол, 0,25 М водный раствор;
НАД+, свежеприготовленный раствор (3,3 мг НАД в 1 мл 0,25 М раствора бутанола).
Оборудование. Пипетки на 0,1; 1 и 2 мл; стеклянные палочки; секундомер;
спектрофотометр.
Материал. Сыворотка крови.
Метод основан на способности алкогольдегидрогеназы (АДГ) катализировать
две последовательные реакции: НАД-зависимое окисление бутанола и восстановление
n-нитрозодиметиланилина с участием НАД∙Н2, образовавшимся в ходе первой
реакции. При этом n-нитрозодиметиланилин, имеющий в растворе интенсивно желтую
окраску, обесцвечивается. Об активности АДГ судят по скорости светопоглощения
красителя, которое регистрируют на спектрофотометре при 440 нм.
Ход определения. Спектрофотометр подготавливают к работе, устанавливают
рабочую длину волны на 440 нм и стрелку шкалы отсчета с помощью рукоятки на
«нуль» при закрытой шторке.
В кювету спектрофотометра помещают 2 мл раствора n-нитрозодиметиланилина
и 0,5 мл сыворотки крови. Против этой кюветы рукояткой «щель» устанавливают
шкалу отсчета на 0,300, после чего реакцию запускают добавлением в кювету 0,1
мл раствора НАД в растворе бутанола. Смесь быстро перемешивают стеклянной
палочкой. Регистрируют снижение экстинкции инкубационной среды в течение 2 мин
при 25˚С.
Примечание. Определение активности АДГ в каждом образце сыворотки
проводят дважды, а при расхождении результатов измерения более чем на 10% - три
раза. После этого вычисляют среднее значение изменения экстинкции за 1 мин.
Расчет производится по формуле
х = 320,5∆Е ,
где х - активность АДГ, мкмоль/(мин∙л);
,5 - коэффициент расчета активности, выраженный в мкмолях превращенного
субстрата при указанных условиях инкубации;
∆Е - изменение экстинкции при 440 нм за 1 мин.
Если изменение экстинкции при 440 нм превышает 0,050 за 1 мин, то
сыворотку крови следует развести натрий-фосфатным буфером в 2-4 раза.
Измеренную величину активности умножить на фактор разведения.
Для определения активности АДГ рекомендуется брать свежеполученную
сыворотку крови. При хранении активность фермента снижается, поэтому значение
активности, измеренной после хранения, следует умножить на соответствующий
коэффициент, установленный эмпирически:
|
Время хранения сыворотки,
сут.
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Коэффициент:
|
|
|
|
|
|
|
|
|
|
при 4˚С
|
1,00
|
1,03
|
1,04
|
1,09
|
1,11
|
1,12
|
1,15
|
1,17
|
|
при 20˚С
|
1,00
|
1,18
|
1,20
|
1,43
|
1,47
|
1,54
|
1,66
|
2,38
|
Оформление работы. Сравнить полученное значение активности АДГ с нормой и
сделать соответствующие выводы.
Практическое значение работы. Алкогольдегидрогеназа не проявляет
абсолютной субстратной специфичности. Этот фермент катализирует окисление,
помимо этанола, ряда первичных и вторичных спиртов, этиленгликоля и т.д.,
причем в некоторых случаях с большей скоростью, чем этанола. АДГ содержится в
гиалоплазме клеток многих органов и тканей, но в ткани печени ее активность в
20-40 раз выше, чем в других. В сыворотке крови концентрация фермента у
здоровых людей очень низка и традиционными методами практически не выявляется.
Описанный метод позволяет определить активность АДГ. У здоровых людей
активность АДГ в сыворотке крови регистрируется в пределах 0,32-2,56, а в
среднем 1,18 мкмоль/мин∙л. У лиц, злоупотребляющих алкоголем, активность
фермента в сыворотке крови повышается в зависимости от длительности приема
алкоголя и стадии алкоголизма. Тест на алкогольдегидрогеназу сыворотки крови
используется в диагностике алкоголизма и контроля эффективности лечения этого
заболевания.
Низкая активность АДГ при поражениях печени, в которой окисляется до 90%
поступающего в организм этанола и других спиртов, или генетическая
недостаточность этого фермента снижает обезвреживание алкоголя и усугубляет его
отрицательное действие на функции систем организма.
Работа 105. Определение ацетилирующей
способности организма по выделению с мочой свободной и ацетилированной форм
сульфаниламидов по А.М. Тимофеевой в модификации Г.А. Пономарева
Процесс ацетилирования является одной из разновидностей реакций
конъюгации ксенобиотиков, происходящих в клетках с участием ферментов.
Ариламины, в том числе сульфаниламиды, подвергаются N-ацетилированию в
организме и поэтому по выделению свободной и ацетилированной форм этих веществ
можно оценить активность процесса ацетилирования.
Реактивы. Соляная кислота, 10%-ный раствор; нитрит натрия, 0,5%-ный
раствор, свежеприготовленный; ацетат натрия, насыщенный раствор; Н-кислота
ацетилированная, свежеприготовленный 0,5%-ный раствор.
Оборудование. Водяная баня; штатив с пробирками; пробки, обернутые
фольгой; пипетки вместимостью 1 и 5 мл; ФЭК.
Материал. Моча, содержащая свободный и ацетилированный сульфаниламиды.
(Для получения мочи белым крысам вводят внутрижелудочно с помощью зонда порошок
сульфадимезина из расчета 0,5 г на 1 кг массы тела в виде взвеси в 3 мл воды. Животных
отсаживают на сутки в стеклянные выделительные воронки для сбора мочи.
Собранную мочу доводят дистиллированной водой до объема 25 мл и фильтруют через
бумажный фильтр).
Метод основан на способности диазотированного сульфаниламида при
взаимодействии с ацетилированной Н-кислотой
(1,6-аминооксинафталин-3,5-дисульфокислота) образовывать комплекс розового
цвета, интенсивность которого пропорциональна концентрации сульфаниламида.
Содержание суммы сульфаниламидов (ацетилированных и свободных) в моче
устанавливают после гидролиза проб с соляной кислотой, в ходе которого
происходит образование свободной формы сульфаниламида из ацетилированной.
Ход определения. В две пробирки (одна для определения общего, а другая -
свободного сульфадимезина) отмеривают по 1 мл разведенной в 20 раз мочи, по 1,5
мл дистиллированной воды и по 0,25 мл раствора соляной кислоты. В третью
пробирку (контрольная) вносят 2,5 мл воды и 0,25 мл раствора соляной кислоты.
Одну пробирку (для определения общего сульфадимезина) закрывают пробкой,
обернутой фольгой, и ставят на гидролиз в кипящую водяную баню на 15 мин. Затем
пробирку охлаждают.
Во все три пробирки приливают по 2 капли раствора нитрита натрия,
тщательно перемешивают содержимое и оставляют стоять 10 мин. Добавляют во все
пробы по 1,5 мл насыщенного раствора ацетата натрия, закрывают пробирки
пробками и энергично встряхивают их несколько раз.
Прибавляют во все пробирки по 0,25 мл раствора ацетилированной Н-кислоты.
Вновь перемешивают содержимое и оставляют стоять пробы на 15 мин для развития
окрашивания.
Измеряют экстинкцию опытных проб против контроля на ФЭКе при 440 нм
(светофильтр синий) в кювете с толщиной слоя 0,5 см.
Расчет проводят по формуле
(Е2 - Е1)100
х = ------- ,
Е2
где х - ацетилирующая способность организма, % ацетилированного
сульфадимезина
Е1 - экстинкция свободного сульфадимезина, содержащегося в пробе, не
подвергшейся гидролизу;
Е2 - экстинкция общего сульфадимезина (свободный + ацетилированный),
содержащегося в пробе, подвергнутой гидролизу.
Оформление работы. Занести значения экстинкции в тетрадь и рассчитать
ацетилирующую способность организма по сульфадимезину. Сделать вывод о
возможности метаболизма ксенобиотиков посредством ацетилирования и значении
этого процесса.
Практическое значение работы. По степени ацетилирования сульфаниламидов
или других ксенобиотиков, подвергающихся в организме ацетилированию, судят об
активности ферментной системы ариламинацетилтрансферазы в клетках, которая
катализирует реакции ацетилирования (конъюгации) различных соединений. Для
сульфаниламидов реакция ацетилирования является основным ведущим механизмом
конъюгации, другие конъюгаты для большинства сульфаниламидов образуются в
незначительном количестве. Ацетилирование приводит к инактивации (обезвреживанию)
сульфаниламидов и выведению их из организма с мочой. Поэтому степень
ацетилирования сульфаниламидов указывает также на соотношение
бактериостатически активной и неактивной форм препаратов. Чем быстрее
ацетилируется сульфаниламид, тем меньше его бактериостатическая активность
Работа 106. Выявление ацетилирования
(инактивации) гидразида изоникотиновой кислоты (ГИНК) в организме
Реактивы. Реактив метаванадата аммония*; соляная кислота, 0,5 М раствор.
Оборудование. Штатив с пробирками; пробки, обернутые фольгой; пипетки
вместимостью 1 и 2 мл; водяная баня.
Материал. Моча, содержащая свободную и ацетилированную формы ГИНК. (Для
получения мочи белым крысам вводят порошок ГИНК в дозе 100 мг на 1 кг массы
тела в виде взвеси в 3 мл воды через рот с помощью специального зонда. Крыс
отсаживают на 12 ч в стеклянные выделительные воронки для сбора мочи. Объем
мочи доводят водой до 10 мл и фильтруют через бумажный фильтр).
Метод основан на выявлении свободной формы ГИНК, которая с метаванадатом
аммония в кислой среде дает комплексное соединение коричнево-красного цвета.
Разница в окраске между пробами мочи до и после гидролиза указывает на степень
ацетилирования ГИНК в организме:
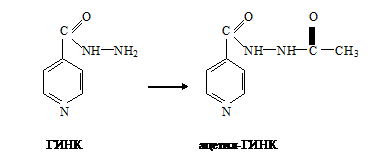
Ход
определения. Собранную мочу разводят в 20 раз дистиллированной водой. В две
пробирки вносят по 1 мл разведенной мочи; в одну из них (для определения общей
ГИНК, т.е. суммы свободной и ацетилированной форм препарата) добавляют 1 мл
раствора соляной кислоты, а во вторую (для выявления свободной ГИНК) - 1 мл
дистиллированной воды.
Первую
пробирку закрывают пробкой и ставят на 20 мин на кипящую водяную баню, после
чего охлаждают под струей водопроводной воды. В обе пробирки приливают по 2 мл
реактива метаванадата аммония и отмечают разницу в окрашивании исследуемых проб
мочи.
Оформление
работы. По разнице в окраске проб мочи дать примерную оценку степени
ацетилирования ГИНК в организме и указать на значение этой реакции для
практики.
Практическое
значение работы. Реакция N-ацетилирования ГИНК осуществляется специальной
ацетилтрансферазой, содержащейся в различных тканях организма. В зависимости от
активности этого фермента у разных людей их делят на быстрых и медленных
«инактиваторов» (ацетиляторов) ГИНК, что имеет значение не только для
практической фармакогенетики, но и для рациональной терапии. По степени
ацетилирования ГИНК устанавливается эффективная индивидуальная доза препарата
для конкретного больного.
1. Исследование пероксидного окисления липидов
биологических мемебран
Пероксидное (перекисное) окисление липидов молекулярным методом
представляет собой цепной свободно-радикальный процесс. Наиболее легко подобным
образом окисляются ненасыщенные липиды или свободные жирные кислоты, входящие в
состав фосфолипидов биологических мембран. Поэтому скорость пероксидного
окисления липидов прежде всего оказывает влияние на функцию мембран и на
развитие в них патологических изменений.
Зарождение этого процесса связывают с появлением в среде, например,
пероксидного радикала НО2˙, возникающего при окислении Fe2+ молекулярным
кислородом:
+ + O2 + H+ → Fe3+ + HO2˙
Пероксидный радикал может реагировать с молекулой ненасыщенного липида
или свободной жирной кислоты (RH) биомембран. При этом образуется липидный
радикал R˙.
HO2˙ = RH →H2O2 + R
который запускает цепную реакцию окисления липидов (стадия инициирования,
или зарождения цепей). Образование R˙ связано с отрывом атома водорода от
углерода, находящегося в α-положении к двойной связи, например, в положениях 8,
11, 14 и 17 линоленовой кислоты:
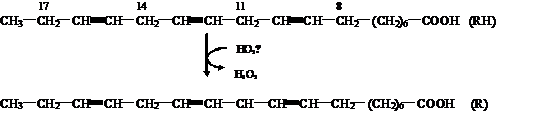
Если
радикал образуется при отрыве атома водорода в положении 11 или 14, то электрон
неспаренной валентности делокализуется, что приводит к появлению молекул липида
с двумя сопряженными двойными связями (диеновые конъюгаты), имеющих максимум
поглощения при 233 нм.
В
присутствии кислорода радикал R˙ дает
новый свободный радикал липида - пероксидный RO2˙.
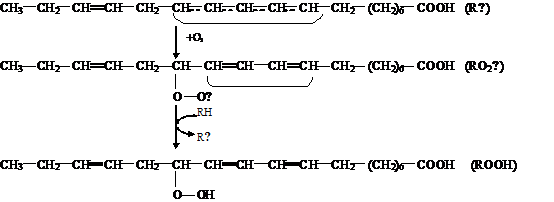
Пероксидный
радикал может взаимодействовать с новой молекулой жирной кислоты RH с
образованием гидропероксида (гидроперекиси) липида ROOH и очередного липидного
радикала R˙;
Причем
сопряженные двойные связи (диеновая конъюгация), отмеченные в формулах скобкой,
сохраняются в гидропероксидах липидов, образующих при свободнорадикальном
окислении таких полиненасыщенных жирных кислот, как линолевая, линоленовая,
арахидоновая. Две последние реакции сохраняют присутствие радикалов RO2 и R в
системе, обеспечивая продолжение цепного окисления липидов:
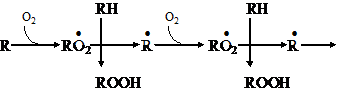
Подобная
цепь пероксидного окисления липидов называется неразветвленной. Длина ее
зависит от числа радикалов RO2˙, которые
«ведут» цепное окисление. Каждый радикал приводит к образованию нескольких
молекул ROOH, по числу которых судят о длине неразветвленных цепей пероксидного
окисления липидов. Следовательно, первичными продуктами пероксидного окисления
липидов являются гидропероксиды липидов, среди которых определенный процент
падает на диеновые конъюгаты.
При
разложении накопившихся гидропероксидов липидов с участием Fe2+ появляется
новый радикал - RO (оксидный радикал жирной кислоты, или алкоксидный радикал):
+
Fe2+ → RO + OHˉ + Fe3+
Далее
пероксидное окисление липидов развивается по разветвленному механизму
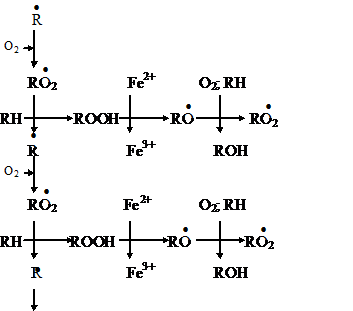
При
этом накапливаются другие продукты пероксидного окисления липидов: спирты,
кетоны, эпоксиды, альдегиды и диальдегиды и т.д. Среди диальдегидов
представляет интерес малоновый диальдегид CH2(CHO)2, который образуется при
свободнорадикальном окислении линоленовой и арахидоновой кислот, но не
олеиновой или линолевой. Его определение служит одним из методов исследования
пероксидного окисления липидов.
Пероксидное
окисление фосфолипидов и ненасыщенных жирных кислот, входящих в состав
биомембраны, может полностью разрушить ее липидную основу.
Однако
этому препятствует взаимодействие радикалов R˙ и RO2 друг с другом, реакция тех же радикалов с Fe2+ и
взаимодействие радикалов с антиоксидантами. При этом в первых двух реакциях
образуются молекулярные продукты, а в третьей - малоактивные радикалы антиоксиданта,
что вызывает обрыв цепей свободнорадикального окисления.
В клетках выделяют два типа пероксидного окисления липидов - ферментный и
неферментный, которые отличаются рядом признаков. Ферментная система требует
участия ферментного белка (поэтому в отличие от неферментной инактивируется
нагреванием), пирофосфата, ионов железа и в качестве восстановителя НАДФ·Н
(НАДФ·Н-зависимая ферментная система пероксидного окисления, НЗП). Неферментная
система нечувствительна к нагреванию; она требует ионов железа и аскорбата в
качестве восстановителя (аскорбат-зависимое неферментное пероксидное окисление,
АЗП). Отличительным признаком этих двух систем служит чувствительность к ионам
железа, пирофосфата и фосфата. Система НЗП имеет очень высокое сродство к ионам
железа, поэтому достаточно следовых количеств их для протекания максимальной
скорости реакций. Для тех же условий АЗП требует значительных концентраций
ионов железа, которые добавляются в среду при исследовании этого процесса в
клетках. Активность НЗП резко усиливается пирофосфатом и угнетается фосфатом,
тогда как АЗП ингибируется обоими веществами.
Наиболее активны обе системы пероксидного окисления в мембранах микросом.
Обнаружено также пероксидное окисление липидов, особенно АЗП, в митохондриях,
лизосомах, мембранах эритроцитов и т.д.
Накопление таких продуктов пероксидного окисления, как гидропероксиды
липидов, приводит к ингибированию многих ферментных белков и нарушает их
функцию. Кетоны, альдегиды и диальдегиды образуют ковалентные внутримолекулярные
и межмолекулярные связи («сшивки») и с функциональными группами белков и других
биомолекул, что также ведет к изменениям клеточных функций.
Развитию свободнорадикальных реакций окисления липидов способствуют
прооксиданты, а сдерживают его ингибиторы - антиоксиданты. К последним
относятся α-токоферол, селен, некоторые гормоны (тироксин, стероидные) и
т.д. От вредного действия гидропероксидов липидов клетку защищает ферментная
система глутатионпероксидазы, разрушающая эти вещества.
Для исследования процессов пероксидного окисления липидов используются
методы: а) определения продуктов пероксидного окисления липидов; б) регистрации
свободных радикалов в ходе реакции; в) определения антиокислительной
(антиоксидантной) активности тканей.
Первые два наиболее просты для выполнения и нашли широкое применение, в
частности, метод определения наиболее изученного продукта пероксидного
окисления - малонового диальдегида.
Работа 107. Определение чувствительности
эритроцитов к пероксидному гемолизу
Реактивы. Фосфатный буфер, 1М раствор с рН 7,4*; хлорид натрия, 170 г/л
раствор; рабочий свежеприготовленный раствор хлорида натрия, объем смеси
доводят до 1 л и перед употреблением насыщают кислородом воздуха путем
встряхивания; фосфатный буфер, 0,17 М раствор с рН 7,4х; раствор гидрохлорида
натрия, приготовленный на фосфатном буфере (0,17 М фосфатный буфер и 1%-ный
раствор NaCl в соотношении 1:3 по объему); изотонический спиртовой раствор
эргокальциферола Д2 (продажный препарат 0,5%-ного спиртового раствора
эргокальциферола разбавляют в 50 раз раствором гидрохлорида натрия на фосфатном
буфере); аммиачный раствор (растворяют 1 мл концентрированного раствора аммиака
в колбе вместимостью 250 мл); ацетат α-токоферола, 5%-ный масляный раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 5 и 10 мл;
стеклянные палочки; центрифуга с центрифужными весами; термостат,
отрегулированный на 38˚С; ФЭК или спектрофотометр.
Материал. Кровь, взятая из пальца.
а. Определение спонтанного гемолиза по Ягеру. Метод основан на определении
при 540 нм экстинкции внеэритроцитарного гемоглобина, поступающего в среду
вследствие спонтанного лизиса мембран эритроцитов, вызванного пероксидным
окислением липидов кислородом воздуха.
Ход определения. В пробирку с 7,5 мл рабочего раствора хлорида натрия
добавляют 0,1 мл крови. Готовят суспензию эритроцитов, втягивая и выдувая
жидкость с помощью пипетки.
Центрифугируют взвесь 10 мин при 1000 об/мин, надосадочную жидкость
осторожно отсасывают. К осадку эритроцитов добавляют 7,5 мл рабочего раствора
хлорида натрия и вновь суспензируют тем же способом.
В три центрифужные пробирки наливают по 1 м приготовленной суспензии: в
первые две пробирки прибавляют по 4 мл рабочего раствора хлорида натрия; а в
третью - 4 мл дистиллированной воды (для полного гемолиза). Пробы перемешивают
стеклянной палочкой и ставят на 2 ч в термостат при 38˚С.
По окончании инкубации содержимое пробирок перемешивают, центрифугируют
10 мин при 1000 об/мин и измеряют экстинкцию всех проб против дистиллированной
воды на ФЭКе или спектрофотометре при 540 нм (светофильтр зеленый) в кювете с
толщиной слоя 1 см.
Расчет проводят по формуле
(Е1 + Е2)100
х = --------
2Е3
где х - степень гемолиза, %;
Е1 и Е2 - экстинкции первой и второй проб;
Е3 - экстинкция третьей пробы.
б. Исследование гемолитического действия витамина D2 (эргокальциферола)
по В.Б.Спиричеву и Н.В.Блажеевич. Метод основан на определении при 540 нм
экстинкции внеэритроцитарного гемоглобина, выход которого усиливается с помощью
витамина D2, запускающего пероксидное окисление липидов в мембранах
эритроцитов. α-токоферол как антиоксидант уменьшает гемолитическую
активность эргокальциферола.
Ход определения. В три пробирки вносят по 0,1 мл крови. В одну
предварительно наливают 4 мл изотонического раствора эргокальциферола
(прооксидант), а в другую - тот же объем раствора эргокальциферола и 1 каплю
раствора ацетата α-токоферола (антиоксидант), в третью - 4 мл раствора
хлорида натрия на фосфатном буфере (контроль).
Суспензируют эритроциты во всех пробах, втягивая и выдувая жидкость с
помощью пипетки, и оставляют стоять при 20-22˚С. Через 30 мин пробы
центрифугируют в течение 10 мин при 3000 об/мин, отбирают 0,1 мл надосадочной
жидкости в три чистые пробирки и прибавляют в них по 5 мл аммиачного раствора.
Осадок эритроцитов в центрифужных пробирках вновь суспензируют, втягивая
и выдувая жидкость пипеткой, и оставляют их стоять при 20-22˚С еще на 30
мин. По истечении этого времени пробы вновь центрифугируют в том же режиме,
отбирают по 0,1 мл надосадочной жидкости в три чистые пробирки и приливают в
них по 5 мл аммиачного раствора.
После добавления аммиачного раствора все шесть пробирок закрывают
кусочком фольги и энергично встряхивают содержимое 2 мин. Затем измеряют
экстинкцию в пробах против контроля на ФЭКе или на спектрофотометре при 540 нм
(светофильтр зеленый) в кювете с толщиной слоя 1 см.
Расчет проводят по формуле
Е3100 Е2100
х = ---- и А = ----- ,
Е1 Е1
где х - степень гемолиза при добавлении эргокальциферола, %;
Е1 - экстинкция пробы с эргокальциферолом;
Е3 - экстинкция контрольной пробы;
А - степень гемолиза после совместного добавления эргокальциферола и α-токоферола, %
Е2 - экстинкция пробы с эргокальциферолом и α-токоферолом.
Торможение антиоксидантом пероксидного окисления (в %) рассчитывают по
формуле
А100
----- .
х
Оформление работы. Провести необходимые расчеты и сделать вывод о
причинах спонтанного гемолиза, а также о действии изучаемых прооксидантов и
антиоксидантов.
Практическое значение работы. По степени гемолиза эритроцитов можно
судить о состоянии антиокислительных систем клетки, в частности, об
обеспеченности организма витамином Е. При нормальной обеспеченности спонтанный
гемолиз, как правило, составляет 2-10%. Недостаток витамина Е резко повышает
этот показатель. Имеется соответствие между спонтанным или индуцированным
гемолизом и содержанием токоферолов в сыворотке крови. Способность витамина D2
ускорять пероксидное окисление липидов в мембранах эритроцитов и других клеток
свидетельствует о его прооксидантных свойствах.
Работа 108. Определение скорости пероксидного
окисления липидов в биомембранах
Реактивы. Трис-HCl буфер, 0,04 М раствор с рН 7,4*; соль Мора -
Fe(NH4)2(SO4)2, 4·10-5 М свежеприготовленный раствор; трихлоруксусная кислота,
40%-ный раствор; тиобарбитуровая кислота, 0,8%-ный свежеприготовленный раствор;
оксалат натрия, 1,34%-ный раствор; хлорид натрия, 0,9%-ный раствор; хлорид
калия, 1,2%-ный раствор.
Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1 и 5 мл;
пастеровские пипетки; резиновая груша; водяная баня с термометром или водяная
баня аппарата Варбурга; аптечные весы с разновесами; спектрофотометр или ФЭК
типа КФК-2.
Материал.
1. Кровь, взятая в смеси с раствором
оксалата натря в соотношении 10:1 (по объему).
2. Печень свежезабитого животного.
а. Определение скорости пероксидного окисления липидов в мембранах
эритроцитов. Метод основан на определении содержания конечного продукта
пероксидного окисления липидов - малонового диальдегида, который при
взаимодействии с тиобарбитуровой кислотой образует окрашенный в розовый цвет
триметиновый комплекс, имеющий максимум поглощения при 530-532 нм:
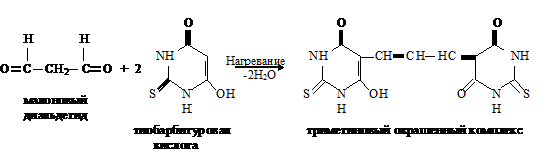
Окраска
раствора пропорциональна концентрации малонового диальдегида. Молярный
коэффициент экстинкции 1,56·10-5л·моль-1·см-1.
Ход
определения. Оксалатную кровь центрифугируют 10 мин при 3000 об/мин, осаждая
эритроциты. Верхний слой отсасывают, а осадок эритроцитов трижды промывают
раствором хлорида натрия и переосаждают при том же режиме центрифугирования.
Отбирают
0,5 мл осадка эритроцитов в чистую центрифужную пробирку, приливают равный
объем дистиллированной воды и оставляют стоять 30 мин для полного гемолиза.
Пробу
центрифугируют 30 мин при 3000 об/мин, осторожно отсасывают пастеровской
пипеткой надосадочную жидкость с серой прослойкой мембран эритроцитов и
переносят в другую пробирку.
Берут
три чистые пробирки. В первую опытную вносят по 0,3 мл растворов соли Мора,
трис-буфера, аскорбиновой кислоты и 0,1 мл полученной взвеси мембран
эритроцитов. Во вторую опытную приливают 0,3 мл трис-буфера, 0,1 мл взвеси
мембран эритроцитов и 0,6 мл дистиллированной воды. В третью (контроль)
добавляют те же реактивы, что и в первую пробирку, после чего сразу приливают 1
мл раствора трихлоруксусной кислоты.
Все
пробирки помещают в водяную баню (или в баню аппарата Варбурга) и инкубируют
пробы 20 мин при 37˚С. Реакцию в опытных пробах останавливают, добавляя в
обе пробирки по 1 мл раствора трихлоруксусной кислоты.
Все пробы центрифугируют 15 мин при 3000 об/мин. Сливают надосадочную
жидкость (ее объем 2 мл) в три другие пробирки, прибавляют по 1 мл раствора
тиобарбитуровой кислоты и помещают пробы на 10 мин в кипящую водяную баню.
Затем пробирки охлаждают в ледяной воде.
Измеряют экстинкцию полученных проб против контроля на спектрофотометре
при 532 нм или на ФЭКе (светофильтр зеленый) в кювете с толщиной слоя 1 см.
Расчет по формулам
Е13∙6 Е23∙6
х1 = ---- и х2 = ---- ,
0,156 0,156
где х1 - скорость образования в пробе малонового диальдегида в
присутствии прооксидантов (индуцированное пероксидное окисление липидов), нмоль∙ч-1;
х2 - скорость образования в пробе малонового диальдегида в отсутствие
прооксидантов (спонтанное пероксидное окисление липидов), нмоль∙ч-1;
- объем пробы, мл;
- коэффициент пересчета на 1 час;
,156 - экстинкция 1 нмоля при 532 нм;
Е1 и Е2- экстинкции соответственно первой и второй проб против контроля.
б. Определение скорости пероксидного окисления липидов в гомогенатах
тканей. Принцип метода описан выше.
Ход определения. Навеску 0,5 г печени гомогенизируют в 19,5 мл
охлажденного до 0-4˚С раствора хлорида калия, поместив стакан
гомогенизатора в лед или снег. Полученный гомогенат сливают в пробирку.
В одну пробирку наливают 2,0 мл гомогената и 0,2 мл дистиллированной
воды, во вторую - 2 мл гомогената и по 0,1 мл растворов аскорбиновой кислоты и
соли Мора, в третью - те же вещества, что и во вторую, и, кроме того, добавляют
1 мл раствора трихлоруксусной кислоты.
Все пробирки помещают на 10 мин в водяную баню при 37˚С, после чего
прибавляют в первые две пробирки по 1 мл раствора трихлоруксусной кислоты.
Далее все пробы центрифугируют 10 мин при 3000 об/мин.
По 2 мл надосадочной жидкости отбирают в три чистые пробирки, приливают
по 1 мл раствора тиобарбитуровой кислоты и помещают пробы в кипящую водяную
баню на 10 мин. После этого их охлаждают в ледяной воде до комнатной
температуры.
Измеряют экстинкцию всех проб против контрольного раствора (2 мл раствора
хлорида калия, 1 мл раствора трихлоруксусной кислоты и 1 мл раствора
тиобарбитуровой кислоты, выдерживают 10 мин на кипящей водяной бане и охлаждают
в ледяной воде до комнатной температуры) на спектрофотометре при 532 нм или
ФЭКе (светофильтр зеленый) в кювете с толщиной слоя 1 см.
Расчет проводят по формулам:
Е1(Е2)3∙3,2∙6 Е33∙3,2
х1 (х2)= ------ и х3 = ------ ,
0,156∙2 0,156∙2
где х1 - скорость спонтанного пероксидного окисления липидов в
гомогенатах, измеряющаяся в наномолях образовавшегося малонового диальдегида в
пробе за час инкубации;
х2 - скорость аскорбат-зависимого неферментативного пероксидного
окисления липидов в наномолях образовавшегося малонового диальдегида в пробе за
час инкубации;
х3 - содержание малонового диальдегида в исходном гомогенате, нмоль;
Е1, Е2 и Е3- экстинкции соответственно первой, второй и третьей проб;
,2 - общий объем исследуемых проб, мл;
- объем надосадочной ждкости, взятой на определение малонового диальдегида,
мл;
- объем проб, взятых на фотометрию, мл;
,156 - экстинкция 1 нмоль малонового диальдегида в 1 мл при 532 нм;
Оформление работы. Рассчитать полученные результаты, дать сравнительную
характеристику скорости спонтанного и индуцированного пероксидного окисления
липидов, сделать вывод о возможности использования метода для оценки скорости
пероксидного окисления липидов и его применимости на практике.
Практическое значение работы. Методы определения скорости пероксидного
окисления липидов биомембран важны для оценки действия на эту систему природных
веществ и ксенобиотиков, среди которых могут быть как прооксиданты, так и
антиоксиданты. Эти исследования дают возможность практически использовать
выявленный эффект различных соединений, в том числе лекарственных средств.
Увеличение скорости пероксидного окисления липидов возможно при старении,
гиповитаминозе Е, дефиците селена, действии ионизирующего облучения,
гипербарической оксигенации (действии кислорода под повышенным давлением), при
некоторых заболеваниях и патологических состояниях (сердечно-сосудистых
заболеваниях, гипоксии, отравлении четыреххлористым углеродом, гипервитаминозах
А и D и т.д.).
Гемоглобин и кислород, содержащиеся в эритроцитах, ускоряют пероксидное
окисление липидов, что вызывает повреждение мембран эритроцитов и их гемолиз.
Защита эритроцитарных мембран осуществляется системой антиоксидантов:
токоферолами, имеющимися в мембранах и плазме крови, глутатионпероксидазой,
обезвреживающей гидропероксиды липидов, и альбумином плазмы, который связывает
пероксиды липидов.
При недостаточности антиоксидантной системы развиваются гемолитические
состояния, которые часто провоцируются некоторыми пищевыми факторами и
лекарственными средствами.
ПРИЛОЖЕНИЕ
Некоторые биохимические показатели жидких сред
организма
КРОВЬ 1. Общие показатели
цельной крови
|
Эритроциты
|
4,0-5,0∙1012 /л
|
|
Гемоглобин:
|
|
|
мужчины
|
130-160 г/л
|
|
женщины
|
120-140 г/л
|
|
Цветной показатель
|
0,8-1,0
|
|
Фетальный гемоглобин
|
0,75-0,97%
|
|
Гликозилированный
гемоглобин
|
3-5,5% от общего гемоглобина
|
|
Ретикулоциты
|
0,2-1,0%
|
|
Лейкоциты
|
4,0-9,0∙109 /л (100%)
|
|
Нейтрофилы
|
2,0-5,5∙109 /л
(47-72%)
|
|
Эозинофилы
|
0,02-0,3∙109 /л
(1-5%)
|
|
Базофилы
|
0-0,065∙109 /л (0-1%)
|
|
Лимфоциты
|
|
Моноциты
|
0,09-0,6∙109 /л
(3-11%)
|
|
Тромбоциты
|
180-320∙109 /л
|
|
СОЭ
|
3-12 мм/ч
|
2. Биохимические показатели плазмы крови
а. Белки
|
Общие белки65-85 г/л
|
|
|
Альбумины
|
35-60 г/л
|
|
Преальбумины
|
0,1-0,4 г/л
|
|
Глобулины:
|
25-35 г/л
|
|
α1-глобулины
|
2,5-5%
|
|
α2-глобулины
|
7-13%
|
|
β-глобулины
|
8-14%
|
|
γ-глобулины
|
12-22%
|
|
фибриноген
|
2,0-7,0 г/л
|
|
Липопротеиды:
|
|
|
хиломикроны
|
0-0,5 г/л
|
|
пре-β-липопротеиды
|
1,5-2,0 г/л
|
|
β-липопротеиды
|
3,0-6,0 г/л
|
|
Гаптоглобин
|
0,28-1,90 г/л
|
б. Ферменты
|
Аланинаминотрансфераза
|
0,16-0,68 ммоль/(ч∙л)
|
|
Аспартатаминотрансфераза
|
0,10-0,45 ммоль/(ч∙л)
|
|
Лактатдегидрогеназа
|
0,8-4,0 ммоль/(ч∙л)
|
|
Креатинкиназа
|
до 1,2 ммоль Р/(ч∙л)
|
|
Фруктозо-1,6-бисфосфат-альдолаза
|
3,6-21,8 мкмоль/(ч∙л)
|
|
Сорбитдегидрогеназа
|
0,9 мкмоль/(ч∙л)
|
|
Ацетилхолинэстераза
|
160-340 ммоль/(ч∙л)
|
|
α-Амилаза
|
15-30 г/(ч∙л)
|
|
Кислая фосфатаза
|
0,05-0,13 ммоль/(ч∙л)
|
|
Щелочная фосфатаза
|
0,5-1,3 ммоль/(ч∙л)
|
|
γ-глютамилтрансфераза
|
167-1767 нмоль/с∙л
|
в. Небелковые азотсодержащие вещества
|
Азот остаточный
(небелковый)19,5-30 ммоль/л
|
|
|
Азот α-аминокислот
|
3,5-5,5 ммоль/л
|
|
Креатин
|
15-70 мкмоль/л
|
|
Креатинин
|
40-150 мкмоль/л
|
|
Мочевина
|
3,0-7,0 ммоль/л
|
|
Мочевая кислота
|
0,1-0,4 ммоль/л
|
|
Пигменты:
|
|
|
билирубин общий
|
8,0-20,0 мкмоль/л
|
|
билирубин неконъюгированный
|
75% общего
|
|
билирубин конъюгированный
|
25% общего
|
|
моноглюкуронид
|
5% общего
|
|
диглюкуронид
|
20% общего
|
г. Углеводы и метаболиты
|
Глюкоза
|
2,8-4,0 ммоль/л
|
|
Сахар
|
0,8-1,2 г/л
|
|
Лактат
|
0,5-2,0 ммоль/л
|
|
Пируват
|
0,1-0,13 ммоль/л
|
|
Сиаловые кислоты
|
2,00-2,36 ммоль/л
|
д. Липиды и метаболиты
|
Общие липиды
|
4,0-8,0 г/л
|
|
Триацилглицерины
|
0,5-2,1 ммоль/л
|
|
Фосфолипиды общие
|
2,0-3,5 ммоль/л
|
|
Холестерин общий
|
4,0-6,2 ммоль/л
|
|
Жирные кислоты свободные
|
0,3-0,8 ммоль/л
|
|
Кетоновые тела (в пересчете
на ацетон)
|
100-600 мкмоль/л
|
е. Минеральные вещества
|
Плазма
|
Эритроциты
|
|
Калий
|
3,6-5,0 ммоль/л
|
80-100 ммоль/л
|
|
Натрий
|
135-155 ммоль/л
|
8,0-13 ммоль/л
|
|
Кальций
|
2,25-2,75 ммоль/л
|
|
|
Магний
|
0,7-1,2 ммоль/л
|
1,4-2,4 ммоль/л
|
|
Фосфор
|
3,0-5,0 ммоль/л
|
13-20 ммоль/л
|
|
Хлор
|
97-108 ммоль/л
|
75-85 ммоль/л
|
|
Сульфаты
|
0,4-0,6 ммоль/л
|
|
|
Железо
|
12-32 мкмоль/л
|
|
ж. Гормоны, медиаторы и их метаболиты
|
Инсулин
|
0,5-5,0 мкг/л
|
|
Адреналин
|
0,1-0,5 нмоль/л
|
|
Тироксин (общий)
|
90-120 нмоль/л
|
|
Альдостерон
|
300-800 нмоль/л
|
|
Эстрогены
|
0,07-1,7 ммоль/л
|
|
Тестостерон:
|
|
|
мужчины
|
10-40 нмоль/л
|
|
женщины
|
0,7-3,0 нмоль/л
|
|
17-оксикортикостероиды
|
300-600 нмоль/л
|
|
Гистамин
|
2,0-40 нмоль/л
|
|
Серотонин
|
30-60 нмоль/л
|
Осадочные пробы
|
Тимоловая проба0-4 ед.
мутности
|
|
|
Сулемовая проба
|
1,6-2,2 мл сулемы
|
|
Проба Вельтмана
|
0,4-0,5 хлорида кальция
|
з. Витамины
|
А (ретинол)
|
0,5-2,0 мкмоль/л
|
|
Е (токоферол)
|
20-40 мкмоль/л
|
|
В1 (тиамин)
|
40-400 нмоль/л
|
|
В2 (рибофлавин)
|
0,06-1,0 мкмоль/л
|
|
В3 (пантотеновая кислота)
|
0,3-1,5 мкмоль/л
|
|
В5 (никотиновая кислота)
|
2,0-12 мкмоль/л
|
|
С (аскорбиновая кислота)
|
30-90 мкмоль/л
|
|
Н (биотин)
|
40-75 нмоль/л
|
МОЧА 1. Общие клинические нормы
|
Объем:
|
|
|
мужчины
|
1500 мл/сут
|
|
женщины
|
1200 мл/сут
|
|
Цвет
|
Соломенно-желтый
|
|
Плотность
|
1,001-1,040 (в среднем
1,012-1,020)
|
|
рН
|
5,0-7,0
|
|
Осмотическая концентрация
|
1000-1200 мосмоль/л
|
|
Белки
|
Следы
|
|
Глюкоза
|
Следы
|
|
Ацетоновые тела
|
Следы
|
|
Лейкоциты
|
2∙106 /л (по
Нечипоренко)
|
|
Эритроциты
|
1∙106 /л (по
Нечипоренко)
|
2. Специальное исследование мочи
а. Ферменты
б. Небелковые азотсодержащие вещества
|
Аминокислоты (по азоту)
|
0,29-5,35 ммоль/сут
|
|
Мочевина
|
333-582,8 ммоль/сут
|
|
Мочевая кислота
|
2,36-5,9 ммоль/сут
|
|
Креатинин
|
4,4-17,6 ммоль/сут
|
|
Креатин
|
0-0,456 ммоль/сут
|
|
Аммиак
|
30-60 ммоль/сут
|
|
Дельта-аминолевулиновая
кислота
|
3,9-19,0 мкмоль/г
креатинина
|
|
Копропорфирин
|
30,5-122,0 нмоль/г
креатинина
|
в. Минеральные компоненты
|
Калий
|
61-79 ммоль/сут
|
|
Натрий
|
174-222 ммоль/сут
|
|
Кальций
|
4,02-4,99 ммоль/сут
|
|
Магний
|
1,20-8,19 ммоль/сут
|
г. Гормоны, медиаторы и их метаболиты
|
Альдостерон
|
2,8-41,6 нмоль/сут
|
|
17-Оксикортикостероиды
(общие)
|
3,61-20,38 мкмоль/сут
|
|
17-Кетостероиды:
|
|
|
мужчины
|
22,9-81,1 мкмоль/сут
|
|
женщины
|
17,2-62,5 мкмоль/сут
|
|
Ванилилминдальная кислота
|
3,53-19,2 мкмоль/сут
|
д. Витамины
|
С (аскорбиновая кислота)
|
113,5-170,3 мкмоль/сут
|
|
В1 (тиамин)
|
0,14-0,29 ммоль/сут
|
|
В2 (рибофлавин)
|
1,08-1,80 ммоль/сут
|
ЖЕЛУДОЧНЫЙ СОК
|
рН1,5-3,5
|
|
|
Общая кислотность
|
40-60 ммоль/л (40-60 ед.)
|
|
Свободная соляная кислота
|
20-40 ммоль/л (20-40 ед.)
|
|
Связанная соляная кислота
|
5-20 ммоль/л (5-20 ед.)
|
СПИННО-МОЗГОВАЯ ЖИДКОСТЬ
|
Плотность1,006-1,007
|
|
|
Цвет
|
Бесцветная
|
|
Белок
|
0,22-0,33 г/л
|
|
Альбумины
|
0,17-0,24 г/л
|
|
Глобулины
|
0,025-0,05 г/л
|
|
Альбумины
|
58,3%
|
|
Преальбумины
|
5,7%
|
|
α1-глобулин
|
5%
|
|
α2-глобулин
|
7%
|
|
β-глобулин
|
15,5%
|
|
γ-глобулин
|
8,5%
|
|
Глюкоза
|
2,50-3,89 ммоль/л
|
|
Фруктоза
|
0,1-0,2 ммоль/л
|
|
Хлориды
|
12-130 ммоль/л
|
НЕКОТОРЫЕ ФУНКЦИОНАЛЬНЫЕ ПРОБЫ С ПРИМЕНЕНИЕМ БИОХИМИЧЕСКИХ МЕТОДОВ
|
Проба на коллоидную
устойчивость (проба Вельтмана в модификации Тейфеля)
|
4-5∙103 мл CaCl2 /л
|
|
Сулемовая проба (по
Гринстедту)
|
3,2-4,4∙103 мл
сулемы/л
|
|
Клеточная фильтрация
|
7,2 л/ч
|
|
Клирентс мочевины:
|
|
|
«максимальный»
|
3,84-5,94 л/ч
|
|
«стандартный»
|
2,4-3,78 л/ч
|
2. Приготовление буферных растворов
1. Фосфатно-цитратный буфер (0,1 М, рН 5,0-8,0)
Исходные растворы:
1. 0,2 М раствор Na2HPO4∙2H2O
(35,61 г соли растворяют в дистиллированной воде в мерной колбе вместимостью 1
л).
2. 0,1 М раствор лимонной кислоты (21,01
г кислоты растворяют в дистиллированной воде в колбе вместимостью 1 л). Для
получения нужного рН смешивают растворы в следующих количествах:
|
рН
|
Na2HPO4 0,2 М, мл
|
Лимонная кислота, 0,1 М, мл
|
|
5,6
|
5,8
|
4,2
|
|
6,4
|
6,9
|
3,1
|
|
6,8
|
7,7
|
2,3
|
|
7,2
|
8,7
|
1,3
|
|
8,0
|
9,7
|
0,3
|
2. Фосфатный буфер (0,1 М, рН 5,8-8,0)
|
Na2HPO4 0,2 М, мл
|
Na2H2PO4 0,2 М, мл
|
Вода, мл
|
рН
|
|
8,0
|
92,0
|
До 200
|
5,8
|
|
12,3
|
87,7
|
-″-
|
6,0
|
|
18,5
|
81,5
|
-″-
|
6,2
|
|
26,5
|
73,5
|
-″-
|
6,4
|
|
37,5
|
62,5
|
-″-
|
6,6
|
|
49,0
|
51,0
|
-″-
|
6,8
|
|
61,0
|
39,0
|
-″-
|
7,0
|
|
72,0
|
28,0
|
-″-
|
|
81,0
|
19,0
|
-″-
|
7,4
|
|
87,0
|
13,0
|
-″-
|
7,6
|
|
91,5
|
8,5
|
-″-
|
7,8
|
|
94,7
|
5,3
|
-″-
|
8,0
|
3. Трис-буфер (0,1 М, рН 7,1-9,2)
,2 г трис-(гидроксиметил) аминометана растворяют в мерной колбе
вместимостью 1 л (в 500 мл Н2О). Для получения необходимого значения рН
прибавляют указанный в таблице объем 1 М HCl и доводят объем дистиллированной
водой до 1000 мл.
|
рН
|
HCl, мл
|
рН
|
HCl, мл
|
|
7,1
|
189
|
8,3
|
70
|
|
7,2
|
183
|
8,5
|
50
|
|
7,4
|
170
|
8,7
|
16,5
|
|
7,8
|
150
|
9,2
|
5,75
|
|
8,1
|
90
|
|
|
4. Ацетатный буфер (0,2 М, рН 3,6-5,8)
|
Ацетат натрия 0,2 М, мл
|
Уксусная кислота 0,2 М, мл
|
рН
|
Ацетат натрия 0,2 М, мл
|
Уксусная кислота 0,2 М, мл
|
рН
|
|
0,75
|
9,25
|
3,6
|
5,90
|
4,10
|
4,8
|
|
1,20
|
8,80
|
3,8
|
7,00
|
3,00
|
5,0
|
|
1,80
|
8,20
|
4,0
|
7,90
|
2,10
|
5,2
|
|
2,65
|
7,35
|
4,2
|
8,60
|
1,40
|
5,4
|
|
3,70
|
6,30
|
4,4
|
9,10
|
0,90
|
5,6
|
|
4,90
|
5,10
|
4,6
|
9,40
|
0,60
|
5,8
|
5. Глициновый буфер (0,05 М, рН 8,6-10,6)
Смешивают указанные объемы глицина и гидроксида натрия и доводят объем
дистиллированной водой до 200 мл
|
рН
|
Глицин 0,2 М, мл
|
NaOH 0,2 М, мл
|
рН
|
Глицин 0,2 М, мл
|
NaOH 0,2 М, мл
|
|
8,6
|
50
|
4,0
|
9,6
|
50
|
22,4
|
|
8,8
|
50
|
6,0
|
9,8
|
50
|
27,2
|
|
9,0
|
50
|
8,8
|
10,0
|
50
|
32,0
|
|
9,2
|
50
|
12,0
|
10,4
|
50
|
38,6
|
|
9,4
|
50
|
16,8
|
10,6
|
50
|
45,5
|
3. Приготовление некоторых реактивов
Активирующий раствор. В мерную колбу вместимостью 100 мл помещают 155 мг
восстановленного глутатиона и 400 мг кристаллического альбумина, растворяют их
в 50 мл дистиллированной воды и с помощью 1 М раствора NaOH доводят рН до 8,2.
Затем доливают до метки воду.
Аммиачный раствор нитрата серебра. К 2-3%-ному раствору серебра добавляют
концентрированный раствор аммиака до растворения осадка.
Ацетатный буферный раствор рН 3,6. Готовят смешивая 463 мл раствора А и
37 мл раствора Б, доводят до метки водой в мерной колбе до 1 л. Раствор А:
11,55 мл ледяной уксусной кислоты разводят водой в мерной колбе на 1 л. Раствор
Б: 27,2 г ацетата натрия растворяют в воде в колбе на 1 л.
Биуретовый реактив (реактив Бенедикта). 173 г цитрата натрия и 100 г
карбоната натрия растворяют в 300 мл дистиллированной воды на водяной бане.
Отдельно в 300 мл воды растворяют 17,3 г сульфата меди. Оба раствора сливают и
доводят общий объем до 1 л.
Буферный раствор. 2,76 г веронала и 2,06 г мединала растворяют в 1 л
дистиллированной воды. Хранят в холодильнике, при появлении осадка раствор не
пригоден к употреблению.
Взвесь угля. 0,25 г активированного угля помещают в мерную колбу на 100
мл и разбавляют ацетатным буфером рН 3,6. Перед употреблением тщательно
встряхивать.
Восстанавливающий реактив. 1%-ный раствор аскорбиновой кислоты,
приготовленный на 0,016%-ном растворе сульфата меди.
Гемоглобин, 4%-ный раствор на ацетатном буфере (рН 4,0). Сначала готовят
8%-ный раствор гемоглобина на 8 моль/л растворе мочевины, выдерживают его 2 ч в
термостате при 60˚С и перед употреблением разводят ацетатным буфером в 2
раза.
Глицил-глицин. 0,55 ммоль/л, рН - 8,3. 3,63 г глицил-глицина помещают в
мерную колбу на 50 мл, доливают водой до метки (буферный раствор).
Денатурирующий раствор. Растворить 1 ампулу ацетонциангидрина (0,5 мл -
0,47 г из набора по определению гемоглобина в крови) в 1 л дистиллированной
воды.
Диазореактив для определения билирубина. Готовят два раствора. Первый
раствор: 3 г сульфаниловой кислоты растворяют в 500 мл дистиллированной воды,
добавляют 15 мл концентрированной соляной кислоты (на горячей бане), доводят
объем водой до 1 л. Второй раствор: 0,5%-ный водный раствор нитрита натрия.
Перед употреблением смешивают 5 мл первого раствора и 0,25 мл второго.
Диацетил, рабочий раствор. 1 мл диацетила разводят дистиллированной водой
в мерной колбе на 100 мл (раствор хранят в холодильнике). Рабочий раствор
диацетила готовят перед употреблением, добавляя в 1 мл основного раствора
диацетила 24 мл дистиллированной воды.
Дифениламиновый реактив. 1 г дифениламина растворяют в 100 мл ледяной
уксусной кислоты. К раствору прибавляют 2,75 мл концентрированной серной
кислоты.
Калибровочный раствор. Основной - 0,75 ммоль/л АЛК (100 мкг/мл) в
пересчете на основание: 0,00635 г АЛК гидрохлорида растворяют в ацетатном
буфере рН 3,6 в мерной колбе на 50 мл. Хранят в холодильнике не более месяца.
Из основного готовится рабочий калибровочный раствор, 1 мкг/мл. Готовят перед
употреблением разведением основного раствора ацетатным буфером в 100 раз.
Калибровочный раствор. 22,5 мг диоксиацетона при нагревании растворяют в
25 мл воды. 1 мл такого раствора содержит 10 мкмолей диоксиацетона. В ряд
пробирок (см. работу) разливают калибровочный раствор диоксиацетона, доливают
до нужного объема и далее проводят реакцию также, как и при определении
активности фермента.
Калибровочный (стандартный) раствор железа (30 мкмоль/л).
Сначала готовят соли Мора.
содержащий 3 ммоль/л, растворяя 1,178 г в 5 мл 0,3 н. соляной кислоты,
после чего доводят до 1 л водой (подкисленной 1 мл концентрированной серной
кислоты). Рабочий стандартный раствор железа получают из основного путем
разведения подкисленной водой в 100 раз. Полученный раствор содержит 30
мкмоль/л или 1,67 мкг/мл железа.
Кофеиновый реактив. 1 г чистого кофеина, 7,5 г бензоата натрия, 12,5 г
ацетата натрия растворяют в 90 мл дистиллированной воды, нагревают до 50-60˚С,
перемешивают, охлаждают и доводят до 100 мл дистиллированной водой.
Молибдат аммония в азотной кислоте. 7,5 г молибдата аммония растворяют в
100 мл воды и прибавляют 100 мл 32%-ной азотной кислоты.
Моча при алкаптонурии. При отсутствии патологической в нормальную мочу
добавляют гидрохинон из расчета 20 г/л.
Моча при гипераминоацидурии. При отсутствии патологической в нормальную
мочу добавляют глицин из расчета 1,0 г/л.
Моча при мукополисахаридозе. При отсутствии патологической в нормальную
мочу добавляют хонсурид или гепарин из расчета 0,05-0,1 г/л.
Моча при пентозурии. При отсутствии патологической в мочу добавляют
ксилулозу или рибозу из расчета 1,0 г/л.
Моча при тирозинозе. При отсутствии патологической в нормальную мочу
добавляют тирозин из расчета 0,4-0,5 г/л.
Моча при фруктозурии. При отсутствии патологической в нормальную мочу
добавляют фруктозу из расчета 0,3-0,4 г/л.
Моча при цистинурии. При отсутствии патологической в нормальную мочу
добавляют цистин из расчета 0,4-0,5 г/л.
Натрия ацетат 3-водный, насыщенный раствор. 375 г ацетата натрия
3-водного (или 226 г безводной соли) растворяют в 250 мл теплой воды, охлаждают
до комнатной температуры. Хранят при комнатной температуре. Раствор должен быть
бесцветным и прозрачным.
Натрий фосфат двузамещенный 0,25 моль/л. Готовят, растворяя 9,7 г Na2HPO4∙12H2O
или 18 г Na2HPO4∙12H2O в воде в колбе на 200 мл. При добавлении 2 мл
этого раствора к 1 мл раствора трихлоруксусной кислоты рН должен быть в
пределах 5,0-6,0.
Основной калибровочный раствор креатинина, 10 ммоль/л. 113,1 мг
креатинина доводят до 100 мл 0,1 моль/л раствором соляной кислоты. При
построении калибровочного графика из основного раствора готовят рабочий раствор
путем разведения основного раствора водой в 100 раз, 1 мл раствора содержит 0,1
ммоль креатинина. Исходя из этого получают ряд пробирок с соответствующими
концентрациями креатина.
Окислительная смесь для определения тиамина. К 8 мл 1%-ного
гексацианоферрата (III) калия приливают 20 мл 30%-ного раствора NaOH, тщательно
перемешивают. Готовят перед употреблением.
Орциновый реактив. К 1 г орцина прилить 500 мл 30%-ной соляной кислоты
(плотностью 1,15 г/см3). Перемешать до растворения и добавить 4-5 мл 10%-ного
раствора хлорида железа (III) FeCl3. Реактив хранят в плотно закупоренной
темной склянке.
Основной калибровочный раствор п-нитроанилина. 0,0829 г п-нитроанилина
помещают в мерную колбу на 100 мл, доводят до метки водой и растворяют.
Осаждающий раствор. Растворить 561 г сульфата аммония в 1 л
дистиллированной воды и через сутки профильтровать.
Основной фосфатный буферный раствор и его рабочие растворы № 1-4.
Растворяют 33,5 г NaOH в 400 мл воды в мерной колбе вместимостью 500 мл и
добавляют 226,8 г KH2PO4, встряхивают до полного растворения, охлаждают и
доливают водой до метки. Для приготовления рабочих растворов основного
фосфатного буфера в мерные колбы вместимостью 100 мл отмеривают следующие
объемы основного фосфатного буфера (в мл): № 1 - 92,51; № 2 - 74,91; № 3 -
59,18 и № 4 - 48,68, после чего доводят их содержимое водой до метки.
Пикриновая кислота, насыщенный раствор. Товарная пикриновая кислота
содержит 15-20% влажности, кислоту не сушить. Взрывоопасно! В 100 мл воды
растворяют 2 г пикриновой кислоты при нагревании в горячей бане. После этого
раствор оставляют стоять на 24 часа, периодически перемешивая. Затем раствор
фильтруют. Раствор стабилен и хранится в посуде из темного стекла.
Пирофосфатный буфер 0,05 М с рН 8,2. Переносят 4,46 г пирофосфата натрия
в мерную колбу вместимостью 200 мл, растворяют его примерно в 100 мл воды,
доводят рН с помощью 0,1 М раствора HCl до 8,2 и доливают дистиллированной
водой до метки.
Пирофосфатный буфер 0,1 М с рН 8,5. Переносят 4,46 г пирофосфата натрия в
мерную колбу вместимостью 100 мл, растворяют его в 50 мл воды, доводят рН с
помощью 0,1 М раствора HCl до 8,5 и доливают дистиллированной водой до метки.
Рабочий реактив. Готовят в день определения, смешивая 30 частей 0,3 н
гидроксида натрия. 2 части 0,5% раствора фенолфталеина и 1 часть 0,12% раствора
сульфата меди.
Раствор ацетонциангидрина. Растворить 1 ампулу ацетонциангидрина (0,5 мл
- 0,47 г из набора по определению гемоглобина в крови) в 1 л дистиллированной
воды.
Раствор ферриацетонциангидрина. Растворить в 1 л дистиллированной воды
200 мг железосинеродистого калия и 1 ампулу (0,5 мл - 0,47 г)
ацетонциангидрина: возможно использование из набора реактивов для приготовления
трансформирующего раствора по определению гемоглобина крови. Устойчив в течение
нескольких месяцев при хранении в посуде из темного стекла при комнатной
температуре.
Раствор глюоксидазы. Содержит около 300 ед. в 1 мг. Готовят, растворяя
соответствующее количество сухого препарата в 10 мл воды.
Раствор сульфонированного бато-фенантролина. В пробирке к 100 мг
бато-фенантролина приливают 0,5 мл хлорсульфоновой кислоты, нагревают на
кипящей водяной бане 30 с, охлаждают и медленно приливают 10 мл
бидистиллированной воды, вновь нагревают на водяной бане в течение 5 мин. Смесь
переносят в колбу на 200 мл, добавляют 100 мл воды, рН раствора доводят до 4-5
н NaOH и добавляют водой до объема 200 мл.
Раствор иода в иодиде калия (раствор Люголя). В 100 мл дистиллированной
воды растворяют 20 г иодида калия и 10 г иода. Перед употреблением раствор
разводят в 5 раз.
Раствор п-нитрозодиметиланилина (НДМА). Имеющийся в продаже препарат НДМА
перекристаллизовывают из этилового эфира. Для измерения алкогольдегидрогеназы 1
мг НДМА растворяют в 100 мл 0,1 М пирофосфатного буфера (рН 8,5). Полученный
раствор фильтруют через бумажный фильтр и разводят фильтрат в 2 раза тем
буфером. Хранят при 4˚С в течение двух месяцев.
Реактив Илька. К 5 частям (по объему) уксусного ангидрида добавляют 1
часть ледяной уксусной кислоты, затем постепенно вливают 1 часть
концентрированной серной кислоты. Хранить реактив на холоду!
Реактив Миллона. (Готовят под тягой!) В 57 мл концентрированной азотной
кислоты растворяют 40 г ртути сначала на холоду, а затем нагревая на водяной
бане. Полученный раствор разбавляют 2 объемами воды, дают отстояться и сливают
с осадка. Хранят во флаконе из темного стекла.
Реактив молибдата аммония. 2,5 г молибдата аммония растворяют в 60 мл
дистиллированной воды, фильтруют. Раствор вносят в колбу вместимостью 100 мл. В
другой колбе к 25 мл дистиллированной воды приливают 7,5 мл концентрированной
серной кислоты. Второй раствор приливают к первому, охлаждают и доводят
дистиллированной водой до метки. Раствор пригоден в течение месяца.
Реактив «НАДИ». 1%-ный раствор диметил-п-фенилендиамина смешивают с
равным объемом 1%-ного раствора α-нафтола в спирте и 1,5%-ного раствора
карбоната натрия. Раствор окрашен в темно-коричневый цвет и не должен иметь
розового оттенка. Готовят за 1 ч до занятия.
Реактив Наша. В колбу вместимостью 100 мл вносят 15,4 г ацетата аммония,
0,3 г ледяной уксусной кислоты и 0,2 г ацетилацетона, растворяют в
дистиллированной воде и доводят объем до метки.
Реактив Несслера. В мерной колбе вместимостью 500 мл смешивают 150 г
иодида калия, 110 г иода, 100 мл дистиллированной воды и около 140-150 г
металлической ртути и сильно встряхивают в течение 15 мин. При этом раствор
самопроизвольно разогревается, и окраска, обусловленная растворенным иодом,
постепенно бледнеет. Затем смесь начинают охлаждать под струей воды до
сохранения отчетливой красной окраски, после чего содержимое встряхивают до
перехода красной окраски в зеленоватую. После декантации осадок ртути тщательно
промывают водой. Объединяют раствор и промывные воды, разбавляют их водой до 2
л. Отбирают 75 мл полученного раствора в мерную колбу вместимостью 0,5 л,
содержащую 75 мл воды и 350 мл 10%-ного раствора гидроксида натрия и доводят
водой до метки.
Реактив Фелинга. Готовят отдельно два раствора. Раствор 1: в мерной колбе
вместимостью 1 л растворяют 200 г сегнетовой соли и 150 г NaOH и доводят водой
до метки. Раствор 2: в мерной колбе вместимостью 1 л растворяют в воде 40 г
сульфата меди (II) и доводят водой до метки. Перед употреблением смешивают
равные объемы этих растворов.
Реактив Фолина. В колбе вместимостью 1 л растворяют 1 г вольфрамата
натрия и 20 г фосфорномолибденовой кислоты в 750 мл воды. Закрывают колбу
пробкой с обратным холодильником и, включив ток воды в холодильнике, содержимое
кипятят 10 ч; затем его охлаждают, переливают в мерную колбу и доводят водный
объем реактива до 1 л.
Реактив Эрлиха. 0,7 г п-диметиламинобензальдегида растворяют в 150 мл
концентрированной соляной кислоты, приливают к 100 мл воды и смешивают. Раствор
должен быть бесцветным или слегка желтым. Хранят в посуде из темного стекла.
Реактив стабилен.
Реактив Эрлиха. 1 г п-диметиламинобензальдегида растворяют в мерной колбе
на 50 мл в 35 мл ледяной уксусной кислоты, добавляют 8 мл 57%-ной хлорной
кислоты и доводят до метки ледяной уксусной кислотой. Хранят в посуде из
темного стекла в холодильнике не более недели.
Спиртовой раствор тимола (10%). 10 г очищенного тимола растворяют в 100
мл 96˚ этилового спирта. Получение очищенного тимола проводят следующим
образом. 100 г тимола растворяют в 100 мл 96˚ этилового спирта, фильтруют.
К фильтрату добавляют 1 л холодной дистиллированной воды, сильно встряхивают и
оставляют стоять на 20 мин. Фильтруют и кристаллы, оставшиеся на фильтре,
промывают два раза холодной дистиллированной водой. Сушат вначале на
фильтровальной бумаге, потом в течение 2-3 дней в эксикаторе над безводным
хлористым кальцием до постоянного веса.
Стандартный раствор. Приготовление стандартного раствора проводится
смешением двух растворов: 1) 0,0962 н раствор хлористого бария: 1,175 г
кристаллического BaCl2∙2H2O растворяют в 100 мл воды в мерной колбе. 2)
0,2 н раствор серной кислоты. Далее получают суспензию сульфата бария: 3 мл
0,0962 н раствора хлористого бария вливают в мерную колбу на 100 мл и доводят
объем 0,2 н раствором серной кислоты при температуре +10˚С (при этой
температуре размеры частиц преципитированного сульфата бария дают относительно
стабильный результат).
Субстратно-буферный раствор: в пробирку наливают 10 мл воды и добавляют
0,028 г L-глутамил-п-нитроанилина и 0,082 г хлорида натрия и, не переставая
перемешивать, растворяют содержимое пробирки на кипящей водяной бане в течение
60 сек. Затем раствор охлаждают до 37˚С и добавляют 2,5 мл буферного
раствора. Приготовленный раствор субстрата во время работы хранят в водяной
бане при 37˚С. Неиспользованный раствор субстрата можно хранить в
холодильнике в течение недели. Субстрат плохо растворим и при комнатной
температуре выпадает в осадок. Поэтому перед употреблением выкристаллизовавшийся
субстрат растворяют нагреванием в кипящей водяной бане. Нагревание и
растворение субстрата можно повторять не более двух раз.
Субстратный раствор для определения АлАТ (раствор № 1). Навески 29,2 мг α-кетоглутаровой кислоты и 1,78 г
аланина (0,89 г α-аланина) взвешивают на аналитических весах и
растворяют в 1 М растворе гидроксида натрия до полного растворения осадка (рН
7,4). Раствор переливают в колбу вместимостью 100 мл и доводят объем до метки
0,1 М фосфатным буфером (рН 7,4). Добавляют 1 каплю хлороформа. Раствор хранят
в холодильнике в замороженном состоянии.
Субстратный раствор для определения АсАТ (раствор № 2). Навески 29,2 мг α-кетоглутаровой кислоты и 2,66 г α-аспарагиновой кислоты (1,33 г α-аспарагиновой кислоты) взвешивают на
аналитических весах. Далее раствор готовят так же, как раствор № 1.
Субстратный раствор для определения глюкозофосфатизомеразы. Готовят
мединалово-ацетатный буферный раствор с рН 7,4 (9,714 г ацетата натрия и 14,714
г мединала растворяют в воде и доводят объем до 500 мл). Смешивают 8,33 мл 0,03
М раствора двунатриевой соли глюкозо-6-фосфата с 25 мл мединалово-ацетатного
буфера; добавляют к смеси 25 мл 0,1 М раствора соляной кислоты и доводят водой
до 100 мл. Хранят на холоду.
Субстратный раствор для определения лактатдегидрогеназы. Смешивают по 1
мл 1 М раствора лактата натрия, 9 М раствора NаCl, 0,05 M Cl2, раствора НАД
концентрации 10 г/л. Добавляют к содержимому по 2,5 мл 0,5 М раствора
фосфатного буфера (рН 7,4) и 1 г/л раствора нитротетразолиевого синего. Перед
употреблением к смеси прибавляют 0,25 мл раствора фенанзинметасульфата
концентрации 1 г/л.
Субстратный раствор для определения фруктозобисфосфатальдолазы. 270 мг
бариевой соли фруктозобисфосфата растворяют в 3,5 мл 1 М раствора соляной
кислоты. Добавляют 1 мл 14%-ного раствора сульфата натрия, а выпавший при этом
осадок удаляют центрифугированием. К надосадочной жидкости добавляют 1 каплю
сульфата натрия. Появление мути свидетельствует о недостаточно полном осаждении
ионов бария. В этом случае добавляют еще сульфата натрия и вновь
центрифугируют. Центрифугат доводят 3%-ным раствором гидроксида натрия до рН
7,4-7,6, переносят в колбу вместимостью 25 мл и объем доводят до метки.
Полученный раствор смешивают с 25 мл 0,56 М раствора гидразинхлорида, 25 мл 0,002
М раствора моноиодуксусной кислоты, 100 мл 0,5%-ного раствора карбоната натрия
и 25 мл дистиллированной воды. Хранят в холодильнике.
Тимолово-вероналовый буфер. В мерной колбе на 100 мл смешивают 80 мл
буферного раствора и 1 мл 10%-ного спиртового раствора тимола, встряхивают и
доливают буферным раствором до метки. Величина рН должна составить 7,55.
о-Толуидиновый реактив. 0,15 г тиомочевины растворяют в 94 мл ледяной
уксусной кислоты и смешивают с 6 мл перегнанного О-толуидина. Хранят в темной
склянке.
Фенол, насыщенный водой. В 100 г перегнанного фенола добавляют 35 мл воды
и перемешивают, слегка подогревая смесь для ускорения растворения фенола.
Фенолфталин, рабочий раствор. Готовят, растворяя 75 мг вещества в 15 мл
0,1 н раствора гидроксида натрия, раствор должен быть бесцветным или слегка
розоватым, окрашенные растворы для работы не пригодны. Для увеличения стойкости
реактива к нему добавляют 3 мг трилона, который, связывая соли тяжелый
металлов, препятствует самоокислению фенолфталеина кислородом воздуха.
Фибрин. Фибрин бычьей крови отмывают от кровяных пигментов в проточной
воде в течение нескольких дней до получения белого сгустка. Воду отжимают, а
фибрин, залитый глицерином, хранят в плотно укупоренной банке. Перед
употреблением фибрин отмывают от глицерина.
Фосфорно-ванилиновый реактив. 4 части (по объему) концентрированной
ортофосфорной кислоты смешивают с 1 частью 0,6%-ного водного раствора ванилина.
Реактив хранят в посуде из темного стекла при комнатной температуре.
Фруктозо-1,6-бисфосфат, натриевая соль. 2,0 мл 10%-ного раствора
натриевой соли фруктозо-1,6-бисфосфата разводят в колбе на 25 мл водой до
метки. Стабилен при условии хранения в холодильнике.
Цветной реактив на мочевину. Таблетку из набора для определения мочевины,
содержащую диацетилмонооксим и тиосемикарбазид, растворяют при нагревании в
колбе на 50 мл. Раствор устойчив в течение трех недель. Перед употреблением
смешивают равные объемы приготовленного раствора и 9,6%-ного раствора серной
кислоты.
Щелочной раствор β-глицерофосфата. В мерную колбу вместимостью 100 мл
вносят 1 г β-глицерофосфата натрия и 0,85 г мединала, приливают около 30
мл дистиллированной воды, растворяют и доводят водой объем до метки. В другую
мерную колбу вместимостью 100 мл вносят 50 мл приготовленного раствора β-глицерофосфата, 2,8 мл 0,1 М раствора
гидроксида натрия и доводят дистиллированной водой до метки (рН раствора 8,6).
Наслаивают на жидкость около 3 мл толуола. Хранят раствор в холодильнике не
более 10 дней.