Дослідження якості води в басейні річки Стир
Дослідження
якості води в басейні річки Стир
Дисципліна
- Екологічний моніторинг
Зміст
Вступ
Розділ 1. Теоретичні основи дослідження якості води в річках
.1 Якість води та фактори, що її формують
.2 Хімічний склад річкових вод
.3 Джерела та шляхи надходження забруднюючих речовин до малих
річок
.4 Вплив забруднень на екосистему річки
Розділ 2. Методика дослідження якості води в річках
.1 Основні методи дослідження якості води у річках
.2 Еколого-гідробіологічні дослідження малих річок
.3 Визначення фізичних властивостей природних вод
.4 Відбір проб для гідрохімічних досліджень
.5 Визначення гідрохімічних характеристик природних вод
Розділ 3. Дослідження якості води в басейні річки Стир
.1 Загальна характеристика басейну річки Стир
.2 Сучасний стан та динаміка забруднення басейну річки Стир
Висновки
Список використаної літератури
Додатки
Вступ
Аналіз сучасного стану водних
ресурсів, рівня їх забруднення, екологічного стану є одним із найактуальніших
питань сьогодення.
Якість води - це сукупність
нормованих хімічних і біологічних характеристик, а також фізичних властивостей,
що визначають придатність води для певного виду використання. Для поверхневих
вод виділяють три групи гранично-допустимих концентрацій забруднюючих речовин
(ГДК) для:
) рибогосподарських водойм;
) господарсько-питного користування;
) культурно-побутового користування.
Забруднення поверхневих і підземних
вод поділяють на такі типи:
механічне - підвищення вмісту
механічних домішок, яке властиве в основному поверхневим видам забруднення;
хімічне - наявність у воді
органічних та неорганічних речовин токсичної і нетоксичної (до найбільш
шкідливих хімічних забруднень води належать нафта і нафтопродукти);
бактеріальне і бактеріологічне -
наявність у воді різноманітних патогенних мікроорганізмів, грибів і дрібних
водоростей (із суші, із суден надходять у воду фекалії, різноманітний
металобрухт, що нерідко призводить до виникнення інфекційних захворювань);
радіоактивне - наявність
радіоактивних речовин;
теплове - випуск у водойми підігрітих
вод теплових та атомних електростанцій.
Наші дослідження спрямовані на
вивчення сучасного стану і динаміки забруднення р. Стир, впливу природного й
антропогенного чинників на кількісні та якісні показники води, відповідності
якості встановленим екологічним нормативам.
Малі річки столиці Волині
(Сапалаївка, Жидувка, Омелянівка) потроху перетворюються на стічні канави. Не
відстає від них і основна водна артерія Луцька - Стир. Екологи б'ють на сполох:
через відсутність централізованої дощової каналізаційної мережі та міських
очисних споруд дощових і талих вод, брудні зливові стоки потрапляють у відкриті
водні об'єкти. Так забруднюють річки практично всі підприємства, установи та
організації міста.
Об'єктом дослідження є басейн річки
Стир.
Предметом дослідження
еколого-гідрохімічний аналіз стану басейну річки Стир.
Мета дослідження - розглянути
особливості дослідження якості води в річках, зокрема в басейні річки Стир.
Згідно з метою дослідження були
визначені такі завдання:
) вивчити теоретико-методологічні
основи дослідження якості води в річках;
) розглянути якість води та фактори,
що її формують;
) проаналізувати хімічний склад
річкових вод;
) дослідити вплив забруднень на
екосистему річки;
) розглянути методику дослідження
якості води в річках;
) дати загальну характеристику
басейну річки Стир;
) дослідити сучасний стан та
динаміку забруднення басейну річки Стир.
Для розв'язування поставлених
завдань використано такі методи наукового дослідження: діалектичного пізнання,
конкретного і абстрактного, логічного та історичного, системного і
порівняльного аналізу та статистичних порівнянь.
Інформаційною базою дипломної роботи
є нормативно-правові документи, статистичні збірники, щорічники, наукові праці
вітчизняних та зарубіжних вчених.
Структура роботи. Курсова робота
складається із вступу, трьох розділів, висновків, списку використаної
літератури, додатків.
Розділ 1. Теоретичні основи
дослідження якості води в річках
.1 Якість води та фактори, що її
формують
В усі часи людство так чи інакше
використовувало воду. Причому, основним її джерелом, в першу чергу, були річки.
Саме тому до річок ставились з особливою повагою, берегли їх навіть у тих
випадках, коли води було вдосталь. З розвитком цивілізації на жаль змінились не
тільки об'єми водокористування, але і саме ставлення до річки як джерела
життєдайної вологи. Людина відірвалась від природи, беручи воду з комунального
крану, вона забула про першоджерела, з яких ця вона надходить. З розвитком
господарства людина навантажувала водні екосистеми і особливо малі річки, в
басейнах яких мешкає переважна більшість населення.
Сьогодні в Україні можна зустріти як
ще збережені річки з криштально чистою, наче бризки діамантів, водою, так із
непрозорою, брудною, а інколи, вода в річках має різнокольорові відтінки, з масною
густою масою, яку взагалі важко назвати водою. Відповідно і річки поділяють на
чисті і забруднені. Разом із тим в усіх річках є вода і, щоб її, таку різну,
якось кількісно чи якісно охарактеризувати і порівняти ввели поняття
"якість води". Під цим терміном розуміють різнофакторну кількісну і
якісну оцінку її хімічного складу та фізико-хімічних і біологічних
властивостей, які визначають придатність води для використання в конкретних
цілях.
В основі оцінки якості води лежать
три групи показників, зокрема:
фізичні - колір, запах, прозорість,
наявність завислих речовин, каламутність тощо;
хімічні - вміст кисню, мінеральних і
органічних речовин, розчинених газів, забруднювачів не характерних для водного
об'єкту або таких, вміст яких перевищує регламентовані норми (гранично
допустимі концентрації - ГДК);
гідробіологічні - розвиток фіто- і
зоопланктону, фіто- і зообентосу, перифітону, вищих водних рослин, індекс
сапробності, інтенсивність фотосинтезу та дихання гідробіонтів тощо [18, 78].
Звичайно, визначена якість води
відповідає якомусь споживчому стандарту - питної води, води для поливу
сільськогосподарських культур, для промислових цілей, для риборозведення тощо.
Формування якості води у річках
забезпечується сукупністю гідрохімічних, бактеріологічних, гідрологічних
процесів, фізико-географічних і гідрометеорологічних особливостей регіону та
рівня антропогенного впливу на водозбір. Весь цей вплив проявляється через
процеси обміну речовин між різними середовищами.
Інші властивості природної води
визначає водневий показник рН та окисно-відновний потенціал - Eh. До
нормативних показників, що найбільш часто застосовуються при визначенні якості
поверхневих вод, належать кисневий показник, який характеризує вміст
розчиненого у воді кисню та його біологічне споживання (БСК); токсикологічні
показники, зокрема вміст азоту - амонійного, нітратів, нітритів, важких
металів, пестицидів, вміст нафтопродуктів, фенолів тощо.
Якість природних вод - є результатом
сукупності складних процесів обміну речовинами на рівні біологічної складової
гідроекосистем з одного боку і алохтонними потоками з площі водозбору. Якість
води залежить від багатьох складових у тому числі і від фізико-географічного
положення водойми, та головне на сьогодні - від рівня антропічного
навантаження. Відповідно якість води є як результатом сукупності природних
процесів, так і результатом впливу на них комплексу антропічних факторів.
Багатофакторність процесу формування
якості води обумовлює складність його вивчення, а недостатність теоретичних та
методичних розробок, інструментальних методів нерідко знецінює спроби розкриття
механізму формування якості води, перешкоджає вивченню і розробці науково
обґрунтованих підходів до управління та раціонального регулювання якості води
[18, 80].
Процес формування якості води
залежить від комплексу факторів, що складаються безпосередньо у даній водоймі.
Комплекс факторів, що впливають на якість води, складають 5 основних блоків:
гідрометеорологічний, гідрохімічний, гідробіологічний, фізико-географічний та
антропічні. Їх можна назвати основними складовими регулювання якості води.
Кожен із цих блоків характеризується великим переліком показників, які
відтворюють специфічні властивості.
Так, гідрометеорологічний блок
охоплює характеристики водного стоку (поверхнево-схиловий, підземний, твердий),
метеорологічні показники (кількість опадів, температурний режим і т. д.).
Під гідрохімічним блоком потрібно
розуміти сукупність фізико-хімічних процесів, які протікають між основними
групами хімічних речовин, розчинених у воді (головні іони, біогенні та
органічні речовини, мікроелементи, специфічні забруднювачі антропогенного
походження). Цей блок, до певної міри, виділяється умовно, оскільки всі його
характеристики пов'язані з аналогічними характеристиками інших блоків, що
регулюють вміст перерахованих груп речовин у річковій воді.
Третій блок регулювання якості води
- гідробіологічний. Серед його основних складових треба виділити: зообентос,
фітопланктон, зоопланктон перифітон, мікробіологічні показникив. В залежності
від завдань та головної мети, цей перелік може бути доповнений або змінений. На
малюнку № 9 представлена схема взаємовпливу окремих комплексів гідробіоценозів,
деяких антропогенних факторів і якості річкових вод.
Фізико-географічний блок
віддзеркалює особливості ландшафту, в якому проходить формування хімічного
складу води конкретної річки. Цей блок включає характеристики лісистості,
заболоченості озерності, еродованості.
На сьогодні чи не найважливішим
треба вважати блок антропічних факторів формування якості води. Його роль і
участь у загальних процесах формування якості води визначаються такими
складовими: розораність, скид стічних вод, внесення добрив, меліорованість
водозбору, густота населення, питома вага поголів'я великої рогатої худоби, що
утримується в річкових долинах, інших тварин, зарегульованість стоку та ін [18,
81].
Кількість ознак, що характеризують
кожен із блоків факторів, може змінюватись залежно від детальності оцінки,
інструментальних можливостей, фізико-географічних особливостей території тощо.
.2 Хімічний склад річкових вод
Хімічна формула води
загальновідома - 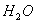 .
Але у природі вода у чистому вигляді не існує, а представлена як складний
розчин. Тільки свіжо конденсована роса може бути наближена до хімічно чистої
води. Але вже через кілька хвилин в ній починають розчинятися речовини. І роса,
що випала на рослини, швидко стає розчином органічних і мінеральних речовин,
властивих даній місцевості і цьому біоценозу.
.
Але у природі вода у чистому вигляді не існує, а представлена як складний
розчин. Тільки свіжо конденсована роса може бути наближена до хімічно чистої
води. Але вже через кілька хвилин в ній починають розчинятися речовини. І роса,
що випала на рослини, швидко стає розчином органічних і мінеральних речовин,
властивих даній місцевості і цьому біоценозу.
Вода є ідеальним
розчинником. Вона розчиняє велику кількість природних речовин. Тому чиста
дощова вода, проникаючи у ґрунти чи стікаючи по поверхні, розчиняє безліч
речовин. Таким чином, до річок дощова вода, що збирається з поверхні водозбору,
потрапляє у вигляді розчину речовин, які вона забрала з тих територій, де
пробігав струмок. От і виявляється, що дуже важливо, якою саме територією
біжить до річки струмок. В залежності від стану водозбірної площі буде
безпосередньо залежати вміст поверхневого стоку, що надходить до річок. І вода,
яка проникла у грунт, теж розчиняє більшість речовин, що зустрілись на її
шляху. І ці речовини теж ймовірно потрапляють до річок з джерельною водою. Не
тільки до річок, а й до криниць. Тобто існує тісний зв'язок між річкою і її
водозбірною площею. Так от, у джерельній воді завжди міститься більшість
хімічних речовин, властивих даному ландшафту, а також доданих людською
діяльністю домішок. Говорячи про природну воду річок, дослідники мають на увазі
цей природний багатокомпонентний розчин і його хімічний склад.
Хімічний склад річкової води
має вирішальне значення для формування та підтримання водних біоценозів. Але
вимоги водокористувачів щодо хімічного складу води не співпадають з
можливостями гідробіоценозів підтримувати певну якість води як середовища їх
існування. Саме тому відповідні водокористувачі здійснюють очищення поверхневих
вод, але нерідко повертають до річок розчин, який далеко не завжди сприяє
нормальному функціонуванню гідробіоценозів. Все це створює певний конфлікт -
впливає на споживчі параметри якості води: робить їх непридатними для вживання,
приготування їжі, приймання ванн, поливу рослин, використання у промислових
технологіях, енергетиці, для нормального функціонування водних екосистем тощо.
Тому доцільно розглянути основні групи хімічних речовин, що зустрічаються сьогодні
у природних, зокрема річкових, водах.
У воді річок знаходяться
в розчиненому стані різні мінеральні сполуки - кислоти, поташі (луги), солі.
Молекули більшості з цих речовин розпадаються, або дисоціюють на іони.
Позитивно заряджені іони називаються катіонами, а іони, що несуть від'ємний
заряд - аніонами. Сама вода також розпадається на іони: водневий (Н+) та
гідроксильний (ОН-). Від співвідношення водневих і гідроксильних іонів
(водневий показник - рН) у воді залежить стан і активність дуже багатьох хімічних
речовин і спрямованість багатьох процесів у водоймі.
У воді річок також
зустрічається величезна кількість різних органічних речовин як природного -
автохтонного і алохтонного походження, що синтезуються в самій водоймі і за її
межами, так і штучного походження, що синтезуються в різних, створених людиною
умовах - від залишків спалювання сміття у звичайних вогнищах до речовин, що є
результатом органічного синтезу в найскладніших установках [18, 85].
Усі розчинені у воді
речовини класифікуються. Зокрема за вмістом у воді речовини діляться на
макроелементи та мікроелементи. До макроелементів належать речовини з
концентраціями понад 1 мг/л. Мікроелементи відповідно містяться у воді в
концентраціях нижчих 1 мг/л.
Природні води також
класифікуються за іонним складом, за переважанням того чи іншого основного
катіону: кальцію, магнію, або суми натрію та калію, за співвідношенням між
основними групами іонів.
Потрібно сказати, що
хімічний склад поверхневих вод протягом року змінюється настільки сильно, що
вони можуть переходити з одного класу до іншого.
Згідно кліматичних та
ґрунтових факторів води річок України з півночі на південний схід мають
загальну тенденцію до підвищення мінералізації. Одночасно відбувається зміна
вод гідрокарбонатного класу на сульфатний чи хлоридний.
Концентрація солей у
воді знаходиться в протилежній залежності від кількості води в річці на час
дослідження. Крім цієї залежності існує і інша залежність - концентрація
біогенних речовин (зокрема азотнокислих і фосфорнокислих сполук) зменшується аж
до повного їх зникнення в період максимального розвитку у воді організмів, які
їх поглинають (фотосинтезуючі водорості та вищі водяні рослини) і, навпаки,
збільшується, коли життєві процеси у річці завмирають.
Джерелами надходження
солей, іонів, біогенних сполук до річки є: підземні води, води поверхневого
стоку (талі, дощові та зливові), води самої річки, які транспортують розчинені
речовини з одного місця в інше, із заплави до річки під час паводків та інші.
Атмосфера також є джерелом поступання іонів у річку, це у першу чергу
вуглекислота і кисень повітря, а також мінеральні та органічні речовини -
розчинена дощем пилюка, наприклад.
Частина мінеральних
речовини, що надходять до річки, частково зв'язуються гідробіонтами, а решта
транспортуються до гирла. Тому кругообіг речовин в річках носить відповідний
характер, наслідком якого є транспорт біогенних речовин, забруднень, окремих
організмів та їх частин у водний об'єкт, куди впадає та чи інша річка.
Сольовий склад природних
вод представлений, головним чином, солями сірчаної, соляної та вугільної кислот
з металами натрієм, калієм, магнієм та кальцієм. Розчинені у воді солі зазвичай
представлені іонами 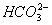 ,
,
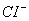 ,
,
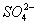 ,
,
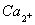 ,
,
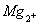 ,
,
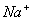 ,
,
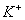 .
Вміст кожного із цих іонів у природних водах не знижується нижче 1 мг/л тому
вони утворюють групу макроелементів. Оскільки сума перелічених вище головних
іонів становить 90-95% мінерального складу прісних вод, то її часто називають
мінералізацією води, яка є кількісною характеристикою розчинених у воді
мінеральних речовин.
.
Вміст кожного із цих іонів у природних водах не знижується нижче 1 мг/л тому
вони утворюють групу макроелементів. Оскільки сума перелічених вище головних
іонів становить 90-95% мінерального складу прісних вод, то її часто називають
мінералізацією води, яка є кількісною характеристикою розчинених у воді
мінеральних речовин.
Зміна складу води відповідно
до величини загальної мінералізації пояснюється відмінностями в розчиненні
хлористих, сульфатних та карбонатних солей, лужних і лужноземельних металів.
Мала розчинність карбонатних солей кальцію обмежує концентрацію
гідрокарбонатних та карбонатних іонів в інтервалі до 1000 мг/л. Порівняно
невелика розчинність сульфату кальцію теж обмежує у певних інтервалах вміст
сульфатних іонів. Лише хлоридні іони завдяки добрій розчинності солей соляної
кислоти можуть досягати найбільших концентрацій.
Гідрокарбонат-іони (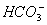 )
характерні для більшості річок, що пояснюється формуванням річкових вод
переважно у верхніх, добре промитих шарах ґрунтів та порід, бідних на інші
розчинні солі і насичених вуглекислим газом внаслідок інтенсивних біохімічних
процесів у грунтах. Гідрокарбонатні і карбонатні іони вважаються однією із
найголовніших частин хімічного складу поверхневих вод. Вони є продуктами
дисоціації вугільної кислоти і знаходяться у розчині в стані динамічної
рівноваги:
)
характерні для більшості річок, що пояснюється формуванням річкових вод
переважно у верхніх, добре промитих шарах ґрунтів та порід, бідних на інші
розчинні солі і насичених вуглекислим газом внаслідок інтенсивних біохімічних
процесів у грунтах. Гідрокарбонатні і карбонатні іони вважаються однією із
найголовніших частин хімічного складу поверхневих вод. Вони є продуктами
дисоціації вугільної кислоти і знаходяться у розчині в стані динамічної
рівноваги:
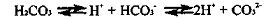
Зміна вмісту у воді
одного з іонів цього рівняння приводить до зміни іншого. Ці іони формують
карбонатну систему хімічної рівноваги, яка має надзвичайно важливе значення для
природних вод. Співвідношення форм карбонатної системи визначають величину рН
води. При рН<5 концентрація 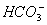 практично дорівнює
нулю. У нейтральних та слаболужних водах іони
практично дорівнює
нулю. У нейтральних та слаболужних водах іони 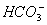 переважають. Карбонатні
іони (
переважають. Карбонатні
іони (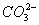 )
з'являються у воді при рН>8, а в сильно лужних водах вони стають
домінуючими.
)
з'являються у воді при рН>8, а в сильно лужних водах вони стають
домінуючими.
Гідрокарбонатні іони
зустрічаються у всіх природних водах, окрім кислих. У річках та озерах
концентрація 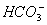 не
перевищує у більшості випадків 250 мг/л [18, 86].
не
перевищує у більшості випадків 250 мг/л [18, 86].
Хлорид-іон (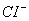 )
надходить у природні води шляхом розчинення хлорвмісних мінералів (содаліт,
хлорапатит та ін.) та соленосних відкладів (галіт). Значна кількість
)
надходить у природні води шляхом розчинення хлорвмісних мінералів (содаліт,
хлорапатит та ін.) та соленосних відкладів (галіт). Значна кількість 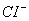 переноситься
атмосферним шляхом із морів та океанів у континентальні води. Останнім часом у
надходженні
переноситься
атмосферним шляхом із морів та океанів у континентальні води. Останнім часом у
надходженні 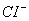 зросла
роль промислових і комунально-побутових стічних вод.
зросла
роль промислових і комунально-побутових стічних вод.
Підвищений вміст 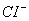 у
воді знижує її смакові якості і робить її непридатною для водопостачання,
зрошення сільськогосподарських угідь. Допускається вміст хлоридів у воді до 300
мг/л.
у
воді знижує її смакові якості і робить її непридатною для водопостачання,
зрошення сільськогосподарських угідь. Допускається вміст хлоридів у воді до 300
мг/л.
Сульфат-іон (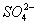 )
надходить у природні води завдяки процесів розчинення сірковмісних мінералів
(гіпс), а також шляхом окислення сірки та сульфідів. Значні кількості
)
надходить у природні води завдяки процесів розчинення сірковмісних мінералів
(гіпс), а також шляхом окислення сірки та сульфідів. Значні кількості 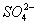 надходять
у річкові води в процесі відмирання живих рослинних і тваринних організмів та
зі стічними водами.
надходять
у річкові води в процесі відмирання живих рослинних і тваринних організмів та
зі стічними водами.
Підвищений вміст
сульфатів погіршує смакові якості води, здійснює вплив на шлунково-кишковий
тракт. Сульфати погано всмоктуються у кишечнику. При концентраціях 100 мг/л і більше
у тварин відбуваються порушення секреторної діяльності шлунку, процесів
всмоктування і перетравлювання їжі. Вміст 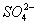 у водах для питного
споживання обмежується величиною 500 мг/л, а для рибогосподарського
використання - 100 мг/л.
у водах для питного
споживання обмежується величиною 500 мг/л, а для рибогосподарського
використання - 100 мг/л.
Іон кальцію (Са2+)
Первинним джерелом надходження його у поверхневі води є мінерали з вмістом
кальцію (всього понад 700 мінералів). Найчастіше кальцій зустрічається у формі
карбонату - у кальциті, мармурі, вапняку, доломітах, мергелі, крейді, а також у
формі сульфату - у гіпсі та ангідриді.
Великі кількості кальцію
надходять зі стічними водами силікатних, металургійних, скловарних та хімічних
підприємств, а також з сільськогосподарських угідь, особливо при застосуванні
мінеральних добрив, що містять кальцій. У річкових водах концентрація Са2+
рідко перевищує 1000 мг/л, але звичайно вона набагато нижча. Гранично допустима
концентрація Са2+ становить 180 мг/л [18, 87].
Іон магнію (Mg2+)
надходить у поверхневі води за рахунок процесів хімічного вивітрювання і
розчинення доломітів, мергелів та інших мінералів зі стічними водами
металургійних, силікатних, текстильних та інших виробництв.
Іонна форма магнію
переважає у маломінералізованих водах, у більш мінералізованих він міститься у
вигляді нейтральних (MgSO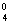 )
або заряджених (MgHCО
)
або заряджених (MgHCО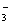 )
іонних пар чи у вигляді комплексів з органічними речовинами. Гранично допустима
концентрація Mg2+ складає 40 мг/л.
)
іонних пар чи у вигляді комплексів з органічними речовинами. Гранично допустима
концентрація Mg2+ складає 40 мг/л.
Сумарний вміст іонів
кальцію та магнію у воді формує її загальну жорсткість. Жорсткість води - один
з важливих критеріїв, який визначає придатність води для пиття та інших видів
водокористування. Вода з жорсткістю до 4 ммоль/л характеризується як м'яка, від
4 до 8 ммоль/л - середньої жорсткості, від 8 до 12 ммоль/л - жорстка, більше 12
ммоль/л -дуже жорстка. У жорсткій воді погано милиться мило, її використання у
парових котлах, у теплопроводах призводить до відкладення солей у трубах, їх
закупорювання і навіть до вибухів парових установок.
У той же час м'які води
(з низькою жорсткістю) через малий вміст карбонатів мають низьке значення рН і
можуть через це негативно впливати на металічні труби, розчиняти метал.
Особливо розчинний за таких умов (м'яка вода) свинець, тому у місцевостях з
низькою жорсткістю це може призвести до отруєння свинцем.
Натрій-іон (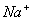 )
та калій-іон (
)
та калій-іон (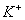 ).
Первинним джерелом надходження Na+ та К+ у поверхневі води є вивержені та
осадові породи, а також хлористі, сірчанокислі та вуглекислі солі. Крім того,
вони надходять зі стічними водами з сільськогосподарських угідь, зі зрошуваних
полів. Концентрація Na+ коливається в річкових водах від 0,6 до 300 мг/л.
).
Первинним джерелом надходження Na+ та К+ у поверхневі води є вивержені та
осадові породи, а також хлористі, сірчанокислі та вуглекислі солі. Крім того,
вони надходять зі стічними водами з сільськогосподарських угідь, зі зрошуваних
полів. Концентрація Na+ коливається в річкових водах від 0,6 до 300 мг/л.
Гранично допустима
концентрація натрію у воді -120 мг/л. Калій знаходиться у воді у значно нижчих
концентраціях, ніж натрій. Його концентрація у річковій воді зазвичай рідко
перевищує 25 мг/л.
Гранично допустима
концентрація К+ складає 50 мг/л. Натрій і калій мають важливе значення для
живих організмів. Вони відповідають за транспорт поживних речовин на клітинному
рівні [18, 89].
Хімічна класифікація
природних вод За іонним складом води малих річок України поділяються на 3
класи: клас гідрокарбонатних вод; клас сульфатних вод; клас хлоридних вод. За
схемою О.А. Алекіна кожний із цих класів складається із трьох груп - згідно
еквівалентному переважанню того чи іншого катіону: кальцію, магнію, або суми
натрію та калію. Кожна група також поділяється - на три типи вод, які
визначаються відповідним співвідношенням між іонами, в основі якого
співвідношення між загальною твердістю та лужністю.
Для зручності класи води
позначаються символами гідрокарбонатний -С, сульфатний - S, хлоридний символом
СІ. Група води позначається своїм хімічним символом, який розташовується у вигляді
степені до символу класу, тип або вид позначається римською цифрою внизу
символу класу. Наприклад: ССа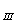 - вода карбонатного
класу, групи кальцію, третього типу.
- вода карбонатного
класу, групи кальцію, третього типу.
Для повноти класифікації
річкової води, а згідно неї і річок, Алекін добавив кількісний показники, яким
він розділив ріки згідно чотирьох ступенів мінералізації.
За цією схемою більшість
малих річок України відносяться до гідрокарбонатного класу і у більшості
випадків до групи кальцієвих вод. За величиною мінералізації природні
незабруднені води гідрокарбонатного класу відносяться до маломінералізованих
(200 і менше мг/л) вод.
У значно меншій мірі
розповсюджені води середньої мінералізації (200-500 мг/л). Сильно
мінералізовані природні води гідрокарбонатного класу (вище 1000 мг/л)
зустрічаються ще в меншій кількості. Річки з водою сульфатного класу порівняно
малочисельні. До них відносяться річки Приазов'я і частково Донбасу. Річки
хлоридного класу зустрічаються ще рідше. їх води надто мінералізовані - 19000 мг/л
і більше.
Біогенні речовини До
біогенних належать мінеральні речовини, які найбільш активно беруть участь у
життєдіяльності водних організмів. Це перш за все сполуки азоту (NH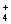 ,
,
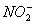 ,
NO
,
NO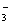 )
і фосфору (
)
і фосфору (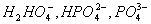 ).
До біогенних також відносяться сполуки кремнію (HSiО
).
До біогенних також відносяться сполуки кремнію (HSiО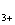 ,
SiО
,
SiО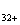 ),
заліза (Fe
),
заліза (Fe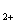 ,
Fe
,
Fe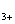 )
та деяких мікроелементів [18, 92].
)
та деяких мікроелементів [18, 92].
У природні води біогенні
речовини попадають головним чином при розпаді тваринних і рослинних організмів,
життєдіяльність яких протікає у водному середовищі, з поверхні водозбору та зі
скидними водами. Концентрація біогенних речовин у воді незначна, але саме ці
елементи визначають рівень біопродуктивності водних об'єктів і таким чином
обумовлюють якість їх води.
З точки зору оцінки
якості води для питного водопостачання найбільший інтерес серед сполук азоту
викликає нітрат-іон (NO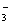 ).
Його концентрація у воді обмежується граничною величиною 50 мг/л. Однак
внаслідок широкого застосування мінеральних добрив в багатьох районах України
спостерігається забруднення ґрунтових і поверхневих вод нітратами понад ГДК.
Присутність нітратних іонів головним чином зв'язана із процесами в самій
водоймі, у першу чергу нітрифікації. Тому збільшення вмісту NO
).
Його концентрація у воді обмежується граничною величиною 50 мг/л. Однак
внаслідок широкого застосування мінеральних добрив в багатьох районах України
спостерігається забруднення ґрунтових і поверхневих вод нітратами понад ГДК.
Присутність нітратних іонів головним чином зв'язана із процесами в самій
водоймі, у першу чергу нітрифікації. Тому збільшення вмісту NO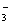 спостерігається в літню пору у період масового відмирання фітопланктону.
Високий вміст нітратів в атмосферних опадах. Істотним фактором підвищення
вмісту нітратних іонів є стічні води.
спостерігається в літню пору у період масового відмирання фітопланктону.
Високий вміст нітратів в атмосферних опадах. Істотним фактором підвищення
вмісту нітратних іонів є стічні води.
Важливе значення для
якості води має вміст іонів амонію (NH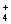 ) та нітрит-іону (NO
) та нітрит-іону (NO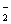 ).
Іон амонію з'являється у воді внаслідок розчинення у ній аміаку - продукту
розкладу органічних азотовмісних речовин. Концентрація NH
).
Іон амонію з'являється у воді внаслідок розчинення у ній аміаку - продукту
розкладу органічних азотовмісних речовин. Концентрація NH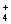 в незабруднених поверхневих водах складає, як правило, соті долі мгN/л і
підвищується до 0,5 мгN/л.
в незабруднених поверхневих водах складає, як правило, соті долі мгN/л і
підвищується до 0,5 мгN/л.
Присутність у
поверхневих водах іонів амонію зв'язана як із природними процесами, так і з
антропогенним впливом. До природних процесів відноситься біохімічна деградація
білкових речовин, що найбільше характерно для періоду відмирання фітопланктону.
Значна кількість амонію може надходити з поверхневим стоком і атмосферними
опадами. Високі концентрації амонію характерні для побутових стічних вод і
промстоків підприємств харчової, хімічної, лісохімічної промисловості [18, 93].
Іон NH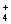 нестійкий, він швидко окислюється до нітритів і нітратів. Підвищений вміст
амонію свідчить про анаеробні умови формування хімічного складу води і про її
незадовільну якість. Підвищення концентрації NH
нестійкий, він швидко окислюється до нітритів і нітратів. Підвищений вміст
амонію свідчить про анаеробні умови формування хімічного складу води і про її
незадовільну якість. Підвищення концентрації NH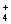 часто спостерігається у
водних об'єктах у місцях скиду стічних вод.
часто спостерігається у
водних об'єктах у місцях скиду стічних вод.
Присутність нітритних
іонів (NO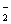 )
у незабруднених природних водах зв'язана з процесами мінералізації органічних
речовин, нітрифікації і денітрифікації. Підвищений вміст нітритних іонів
свідчить про посилене розкладання органічних речовин, що зв'язано з органічним
забрудненням, тобто є важливим санітарним показником.
)
у незабруднених природних водах зв'язана з процесами мінералізації органічних
речовин, нітрифікації і денітрифікації. Підвищений вміст нітритних іонів
свідчить про посилене розкладання органічних речовин, що зв'язано з органічним
забрудненням, тобто є важливим санітарним показником.
Концентрація NO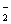 у воді в природних умовах дуже незначна (тисячні долі мгN/л). Підвищена
концентрація нітритів свідчить про інтенсивний розклад органічних речовин і
затримку окислення NO
у воді в природних умовах дуже незначна (тисячні долі мгN/л). Підвищена
концентрація нітритів свідчить про інтенсивний розклад органічних речовин і
затримку окислення NO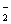 до NO
до NO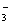 ,
що чітко свідчить про забруднення водойми.
,
що чітко свідчить про забруднення водойми.
Фосфор є одним із
найважливіших біогенних елементів, регулятором продуктивності водойм. Сполуки
фосфору надходять у води в результаті процесів життєдіяльності і розкладу
водних організмів, вивітрювання і розчинення порід і мінералів (апатити і
фосфорити), а також в результаті господарської діяльності людини. Забрудненню
поверхневих вод фосфором сприяє надходження комунальних стічних вод, що містять
поліфосфати як компоненти миючих засобів, фотореагенти та пом'якшувачі води.
Важливим фактором є змив фосфорних добрив з сільськогосподарських угідь.
Оцінка вмісту фосфору у
природних водах має велике значення для визначення існуючої та потенційної
продуктивності водойм. Зростання біопродуктивності водойм через надходження
фосфору веде до їх євтрофікації та різкого погіршення якості води.
Важкі метали Важкі
метали (As, Cd, Сr, Co, Fe, Рb, Мn, Hg, Ni, Se, Ag, Zn) відносяться до групи
мікроелементів, враховуючи їх низькі концентрації у природних водах
(мікрограмовий діапазон концентрацій). У природних водах важкі метали
зустрічаються у вигляді завислих речовин, колоїдів, у формі комплексів,
утворених з гуміновими та іншими органічними кислотами.
Свинець належить до
малопоширених елементів. Значне підвищення вмісту свинцю в навколишньому
середовищі, в тому числі у поверхневих водах, зумовлене його широким
застосуванням у промисловості. Найбільшим джерелом забруднення поверхневих вод
сполуками свинцю є спалення вугілля і застосування тетраетил свинцю у моторному
паливі, а також стічні води.
Для живих організмів
свинець є одним із сильних токсикантів. Неорганічні сполуки свинцю (Рb2+)
порушують обмін речовин і виступають інгібіторами ферментів. Тривале споживання
води навіть із низьким вмістом металу - одна з причин гострих і хронічних
захворювань.
Ртуть потрапляє в
організми риб та інших водних істот у формі метилртуті. Якщо людина вживає рибу
з певним вмістом ртуті, то 90% її акумулюється людським організмом і не
виводиться з нього.
Мікроорганізми можуть
утворювати метилртуть за різних умов. В аеробних умовах у воді присутній
сульфід-іон, який сприяє утворенню нерозчинного сульфіду ртуті. Утворення
метилртуті у річках і озерах відбувається при низьких значеннях рН води. Питна
вода містить, як правило, ртуті менше, ніж її гранично допустима концентрація у
воді (1 мкг/л).
Цинк. Основним джерелом
надходження цинку в природні води є мінерал сфалерит (ZnS). Майже всі сполуки цинку
добре розчинні у воді. Внаслідок цього на відміну від міді й свинцю цинк
поширений у водах. У річкових водах його концентрації коливаються від кількох
мікрограмів до десятків іноді сотень мікрограм на літр. У забруднених важкими
металами водах концентрація цинку досягає сотень мікрограм на літр. Максимальні
концентрації цинку характерні для слабокислих рудних вод (рН - 5,5-6,5). У
лужних розчинах вміст цього елемента різко зменшується [18, 95].
Мідь. Характерна
особливість міді, присутньої в природних водах -здатність сорбуватися
високодисперсними частинками ґрунтів і порід. Мідь легко сорбується колоїдами,
що обмежує міграцію цього елемента. Кількість міді у водах лімітується
значенням рН. Мідь стає нестійкою і випадає в осад уже при рН = 5,3. Тому у водах,
які мають нейтральну чи близьку до нейтральної реакцію, вміст міді невеликий
(1-100 мкг/л). Найважливішими джерелами надходження міді вважаються гірські
породи, стічні води хімічних і металургійних виробництв, шахтні води, різні
реагенти, що містять мідь, а також стічні води і поверхневий стік з
сільськогосподарських угідь.
Марганець. Основним
джерелом надходження марганцю у поверхневі води є залізомарганцеві руди та
деякі мінерали, стічні води марганцевих збагачувальних фабрик, металургійних
заводів, підприємств хімічної промисловості, шахтні води тощо. У природні води
значна кількість марганцю потрапляє при відмиранні й розкладанні гідробіонтів,
особливо синьо-зелених і діатомових водоростей, а також вищих водяних рослин. У
природних водах вміст марганцю коливається від одиниць до десятків і навіть
сотень мікрограмів в 1 літрі.
Нікель міститься у
природних водах у мікрограмових дозах. Найважливішим джерелом забруднення
нікелем є стічні води цехів нікелювання, збагачувальних фабрик. Великі викиди
нікелю відбуваються при спаленні палива, таким шляхом щорічно в атмосферу
потрапляє до 70 тис. т нікелю. Переважна частина нікелю переноситься річковими
водами у завислому стані.
Кобальт. Завдяки меншій
міграційній здатності і низькому вмісту у гірських породах кобальт у природних
водах виявляється рідше, ніж нікель. Кобальт і його сполуки потрапляють у
природні води при вилуговуванні мідно-колчеданових руд, екзогенних мінералів і
порід, з ґрунтів при розкладанні організмів і рослин тощо. Особливо небезпечним
джерелом надходження кобальту є стічні води металургійних, металообробних,
нафтопереробних, хімічних виробництв.
Стронцій -
лужноземельний елемент групи кальцію. Має низькі концентрації у природних
водах, що пояснюється слабкою розчинністю Його сірчанокислих сполук, які
вважаються основним джерелом надходження стронцію. У прісних водах концентрація
Sr звичайно набагато менша, ніж 1 мг/л. Джерелом стронцію в природних водах є
гірські породи, найбільшу кількість його містять гіпсоносні відклади. Інше, не
менш важливе джерело надходження стронцію (радіоактивних ізотопів) у наш час
антропогенне.
Синтетичні
поверхнево-активні речовини, феноли та нафтопродукти
Синтетичні
поверхнево-активні речовини (СПАР) - речовини, здатні адсорбуватися на
поверхнях розподілу фаз і знижувати внаслідок цього їх поверхневу енергію
(поверхневий натяг). У водні об'єкти СПАР потрапляють з побутовими та
промисловими стічними водами. У поверхневих водах СПАР перебувають у
розчиненому і сорбованому станах, а також у поверхневій плівці води. У
слабозабруднених поверхневих водах концентрації СПАР коливаються в межах
тисячних і сотих часток міліграма на літр. У зонах забруднення їх концентрації
підвищуються до десятих часток міліграм на літр, поблизу джерела забруднення -
кілька міліграм.
Потрапляючи у водойми,
водотоки, СПАР впливають на їх фізико-біологічний стан, погіршуючи кисневий
режим і органолептичні властивості - смак, запах тощо, і зберігаються там
протягом тривалого часу, оскільки розкладаються повільно. Головними факторами
зниження їх концентрації є процеси біохімічного окислення, сорбція завислими
речовинами і донними відкладами.
Гранично допустима
концентрація СПАР у воді питного водопостачання та культурно-побутового
водокористування становить 0,5 мг/л, у воді водойм рибогосподарського
використання - 0,1 мг/л.
Феноли. У природних
умовах феноли утворюються в процесах метаболізму водних організмів, при
біохімічному окисленні та трансформації органічних речовин. Вони є однією з
найпоширеніших забруднюючих речовин, що надходять у природні води зі стічними
водами нафтопереробних, лісохімічних, коксохімічних, лакофарбових,
фармацевтичних та інших виробництв. Концентрація фенолів у стічних водах може
перевищувати 10-20 г/л. У незабруднених або слабозабруднених річкових водах
концентрації фенолів звичайно не перевищують 20 мкг/л. У забруднених водах
вміст фенолів досягає десятків і навіть сотень мікрограм на літр.
Вміст фенолів
обмежується в природних водах, які використовуються для водопостачання,
риборозведення. Хлорування природних вод, в яких містяться феноли, при
водоочищенні призводить до утворення хлорфенолів, які навіть при концентрації 1
мкг/л надають воді неприємного запаху і смаку. ГДК фенолів становлять 0,001
мг/л.
Нафтопродукти - суміші
газоподібних, рідких і твердих вуглеводнів різних класів, які видобуваються з
нафти і нафтових супутніх газів. Нафтопродукти належать до найпоширеніших і
небезпечних речовин, які забруднюють природні води.
В момент потрапляння у
воду основна маса нафтопродуктів зосереджена у плівці. З віддаленням від
джерела забруднення проходить перерозподіл між основними формами міграції,
направлений у бік підвищення частки розчинних, емульгованих, сорбованих сполук
і відповідного зменшення їх вмісту в плівці.
Вміст нафтопродуктів у
річкових, озерних, морських, підземних водах і атмосферних опадах, звичайно,
становить соті або десяті частки міліграма в 1 літрі. У незабруднених
нафтопродуктами водних об'єктах концентрація природних вуглеводнів коливається
у річкових й озерних водах - від. 0,01 до 0,20 мг/л, іноді досягаючи 1,0-1,5
мг/л. Характер розподілу нафтопродуктів і природних вуглеводнів по акваторії
водного об'єкту непостійний. Найчастіше забруднюються прибережні зони.
Підвищені концентрації спостерігаються у поверхневому і придонному шарах, іноді
на окремих ділянках всередині водної товщі [18, 97].
Органічні сполуки
неприродного походження забруднювачі природних вод. Cинтетичні органічні
хімічні речовини у багатьох випадках стають причиною токсичності сполук
природного походження. На жаль, речовини природного походження не часто
перевіряються на токсичність за тими ж критеріями, що і синтетичні сполуки. Під
час перевірки на канцерогенність невеликої кількості природних органічних
сполук біля половини їх проявили себе як речовини з генно-мутаційною дією, тобто
потенційними канцерогенами.
Діоксини складаються із
двох груп речовин, які виникають при синтезі деяких хлорорганічних сполук, якщо
вони спалюються при відносно низьких температурах (<1000°С). У загальних
випадках під діоксинами розуміють перш за все поліхлоровані дибензо-діоксини
(ПХДБ) та поліхлоровані дибензофурани, (ПХДФ).
Різні види діоксинів
мають різну токсичність. Для розрізнення діоксинів використовується еквівалент
токсичності (ЕТ). Кожен із діоксинів має свій фактор токсичності (ФТ).
Найбільше значення ФТ надано найтоксичнішій речовині
2,3,7,8-тетрахлордібензо-(р)-діоксину (2,3,7,8-ТХБД). Воно дорівнює 1. Значення
ФТ для інших сполук коливається від 0 до 1 (для моно-, ді- та трихлоровмісних
сполук).
Пестициди - це хімічні
препарати, синтезовані сполуки, які використовуються у сільському господарстві
для захисту рослин від хвороб і шкідників з метою збереження урожаю
сільськогосподарських культур.
Водноекологічні аспекти
використання пестицидів потребують тривалого і детального дослідження. Відомо,
що сьогодні застосовується понад 300 пестицидів. Контролювати таку кількість
речовин у воді не здатна жодна з країн світу. Для більшості з цих речовин не
існує токсикологічно обгрунтованих ГДК.
Значну небезпеку для
поверхневих та ґрунтових вод становлять пестициди, які вносяться в кількостях
від 1 до 10 кг/га, добре розчиняються у воді (>10-50 мг/л) і дуже повільно
розкладаються. До таких пестицидів належать триазинові деривати (атразин,
симазин, тербутилазин), феноксикарбонові кислоти та їх похідні (бентазон,
бромазил, гексазинон).
В останні роки у воді
річок, озер та водосховищ знаходять багато різноманітних пестицидів, які попали
у воду внаслідок їх застосування у сільському та лісовому господарстві. їх
можна розділити на дві групи:
а) такі, що мають високу
імовірність виявлення у пробах води (атразин, симазин, тербутилазин,
хлортолурон, діурон, ізопротурон);
б) такі, що імовірне
виявлення лише в окремих пробах (бентазон, 2,40, мекопроп, метазахлор,
метрібузин).
Таким чином, в річці
відбувається постійна зміна як загальної концентрації розчинених речовин, так і
співвідношення між окремими з них. Також з течією відбувається переміщення
розчинених у воді мінеральних та органічних речовин, нерідко разом з
гідробіонтами. Уся ця рідка, тверда, розчинена і біологічна маса безперервно
зміщується по руслу, аж до гирла річки, іноді на цьому шляху частина
транспортованих речовин залишається у заплаві, переходить у підземні водоносні
горизонти і рухається по них, або виділяється при випаровуванні в атмосферу.
1.3 Джерела та шляхи
надходження забруднюючих речовин до малих річок
Відомий американський
еколог Рамад у своїй книзі "Основи прикладної екології",
характеризуючи забруднення, вказує на те, що забрудненням є небажані для людини
зміни в оточуючому середовищі, які виникають під впливом людської діяльності і
прямо, або опосередковано міняють розподіл енергії, що надходить до екосистеми.
Це в свою чергу змінює фізико-хімічні властивості оточуючого середовища, а
через це і умови, в яких існують живі організми. Аналізуючи цю думку стосовно
забруднення малих річок, попробуємо розібратись не тільки в термінах, що
характеризують забруднення, а і з джерелами та механізмами цього процесу.
Забруднення гідросфери
має дві складові. Одна є наслідком нераціонального, екстенсивного, нерідко без
чітко визначеної потреби надмірного використання природних ресурсів людиною. А
інша формується безпосередньо у водоймах на основі системи природних процесів,
пов'язаних з синтезом та розпадом органічної речовини. Тому забруднення річок
поділяють відповідно на антропогенне та біологічне.
В основі біологічного
забруднення річок лежить природне збільшення біомаси гідробіонтів, переважно
вищих водних рослин, з наступним їх відмиранням та розпадом. Також біологічним
забрудненням є органічні речовини, що утворюються в лісах, на полях та луках і
тим чи іншим чином потрапляють до річок. Тому розрізняють органічну речовину
автохтонного походження і алохтонного. Органічна речовина автохтонного
походження - це та, яка утворюється у самій річці, алохтонного походження - та
органічна речовина, що надходить до річки з площі її водозбору, у т.ч. і
антропогенного походження.
Використання площі
водозбору малих річок проходить з різною інтенсивністю, є різнонаправленим, в
основі його людська діяльність, яка в абсолютній більшості дає деяку кількість
побічних, непотрібних людині продуктів. Останні і складають основу всіх
забруднень, що формує людство. Забруднення річок, які виникають в результаті
людської діяльності, дістали назву антропогенних. Таким чином, антропогенні
забруднення малих річок тісно пов'язані з господарською діяльністю людини.
Не усі стічні води з
огляду на їх різний хімічний склад можуть суттєво змінити якість води в річці.
Разом з тим малі річки в найбільшій мірі зазнають впливу навіть незначних
концентрацій забруднювача, що поступає із стічними водами. Це обумовлено тим,
що стік малих річок в цілому незначний, їх самоочисні можливості невеликі, а
сумарне забруднення, яке поступає з водозбору, співвимірне, а нерідко і значно
перевищує трансформуючу здатність водної екосистеми.
Особливо небезпечний для
малих річок є сільськогосподарський стік. В результаті сільськогосподарської
діяльності в басейнах малих річок до їх русел разом з поверхневим стоком
надходять завислі мінеральні частки і органічні речовини, агрохімікати
(мінеральні добрива та пестициди). Згідно досліджень установлено, що в Україні
щорічно змивається до русел річок та інших водних об'єктів в середньому близько
120 млн.т. грунту в якому міститься відповідно 0,24; 0,12 та 2,4 млн.т азоту,
фосфору і калію. Із внесених добрив за різними джерелами з грунту вимиваються
до 20% азоту, 2-5% фосфору та 10-70% калію. Вимивання пестицидів складає до 1%
від внесеної кількості [18, 102].
Особливо значний
негативний вплив на екосистеми малих річок мають стічні води тваринницьких
комплексів. Вони, як правило, розміщуються поблизу малих річок і здебільшого ще
і не мають очисних споруд. їх робота приводить до надмірного накопичення
значних обсягів стічних вод на обмеженій території, очистка та обеззараження
яких ускладнюється через високі концентрації в них органічних речовин.
Однією з небезпечних
причин забруднення малих річок є водна ерозія, що розвивається на водозборі.
Внаслідок ерозії в русла річок з природних і, особливо, освоєних людиною
ландшафтів, полів змивається грунт, гумус, біогени та інші мінеральні й
органічні речовини. При цьому, як було вже зазначено вище, змивається і частина
внесених мінеральних добрив. Інтенсивність їх вимивання залежить від періоду
року та способу внесення, рухливості сполук біогенів у ґрунті та інтенсивності
розвитку ерозійних процесів. Найбільш рухливими є азотовмісні сполуки, а тому
вони і вимиваються у найбільшій мірі. Азот знаходиться як у ґрунтовому розчині
(в іонній формі), так і у зв'язаному стані. Амонійна форма азоту затримується
головним чином вбірним комплексом грунту і лише незначна частина переходить до
ґрунтового розчину. Нітрат-іони (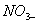 ) азоту цілком
переходять до ґрунтового розчину, а отже, з водним потоком, як поверхневим, так
і підземним, можуть виноситься до річки. За даними багатьох спостережень
найбільша кількість азотовмісних сполук надходить у водні об'єкти з поверхневим
стоком у період повені.
) азоту цілком
переходять до ґрунтового розчину, а отже, з водним потоком, як поверхневим, так
і підземним, можуть виноситься до річки. За даними багатьох спостережень
найбільша кількість азотовмісних сполук надходить у водні об'єкти з поверхневим
стоком у період повені.
Фосфор, що входить до
складу мінеральних добрив, трансформується у слабо розчинні сполуки. У зв'язку
з цим його вміст у ґрунтовому розчині дуже обмежений. У водні об'єкти басейнів
річок і самі річки при ерозійному процесі сполуки фосфору вимиваються разом з
частинками грунту у завислому стані.
В останні десятиріччя
суттєво зістарілася та зносилася система очисних споруд у різних галузях
народного господарства. Особливо гострою ця проблема є з очисними спорудами
комунально-побутового стоку у невеликих містах, які, як правило, розміщені на
малих річках. Саме тут проживає більшість населення України. Тому побутовий
стік невеликих населених пунктів дає суттєву частину забруднень малих річок.
Вирішення цієї проблеми потребує неабияких зусиль.
Як бачимо, внаслідок дії
перерахованих і ще не згаданих факторів та джерел забруднення малих річок
антропогенна складова забрудненого стоку з року в рік зростає, і це буде
продовжуватись до тих пір, поки не будуть впроваджуватись заходи з її зниження.
Таким чином, вирішальним
у створенні дискомфорту у басейнах малих річок нині є антропічні фактори. Ці
фактори мають як пряму, так і опосередковану дію. Різноманіття джерел
забруднень малих річок, різнобічне безсистемне використання їх стоку та
природних ресурсів у їхніх басейнах, відсутність господарських та
природоохоронних організацій, які б відповідали за охорону та підтримання
цілісності річкових екосистем, значно ускладнює вирішення цього комплексу
проблем. Одним з напрямків для виходу з цього кризового стану є залучення до
охорони річок громадських природоохоронних організацій та активістів-природоохоронців,
забезпечення їх роботи відповідними знаннями і конкретними настановами.
.4 Вплив забруднень на
екосистему річки
Вплив людської
діяльності на екосистеми малих річок відбувається через зміну фізико-хімічних
властивостей води в результаті додаткового надходження до річки біогенних
елементів, токсичних речовин, мулистих часток тощо. Відповідь екосистеми на ці
фактори можна знайти як у певних змінах параметрів екосистеми в цілому, так і
зміні структури і характеру функціонування окремих її компонентів.
Першою, і чи не найбільш
помітною ознакою впливу забруднень на стан річки є зміни в структурі біоценозу
екосистеми. Структура біоценозу - це у першу чергу кількісний та якісний склад
біологічних видів і кількість та біомаса особин окремих видів. Реакція на вплив
забруднень проявляється, як у змінах видового складу гідробіонтів, що входили
до складу біоценозу перед забрудненням річки, так і у змінах чисельності та
біомаси окремих видів. При цьому порушення структури біоценозу проявляються у
зникненні одних і появі інших видів. Зміна чисельності і біомаси видів
характеризує відтворювальну функцію гідробіонтів, а це, як було сказано вище,
напряму пов'язано з процесами продуктивності екосистеми, а отже, і процесами
самоочищення та формування якості води в річці. Саме дослідження змін у
продуктивності окремих складових біоценозів річки через оцінку їх загальної
чисельності і біомаси, дозволяє з'ясувати здатність екосистеми річки
протистояти надходженню нових забруднень.
Визначення крайніх меж
дії того чи іншого фактору, як на окремі складові біоценозів, так і на
екосистему в цілому є необхідним елементом у розробці заходів з управління
екосистемою. Якісні та кількісні показники факторів у межах яких функціонує
екосистема визначають максимальний та мінімальний їх вплив на екосистему. У
зоні дії факторів, що розміщена між мінімумом і максимумом, екосистема
знаходяться в стані, який характеризується відповідною продуктивністю, а ЇЇ
компоненти з належною інтенсивністю функціонують, здійснюючи обмін речовин, але
якісно не змінюючись. Поза межами даної зони дії фактору екосистеми річок
значно змінюють не тільки структуру своїх біоценозів, але і направленість
процесів функціонування (життєдіяльності). Це стає передумовою виникнення
якісно нової екосистеми, якій властиві інша структура та інший характер та
направлення процесів функціонування.
Прикладом такої зміни
зони дії факторів, яка приводить до перебудови екосистем, є, наприклад,
екологічно необгрунтоване спрямлення русел річок, облицювання
("закріплення") берегів бетонними плитами, розорювання луків, вирубка
заплавних чагарників, лісів тощо. Частіше всього в таких умовах виникають
екосистеми зі спрощеною структурою (перш за все зменшується кількість видів) та
процесами функціонування. Такі екосистеми не здатні забезпечити не тільки
формування відповідної якості води в руслі річки, а і самі у зв'язку із
зростанням їх продуктивності, стають причиною вторинного забруднення [18, 106].
Виявити такі річки під
час обстеження можна не тільки візуально, але і за гідрохімічними та
біологічними показниками.
Таким чином, суть
антропогенного забруднення малих річок полягає у збільшенні маси алохтонних
речовин, що надходять до русла річки з поверхневим стоком.
Компонентами останнього
є токсичні речовини, завислі частки, наноси, іонний стік, стік органічних
речовин та біогенних елементів, біологічний стік тощо. Якісні та кількісні
показники, що характеризують окремі складові поверхневого стоку потрібні для
визначення допустимого навантаження на конкретну річку з урахуванням особливостей
її екосистеми. Сьогодні існує багато різних способів та методів регулювання
величини окремих складових поверхневого стоку.
Для прикладу розглянемо
біогенний стік. Ця складова поверхневого стоку дуже інтенсивно використовується
зеленою рослинністю, як на площі водозбору, зокрема у заплаві, так і в самій
річці. На відміну від забруднень хімічної природи біогени включаються до так
званого біотичного кругообігу і частково, поглинаються донними відкладами, де
можуть накопичуватися, захороняючись на досить довгий період життя річки.
Для кожної складової
антропогенного стоку існують свої методи зниження його пресу на екосистему
річки. Усі компоненти екосистеми річки пов'язані між собою біотичними
зв'язками. В їх основі лежить обмін речовин та енергії. Разом з тим, вони
залежать і від абіотичних факторів - субстрату, (морфометричних, гідрофізичних,
гідрологічних), які в значній мірі визначають характер розвитку біоти в річці.
В цілому, у річці існує певний кругообіг речовини у т.ч. з участю в ньому антропогенного
стоку. Надходження до річок органічної речовини, біогенів пестицидів, солей
важких металів і забруднювачів іншої природи відповідним чином впливає на
життєдіяльність гідробіонтів. В результаті забруднення, зменшується видовий
склад іхтіофауни, фітопланктону (замість діатомових, які властиві для більшості
фітоценозів малих річок, значного розвитку досягають синьозелені). Це приводить
до погіршення умов розвитку зоопланктону і зообентосу, як кормової бази
гідробіонтів, а звідси і біологічного різноманіття популяцій ссавців та птахів.
Крім цього погіршуються рекреаційні можливості річок. Тому, слід пам'ятати, що
в екосистемі річки, як і в інших цілісно-системних природних утвореннях, усі
складові екосистеми функціонально пов'язані одна з одною. Зникнення окремого
виду обов'язково приводить до зникнення інших, тісно пов'язаних з ним видів
гідробіонтів, а звідси змінюються і функціональні особливості екосистеми в
цілому. На такому етапі знаходяться майже всі екосистеми малих річок України.
Їх деградація наблизилась до тої межі, за якою відбуваються глибокі порушення в
структурі та функціонуванні гідробіоценозів, а через це і катастрофічне
зниження самоочисної здатності річки.
Особливо це стосується
каналізованих річок екосистеми, які уже зазнали значного порушення. В них
відсутні заплави з луками, ліси вирубані, відсутні природні біофільтри
поверхневого стоку з площі водозбору. Стан таких річок свідчить, що потрібно
говорити уже не про стимулювання процесів самоочищення, а про повне їх
відновлення.
Розділ 2. Методика
дослідження якості води в річках
.1 Основні методи
дослідження якості води у річках
Фізико-хімічний. Цей
напрям визначення якості води базується на фізичних та хімічних методах
досліджень і, в цілому, оцінка за цими методами дає достатньо репрезентативні
результати. Основним результатом є з'ясування хімічного складу розчинених у
природних водах речовин. Фізико-хімічними методами можна визначити не тільки
кількість і якісний склад присутніх у воді хімічних речовин, але і фізичні та
органолептичні властивості води, наприклад, прозорість, кольоровість, запах,
смак води, текучість та інші.
Так, більш конкретно,
наприклад, загальний ступінь мінералізації визначають шляхом випаровування
деякого об'єму води і зважування сухого залишку. Вміст у воді розчинених та
завислих органічних речовин визначають методами окислення. Кількість
легкорозчинних органічних речовин визначають методом пtрманганатного, а всіх
разом - біхроматного окислення.
Дуже важливими
показниками якості води є вміст в ній біогенних речовин, зокрема різних форм
азоту (NH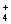 ,
NO
,
NO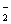 ,
NO
,
NO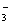 ),
фосфору (H
),
фосфору (H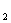 РO
РO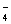 ,
НРО
,
НРО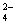 ,
РO
,
РO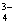 ),
кремнію (HSiO3+, SiO
),
кремнію (HSiO3+, SiO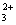 ),
заліза (Fe2+, Fe3+), мікроелементів. Для визначення цих речовин на сьогоднішній
день розроблено багато різних методик.
),
заліза (Fe2+, Fe3+), мікроелементів. Для визначення цих речовин на сьогоднішній
день розроблено багато різних методик.
Для з'ясування
інтенсивності процесів, спрямованих на покращення якості води у поверхневих
водах, важливо встановлювати вміст кисню. Його вміст у воді характеризує
інтенсивність та направленість багатьох процесів, що проходять у водоймі,
зокрема біологічного окислення органічних речовин.
Іншим важливим
показником є рН. При зміні у воді співвідношення водневих і гідроксильних іонів
змінюється, водневий показник (рН). Його значення в нейтральній воді дорівнює
7, в кислій - менше 7, а в лужній - більше 7. Водневий показник є важливим,
оскільки вказує не тільки на кількісне співвідношення водневих та гідроксильних
іонів, але і спрямованість багатьох біологічних та хімічних процесів у водоймі.
До того ж у кислій воді з рН менше 5 більшість гідробіонтів не здатна до
нормального існування і відповідно їх роль у формуванні якості води практично
зводиться у таких умовах нанівець. Оптимальною треба вважати воду з рН близько
7. Тобто вже за одним цим показником еколог може зробити попередні висновки
щодо функціональної активності біотичної складової гідроекосистеми, яку він
починає досліджувати. Саме тому такі показники як кисень і рН завжди входять до
експрес тестів і без перебільшення є важливими і показовими [17, 23].
Окремо потрібно сказати
про надзвичайно широку групу т.з. приладних методів визначення вмісту різних
хімічних речовин і показників. Наприклад, давно розроблені та широко
використовуються прилади для визначення з допомогою електродів водневого
показника (рН), вмісту кисню, загальної суми іонів, серед них окремо аніонів і
катіонів і т.п. На сьогоднішній день точне визначення вмісту у воді іонів
мікроелементів, більшості найрізноманітніших складних органічних речовин
практично неможливе без застосування відповідних приладних методів. Вони
ґрунтуються на різних фізичних властивостях цих речовин, наприклад - різні
спектри випромінювання чи поглинання, різні температури горіння тощо.
Біологічний. В основі
цього напряму оцінки якості води річок лежить аналіз населення водойм, який
проводять диференційовано, переважно за екологічними групами. Окремо вивчають
планктон, бентос, перефітон, або вивчають прибережну рослинність тощо. Серед
біологічних показників, що визначають ступінь забруднення води, зокрема в
річках, перш за все, потрібно назвати мікробіологічні показники. Мікроорганізми
завдяки своїм біологічним властивостям найбільш швидко реагують на зміни у
зовнішньому середовищі, сигналізуючи про це досліднику як своїм якісним
складом, так і кількісним розвитком. Серед експрес методів у мікробіології
найбільш поширеними вважаються колі-титр і колі-індекс.
Крім бактерій у воді
річок мешкає багато інших мікроскопічних організмів зокрема, грибів,
джгутикових, амеб та інфузорії. До мікрооб'єктів зараховують і найбільш дрібних
-коловерток. Більшість мікроскопічних еукаріот не здатні самі засвоювати
органічні речовини, але інтенсивно споживають бактерій та водорості.
Мікроскопічна складова гідроекосистем особливо добре розвивається за умов
наявності у воді великої кількості органічних речовин. Та з погіршенням умов -
у першу чергу, зниженням вмісту кисню, більшість еукаріот зникає, утворюючи
цисти і яйця і переходять у стан спокою.
Серед організмів, які
чітко реагують на наявність у воді забруднюючих речовин слід назвати
представників, що закріпляються на різних субстратах. Це здебільшого обростання
з бактерій, грибів, водоростей, інфузорій. До тих, що закріпляються на
субстратах належать також прісноводні губки та моховатки. За видовим складом і
кількісним розвитком гідробіонтів визначають якість води. У такий спосіб визначають
вміст органічних речовин у воді, або сапробність річкової води. Це обумовлено
тим, що прикріплені організми знаходяться постійно на одному місці і дуже
швидко реагують на всі зміни, які відбуваються у середовищі. Вони реагують як
на поступове, раптове чи періодичне забруднення води, що негайно відображається
на їхньому кількісному розвитку і якісному складі. Важливо зазначити, що ці
форми утворюють настільки характерні обростання, нарости і нагромадження, що їх
можна розрізняти, навіть не застосовуючи мікроскопа, безпосередньо на місці
відбору проби. Це має свої переваги та недоліки. Тому, перш ніж приступати до
визначення сапробності води в річці, потрібно вибрати той чи інший метод з
урахуванням екологічного стану річки.
Хімічні та
бактеріологічні дослідження є досить трудомісткими і потребують складного
лабораторного обладнання. Тому висновок відносно ступеню сапробності води на
тій чи іншій ділянці річки, визначеної хімічними або біологічними методами,
можна зробити тільки за кілька днів з моменту відбору проб.
Для біологічних
досліджень якості води не потрібна обладнана лабораторія. Для цього досить мати
мікроскоп та прилади для відбору планктону, бентосу або обростань. Таким чином
біологічний метод характеризується простотою і швидкістю одержання кінцевих
результатів. В тих випадках, коли він застосовується для визначення загального
екологічного стану річки, висновок про сапробність можна зробити на місці. Але
застосування цього методу можливе тільки при наявності у дослідників
відповідних знань.
Біологічний метод
застосовується також для попередньої оцінки екологічного стану річки з
наступним хімічним та бактеріологічним аналізом води. Великою перевагою
біологічного методу над іншими є те, що його застосування дає можливість
отримати інформацію як про населення річки в цілому, так і про організми
окремих біотопів. Разом з тим, слід вказати, що біологічний метод є більш
суб'єктивний, ніж інші методи, які включають вивчення забруднення річок, але
він більш чітко визначає не лише якість води, а і загальний стан екосистеми
річки.
Санітарно-бактеріологічний.
Цей напрям має переважно вузькопрактичне застосування, зокрема для визначення
якості питної води, або рівня епідемічної небезпеки поверхневих вод. В основі
його - дослідження та облік бактеріального населення водойм. При оцінці якості
води цим методом використовуються як кількісні так і якісні показники. В
останньому випадку, визначається видовий склад бактерій, що зустрічаються у
воді. Кількісні показники особливо широко використовуються для порівняльної
характеристики якості води в різних річках, або в одній і тій же річці, але на
різних її ділянках.
З допомогою кількісного
методу можна визначити ступінь бактеріального забруднення води в річці, хід та
направленість процесів самоочищення в річці, їх інтенсивність тощо. Кількісний
бактеріологічний метод особливо практикується для оцінки роботи фільтрів, на
водопровідних станціях, оцінки роботи біофільтрів, ефективності роботи заходів
з очищення поверхневого стоку, що надходить до річки з площі водозбору тощо
[17, 30].
Якісні бактеріологічні
дослідження води в річках проводяться переважно для характеристики фекального
забруднення, індикатором якого є наявність у воді кишкової палички, або
близьких до неї форм бактерій.
Екологічна класифікація
якості води. Для різних практичних потреб суспільства потрібна глибоко наукова,
але доступна практична методика оцінки якості води, що ґрунтується на природних
властивостях і особливостях водних об'єктів. В інституті гідробіології НАН
України були розроблені принципи побудови екологічної класифікації якості води.
Згідно цієї класифікації якість води у переважній більшості малих річок України
за даними проф. А.В. Яцика належить до 4-6 класів. Тобто, від
"забрудненої" до "дуже забрудненої".
Аналіз сучасного стану
якості води в річках з урахуванням економічного розвитку регіонів України та
впливу на них господарської діяльності дозволив А.В. Яцику зробити розрахунки з
визначення мінімальних змін забруднень з тим, щоб якість води в річках Карпат і
Полісся повернулась до 3 класу, а для річок Лісостепу та Степу до 4 класу. В
лісостеповій зоні якість води в річках відноситься до 6 класу. Щоб цей показник
знизити до 5 класу, необхідно, наприклад, в річці Гнила Липа (басейн Південного
Бугу) зменшити концентрацію нафтопродуктів з 0,45 до 0,30 мг/л.
Особливо низька якість
води у степових річках. Якщо в річках лісостепу та Полісся якість води можна
відновити шляхом зниження концентрації у воді невеликої групи забруднюючих
елементів, то, наприклад, для відновлення якості води до 4 класу в р. Кальчик
(басейн Азовського моря) необхідно значно знизити вміст сульфатів, хлоридів,
нітратів, нітритів, цинку нафтопродуктів і це ще не повний перелік.
2.2
Еколого-гідробіологічні дослідження малих річок
Річка це особливе
природне утворення неоднорідне, як по довжині, так і на окремих ділянках. Тому
вивчення її біоти (живого населення) і якості води проводиться на протязі усієї
річки - від витоку до гирла, або на окремих ділянках. Такі ділянки виділяються
на різних ділянках річки - у верхній течії, середній та нижній.
Мета
еколого-гідробіологічних досліджень малих річок полягає у вивченні водних
організмів - бактерій, рослин, безхребетних та хребетних тварин в єдності з
умовами їх існування. Предметом цих досліджень є не тільки окремі організми та
їх угрупування, біоценози і усе населення річки в цілому. Вивчається також
біологічна продуктивність річок на основі досліджень продуктивності окремих
видів чи груп організмів при порівнянні умов: тих чи інших значень
антропогенного навантаження, солоності, температури, прозорості води та інших
факторів середовища.
Вивчаючи в різних
напрямках річку та аналізуючи отримані результати, можна чітко охарактеризувати
гідробіологічний, гідрохімічний і гідрологічний режими річки, а також процеси,
які в ній відбуваються і пов'язані з формуванням якості води. Комплексність
досліджень дає змогу оцінити екологічний стан річки в цілому.
Таким чином, головними
напрямками екологічних досліджень річок можуть бути:
дослідження біоти річок,
умов її існування, специфіки розподілу її в структурних складових річки,
вивчення впливу різних
факторів на розподіл біоти в системі річки;
дослідження реакції
біоти на різнобічні забруднення річок;
вивчення можливостей
використання функціональної активності біоти для інтенсифікації процесів
самоочищення річок та формування якості води в них;
використання біоти як
індикатора стану екосистем річки та якості води в ній;
визначення комплексу
заходів (у річці і у заплаві), необхідних для покращення процесів самоочищення.
Дослідження у вказаних
напрямках можуть проводились як безпосередньо на річці, так і в лабораторних
умовах в залежності від поставлених завдань [17, 31].
Початковою ланкою таких
досліджень був збір відомостей про річку, її фізико-географічне розташування,
характеристика витоку, наявність притоків, заплавних озер, швидкість течії в
руслі, глибинах тощо. Далі ми приступили безпосередньо до загальної оцінки
стану екосистеми річки.
Основні групи показників
та критерії для різних еколого-гідробіологічних досліджень та оцінок представлені
відповідно у додатку 1 і 2.
Запропоновані показники
оцінки екологічного стану річки не потребують складних інструментальних
досліджень і можуть бути одержані безпосередньо, на річці, що дає певну
перевагу перед дослідженням річок з допомогою складних приладів, користування
якими у польових умовах є неможливим. Разом з тим слід зазначити, що такий
підхід дає тільки загальну картину стану екосистеми річки і є початковим етапом
досліджень її екосистеми.
Для більш глибокої
оцінки стану річки, аналізу процесів, які відбуваються в ній, зокрема
самоочищення річки та формування якості води в ній, потрібні більш глибокі
дослідження, як по характеру так і за інструментальним забезпеченням.
Отже, розпочинаючи
дослідження, ми спочатку проводимо звичайний огляд річки, а також можемо
довідатися деяку інформацію від місцевих жителів. Вже перший огляд річки,
найдоступніші спостереження дають багато інформації про річку, її особливості,
її проблеми, розуміння можливих шляхів покращення стану річки.
Наприклад, річний стік
річки Стир відповідає природному, річка не пересихає влітку і не промерзає до
дна взимку, об'єм стоку навіть у маловодні роки не викликає критичних ситуацій
для біоти і забезпечує в достатній мірі водокористування. Отже, водний режим
річки оцінюється як екологічно благополучний.
Проте, для річки
Сапалаївка характерний значний нерівномірний стік, річка пересихає влітку,
глибоко промерзає взимку, отже, водний режим оцінюється як екологічно
неблагополучний.
.3 Визначення фізичних
властивостей природних вод
Визначення температури
води та повітря під час відбору проб є невід'ємною частиною аналізу.
Температуру води вимірюють завжди одночасно з відбором проб ртутним термометром
з поділками від 0,1-0,5°С. Там де є можливість і дозволяють умови, температуру
природних та стічних вод вимірюють шляхом занурення термометра у воду. Якщо це
неможливо, то температуру вимірюють у посудині зразу після відбору проби. При
цьому вона не повинна освітлюватися сонцем.
Прозорість води залежить
від її кольоровості та мутності. Тому для її визначення можна застосувати білу
квадратну, або круглу дошку з довжиною сторони, або діаметром 20 см. Дошку на
шнурку занурюють у воду до тих пір, поки вона стане невидимою. За допомогою
мірної рейки або шнурка визначають товщину прозорого шару води в см.
Кольоровість води
обумовлена присутністю у ній гумінових речовин та трьохвалентного заліза.
Кольоровість води в якій присутні завислі частки визначають після відстоювання.
Це відбувається всього через 2 години після відбору проби. Пробу наливають у
циліндр висотою стовпчика 10 см. Розглядають пробу на білому фоні на розсіяному
денному світлі. Результат визначення описується словесно з зазначенням відтінку
та інтенсивності забарвлення (слаба, сильна).
Мутність води обумовлена
вмістом у воді нерозчинних і колоїдних речовин неорганічного та органічного
походження. Причиною мутності є мулисті частки, кремнієва кислота, гідроокиси
заліза та алюмінію, органічні колоїди, мікроорганізми та планктон. Мутність
води визначається різними методами, але зупинимось на характеристиці найбільш
доступного.
Візуальне визначення
мутності проводиться з допомогою двох циліндрів об'ємом до 200 мл. В один із
них наливаємо досліджувану воду висотою стовпчика 20, 30 або 40 см в залежності
від мутності. До іншого циліндру доливаємо дистильовану воду до половини його
об'єму і добавляємо із бюретки розбавлену стандартну суспензію SiО2. Чим більше
мутність, тим більшої концентрації виготовляють стандартний розчин SiО2. Для
визначення незначної мутності використовують стандартну суспензію, що містить
0,1 мг SiО2 в 1 мл. При аналізі проб, мутність яких складає вище 50мл SiО2, в
1л використовують суспензію 1мг SiО2 в 1 мл. Стандартну суспензію доливають до
тих пір, поки вода в обох циліндрах стане однакової мутності. Після цього до
обох циліндрів доливають дистильовану воду до 200 мл, тобто до висоти стовпчика
води в циліндрах (40 см). При необхідності в один із циліндрів добавляють
стандартну суспензію SiО2 до менш мутного циліндру. Записують об'єм проби та
об'єм стандартної суспензії SiО2, що добавили до циліндру з дистильованою
водою. Далі усі розрахунки виконують за формулою:
Мутність води (х) у мг
SiО2/л
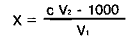
С - концентрація
стандартної суспензії мг/мл;- об'єм стандартної суспензії мл;- об'єм проби мл;
Результати округляють з
точністю до 1 мг/л.
Визначення змулених
речовин. Визначаються змулені речовини зважуванням. Для визначення змулених
речовин застосовується фільтрування. Фільтрують через раніше зважений тигель
Гука, або фільтруючий скляний тигель, чи воронку. Висушують у термостаті при
температурі 105°С, охолоджують і зважують. При відсутності тиглів Гука змулені
речовини визначають за допомогою доведених до сталої ваги безколірних паперових
фільтрів. При цьому обов'язково проводять сухий дослід, пропускаючи через такий
же фільтр дистильовану воду в такому ж об'ємі, потім фільтр сушать до сталої
ваги і знайдену таким способом поправку віднімають [17, 35].
При великій кількості
змулених речовин беруть води для визначення менше літра при малій - більше
літра. Кількість змулених речовин у досліджуваній воді в мг/л визначають за
формулою:
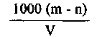
- вага тигля із змуленою
речовиною,- вага пустого тигля,- кількість взятої води для визначення.
Смакові якості води
обумовлюються присутністю речовин природного походження, або речовин, які
надходять до річки разом з забрудненням. Розрізняють наступні смакові якості:
солоний, солодкий, гіркий, кислий. Крім того можна виділяти і деякі присмаки:
металічний, лужний тощо.
Результат визначення
цього показника залежить від смакового сприйняття та досвіду дослідника. Для
уникнення помилки у визначенні смаку води цю роботу проводять зразу кілька
дослідників під час відбору проби.
Визначення запаху. Чиста
вода не має ніякого запаху: Вона має запах лише тоді, коли в ній відбуваються
ті чи інші процеси, зокрема хімічні, біохімічні тощо. Запах води у річці
викликають леткі речовини, що утворюються в ній природнім шляхом, або попадають
до неї зі стічними водами.
Спочатку визначають
природу запаху (болотний, гнилісний т.п.), а потім визначають його
інтенсивність по п'ятибальній шкалі. Для визначення запаху у конічну колбу
наливають 250 мл проби води при t до 20°С. Колбу закривають пробкою, кілька
разів збовтують і, відкривши, визначають характер запаху та його інтенсивність.
До іншої колби також наливають 250 мл води, накривають годинниковим склом і
підігрівають до t 60°C і таким же способом встановлюють характер та
інтенсивність запаху.
Основні запахи, які може
мати річкова вода: А - ароматичний, Б -болотний, Г - гнилісний, Д - деревний, 3
- земляний, П - пліснявий, Р -рибний, С - сірководневий, Т - трав'янистий, О -
огірковий Н - невизначений, тощо.
Запахи, створені
речовинами штучного походження, називають за відповідними речовинами: фенольний,
камфорний, гасовий хлоридний тощо. Інтенсивність запаху оцінюють за
п'ятибальною шкалою (таблиця 2.1).
Таблиця 2.1 Визначення
інтенсивність запаху води
|
Інтенсивність
|
Характер запаху
|
Прояви запаху
|
|
0
|
Ніякого захисту
|
Відсутність суттєвого запаху, запаху не відчувається
|
|
1
|
Дуже слабкий
|
Запах невизначений, але є.
|
|
2
|
Слабкий
|
Запах визначений, звертає на себе увагу
|
|
3
|
Помітний
|
Запах легко виявляється і визначається
|
|
4
|
Чітко виражений
|
Запах добре помітний, звертає на себе увагу і змушує
утримуватися від пиття
|
|
5
|
Дуже сильний
|
Запах настільки сильний, що викликає у дослідника негативні
відчуття, вода непридатна для пиття
|
Таким чином, ми охарактеризували
прості та доступні способи визначення деяких властивостей води, що у певній
мірі характеризують її якість у річці. Але у кожному конкретному випадку, в
залежності від мети та завдань досліджень слід використовувати інші більш
складні та трудомісткі методи: визначення кисню, вуглекислоти, окислювальних
процесів, вміст окремих мінеральних та органічних речовин, тощо.
.4 Відбір проб води для
гідрохімічних досліджень
При застосуванні хімічних методів
аналізу води велике значення відводиться правильному відбору проб води.
Існують загальні вимоги до відбору
проб: проба повинна відображати умови, місце та мету її відбору; відбір,
зберігання та доставка проб до лабораторії повинні забезпечувати незмінність у
вмісті відповідних хімічних компонентів; об'єм проби повинен бути достатнім для
наступного її аналізу. Останнє визначається повнотою хімічного аналізу проби.
Для неповного аналізу - визначають тільки кілька компонентів, або окремі
властивості води досить відібрати 1л, а для більш широкого аналізу відбирають
2л води.
Місце для відбору проб вибирається у
відповідності з метою аналізу на основі вивчення місцевості. Визначаючи місце
відбору проб води для хімічного аналізу, особливо ретельно потрібно обстежити
притоки річки та джерела їх забруднень, що знаходяться вище місця відбору
проби.
Разові проби відбирають один раз у
відповідному місці і розглядають як результат одного аналізу, якого досить для
з'ясування стану якості води на даний час та у даному місці.
Розрізняють дві основні проби:
просту та змішану. Проста - це коли з одного місця разово відбирається увесь
об'єм потрібної проби. Змішану пробу одержують шляхом злиття простих проб води,
відібраних з одного і того ж місця через відповідні проміжки часу, або
відібрані одночасно на різних ділянках річки. Ця проба відображає середній
хімічний склад води із урахуванням як місця, так і часу відбору. У більшості
випадків цей вид проб застосовується для характеристики якості води у заплавних
озерах річок. Необхідно пам'ятати, що змішану пробу не можна використовувати
для визначення компонентів якості води, які легко змінюються (наприклад рН,
розчинні у воді гази тощо). Ці компоненти визначають у кожній окремо взятій
пробі.
Для зберігання проб використовують
попередньо ретельно вимитий скляний або поліетиленовий посуд відповідного
об'єму. Перед відбором проб посуд слід кілька разів сполоснути тією ж водою, з
якої береться проба. Ємкості з пробами потрібно підписати, або пронумерувати та
зареєструвати у щоденнику.
Відбір проб здійснюється шляхом
занурення ємкості у воду, заповнюючи посуд до верху і при можливості уникати
контакту води з повітрям.
Середню пробу води з річок відбирають
у місці де найбільша течія, краще на фарватері. Відбирають пробу під поверхнею
води (як правило 20-30 см). Проби відбирають одночасно, або серійно, прості або
змішані. Якщо є необхідність відібрати пробу в місці надходження до річки
стічних вод, то здійснюють це там, де стічні води повністю змішуються з
річковою водою. Але при цьому потрібно враховувати, що річкова вода і стічні
води мають різну щільність, тому процес змішування може проходити досить
повільно. Як правило, процес змішування вод відбувається на відстані від сотень
метрів до кількох кілометрів. У свою чергу місце відбору проб не повинно бути
дуже віддаленим від місця поступання у річку забруднених вод.
Хімічні характеристики у відібраній
пробі з часом можуть мінятись. Наприклад, досить швидко може змінитись рН,
температура, вміст розчинених у воді газів тощо. Кисень, двоокис вуглецю,
сірководень, хлор тощо можуть або з'явитись у пробі, або зникнути з неї. Ці та
подібні їм показники потрібно визначити на місці відбору проб, або пробу води зафіксувати.
Зміна величини рН, вмісту кисню, карбонатів, вільного двоокису вуглецю і т.д.
може викликати зміну властивостей інших компонентів, які містяться у пробі.
Деякі із них можуть випасти в осад, або навпаки із нерозчиненої форми перейти
до розчину. Це відноситься особливо до солей заліза, марганцю та кальцію. У
нефіксованій пробі проходять різні біохімічні процеси за участю
мікроорганізмів, водоростей тощо. Ці процеси у відібраній пробі проходять не
так, як у природному середовищі річки і приводять до окислення або відновлення
деяких компонентів проби: нітрати відновлюються до нітритів, або амонію,
сульфати до сульфітів, витрачається кисень або навпаки, відбувається окислення
сульфідів, до сульфітів заліза (II), ціанідів тощо. Вплив різних факторів на
зміну компонентів, які знаходяться у воді, може бути як прямим так і
опосередкованим.
.5 Визначення гідрохімічних
характеристик природних вод
Застосування хімічних показників для
характеристики якості води обумовлено тим, що інші методи не завжди дають точні
кількісні показники забруднень. За допомогою ж хімічних методів можна
встановити не тільки вплив забруднень на життєві функції водяних організмів, а
і хімічну природу забруднень, їх розсіювання у товщі води, характер процесів у
водному середовищі, на проходження яких вони впливають тощо.
Для простого гідрохімічного
обстеження річки може бути достатньо:
три дуже чисто вимиті майонезні
склянки;
чисті пляшки з пробками місткістю
0,5-1,0 л, які можна використати і для відбору, тимчасової консервації та транспортування
проб води;
індикаторні набори для виміру рН,
нітратів та жорсткості води тощо. Інструкції з їх практичного застосування
завжди надаються у комплекті.
Кислотність води Визначення в
польових умовах загальної кислотності води у річці. Для цього на місці відбору
проб в колбу для титрування відбирають 100 мл води. В пробу добавляють (3
каплі) розчину фенолфталеїну і титрують на білому фоні 0,1 н розчином їдкого
калію до появи рожевого кольору. Розраховують загальну кислотність за формулою:
Р = (вк 0,1 1000) / V = (вк 100) / V
де Р - кислотність,
в - об'єм 0,1 н їдкого калію, що
витрачено на титрування;
к - коефіцієнт для проведення
концентрації розчину NaOH до 0,1 н- об'єм проби взятої для титрування.
Розчинний кисень Для якості води у
річці важливе значення має її газовий режим і особливо вміст розчиненого кисню.
Для його визначення використовують різні методи. Найбільш поширені це
йодометричний метод Вінклера, пірофосфатний метод та полярографічний. Найбільш
доступний є метод Вінклера. В його основі реакція розчиненого кисню з
гідроокисом марганцю двохвалентного і на йодометричному визначенні сполук вищих
за ступенем окислення, що утворились в результаті реакції. Проби для визначення
розчинного у воді кисню відбирають у так звані кисневі склянки (пляшечки з
притертою пробкою). Під час відбору проб їх повністю занурюють у воду і там же
закривають пробкою.
Для фіксації проби у склянку, в
залежності від її об'єму, доливають від 0,5 до 2 мл розчину сульфату (або
хлориду) марганцю. Другою піпеткою додають стільки ж розчину їдкого калію.
Потім склянку обережно закривають пробкою так, щоб не було бульбашок повітря.
Горло склянки обмивають водою і добре перемішують перевертаючи склянку до
утворення осаду, якому дають можливість зібратися на дні склянки. Для
подальшого визначення вмісту розчиненого у пробі кисню необхідно розчинити
осад. Для розчинення осаду у склянку додають 5мл розбавленої сірчаної кислоти
(розведення 1:4). Склянку закривають і перемішують вміст. Через 5 хвилин вміст
склянки переносять до конічної колби і титрують 0,01 норм розчином тіосульфату
натрію до переходу буро-коричневого забарвлення проби в солом'яно жовте. Після
цього добавляють кілька капель розчину крохмалю і продовжують титрувати до
знебарвлення синього кольору.
Вміст розчиненого кисню (X) в мг/л
вираховують за формулою:
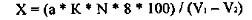
де: а - об'єм 0,01 норм розчину
тіосульфату натрію витраченого на титрування, мл;
К - коефіцієнт поправки до
концентрації титрувального розчину тіосульфату натрію;- концентрація
(нормальність) розчину тіосульфату;
- еквівалент кисню; - об'єм проби
(кисневої склянки);- загальний об'єм реактивів, які доливають в кисневу склянку
при фіксації кисню.
Насичення води киснем (Y) у
відсотках вираховують по формулі:
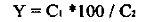
де: С1 - визначена концентрація
кисню мг/л,
С2 - рівноважна концентрація кисню
визначена згідно таблиці для температури води зафіксованої під час відбору
проби
Для інших значень атмосферного тиску
рівноважні концентрації вираховуються згідно формули:
С1 = С2*Р/760
де: С1 - концентрація кисню, що
визначається при тиску Р, мг/л.
С2 - величина рівноважної
концентрації кисню, знайдена згідно таблиці при відповідній t води, мг/л;
Р - атмосферний тиск, мм. рт.ст.
Вплив розчинених у воді солей
виражається у зменшенні розчиненого кисню (на кожні 1000 мг солей віл води).
Температура (С°) 0 10 20 30
Зниження розчинності кисню мг/л
0,08405 0,06217 0,04777 0,04085
Біологічне споживання кисню Важливим
показником якості води є вміст у ній органічної речовини. Природні води здатні
окислювати органічні речовини, що виражається у зменшенні кисню у воді.
Найбільш повно цей показник можна визначити при використанні для аналізів
біхромату калію, його звичайно, називають хімічним споживанням кисню (ХСК) і
для питної води він не повинен перевищувати 15 мг/л кисню.
Особлива роль належить розчиненому у
воді кисню в анаеробному біохімічному розщепленні органічної речовини, що
присутня у природній воді. Кількісно цей процес виражається величиною хімічного
поглинання кисню і називають біохімічним споживанням кисню (БСК). БСК у
природних водах не повинен перевищувати 3 мг/л кисню при 20°С.
Суть методу оцінки БСК полягає у
визначенні різниці між вмістом кисню до і після інкубації проб у стандартних
умовах. Стандартні умови - це термін інкубації проби 5 днів при 20°С без
доступу повітря і світла. Споживання кисню при цих умовах зветься БСК5. Час
експозиції проби може бути і одна, або три доби і навіть 10. У цих випадках ми
одержуємо БСК1, або БСК3, і т.д. в залежності від часу експозиції проби. Усю
роботу з підготовки проби для визначення БСК проводять на місці її відбору.
Проба не фільтрується. В лабораторних умовах перед визначенням БСК пробу добре
перемішують. В разі, коли у пробі БСК5 досягає 6 мг/л, її розбавляють. Для
цього використовується штучно приготовлена вода, яка містить мінеральні поживні
елементи в кількості достатній для того, щоб біохімічні процеси, які
відбуваються в аеробних умовах, протікали зі звичною для них інтенсивністю.
Добавку використовують, зважаючи на характер проби та мету визначення БСК.
За визначеною в стандартних умовах
величиною БСК5 можна робити оцінку ступеню забруднення даної водойми чи ділянки
річки (див. таблицю 2.2).
Для визначення показника БСК
потрібно мати три кисневі склянки ємністю 100-300 мл. Кожну склянку споліскують
відібраною пробою і заповнюють до верху так, щоб при закриванні під пробкою не
залишилися бульбашки повітря. Якщо підготовлена для визначення БСК проба
містить завислі речовини її перемішують перед кожним заповненням склянки. У
одній із склянок зразу ж після заповнення визначають вміст кисню. Час між
розведенням проби водою та визначенням кисню в ній не повинен перевищувати 15
хв.
Інші дві склянки ставлять до
термостату У такому стані при t 20°С склянки зберігаються у темноті протягом 1,
2, 3, 4, 5 чи більше діб. Потім у кожній із них визначають вміст розчинного
кисню.
П'ятидобове біохімічне споживання
кисню нерозведёними пробами, розведеними водою, або водою з домішуванням інших
речовин у мг/л (відповідно х, у, z), вираховують за наступними формулами:
х = а - в; у = (а-в) / R; z =
(а-в-cd) / R
де а - концентрація кисню у пробі до
експозиції склянок у термостаті (проба 1), мг/л;
в - концентрація кисню у пробі після
експозиції у термостаті (проба 1 та 2), мг/л.
с - біохімічне споживання кисню 1 мл добавки (БСК5 добавки у мг/л
помножена на 0,001);- об'єм добавки у 1л підготовленої проби, розведеної водою
з добавками.- розведення, тобто об'єм проби в літрі суміші проби і розведеної
води.
Таблиця 2.2 Значення БСК5 у водоймах з різним ступенем забруднення
|
Ступінь забруднення
|
БСК5, мгО2/л
|
|
Дуже чисті
|
0,5-1,0
|
|
Чисті
|
1,1-1,9
|
|
Помірно забруднені
|
2,0-2,9
|
|
Забруднені
|
3,0-3,9
|
|
Брудні
|
4,0-10,0
|
|
Дуже брудні
|
>10,0
|
Перманганатна і біхроматна
окислюваність. Скидання до річок стічних вод різного характеру та походження
приводить до збільшення у річковій воді концентрації різноманітних органічних
речовин. Також на різних ділянках річки може бути різна природна продуктивність
водойми, яка виражається у різній кількості автохтонної органічної речовини у
воді. Дія цих речовин, особливо забруднюючих, на біоту річок може бути як
позитивна, так і негативна. У зв'язку з цим бажано знати концентрацію
органічних речовин у воді для оцінки впливу можливої їхньої дії на водні
організми. Але, на жаль, визначити окремі складові органічного забруднення
звичайними доступними методами не має можливості. Тому у практиці
гідробіологічних досліджень частіше всього визначають загальний вміст
органічних речовин. Для цього використовують опосередковані методи, засновані
на характеристиці величин окислення води.
В залежності від використовуваного
окислювача розрізняють окислення перманганатне і біхроматне і інше. У
розрахунках отриману кількість кисню, що пішов у складі окислювача на окислення
органічної речовини, називається окисленням (окислюваність).
Біхроматне окислення. Найбільш повне
окислення досягається з допомогою біхромату і називається хімічне поглинання
кисню (ХПК). Цим методом окислюються більшість органічних речовин, зокрема і
нерозчинних, а також деякі неорганічні сполуки. Для більш повного окислення
органічної речовини у воді в якості каталізатора використовують сульфат срібла.
Після окислення надлишок біхромату відтитровують розчином солі Мора.
Для аналізу відбирають 20 мл води в
круглодонну колбу для кип'ятіння. В пробу додають 10 мл 0,25 норм розчину
біхромату калію, 0,4 г сульфату срібла, скляні кульки, або кусочок заліза.
Суміш перемішують і обережно доливаяють 30 мл концентрованої сірчаної кислоти.
Колбу закривають зворотним холодильником, або маленькою вороночкою і кип'ятять
протягом 2 годин. Після чого пробу охолоджують і додають 100 мл дистильованої
води. Суміш знову охолоджують, додають 2-3 каплі розчину фенолу, або 5 капель
розчину N-фенолфталеїнової кислоти і відтитровують залишок біхромату калію
сіллю Мора до зміни кольору. Паралельно проводять холостий дослід з 20 мл.
дистильованої води. Розрахунок біхроматного окислення виконують за формулою:
= ((а- в)К * 0,25 * 8 * 1000) / V =
(2000 (а- в) К) / V,
де а - об'єм розчину солі Мора, який
витрачений на титрування холостої проби в мл.
в - об'єм розчину солі Мора, який
витрачено на титрування проби води, мл.
К - коефіцієнт для приведення
концентрації розчину солі Мора до 0,25 н.- об'єм проби взятої для аналізу мл.
- еквівалент кисню.
Більш доступним методом визначення
біхроматної окислюваності є спрощений метод її визначення. Головна його
особливість - використання підвищення температури внаслідок екзотермічної
реакції води з концентрованою сірчаною кислотою. До 20 мл проби долити 2,5 мл,
0,25 норм розчину біхромату калію та 0,22 г сульфату ртуті і при перемішуванні
долити концентровану сірчану кислоту (7,5 мл на 1 мл проби, 15 мл на 5 мл
проби). При цьому температура піднімається вище 100°С Через 2 хв розчин
охолоджують до кімнатної температури. Добавляють 100 мл дистильованої води і
відтитровують надлишок біхромату калію як описано вище. Розрахунок проводять за
формулою приведеною раніше.
Перманганатне окислення ґрунтується
на використанні перманганату калію у сірчанокислому середовищі. Цим методом
визначаються переважно розчинні легко окислювані органічні речовини. Для
аналізу у конічну колбу відбирають 100 мл води (після 2-х годинного
відстоювання). В колбу поміщають кілька скляних кульок, додають 5 мл сірчаної
кислоти (розведення 1:3) і 20 мл 0,01н розчину перманганату калію. Суміш
нагрівають і кип'ятять 10 хв. На слабкому вогні. До гарячої суміші додають 20
мл 0,01н розчину щавелевої кислоти. Безколірний гарячий розчин титрують 0.01н
розчином перманганату калію до слаборожевого кольору.
Одночасно проводять холостий дослід
в такій же послідовності. Розрахунок окислюваності в мг/л О2 виконують за
формулою:
= [(а-в)* к * 0,01 * 8 * 1000] V =
[(а- в) * К * 80] / V
де а - об'єм 0,01н розчину
перманганату калію витраченого на титрування в мл;
в - об'єм 0,01 н розчину
перманганату калію витраченого на титрування холостої проби в мл;
К - поправочний коефіцієнт до
нормальності розчину перманганату калію;- об'єм проби, взятої для аналізу;
- еквівалент кисню.
Описані методи визначення окислюваності
води пов'язані із застосуванням стаціонарного лабораторного обладнання і в
польових умовах не завжди придатні для застосування.
Азот органічної речовини Для
характеристики органічної речовини також можна використати інші методи. В
основі одного з них лежить визначення азоту органічної речовини. У поверхневих
водах органічно зв'язаний азот з'являється як продукт біологічних процесів, або
надходить до них разом зі стічними водами комунальних сільськогосподарських та
промислових підприємств. Кількісний вміст азоту в таких стоках свідчить про
ступінь забруднення води в річці. З іншого боку вміст азоту органічної речовини
може характеризувати процеси самоочищення, що йдуть у річці.
Органічний азот у поверхневих
стокових водах визначають шляхом реєстрації аміаку після розпаду органічної
речовини проби шляхом її нагрівання з сірчаною кислотою в присутності
каталізатора (ртутної солі) цей метод дістав назву - метод Кьельдаля. Далі
відганяють аміак при рН 7,4. Кубовий залишок нагрівають разом з сумішшю сірчаної
кислоти і сульфату калію при 345-370°С. Зв'язаний азот переходить при
каталітичній дії сульфату ртуті в гідросульфат амонію. Далі аміак шляхом
відгонки переміщають в колбу з кислотою та визначають шляхом титрування або
колориметрично. Якщо органічний азот не визначають під час відбору проби, то її
консервують сірчаною кислотою, або 2-4 мл хлороформу на 1л проби. Результати
виражають в міліграмах азоту в 1л проби. Вміст органічного азоту визначають за
формулою:
х = с*0,78,
де с - концентрація в мг/л результату
титрування азоту.
Хід визначення загального вмісту
азоту: до колби Кьельдаля наливають 5 мл розбавленої сірчаної кислоти (1:3) і
близько 0,5 г порошку заліза. Суміш нагрівають на водяній бані до тих пір, поки
в колбі залишиться тільки незначна кількість заліза. Після охолодження
добавляють 50мл суміші (сірчана кислота сульфат калію і сульфат ртуті.
Розчиняють 134 г K2SO4 у 600 мл двічі дистильованої води (бідистилят) і
змішують з 200 мл концентрованої H2SO4 і потім додають розчин сульфату ртуті, виготовлений
шляхом розчинення 2 г окису ртуті (HgO) в 25 мл 20% розчину сірчаної кислоти. В
якості каталізатора можна використати і чисту ртуть. Після охолодження суміші
об'єм проби доводять до 1 л дистильованого водню) для мінералізації. Після
цього суміш кип'ятять на слабкому вогні. Мінералізація вважається закінченою
через 20-30 хв коли суміш просвітліє. Залишок в колбі розбавляють бідистилятом
приблизно до об'єму 300 мл. Додають кілька капель фенолфталеїну і нейтралізують
розчином для зміни рН до лужного (розчиняють 500 г NaOH і 25г Na2SО4 в
бідистильованій воді і доводять до об'єму 1л. З колби відганяють біля 200 мл
розчину у приймальник з кислотою.
Відміряють 50 мл проби добавляють до
неї 1-2 каплі розчину сегнетової солі і ретельно перемішують. Потім до проби
вносять 1 мл реактиву Неслера і знову перемішують. Далі на колориметрі
визначають оптичну густину розчину. Вміст NH4+ в мг/л за формулою:
х = (с * 50) / V,
де: с - знайдена концетрація NH4 в
мг/л; - об'єм проби взятої для аналізу в мл;
- об'єм проби в мл.
Визначення різних форм азоту у воді.
На практиці часто користуються простими та доступними методами визначення
вмісту у воді різних форм азоту, які, на жаль, дають тільки якісні показники.
Присутність у воді іонів амонію та
аміаку можна виявити шляхом додавання до проби води об'ємом 10 мл кількох
кристалів сегнетової солі і 0.5 мл реактиву Неслера. Жовтий колір розчину,
помутніння, або випадання жовтого осаду свідчить про присутність у воді аміаку.
У присутності підвищеної концентрації органічних речовин, особливо гумінових
кислот, які створюють коричневий колір, після підвищення рН необхідно провести
холостий дослід, добавивши сегнетову сіль і 0,5 мл 15% розчину їдкого натрію.
Останнім часом про нітрати все
частіше говорять як про забруднювачі і це справедливо стосовно їх підвищеного
вмісту. Наприклад, у питній воді. Але не треба забувати, що нітрати, як поживні
речовини, потрібні рослинам, які живуть у природних водоймах. Нижче
пропонується шкала відносної корисності-шкоди різних концентрацій нітратів у
воді.
* 0 мг/л- відсутність нітратів
доступних для рослин;
* 10 мг/л- низький рівень вмісту
нітратів у воді;
* 50 мг/л - стандарт європейської спілки
для питної води;
* 500 мг/л - надзвичайно високий
рівень вмісту нітратів.
Присутність у воді нітратів можна
визначити шляхом поміщення у пробірку 3-5 мл концентрованої сірчаної кислоти,
далі, постійно перемішуючи, по каплях додають 2 мл проби води. Після цього
додають незначну кількість твердого бруцину (обережно, сильна отрута) і суміш
знову перемішують. Жовтий, або коричнево-червоний колір, що з'явився свідчить
про наявність у воді нітратів. За інтенсивністю забарвлення можна орієнтуватися
у загальній концентрації нітратів. Чутливість реакції 1 мг і більше NО3 в 1л
води.
Для визначення наявності у воді
нітритів потрібно взяти 10 мл проби води, добавити 1 мл розчину сульфанілової
кислоти і 1 мл розчину а-нафтіламіну. При наявності нітритів з'являється
розовий або червоно-фіолетовий колір. Визначення можливе або чутливість методу
складає біля 0,01 мг нітритів в 1л води.
Для приготування розчину
а-нафтиламіну потрібно 1,2 г цієї речовини розчинити у дистильованій воді,
добавляти 50 мл льодяної (нерозведеної) оцтової кислоти і довести дистильованою
водою до об'єму 200 мл. Коли утворилась муть, розчин фільтрують через бавовняну
тканину промиту, дистильованою водою, отримаємо 0,6% розчин, який зберігається
2-3 місяці.
Визначення фосфору. Поверхневі води
іноді містять значну кількість фосфору, який надходить до них із грунту, різних
стічних вод, або з органічної маси рослин і тварин, що розпадаються. Останні
десятиліття значним джерелом забруднення річок фосфором стали пральні порошки.
Під терміном "загальний
фосфор" розуміють усі види фосфатів, які знаходяться у воді - у розчинній
і нерозчинній формі, неорганічні і органічні їх сполуки. У поверхневих водах
фосфор присутній переважно у формі неорганічних розчинних фосфатів. Для їх
визначення рекомендується використовувати колориметричний метод із
застосуванням молібдату і солі сурми, а комплексні сполуки, що утворюються,
відновлюють з допомогою аскорбінової кислоти. Реакцію проводять при кімнатній
температурі. При цьому поліфосфати не гідролізуються, а органічні фосфати не
розкладаються.
Усі види фосфору, в тому
числі і загальний, потрібно, по можливості, визначити безпосередньо після
відбору проби води. Біохімічні процеси в пробі можна призупинити додаванням до
проби 2-4 мл хлороформу на 1л води. Консервувати пробу кислотами не можна. Для
визначення розчинних ортофосфатів та поліфосфатів пробу на місці відбору
фільтрують через щільний паперовий фільтр. Результати визначення фосфатів та
поліфосфатів виражають в мг РО або в міліграм-еквівалентах
відповідної іншої форми на 1л води. Результати визначення загального фосфору
виражають в мг фосфат іонів (РО
або в міліграм-еквівалентах
відповідної іншої форми на 1л води. Результати визначення загального фосфору
виражають в мг фосфат іонів (РО ) на 1л води.
) на 1л води.
Для визначення
загального фосфору у воді проводять мокре спалювання проби води в присутності
сірчаної кислоти та перекису водню. При цьому усі види фосфатів у пробі
переводять у розчині неорганічні ортофосфати, які визначають в подальшому
молібдатом та аскорбіновою кислотою.
Для аналізу відміряють в
стакан чи іншу посудину з хімічно-стійкого скла 50 мл нефільтрованої, добре
перемішаної проби. До цієї проби додають 0,15 мл (3 каплі) перекису водню і
точно 1,0 мл 37% розчину сірчаної кислоти. Паралельно проводять холостий дослід
з 50 мл дистильованої води. Суміш нагрівають до 160° С, і випаровують протягом
6 год. Мінералізована проба повинна бути чистою і безколірною інакше потрібно
все повторяти. Після охолодження пробу доводять до об'єму 30 мл дистильованою
водою, деякий час кип'ятять, охолоджують і кількісно переносять в колбу, доводячи
об'єм до 50 мл. Після цього починають визначати ортофосфат іони. Для цього до
проби додають 2 мл розчину аскорбінової кислоти. Суміш перемішують. Далі
вимірюють оптичну густину в проміжку часу від 5 до 15 хв. Від знайденої
величини віднімають значення оптичної густини холостого досліду. Вміст
загального фосфору (X) в мг/л знаходять згідно формули:
- (с * 50) / V
де: с - концентрація РО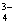 знайдена на калібровальній кривій, мг/г; - об'єм проби взятої для визначення
мл;
знайдена на калібровальній кривій, мг/г; - об'єм проби взятої для визначення
мл;
- об'єм проби, до якої
була розведена проба, мл.
Калібрувальна крива: В
ряд колб наливають 0; 1,0; 2,5; 5,0; 10,0; 25,0; 50,0; робочого стандартного
розчину, який виготовляють шляхом розчинення фосфату калію (КН2РО4) - 0,7165 в
дистильованій воді, добавляючи 2 мл хлороформу і доводячи об'єм дистильованою
водою до 1 л. 1 мл такого розчину містить 0,5 мг РО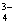 .
.
мл стандартного розчину
доводять дистильованою водою до об'єму 1 л. Цей розчин містить уже 0,05 мг РО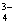 50 мл цього розчину доводять до об'єму 250 мл дистильованою водою і вміст РО
50 мл цього розчину доводять до об'єму 250 мл дистильованою водою і вміст РО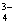 в ньому буде становити уже 0,01 мг/л РО
в ньому буде становити уже 0,01 мг/л РО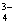
Об'єм розчинів в усіх
колбах доводять до 50 мл дистильованою водою. В одержаних розчинах,
концентрації, яких відповідають 0; 0,02; 0,05; 0,10; 0,20; 0,50; 1,00 РО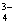 -
визначають оптичну густину і будують калібрувальну криву в координатах: оптична
щільність - концентрація фосфат іонів.
-
визначають оптичну густину і будують калібрувальну криву в координатах: оптична
щільність - концентрація фосфат іонів.
Визначення присутності у
воді іонів металів та інших речовин. Залізо постійно присутнє у поверхневих
водах. Концентрація його залежить від геологічної будови і гідрологічних умов
басейну річки. Високий вміст заліза у воді свідчить про її забруднення шахтними
або промисловими стічними водами, особливо водами металообробних підприємств,
протравлювальних цехів тощо. Надлишок вмісту заліза у воді іноді приводить до
зміни її споживчої якості. Тому слід час від часу слідкувати за вмістом заліза
у відповідних водних об'єктах. Для цього можна використати простий доступний
метод його визначення на місці відбору проб. В пробірку наливають 10 мл проби,
додають каплю концентрованої азотної кислоти декілька капель 5 % розчину
роданіду калію. При концентрації заліза біля 0,1 мг/г появляється рожеве
забарвлення розчину, а при більш високій концентрації - червоне.
Таким же доступним
способом можна визначити і вміст у воді марганцю: пробу об'ємом 10-50 мг
підкислюють декількома каплями 25% розчину азотної кислоти. Потім, по каплях,
добавляють 5% розчин нітрату срібла до тих пір, поки розчин помутніє. Після
цього добавляють біля 0,5 г персульфату амонію або калію і нагрівають до
кипіння. В присутності марганцю в кількості 0,1 мг/л і вище розчин
забарвлюється у блідо-рожевий колір.
Для визначення наявності
цинку у воді відбирають пробу об'ємом 50 мл., добавляють кілька капель
концентрованої соляної кислоти і, після переміщування, приблизно 20 мл
ацетатного буферного розчину - 3 мл розчину тіосульфату натрію (50 г Na2S2О3 *
5Н2О в 30 мл дистильованої води) і 3 мл розчину дістізону; суміш добре
перемішують. У присутності цинку колір органічного шару переходить у
фіолетовий, або червоний.
Для визначення
присутності в річковій воді сульфатів необхідно взяти близько 10 мл проби,
підкислити її кількома каплями соляної кислоти і додати 0,5 мл 10% розчину
хлориду барію. При концентрації у воді сульфатів 5-50 мг/л виникає
опалесценція, або слабке помутніння, при більш високій концентрації випадає
осад.
Якісно можна визначити
присутність у водах також фенольних сполук. Для цього до конічної колби об'ємом
200 мл наливають 100 мл проби, добавляють розчин хлорного вапна, або хлорну
воду у такому ж об'ємі, що було внесено 0,05 мг активного хлору. Через 10 хв.
визначають (спочатку на холоді, потім при нагріванні) наявність характерного
"аптечного запаху".
Часто приходиться мати
справу з забрудненням річкової води жировими компонентами стічних вод. Для
того, щоб бути впевненому, що існує саме таке забруднення потрібно взяти
невеликий кусочок камфори (або п-фенілендіаміну) величиною з рисове зерно і
внести на поверхню проби води. У присутності масел камфора залишається на тому
ж місці. При відсутності масел камфора швидко переміщується по поверхні води.
Отже, для визначення
придатності води для тих чи інших своїх потреб, суспільство користується
поняттям якість води. Це поняття вбирає в себе кількісну і якісну
характеристики хімічного складу та фізичних властивостей води.
Розділ 3. Дослідження
якості води в басейні річки Стир
.1 Загальна
характеристика басейну річки Стир
Річка Стир бере початок
із заболоченої балки на південно-східній окраїні с. Пониква Бродівського району
Львівської області, тече Малим Поліссям, Волинською височиною і Поліською
низовиною. Напрям течії річки з півдня на північ зумовлений загальним зниженням
у цьому напрямку висотних відміток. У верхній та середній течії звужені
трапецієвидні ділянки (0,2-0,5 км) чергуються з коритоподібними розширеними (до
3-5 км); у пониззі долина річки невиразна.
Заплава двохстороння (шириною
від 50-100 м у верхній частині до 1,5 - 2,0 км у пониззі), заболочена, із
численними старицями.
Загальна довжина річки
становить 494 км (у т. ч. в межах України - 445 км, в межах Волинської області
-235 км). Площа басейну - 12900 км2, в т.ч. вище м. Луцька - 7200 км. Загальне
падіння річки - 119,4 м (0,21 м/км), похил - 0,34 м/км, лісистість басейну - 22
%, заболоченість - 14%. Стир має понад 10 приток, із них основні: Слонівка,
Іква, Кормин, Стубла (праві); Липа. Чорногузка, Сірна, Річиця (ліві).
Русло звивисте, місцями
каналізоване, в нижній течії розгалужене. Ширина: у верхів'ї - 2-10 м; у
пониззі - 30-50 м. Глибина: на плесах - 2,0-3,5 м, на перекатах - 0,5-1,5 м.
Швидкість течії становить 0,2-0,5 м/с. Дно річки переважно рівне, на плесах -
мулисто-піщане; на окремих перекатах - нерівне, кам'янисте.
За гідрологічним режимом
р. Стир належить до східноєвропейського типу. Живлення річки мішане, із
переважанням снігового. Режим характеризується яскраво вираженою повінню та
досить тривалим меженним періодом. Весняний підйом рівня води припадає на першу
декаду березня і проходить інтенсивно. Найвищий рівень підйому становить
0,3-2,5 м у верхній течії та 1,5-2,3 м у нижній. Інтенсивність підйому води
становить 0,2-0,5 м/добу, але були й випадки з інтенсивністю до 1 м/добу.
Найвищий рівень води при високій повені досягає 3,8-4,5 м ум. (над умовним
рівнем водомірного посту Луцьк). Абсолютний максимум рівня води був відмічений
7-8 квітня 1932 р. (5,15 м). Найчастіше повінь має 1 пік, але якщо в цей час
відбувається чергове різке похолодання або значні опади, то може мати і 2 піки.
Загальна тривалість повені становить 50-90 днів. Тривалість меженного періоду
влітку становить 130-150 днів. Літня межень триває з травня до листопада, а
зимова - із грудня до лютого. Абсолютні мінімуми рівня води при літній межені -
0,27 м ум. (13 серпня 1963 p.), а взимку - 0,08 м ум. (13 грудня 1961 p.). Під
час межені на річці спостерігаються дощові паводки. Висота рівня води може
досягати на 2,0-2,6 м ум. Максимум відмічено 2 липня 1948 р. (4,24 м ум.).
Найвищі рівні паводків значно нижчі, ніж найвищі рівні весняної повені. Стир
починає замерзати на початку грудня з появою заберегів і "сала".
Льодостав установлюється приблизно 1 січня, хоча бувають роки, коли річка практично
не замерзає. В середині березня відбувається відкриття ріки від льоду. Спочатку
з'являються промоїни і закраїни. Льодохід триває 2-10 днів.
Стік води протягом року
розподілений нерівномірно. Найбільш багатоводною річка буває навесні. На весну
припадає 50-70% стоку; на літо - 10-15 %; на зиму 15-30 % річкового стоку.
Нерівномірність розподілу стоку визначається зональними факторами (кількість
опадів і випаровування), а також азональними факторами: характером грунтів та
рослинного покриву, геоморфологічною будовою басейну, впливом антропогенної
діяльності. Гідрологічні пости розташовані біля м. Луцька (з 1923 р.), с.
Полонного (з 1946 р.), с Млинок (з 1925 р.).
Мутність води в р. Стир
упродовж року неоднакова і залежить від інтенсивності ерозійних процесів.
Найпрозоріша вода взимку та під час літньо-осінньої межені. У цей час річка
живиться підземними водами. Коли до річки стікають талі та зливові води
-концентрація завислих речовин у річці різко підвищується, досягаючи максимуму
в момент найвищого підйому повені. Показники вмісту завислих речовин змінюються
в широких межах: від 12 до 150 г/м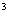 . За гідрохімічним
режимом р. Стир належить до західно-поліського типу.
. За гідрохімічним
режимом р. Стир належить до західно-поліського типу.
Формування хімічного
складу ґрунтових вод відбувається під впливом карбонатних порід. У живленні
річки беруть участь напірні води закарстованої товщі вапнякових та
мергельно-крейдових відкладів верхньо-крейдової та третинної системи. Це
обумовлює виражений гідрокарбонатно-кальцієвий склад вод та підвищену
мінералізацію в меженний період. Підвищені концентрації заліза, азоту
амонійного та органічних речовин пояснюються впливом болотних комплексів,
забрудненням річки стічними водами та змивом ґрунту.
Збільшення
антропогенного впливу (прямого чи опосередкованого) на басейні річки призводить
до трансформації природної системи в нову - природно-господарську. Це
виявляється, зокрема, у трансформації заплавних та терасних ландшафтів;
зниженні рівня води; зміні хімічних, мікробіологічних, органолептичних
властивостей води.
Найкрупнішою правою
притокою р. Стир у межах міста є р. Сапалаївка. Її довжина становить 12 км, а
площа басейну - 39,2 км2. Падіння річки - 2,25 м/км. Витрата води річкою
коливається в межах 0,04-0,4 м3/с. лтямївка бере початок на північно-східній
околиці с Струмівка Луцького району, Протікає північними околицями цього села
та через м. Луцька. Впадає в р. Стир на 302 км від її гирла в північно-західній
частині обласного центру, навпроти Луцької пристані. Долина у верхній течії
місцями заболочена, заплава шириною 100 м стелиться через горбисту місцевість.
Русло шириною до 2 м, слабозвивисте. Береги низькі, дно часто замулене. В
районі м. Луцька русло розчищене, в центральній частині міста каналізоване, в
межах Парку культури й відпочинку їм. 900-річчя Луцька - розширене й
перетворене на ставок. В районі Теремно на Сапалаївці споруджено 2 ставки.
Екологічний стан річки
погіршується внаслідок скиду неочищеного поверхневого стоку з міської
території. На сьогодні річка справляє гнітюче враження внаслідок погано
екологічного стану, хоча в минулому Сапалаївка була досить повноводою річкою,
лише в межах Луцька на ній стояло декілька
водних млинів. Будівля
одного з них збереглась на сьогодні. Там розміщується житловий будинок (справа
перед мостом через Сапалаївку по вул. Винниченка).
Найкрупніша ліва притока
р. Стар у межах околиць міста (район Вересневого) - р. Чорногузка. Довжина її
49 км, площа водозабору - 527 км2, падіння - 0,63 м/км. Чорногузка бере початок
із струмків в околицях с. Линів Локачинського району. Загальний напрям течії
річки - із заходу на схід. Впадає в р. Стир на 320 км від її гирла на схід від
с. Новостав Луцького району. Долина річки горбиста, місцями заболочена. Заплава
шириною до 0,7 км. Русло дуже меандруюче, шириною до 5 м, береги пологі низькі,
низькі. Територія її басейну інтенсивно антропогенно трансформована, густо
заселена, розорана, у верхній течії споруджено 6 ставків. Одна з основних
причин погіршення гідроекологічного стану річки в межах міста - скид
недостатньо очищених стічних вод Гнідавського цукрового заводу. Хоча власне
річка через територію самого м. Луцька і не протікає, але вищенаведена причина
погіршення екологічної ситуації річки зумовлена саме впливом урбоекосистеми
міста, зокрема, його промислових підприємств.
Інші притоки річки Стир
мають суттєво менші розміри. Їх довжина на перевищує 10 км, тому їх можна
віднести і до струмків. Омеляник має довжину близько 10 км, Жидувка - 4 км.
Витрата води становить відповідно 0,18 м3/с і 0,03 м3/с. Русло р. Омеляник у
межах міста перекрите греблями, побудовані ставки використовуються для
розведення риби. Гідрологічний режим цих річок суттєво спотворений інтенсивною
антропогенною діяльністю. Гідрологічні сезони виявлені суттєво слабше у зв'язку
із меншими розмірами, прибиранням снігу в межах міста, замуленням джерел в
межах русел рік, прискореними темпами добігання поверхневого стоку до русел рік
внаслідок перекриття території міста водонепроникними поверхнями (асфальт,
бетон). Замерзають річки на 3-4 дні раніше ніж р. Стир. а звільняються від
льоду - на 4-5 днів раніше. Жидувка на сьогодні повністю каналізована, реально
являє собою стічну канаву, куди скидаються неочищені поверхневі стоки з
промислових майданчиків ЛПЗ, завдяки яким річка й існує. В сильні морози
Жидувка повністю перемерзає, а влітку - пересихає.
В цілому поверхневі води
території для водозабезпечення міста практично не застосовуються. Це пов'язано
із їх низькою якістю й достатністю для водопостачання ресурсів підземних вод.
.2 Сучасний стан та
динаміка забруднення басейну річки Стир
Аналіз стану води р.
Стир вказує на необхідність створення заходів спрямованих проти замулення і
забруднення, серед яких головними є заборона розорювання земель на
ерозійно-небезпечних ділянках, збільшення лісистості водозбору, що найбільшою
мірою сприяє оптимальному стану води у річці.
При протіканні через
територію м. Луцька якість води р.Стир знижується внаслідок скиду неочищених
зливових, талих, поливо-миєчних вод і очищених стічних вод із міських
комунальних очисних споруд; р.Чорногузки - унаслідок скиду стічних вод з
очисних споруд Гнідавського цукрового заводу; р. Сапалаївки та р. Жидувки -
внаслідок скиду неочищених поверхневих стоків із території міста (у т.ч. і з
промислових майданчиків); р. Омеляника - унаслідок інтенсивного
рибогосподарського використання, а також скиду неочищених поверхневих стоків.
При скиданні забруднених
стічних вод у водний об'єкт, що характеризується турбулентним режимом,
відбувається процес розбавлення домішок, які на деякому віддаленні від місця
скиду виявляються рівномірно розподіленими по січенню потоку. Процес
турбулентної дифузії супроводжується фізико-хімічним знешкодженням, зокрема,
окисленням. В результаті розбавлення, аерації, біохімічних і фізичних процесів
проходить очищення потоків від забруднення. При повному самоочищенні в потоці
чи водоймі відновлюється природний хімічний (склад води і природні біохімічні
процеси).
В районі скиду стічних
вод за рахунок осадження зважених часточок, що містяться в стічних водах,
утворюється зона забруднення донних відкладів. Забруднені грунти в певних
умовах можуть служити джерелом вторинного забруднення водних мас. Інтенсивне
скаламучування грунтів, що супроводжується виносом забруднюючих речовин у
зваженому стані за межі зони забруднення, призводить до більш-менш значної
очистки дна. Такий процес накопичення й промивки може носити періодичний
характер і призводити до обмеження росту розмірів зони забруднення дна.
Зону забруднення р.Стир
унаслідок скиду очищених стічних вод із МКОС м.Луцька ми визначили як ділянку
річки з концентраціями забруднюючих речовин у воді, що перевищують ГДК для
водних об'єктів рибогосподарського використання. За нашими розрахунками, при
рівномірному розподілі забруднення по січенню потоку, зона забруднення
простягається на 21 км нижче по течії від м.Луцька. Зону впливу очищених
стічних вод із МКОС м.Луцька ми визначили як ділянку річки з концентраціями
забруднюючих речовин у воді, що не перевищують ГДК для водойм
рибогосподарського використання, але перевищують величину гідрохімічного фону.
Ця зона простягається ще на 6 км униз по течії р. Стир від зони забруднення.
При вході р. Стир у м.
Луцьк розміщується Дубнівський водозабір. Раніше він використовувався і для
господарсько-питного водопостачання міста, а зараз лише для забору води на
технічні потреби. В центральній частині міста (ПКіВ ім. Лесі Українки) на
березі р. Стир розміщується Центральний пляж. Тут вода річки використовується
для культурно-побутових потреб (купання, спорт, любительська риболовля і т.д.).
На виході з міста розміщується промисловий водозабір і місце скиду очищених
стічних вод із МКОС. Саме скид цих вод і спричинює найбільшу частину
забруднення річки. Так, зокрема, в 2007 році при дослідженні якості води р.
Стир вище і нижче МКОС нами встановлено перевищення концентрації забруднюючих речовин
в створі нижче місця випуску по: завислих речовинах в 2,5 раза, сульфатах на
38,5%, хлоридах на 12,5%, сухому залишку на 10%, БСК на 25%, амонію сольовому в
2,5 раза, нітратах в 2,1 раза, нітритах в 2,25 раза, фосфатах па 13.9%, залізу
на 4,6%, цинку на 36,4%; хрому (VI) на 33,3%, нафтопродуктах в 1,9 раза.
Зменшилась концентрація розчиненого кисню на 7,3%, залишились майже без змін
"концентрації міді, хрому загального, нікелю, рН, лужність.
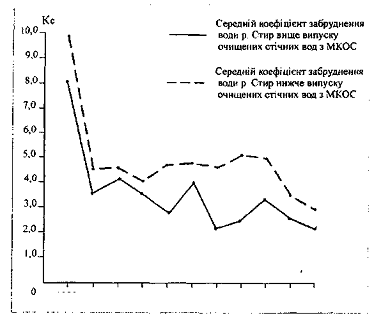
Рис. 3.1 Динаміка забруднення
води p. Cmup
Проведений аналіз
результатів аналітичного контролю якості води р. Стир 2001-2007 pp. в різних
пунктах створу свідчить, що за цей період якість води у р. Стир біля с. Мерва
Горохівського району значно погіршилась - уміст завислих речовин збільшився у
9,5 раза, нітратів у 9 разів, проте зменшився вміст сульфатів у 0,8, хлоридів -
у 0,9 раза. В районі м. Берестечко Горохівського району вміст завислих речовин
збільшився у 4 рази; сульфатів - у 1,2; хлоридів - у 1,6; нітратів - у 9,2 раза.
При виході р. Стир із Волинської області у с. Козлиничі Маневицького району
ситуація поліпшується - завислих речовин збільшилося лише у 1,9 раза, хлоридів
- у 1,04 раза; зменшився вміст сульфатів, нітратів, заліза. У створі Стиру -
вище випуску очисних споруд м. Луцьк - зростає вміст завислих речовин у 3,5
раза; нітратів у 3,5 раза, проте зменшується вміст сульфатів, хлоридів. У
створі р. Стир - нижче випуску очисних споруд м. Луцьк поліпшується якість води
за вмістом завислих речовин, сульфатів, нітратів, заліза, але тут збільшується
вміст нітратів. Аналізуючи ці результати якості води р. Стир, можна
стверджувати про значні зміни в таких показниках, як уміст завислих речовин та
вміст нітратів. Незважаючи на спад виробництва, відбувається забруднення водойм
стічними водами, де основними забруднювачами є об'єкти комунального
господарства, харчової промисловості, заклади охорони здоров'я. Крім того, р.
Стир при весняних та літніх повенях часто виходить із берегів, підтоплює і
заливає городи, пізніше з повеневими водами річки змиваються отрутохімікати,
гербіциди, що застосовувалися під час обробітку землі, з розораних земель
змиваються частини фунту і замулюють річку.
За даними Луцької
санепідемстанції проведена оцінка санітарно-хімічного стану води р. Стир на основі
порівняння результатів аналізів проб води 2007 з гранично допустимими
концентраціям забруднюючих речовин для рибогосподарських водойм.
Значним забруднювачем р.
Стир в межах Волинської області є Гнідавський цукровий завод, який скидає у
річку недостатньо очищені стічні води Крім точкових джерел забруднення, значна
кількість забруднюючих речовин надходить у річкову систему Стир із дифузних
(розсіяних) джерел - поверхневий стік із сільськогосподарських угідь, територій
підприємств, населених пунктів із ним у річку надходять завислі речовини,
пестициди, сполуки азоту, важкі метали і т. д. Об'єми цих стоків та кількість у
них забруднюючих речовин значно перевищують ті, що надходять із точкових
джерел. Із унесених на поля добрив у водні об'єкти виноситься 10-20 % азотних
сполук, 50-70% калійних і до 1% пестицидів.
Цікаво виглядає динаміка
забруднення води р.Стир упродовж кількох останніх років. Нами розраховано
значення середніх коефіцієнтів забруднення по основних забруднюючих речовинах
протягом трьох років.
Загальна тенденція -
зменшення забруднення річкової води, що відповідає зменшенню обсягів стічних
вод (особливо промислових). Має місце інерційність забруднення води. Вона
пояснюється наступними причинами:
. Окрім м. Луцька
негативний вплив на якість води чинять і інші населені пункти, що
використовують р. Стир для водозабезпечення промисловості і сільського
господарства (м. Берестечко, СМТ Рожище). СМТ Млинів Рівненської області, що
розміщується на р. Ікві, взагалі не має комунальних очисних споруд. Стічні води
Млинова забруднюють р.Ікву,а потім і р. Стир, куди Іква впадає південніше
м.Луцька.
. Навіть без стічних
вод, що надходять у р. Стир на сучасному етапі існують ще й речовини, які були
заакумульовані раніше в донних відкладах. При певних умовах (кислотність,
лужність, окисно-відновні умови, турбулентність) забруднюючі речовини, в т.ч. і
важкі метали, мають здатність мігрувати від донних відкладів у воду. Саме явище
деякого розвантаження забруднюючих речовин із донних відкладів у воду
характерно на сьогодні для р. Стир.
. Недосконале
функціонування МКОС. Зокрема, на початку 90-х років основна частина забруднення
припадала на промислові стоки, що після очистки на локальних очисних спорудах
усе одно містили важкі метали, СПАР і т.д. Зараз основна частина забруднення
припадає на амоній сольовий, нітрити, нафтопродукти. Є підозра на зміну
видового складу активного мулу.
Підсумовуючи, слід
відмітити, що хоч із середини 90-х років р. Стир дещо і очистилась, але її стан
усе ще далекий від екологічного оптимуму.
Не менш чітко
проявляється і тенденція до забруднення інших річок урбоекосистеми Луцька. Їх
екологічний стан різко погіршується при проходженні територією міста. Ці зміни
зручно оцінити інтегральним показником - середнім коефіцієнтом забруднення
(індексом забруднення). Так, зокрема, середній коефіцієнт забруднення (СКЗ)
води р. Сапалаївки в межах міста становить 2,87, зростаючи нижче скиду
неочищених стічних вод із колектора каналізації поверхневого стоку по вул.
Карпенка-Карого до 3,94. СКЗ води р. Чорногузка дещо менший - 1,21, але теж
суттєво зростає нижче скиду очищених стічних вод Гнідавського цукрового заводу
- до 1,76. Річки Жидувка і Омеляник у зв'язку з малими розмірами мають
стабільно високий СКЗ - відповідно 2,12 і 1,70.
Отже, практично весь басейн
річки Стир характеризується СКЗ у діапазоні 1,5-2,0. Максимальними значеннями
СКЗ виділяється територія південно-східного виробничого району.
Погіршення
бактеріального стану води р. Стир зумовлено поганим санітарним станом річки,
величезною кількістю смітників у заплаві річки, відсутністю санітарно-захисних
і водоохоронних зон.
Проблема забруднення
поверхневих вод для м. Луцька стоїть дійсно дуже гостро.
річка вода якість
забруднення
Висновки
У курсовій роботі ми
досліджували одну з актуальних проблем сучасності - еколого-гідрохімічний
аналіз стану басейну річки Стир. Вивчення та аналіз наукових джерел дали нам
змогу зробити наступні висновки.
Формування якості води у
річках забезпечується сукупністю гідрохімічних, бактеріологічних, гідрологічних
процесів, фізико-географічних і гідрометеорологічних особливостей регіону та
рівня антропогенного впливу на водозбір. Весь цей вплив проявляється через
процеси обміну речовин між різними середовищами.
В річці відбувається
постійна зміна як загальної концентрації розчинених речовин, так і
співвідношення між окремими з них. Також з течією відбувається переміщення
розчинених у воді мінеральних та органічних речовин, нерідко разом з
гідробіонтами. Уся ця рідка, тверда, розчинена і біологічна маса безперервно
зміщується по руслу, аж до гирла річки, іноді на цьому шляху частина
транспортованих речовин залишається у заплаві, переходить у підземні водоносні
горизонти і рухається по них, або виділяється при випаровуванні в атмосферу.
Річка Стир - правий
доплив р. Прип'яті, правого допливу р. Дніпра басейну Чорного моря. Її можна
назвати транскордонним об'єктом, оскільки вона бере початок на південно-східній
окраїні с. Пониква Бродівського району Львівської області, тече Малим Поліссям,
Волинською височиною і Поліською низовиною, на 8 км вище кордону з Білоруссю р.
Стир розгалужується на два рукави, якими впадає у р. Прип'ять.
Характерною ознакою
річки є добре виражений повеневий режим із різким коливанням стоку води та
наносів. Клімат визначає змішаний характер живлення дощовими, талими і
ґрунтовими водами. Живлення частково відбувається за рахунок напірних вод
закарстованої товщі вапнякових і мергельно-крейдових відкладів На це вказує
гідрокарбонатно-кальцієвий склад води та підвищена мінералізація. Нерівномірний
річний стік пояснюється зональними чинниками (кількістю опадів й
випаровування), а також азональними - антропогенним навантаженням,
геоморфологічною будовою басейну, характером ґрунтів, рослинним покривом.
Колір і мутність води в
р. Стир залежать від інтенсивності ерозійних-процесів, типу торфо-болотних
грунтів, забруднення річки стічними водами. Це зумовлює підвищення концентрації
заліза, азоту амонійного, хлоридів, нітратів, сульфатів, органічних речовин.
Під час літньо-осінньої межені та взимку, коли річка живиться підземними
водами, вода найпрозоріша. Підвищення концентрації забруднюючих речовин
спостерігається в період повені, коли до річки стікають талі і зливові води.
Проведений аналіз
результатів аналітичного контролю якості води р. Стир 2001-2007 pp. в різних
пунктах створу свідчить, що за цей період якість води у р. Стир біля с. Мерва
Горохівського району значно погіршилась - уміст завислих речовин збільшився у
9,5 раза, нітратів у 9 разів, проте зменшився вміст сульфатів у 0,8, хлоридів -
у 0,9 раза. В районі м. Берестечко Горохівського району вміст завислих речовин
збільшився у 4 рази; сульфатів - у 1,2; хлоридів - у 1,6; нітратів - у 9,2
раза. При виході р. Стир із Волинської області у с. Козлиничі Маневицького
району ситуація поліпшується - завислих речовин збільшилося лише у 1,9 раза,
хлоридів - у 1,04 раза; зменшився вміст сульфатів, нітратів, заліза. У створі
Стиру - вище випуску очисних споруд м. Луцьк - зростає вміст завислих речовин у
3,5 раза; нітратів у 3,5 раза, проте зменшується вміст сульфатів, хлоридів. У
створі р. Стир - нижче випуску очисних споруд м. Луцьк поліпшується якість води
за вмістом завислих речовин, сульфатів, нітратів, заліза, але тут збільшується
вміст нітратів. Аналізуючи ці результати якості води р. Стир, можна
стверджувати про значні зміни в таких показниках, як уміст завислих речовин та
вміст нітратів. Незважаючи на спад виробництва, відбувається забруднення водойм
стічними водами, де основними забруднювачами є об'єкти комунального
господарства, харчової промисловості, заклади охорони здоров'я. Крім того, р.
Стир при весняних та літніх повенях часто виходить із берегів, підтоплює і
заливає городи, пізніше з повеневими водами річки змиваються отрутохімікати,
гербіциди, що застосовувалися під час обробітку землі, з розораних земель
змиваються частини фунту і замулюють річку.
За даними Луцької
санепідемстанції проведена оцінка санітарно-хімічного стану води р. Стир на
основі порівняння результатів аналізів проб води 2007 з гранично допустимими
концентраціям забруднюючих речовин для рибогосподарських водойм.
Значним забруднювачем р.
Стир в межах Волинської області є Гнідавський цукровий завод, який скидає у
річку недостатньо очищені стічні води Крім точкових джерел забруднення, значна
кількість забруднюючих речовин надходить у річкову систему Стир із дифузних
(розсіяних) джерел - поверхневий стік із сільськогосподарських угідь, територій
підприємств, населених пунктів із ним у річку надходять завислі речовини,
пестициди, сполуки азоту, важкі метали і т. д. Об'єми цих стоків та кількість у
них забруднюючих речовин значно перевищують ті, що надходять із точкових
джерел. Із унесених на поля добрив у водні об'єкти виноситься 10-20 % азотних
сполук, 50-70% калійних і до 1% пестицидів.
Аналіз стану води р.
Стир вказує на необхідність створення заходів спрямованих проти замулення і
забруднення, серед яких головними є заборона розорювання земель на
ерозійно-небезпечних ділянках, збільшення лісистості водозбору, що найбільшою
мірою сприяє оптимальному стану води у річці.
Список використаної літератури
1. Білявський Г.О., Фурдуй Р.С. Практикум з загальної екології. -
К.: Либідь, 1997.
. Гей В., Козак В. Пограбоване Полісся // Вітчизна. - 1998. - № 4.
- С.11-113.
. Географічна енциклопедія України: В 3-х т./ Редкол.: О. М.
Маринич (відповід. ред.) та ін.- К.: «Українська Радянська Енциклопедія» ім. М.
П. Бажана, 1990.- Т. 2: З - О.- 480 с.
. Географічна енциклопедія України: В 3-х т. / Редкол.: О. М.
Ма-ринич (відповід. ред.) та ін.- К.: «Українська Радянська Енциклопедія» ім.
М. П. Бажана, 1993.- Т. 3: З - О.- 496 с.
. Гриб Й.В., Клименко М.О., Сондак В.В., Волкова Л.А. Відновна
гідроекологія порушених річкових та озерних екосистем (гідрохімія,
гідробілогія, гідрологія, управління) т. 2. - Рівне: Рівенський державний
технічний університет. 1999. - 198 с.
. Запольський А. К. Водопостачання, водовідведення та якість води:
Підручник. - К.: Вища шк., 2005. - 671 с.
. Збірник законодавчих актів України про охорону навколишнього
середовища: В 3 т. - Чернівці: Вид. журн. «Зелена Буковина», 1996.
. Збірник міжнародно-правових актів у сфері охорони довкілля. -
2-е вид., допов. - Львів: Торма, 2002. - 416 с.
. Злобін Ю.А. Основи екології. - К.: Лібра, 1998.
. Лук'янова Л.Б. Основи екології. - К.: Вища школа, 2000.
. Луцишин П.В. Єврорегіон "Буг". Обласний суспільно-географічний
комплекс: теорія, методика, практика. - К., 1996.
. Малі річки України: Довідник. - За ред. А.В.Яцика. К.: Урожай,
1991. - 294 с.
. Микитюк О.М., Злотін О.З., Грицайчук В.В., Маркіна Т.Ю. Основи
екології. - Харків: «ОВС», 2003.
. Міщенко О.В. Сучасний стан та динаміка забруднення річки Стир /
Науковий вісник ВДУ. - 2006. - № 2. - С. 321-325.
. Мольчак Я. О., Фесок В.О., Картава О.Ф. Луцьк: сучасний
екологічний стан та проблеми. - Луцьк: РВВ ЛДТУ, 2003. - 488 с.
. Сніжко С.І. Оцінка та прогнозування якості природних вод. -
Київ: "Ніка-Центр", 2001. - 264 с.
. Хімко Р.В. Досліджуємо малі річки (методичні вказівки). - Київ:
Інститут екології Національного екологічного центру України, 1997. - 68 с.
. Хімко Р.В., Мережко О.І., Бабко Р.В. Малі річки - дослідження,
охорона, відновлення. - К.: Інститут екології. - 2003. - 380 с.
Додаток 1
Оцінка екологічного стану річки
|
Екологічний стан річки
|
Основні показники за якими оцінюється екологічний стан річки.
|
|
Біологічні
|
Гідрохімічні
|
Гідрологічні
|
Структурні
|
|
Повнота структури
|
Наявність планктону, бентосу, мікрофлори, риб, вищих водяних
рослин
|
Розчинний О ,наявність
сірководню.Наявність течії, плесів, перекатів, ерозії берегів.Наявність
заплави, терас та лісових масивів на площі водозбору. ,наявність
сірководню.Наявність течії, плесів, перекатів, ерозії берегів.Наявність
заплави, терас та лісових масивів на площі водозбору.
|
|
|
|
Функціонування екосистеми
|
Структурні показники планктону, бентосу рибного населення,
наявність вищих водяних рослин та водних ссавців, птиці тощо.
|
Розчинний О ,рН,
електропровідність води, наявність нафтової чи жирової
плівки.Замуленість,прозорістьШирина заплави, наявність рослинності (ліс,
чагарники, трави). ,рН,
електропровідність води, наявність нафтової чи жирової
плівки.Замуленість,прозорістьШирина заплави, наявність рослинності (ліс,
чагарники, трави).
|
|
|
|
Забруднення органічними речовинами та мінеральними елементами
тощо
|
Наявність в планктоні великої кількості синьо-зелених водоростей
та занурених вищих водяних рослин, кишкова паличка
|
Розчинний кисень, деякі забруднення органічні забруднення, забруднення
ПАР, рН, електропровідність
|
Замуленість,прозорість
|
Розвиток трав'яного покриву (біомаси) в заплаві наявність боліт,
заболоченість
|
Додаток 2
Загальні критерії
еколого-гідробіологічної оцінки стану річки
|
екологічного стану
|
Основні індикатори показників екологічного стану річки
|
Доповнюючі індикатори показників екологічного стану річки
|
|
Природний стан функціонування екосистеми річки
|
Наявність повного структурного складу екосистеми басейну.
Різноманітність бентосних макрозооценозів
|
Різноманітність біоценозів планктону та бентосу, видове
різноманіття фітопланктону та вищої водяної рослинності
|
|
Забрудненість органічною речовиною
|
Вміст кисню, фекальні забруднення (наявність кишечної палички)
|
Органічна речовина (ХПК), БСК5, макрозообентос
|
|
Засолення
|
Електропровідність води
|
Основні іони, наявність іонів хлору
|
|
Забруднення біогенами
|
Вміст кисню, загальний азот, загальний фосфор, вміст у воді
хлорофілу А
|
Вміст амонійного азоту, нітрати, ортофосфати, безчерепашкові
водорості.
|
|
Підкислення
|
рН
|
Лужність, безчерепашкові водорості.
|
|
Забрудненість небезпечними речовинами
|
Наявність нафти, важких металів, кадмію, ртуті
|
Присутність пестицидів.
|
Додаток 3
Основні гідрологічні характеристики
р. Стир (в районі м. Луцька)
|
№ п/п
|
Характеристика
|
Одиниці вимірювання
|
Значення
|
|
1
|
Норма річного стоку (середня багаторічна витрата води)
|
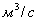 30,8 30,8
|
|
2 Максимальний стік весняної повені забезпеченістю
/ шар стоку 1% 5% 10% 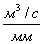
/115
/64,4
3 Максимальний стік дощового паводка / шар стоку
забезпеченістю 1% 5% 10% 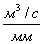
/70
/39
4 Мінімальний стік (мінімальна середньомісячна
витрата води) забезпеченістю: Холодний період / теплий період 80% 90% 95% 97%
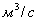
|
14,4/10,3 12,9/9,27 11,5/8,24 10,1/7,21
|
|
Додаток 4
Результати аналітичного контролю
якості води р. Стир
|
Назва водного об'єкту, пункт створу
|
Забруднююча речовина
|
|
назва інградієнта
|
концентрація мг/л
|
|
|
згідно з ГДК
|
фактично
|
|
18.06.2003
|
|
Дубнівський водозабір
|
Завислі речовини
|
10
|
64,8
|
|
Залізо
|
0,5
|
0,3
|
|
Хлориди
|
300
|
24,1
|
|
Нітрати
|
40
|
3,4
|
|
Сульфати
|
100
|
26,1
|
|
Центральний пляж
|
Завислі речовини
|
10
|
34,2
|
|
Залізо
|
0,5
|
0,28
|
|
Хлориди
|
300
|
22,1
|
|
Нітрати
|
40
|
3,6
|
|
Сульфати
|
100
|
25,8
|
|
10.05.2007
|
|
Дубнівський водозабір
|
Завислі речовини
|
10
|
16,2
|
|
Залізо
|
0,5
|
0,52
|
|
Хлориди
|
300
|
23,3
|
|
Нітрати
|
40
|
7,2
|
|
Сульфати
|
100
|
45
|
|
Центральний пляж
|
Завислі речовини
|
10
|
16,0
|
|
Залізо
|
0,5
|
0,49
|
|
Хлориди
|
300
|
20,8
|
|
Нітрати
|
40
|
6,9
|
|
Сульфати
|
100
|
31,1
|
|
|
|
|
|