|
Найменування і характеристика дезінфектанту
|
Переваги
|
Недоліки
|
|
Основні дезінфектанти
|
|
Хлор Застосовується в газоподібному вигляді, вимагає
дотримання найсуворіших заходів безпеки
|
• ефективний окислювач і дезінфектанти • ефективний
для видалення неприємного смаку і запахів • володіє післядією • запобігає
росту водоростей і біообрастань • руйнує органічні сполуки (феноли) • окисляє
залізо і магній • руйнує сульфід водню, ціаніди, аміак та інші сполуки азоту
|
• підвищені вимоги до перевезення і зберігання •
потенційний ризик здоров'ю в разі витоку • утворення побічних продуктів
дезінфекції - трігалометанів (ТГМ) • утворює бромати і броморганічні побічні
продукти дезінфекції у присутності бромідів
|
|
Гіпохлорит натріюЗастосовується в рідкому вигляді
(товарна концентрація розчинів - 10 -12%), можливе отримання на місці
застосування електрохімічним способом.
|
• ефективний проти більшості хвороботворних
мікроорганізмів • відносно безпечний при зберіганні та використанні • при
отриманні на місці не вимагає транспортування та зберігання небезпечних
хімікатів.
|
• неефективний проти цист (Giardia, Cryptosporidium)
• втрачає активність при тривалому зберіганні • потенційна небезпека
виділення газоподібного хлору при зберіганні • утворює побічні продукти
дезинфекціі, включаючи тригалометани, У тому числі бромоформ і бромати у
присутності бромідів • при отриманні на місці вимагає або негайного використання,
або, для забезпечення можливості зберігання, Спеціальних заходів з очищення
початкової води і солі від іонів важких металів • при зберіганні розчинів
NaClO з концентрацією активного хлору більше 450 мг / л і рН більше 9
відбувається накопичення хлорат
|
|
Діоксид хлоруОтримують тільки на місці застосування.
В даний час вважається найефективнішим дезінфектантів з хлорвмісних реагентів
для обробки води при підвищених рН.
|
• працює при низьких дозах • не утворює хлорамінів •
не сприяє утворенню тригалометанів • руйнує феноли - джерело неприємного
смаку і запаху • ефективний окислювач і дезінфектантів для всіх видів
мікроорганізмів, включаючи цисти (Giardia, Cryptosporidium) і вірусів • не
утворює броматов і броморганіческіх побічних продуктів дезінфекції у присутності
бромідів • сприяє видаленню з води заліза і магнію шляхом їх швидкого
окислення і осадження оксидів
|
• обов'язково отримання на місці застосування •
вимагає перевезення і зберігання легкозаймистих вихідних речовин • утворює
хлорат і хлорити • в поєднанні з деякими матеріалами і речовинами призводить
до прояву специфічного запаху і смаку
|
|
ХлорамінУтворюється при взаємодії аміаку з сполуками
активного хлору, використовується як дезінфектанти пролонгованої дії
|
• володіє стійким і довготривалим післядією • сприяє
видаленню неприємного смаку і запаху • знижує рівень освіти тригалометанів та
інших хлорорганічних побічних продуктів дезінфекції • запобігає утворенню
біообрастань в системах розподілу
|
• слабкий дезінфектанти і окислювач в порівнянні з
хлором • неефективний проти вірусів і цист (Giardia, Cryptosporidium) • для
дезінфекції потрібні високі дозування і пролонговане час контакту • становить
небезпеку для хворих, що користуються діалізаторів, так як здатний проникати
крізь мембрану діалізаторів та вражати еритроцити • утворює азотовмісні
побічні продукти
|
|
Альтернативні дезінфектанти
|
|
ОзонВикористовується протягом декількох десятків
років у деяких європейських країнах для дезінфекції, видалення кольору,
поліпшення смаку і усунення запаху
|
• сильний дезінфектанти і окислювач • дуже
ефективний проти вірусів • найбільш ефективний проти Giardia,
Cryptosporidium, а також будь-якої іншої патогенної мікрофлори • сприяє
видаленню каламутності з води • видаляє сторонні присмаки і запахи • не
утворює хлорвмісних тригалометанів
|
• утворює побічні продукти, що включають: альдегіди,
кетони, органічні кислоти, бромвміщуючі тригалометани (включаючи бромоформ),
бромати (у присутності бромідів), пероксиди, бромуксусну кислоту •
необхідність використання біологічно активних фільтрів для видалення
утворюються побічних продуктів • не забезпечує остаточного дезінфікуючої дії
• вимагає високих початкових витрат на устаткування • значні витрати на
навчання операторів і обслуговування установок • озон, реагуючи зі складними
органічними сполуками, розщеплює їх на фрагменти, що є живильним середовищем
для мікроорганізмів в системах розподілу води
|
|
УльтрафіолетПроцес полягає в опроміненні води
ультрафіолетом, здатним вбивати різні типи мікроорганізмів
|
• не вимагає зберігання та транспортування хімікатів
• не утворює побічних продуктів • ефективний проти цист (Giardia,
Cryptosporidium)
|
• немає остаточного дії • вимагає великих витрат на
обладнання і технічне обслуговування • вимагає високих операційних
(енергетичних) витрат • дезінфікуюча активність залежить від каламутності
води, її жорсткості (утворення відкладень на поверхні лампи), осадження
органічних забруднень на поверхні лампи, А також коливань в електричній
мережі, що впливають на зміну довжини хвилі. • відсутня можливість оперативного
контролю ефективності знезараження води
|
1.2 Теоретичні основи процесу
знезаражування води
1.2.1 Обробка води хлором
Хлор - це важка (майже в 2,5 рази важчий за повітря)
зеленувато-жовтий газ, що володіє гострим задушливим запахом і високою отруйні
для всього живого - від ледь помітних під мікроскопом бактерій до найбільших
тварин.
Отруйність газу, названого за свій колір хлором (від
грецького слова "хлорос" - зеленувато-жовтий), пояснюється його
великою хімічною активністю. Він легко вступає в з'єднання майже з усіма
хімічними елементами, у тому числі з багатьма металами (натрієм, калієм, міддю,
оловом і ін.). При хімічній взаємодії хлору з іншими елементами виділяється
велика кількість тепла і світла. Віднімаючи водень від води, що входить до складу
кожної клітини рослинних і тварин організмів, хлор тим самим руйнує структуру
їх, що тягне за собою загибель усього живого.
З розвитком техніки області застосування хлору все більше і
більше розширювалися. Крім знезараження води він застосовувався при виготовленні
численних хімічних сполук у аніліновому-барвистою і фармацевтичної
промисловості, у виробництві соляної кислоти, хлорного вапна, гіпохлоритом і т.
д. Великі кількості хлору використовуються для відбілювання тканин і целюлози в
паперової та текстильної промисловості. У кольоровій металургії хлоруванням
отримують деякі метали з руд. У хімії високомолекулярних сполук хлор
використовується при виготовленні пластичних мас, синтетичних волокон, каучуку
і т. д. Цікавою властивістю володіє одне з кисневих сполук хлору з магнієм
(хлорат магнію). При дії цієї речовини на бавовник останній втрачає листя. Це
використовується при зборі бавовни. Речовин з подібною дією отримано вже
багато. Вони називаються дефоліантів.
.2.2 Недоліки хлору як реагенту для знезараження води
Більш ніж віковий досвід використання методу знезаражування
води хлором, що завозяться на очищення стічних вод в зрідженому вигляді,
дозволив виявити окремі недоліки цього методу:
Хлор є сильно діючим отруйною речовиною, тому очисні станції,
що використовують хлор для знезараження, є об'єктами підвищеної небезпеки.
Необходімость точного дозування хлору. Недостатня доза хлору
може призвести до того, що він не зробить необхідного бактерицидної дії; зайва
доза хлору погіршує смакові якості води. 2.2.3.Необходімость забезпечення
доброго змішування хлору з водою і достатньої тривалості їх контакту (не менше
30 хвилин) їх контакту.
Можливість витоку хлору при використанні напірних хлоратори.
Зважаючи на отруйності хлору витік його становить небезпеку для обслуговуючого
персоналу.
Необходімость зберігання великого запасу хлору на станціях.
Тому що з одного балона (при кімнатній температурі) може бути отримано лише
близько 0,5-0,7 кг хлору на годину, то при великому загальну витрату хлору може
виникнути необхідність одночасного використання значної кількості балонів.
Дотримання
особливих правил при влаштуванні хлораторних установок. При проектуванні та
експлуатації хлораторних установок треба враховувати вимоги, спрямовані на
запобігання обслуговуючого персоналу очисної станції від шкідливої дії хлору.
Найбільш істотним з перерахованих недоліків є здатність хлору
у випадку його витоку вражати не тільки обслуговуючий персонал, але й населення
прилеглої до водоочисної станції території. Ця його здатність обумовлена
летючість і отруйними властивостями хлору.
Одним з недоліків хлорування води є утворення побічних
продуктів - галогенвміщуючих сполук (ГСС), більшу частину яких становлять
тригалометани (ТГМ): хлороформ, діхлорбромметан, дібромхлорметан і бромоформ.
Освіта трігалометанов обумовлено взаємодією сполук активного хлору з
органічними речовинами природного походження.
Заводи постачають хлор у балонах масою до 100 кг і в
контейнерах масою до 3000 кг, а також в залізничних цистернах місткістю 48 т.
Розчинність хлору у воді збільшується з пониженням температури і підвищенням
тиску; при атмосферному тиску і температурі 20 ° С розчинність С12 становить
7,29 г / л. При низькій температурі і високому тиску (-34,6 ° С при
атмосферному тиску або 0,575 МПа при 15 ° С) хлор зріджується. Для запобігання
випаровування рідкий хлор зберігається під тиском 0.6 ... 0.8 МПа з балонах або
в бочках (контейнерах).
При добавці у воду хлору відбувається його гідроліз
Cl2 + H2O HClO + HCl
Частина хлорнуватисту кислоти НСlO дисоціюють з утворенням
гіпохлорітного іона OCl.
За наявності у воді аміаку утворюються моно-і діхлораміни:
+ NH3 NH2Cl + H2O+
NH2Cl NHCl2 + H2O
Основними знезаражувальним речовинами є Сl2, НСlO,
NaOCl, NH2С1 і NHCl2,
їх називають активним хлором. При цьому Cl2, HClO і NaOCl утворюють вільний хлор, хлорамін
і діхлорамін - пов'язаний хлор. Бактерицидність хлору більше при малих
значеннях рН , тому воду хлорують до введення подщелачівающіх реагентів.
Необхідна доза хлору визначається на основі експериментально
побудованої кривої хлоропоглинаємості води. Оптимальною вважається доза, яка
при заданому часу контакту забезпечить у воді необхідну концентрацію
залишкового хлору - для господарсько-питних вод 0,3 ... 0,5 мг / л вільного
хлору при часі контакту 30 хв. або 0,8 ... 1,2 мг / л пов'язаного хлору при
часі контакту 60 хв.
При відсутності даних технологічних досліджень дозу хлору
беруть для знезараження поверхневих вод 2 ... 3 мг / л, для підземних 0,7 ...
1,0 мг / л.
Хлорування рідким хлором є найбільш широко застосовуваним
методом знезаражування води на середніх і великих водоочисних станціях.
Зважаючи на малій розчинності рідкого хлору вступник реагент
попередньо випаровується. Потім хлор-газ розчиняють у малій кількості води, що
отримується, хлорну воду перемішують з оброблюваної водою. Дозування хлору
відбувається у фазі газоподібного речовини, що відповідають газодозатори
називаються хлоратори. На практиці застосовують як напірні, так і вакуумні
хлоратори. СНиП 2.04.02-84 вимагає використання останніх, тому що при вакуумних
хлоратори менше небезпека потрапляння хлор-газу в повітря приміщень. Є
хлоратори пропорційного і постійного витрат, а також автоматичні хлоратори, що
підтримують у воді задану концентрацію залишкового хлору.
Найбільш широко використовують вакуумні хлоратори постійної
витрати ЛОНІІ-100 продуктивністю до 85 кг / год. С12.
Для випаровування хлору балон або контейнер встановлюють на
ваги і відкривають вентиль. Обсяг хлор-газу з одного балона при кімнатній
температурі складе 0,5 ... 0,7 кг / год., з одного контейнера - 3 кг / год. на
1 м2 його поверхні. Знімання хлору можна значно збільшити підігрівом балонів
теплою водою або повітрям. Тому на великих станціях використовують спеціальні
випаровувачі хлору у вигляді боксу, куди встановлюють балон або контейнер і
подається тепла вода або підігрітий повітря.
Хлор-газ надходить в проміжний балон, де затримуються краплі
води та інші домішки. Більш повне очищення газу відбувається в фільтрі, який
заповнений скловатою, замоченою в сірчаної кислоти. Редуктор забезпечує
постійний тиск в системі; вимірювальний пристрій у вигляді діафрагми і ротаметр
забезпечує контроль і регулювання кількості, що подається хлору. Продуктивність
хлоратори залежить від застосовуваного ротаметр: при РС-3 до 10 кг / год., при
РТ-5 до 20 кг / год. і при РС-7 до 85 кг / год. Приготування хлорного води
відбувається у змішувачі. Необхідний вакуум створюється ежектором, за допомогою
якого хлорне вода подається в оброблювану воду. Включення в схему регулювання
аналізатора залишкового хлору можна автоматично підтримувати задану
концентрацію хлору в очищеної воді в умовах зміни властивостей води, що
поступає.
Хлорне господарство водоочисної станції розташовується в
окремому будинку, де зблокований склад хлору, випарних н хлораторних.
Витратні склад хлору відокремлений від інших приміщень глухою
стіною без отворів. Склад може знаходитися і в самостійному будинку. У такому
випадку там зазвичай мають у своєму розпорядженні також випарну, причому
хлораторних знаходиться в основному блоці водоочисних споруд. Ємність
витратного складу хлору не повинна перевищувати 100 т. Рідкий хлор зберігається
на складі в балонах або контейнерах, при добовому витрату хлору понад 1 т - в
танках місткістю до 50 т з поставкою хлору в залізничних цистернах.
Склад розміщують в наземній або полузаглибленій будівлі з
двома виходами з протилежних сторін будинку. У приміщенні складу необхідно мати
ємність з сульфітом, що нейтралізує, розчином натрію для швидкого занурення
аварійних контейнерів або балонів.
Якщо трубопровід хлор-газу розташований поза будівлею, на
виході з випарника потрібна установка вакуумного клапана, що виключає
можливість конденсації газу при низькій температурі навколишнього повітря.
Трубопроводи рідкого і газоподібного хлору виготовляють з сталевих безшовних
труб діаметром до 80 мм, розрахованих на робочий тиск 1,6 МПа. Для приміщення
хлоропровід розміщують по стінах або естакадам на кронштейнах, поза будинком -
на естакадах, передбачаючи захист трубопроводу від сонячних променів.
У хлораторних встановлюють дозатори хлору з необхідною
арматурою і трубопроводами. Хлораторні (хлордозаторні) можуть перебувати в
основному корпусі станції або в будівлі хлорного господарства. Приміщення
хлораторної повинно бути відокремлене від інших приміщень глухою стіною без
отворів і мати два виходи, причому один з них через тамбур. Всі двері мають
відкриватися назовні, в приміщенні повинна бути примусова витяжна вентиляція.
Трубопроводи хлорного води виконуються з корозієстійких
матеріалів. У приміщенні трубопровід встановлюють у каналах в валу або на
кронштейнах, поза будівлею - в підземних каналах або футлярах з корозієстійких
труб.
Хлорування води порошкоподібними містять хлор реагентами та
діоксином хлору.
На малих станціях і водоочисних установках часто доцільно відмовитися
від використання рідкого хлору і застосовувати тверді, порошкоподібні речовини
- хлорне вапно і гіпохлорит кальцію. Ці речовини менш небезпечні у зверненні,
процес їх підготовки та подання значно простіше - практично аналогічний
застосуванню коагулянту.
Хлорне вапно одержують при обробці сухий, негашене звести
хлором. При контакті з повітрям і вологою хлорне вапно поступово розкладається
СаС12О+СО2+Н2О СаСО3+СаС12+2НС1О
тому реагент необхідно зберігати в сухому, вентильованому
приміщенні в закритій тарі.
Гіпохлорит кальцію утворюється при насиченні вапняного молока
хлором
2Са(ОН)2+2С12 Са(С1О)2+СаС12+2Н2О
Товарний продукт СаСl2O або Са(С1O)2
розчиняють в розчинної баку з механічним перемішуванням. Кількість баків не
менше двох. Потім розчин розбавляють у видатковому баку до концентрації 0,5 ...
1 і подають у воду дозаторами розчинів і суспензії.
З огляду на корозійну активність розчину, баки слід
виготовляти з дерева, пластмаси або залізобетону, з корозієстійких матеріалів
(поліетилен або вініпласт) повинні бути також трубопроводи і арматура.
Діоксид хлору отримують безпосередньо на водоочисної станції
хлоруванням хлориту натрію
СlONa: 2NaClO2 + Сl2 2С1O2+2NаСl
Замість хлору можна для отримання ClO2 також використовувати
озон або соляну кислоту
NаС1O2 + O3 + Н2O →
2С1O2 + 2NаОН+O2;
NaС1O2+4НСl → 4С1O2 + 5NаСl+ 2Н2O.
СlO2
є отруйним, вибухонебезпечним газом з інтенсивним запахом, водний розчин його
практично безпечний. У порівнянні з Cl2 двоокис хлору має ряд
переваг - вища бактерицидність у лужному середовищі, більш активно окисляє
органічні речовини, може розкладати феноли, не надаючи при цьому воді
хлорфенольного запаху, наявність у воді аміаку не знижує ефективності ClO2.
.2.3 Хлорування води гіпохлоритом натрію
На водоочисних станціях, де добова витрата хлору не перевищує
50 кг, де транспортування, зберігання і підготовка токсичного хлору пов'язані з
труднощами, що можна для хлорування води використовувати гіпохлорит натрію
NаСlO. Даний реагент отримують на станціях в процесі електролізу розчину
кухонної солі. Електролізна установка складається з бака концентрованого
розчину солі (розчинної бака), електролізною ванни (електролізера),
бака-накопичувача розчину гіпохлориту, випрямляча і блоку управління.
Розчинних баків повинно бути не менше двох, їх сумарний обсяг
повинен забезпечити безперебійну роботу установки протягом 24 год. При мокрому
зберіганні солі обсяг розчинних баків приймається з розрахунку 1,5 м3 на 1 т
солі. Допускається зберігання солі на складі в сухому вигляді, причому товщина
шару солі не повинна перевищувати 2 м.
У розчинної баку виготовляється розчин, близьке до насиченого
-200 ... 310 г /л. Для перемішування застосовують механічні пристрої н
циркуляційні насоси.
Електролізери можуть бути проточного або непротічних типу.
Найбільш широко використовують останні. Вони являють собою ванну з встановленим
там пакетом пластинчастих електродів. Електроди, як правило графіт, приєднують
до мережі постійного струму.
У електролізною ванні відбувається дисоціація солі, a також
води. При включенні електролізера в мережу на аноді відбуватиметься окислення
хлоридів 2Сl- 2e Cl2 , потім їх гідроліз Сl2 + Н2O
НС1O+НC1. На катоді виділяється газ Н2, утворюється їдкий натр. У
результаті реакції NаОН з НСlO утворюється гіпохлорит.
У міжелектродному просторі електролізера непротічних типу
щільність електроліту в результаті його насичення бульбашками газу буде менше,
ніж в іншому обсязі ванни, тому буде відбуватися циркуляція розчину - між
електродами висхідне, в решті ванні спадний протягом електроліту. Циркуляція
триватиме до повного електролізу всього розчину кухонної солі. Потім
електролізна ванна спорожняється і заповнюється новою порцією розчину NaCl.
При роботі електролізера необхідно звести до мінімуму розпад
утвореного NaClO. Для цього слід процес електролізу проводити при низькій
температурі і великої щільності струму на аноді, утримуючись від перемішування
електроліту у ванні.
В Україні виготовляються електролізери непротічних типу марки
ЕВ. На станції необхідно мати не менше трьох електролізерів, які встановлюють у
сухому опалювальному приміщенні. У електролізною ванні повинні бути
трубопроводи для водяного охолодження, над електролізером встановлюють зонт
витяжної вентиляції.
Концентрація робочого розчину солі в електролізною ванні
приймається 100 ...120 г / л, висотне розташування електролізера має
забезпечити надходження розчину NаСlO в бак-накопичувач самопливом.
Бак-накопичувач розміщують у вентильованому приміщення, дозування розчину
гіпохлориту у воду відбувається ежектором, насос-дозатором або іншим пристроєм
для подачі розчинів і суспензій.
.2.4 Хлорування
води прямим електролізом
Для електролітичного виготовлення бактерицидної хлору можна
використовувати хлоридні іони, які є в самій природній воді. Метод називається
прямим електролізом, розроблена відповідна установка "Потік".
Застосування установки можливо при вмісті у воді хлоридів не менше 20 мг / л н
загальної жорсткості не більше 7 мг-екв / л.
Установка "Потік" складається з вертикального
електролізера, який на фланцях приєднується до трубопроводу оброблюваної води.
Рух води - знизу вгору. Крім того є блок живлення і замкнута система кислоти,
призначена для змиву з електродів карбонатної плівки. У систему входять бак і
кислотостійкий насос. Розміри електролізера 940х815х1590 мм, тиск у робочій
камері - не більше 0,5 МПа, номінальна потужність 7,6 кВт-ч, продуктивність 15
... 150 м3 / ч.
Основною проблемою є утворення карбонатної плівки на поверхні
електродів, що значно знижує термін стабільної безперервної роботи установки.
Для змиву плівки застосовується 3%-ий розчин НCI.
Якщо жорсткість оброблюваної води не більше 3 ... 4 мг-екв /
л, рекомендується направляти всю воду через електролізер; при жорсткості 10
...12 Мг-екв / л - 10 ... 12 води, яка потім перемішується з іншим
потоком.
.2.5 Перехлорування і дехлорування, з амонізацією
Хлорування води з підвищеними дозами перед очисними спорудами
називають перехлоруванням. Метод застосовується в умовах, коли мікробіологічні
властивості води швидко і у великих межах змінюються, а також при високій
кольоровості природної води, великому вмісті в воді органічних речовин і
планктону. Перехлорування використовують в системах технічного водопостачання
як засіб проти утворення біологічної плівки. Доцільність застосування пере хлорування
в системах господарсько-питного водопостачання необхідно вирішити на основі
технологічних досліджень та аналізів. При цьому треба особливо брати до уваги
можливість утворення хлорорганічних з'єднань (тригалогенметанів). Це результат
хлорування води, що містить багато органічних речовин. Тригалогенметани
(хлороформ та інші сполуки) - канцерогенні речовини, вміст яких у питній воді в
багатьох країнах нормується стандартом. Зокрема, Всесвітня асоціація охорони
здоров'я рекомендує норму 30 мг / л. Для запобігання утворення хлорорганічних
речовин при підготовці господарсько-питних вод рекомендується відмовитися від
введення хлору до очисних споруд (первинне хлорування), замінити С12
на ClO2 або О3, використовувати окислювачі в комбінації c
сорбентами. Наприклад, за схемою: О3 - активний вугілля - вторинне
хлорування.
Для забезпечення необхідного вмісту у воді залишкового хлору
після перехлорування, а також в інших випадках необхідно воду дехлорувати. З
цією метою застосовують фізичні та хімічні способи.
При фізичних способах надлишок активного хлору виділяється з
води сорбентами або аерацією. Використовують вугільні фільтри з товщиною шару
вугілля 2,5 м при швидкості фільтрування 20 ... 25 м / ч. Аерація дає позитивні
результати при рН <5 і невеликій кількості що видаляється хлору. Оскільки
багато сполук хлору не зникають, ефективність аерації низка.
При хімічному дехлорування надлишковий активний хлор
зв'язується з сульфітів натрію або двоокисом сірки.
Як відомо, хлораміни в порівнянні з молекулярною хлором органолептично
менш відчутні, їх дію більш довготривале, за наявності у воді фенолів вони не
утворюють хлорфенольних запахів. З цією метою іноді доцільно хлорували з
амонізацією, тобто подати у воду додатково до хлору аміак. Технологія
амонізації води аналогічна хлоруванню рідким хлором. Аміак також прибуває на
станцію в балонах в зрідженому вигляді. При реакції NH3 з
хлорнуватисту кислотою у воді утворюються моно - і дихлораміни. Слід врахувати,
що добавкою аміаку можна заощадити до 60 хлору, витраченого для
знезараження. . NH3 и Cl2 перемішуються в пропорції 1:4
... 1:10.
Якщо мета амонізації - запобігання освіти хлорфенольного
запаху, аміак додається у воду за 2 ... 3 хв. до введення хлору
(переамонізація), якщо мета - зниження інтенсивності хлорного запаху і
присмаку, а також продовження бактерицидної дії хлору, то аміак додається після
хлорування (постамонізація).
Електрохімічні методи знезараження природних та стічних вод
знаходять все більш широке застосування в технології водопідготовки як у нас в
країні, так і за кордоном. В даний час найбільш перспективним методом є метод
знезараження води з використанням електролітичного гіпохлориту натрію,
одержуваного на місці споживання шляхом електролізу розчинів хлоридів.
Зберігаючи всі переваги методу хлорування із застосуванням рідкого хлору, метод
знезараження електролітичним дозволяє уникнути основних труднощів, таких як
транспортування і зберігання токсичного газу. Гіпохлорит натрію застосовується
для обробки побутових і промислових вод, для руйнування тваринних і рослинних
мікроорганізмів, усунення запахів (особливо утворюються з сірковмісних
речовин), знешкодження промислових стоків, наприклад, від ціанистих з'єднань.
Аналіз результатів показує, що при знезараження води прямим
електролізом, так само як і при хлоруванні, основним критерієм бактеріальної
надійності є величина залишкового хлору і для повного взаємодії продуктів
електролізу з водою потрібен час контакту не менше 30 хв. Отже, незалежно від
вихідної зараженості і якості води режимні параметри необхідно підбирати таким
чином, щоб величина залишкового хлору на виході з електролізера відповідала
вимогам санітарних органів. За коливань величини залишкового хлору можна
оцінювати ефективність роботи установки і регулювати струмів навантаження.
В даний час гранично допустимі концентрації для речовин, що є
побічними продуктами хлорування, встановлені в різних розвинених країнах в
межах від 0,06 до 0,2 мг / л і відповідають сучасним науковим уявленням про
ступінь їх небезпеки для здоров'я. Наукова дискусія про здатність цих речовин
викликати рак і виявляти мутагенну активність, що тривала в США протягом
багатьох років, завершилася визнанням їхньої безпеки у вказаному вище діапазоні
концентрацій.
Однак, безумовно, зменшення концентрації побічних продуктів хлорування,
точно так само, як і побічних продуктів озонування, що становлять набагато
більшу небезпеку, ніж побічні продукти хлорування, є однією з основних причин
пошуку нових технологій і засобів знезараження питної води. У таблиці 1
наведені відомості про переваги і недоліки відомих основних і альтернативних
методів і технологій знезараження води.
.3 Порівняльна характеристика електродних матеріалів
1.3.1Загальні відомості про процес електролітичного одержання гіпохлориту натрію
При електролізі на електродах при пропущенні електричного
струму через розчини або розплави електролітів протікають окислювально-відновні
реакції.
Електрохімічний спосіб отримання гіпохлориту натрію (NaClO)
заснований на отриманні хлору шляхом електролізу водного розчину хлориду натрію
(NaCl) і його взаємодії з лугом в одному і тому ж апараті - електролізері.
У даному випадку, коли в якості електроліту використовується
розчин кухонної солі, сутність процесу полягає в наступному:
На аноді йде розряд іонів хлору (процес окислення):
Cl-= Cl2 + 2e -
Виділяється хлор розчиняється в електроліті (NaCl) з
утворенням хлорнуватисту і соляної кислот:
Cl2 + H2O = HClO +HCl
На катоді відбувається розряд молекул води (процес
відновлення):
H2O + e- = OH- + H+
Атоми водню після рекомбінації виділяються з розчину у
вигляді газу, що залишилися ж в розчині іони OH-утворюють біля катода з іонами
Na луг.
Внаслідок перемішування аноліта з католітом відбувається
взаємодія хлорнуватисту кислоти з лугом з утворенням гіпохлориту натрію:
HClO + NaOH = NaClO + H2O
Якщо вся кількість лугу, що утворюється на катоді, буде
надходити до анода, то процес електролізу протікає тільки з утворенням розчину
гіпохлориту натрію.
Що виходить гіпохлорит натрію в значній мірі дисоціюють з
утворенням іонів ClO-, які здатні до подальшого анодному окислення з утворенням
хлорат - іона СlO3-:
6СlO-+6OH-
-6e-=6H2O +4Cl- +2ClO3-
+ 1,5O2
Концентрація іонів СlO- суттєво впливає на подальший хід
електролізу. Іони ClO- розряджаються при значно менших потенціалах анода, ніж іони
Сl-, тому вже при незначних концентраціях гіпохлориту натрію на аноді
починається спільний розряд іонів Сl- та СlO-.
Утворення хлорату може протікати і хімічним шляхом з реакції:
2HClО+ClO- = ClO3-+2Cl-
+ 2H+
Одержуваний розчин гіпохлориту натрію має достатню стійкість
і може тривалий час зберігатися без значного розкладу при дотриманні наступних
факторів, що впливають на його стійкість:
. низька температура (не більше 20оС)
. виключення впливу світла
. відсутність іонів важких металів
. значення водневого показника рН не менше 10
Розряд іонів Сl- призводить до утворення гіпохлориту натрію з
поступово збільшується, концентрацією, а розряд іонів СlO- зменшує його
концентрацію. При достатній тривалості електролізу швидкості цих двох процесів
стають однаковими (v1 = v2) і подальше зростання концентрації утворюється
гіпохлориту натрію припиниться.
Тому завданням отримання гіпохлориту натрію є здійснення
процесу електролізу в таких умовах, при яких рівноважна концентрація
гіпохлориту натрію наступала б якомога пізніше. Очевидно, що цим умовам будуть
сприяти всі фактори, що полегшують розряд іонів Сl, які утрудняють, розряд
іонів CIО -.
.3.2 Фактори,
що впливають на електроліз хлориду натрію
Найбільш істотне значення для ведення електролізу на
оптимальному рівні мають наступні фактори:
. концентрація розчинів хлоридів
. температурний режим
. анодна щільність струму
. характер руху рідини
. спосіб розкладання електродів
.Чем вище концентрація хлоридів, тим менше перенапруження
виділення хлору і тим більше зсувається його рівноважний потенціал в
електронегативну сторону. Отже, збільшення концентрації NaCI полегшує виділення
хлору. Однак чим вище концентрація розчину NaCI, тим більше витрата кухонної
солі на 1 кг гіпохлориту натрію, тому в практичних умовах концентрацію розчину
хлориду натрію вибирають в залежності від необхідної концентрації гіпохлориту
натрію. Чим менше розчин повинен містити гіпохлориту, тим менше може бути
початкова концентрація NaCI.
.Процесс окислення гіпохлориту з наступним утворенням хлорат
сповільнюється при зниженні температури розчину, тому електроліз це ¬
доцільність вести при низьких температурах в інтервалі 20-25 ° С.
. Вихід гіпохлориту по струму збільшується із зростанням
анодного щільності струму, тому що в цих умовах важко доступ іонів СlO анода.
При дуже малих щільності струму, що відповідають інтервалу потенціалів 0,8-1,33
В, на аноді буде виділятися кисень, потім при досягненні рівноважного
потенціалу виділення хлору розпочнеться спільне виділення кисню і хлору,
причому із зростанням щільності струму вихід хлору по струму буде швидко
зростати. При щільності струму близько 1000 А/м2 на виділення кисню буде
витрачатися лише кілька відсотків струму.
. Досить суттєве значення має характер руху електроліту. Якщо
прианодний шар електроліту не порушується, то в ньому знаходиться переважно
слабо дисоційована хлорнуватиста кислота, а звертання гіпохлориту натрію
відбувається на деякій відстані від анода. У цьому випадку іони СlO можуть
надходити до анода з глибини розчину тільки завдяки дифузії та електропереносу,
тому при відсутності перемішування пріанодного шару в розчині може
накопичуватися гіпохлорит натрію більш високої концентрації, ніж це відповідає
початку розряду іонів СlO-, Зі сказаного слід, Що необхідно уникати механічного
перемішування розчину.
.Для проведення процесу електролітичного одержання
гіпохлориту натрію з мінімальними енергетичними витратами велике значення має
вибір матеріалу анода. Аноди працюють в умовах безпосереднього зіткнення з
хімічно активними речовинами, тому основною вимогою до матеріалу анода є їх
хімічна стійкість. Від стійкості електродних матеріалів та їх питомої зносу
залежать тривалість експлуатації, витрати на ремонт і обслуговування
електролізерів. Матеріал анода повинен сприяти розряду іонів Сl-, т. тобто
перенапруження хлору на ньому має бути найменшим.
.3.3 Характеристика
катодів і анодів установки електролізу хлориду натрію
З кінця 60-х років почалося широке впровадження в хлорне
промисловість і поступова заміна графітових електродів на титанові аноди з
діоксинів рутенію і титану. За кордоном вони знайшли застосування під назвою
DSA (dimensionally stable anodes). У вітчизняній практиці вони застосовуються
під назвою ОРТА (оксидні рутенієво-титанові аноди). ОРТА є офіційно
зареєстрованим товарним знаком.
Аноди типу ОРТА, яка мало зношуються, мають низку
незаперечних переваг у порівнянні з графітовими електродами:
Вони мають більш високими селективними і електрокаталітичними
властивостями (перенапруження виділення хлору на ОРТА значно нижче) по відношенню
до основного процесу - виділення хлору на аноді. Це дозволяє при всіх інших
рівних умов ведення електролізу здійснювати процес при більш низькому значенні
напруги на ванні й інтенсифікувати його, використовуючи більш високі анодні
щільності струму (аж до 10 кА/м2 на ртутних електролізерах, що недосяжне на
графіті). Тим самим збільшується вихід кінцевого продукту з одиниці поверхні
анода, що забезпечує можливість виконувати конструкції електролізерів менших
габаритів при аналогічній продуктивності.
Корозійна стійкість ОРТА значно вище, ніж у графітів анодів -
час безперервної експлуатації металоксидних анодів (без істотної втрати своїх
електрофізичних характеристик) в діафрагмові хлорних електролізерах становить ~
5-6 років, в електролізерах з ртутним катодом ~ 1,5 і більше років, В хлоратних
і гіпохлорітних електролізерах ~ 1 рік. Графітові аноди в хлорних
електролізерах мають термін пробігу не більше 6 місяців; в хлоратних і
гіпохлорітних електролізерах не більше 3-4 місяців. При цьому ОРТА, маючи
досить хороші техніко-експлуатаційні характеристики, дозволяють проводити
процес електролітичного одержання ГПХН при мінералізації хлориду в мережі
живлення розчині до 20-25 г / л. Ця обставина дає можливість проводити
електроліз до більш глибокого ступеня конверсії кухонної солі і знижує її
питома витрата в перерахунку на кінцевий продукт.
Аноди типу ОРТА та їх модифікації (термін «dimensionally
stable anodes» дослівно означає «розмірно стабільні аноди» або, що більш
прийнято на практиці - «аноди незмінний розмірів») в процесі тривалої
експлуатації не змінюють своєї форми і в першу чергу міжелектродної відстані по
відношенню до противоелектроду (катода), Що не властиво графіту. Титанову
підкладку анодів в міру спрацювання активного покриття можна піддавати
багаторазової регенерації і повторному нанесення активного покриття, що в
умовах і відносній дорожнечі титану є важливим позитивним чинником.
До недоліків ОРТА можна віднести їх порівняно високу
вартість. Для збереження їх корозійної стійкості слід передбачати заходи, що
запобігають підвищення анодного потенціалу. ОРТА не можна рекомендувати для
використання в установках з періодичним зміною полярності електродів, оскільки
в результаті відновлення оксидів утворюється металевий рутеній, який не стійкий
в умовах анодного поляризації. Однак, незважаючи на зазначені недоліки
окисно-рутенієвих анодів, з усіх нових розроблених МИА вони знайшли найбільш
широке застосування на практиці.
Що стосується катодного матеріалу, то в промисловості
використовуються, в основному, сталь, графіт і титан. Важливими їх
властивостями є стійкість при анодного поляризації, низький потенціал виділення
хлору і висока електропровідність.
Процес електролізу розчинів хлоридів супроводжується
утворенням на катодах відкладень солей жорсткості. Спочатку з'являються тонка
плівка і окремі кристали, кількість яких з часом збільшується, і вся поверхня
катода поступово покривається осадом. Товщина осаду безупинно зростає, у
зв'язку, з чим міжелектродний простір забивається відкладеннями, знижується
сила струму через електролізер та зменшує продуктивність установки.
Поруч дослідників було встановлено, що швидкість утворення
опадів і структура сольовий плівки залежать від щільності струму, часу
поляризації, хімічного складу розчину, стану поверхні електродів.
Зі збільшенням щільності струму і часу поляризації обростання
катода відбувається інтенсивніше. Швидкість налипання відкладень знижується при
застосуванні електродів з більш гладкою поверхнею. Найкращі результати
досягаються при використанні полірованих катодів.
З перерахованих факторів найбільший вплив на утворення
відкладень на катодах надає хімічний склад води і головним чином загальна
жорсткість. Зі збільшенням жорсткості швидкість утворення катодних відкладень
зростає. У прикатодному просторі первинним продуктом є луг, що виходять в
результаті розкладу води. При наявності в розчині іонів Са 2 і Mg2 відбувається
утворення відповідних гідроксидів, а в присутності іонів СО3-карбонатів.
Існує кілька технічних прийомів, застосування яких запобігає
зростанню опадів на катодах:
створення високої лінійної швидкості руху рідини щодо
електродів; механічне очищення поверхні катодів;
розчинення відкладень кислотою;
«сколювання» опадів з катодів методом тимчасової зміни
полярності електродів.
При створенні високої лінійної швидкості руху рідини
відносини електродів відкладення відриваються від поверхні катода і виносяться
потоком. Швидкість руху рідини повинна становити не менше 1,5-2 м / с. Технічне
здійснення даного способу можливо при трансформаційних змінах спеціального
насосного обладнання або електролізерів спеціальної конструкції, завдяки чому в
міжелектродному просторі створюються необхідні лінійні швидкості.
Електроліт насосом під тиском знизу вгору вводиться в
електролізер і по магістралі надходить у сепаратор. Сепаратор обладнаний в
пристрої для видалення водню, конусоподібним дном для збору відкладений,
штуцером для підведення електроліту і штуцером з клапаном для відведення
готового продукту.
Електроліт безперервно із заданою швидкістю циркулює по
замкненому обсягу до досягнення необхідної концентрації з активного хлору.
Катодні відкладення виносяться з електролізера, збираються у конусній частині
сепаратора, звідки періодично видаляються. Нова порція електроліту додається у
кількості, що дорівнює відведеному готового продукту.
Впускна камера забезпечує рівномірний розподіл електроліту по
перетину електролізера. У електролізною частини апарату вертикально почергово
розташовані анодні і катодні пластини.
У розділової секції змонтовані пристрої, що звужуються в
верхній частині. Ширина зазору в цих пристроях менше, ніж відстань між
електродами.
Осередок забезпечена патрубком для підведення електроліту,
кришкою з гідравлічним затвором та отвором для видалення водню, штуцером для
відводу одержуваного гіпохлориту натрію і патрубком з пробкою для періодичного
видалення відкладень солей жорсткості.
Електроліт рухається знизу вгору зі швидкістю, що затрудняє
утворення катодних відкладень. Продукти електролізу взаємодіють не в
електролітичної комірки, а в розділової камері.
У разі застосування механічного очищення зняття відкладень
здійснюється вручну або за допомогою спеціальних механізмів. При ручній очистці
потрібні повне розбирання установки і виконання обслуговуючим персоналом
трудомістких робіт.
Типова конструкція електролізера складається з ряду біполярно
включених дисків, закріплених по черзі на валу, по ¬ критому ізоляційним
матеріалом. Електролізер закривається кришкою і стягується болтами. Для зняття
відкладень солей жорсткості в електролізер введені скребкові механізми.
Видалення відкладень з поверхні електродів здійснюється при повороті валу.
Технічно більш простій операцією є розчинення відкладень
кислотою, у зв'язку, з чим цей метод знайшов досить широке застосування в
практиці. Суть методу полягає в тому, що періодично у міру обростання катодів
солями жорсткості через установку пропускають 3 - 5%- ний розчин соляної або
азотної кислоти, який і розчиняє відкладення. Кислота на промивання подається
за допомогою, так званого замкненого кислотного контуру, відбутися з насоса
невеликий подачі, бачка з кислотою, сполучних магістралей і запірної арматури.
Все обладнання ви ¬ виконується з антикорозійного матеріалу. При проведенні
кислотної промивки закривають засувки і припиняють надходження електроліту в електролізер.
Відкривають спускної вентиль, в повітрявіддільники зливають розсіл з установки.
Чи включають насос і в установку подають розчин кислоти, який зливається у
збірний бачок з поворотної магістралі. Промивку здійснюють до повного
розчинення відкладень, після чого електролізер знову включають в роботу.
Періодичність промивки і її тривалість залежать від
інтенсивності обростання катодів.
Одним з найбільш бажаних методів зняття відкладень є спосіб
«сколювання» опадів, що здійснюється шляхом проведення тимчасової зміни
полярності електродів. У цьому випадку виключається необхідність застосування
ручної праці та реагентів, крім того, можлива автоматизація процесу. Однак цей
метод можна застосовувати тільки для обмеженої кількості матеріалів, здатних поперемінно
працювати як в якості анода, так і катода. До числа таких електродів належать,
наприклад платинові, магнетитові, з платинірованого титану.
1.3.4 Види
електролітичних ванн установки електролізу хлориду натрію
У практиці електрохімічного виробництва хлоропродуктів
знайшли застосування різноманітні конструкції електролітичних ванн. На підставі
загальних ознак вони можуть бути розділені на дві групи: Монополярний і
біполярні. Схема включення електродів в електричний ланцюг для ванн кожної з
цих груп є спільною.
Монополярний ванни мають ряд паралельно розташованих
електродів, одна половина яких з'єднана з позитивною шиною ланцюга - аноди,
інша - з негативною шиною - катоди. При такому З'єднанні кожен електрод має
тільки одну полярність, тобто є або анодом, або катодом. Сила струму на ванні
пропорційна щільності струму і поверхні всіх електродів однієї якої-небудь
полярності, напруга на ванні визначається різницею потенціалів на одній парі
електродів (катоді і аноді), тому для роботи монополярних ванн потрібна велика
струмова навантаження при низькій напрузі.
Біполярні ванни, так само як і монополярні, мають ряд
розташованих паралельно один одному електродів, але включених в електричний
ланцюг послідовно. Струм підводять лише до крайніх електродів - анода і катода.
Проміжні електроди включені в електричний ланцюг через провідники другого роду
- електроліт.
При накладенні напруги на крайні струмопровідні елементи
проміжні електроди поляризуються. На одній їх стороні, що звернена до анода,
концентруються негативні заряди, на іншій - позитивні.
Таким чином, крайні електроди і є монополярними, а всі
проміжні - біполярними електродами, тобто. однією стороною вони працюють як
катоди, а інший - як аноди.
Сила струму на біполярної ванні залежить тільки від щільності
струму і площі поверхні одного монополярного електрода (анода або катода) і не
залежить від числа біполярних електродів. Напруга на ванні, навпаки, залежить
від різниці потенціалів між сусідніми електродами і прямопропорційного числа
пар анодів і катодів. Сучасні електролізери в основному відносяться до
біполярному типу.
Кількість продукту Gт, кг, яке теоретично має виділитися на
аноді при електролізі, може бути визначено, відповідно до закону Фарадея, за
формулою:
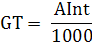
А - електрохімічний еквівалент, г / (Ач)- повний струм через
електролізерчисло працюючих анодів- тривалість роботи електролізера
.3.5 Побічні
процеси і основні показники електролізу хлориду натрію
Важливо відзначити, що на електродах паралельно з основними процесами
створення цільових продуктів відбуваються інші побічні електродні процеси. У
зв'язку з цим кількість виділився продукту завжди менше теоретичного. До таких
процесів належать:
■ реакція освіти по хімічному механізму хлорат, що
протікає в обсязі:
2HClO + ClO- = ClO3-
+2Cl- + 2H+
■ реакція електрохімічне окислення гіпохлориту до
хлорат:
6ClO- - 6 e- = ClO3-
+ 1,5O2 + 5Cl-
■ хімічна реакція розкладу гіпохлориту, яка особливо
активується в присутності забруднень електроліту, особливо заліза, міді, нікелю:
2СlO- = O2 + 2Cl-
відновлення гіпохлориту і хлорат на катоді:
ClO- + H2O + 2e- = Cl- +
2OH-
ClO3- + 3H2O + 6e-
= Cl- + 6OH-
За кількістю реально отриманого продукту можна підрахувати,
яка частина струму витрачена корисно. Ця частина струму, виражена в частках
одиниці, називається коефіцієнтом використання струму, а виражена у
відсотках-виходом по струму.
Якщо теоретично розраховане кількість продукту електролізу
позначити GT, а практично отримане кількість G, то коефіцієнт використання
струму
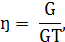
а вихід по струму дорівнює 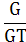 100%.
100%.
Значення ŋ є основним показником процесу електролізу.
Чим вище його значення, тим ефективніше протягом електролізу і нижче
енергетичні витрати на отримання одиниці готового продукту. При більш високих
значеннях ŋ можна зменшити до потрібної площа робочої поверхні електродів
для досягнення заданої продуктивності, застосувати більш компактні установки і
знизити витрати на їх виготовлення.
На зміну коефіцієнта використання струму ŋ впливає ряд
факторів:
величина напруги на розрядний проміжок
початкова концентрація електроліту
ступінь використання розчину хлоридів
Величина виходу хлору по струму позначається в першу чергу на
зміну витрат електроенергії W, кВт-ч/кг, при отриманні гіпохлориту натрію, які
можуть бути підраховані за формулою:
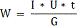
або
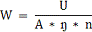
де U - напруга на струмопровідних електродах, В.
Можна вибрати один з можливих способів регулювання
продуктивності електролізера. Підвищуючи напруга на струмопровідних електродах,
а отже, підвищуючи і силу струму, можна збільшити в певних межах продуктивність
установки без істотного відхилення від мінімальних енергетичних витрат при
збереженні максимально можливого значення виходу хлору по струму. Міжелектродна відстань δ
істотно не
впливає на зміну величини ŋ і інші параметри роботи електролізера. Зміна
величини δ при збереженні площі робочої
поверхні електродів позначається тільки на продуктивності установки. При
збільшенні міжелектродної відстані відбувається пропорційне зниження щільності
струму i відповідно зниження загального виходу гіпохлориту натрію. З точністю,
прийнятною для інженерних розрахунків, залежність між δ
і i може бути
виражена співвідношенням:
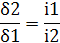
Для створення малогабаритних і високопродуктивних установок
найбільш доцільно передбачати мінімально можливі міжелектродні відстані, рівні
3-6 мм, що дозволяє вести процес електролізу при великих щільності струму.
Техніко-економічні показники роботи електролізера
визначаються не тільки витратами електроенергії, а й що досягається ступенем
виконання вихідного розчину. Особливо велике значення це має у випадку
застосування як електроліту розчинів кухонної солі, оскільки витрати на сіль є
однією з головних статей витрат при виробництві гіпохлориту натрію. Під
ступенем використання солі (відсотком розкладання) λ,%,
розуміють
відношення концентрації активного хлору в розчиненні гіпохлориту натрію,
отриманого в результаті електролізу, до концентрації NaCI, що вводиться в
установку:
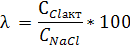
ССl акт - концентрація активного хлору в гіпохлорит натрію
CNaCl - концентрація NaCl в електроліті, г
/ л.
Витрати на сіль залежать від досягає мого ступеня корисного
використання вихідного продукту. У міру збільшення концентрації активного хлору
і розчині витрата солі на отримання одиниці готового продукту знижується . Так,
при електролізі розчину з концентрацією 100 г / л NaCI і досягнення вмісту
активного хлору на виході з електролізера 5 г / л витрата солі становить 20 г
на 1 г готового продукту (5% - розкладання). При вмісті ж хлору в розчині 10 г
/ л витрати на сіль зменшуються і складають всього 10 r / л (10%- ве
розкладання). Таким чином, для зниження витрат на сіль переважно ведення
процесу електролізу при глибокому розкладанні NaCl. Однак збільшення ступеня
використання кухонної солі призводить до зростання енергетичних витрат, тому
повинен бути якийсь оптимальний режим експлуатації установки, при якому сумарні
витрати на сіль та електроенергію будуть мінімальні.
У разі використання природних електролітів основною статтею
рас-ходу є витрати електроенергії на подачу розсолу, його транспортування до
об'єкту застосування та виробництво гіпохлориту натрію. Оптимальна ступінь
використання розчинів визначається в кожному конкретному випадку залежно від
початкової мінералізації і необхідної концентрації активного хлору. В
енергетичному відношенні, найвпевненіше, отримання гіпохлоритів невеликій
концентрації.
Розрахунок електролізною установки в загальних рисах
зводиться до наступного. Для заданої з активного хлору продуктивності
електролізера за законом Фарадея з урахуванням коефіцієнта використання струму,
значення якого залежить від типу застосовуваних електродних матеріалів,
концентрації хлоридів у електроліті, виду розсолу і необхідного ступеня
використання розчину, Визначають необхідну струмів навантаження:
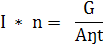
Згідно з вихідними параметрами стандартних випрямних
агрегатів, що випускаються серійно електротехнічної промисловістю і
передбачуваних для комплектування з даними електролізером, вибирають допустиму
величину повного струму та напруги. Відповідність номіналів випрямних агрегатів
і параметрів режиму роботи електролізера досягається правильним вибором числа
розрядних проміжків.
1.3.6 Механізм знезаражуючого дії гіпохлориту натрію
Метод знезараження гіпохлоритом натрію найбільш часто
використовується для знешкодження стоків,що містять ціани, різних об'ємів і
концентрацій, а також від таких органічних і неорганічних сполук, як
гідросульфіду, сульфід, МЕТИЛМЕРКАПТАН і т.д. Необхідно відзначити, що стічні
води, що містять ціаніди, утворюються при нанесенні мідних, цинкових і
кадмієвих покриттів з ціанистих електролітів. Крім того, ціановміщуючі стоки
утворюються при термічній гарту сталевих виробів в розплавах ціанистих солей, а
на металургійних підприємствах ціаніди потрапляють у стічні води з доменних
газів (при їх промивання і охолодженні). Концентрація простих ціанідів (KCN,
NaCN) в промивних водах зазвичай не перевищує 200 мг / л. У цих водах також
містяться в невеликих кількостях комплексні ціаніди міді, цинку, кадмію, заліза
та інших речовин.
При введенні гіпохлориту натрію у воду утворюються
хлорнуватиста і соляна кислоти з реакції:
NaCIO + H2O= НCIO + NaOH=CIO- + H+
Очищення стічних вод заснована на окисленні токсичних домішок
у менш токсичні (приблизно в 1000 разів) ціанат-іони з їх подальшим гідролізом
у нейтральному середовищі до NH4 і CO32-за наступними реакцій:
При pH = 9-10
CN- + 2OH- + NaClO = CNO- +
Cl- + NaOH
При рН = 7
CNO- + 2H2O = NH4+
+ CO32-
Гіпохлорити окислюють в стічних водах сполуки амонію, аміак і
органічні речовини, що містять аміногрупи до моно-і хлорамінів, а також до
трихлористого азоту по наступних реакціях:
3 + HCIO = NH2CI + H2O2CI +
HCIO = NHCI2 + H2O2 + HCIO = NCI3 +
H2O
.3.7 Характеристика гіпохлориту натрію з технологічних
санітарно-гігієнічним показникам
Санітарно-гігієнічні показники.
Якщо порівняти процеси, що відбуваються при введенні в
оброблювану воду гіпохлориту натрію:
NaCIO + H2O= НCIO + NaOH=CIO- + H+
и хлора:
CI2 + H2O = HCIO + HCI= CIO-
+ H+
то видно, що в обох випадках утворюються одні й ті ж
бактерицидні агенти - HClO і СlО. Взаємне співвідношення недіссоціірованої
хлорнуватистої кислоти і гіпохлорітного іона залежить від рН води.
Очевидно, що основні особливості, притаманні хлоруванню води
рідким хлором, повинні зберігатися і при застосуванні електролітичного
гіпохлориту натрію. Так, за інших рівних умовах незалежно від виду
використовуваного хлорреагента необхідний ступінь знезаражування досягається
при одній і тій же дозі з активного хлору. Величина вільного залишкового хлору,
що дорівнює 0,3-0,5 мг / л для питної води та 1,5 - 2 мг / л для стічної
рідини, як у випадку застосування рідкого хлору, так і при використанні
гіпохлоритом є гарантованим показником бактеріальної надійності оброблюваної
води.
Ефективність знезараження гіпохлоритом натрію істотно
залежить від активної реакції середовища, ступеня очищення води, її ініціальної
зараженості.
Для повного придушення життєдіяльності кишкової палички, що
знаходиться у воді з рН = 5,2 в концентрації 12000 клітин в 1 л, потрібна доза
бактерицидної продукту з активного хлору, що дорівнює 0,4 мг / л, при
підвищенні ж реакції середовища до рН == 8 , 3 летальну дозу треба майже
подвоїти.
При вмісті у воді підвищеної кількості зважених часток
потрібні великі дози реагенту. Особливо це необхідно при знезараженні стічної
рідини. Для стічної рідини з БПК5 = 3-10 мг / л зниження кишкових паличок до 10
в 1 мл досягається при введенні активного хлору в кількості 1-1,5 мг / л; при
БПК5 = 12 - 28 мг / л доза підвищується до 2-2,5 мг / л, а при БПК5 = 30 - 70
мг / л доза збільшується до 3,5-4 мг / л. (БПК - біологічне споживання кисню).
Підвищений вміст в стічній воді нітритів і амінокислот також
вимагає збільшення доз гіпохлориту натрію. За бактерицидній дії електролітичний
гіпохлорит натрію при знезараження води з високою ініціальної зараження не
тільки не поступається хлору, а й нерідко перевершує його. Наприклад, при
застосуванні гіпохлориту натрію повне знезаражування настає при дозі з
активного хлору 0,8 мг / л, тоді як при такій же дозі у випадку звичайного
хлорування бактерицидний ефект був неповним і становив 97-98%. Це пояснюється,
мабуть, тим, що в природних електролітах є з'єднання йоду, брому та ін., Які
при електролізі утворюють сильні окислювачі, що сприяють течією процесу
знезараження.
Вивчення впливу гіпохлориту натрію на бактеріальні клітини
(кишкову паличку) щодо встановлення рівня зниження активності ферментів показало,
що механізм дії електролітичного гіпохлориту натрію та рідкого хлору
аналогічний.
Застосування електролітичного гіпохлориту натрію дозволяє
покращити органолептичні показники оброблюваної води. Так, зниження
кольоровості найбільш інтенсивно йде при часі контакту 30 хв. Подальше
збільшення часу контакту значного зниження кольоровості не дає.
У процесах очищення води (коагуляція, стабілізація,
знезараження), пов'язаних з використанням тих чи інших реагентів, в оброблювану
воду разом з хімічними продуктами вноситься і певна кількість різних солей, що
може позначатися на зміні сольового складу оброблюваної води, її рН, Жорсткості
і стабільності.
При знезараженні гіпохлоритом натрію разом з одним грамом
активного хлору у воду буде вводитися від 8-10 до 40-50 мг / л солей. Кількість
вводяться солей залежить від типу вихідного розчину хлоридів, концентрації
активного хлору в готовому продукті і необхідної дози на знезараження.
Найбільше збільшення солевмісту води може спостерігатися при використанні
гіпохлориту натрію, що отримується з підземних мінералізованих або морських
вод.
У природних електролітах можливо також зміст таких
мікрокомпонентів, як йод, бром, мідь, цинк, свинець та інші. Зміст їх трохи -
близько 10-6-10-8. При концентрації активного хлору в електролітичному
гіпохлорит 1-5 г / л і дозі хлору на знезараження 1-5 мг / л кількість
вводяться мікрокомпонентів зменшується в тисячі разів і становитиме всього
10-9-10-11 мг / л, тобто значно нижче максимально допустимого для питної води
рівня.
Розчини гіпохлориту натрію в часі розпадаються і кілька
втрачають свою активність. Це пояснюється тим, що Гіпохлорити у водному розчині
гідролізуються з утворенням хлорнуватисту кислоти:
ClO- + H2O = HClO + OH-,
яка нестійка і розкладається за трьома напрямками:
хлоратний розпад:
HCIO = HCIO3 + 2HCI
кисневий розпад :
HCIO = 2HCl + O2
хлорний розпад (в присутності хлоридів):
HClO + NaCl + H2O = NaOH + H2O + Cl2
Утворення значної кількості HCl зменшує рН розчину, що і
приводить до швидкого розпаду гіпохлоритом. Швидкості розкладу розчину
гіпохлориту натрію сприяють підвищення температури, сонячне світло,
концентрація гіпохлорит- іона в розчині і контакт з навколишнім повітрям.
Найбільший вплив на швидкість розкладання робить концентрація
гіпохлорит- іона. Так, якщо розчин з вмістом активного хлору 0,6-0,8 г / л
протягом перших трьох діб втрачає свою активність на 4-5%, то за цей же час
розчин з вмістом хлору 10-12 г / л розпадається на 10 -12%. При цьому найбільш
інтенсивно процес розпаду відбувається протягом перших 2-3 діб, а в наступну
добу він зменшується. У зв'язку з цим найбільш доцільним є застосування
гіпохлориту натрію відразу ж після його отримання. При необхідності
використання гіпохлориту натрію через деякий час після отримання його слід
розбавляти.
Загальноприйняті при хлоруванні методики хімічного контролю
за якістю оброблюваної води прийнятні і при застосуванні електролітичного
гіпохлориту натрію.
Оскільки дезінфекція води є заключною фазою в технології її
очищення, гранично допустимі концентрації тих чи інших елементів не можуть
перевищувати регламентованих норм. Нормований хімічний склад питної води та
«Правила охорони поверхневих під від забруднення стічними водами» показують, що
найбільший допустимий діапазон коливань вмісту у воді властивий іонів Cl- , SO42-, солей жорсткості, а також водневим
іонів. Зміна змісту інших численних елементів води незначно.
З результатів бактеріологічних аналізів, отриманих після
обробки стічних вод був зроблений висновок, що кількість кишкових паличок Е
Coli безпосередньо на виході з електролізера знижується на два порядки у
порівнянні з початковою обсеменністю води, яка не пройшла через установку (що
складає 25%). Наступні 15 - і 30-хвилинний контакти води з продуктами
електролізу приводили до подальшого зниження числа кишкових паличок. Збільшення
часу контакту до 1 год. істотного впливу на зниження кількості кишкових паличок
не впливало. Мабуть, відсутність подальшої дії продуктів електролізу пов'язане
зі зменшенням кількістю вільного хлору внаслідок його зв'язування з органічними
речовинами, присутніми в стічної рідини, і утворенням органічних хлорамінів,
бактерицидну дію яких менш виражено, ніж у вільного хлору.
Таблиця 3.1.Вплив прямого електролізу і хлорреагентів на
якість забрудненої води
|
Показники
|
Значення показників
|
|
Вихідної води
|
Обробленної води
|
|
|
Прямим електролізом
|
Хлорною водою
|
|
Кольоровість, град
|
38
|
34
|
34
|
|
Лужність, мг- экв/л
|
2,1
|
2,2
|
2,1
|
|
Жорсткість, мг-кв/л
|
3
|
3
|
3
|
|
Окислюваність, мг/л
|
12,7
|
11,6
|
11,8
|
|
рН
|
7,9
|
8,1
|
7,8
|
|
Хлориди, мг/л
|
17
|
17
|
|
Coli індекс
|
104- 4*104
|
3
|
3
|
|
Залишковий хлор, мг/л
|
_
|
0,3-0,5
|
0,3-0,5
|
|
Час контакту, хв
|
_
|
30
|
30
|
Аналіз результатів показує, що при знезараження води прямим
електролізом, так само як і при хлоруванні, Основним критерієм бактеріальної
надійності є величина залишкового хлору і для повного взаємодії продуктів
електролізу з водою потрібен час контакту не менше 30 хв. Отже, незалежно від
вихідної зараженості і якості води режимні параметри необхідно підбирати таким
чином, щоб величина залишкового хлору на виході з електролізера відповідала
вимогам санітарних органів. За коливань величини залишкового хлору можна
оцінювати ефективність роботи установки і регулювати струмів навантаження.
Для порівняння була оброблена проба забрудненої води як
прямим електролізом, так і хлорного водою. У результаті електролітичної обробки
трохи збільшилося значення рН води, знизилися її кольоровість і окислюваність.
Зміна вказаних показників цілком закономірно. Збільшення рН води відбувається в
результаті створення в прикатодному просторі луги; зниження кольоровості і як
наслідок окислюваність при взаємодії органічних речовин з окислювачами, зокрема
з електролітичним гіпохлорітіоном.
При знезараженні стічної рідини прямим електролізом значення
БПК5 та оптичної щільності, що характеризує наявність у воді розчинних
органічних забруднень, практично не змінюється. Якість води, що оцінюється по
ГПК і окислюваність, поліпшується в середньому на 5,8 і 8% відповідно. Зниження
в обробленої воді перманганатної і біхроматної окислюваність, очевидно, пов'язано
з наявністю залишкового хлору і хлорамінів. Діючи як окислювачі, вони знижують
кількість споживаного KMnO4 і K2Cr2O7.
Результати санітарно-бактеріологічних досліджень, які
підтверджують, що основним критерієм бактеріальної надійності води залишається
величина залишкового хлору, а також дані технологічних дослідів дозволяють
вважати, що, незважаючи на можливість утворення в процесі електролізу різних
з'єднань і окислювачів, Основний вплив на ефект обробки води робить, мабуть,
активний хлор. Отже, з метою створення економічного методу знезаражування води
процес її прямого електролізу необхідно проводити за умов, що забезпечують
максимально можливий вихід хлору по струму.
Таблиця 3.2 Вплив прямого електролізу на якість очищеної стічної рідини
|
Показники
|
Значення показників на етапі обробки
|
Відсоток зниження показників
|
|
до електролізу
|
після електролізу
|
|
|
БПК5, мг/л
|
1,46
|
1,46
|
0
|
|
ХПК, мг/л
|
27,9
|
26,3
|
5,8
|
|
Окислюваність, мг/л
|
5,14
|
4,73
|
8
|
|
Оптична щіль-ність (250 см)
|
0,13
|
0,13
|
0
|
.3.8 Технологічна
схема знезараження води методом електролізу
Можливі технологічні схеми процесу одержання розчинів
гіпохлориту натрію залежить від виду вихідного розчину хлоридів, необхідної
концентрації активного хлору в готовому продукті, територіального розташування
об'єкта, на якому виробляється гіпохлорит натрію, вартості електроенергії та
солі. Найбільш простою схемою електролізною установки з мінімальними можливими
капітальними витратами є схема, при якій в якості розсолів використовують
природні електроліти - мінералізовані підземні та морські води. У цьому
випадку, як показують розрахунки, експлуатаційні витрати визначаються в
основному витратами електроенергії, тому з метою зниження енергетичних витрат
процес доцільно вести в напрямку отримання слабоконцентрованих розчинів гіпохлориту
натрію з вмістом активного хлору 0,2-1 г / л. При реалізації такої схеми на
практиці електроліт без будь-якої попередньої обробки з заданим витратою
подається на електролізну установку, а потім в бак накопичувач гіпохлориту
натрію або прямо в опрацюванні системи. У певних умовах при роботі
електролізерів на морській воді за санітарно-гігієнічних міркувань потрібно
застосування розчинів гіпохлоритом з більш високим вмістом активного хлору (до
3-3,5 г / л). Однак очевидно, що застосування таких установок обмежена
районами, розташованими в прибережних зонах, і підземні мінеральні води можуть
використовуватися тільки в тих випадках, коли поблизу очисних споруд
знаходяться свердловини багатоцільового призначення. У зв'язку з вищесказаним,
найбільше поширення знайшли установки, що працюють на розчинах кухонної солі.
Технологічні схеми електролізних установок, що працюють на розчинах кухонної
солі, можуть бути як проточні, так і з системою рециркуляції. Основна
відмінність режимних параметрів проточних електролізерів від параметрів
електролізерів періодичної дії полягає в тому, що в першому випадку процес
електролізу можна вважати стаціонарним, що не залежать від часу. При цьому,
якщо витрата розсолу, що подається на електроліз, і струмова навантаження на електролізер
залишаються постійними, то зберігається незмінною і концентрація розчину
гіпохлориту натрію, що відводиться з електролізера. У електролізерах
періодичної дії концентрація гіпохлориту натрію залежить від часу, що пройшов з
початку електролізу. При використанні проточних електролізерів з'являється
можливість скоротити витрати на обслуговування установок, тому що тут значно
легше керувати процесом.
При застосуванні проточних електролізерів найбільш складним
завданням в обслуговуванні є забезпечення безперервної подачі розчину кухонної
солі на електролізери.
У разі застосування електролізерів періодичної дії
обслуговуючий персонал повинен значно більше витрачати часу на організацію
процесу у зв'язку з тим, що він змушений кілька разів на добу заповнювати
електролізери розчином і зливати з них гіпохлорит натрію.
Ця причина, мабуть, обумовлює переважне застосування
електролізерів проточного типу за кордоном.
Залежно від виду використовуваного сировини електролізних установки можна
розділити на: установки для прямого електролізу,
для електролізу штучно приготованого розчину, для електролізу природних
розсолів. У
першому випадку гіпохлорит натрію одержують з хлоридів, що містяться в
невеликих концентраціях в оброблюваної воді, а в двох останніх для цієї мети використовують
більш концентровані розчини кухонної солі.
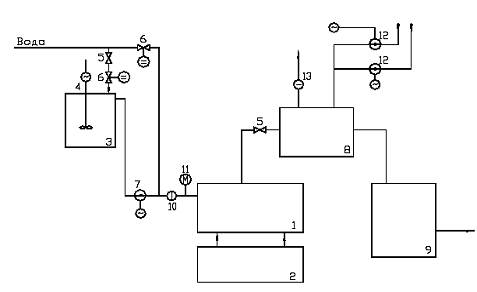
Рис.3.1. Технологічна схема проточного електролізера
- проточні трубчастий електролізер
- блок живлення
- ємність приготування концентрованого розчину солі
- мішалка
- кульових вентиль
- регулювальні клапани
- насос дозатор соляного розчину
- сепаратор
- ємність розчину гіпохлориту натрію
- реле протоки рідини
- Манометр
- вентилятор
- реле протоку повітря
Витрата кухонної солі у прямоточних установок, як правило,
трохи більше, ніж у реціркуляційніх. Проте їх оформлення та умови експлуатації
значно простіше. Тому такі апарати часто використовують на об'єктах невеликий
пропускної здатності, коли деякий перевитрати солі виправданий простий їх
конструкції і обслуговування.
В останні роки прямоточні схеми знаходять поширення і на
очисних спорудах і зі значною добової потребою в активному хлорі. У цих схемах
використовуються електролізері з окисно-металевими анодами, здатними ефективно
працювати навіть при концентрації розчину кухонної солі всього 12-25 мг / л.
При настільки невисокому вмісті хлоридів у вихідному електроліті економічно
виправдана ступінь розкладу солі досягається без застосування будь-яких
додаткових пристроїв у вигляді реціркуляційніх насосів, систем охолодження і
т.п.
Таблиця 3.3 Розміри приміщень у залежності від типу установки
|
Показник
|
Значення показників при типовому номері
електролізера
|
|
1
|
1,5
|
2
|
5
|
10
|
15
|
20
|
25
|
30
|
|
Продуктивність з активного хлору, кг / год
|
1,2
|
1,5
|
2
|
5
|
10
|
15
|
20
|
25
|
30
|
|
Розміри будівлі h*l, м
|
2*2
|
2*2,5
|
2*2,5
|
2,5*3,5
|
3*5
|
4*7
|
5*7,5
|
6*6
|
6*6,5
|
Технологічна схема електролізера циклічної дії більш складна
у порівнянні зі схемою проточного електролізера. Тому вона застосовується, як
правило, у тих випадках, коли потрібно найбільш повне використання кухонної
солі, а також при необхідності отримання розчинів гіпохлорітом з підвищеним
вмістом активного хлору. Концентрований розчин кухонної солі з ємності мокрого
зберігання насосом подається в ємність робочого розчину, де відбувається розбавлений
солі водопровідною водою до робочої концентрації, а потім - у електролізер. У
процесі електролізу відбувається нагрів електроліту, тому необхідна постійна
вентиляція.
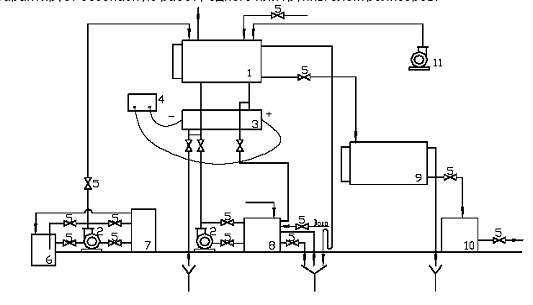
Рис.3.2. Технологічна схема електролізера циклічної дії
- електролізна ємність
- насос перекачує
- трубчастий електролізер
- блок живлення (Випрямляч)
- кульові вентилі
- ємність мокрого зберігання солі
- ємність робочого розчину солі
- вузол кислотного промивання
- ємність розчину гіпохлориту натрію
- дозуючого пристрій
- вентиляційна установка
Таблиця 3.4. Основні техніко-економічні показники трубчастих
електролізерів "ХлорЕл"
|
№
|
Найменування показника
|
Модифікація трубчастого електролізера ХлорЕл
|
|
|
РГ001/800
|
РГ001/1150
|
РГ 001/1500
|
РГ 001/2000
|
|
1
|
Режим роботи
|
Прот-непр
|
Прот-непр
|
Прот-непр
|
Прот-непр
|
|
2
|
Робоча концентрація
Розчину NaCl, г/дм3
|
20+/- 2
|
20+/- 2
|
20+/-2
|
40+/-4
|
|
3
|
Питома витрата ел. Ен на електроліз, кВт-ч/кг
|
6,5
|
6,5
|
6,5
|
4,2
|
|
4
|
Матеріал аноду
|
ОРТА
|
ОРТА
|
ОРТА
|
ОРТА
|
|
5
|
Матеріал
катоду
|
титан
|
титан
|
титан
|
титан
|
|
6
|
Питома витрата NaCl, кг/кга.х.
|
3,3
|
3,3
|
3,3
|
5,0
|
|
7
|
Робоча щільність струму, А/дм2
|
100
|
100
|
100
|
100
|
|
8
|
Ресурс роботи анодного покриття, год
|
2000
|
2000
|
2000
|
2000
|
|
9
|
Ресурс роботи електродів, не меньш, років
|
10
|
10
|
10
|
10
|
|
10
|
Продуктивність по активному
хлору, г/год
|
800
|
1150
|
1500
|
2000
|
Переваги електролітичного гіпохлориту натрію як ефективного
бактерицидного агента, простота і надійність електролізних установок, А також
зацікавленість споживачів у застосуванні безпечного електрохімічного методу
знезаражування води призвели до створення величезного числа найрізноманітніших
за своєю конструкцією електролізерів.
Кращими зарубіжними зразками установок є «Sanilec» (Diamond
shamrock corporation), «Pepcon» (Pacific engineering and Production company of
Nevada)
Так, наприклад, фірмою «Diamond Shamrock Corporation»
розроблений ряд електролізерів. Найбільше поширення получила установка
«Saniles», яка може працювати при використанні як розчинів кухонної солі, так і
морської води.
Установка «Saniles», що працює на кухонної солі, складається
з електролізера, випрямляча, системи автоматичної подачі розсолу, ємностей для
зберігання розсолу і гіпохлориту натрію, помякшувача води і елементів
автоматичного контролю за показниками роботи.
Електролізер виконаний у вигляді корпусу прямокутного
перерізу з розташованим у ньому електродний пакетом. Аноди - малозношуючися
стабільні електроди з активним покриттям з оксидів дорогоцінного металу, катода
- титанові. Вся апаратура виготовлена з таких корозійностійких матеріалів, як
титан, нержавіюча сталь, фторопласт і т.п.
Установка працює в такий спосіб. У розчинної баку готується
концентрований розчин кухонної солі, який насосом подається в змішувач, де
розбавляється водою до 3%-ного змісту NaCl, а потім у - електролізер. Отриманий
гіпохлорит натрію надходить у газовизначник, збирається в ємності-сховище і
звідти дозується в оброблюваних воду. Концентрація активного хлору в готовому
продукті в середньому складає в г / л. При необхідності вона може бути дещо
збільшена.
Вода, яка надходить на розчинення і розведення солі,
попередньо проходити через умягчитель. У процесі роботи установки контролюється
витрата електроліту, його концентрація, температура й інші технологічні
параметри. При відхиленні параметрів від заданих або створення аварійної
ситуації установка автоматично вимикається.
На отримання 1 кг активного хлору витрачається 3,5 кг солі,
5,5 кВт-год енергії та 125 літрів води.
Установки «Saniles» можуть працювати і при використанні
морської води. Морська води попередньо перед подачею в електролізер повинна
пройти фільтрацію. Концентрація активного хлору в готовому продукті в
залежності від вихідної солевмісту води і режимних параметрів складає 0,2-2,35
г / л. Катодні відкладення видаляються періодично шляхом кислотного промивання.
За даними фірми, частота промивки - 1 раз на 6 місяців. Час, необхідний на
проведення всієї операції, з урахуванням встановлення електролізера та пуску
його в експлуатацію, становить 4-6 годин. Установки випускаються продуктивністю
від 60 до 1000 кг активного хлору на добу.
Електролізері «Pepcon» також можуть працювати при
використанні як розчинів солі (концентрацією 15-20 г / л), так і морської води.
Конструкція електролітичної комірки складається з анодного графітового стрижня
з активним покриттям з PbO2 на спеціальних фіксаторах, встановлених усередині
металевої труби, яка є катодом. При використанні морської води катод
виконується з титану, а розчинів кухонної солі - з нержавіючої сталі.
Струмопідведення розташовані зовні труби, розсіл протікає у вузький зазор між
електродами.
Окремі комірки (у кількості до 10) можна компонувати в
паралельні блоки з утворенням, так званих модулів. Набір модулів дозволяє
отримати необхідну продуктивність.
Кожна комірка розрахована на струмів навантаження до 500 А при
напрузі 6-7 В і здатна на добу виробляти до 9 кг активного хлору - при
використанні розчинів кухонної солі і до 11 кг - при використанні морської
води. Регулююча струмів навантаження і напруга, можна отримати розчини з
вмістом активного хлору від 0,2 до 8 г / л.
Отримання концентрованих розчинів гіпохлориту натрію можливо
тільки при застосуванні системи рециркуляції і теплообмінних пристроїв. Для
отримання 1 кг активного хлору витрачається 3-3,5 кг солі і 6-6,8 кВт-год
електроенергії. За даними фірми при використанні розсолу з вмістом завислих
речовин до 500 мг / л попереднього очищення не потрібно.
Що утворюються відкладення солей жорсткості видаляються
шляхом кислотного промивання або при застосуванні системи рециркуляції в
результаті використання підвищених швидкостей протікання електроліту.
Установка «Chloropac» складається з низки осередків,
виконаних за принципом «труба в трубі». Внутрішній циліндр працює як «Плаваючий
Біполь», зовнішній складається з двох половинок - анодного і катодного,
розділених діелектриком.
Продуктивність кожного осередку становить 5 кг активного
хлору на добу. Осередки монтуються в групи (модулі) продуктивністю до 60 кг
активного хлору на добу. Розміри такого модуля складають 1,8 * 2,1 * 4,8 м. На
виробництво 1 кг активного хлору витрачається 6,2 кВт * г електроенергії.
Можливі технологічні схеми процесу отримання гіпохлориту
натрію залежать від необхідної концентрації активного хлору в готовому
продукті, територіального розташування об'єкта, на якому виробляється
гіпохлориту натрію, вартості електроенергії та солі.
Далі наведена технологічна схема комплексу з електрохімічного
виробництва гіпохлориту натрію продуктивністю з активного хлору від 10 до 1080
кг на добу:
Виробництво розчину гіпохлориту натрію здійснюється за безперервною
схемою. Для запобігання значного зниження виходу активного хлору по струму
застосовується каскад електролітичних осередків, розташованих в одній
електролізною ванні, що дозволяє отримати концентрацію з активного хлору від 5
до 10 г / л.
Комплекс з виробництва гіпохлориту автоматизований і
управляється з пульта управління, а також є можливість роботи електролізною
установки в ручному режимі.
.4 Технологіческая
схема установки отримання активного хлору і опис її
Рис.4.1. Технологічна схема комплексу з електрохімічного
виробництва гіпохлориту натрію
Можливі технологічні схеми процесу отримання гіпохлориту
натрію залежать від необхідної концентрації активного хлору в готовому
продукті, територіального розташування об'єкта, на якому виробляється
гіпохлорит натрію, вартості електроенергії та солі.
Таблиця 4.2 Найменування елементів обладнання технологічної схеми
|
позначення
|
найменування
|
позначення
|
найменування
|
|
БМЗС
|
Бак мокрого зберігання солі
|
БП
|
Бачок підживлюючий
|
|
ФС
|
Фільтр сольовий
|
КЄ
|
Клапан електромагнітний
|
|
Р1, Р2
|
Водяний редуктор
|
ДР
|
Датчик рівня
|
|
Км
|
повітродувки
|
РС
|
Ротаметр сольовий
|
|
ЄС
|
Ежектор сольовий
|
РГ
|
Ротаметр гіпохлорітний
|
|
ЄГ
|
Ежектор гіпохлорітний
|
ВБ
|
Витратний
бак
|
Таблиця 4.3 Технічні дані установки виробництва гіпохлориту натрію
|
Продукт. Cl2 гр/ год
|
80
|
240
|
480
|
800
|
1280
|
1600
|
|
Поток соляного р-ну NaCl
л/год
|
0,75
|
2,25
|
4,5
|
7,5
|
12
|
15
|
|
Витрати
солі кг/год
|
0,23
|
0,7
|
1,4
|
2,33
|
3,72
|
4,65
|
|
Витрати води лит/год
|
10,75
|
32,25
|
64,5
|
107,5
|
172
|
215
|
|
Витрати води лит/кг Cl2
|
134,4
|
134,4
|
134,4
|
134,4
|
134,4
|
134,4
|
|
Витрати потужності, АС, кВт
|
0,55
|
1,64
|
3,07
|
5,12
|
7,72
|
9,11
|
|
Витрати енергії , КВт/час АС/кг, Cl2
|
6,8
|
6,8
|
6,4
|
6,4
|
6
|
5,7
|
Наведені дані свідчать про високу ефективність
електрохімічного методу знезаражування води у порівнянні з традиційними.
Запропонований метод не вимагає застосування газоподібного хлору, створення
запасів дезінфікуючого реагенту, легко піддається контролю та автоматизації, не
сприяє утворенню хлорорганічних сполук.
2. ВИБІР І РОЗРАХУНОК ЕЛЕКТРОЛІЗЕРА
2.1 Вибір і обґрунтування конструкції електролізера
Для виробництва розчинів гіпохлориту натрію
розроблені і використовуються різні конструкції електролізерів. Застосовуються
електролізери з монополярним і біполярним включенням електродів. Біполярні електролізери
відрізняються компактністю, меншими витратами конструкційних матеріалів,
простотою обслуговування. Використовуються електролізери з коаксіальним і
плоскопаралельним розташуванням електродів. Електролізери великої одиничної
потужності конструюють з плоскопаралельним розташуванням електродів.
Електролізер складається з сталевого корпуса що
працює катодом. У середині корпуса розташований порожній графітовий анод .
Розчин хлориду натрію або морська вода подається по трубі у внутрішню частину
порожнього графітового анода, а потім проходить міжелектродний простір. Розчин
гіпохлориту натрію відводиться по трубі .
У Росії випускаються установки типу ЭН з графітовими
електродами продуктивністю 5,25 і 100 кг за добу активного хлору для роботи на
розчинах, що містять 80…120 кг×м-3 NaCl [6].
Розроблені електролізери біполярного типу з
природною циркуляцією і обладнані холодильником з поліетилену. Вони дозволяють
одержувати розчини гіпохлориту натрію концентрацією близько 10 кг×м-3 при густині
струму 1,0…1,2 кА×м-2 і температурі 293…308 К, з виходом за струмом
60 %, витратою хлориду натрію 8…10 кг на кг активного хлору та витратою
електроенергії 8…10 кВт×год×кг-1.
Фірма Де Нора випускає електролізери “Синкхлор” з
біполярним включенням електродів, що з анодного боку покриті активною масою на
основі діоксиду рутенію. Корпус електролізера виготовлений з пластмаси.
Пропонуються електролізери на навантаження за струмом від 0,15 до 5,0 кА і
продуктивністю від 24 до 800 кг активного хлору за добу.
При електролізі морської води максимально можливий
вміст NaClО складає не більше 3 кг×м-3, при роботі на більше
концентрованих розсолах концентрація NaClО може зрости до 5…6 кг×м-3 (максимально
до 8 кг×м-3) [5].
2.2 Матеріальний розрахунок
електролізера
2.2.1 Вихідні дані
|
Струмове навантаження на електролізері (I)
|
А
|
100
|
|
Середній вихід за струмом гіпохлориту натрію
|
%
|
60
|
|
Кількість ячеєк (n)
|
штук
|
8
|
|
Тривалість електролізу (t)
|
г
|
7
|
|
Концентрація NaCl в вихідному розсолі (CNaCl)
|
кг/м3
|
150
|
|
Об'єм розсолу в електролізері (Vp)
|
м3
|
0.5
|
|
Температура розсолу на початку електролізу (Тр)
|
К
|
293
|
|
Температура електроліту в кінці електролізу (Тк)
|
К
|
308
|
|
Температура охолоджуючої води на вході (Твх)
|
К
|
280
|
|
Температура охолоджуючої води на виході (Твих)
|
К
|
288
|
.2.2 Розрахунки матеріального балансу
Знаходимо кількість гіпохлориту натрію, що виділився, кг
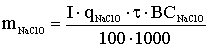 (2.1)
(2.1)
де qNaClO - електрохімічний еквівалент, г/А·год; ВСNaClO - вихід за
струмом гіпохлориту натрію, %
Знаходимо об'єм кисню, що виділився, м3
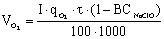 ,(2.2)
,(2.2)
де qNaClO - електрохімічний еквівалент, л/А·год
Встановлюємо кількість водню, що виділився, м3
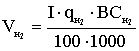 (2.3)
(2.3)
де qН2 - електрохімічний еквівалент водню, л/А·год; ВСН2 - вихід за
струмом водню, %, (ВСН2 » 100%).
Концентрація гіпохлориту натрію в кінці циклу електролізу, кг/м3
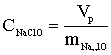 (2.4)
(2.4)
Розрахунки матеріального балансу виконані на ЕОМ. Результати
розрахунків наведені у додатку 1.
.3 Розрахунок балансу напруги
Загальна напруга на електролізері розраховується по формулі:
= (Ea - Eк + DUa + DUк + DUел) × n + DUконт, (2.5)
де Ea та Eк - анодний та катодний потенціали, В; DUa та DUк - падіння напруги в
анодах, катодах, В; DUел - падіння напруги в електроліті, В; DUконт - падіння напруги в
контактах, В.
Розраховуємо анодний потенціал реакції
2Cl- - 2e- = Cl2 ; 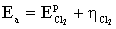 , (2.6)
, (2.6)
де 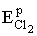 - равноважний потенціал хлорного електроду, В,
- равноважний потенціал хлорного електроду, В,
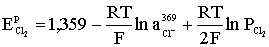 (2.7)
(2.7)
,359 - стандартний потенціал хлоридного електроду, В; 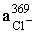 - активність іонів хлору в рассолі при температурі
електролізу;
- активність іонів хлору в рассолі при температурі
електролізу; 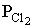 - парціальний тиск хлору в електролізері, атм.
- парціальний тиск хлору в електролізері, атм.
При интегруванні рівняння 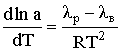 отримуємо
отримуємо
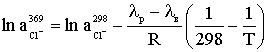 , (2.8)
, (2.8)
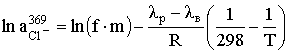 ,(2.9)
,(2.9)
де f - середний коефіцієнт активності розчину при Т = 298 К; lр
та lв - сховане тепло випарення розчину та води, lр
- 2317,9 кДж/кг [6, с. 476]; m - молярність розчину NaCl;
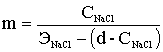 ,(2.9)
,(2.9)
де 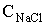 - концентрація NaCl в розсолі, кг/м3;
- концентрація NaCl в розсолі, кг/м3; 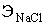 - хімічний еквивалент NaCl, кг; d - густина розчину
NaCl , кг/м3.
- хімічний еквивалент NaCl, кг; d - густина розчину
NaCl , кг/м3.
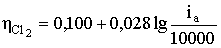 , (2.10)
, (2.10)
де 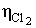 - перенапруга виділення хлору, В; ia -
анодна густина струму, А/м2.
- перенапруга виділення хлору, В; ia -
анодна густина струму, А/м2.
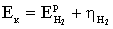 ,
,
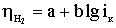 ,(2.11)
,(2.11)
де  - рівноважний потенціал водневого електроду в умовах
електролізу, В,
- рівноважний потенціал водневого електроду в умовах
електролізу, В,  = -0,84 В;
= -0,84 В; 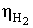 -
перенапруга виділення водню, В; iк - катодна густина струму, А/м2.
-
перенапруга виділення водню, В; iк - катодна густина струму, А/м2.
Визначаємо падіння напруги в анодах
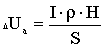 або
або
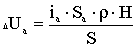 ,(2.12)
,(2.12)
де ia - анодна густина струму, А/м2; Sa
- робоча поверхня одного аноду, м2, Sa » 0,11 м2; r - питомий електричний опір матеріалу аноду, Ом×см; H - висота робочої частини аноду, м; S -
площа поперечного січення аноду, м2.
Визначаємо падіння напруги в катодах
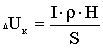 або
або
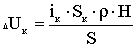 ,(2.13)
,(2.13)
де iк - катодна густина струму, А/м2; Sк
- робоча поверхня одного катоду, м2, Sк » 0,11 м2; r - питомий електричний опір матеріалу аноду, Ом×см; H - висота робочої частини катоду, м; S -
площа поперечного січення катоду, м2.
Встановлюємо падіння напруги в електроліті
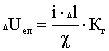 ,(2.14)
,(2.14)
де i - густина струму, А/м2; Dl - відстань між електродами, м; c - питома електропровідність електроліту, Ом-1×м-1; Кг - коефіцієнт, що
враховує додатковий опір електроліту за рахунок газонаповнення (Кг =
1.2).
Падіння напруги в контактах  =
0,05 В.
=
0,05 В.
Розраховуємо витрати електроенергії на 1 кг NaClO, кВт
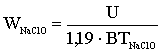 .(2.15)
.(2.15)
Розрахунки балансу напруги виконані на ЕОМ. Результати розрахунків
наведені у додатку 2.
2.4 Тепловий розрахунок електролізера
Прихід тепла
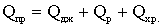
де Qдж - джоулеве тепло, кДж; Qр - прихід тепла з
розсолом, кДж; Qх.р. - тепло хімічної реакції взаємодії хлору з
лугом;
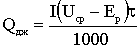 ,(2.16)
,(2.16)
де Uср - середня напруга на електролізері, В; Ер
- напруга розкладу водного розчину хлориду натрію, В.
Тепло хімічної реакції взаємодії хлору з лугом
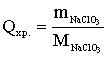 або
або
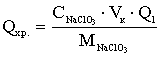 , (2.17)
, (2.17)
де 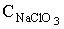 - концентрація хлорату натрію в електроліті, кг/м3;
Vк - об'єм електроліту, м3; Q1 - тепловий
ефект реакції, кДж/моль;
- концентрація хлорату натрію в електроліті, кг/м3;
Vк - об'єм електроліту, м3; Q1 - тепловий
ефект реакції, кДж/моль; 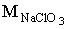 - молекулярна маса NaClO3, кг.
- молекулярна маса NaClO3, кг.
Визначимо витрати тепла, кДж,
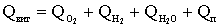 ,(2.18)
,(2.18)
де 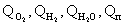 - витрати тепла з киснем, воднем та охолоджуючою
водою, відповідно.
- витрати тепла з киснем, воднем та охолоджуючою
водою, відповідно.
Розрахуємо витрати тепла з киснем
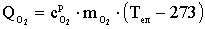 ,(2.19)
,(2.19)
де 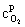 - питома теплоємність кисню при постійному тиску,
кДж/кг×К,
- питома теплоємність кисню при постійному тиску,
кДж/кг×К,
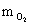 -
масса отриманого кисню, кг; Тел - температура кисню, К.
-
масса отриманого кисню, кг; Тел - температура кисню, К.
Розрахуємо витрати тепла з воднем
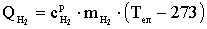 ,(2.20)
,(2.20)
де 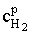 - питома теплоємкість водню при постійному тиску,
кДж/кг×К,
- питома теплоємкість водню при постійному тиску,
кДж/кг×К, 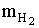 -
масса отриманого водню, кг; Тел - температура водню, К.
-
масса отриманого водню, кг; Тел - температура водню, К.
Визначимо кількість тепла, яке уноситься охолоджуючою водою
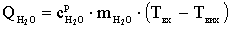 ,(2.21)
,(2.21)
де 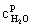 - питома теплоємкість води, кДж/кг×К,
- питома теплоємкість води, кДж/кг×К, 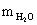 -
масса охолоджуючої води.
-
масса охолоджуючої води.
Встановимо витрати тепла поверхнею електролізеру в навколишнє
середовище
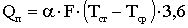 ,(2.22)
,(2.22)
де a - сумарний коефіцієнт тепловіддачі, Вт/м2×К, 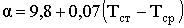 ;
F - поверхня електролізеру, м2; Тст та Тср -
абсолютна температура стінки електролізеру та воздуху на дільниці електролізу,
К.
;
F - поверхня електролізеру, м2; Тст та Тср -
абсолютна температура стінки електролізеру та воздуху на дільниці електролізу,
К.
Кількість тепла, що поступає з розсолом
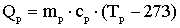 ,(2.23)
,(2.23)
де mp - маса розсолу, що подається на електроліз, кг; cp
- питома теплоємкість кДж/кг×К.
Розрахуємо кількість охолоджуючою води
 (2.24)
(2.24)
Розрахунки балансів виконано з застосуванням ЕОМ. Результати
розрахунків наведені у додатку.
3. ЕКСПЛУАТАЦІЯ ЕЛЕКТРОЛІЗЕРА ТА ЙОГО ТЕХНІЧНІ ХАРАКТЕРИСТИКИ
Електролізна установка непроточного типу, з малозношуваними
електродами, призначена для отримання знезаражуючого реагенту - розчину гіпохлориту
натрію шляхом електролізу хлористого натрію. Установка застосовується для
знезараження питної та стічної води в населених пунктах, дитячих таборах
відпочинку, при обробці води в басейнах, системах оборотного водопостачання.
Електролізна установка складається з розчинного вузла
1,електролізеру 2, баку-накопичувачу 3, джерела струму 4 та вентилятора (рис.
3.1).
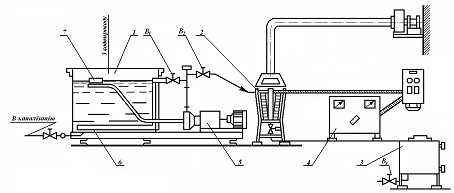
Рисунок 3.1 - Принципова схема електролізної установки для
одержання водних розчинів активного хлору.
Розчинний вузол складається з бака-розчинника ємкістю 1,16 м3
зварної конструкції з нержавіючої сталі та насосу 5, що встановлено на рамі.
Всередині бака розміщена трубчата решітка 6 з отворами для рівномірного
розподілу струму рідини по дну баку при розчиненні солі, та поплавок 7, що
призначений для забору рідини в верхній частині бака. На поплавку змонтовано
патрубок з отворами, конструкція забірного патрубка попереджує засмічення
штуцеру та магістралі.
В нижній частині бака є зливний патрубок, на який встановлено
запірний вентиль.
Насос, що поєднаний з усмоктувальним патрубком з поплавком,
напірним патрубком через вентиль з решіткою та через вентиль з трубопроводом
подачі розчину солі в електролітичну ванну.
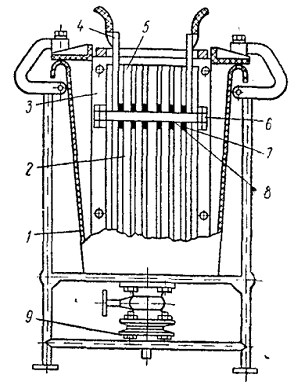
Рисунок 3.2 - електролізер.
Електролізер складається з електролітичної ванни 1,
виготовленої з титану та касети 2, в якій розташовані шість біполярних та два
монополярні графітові електроди. На отбортовці ванни встановлено зонт, який
поєднується з повітрявідводом витяжного вентилятора. Патрубок переливу призначений для
підтримання постійного рівня розчину хлориду натрію в електролітичній ванні. В
конструкції передбачено вентиль для зливу готового продукту в бак-накопичувач,
та вентиль для зливу в каналізацію промивної води з забрудненнями (солі
жорсткості).
бак-накопичувач зварної конструкції з
титану використовується для збору й тимчасового схову готового продукту
електролізу (розчину гіпохлориту натрію). В дні бак-накопичувач має два
патрубки з запірними вентилями, що пристосовані для зливу осаду та подачі
розчину гіпохлориту натрію в воду, що обробляється. Подача розчину гіпохлориту
натрію в бак-накопичувач здійснюється через верхній патрубок.
Рисунок 3.3 - схема дільниці електросинтезу розчинів
активного хлору.
В установці використано джерело струму УЗА-150-80. Схема
живлення електролізної установки складається з джерела струму й елементів
автоматики. джерело струму
УЗА-150-80 розрахований на живлення від мережі перемінного струму частотою 50
Гц при напрузі 380 В. Струмове навантаження на електродний блок 100-110 А, при
напрузі 30-35 В. Контроль за роботою джерела струму здійснюється за показниками
амперметра та вольтметра.
Електролізна установка працює за наступною схемою. В бак-розчинник
загружається кам'яна сіль, заливається водою й за допомогою насоса
перемішується до одержання концентрованого розчину (300 ± 10 г/л NaCl). Одержаний
розчин перекачується з бака-розчинника в ванну електролізера, де розчинюється
водопровідною водою до робочої концентрації 100-120 г/л NaCl. На електродний
блок подається напруга від джерела струму. Під дією електричного струму
проходить електроліз хлориду натрію з утворенням гіпохлориту натрію. Після
проведення електролізу, одержаний розчин гіпохлориту натрію зливається в
бак-накопичувач. Із бака-накопичувача розчин дозується в воду, що обробляється.
Застосування графітових електродів має як свої переваги, так
і недоліки. До переваг варто віднести: стійкість в агресивному розчині;
можливість використовувати графітовий електрод і як анод і як катод, що
дозволяє видаляти відкладення солей жорсткості з катода за допомогою зміни
полярності електродів; доступність і відносна дешевина. До недоліків -
“вигоряння” графіту в процесі електролізу, високий питомий електричний опір
графіту в порівнянні з металевими струмопідводами, забруднення електроліту
порошкоподібним графітом з електродів. Термін роботи графітового електродного
блоку складав 400 - 600 годин. При “вигорянні” графіту відбувалося збільшення
міжелектродної відстані і, відповідно, збільшення омічних втрат напруги в
електроліті. Падіння напруги на графітовому блоці сягало 60 - 65 В. Розігрів
електроліту за рахунок омічних втрат напруги в графітовій касеті досягав 40 -
45 ос. Підвищення
температури приводило до збільшення швидкості хімічного розкладання і катодного
відновлення гіпохлорита натрію і ініціювало перебіг хімічної реакції утворення
хлорату натрію [2, 5].
Термін служби поліпропіленового бака не перевищував двох
років. Найбільш нестійкими виявилися зварні шви бака. В результаті взаємодії з
з'єднаннями активного хлору відбувалося загальне “старіння” поліпропілену. Тому
ремонт бака не був можливий.
Для усунення вищезазначених недоліків, а також через проблеми
придбання графітових анодів в Росії, була проведена модернізація електролізної
установки, що полягає у виготовленні нової металевої біполярної касети і заміни
поліпропіленового електролізного бака на титановий. Вибір матеріалу для
виготовлення біполярного електрода був ускладнений специфічними умовами його
роботи. Занурена в електроліт конструкція блоку вимагає спеціальних заходів для
захисту від струмів витоку. З цією метою неробоча поверхня електродів була
захищена футеровкою фторопластом. Як матеріал катода розглядалися титан ВТ 1-0
і сплав титана ОТ 4-0. Поряд з високою корозійною стійкістю обраних матеріалів
в хлоридних окислювальних розчинах значною проблемою для них є наводнювання.
Через наводнювання електроди з ОТ 4-0 послу 1000 годин роботи зазнали дуже
сильної деформації з корозійним розтріскуванням по місцях зварювання. Електроди
з ВТ 1-0 послу 1000 годин роботи практично не деформувалися, після 2000 годин
роботи почалась спостерігатися невелика опуклість катодної сторони.
Електроди нової касети були виготовлені з листового титана ВТ
1-0. На анодну сторону електродів була наварена просічно-тянута титанова сітка
з каталітично активним покриттям із суміші оксидів рутенію і титана (ОРТА).
Робоча електродна поверхня біполярного електрода склала 0,11 м2. Як
катод використовувалася катодна сторона титанового електрода. У єдиний блок
електроди збиралися за допомогою шпильок.
Нова касета складалася з двох монополярних і семи біполярних
електродів. Електродні ячейки обмежувалися вертикальними гумовими прокладками
товщиною 8 мм. Міжелектродна відстань склала 5мм. Поперечний переріз нижнього
зазору осередків було зменшено в 4 рази, з метою зменшення струмів витоку, за
рахунок гумових уставок. Циркуляція електроліту в ячейках здійснювалася за
рахунок аероліфта газами, що виділяються.
При токовому навантаженні 110 - 120 А падіння напруги на
модернізованому блоці складало 30 - 32 В. Температура електролізу не
перевищувала 22 ос
влітку і 14 ос взимку.
Концентрація гіпохлорита натрію піднялася до 12,8 - 14,6 г/л, у порівнянні з 4
- 7 г/л на графітових електродах. Вміст хлорату натрію не перевищував 0,6 г/л.
Питомі витрати електроенергії складали 3,5 кВт×год на кг NaCl (100 %), що
нижче показників електролізу на графітовому блоці в 4,5 рази.
Умови електролізу розчину хлориду натрію з концентрацією 120
г/л є досить жорсткими для ОРТА. Через 2 роки експлуатації (~4000 годин роботи)
модернізованого електродного блоку було замічене збільшення анодного потенціалу
на ОРТА, що пояснюється зносом активного оксидно-рутенієвого покриття. Для
регенерації каталітично активного покриття анодів нами було використано оксидне
кобальт-титанове покриття, отримане методом термічного розкладання [6, 7].
Оксидне кобальт-титанове покриття наносилося в три шари по відпрацьованому
ОРТА. Залишковий вміст оксидного рутенійово-титанового покриття допомагав
вирішити проблему зростання перехідного опору на титановому струмовідводі.
Вміст оксидів кобальту в отриманому покритті 6 - 8 г/м2 рахуючи на
металевий кобальт.
Експлуатація електродного блоку протягом року (~2000 годин
роботи) підтвердила високу ефективність використання оксидного
кобальт-титанового покриття анодів для електролізу розчину хлориду натрію.
Показники електролізу при використанні регенерованих анодів не відрізнялися від
показників, отриманих на ОРТА. По нашим даним [7] корозійний знос при
використанні оксидного кобальт-титанового анодного покриття в описуваних умовах
не перевищував 0,5 мг на 1000 А×год рахуючи на металевий кобальт.
Проведені дослідження показали, що для електросинтезу водних
розчинів активного хлору можна використовувати відпрацьовані ОРТА, регенеровані
оксидним кобальт-титановим каталітично активним покриттям.
Слабким місцем у роботі модернізованого електролізного блоку
є відкладення солей жорсткості в робочих ячейках. Розчинні з'єднання кальцію і
магнію, що надходять на електроліз з кам'яною сіллю і водопровідною водою,
взаємодіючи з гідрооксид іонами, що утворюються при катодній реакції,
переходять у нерозчинні з'єднання. Кристалізуючись на поверхні катода, солі
жорсткості зриваються з неї пухирцями водню, що виділяються, і у виді пластинок
обсипаються в нижню частину ячеєк. Це перешкоджає підводу електроліту для
циркуляції в робочих ячейках.
Частково солі жорсткості вдалося осадити на стадії
солерозчинення шляхом содово-каустичної обробки вихідного сольового розчину по
реакціях:
Mg2+ + 2OH- = Mg(OH)2 ¯2+ + CO32- = CaCO3
¯,
частково осипавшийся шлам видалявся з ячеєк електролізного
блоку шляхом вимивання струменем води по закінченні циклу електролізу і зливу
отриманого розчину гипохлорита натрію.
З метою моніторингу стану електродів електродного блоку
періодично оглядалась поверхня електродів з одночасним повним очищенням робочих
камер від солей жорсткості. Відзначено невелику деформацію біполярних титанових
пластин в анодну сторону через 2000 годин роботи і заростання солями жорсткості
поверхні катодів, вхідних і вихідних отворів електродних ячеєк.
Вдалим рішенням виявилось застосування титану ВТ 1-0 для
виготовлення електролізного бака. За весь термін експлуатації (5 років) стан
поверхні та зварних швів не зазнав жодних змін. Зважаючи на недовгий термін
експлуатації поліпропіленових електролізних баків застосування титану стає все
більш економічно доцільним.
Для виконання добової програми достатньо використання однієї
електролізної установки в дві робочі зміни. Але з урахуванням зупинок на ремонт
і профілактичне обслуговування і для забезпечення безперервної роботи на
дільниці встановлюємо дві електролізні установки. З тією ж метою встановлюється
два баки-солерозчинника і два баки-накопичувачі одержаного розчину.
Дільниця електросинтезу водних розчинів активного хлору
розташована в будівлі басейну і займає 4 кімнати. В першій кімнаті розташовано
вузол розчинення солей, в другій - електроліз, в третій - зберігається готовий
розчин активного хлору, в четвертій - розташовані джерела постійного струму.
Джерела постійного струму повинні бути відокремлені від інших кімнат для
запобігання їх контакту з воднем і бризками розчину.
Концентрація активного хлору у розчині перевіряється раз за
зміну шляхом іодометричного титрування.
4. ЕКОНОМІЧНА ЧАСТИНА
. 1 Планування виконання роботи
При плануванні виконання дипломної роботи за допомогою
методів мереж доцільно виконати ряд етапів.
Перший етап передбачає постановку проблеми, встановлення
комплексу робіт для її вирішення, тривалості та послідовності їх виконання.
Таблиця 4.1 Вихідні параметри графіку мережі
|
Показники
|
Номер роботи
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
Тривалість роботи,дні
|
10
|
2
|
4
|
5
|
3
|
15
|
7
|
10
|
2
|
1
|
|
Послідовність виконання
|
2
|
3
|
4
|
5;6;7
|
8
|
8
|
8
|
9
|
10
|
-
|
Другий етап передбачає побудову графіку(рис. 4.1) мережі
мовою робіт. Він будується з ліва на право. Робота позначається у вигляді кола,
а зв'язок між ними - стрілками.
5
3
2 3 4 6
8 9 10
10 2 4 5 15
10 2 1
7
7
Рисунок 4.1. Графік мережі виконання робіт.
Третій етап передбачає розрахунок параметрів графіку мережі.
До розрахункових параметрів графіку мережі належать:
- Тривалість критичного шляху;
- Ранній термін початку робіт;
- Ранній термін закінчення робіт;
- Пізній термін початку робіт;
- Пізній термін закінчення робіт;
- Повний резерв часу графіку мережі;
- Вільний резерв часу графіку мережі.
Критичний шлях-Ткр- дорівнює сумі тривалості робіт
з максимальною тривалістю від початку НДР і до її закінчення:
+2+4+5+15+10+2+1=49- Ткр
+2+4+5+7+10+2+1=41
+2+4+5+3+10+2+1=37
Ранній термін початку робіт:
 =
=
 +
+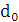
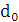 =0+0=0
=0+0=0
 =
=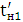
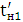 +
+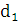
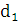 =0+10=10
=0+10=10
 =
=
 +
+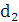
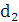 =10+2=12
=10+2=12
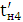
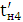 =
=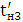
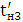 +
+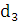
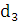 =12+4=16
=12+4=16
 =
=
 +
+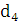
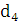 =16+5=21
=16+5=21
 =
=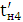
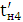 +
+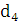
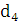 =16+5=21
=16+5=21
 =
=
 +
+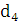
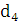 =16+5=21
=16+5=21
 =
=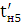
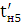 +
+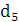
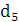 =21+3=24
=21+3=24
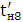
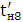 =
=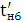
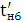 +
+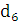
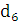 =21+15=36-max
=21+15=36-max
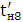
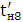 =
=
 +
+
 =21+7=28
=21+7=28
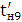
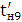 =
=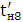
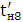 +
+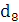
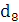 =36+10=46
=36+10=46
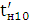
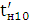 =
=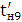
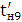 +
+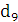
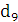 =46+2=48
=46+2=48
Пізній термін початку роботи:
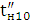
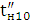 =Ткр-
=Ткр-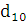
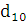 =49-1=48
=49-1=48
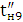
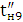 =
=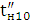
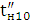 -
-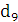
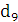 =48-2=46
=48-2=46
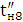
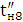 =
=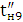
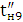 -
-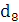
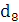 =46-10=36
=46-10=36
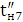
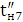 =
=
 -
-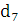
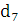 =36-7=29
=36-7=29
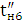
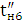 =
=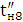
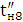 -
-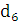
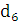 =36-15=21
=36-15=21
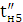
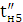 =
=
 -
-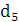
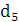 =36-3=33
=36-3=33
 =
=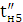
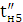 -
-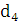
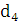 =33-5=28
=33-5=28
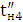
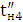 =
=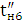
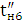 -
-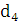
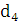 =21-5=16- min
=21-5=16- min
 =
=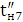
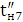 -
-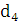
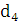 =29-5=24
=29-5=24
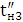
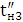 =
=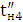
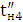 -
-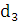
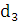 =16-4=12
=16-4=12
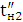
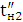 =
=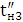
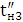 -
-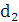
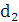 =12-2=10
=12-2=10
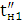
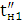 =
=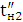
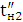 -
-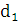
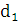 =10-10=0
=10-10=0
Таблиця 4.2 Числові характеристики графіку мережі
|
№
|
d
|
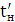
|
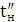
|
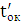
|
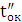
|
Рп
|
|
1
|
10
|
0
|
0
|
10
|
10
|
0
|
|
2
|
2
|
10
|
10
|
12
|
12
|
0
|
|
3
|
4
|
12
|
12
|
16
|
16
|
0
|
|
4
|
5
|
16
|
16
|
21
|
21
|
0
|
|
5
|
3
|
21
|
33
|
24
|
36
|
12
|
|
6
|
15
|
21
|
21
|
36
|
36
|
0
|
|
7
|
7
|
21
|
29
|
28
|
36
|
8
|
|
8
|
10
|
36
|
36
|
46
|
46
|
0
|
|
9
|
2
|
46
|
46
|
48
|
48
|
0
|
|
10
|
1
|
48
|
48
|
49
|
49
|
0
|
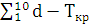
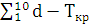 =59-49=10дней
=59-49=10дней
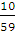
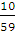 ·100=16,9≈17%
·100=16,9≈17%
.2 Оцінка долі творчої праці
Найважливішою частиною наукового процесу є творча праця, тобто така
діяльність, результатом якої є поява нових знань, розвиток ідей.
В пошукових та прикладних розробках вихідним предметом праці є ідея
(або ідеальний образ процесу, конструкції, матеріалу, процесу, комплексу і
т.д.), яка послідовно проходить технічні стадії НДР, отримує подальший розвиток
та поступово перетворюється на продукт праці. Таким чином виникнення, розвиток
ідеї, її перетворення на матеріальний продукт є результатом творчої праці
наукових робітників. На перших трьох стадіях НДР іде процес уявного проникнення
в сутність явища і пізнання його закономірностей. На четвертій стадії
(експеримент) творча праця доповнюється суто технічними процесами праці, на
п’ятій стадії використовуються математичні та логічні моделі. Основну роль тут
знову відіграють уявні процеси. На стадії прийняття та виконання рішень ”
важливу роль має процес аналітичного мислення, а на стадії “впровадження”-
отриманий результат (матеріалізована вихідна ідея) випробовується на практиці,
аналізується, перевіряється його відповідність чи невідповідність вихідній
ідеї.
4.3 Кошторис витрат на виконання науково-дослідної роботи
(НДР)
Витрати на проведення НДР належать до перед виробничих витрат. Ці
одночасні витрати складаються з: витрат на виконання НДР-
 ;
проектування та користування
;
проектування та користування 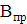
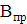 ;
виготовлення обладнання, необхідного для проведення НДР-
;
виготовлення обладнання, необхідного для проведення НДР- 
 ;
освоєння нової техніки-
;
освоєння нової техніки-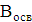
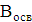 .
.
Кошторис витрат на проведення НДР складеться в укрупненому вигляді та
включає в себе такі статті. Заробітна плата всіх учасників НДР визначається у
таблиці 4.3.
Таблиці 4.3 Витрати на заробітну платню
|
Категорії працюючих
|
Кількість, чол.
|
Посадовий оклад, грн.
|
Час роботи, місяців
|
Основний фонд оплати праці, грн.
|
Додатковий фонд оплати праці, грн.
|
Фонд оплати праці, грн.
|
|
Керівник
|
1
|
1350
|
10
|
13500
|
2700
|
16200
|
|
Старший науковий працівник
|
1
|
1200
|
11
|
13200
|
2640
|
15840
|
|
Молодший науковий працівник
|
2
|
1050
|
11
|
11550
|
2310
|
13860
|
|
Дипломник
|
1
|
300
|
8
|
2400
|
480
|
2880
|
|
Разом:
|
5
|
-
|
-
|
40650
|
8130
|
48780
|
Відрахування у фонд соціального страхування приймаються у
розмірі 37% до фонду оплати праці:
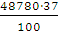
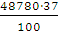 =18048,6
грн.
=18048,6
грн.
Витрати на науково-виробничі відрядження приймаються, умовно, у розмірі
5% до фонду оплати праці:
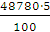
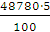 =2439
грн.
=2439
грн.
Контрагентські роботи та послуги ззовні визначають у розмірі 10% до
фонду оплати праці:
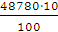
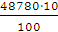 =4878
грн.
=4878
грн.
Витрати на матеріали приймають у розмірі 10% від
фонду оплати праці:
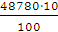
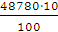 =4878
грн.
=4878
грн.
Витрати на електроенергію становлять:
 =
=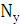
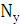 ·
·
 ·
·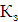
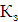 ·
·
 ;
;
де 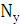
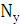 -
встановлена потужність електрообладнання, кВТ;
-
встановлена потужність електрообладнання, кВТ;
 -
ефективний фонд робочого часу обладнання;
-
ефективний фонд робочого часу обладнання;
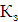
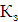 -коефіціент
завантаження обладнання, рівний 0,75;
-коефіціент
завантаження обладнання, рівний 0,75;
 -ціна
1
-ціна
1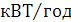
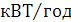 електроенергії.
електроенергії.
 =20·180·0,75·0,3=810
грн.
=20·180·0,75·0,3=810
грн.
Витрати на малоцінний та швидкозношуваний інвентар приймають у розмірі 5% від
вартості обладнання:
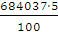
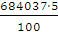 =34201,85
грн.
=34201,85
грн.
Амортизаційні відрахування розраховують у відсотках від вартості
обладнання (
 ),
тобто:
),
тобто:
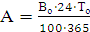
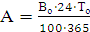 ;
;
де 
 -
час роботи обладнання, дні.
-
час роботи обладнання, дні.
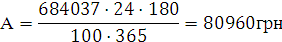
Накладні витрати, які включають витрати на господарські цілі(опалення,
освітлення тощо) приймають 80% до фонду оплати праці:
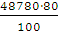
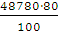 =39024
грн.
=39024
грн.
Загальні витрати на НДР становлять:
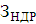
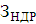 =
=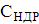
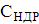 ·1,2;
·1,2;
де 1,2-коефіціент планового накопичення,
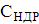
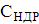 -
сума статей становить собівартість НДР,
-
сума статей становить собівартість НДР,
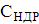
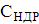 =18048,6+2·4878+2439+810+34201,85+80960+39024=167209,33
грн,
=18048,6+2·4878+2439+810+34201,85+80960+39024=167209,33
грн,
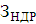
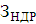 =167209,33·1,2=200651,19
грн.
=167209,33·1,2=200651,19
грн.
Кошторис витрат надамо у вигляді таблиці(див. таблицю 4.4).
Таблиця 4.4 Кошторис витрат на проведення НДР
|
Статті витрат
|
Сума,грн.
|
Метод розрахунку
|
|
Заробітна платня
|
48780
|
З табл. 4.1
|
|
Відрахування до фонду соціального страхування
|
18048,6
|
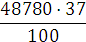
|
|
Витрати на науково-виробничі відрядження
|
2439
|
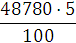
|
|
Контрагентські роботи за послуги ззовні
|
4878
|
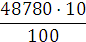
|
|
Витрати на матеріали
|
4878
|
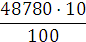
|
|
Витрати на електроенергію
|
810
|
20·180·0,75·0,3
|
|
Витрати на малоцінний та швидкозношуваний інвентар
|
34201,85
|
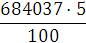
|
|
Амортизаційні відрахування
|
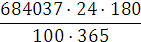
|
|
Накладні витрати, які включають витрати на
господарські цілі
|
39024
|
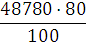
|
|
Сума статей, яка становить собівартість НДР
|
167209,33
|
18048,6+2·4878+2439+810+34201,9+80960+39024
|
|
Загальні витрати на НДР
|
200651,19
|
167209,33·1,2
|
4.4 Оцінка науково-технічного рівня НДР
Для оцінки рівня виконаної дипломної НДР використовується
метод банальних оцінок, згідно якого кожному чиннику за прийнятою шкалою
присвоюється певна кількість балів. Оцінку виконують за дев’ятьма чинниками на
основі запропонованих характеристик чинника та їх значень у балах(таблиця 4.5)
та вагомості чинника(таблиця 4.6).
Таблиця 4.5 Характеристики чинників науково-технічного рівня
НДР
|
Найменування чинника
|
Характеристика
|
Кількісне значення в балах
|
|
1
|
2
|
3
|
|
1.Ступінь новизни
|
1.Пропозиції та винаходи, які полягають у
використанні відомих засобів. 2.Винаходи, які характеризуються сукупним
використанням відомих часткових рішень. 3.Винаходи, які характеризуються
частковою новизною,мають прототип, який співпадає з новим рішенням за
більшістю ознак. 4.Винаходи, які характеризуються повною новизною.
5.Пропозиції, які характеризуються повною новизною.
|
1 2 4 6 10
|
|
2.Рівень отриманого результату
|
1.Опис окремих елементарних чинників, реферативні
чинники, передача та розповсюдження досвіду. 2.Поліпшення незначної кількості
технічних параметрів або потенційна можливість їх поліпшення. 3.Поліпшення
основних технічних параметрів. 4.Позитивне вирішення поставлених задач на
основі простих узагальнень. Аналіз зв’язку між чинниками, розповсюдження
відомих принципів на нові об’єкти, виробництво агрегатів. 5.Досягнення якісно
нового параметру, раніше відсутнього. 6.Отримання нових матеріалів речовин,
виробів, конструкцій тощо серед аналогічних відомих видів. 7.Встановлення
деяких закономірностей; розробка нових пристроїв,методів,способів,
алгоритмів, отримання нових матеріалів, речовин виробів, отриманих вперше.
8.Розробка нових теорій, відкриття загальних закономірностей, отримання
принципово нових результатів, невідомих раніше.
|
1 2 3 4 4 6 8 10
|
|
3.Ступінь теоретичного обґрунтування результату НДР
|
1.Вирішення задачі на основі простих узагальнень.
2.Вирішення задачі на основі використання окремих позитивних закономірностей.
3.Встановлення деяких загальних закономірностей, які можуть бути використані
поза межами даної роботи. 4.Відкриття нового шляху вирішення поставлених
задач.
|
2 4 8 10
|
|
4.Ступінь експериментальної перевірки отриманих
результатів
|
1.Експерементальна перевірка отриманих результатів
не проводилась. 2.Результати перевірені на незначній кількості
експериментальних даних. 3.Результати підтверджені великою кількістю
експериментальних даних.
|
1 4 6
|
|
5.Трудомісткість виконання НДР
|
1. Отримання даного результату не викликало необхідності
у проведенні розрахунків, дослідів та інших досліджень. 2. Отримання
результатів супроводжувалось проведенням нескладних дослідів, розрахунків,
обґрунтувань. 3. Отримання результатів супроводжувалось проведенням складних
експериментів, розрахунків тощо. 4. Отримання результатів є наслідком
особливо складних експериментів, досліджень та розрахунків.
|
1 2 5 8
|
|
6. Перспективність роботи
|
1. Корисні результати в подальшому можуть сприяти
росту продуктивності праці. 2. Важливі результати сприяють (будуть сприяти)
задоволенню нових потреб. 3. Першорядна вагомість результату має значення для
прогресу всієї науки.
|
1 5 10
|
|
7.Рівень досягнення світових стандартів
|
1. Нижче рівня світових стандартів. 2. Наближається
до світових досягнень. 3. На рівні світових стандартів. 4. Вище рівня
світових досягнень
|
1 3 7 10
|
|
8. Рівень реалізації (за обсягом та термінами)
|
На реалізації об’єм реалізації, бали
|
|
|
Народне господарство галузь організація До 3 10 8 4
Від 3 до 5 8 7 3 Від 6 до 10 6 5 2 Понад 10 4 3 1
|
|
|
9.Ступінь наукового результату до практичного
використання
|
1. Напрямок практичного використання на даному етапі
визначити неможливо. 2. Окреслені шляхи практичного використання наукового
результату. 3. Відомі форми використання наукового результату у виробництві та
очікуваний економічний ефект. 4. Практично використовується в сфері
виробництва і споживання; відомий фактичний економічний ефект.
|
2 4 5 8
|
Таблиця 4.6 Вагомість науково-технічного рівня досліджень, %
|
Чинник
|
Фундаментальні дослідження
|
Прикладні дослідження
|
|
1
|
Ступінь новизни
|
15
|
5
|
|
2
|
Рівень отриманого результату
|
15
|
22
|
|
3
|
Ступінь експериментальної перевірки отриманого
результату
|
10
|
15
|
|
4
|
Трудомісткість виконання НДР
|
5
|
10
|
|
5
|
Перспективність
|
15
|
10
|
|
6
|
Рівень досягнення світових стандартів
|
9
|
8
|
|
7
|
Рівень реалізації
|
5
|
15
|
|
8
|
Ступінь наукового результату до практичного
використання
|
5
|
10
|
Загальну оцінку науково-технічного рівня НДР знаходять за
формулою:
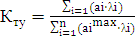
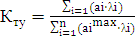 ;
;
де аі - чинник науково-технічного ефекту НДР (приймається з таблиці 6);
n - число і-тих чинників, взятих з оцінки
науково-технічної значимості;
 -
чинник науково-технічної значимості за максимальним значенням балу;
-
чинник науково-технічної значимості за максимальним значенням балу;
 -
вагомість чинника для науково-технічної ефективності НДР, %(приймається з таблиці
4).
-
вагомість чинника для науково-технічної ефективності НДР, %(приймається з таблиці
4).
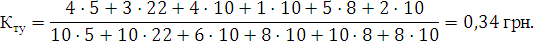
4.5 Визначення економічного ефекту природоохоронних заходів на стадії
досліджень та розробок
Економічний ефект від реалізації природоохоронних заходів визначають за
формулою:
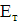 =
=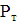
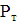 -
-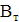
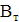 ;
;
де 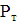
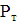 -
вартісна оцінка результату від реалізації природоохоронних заходів за
розрахунковий період Т. В якості розрахункового періоду приймається один рік;
-
вартісна оцінка результату від реалізації природоохоронних заходів за
розрахунковий період Т. В якості розрахункового періоду приймається один рік;
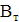
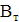 -
вартісна оцінка витрат на реалізацію природоохоронних заходів.
-
вартісна оцінка витрат на реалізацію природоохоронних заходів.
Вартісну оцінку результату для водного басейну розраховують за
формулою:
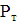
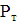 =V·T·(
=V·T·(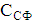
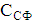 -
-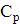
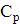 )
)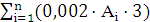
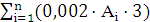 ·К·
·К·
 ;
;
де V- обсяг стічних вод у 
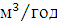 ;
;
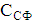
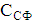 -середня
фактична концентрація забруднюючих речовин в стічних вода, у
-середня
фактична концентрація забруднюючих речовин в стічних вода, у 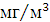
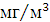 ;
;
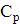
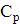 -
дозволена до скиду концентрація забруднюючих речовин, визначена при
затвердженні гранично допустимих концентрацій,
-
дозволена до скиду концентрація забруднюючих речовин, визначена при
затвердженні гранично допустимих концентрацій, 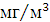
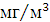 ;
;
,002- базова ставка відшкодування шкоди в частинах неоподаткованого
мінімуму доходів громадян(на одиницю маси речовини), 
 ;
;
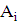
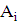 -
показник відносної небезпеки речовини (
-
показник відносної небезпеки речовини (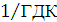
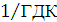 ),
),
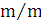
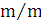 ;
;
К- коефіцієнт,що враховує категорію водного басейну(таблиця 4.7).
Таблиця 4.7 Значення регіонального басейнового коефіцієнту К
|
Басейни морів та рік
|
К
|
|
1
|
Азовське море
|
2,0
|
|
2
|
Чорне море
|
2,0
|
|
3
|
Дунай
|
2,2
|
|
4
|
Дніпро(від кордону України до м. Києва)
|
2,5
|
|
5
|
Дніпро(від м. Києва до Каховського гідровузла)
|
2,2
|
|
6
|
Дніпро(від Каховського гідровузла до Чорного моря)
|
1,8
|
|
7
|
Десна
|
2,5
|
|
8
|
Ріки Кримського півострова
|
2,8
|
|
9
|
Сіверський Донець
|
2,0
|
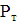
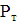 =29505·1·(0,15-0,1)·(0,002·10·3)·2,0·
=29505·1·(0,15-0,1)·(0,002·10·3)·2,0·
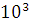 =177033
грн.
=177033
грн.
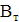 Вт=
Вт=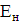
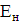 ·
· СНДР;
СНДР;
де Ен - нормативний коефіцієнт ефективності,
 СНДР
- витрати на науково-дослідницьку роботу.
СНДР
- витрати на науково-дослідницьку роботу.
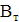 =0,15·2243,3=336,9
грн.,
=0,15·2243,3=336,9
грн.,
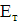
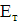 =177033-33647,9=176696,1
грн.
=177033-33647,9=176696,1
грн.
5.ОХОРОНА ПРАЦІ НАВКОЛИШНЬОГО СЕРЕДОВИЩА
5.1 Загальна характеристика умов проведення технологічного
процесу
Охорона праці - це система правових, соціально-економічних,
санітарно-гігієнічних, лікувально-профілактичних, організаційно-технічних
заходів та засобів, що направлені на збереження життя, здоров’я та
працездатності людини у процесі праці. [11]
Актуальність і необхідність охорони праці й навколишнього
середовища полягає в тому, що по статистиці кожен працівник, що постраждав на
виробництві, за якимись причинами не пройшов інструктаж з техніки безпеки.
Поліпшення умов праці є найважливішим завданням соціальної
політики держави. Основні положення статей Закону України «Про охорону
праці»[11] реалізують конституційне право громадян на охорону життя й здоров’я
в процесі праці, а також установлюють єдиний порядок організації охорони праці
в Україні.
.2 Промислова санітарія
Аналіз небезпечних та шкідливих виробничих факторів, що
виникають у технологічному процесі приведені у табл. 5.1, за ГОСТ 12.0.003 -
74* [12]
Таблиця 5.1 Перелік небезпечних та шкідливих виробничих
факторів та іх джерела
|
Небезпечні шкідливі виробничі фактори
|
Джерело виникнення
|
|
Механічні
|
Рушійні частини машин та механізмів (насоси,
транспортери)
|
|
Підвищення рівня шуму>80 дБА
|
Вентиляційні установки, насоси
|
|
Підвищений рівень напруги, 220-380В
|
Щити керування, електродвигуни
|
5.3 Параметри мікроклімату на робочому місці
Метрологічні умови відповідають нормам згідно ГОСТ
12.1.005-88 [13] та ДСН 3.36.042-99 [14] з урахуванням категорії робіт по
енерговитратам під час виконання відповідних технологічних операцій та періоду
року. Вибираємо оптимальні параметри мікроклімату, які наведені у табл. 5.2.
Таблиця 5.2 Припустимі параметри мікроклімату
|
Категорія роботи
|
Період року
|
Температура,°С
|
Відносна вологість,%
|
Швидкість руху повітря, м/с
|
|
Середньої важкості IIб
|
Холодний
|
17-19
|
≤ 75
|
0,2
|
|
Теплий
|
20-22
|
≤ 75
|
0,3
|
5.4 Вентиляція
Для забезпечення нормального мікроклімату передбачені
наступні заходи: вентиляція та опалення в холодні періоди року. Відповідно до
санітарних норм проектування промислових підприємств у щитових приміщеннях та
прилягаючих до них тамбурах та коридорах вміст пилу не повинен перевищувати 2
мг/м3 , що досягається за рахунок загальнообмінної та
приточно-витяжної вентиляції, згідно СНіП 2.04.05-93 [15]. Крім того,
проводиться герметизація обладнання, теплоізоляція, механізація
вантажно-розвантажувальних робіт.
.5 Освітлення
У світлий час доби використовується природне освітлення, у
темний час-штучне. Природне освітлення - бічне, двобічне, через бічні прорізи
взовнішніх стінах приміщень. Для штучного освітлення
застосовуєтьсявологозахищений освітлювач ПВЛМ з розсіювачем на дві люмінесцентнілампи
згідно. У цехах штучне освітлення - загальне. Джерело світла - люмінесцентна
лампа ЛД 80-4, тип освітлювача ПВЛМ 2×40.
Розряд підрозряд зорової роботи IV «в», коефіцієнт природного
освітлення КПО 
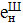 =1,5%,
=1,5%,

 =200лк.
=200лк.
.6 Шум і вібрація
Основними джерелами шуму в цеху є механічне обладнання:
вентилятори, насоси, токарні та фрезерні станки. Відповідно ГОСТ
12.1.003-83*[16] припустимий рівень шуму у виробничому приміщенні не більше 80
дБА. Якщо шум перевищує припустимий рівень, то проводять заходи щодо його
нормалізації згідно ДСН 3.3.6.037-99 [17]:
поліпшення рівня експлуатації робочого обладнання;
використання демпфіруючих матеріалів;
звукоізоляція обладнання кожухами.
.7 Електробезпека і захист від статичної електрики
Виробниче приміщення відноситься до класу приміщень із
підвищеною небезпекою ураження електричним струмом згідно ПУЕ-87[18] (2
категорія).
Пристрій і експлуатація електроустаткування повинні
задовольняти вимогам безпеки ГОСТ 12.1.030-81[19], ПУЕ-87[18]. Захист від
статичної електрики повинний бути зроблений відповідно ДНАОП 0.001.29-97,
ПУЕ-87[18]. Уся силова електропроводка повинна прокладатися в місцях доступних
для зовнішнього огляду.
Відповідно ГОСТ 12.1.030-81[20] для захисту від електроструму
використовують такі заходи: захисне заземлення, застосування електрозахисних
засобів (гумових доріжок, калош), застосування зниженої напруги при проведенні
ремонтних робіт.
Розрахунок групового контурного захисного заземлення щита
керування
Вихідні дані для розрахунку:
. Найбільший припустимий опір заземлюючого пристрою Rдоп=3Ом;
. Довжина одиночного вертикального заземлювача lb=2,4м;
. Діаметр труби одиночного заземлювача d=0,05м;
. Ширина смугового заземлювача b=0,05м;
. Відстань від поверхні землі до верху заземлювача to=0,5м;
. Питомий опір грунту r=250 Ом·м.
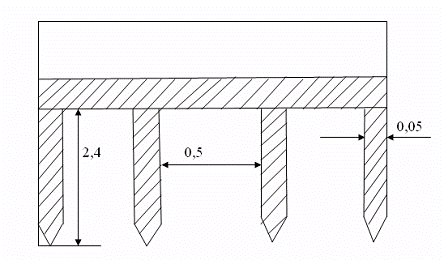
Рисунок 5.1. Контурний заземлюючий пристрій.
Розрахунок опору одиночного вертикального заземлювача:
R=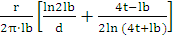
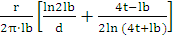 ,
Ом
,
Ом
t-
глибина занурення заземлювача в грунт;
t=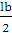
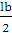 +t0=
+t0=
 +0,5=1,7м
+0,5=1,7м
R=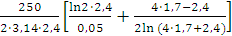
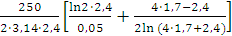 =90,1 Ом
=90,1 Ом
Розрахунок опору горизонтального смугового заземлювача:
а) знаходимо довжину горизонтального заземлювача:
lr=a·n
а- відстань між заземлювачами, м;
a=lb·k=2,4·2=4,8
n-число вертикальних заземлювачів
n=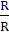
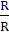 =
=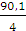
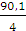 =22,5
=22,5
lr=a·n=4,8·22,5=108
б) знаходимо опір
горизонтального заземлювача:
Rr=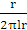
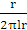 ln
ln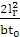
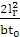
Rr=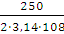
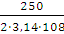 ln
ln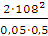
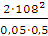 =5,09 Ом
=5,09 Ом
Розрахунок групового контурного заземлюючого пристрою:
Rгг=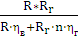
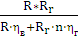
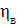
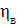 -
коефіцієнт використання вертикальних заземлювачів;
-
коефіцієнт використання вертикальних заземлювачів;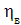
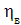 =0,69;
=0,69;
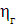
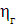 -
коефіцієнт використання горизонтальних заземлювачів;
-
коефіцієнт використання горизонтальних заземлювачів;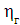
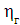 =0,45;
=0,45;
Rгг=
 =3,98 Ом
=3,98 Ом
Rгг<Rдоп
3,98<4
.8 Системи протипожежного захисту
Відповідно до ГОСТ 12.1.004 -91* [20] та ДНАОП 0.01 - 1.01 - 95 [21]
пожежна безпека забезпечується системами запобігання пожежі та протипожежного
захисту, а також організаційно-технічними заходами. Передбачена наявність
внутрішнього водопроводу та зовнішнього з пожежними кранами, для повідомлення
про пожежу - електрична пожежна сигналізація та телефонний зв'язок. Для
запобігання пожежі використовуються первині засоби пожежогасіння -
повітряно-пінний вогнегасник ВПП -10-1 шт., вуглекислий вогнегасник ВВК - 5 - 2
шт., шухляда з піском.
Організаційно-технічні заходи запобігання пожежі:
застосування непальних речовин;
обмеження кількості пальних речовин і їхнє розміщення;
протипожежні розриви між будинками;
періодична очистка приміщень і територій;
ізоляція пальних речовин.
.9 Захист навколишнього середовища
При роботі скиди води піддаються попередньому очищенню.
Проводяться захисні роботи з охорони навколишнього середовища, тому
вихідні дані негативного впливу на навколишнє середовище не чинять. Це можна
побачити в розділі 2.
6. ЦИВІЛЬНА ОБОРОНА
Цивільна оборона України є державною системою органів
управління, сил і засобів, що створюється для організації і забезпечення
захисту населення від наслідків надзвичайних ситуацій техногенного,
екологічного, природного та воєнного характеру.
В данному розділі дипломної роботи розглянута тема: «Аварії з викидом сильнодіючих ядучих
речовин. Захист населення при хімічному зараженні».
Основні заходи i засоби захисту населення i територій.
Основним завданням цивiльного захисту при виникнення
надзвичайних ситуацiй є
захист населення.
Захист населення - це створення необхiдних умов для збереження життя i здоров'я людей у надзвичайних ситуацiях.
Головна мета захисних заходiв - уникнути або максимально знизити
ураження населення.
До системи захисту населення i територiй, що проводяться в масштабах держави
у разi загрози та виникнення надзвичайних
ситуацiй належать: iнформацiя та оповiщення, спостереження i контроль, укриття в захисних
спорудах, евакуація, інженерний, медичний, психологiчний, бiологiчний, екологічний, радiацiйний i хiмiчний захист, iндивiдуальнi засоби захисту, самодопомога,
взаємодопомога в надзвичайних ситуацiях.
Основні причини аварiй на хiмiчно небезпечних об'єктах:
- органiзацiйнi помилки людей;
несправнiсть в системi контролю i забезпечення безпеки виробництва;
поломки вузлiв, устаткування, трубопроводiв, ємкостей або окремих
деталей;
пошкодження у системi запуску i зупинки технологiчного процесу, що може призвести до виникнення
вибухонебезпечної обстановки;
несправності у системi контролю параметрiв технологiчних процесiв;
акти диверсiй, обману або саботажу
виробничого персоналу або сторонніх осiб;
дiя сил
природи i техногенних систем на обладнання.
Значнi аварії
можуть виникнути при витiканнi (викиданні) великої кiлькостi хiмiчно небезпечних речовин. Це може статися за таких обставин:
- при
втраті енергiї, вiдмовi в роботi машин i механiзмiв;
витікання хiмiчно небезпечних речовин iз труб;
використання непридатних матерiалiв;
виникнення екзотермiчiних реакцiй через вихiд з ладу системи безпеки й контролю;
розриву шлангових з'єднань у системi розвантажування;
полiмеризацiї хiмiчно небезпечних речовин у резервуарах
для їх зберiгання.
Факторами ураження при аварiях на хiмiчно небезпечних об'єктах є хiмiчне ураження людей, сiльськогосподарських тварин, зараження
мiсцевостi, ґрунту, води, урожаю, продуктiв харчування, кормів i повiтря.
В Україні функціонує 1810 об'єктiв господарювання, на яких зберiгаються або використовуються у
виробничому процесi понад
283 тис. т сильнодiючих
ядучих речовин, у тому числi - 9,8 тис. т хлору, 178,4 тис. т аміаку.
Цi об’єкти
розподiленi за ступенями хiмiчної небезпеки, перший ступiнь хiмiчної небезпеки (у зонах можливого хiмiчного зараження, в кожному з них
мешкає бiльше 75 тис. осiб) - 76 об'єктів.
Другий ступiнь хiмiчної небезпеки (у зонах можливого хiмiчного зараження, в кожному з них мешкає від 40 до 75 тис. осiб) - 60 об'єктiв.
Третiй ступiнь хiмiчної небезпеки (у зонах можливого хiмiчного ураження, в кожному з об'єктiв мешкає 40 тис. осiб) - 1134 одиниці.
Четвертий ступiнь хімічної небезпеки (зони
можливого хiмiчного зараження, кожна не виходить за межi об'єкта) - 540 одиниць.
У зонах можливого хiмiчного
зараження вiд цих об'єктiв проживає близько 20 млн. осiб адмiнiстративно-територiальна одиниця (АТО) вiднесена
до певного ступеня хімічної небезпеки: до першого ступеня вiднесено 154 АТО (в зонi можливого хiмiчного ураження перебуває бiльше 50 % мешканцiв), до другого ступеня вiднесено 47 АТО (де перебуває вiд 30 до 50 % населення), до третього ступеня - 108 АТО (вiд 10 до 30 % населення).
Правилами технiки безпеки i контролю суворо
регламентуються виробництво, транспортування
i зберiгання СДЯР. Але аварії, катастрофи, пожежi й стихiйнi лиха можуть призводити до руйнування
виробничих споруд, складів, мiсткостей, трубопроводiв, технологiчних ліній. Тому СДЯР можуть потрапити в
навколишнє середовище - на грунт, рiзноманiтнi об'єкти, в повiтря i поширитися на населені пункти, що може призвести до масового отруєння людей i сільськогосподарських тварин. У 1998 р. було 22 аварій з викидом (i загрозою викиду) небезпечних хiмiчних речовин, через що загинув 1 та постраждало 26 осiб.
Потенцiйно небезпечним є накопичення, зберiгання i лiквiдацiя хімічної зброї.
Коротка характеристика осередку хiмiчного ураження
При поширенi у навколишньому середовищi отруйних речовин (ОР) або сильнодiючих ядучих речовин (СДЯР)
утворюються зони хiмiчного зараження i осередки хiмiчного ураження.
Зона хiмiчного ураження - це територiя, яка безпосередньо перебуває пiд впливом хiмiчної зброї або сильнодiючих ядучих речовин i над якою поширилася заражена хмара з
вражаючими концентрацiями.
Зона хiмiчного зараження ОР
характеризується типом застосованої ОР, довжиною i глибиною. Довжина зони хiмiчного зараження це розмiри фронту виливання ОР (за допомогою
авiацi'i) або дiаметр розбризкування ОР пiд час вибуху (бомб чи ракет). Глибина
зони хімічного зараження - це відстань від повітряної сторони регіону
застосування у бік руху вітру, тієї межі, де концентрація ОР стає неуражаючою,
Зона хiмiчного зараження, яка
утворилася в результатi застосування авіацією отруйної речовини, включає район застосування
хімічної зброї, довжиною, шириною, територiю поширення хмари, зараженої отруйною
речовиною, глибиною.
Поширюючись за вітром, заражена хмара може уражати людей,
тварин і рослини на значній відстані від безпосереднього місця потрапляння небезпечних хімічних речовин у навколишнє середовище. Відстань від підвітряної межі площі
безпосереднього зараження до межі, на який перебування незахищених людей,
тварин в атмосфері зараженого повітря залишаєтеся небезпечним, називаєтъся
глибиною небезпечного поширення парів хiмiчнuх речовин. Цi вiдстанi можуть бути до кількох кiлометрiв, інколи навіть кількох десяткiв кiлометрів вiд мiсця безпосереднього застосування чи
аварiйного потрапляння в
навколишнє середовище небезпечних хiмiчних
речовин. [15]
Зона зараження характеризується типом ОР або СДЯР, розмiрами, розмiщенням об'єкта господарювання чи
населеного пункту, ступенем зараженості навколишнього середовища i змiною цiєї зараженості з часом.
Заражене повiтря з парами i
аерозолями затримується в населених пунктах, лiсах, садах, високостеблових
сільськогосподарських
Хiмiчний захист
Хiмiчний захист передбачає виявлення та
оцiнювання радіаційної та хiмiчної обстановки, органiзацiю та проведення дозиметричного i хiмiчного контролю, розроблення типових
режимiв радiацiйного захисту, забезпечення засобами iндивiдуального та колективного захисту,
органiзацiю i проведення знезаражування.
Заходи радіаційного і хімічного методу забезпечуються:
завчасним накопиченням і підтриманням у готовності засобів індивідуального
захисту, приладів дозиметричного і хімічного контролю, якими забезпечуються
насамперед особовий склад формувань, які беруть участь в аварійно-рятувальних
та інших невідкладних роботах, а також персонал радіаційно і хімічно
небезпечних об'єктів і населення, яке проживає в зонах небезпечного зараження
та біля них; терміновим впровадженням засобів, способів і методів виявлення та
оцінювання масштабів і наслідків аварій на радіаційно та хімічно небезпечних
об'єктах; створенням засобів захисту і приладів дозиметричного і хімічного
контролю; підготовкою об'єктів побутового обслуговування і транспортних
підприємств для проведення caнітарної обробки людей та спеціальної обробки одягу, майна і транспорту;
завчасним створенням, пристосуванням та використанням засобів колективного
захисту населення від радіаційного та хімічного ураження, організацією допомоги
населенню в придбані в особисте використання засобів індивідуального захисту і
дозиметрів. [16]
Таким чином, щоб уникнути ситуацій хімічного ураження або
його максимально знизити треба на підприємстві провести заходи по застереженню
від аварій. А якщо це вже сталося то до основних способів захисту населення
належать: iнформацiя та оповiщення, спостереження i контроль, укриття в захисних
спорудах, евакуація, інженерний, медичний, психологiчний, бiологiчний, екологічний, радiацiйний i хiмiчний захист, iндивiдуальнi засоби захисту, самодопомога,
взаємодопомога в надзвичайних ситуацiях.
Висновок
В пояснювальній записці дипломного проекту розглянуті
теоретичні основи процесу електролізу водних розчинів активного хлору. Обрані
електродні матеріали, конструкція електролізеру. Виконана компоновка установки
для електролізу водних розчинів активного хлору.
Проведені розрахунки матеріального, енергетичного і теплового
балансів проектуємої установки. Розрахована кількість електролізерів - 2, що
забезпечить виконання добової програми.
В даній роботі розраховані техніко-економічні показники
дільниці електросинтезу водних розчинів активного хлору басейну спорткомплексу
НТУ “ХПІ”.
Розраховані виробничі площі і їх вартість, вартість
устаткування, основний фонд заробітної платні промислово-виробничого персоналу,
собівартість каустику, строк окупності дорівнює 2,6 роки, що є задовільно.
Розроблені заходи з охорони праці і навколишнього середовища.
Перелік використаної
літератури
1.
Кульский Л.А.,
Строкач П.П. Технология очистки природных вод. - К.: Вища шк. 1986. - 353 с.
2.
Горбачов А.К.
Технічна електрохімія Ч.І. Електрохімічні виробництва хімічних продуктів. -Х.:
ВАТ “Видавництво “Прапор”, 2002. - 254 с.
3.
Банников В.В.,
Савинков С.В., Коренной А.К., Львович Ф.И. Обеззараживание питьевой воды,
обработка воды плавательных бассейнов, приготовление дезинфицирующих растворов
и обезвреживание сточных вод. - М.: НПП “Санер”, 1996. - 32 с.
4.
Установка
электролизная непроточного типа с графитовыми электродами производительностью
25 кг/сутки активного хлора. Московский экспериментальный машиностроительный
завод “Коммунальник”. - М.: 1987, - 40 с.
5.
Якименко Л.М.,
Серышев Г.А. Электрохимический синтез неорганических соединений. - М.: Химия,
1976. - 88 с.
6.
Горбачев
А.К., Тульский Г.Г., Бровин А.Ю., Куликова Т.П. Активация поверхности
отработанных ОРТА оксидами кобальта. Вісник Харківського державного
політехнічного університету. 2000. Вип. 105. с. 55 - 57.
7.
Горбачов
А.К., Тульський Г.Г., Бровін А.Ю. Кінетика анодних процесів на
оксидно-кобальтових титанових електродах та їхня корозійна поведінка при
електролізі водних розчинів хлориду натрію. Вісник Львівського університету.
2002. Вип. 9. Ч.1. с. 200 - 202.
8.
ДСТУ
2293-00. ССБП.ОП. Терміни та визначення. Діє з 01.07.00.
9.
Правила
пристрою електроустановок. ПУЭ-87. - М.: Энергоиздат, 1987. - 648 с.
10.
ДСТ
12.0.003.-74*. ССБТ. Небезпечні і шкідливі виробничі фактори. Класифікація. -
Введ. 01.01.76.
11.
Самойленко
Н.Н., Моисеев В.Ф., Байрачный В.Б. Основы экологии и природопользования.
Методические указания. Х.: 1999-27с.
12.
Бобылев
С.Н. Эффективность природоохранных мероприятий.-М.:1990.-187с.
13.
Глухов
В.В., Лисочкина Т.В., Некрасова Т.П. Экономические основы экологии. Учебник.
Санкт-Петербург: Специальная литература, 1995.
14.
Жадан
Л.В., Папирова Л.Н. Методические указания к выполнению экономической части
научно-исследовательских дипломних работ. Х.:ХПИ, 1992.-40с.
15.
Нестеров
А.П., Нестеров П.М. Экономика природопользования и охрана природы.
М.:1994.-316с.
16.
Нестеров
П.М., Нестеров А.П. Экономика природопользования и рынок. М.: 1995-413с.
17.
Цурик
Є.І. Еколого-економічна ефективність лісокористування: навч. посібник.-К.: У МК
ВО, 1991-52с.
18.
Яремчук
І.Г. Економіка природокористування: навч. посібник.-К.: ”Просвіта”, 2000-431с.
19.
Закон
України «Про охорону праці». -Діє з 21.11.02.
20.
ГОСТ 12.0.003 -
74*. ССБТ. Опасные и вредные
производственные факторы. Классификация. - Введен 01.01.76
21.
ГОСТ 12.1.005 -
88. ССБТ. Общие санитарно гигиенические требования к воздуху рабочей зоны. -
Введен 01.01.89.
22.
ДСН 3.3.6.042 - 99. Санітарні норми мікроклімату
виробничого приміщення.- Київ, 2000.
23.
СН и П 2.04.05 - 91*, Отопление,
вентиляция й кондиционирование воздуха, -М.: Стройиздат, 1993.
24.
ГОСТ 12.1.003 -
83* ССБТ. Шум общие требования
безопасности. - Введен 01.07.89.
25.
ДСН 3.3.6.037 -
99. Санітарні норми виробничого шуму, ультразвуку та інфразвуку. - Київ 1999.
26.
ПУЭ-87. Правила устройства электроустановок.
- М.: Энергоатомиздат, 1988.-648с.
27.
ГОСТ 12.1.030-81
ССБТ. Защитное заземление, зануление.-Введ.01.07.82.
28.
ДБН В. 1.1-7-02.
Пожежна безпека об'єктів будівництва. - Діє з 01.01.03.
29.
Правила и
устройство электроустановок ПУЭ - 87. - М.: Энергоатомиздат,1987.
30.
Стеблюк М.І.
Цивільна оборона: Підручник.-К.: Знання, 2006.-487с.
31.
Кулаков М.А. та ін. Цивільна оборона: Навч. посіб.
для студ. вищ. навч. заклад./За ред.. проф. В.В. Березуцького.-Х.: Факт, 2008.-312с.