Синтез аммиака
Задание
Процесс синтеза аммиака протекает по уравнению
реакции:
2
+ 3H2 = 2NH3
Известно уравнение скорости синтеза аммиака,
полученное Темкиным М. И. и Пыжевым В. М.
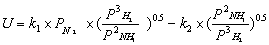

Для расчетов рекомендуются следующие параметры
уравнения Аррениуса для прямой реакции: k01=0,184,
Е1=57000 кдж/моль и для обратной реакции: k02=4,56*1010,
Е2=165000 кдж/моль.
Рекомендуемый диапазон исследования:
· температур от 700 до 925 К;
· степеней превращения от 0 до 0,26;
· давлений от 400 до 600 атм.
Рекомендуемый состав исходной смеси, в мольных
долях: водорода 0,72, азота 0,24, аммиака 0,01, остальное - метан. В уравнении
давление подставлять в атмосферах.
Построить зависимость скорости от температуры,
давления и степени превращения. А также зависимость равновесной степени
превращения от температуры и давления. Рассчитать материальный баланс и
модельную себестоимость для синтеза аммиака.
Содержание
Введение
1. Аммиак и его свойства
2. Получение аммиака
. Потребление и способы
хранения
. Расчет материального
баланса
. Кинетика реакции синтеза
аммиака
. Химическое равновесие в
реакции синтеза аммиака
. Реакторы РИВ и РПС
. Расчет модельной
себестоимости
Заключение
Список используемой литературы
Введение
Соединения азота, в частности, аммиак имеют
исключительно большое значение для всего народного хозяйства, поскольку они
являются составной частью всех белковых соединений и находят широкое применение
во всех областях деятельности человека. Азот - один из наиболее
распространенных элементов в земной коре (около 0,04%), а содержание его в
воздухе составляет 78%. Однако ввиду большой прочности связи в молекуле азота
проблема получения его соединений искусственным путем была решена сравнительно
недавно.
В настоящее время основным
промежуточным продуктом для получения огромного числа различных азотсодержащих
соединений является аммиак, а синтез его из водорода и азота - единственным
крупномасштабным методом производства этого важнейшего продукта.
В связи с этим азотная промышленность по темпам
развития опережает другие подотрасли химической промышленности.
1. Аммиак и его свойства
Аммиак NH3
- простейшее соединение азота с водородом; бесцветный газ удушливым резким
запахом и едким вкусом. Жидкий аммиак практически не проводит электрический
ток, он - хороший растворитель для очень большого числа органических, а также
для множества неорганических соединений. Твёрдый аммиак - бесцветные кубические
кристаллы.
Аммиак был известен древним алхимикам еще со
времен Гебера (VIII
в. н. э.), однако широкого применения не находил. Только в 1-ой половине XIX
в. начинают использовать аммиак, получаемый в качестве побочного продукта на
газовых заводах, а во 2-ой половине XIX
в. - в некоторых коксохимических производствах.
Аммиак - весьма реакционноспособное соединение.
За счёт наличия неподелённой электронной пары у атома N особенно характерны и
легко осуществимы для него реакции присоединения. Наиболее важна реакция
присоединения протона к молекуле аммиака, ведущая к образованию иона аммония NH+,
который в соединениях с анионами кислот ведёт себя подобно ионам щелочных
металлов. Такие реакции происходят при растворении аммиака в воде с
образованием слабого основания - аммония гидроокиси NH4OH,
а также при непосредственном взаимодействии аммиака с кислотами. Аммиак
реагирует также с серой, галогенами, углем, СО2 и др.
Также неразделенная пара электронов на гибридной
орбите и значительная полярность молекул NH3
обуславливает то, что физические свойства его имеют отличия от других
соединений (PH3,
SbH3,,
AsH3):
температуры кипения и плавления относительно высоки, теплота испарения велика.
Аммиак очень хорошо растворим в воде.
NH3
с воздухом и кислородом образует взрывоопасные смеси. В жидком состоянии он при
соприкосновении с кожей вызывает сильные ожоги. Особенно опасно попадание его в
глаза. При высокой концентрации аммиака в воздухе он оказывает удушливое
действие.
. Получение аммиака
Производство синтетического
аммиака их природного газа состоит из следующих основных стадий:
) Очистка природного газа от
соединений серы (так как соединения серы являются катализаторными ядами;
) Конверсия природного газа с
водяным паром с образованием угарного газа и водорода;
) Образовавшаяся газовая смесь
конвертируется с водяным паром, таким образом, чтобы угарный газ превратился в
углекислый;
) Очистка газовой смеси от
соединений кислорода;
) Синтез аммиака.
В лабораторных условиях аммиак
может быть получен вытеснением его сильными щелочами из аммониевых солей по
схеме: 2NH4C1
+ Са(ОН)2 = 2NH3
+ СаС12 + + 2Н2О. Старейший промышленным способ получения
аммиака - выделение его из отходящих газов при коксовании угля. Основной
современный способ его получения - синтез из элементов - азота и водорода.
Наиболее распространённым и
экономичным методом получения технологии, газа для синтеза аммиака является
конверсия углеводородных газов. Исходным сырьём в этом процессе служит
природный газ, а также попутные нефтяные газы, газы нефтепереработки,
остаточные газы производства ацетилена. Сущность конверсионного метода
получения азотоводородной смеси состоит в разложении при высокой температуре
метана и его гомологов на водород и окись углерода с помощью окислителей -
водяного пара и кислорода. К конвертированному газу при этом добавляют
атмосферный воздух или воздух, обогащенный кислородом. Синтез аммиака из
простых веществ протекает с выделением тепла и уменьшением объёма. Наиболее
благоприятными, с точки зрения равновесия, условиями образования аммиака
являются, возможно, более низкая температура и возможно более высокое давление.
Без катализаторов реакция синтеза аммиака вообще не происходит. В
промышленности для синтеза аммиака используют исключительно железные
катализаторы, получаемые восстановлением сплавленных окислов железа Fe3O4
с активаторами (CaO,
SiO2,
а иногда и MgO).
Важный этап процесса синтеза -
очистка газовой смеси от каталитических ядов (к ним относятся вещества,
содержащие S, O2,
Se, P,
As, пары воды, СО и
др.).
Для увеличения степени
использования газа в современных системах синтеза аммиака применяют
многократную циркуляцию азотоводородной смеси - круговой аммиачный цикл (см.
рис.).
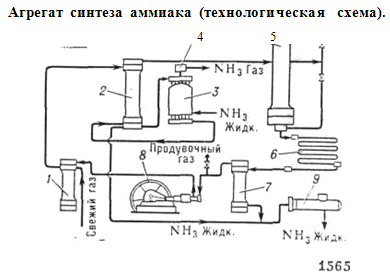
Свежий газ (азотоводородная смесь) и
непрореагировавшне газы поступают сначала в фильтр 1, где они очищаются от
посторонних примесей, затем в межтрубное пространство конденсационной колонны
2, отдавая своё тепло газу, движущемуся по трубкам колонны. Далее газы проходят
через испаритель 3, в котором происходят их дальнейшее охлаждение и конденсация
аммиака, увлечённого циркуляционными газами. Охлаждённая смесь газов и
сконденсировавшийся аммиак из испарителя направляются в разделительную часть
(сепаратор) конденсационной колонны, где жидкий аммиак отделяется и как готовый
продукт выводится по трубе в резервуар 9. Газообразный аммиак, выходящий из
испарителя, проходя брызгоуловитель 4, освобождается от капель жидкого аммиака
и направляется в цех переработки или в холодильную установку на сжижение.
Газы, освобождённые от аммиака, из сепаратора
поступают в колонну синтеза 5. Колонна синтеза внутри имеет катализаторную
коробку с трубчатой пли полочной насадкой и теплообменник. Газы, проходя через
колонну синтеза, реагируют между собой: выходящая из колонны газовая смесь
содержит 15 - 20% аммиака. Далее эти газы поступают в конденсатор 6, где и
происходит сжижение аммиака. Жидкий NH3
отделяется в сепараторе 7 и поступает в резервуар 9, а непрореагировавшне газы
подаются циркуляционным насосом 8 в фильтр 1 для смешения со свежей
азотоводородной смесью.
Производство аммиака -
полностью автоматизированный процесс. Управление агрегата сосредоточено в одном
центральном пункте управления с применением ЭВМ. Единая энерготехнологическая
схема связывает блок синтеза аммиака с предыдущими стадиями производства.
В колонне синтеза выделяется
большое количество реакционного тепла, которое используется на подогрев
питательной воды, направляемой для получения пара давлением 10,3 МПа.
. Потребление и способы хранения
Потребление. Аммиак используется для
производства азотной кислоты и азотсодержащих солей, мочевины, синильной
кислоты. Также он используется при получении соды по аммиачному способу, в
органическом синтезе, для приготовления водных растворов (нашатырный спирт),
находящих различное применение в химической промышленности и в медицине; в
холодильных машинах.
Жидкий аммиак, а также его растворы применяют в
качестве жидких удобрений. Большое количество аммиака идет на аммонизацию суперфосфата
и туковых смесей.
Хранение. Вопросы хранения
жидкого аммиака приобрели в последние годы особую актуальность в связи с резким
ростом мощностей агрегатов, увеличением потребления аммиака сельским хозяйством
и расширением его экспортных поставок. Периодичность сельскохозяйственного и
экспортного спроса на жидкий аммиак при непрерывном процессе его промышленного
производства выдвинула проблему создания высокоэкономичных крупнотоннажных
хранилищ жидкого аммиака. Кроме заводских складов в последние годы созданы
крупные прирельсовые склады "Сельхозтехники", припортовые склады,
раздаточные станции аммиакопровода, глубинные склады колхозов и совхозов.
Аммиак хранят на складах при различном давлении.
Хранение при повышенном
давлении. Жидкий аммиак хранят в горизонтальных (цилиндрических) и шаровых
резервуарах под избыточным давлением до 2 МПа включительно, без отвода
испаряющегося аммиака.
В закрытом резервуаре
пространство над быстро испаряющимся жидким аммиаком всегда насыщено его
парами, которые оказывают давление на стенки. Каждой температуре жидкого
аммиака в состоянии равновесия соответствует определенное давление его паров.
При обычной температуре (до 25 °С) давление паров жидкого аммиака достигает 1
МПа, а при 40 °С - до 1,6 МПа, что определяет необходимость тщательного
контроля за температурой с целью предотвращения возникновения давлений, выше
допустимых. В зависимости от климатических условий хранилища устанавливают в
закрытом помещении или на открытом воздухе.
Хранение при среднем давлении.
Жидкий аммиак хранят в шаровых резервуарах с теплоизоляцией под избыточным
давлением от 0,3 до 1 МПа включительно. Заданное давление поддерживают
конденсацией испарившегося аммиака с возвращением его в резервуар или выдачей
испарившегося аммиака потребителям.
Хранение при атмосферном
давлении. Жидкий аммиак хранят в вертикальных резервуарах с теплоизоляцией, при
температуре около -33 °С, под давлением, близким к атмосферному. Давление
поддерживают так же, как в предыдущем случае. Указанный способ хранения
называется изотермическим.
. Расчет материального баланса
аммиак
синтетический реактор вытеснение

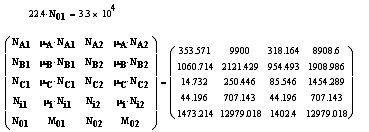
Технологические показатели.
Моль вещества - совокупность числа Авагадро
(6,02*1023 моль-1) структурных элементов (молекул,
атомов). Объем 1 моля идеального газа = 22,4 м3 при нормальных
условиях.
Молярная масса - отношение массы вещества к
количеству вещества. То есть это масса одного киломоля, которую можно
рассчитать с помощью таблицы Д. И. Менделеева.
Степень превращения - отношение количества
прореагировавшего вещества к тому веществу, которое было подано в реактор.

Мольная доля вещества - отношение мольного
потока вещества к мольному потоку смеси (отношение числа молей компонента к
общему числу молей в смеси).
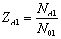
Стационарный режим работы реактора - режим, при
котором все параметры процесса во времени не изменяются. Условие стационарности
заключается в том, что алгебраическая сумма скоростей подвода и отвода каждого
из веществ равна нулю. Количество уравнений в системе равно количеству веществ,
принятых в расчет, в том числе и инертных. Система уравнений условия
стационарности:
Селективность - отношение количества конечного
продукта к количеству продукта, который получился из всего прореагировавшего
вещества с учетом стехиометрических коэффициентов.
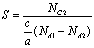
Производительность:
мольная Пс = NC2
- NC1
= c´e;
массовая Пс = MC2
- MC1
= mc
(NC2
- NC1)
=mc
´c´e;
объемная Пс = VC2
- VC1
= 22,4 (NC2
- NC1)
= 22,4 ´c´e.
Интенсивность - отношение производительности к
объему реактора.
Основные этапы расчета материального баланса:
· формализация условий (упрощение);
· определения перечня и количества
неизвестных;
· составление системы линейных
уравнений;
· расчет корней этой системы;
· проверка и оформление результатов.
Правильность расчета материального баланса:
· нет отрицательных чисел;
· выполняется закон сохранения массы
вещества;
· при подстановке выполняются все
условия.
5. Кинетика реакции синтеза аммиака
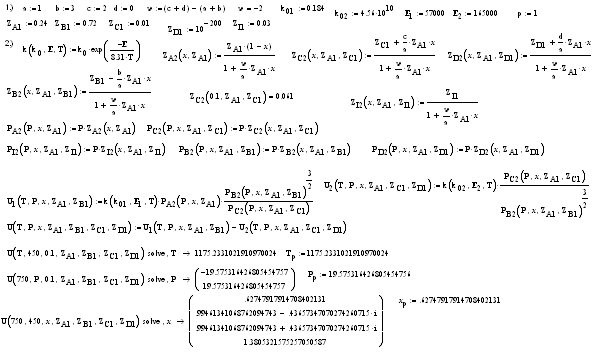
1. Зависимость скорости реакции
от температуры.
Скорость прямой и обратной
реакций увеличиваются с ростом температуры. На форму кривых не влияют
предэкспонентные сомножители. Они представляют собой константы и могут лишь
менять масштаб изображения.
Таким образом, на степень
изогнутости кривых влияет энергия активации и стехиометрические коэффициенты
реакции. Так как реакция экзотермическая (Е2 > Е1), то
энергия активации для обратной реакции больше, чем для прямой. Поэтому сильнее
изогнута кривая скорости обратной реакции.
U
= U1
- U2
> 0. Чем больше показатели степени, тем больше
изогнуты кривые. Кривая наблюдаемой скорости проходит через максимум и
пересекает абсциссу. Имеется две характерные точки: оптимальная и равновесная
температура.
Оптимальная температура -
температура, при которой скорость максимальна. Химическое равновесие -
состояние, при котором скорость прямой и обратной реакции равны.
. Зависимость скорости реакции
от давления.
Реакция протекает с уменьшением
объема. U = U1
- U2
< 0. Скорость прямой реакции увеличивается с
ростом давления. На форму кривых скоростей влияет степень, в которую возведено
давление смеси. Поэтому скорость обратной реакции уменьшается с ростом
давления. Таким образом, наблюдаемая кривая скорости имеет минимум. В точке,
где обе скорости равны, наступает состояние химического равновесия. Равновесным
называется давление, при котором скорость обратимой реакции равна 0.
. Зависимость скорости реакции
от степени превращения.
Кривая зависимости скорости
реакции от степени превращения убывает. Скорость прямой реакции зависит от
концентрации исходных веществ. Таким образом, по мере протекания процесса
концентрация исходных веществ уменьшается (вещества расходуются),
соответственно скорость прямой реакции также уменьшается.
При степени превращения равной
0 концентрация исходных веществ максимальна, следовательно, и скорость прямой
реакции максимальна. Если исходные вещества полностью прореагировали (х=1), то
концентрация исходных веществ равна 0 и, следовательно, скорость прямой реакции
также равна 0.
По мере протекания реакции
увеличивается концентрация конечных веществ, следовательно, скорость обратной
реакции также увеличивается.
Поскольку наблюдаемая скорость
представляет собой разность скоростей прямой и обратной реакций, то она с
ростом степени превращения уменьшается. В точке, где обе скорости сравниваются,
наблюдаемая скорость становится равной 0 и наступает химическое равновесие.
Химическая кинетика - учение о
химическом процессе, его механизме и закономерностях развития во времени.
Скорость химической реакции -
изменение количества вещества в единицу времени (изменение концентрации
реагирующего вещества в единицу времени).
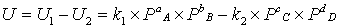
(произведение парциальных
давлений в степенях, которые равны стехиометрическим коэффициентам).
Парциальное давление - произведение общего давления на мольную долю: PA
= P´ZA1
Обратимые реакции - протекают
одновременно как от исходных веществ к продуктам, так и наоборот.
Ключевое вещество - то, которое
находится в недостатке от стехиометрии. Порядок реакции - сумма показателей
степеней при концентрациях уравнения скорости. Объемная концентрация -
отношение количества вещества к объему.
Константа скорости -
произведение предэкспоненты на экспоненту.
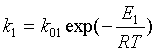 ;
; 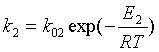
Уравнение Аррениуса.
E1
- энергия активации - энергия, имея которую молекулы вступают в химическое
взаимодействие;
R
- универсальная газовая постоянная = 8,31´103.
6. Химическое равновесие в реакции синтеза
аммиака
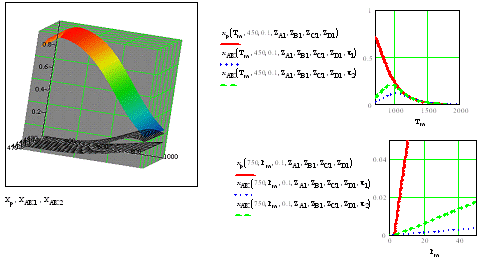
Зависимость степени превращения от температуры.
Из графика видно, что с увеличением температуры равновесная степень превращения
уменьшается. Это объясняется тем, что согласно принципу Ле Шателье увеличение
температуры усиливает эндотермическое направление реакции. Сильнее
увеличивается скорость обратной реакции, чем прямой, процесс идет в сторону
исходных веществ (до тех пор, пока при меньшей степени превращения скорости
прямой и обратной реакции не сравняются). При дальнейшем увеличении температуры
снова происходит вышеописанное. Если увеличение температуры происходит на
бесконечно малые интервалы, то степень превращения бесконечно малыми шажками
уменьшается. Это называется равновесным процессом.
Зависимость степени превращения от давления. С
увеличением давления равновесная степень превращения увеличивается. По принципу
Ле Шателье это можно объяснить тем, что, поскольку реакции протекает с
уменьшением объема, сильнее увеличивается скорость обратной реакции.
Химическое равновесие - состояние, при котором
скорость прямой реакции равна скорости обратной. Химическое равновесие в
обратимых процессах достигается в случае, если процесс длится бесконечно долго,
это возможно, если реактор будет иметь бесконечный объем и бесконечную длину.
Равновесным называется параметр, при котором
скорость обратимой реакции равна 0. Чаще всего в ходу равновесная степень
превращения. Равновесный параметр можно рассчитать, используя либо уравнение
скорости (которое необходимо приравнять к нулю), либо выражение для константы
равновесия.
Так как функциональная зависимость от х очень
сложна, то аналитически решить уравнение относительно х практически невозможно.
Такое уравнение называется трансцендентным. Корни его находят численным
способом, ищут такое значение х, при котором скорость реакции равна 0.
Катализаторы не влияют на химическое равновесие,
они влияют на скорость установления равновесия. Катализатор ускоряет как прямое
превращение, так и обратное.
Принцип Ле Шателье: если на систему, находящеюся
в состоянии равновесия, производить внешнее воздействие, изменяя какое-нибудь
из условий, определяющих положение равновесия (температура, давление,
концентрация), то оно благоприятствует протеканию той из двух противоположных
реакций, которая ослабляет это воздействие. Химическое равновесие является
устойчивым: если систему вывести из равновесия, то она самопроизвольно вернется
в равновесное состояние.
Меняться форма кривых будет до тех пор, пока
скорость прямой реакции не сравняется со скоростью обратной. Таким образом,
система среагировала на внешнее воздействие.
7. Реакторы РИВ и РПС
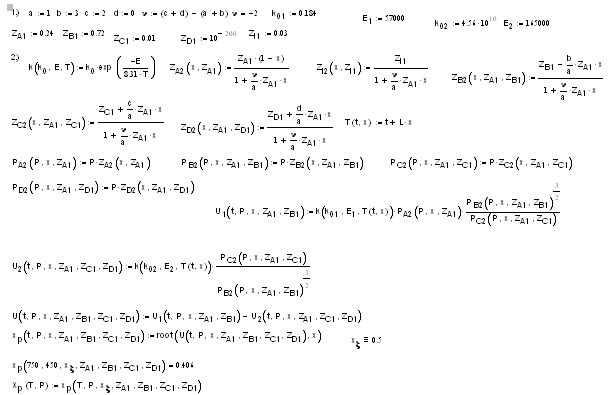
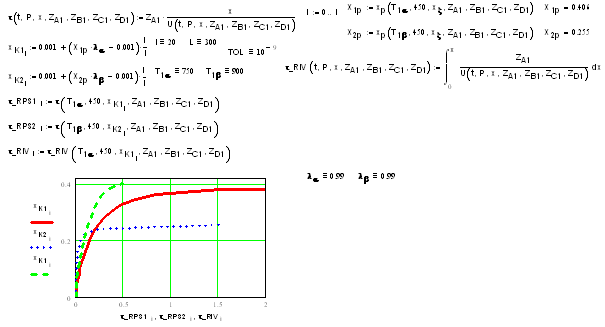
Зависимость степени превращения от времени
пребывания:
С увеличением времени пребывания газовой смеси в
адиабатических реакторах с экзотермической реакцией степень превращения растет
и стремится к своему равновесному значению. Причем степень превращения никогда
не сможет превысить значение равновесного, поскольку по мере приближения к
равновесию скорость химического превращения стремится к нулю.
Из графика также следует, что при меньшей
температуре исходной смеси достигается более высокая равновесная степень
превращения. Это объясняется графиком зависимости степени превращения от
температуры.
С увеличением температуры газовой смеси внутри
реактора скорость проходит через максимум. В числители уравнения материального
баланса РПС стоит конечная степень превращения, а в знаменателе - скорость
реакции. Таким образом, S-образная
форма кривых для адиабатических РПС с обратимой экзотермической реакцией
объясняется тем, что скорость проходит через максимум.
Время пребывания в адиабатическом РИВ больше,
чем в РПС (за исключением случая, когда степень превращения близка к равновесной).
Сравнивая площади криволинейной трапеции и прямоугольника, видно, что меньше
будет площадь прямоугольника.
По мере приближения степени превращения к своему
равновесному значению, время пребывания стремится к бесконечности и скорость
реакции стремится к нулю.
Классификация реакторов.
) Временной режим работы реактора:
а) Реакторы периодического действия;
б) Реакторы непрерывного действия;
в) Реакторы с полунепрерывным режимом;
г) Реактором с принудительным нестационарным
режимом.
) По тепловому режиму:
б) Адиабатические - реакторы, в которых процесс
происходит без теплообмена с окружающей средой;
в) Политермические;
) По характеру движения потоков:
а) РПС - абстракция, согласно которой в любой
точке реактора одинаковые значения параметров.
б) РИВ - абстракция, согласно которой молекулы
вещества движутся внутри элементарного слоя, при этом не перемешиваются ни в
продольном, ни в поперечном направлении (поршневой двигатель). На основе РИВ и
РПС составляется система уравнений.
в) ячеечные реакторы.
Математическая модель - система уравнений, с
помощью которой можно рассчитать параметры процесса и размера реактора.
Зависимость концентрации от времени пребывания
смеси в реакторе:
Характеристическое уравнение (уравнение
материального баланса) - с его помощью можно рассчитать время превращения,
объем реактора, объемный расход и концентрацию на выходе из реактора.
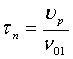
РИВ: 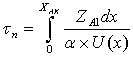 РПС:
РПС:
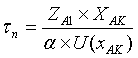 ,
где
,
где
A1
- концентрация ключевого вещества на входе в реактор;
U(xAK)
- скорость реакции по ключевому веществу в любой точке РПС;
U(х) - текущая
скорость в сечении РИВ обратимой газофазной реакции по ключевому веществу А;
ά - коэффициент
согласования размерности числителя и знаменателя. Числитель: количество
вещества А, которое превратилось в продукт.
Знаменатель: скорость превращения (скорость
реакции). ά = 1.
Уравнение адиабаты: 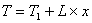 ,
где
,
где
Т - текущая температура газа;
Т1 - начальная температура;
L - коэффициент
адиабатического разогрева (охлаждения), К. Он показывает, на сколько изменится
температура газа в смеси в случае полного превращения ключевого вещества А, то
есть при х = 1. 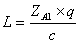 , где
, где
q - тепловой эффект
реакции;
с - средняя теплоемкость газовой смеси.
8. Расчет
модельной себестоимости
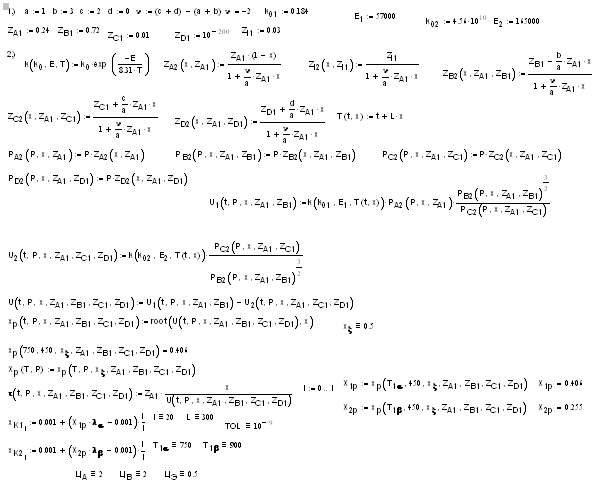
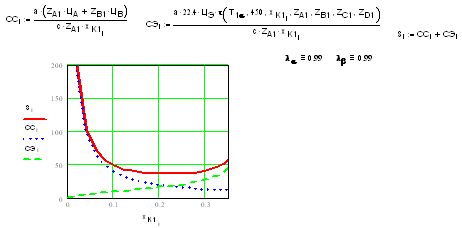
Из графика видно, что сырьевая компонента
себестоимости СС убывает с увеличением степени превращения, а эксплуатационная
СЭ увеличивается. В результате суммарная себестоимость имеет минимум.
Рост эксплуатационной себестоимости, которая
пропорциональна объему реактора и времени пребывания смеси, объясняется тем,
что по мере приближения степени превращения к своему равновесному значению
скорость обратимой реакции стремится к 0, а время пребывания - к бесконечности.
Рост сырьевой компоненты с уменьшением степени
превращения вызван тем, что на производство единицы продукции затрачивается все
больше исходных веществ (сырья). Чем хуже перерабатывается сырье, тем больше на
него затрат и тем выше величина сырьевой компоненты себестоимости.
Минимальная себестоимость определяет оптимальную
степень превращения.
Сырьевая компонента складывается из приведенных
затрат на сырье: 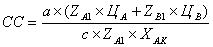 , где ЦА,
ЦВ - цены на сырье.
, где ЦА,
ЦВ - цены на сырье.
Эксплуатационная компонента: 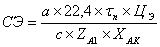 ,
где ЦЭ - удельная цена на обслуживание единицы объема реактора.
,
где ЦЭ - удельная цена на обслуживание единицы объема реактора.
Заключение
Современное производство
синтетического аммиака состоит из ряда последовательных технологических стадий,
сосредоточенных в отдельных блоках: сероочистки природного газа, конверсии
метана, конверсии СО, очистки синтез-Газа от СО2, метанирования,
компрессии, синтеза аммиака, объединенных по технологическому принципу и, кроме
того, по энергетическому - единой системой парового цикла.
Характерной особенностью блока
отделения синтеза аммиака является то, что здесь образуется и выделяется жидкий
аммиак - товарный продукт. От остальных стадий производства синтез аммиака
отличается применением высокого давления, наличием циркуляционного газового
контура, использованием холода. На этой стадии выделяется и утилизируется
наибольшее количество реакционного тепла.
Блок синтеза характеризуется применением
сложной и разнообразной реакционной и теплообменной аппаратуры, для
изготовления которой используются высококачественные стали. По капитальным
затратам он один из самых весомых в аммиачном производстве.
Выбор технологических схем,
аппаратурного оформления и экономические показатели производства аммиака во
многом определяются свойствами катализаторов синтеза: его активностью,
стабильностью, механической прочностью, в связи с чем к качеству катализатора
предъявляют самые высокие требования.
Исследования каталитического
синтеза аммиака проводились учеными разных стран, поэтому решение этой проблемы
носит интернациональный характер. Профессор В. И. Кузнецов отмечал:
"Синтез аммиака имеет исключительное значение среди других реакций:
во-первых, он связан с решением одной из главных практических проблем, а
именно, с созданием мощной сырьевой базы для получения самых разнообразных
органических и неорганических азотсодержащих соединений; во-вторых, он является
исторически первым примером практического объединения трех направлений
физической химии - термодинамики, кинетики и катализа - при решении комплексной
теоретической проблемы и, наконец, в-третьих, с синтезом аммиака связаны первые
эмпирические обобщения по подбору катализаторов".
Таким образом, можно сделать
вывод о том, что исследование реакции синтеза аммиака очень важно в современной
химической промышленности, а также при связи технологических параметров с
экономическими.
Список используемой литературы
1. Кузнецов Л. Д., Дмитренко Л.
М., Рабина П. Д., Соколинский Ю.А. "Синтез аммиака", - под редакцией
Л. Д. Кузнецова, - М.: Химия, 1982 год, - 296 с.
2. "Химико-технологические
расчеты с применением MathCAD",
учебное пособие под редакцией Луцко Ф. Н., Сороко В.Е., Прокопенко А.Н. - СПб.:
СПбГТИ(ТУ), 2006 год, - 456 с.
. Семенов В. П., Киселев Г.
Ф., Орлов А.А., Коновалов В. М. "Производство аммиака", под редакцией
Семенова В. П. - М.: Химия, 1985 год, - 368 с.
. "Общая химическая
технология": Учебник для ВУЗов под редакцией А. М. Кутепов, Т. И. Бондарева,
М. Г. Беренгартен. - 3 издание, перераб. - М.: ИКЦ "Академкнига",
2003 год, - 528 с.