׃
Студент
ИСХиПР
Группы
6651
Сыров
Константин Михайлович
Великий Новгород 2010 год
АГРЕГАТ СИНТЕЗА АММИАКА
Физико-химические
основы синтеза аммиака
Реакция синтеза
аммиака из газообразных азота и водорода является обратимой и протекает по
уравнению
H2+N2=2NH3+22 ккал.
При определенных
условиях наступает состояние равновесия между прямым и обратным процессами, при
котором невозможно дальнейшее увеличение содержания аммиака в газовой смеси. На
практике стараются создать такие условия, при которых равновесие реакции
сдвигается в сторону образования аммиака из азота и водорода.
Так как реакция
синтеза аммиака сопровождается уменьшением объема газовой смеси вдвое, то для
сдвига равновесия вправо, согласно принципу Ле Шателье, процесс следует
проводить при повышенном давлении. В промышленности установки по производству
синтетического аммиака работают под давлением 300-900 ат.
Реакция синтеза
протекает с выделением тепла. Поэтому согласно принципу Ле Шателье, с
повышением температуры равновесие реакции сдвигается влево, т. е. чем выше
температура, тем меньше азота и водорода вступают в реакцию. При низкой
температуре реакция синтеза аммиака протекает более полно.
Однако с понижением
температуры скорость большинства химических реакций, в том числе и скорость
реакции синтеза аммиака, уменьшается. Поэтому для обеспечения значительной
скорости образования аммиака реакцию необходимо проводить при достаточно
высокой температуре. Практически синтез аммиака ведется при температуре 450-
500° С, при которой реакция протекает достаточно быстро и содержание аммиака в
газовой смеси сравнительно высоко.
По закону действия
масс для сдвига равновесия реакции синтеза аммиака вправо необходимо в
равновесной газовой смеси увеличить концентрацию азота и водорода или уменьшить
концентрацию аммиака. Последнее осуществляется на практике. После того, как из
азота и водорода образовалось некоторое количество аммиака, газовую смесь
выводят из колонны синтеза и освобождают ее целиком или частично от аммиака.
Затем к газовой смеси добавляют свежие азот и водород и вновь пропускают ее через
колонну синтеза. Повторяя этот процесс непрерывно, добиваются почти полного
использования азотоводородной смеси.
Образовавшийся
аммиак выделяется из газовой смеси путем конденсации его. Превращение
газообразного аммиака в жидкость, т. е. процесс конденсации, осуществляется
охлаждением газовой смеси водой и испаряющимся аммиаком. В системах синтеза
аммиака, работающих при давлениях 300 ат и ниже, охлаждение газовой
смеси производится в две стадии: водой в скоростных холодильниках и
испаряющимся жидким аммиаком - в аммиачных испарителях.
Содержание аммиака
в газовой смеси на выходе из колонны синтеза зависит еще и от объемной
скорости. Чем больше последняя, тем меньше времени газовая смесь находится в
колонне синтеза аммиака, заполненной катализатором. С увеличением объемной
скорости содержание аммиака в газовой смеси уменьшается.
Для каждого
давления существует своя оптимальная объемная скорость газа, обеспечивающая
максимальное использование катализатора и максимальную производительность всех
аппаратов, входящих в систему синтеза аммиака.
В зависимости от
величины давления азотоводородной смеси системы синтеза аммиака делятся на три
типа:
. Системы,
работающие при низких давлениях (90- 100 ат).
. Системы, работающие при средних давлениях (200- 350 ат).
3. Системы,
работающие при высоких давлениях (500- 1000 ат).
Широкое
распространение в Советском Союзе и за границей получили системы синтеза
аммиака, работающие при средних давлениях. Системы низкого давления в виду их
сложности в промышленности применяются мало.
Катализатор
синтеза аммиака должен быть активным при
определенных условиях в течение длительного времени и стойким к ядам.
Каталитическими
свойствами по отношению к реакции синтеза аммиака обладают многие металлы.
Наибольшее промышленное применение получили железные катализаторы, являющиеся
по сравнению с другими особенно активными и дешевыми в изготовлении.
Железо приобретает
каталитическую активность лишь в том случае, если оно приготовлено
восстановлением окислов железа при определенных условиях.
Не вся масса
катализатора обладает активными свойствами, а лишь отдельные его участки,
называемые активными центрами. Чем меньше частицы катализатора, тем более
развита его поверхность, тем активнее катализатор.
К железному
катализатору добавляют окись алюминия Аl2О3 и окись калия
К2О, которые являются
активаторами катализаторов. Активаторы не ускоряют реакцию синтеза аммиака, а
улучшают физическую структуру катализатора, повышают его устойчивость,
увеличивают число активных центров. Окись алюминия обволакивает кристаллы
железа тонкой пленкой, которая мешает взаимодействию атомов железа и росту
кристаллов. Однако окись алюминия обладает свойством адсорбировать, т. е.
удерживать на своей поверхности образовавшийся аммиак, что является крайне
нежелательным. Для подавления адсорбционной активности окиси алюминия в
катализатор вводят второй активатор К2О.
В дважды
промотированных (содержащих два активатора) катализаторах отношение количеств Аl2О3 и К2О должно быть близким к 2 : 1 .
Сырьем для
получения катализаторов являются железо и магнитная железная руда. Процесс
приготовления катализатора состоит из двух стадий: получения окислов железа и
восстановления их водородом до металлического железа.
Технический процесс
получения катализатора синтеза аммиака из железной руды осуществляется
следующим образом: концентрат подвергают трехкратной сепарации, восстановлению
в печи с помощью водорода и электроплавке в индукционных печах, затем плав
окисляют, охлаждают и дробят. Готовый катализатор сортируют.
С июня 1967 г.
введен первый ГОСТ на катализатор синтеза аммиака СА-1 (ГОСТ 12411-66). В
соответствии с указанным ГОСТ лимитируется содержание промотирующих и примесных
компонентов. Содержание окиси алюминия в катализаторе должно быть в пределах 3
- 4%. При содержании в катализаторе 2% Аl2О3 резко
уменьшается его устойчивость, а при содержании 6% Аl2O3, значительно снижается активность катализатора. Оптимальное
содержание К20 0,7-1%.
В катализаторе
допускается наличие SiO2 - до
0,7% (примесь сырья) и МgО - до 0,7% (примесь, попадающая при проведении плавки в
магнезитовых тиглях). Содержание вредных примесей (Си, Ni, S) должно быть минимальным.
С целью повышения
механической прочности катализатора ГОСТ предусматривает уменьшение степени
окисления катализаторного плава (FеО -29-36%) и выпуск гранулированного катализатора с размером
зерен (гранул) -не менее 3 мм.
Вторая стадия
приготовления катализатора - восстановление окислов железа до элементарного
железа водородом - в большинстве случаев проводится в колоннах синтеза аммиака.
Процесс
восстановления катализатора протекает по уравнениям:
FеО + Н2 = Fе + Н2О;
Fе2О3 + ЗН2 =2Fе + ЗН2О
Fе304 + 4H2 =ЗРе + 4Н20.
Водяные пары
конденсируются в конденсаторах и отделяются от газовой смеси в сепараторах и в
конденсационной колонне. Реакции восстановления окислов железа эндотермичны и
протекают лишь при нагревании, которое осуществляется с помощью
электроподогревателя.
Восстановление
окислов железа проводят при постепенном повышении температуры и давления.
Объемная скорость водорода при восстановлении катализатора должна быть не ниже
10 000 м3 на 1 м3 катализатора
в час. Режим восстановления катализатора контролируется по часовому количеству
воды, выделяющейся в сепараторах. Процесс восстановления катализатора в колонне
синтеза аммиака протекает в течение 5-6 суток.
О готовности
катализатора судят по количеству выделившейся реакционной воды и по содержанию
аммиака в ней. Общее количество выделившейся аммиачной воды при полном
восстановлении 1 м3 катализатора
должно составлять 0,6-0,8 м3.
Содержание аммиака в воде 80- 90% вес.
В последнее время
разработана методика восстановления катализатора синтеза аммиака
непосредственно в цехах приготовления катализаторов. Процесс восстановления
осуществляется под давлением 10-15 ат при объемной скорости водорода
2000-3000 м3 на 1 м3 катализатора в час.
Восстановление катализатора длится в течение 4 суток с повышением температуры
от 380 до 500° С (через каждые 12 ч -на 25°). После восстановления
катализатор азотируют и пассивируют при температуре 200° С, а затем производят
его поверхностное окисление при содержании в газе 0,2% кислорода.
В процессе работы
катализатор может отравляться катализаторными ядами, в результате чего его
активность снижается или полностью исчезает.
Отравление
катализатора, как известно, бывает временным и постоянным. Такие вещества, как
кислород, окись углерода, углекислый газ и пары воды вызывают временное
отравление катализатора. Последний под действием этих веществ теряет свою
активность и вновь восстанавливает ее при пропускании чистой азотоводородной
смеси, не содержащей указанных веществ. Постоянное отравление катализатора
является необратимым. Оно наступает при действии мышьяка, фосфора и соединений
серы. Восстановить активность катализатора при отравлении его этими веществами путем
пропускания чистой азотоводородной смеси не удается.
При попадании на
катализатор паров воды металлическое железо окисляется и теряет свою
активность. Процесс отравления катализатора водяными парами протекает по
уравнениям:
Fе + Н2О = FеО + Н2;
Fе + ЗН2О = Fе2О3 + ЗН2.
При пропускании
через катализатор азотоводородной смеси, не содержащей паров воды, идет
обратный процесс восстановления окислов. Содержащиеся в азотоводородной смеси
окислы углерода реагируют с водородом по уравнениям
СО +ЗН2=СН4 + Н2О
CO2+4H2=СН4+ 2Н20.
Образующиеся
водяные пары взаимодействуют затем с железом катализатора. Содержание окиси
углерода в азотоводородной смеси не должно превышать 0,002%, двуокиси углерода
- 0,0001%.
Отрицательное
действие на активность катализатора оказывают также масла, уносимые свежей
азотоводородной смесью из компрессоров высокого давления и циркуляционным газом
- из поршневых циркуляционных насосов. Поэтому газ после сжатия в поршневых
машинах должен подвергаться тщательной очистке от капелек масла.
Срок непрерывной
работы колонны синтеза зависит от ряда факторов: степени очистки
азотоводородной смеси от катализаторных ядов, режима восстановления
катализатора и состояния насадки колонны. Замена катализатора производится один
раз в два года. Однако в практике нередки случаи, когда срок непрерывной работы
колонны превышает три года.
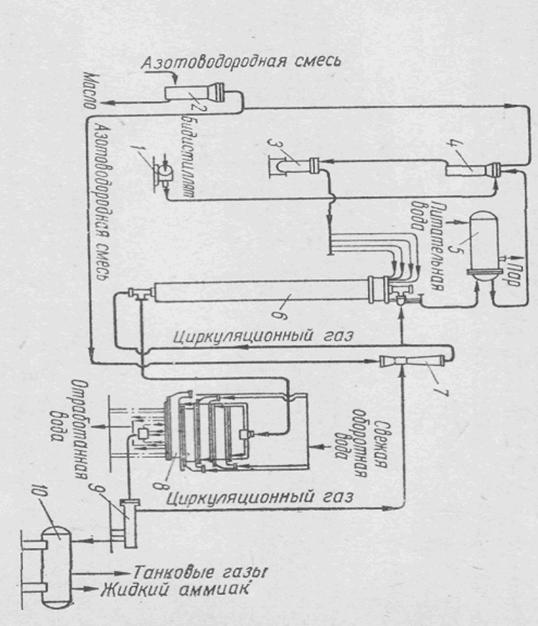
Рис 1. Схема агрегата высокого давления
На рисунке
представлена схема агрегата синтеза аммиака под давлением 500 ат с
использованием тепла, выделяющегося в результате реакции, для получения
водяного пара.
Азотоводородная
смесь под давлением 520 ат поступает в фильтр 2, где очищается от
масла, и направляется в инжектор 7. Циркуляционный газ подсасывается в инжектор
струей свежего газа. Газовая смесь подается в колонну синтеза 6, состоящую
из катализаторной коробки с теплоотводящими устройствами, теплообменника и
электроподогревателя. Из колонны газ, содержащий около 18-21% аммиака, при
температуре 100-120° С поступает в водяной конденсатор 8, где
охлаждается до 35° С. При этом конденсируется весь аммиак. Из конденсатора 8
газ направляется в сепаратор 9, где отделяется жидкий аммиак,
поступающий затем в сборник 10. Циркуляционный газ после сепаратора
возвращается во всасывающую линию инжектора 7. Тепло, выделяющееся в результате
реакции синтеза, используется для получения пара по двухконтурной схеме,
аналогичной описанной выше. Пар получается в котле-утилизаторе 5. Циркуляция
бидистиллята осуществляется насосом 3, давление в контуре поддерживается
с помощью уравнительного сосуда 4. Уровень бидистиллята в
котле-утилизаторе поддерживается дозировочным насосом 1.
Расчет ведем на
1000 м3 свежей смеси, с
которой поступает (в кмоль):
H2 746/22,4 =33,30
N2 249/22,4=11,116
CH4 5/22,4=0,223
------------------------------------
Итого 44,639
а) Количество и
состав продувочных газов. Количество продувочных газов определяется.
Х =
100*0,223/5= 4,460 кмоль на
1000 м3 свежей смеси.
СН4 5*4,460/100=0,223
NH3 4*4,460/100=0,178
Смеси N2 и H2 91*4,460/100=4,059
------------------------------------
Итого. . . 4,460
б) Количество
циркуляционной смеси в цикле (у кмоль) и количество газа, выходящего из
колонны синтеза, (z кмоль) на 1000 м3 (44,639 кмоль) свежей
смеси.
Пусть d кмоль - количество
аммиака,выводимого через сепаратор.
Тогда z=(y+d+4,460) кмоль
С другой стороны,
количество газовой смеси (г кмоль) составится из суммы циркулирующей
смеси в цикле (у кмоль) и свежей азото-водородной смеси (44,639 кмоль)
минус уменьшение объема газа в процессе синтеза. Согласно уравнению реакции
синтеза аммиака (ЗН2 +N2 =2NH3), из 2 кмоль азото-зодородной
смеси образуется 1 кмоль МН3.
Следовательно, если обозначить через е количество кмоль NН3, образовавшегося в колонне синтеза, то и объем
газовой смеси после реакции уменьшится на е кмоль.
Отсюда имеем
z = (y + 44,639 - е) кмоль.
Приравнивая 2
уравнения друг к другу, получим:
d = (40,179- е) кмоль.
Синтез протекает
таким образом, что количество аммиака, образующегося в колонне (е кмоль), должно
быть равно количеству его, выводимому из цикла через сепаратор (d кмоль) и с продувочными газами (0,178 кмоль). Следовательно,
е = (d+0, 178) кмоль.
Совместное решение
уравнений дает:
e=20.179 d=20.001
Количество газовой
смеси на выходе из колонны (z кмоль) и количество циркулирующей смеси (у кмоль) определится из
следующего. В газовой смеси содержится 25% NН3 и в циркулирующем газе
(так же, как и в продувочном) 4% NНз. Все количество NНз, содержащееся в газовой смеси (25%), распределяется в
дальнейшем ходе процесса так:
выводится из цикла
через сепаратор в виде жидкого NН3 (аммиака-продукта)
20,001 кмоль;
выводится из цикла
с продувочными газами 0,178 кмоль;
уходит с
циркулирующей смесью b кмоль.
Отсюда общее
количество NНз определится
NН3 = 20,001 +0,178 +b -= (20,179 +b) кмоль.
Это количество NНз должно составить 25% по отношению
ко всей смеси (г кмоль).
Отсюда:
z=(20.179+b)/0.25=(80.716+4*b) кмоль
С другой стороны,
содержание NНз в циркулирующей смеси 4%, а всего смеси получается
у
кмоль. Отсюда:
y=b/0.04=25*b кмоль.
Вычитая одно
равенство из другого, получим:
z-y=(80/716-21*b) кмоль
z-y=(44.639-e)=24.460 кмоль
b=56.256/21=2.679 кмоль
Таким образом, в
циркулирующей смеси постоянно находится 2,679 кмоль NН3. Количество этой смеси:
у = 25*2,679 = 66,975 кмоль , а количество газовой смеси
после колонны синтеза z = 80.716 + 4*2,679 =
91,432 кмоль.
В циркулирующей смесь входит 5
% CH4
.975*0.05=3.337 кмоль
Материальный
баланс цикла синтеза Аммиака
Колонна Синтеза.
Приход.
Свежая Азото-водородная смесь׃
3
H2+N2
44,416 кмоль
CH4
0.223
кмоль
Итого
44,639 кмоль
Циркулирующая смесь ׃
3
H2+N2
60,959 кмоль
CH4
3,337
кмоль
NH3
2.679 кмоль
Итого
66,975 кмоль
Всего поступает в колонну
синтеза ׃
3 H2+N2
105,375 кмоль
CH4
3,560
кмоль
NH3
2.679 кмоль
--------------------------------------
Итого 111,614 кмоль
Расход
Газовая смесь при выходе из
колонны׃
(3 H2+N2
)=z-(22.680+3.560)
65,194 кмоль
CH4
3,560
кмоль
NH3
=(2.679+d) 22.680 кмоль
Итого 91,434 кмоль
Уменьшение числа молей за счёт
реакции синтеза 20,179 кмоль
----------------------------------------
Итого 111,613 кмоль
Сепаратор.
Приход
3
H2+N2
65,194 кмоль
CH4
3,560
кмоль
-----------------------------------
Итого
91,434 кмоль
Расход
Жидкий NH3
(Готовый продукт) 20,001 кмоль
Циркулирующая смесь 66,975
кмоль
Продувочные газы ׃
3 H2+N2
4,059 кмоль
CH4
0,223
кмоль
NH3
0,178 кмоль
-------------------------------------------
Итого 91,436 кмоль
Тепловой
баланс колонны синтеза аммиака
Получено аммиака за
счет реакцииУ
,89 - 2,68 = 20,21 кмоль.
При этом выделяется
тепла
Q1 = 11010*20,21 = 221301
ккал
Количество тепла,
которое несет с собой газ при выходе из
реакционного
пространства У
NH3 22 ,89*10,44*530 =126655 ккал
H2 48,83*7,02*530=181677 ккал
N2 16,23*7,22*530 =62106 ккал
CH4 3,53*12,14*530=22713 ккал
Итого ……………….. 393151 ккал
Потери тепла составят
У
Q3 =0,05*393151= 19658 ккал
Теплосодержание
газовой смеси при входе ее в реакционное пространстзо колонны синтеза
определится:
Q3= (393151- 221301) + 19658 = 191508 ккал.
Это количество
тепла газовая смесь получает в теплообменнике от прореагировавшего газа.
Приход.
Теплота реакции
221301 ккал
Тепло, получаемое
газом в теплообменнике 191508 ккал
------------------------------
Итого 412809 ккал
Расход.
Тепло, отдаваемое
газом в теплообменнике 191508 ккал
Тепло, уносимое
газом из теплообменника 201643 ккал
Потери тепла в
окружающую среду 19658 ккал
------------------------------
Итого 412809 ккал
катализатор синтез производство
аммиак
Список используемой литературы
1.
«Производство аммиака из природного газа» Ведерников М. И. 1970 год
.
«Справочник азотчика» 1967 год
.
«Технология связанного азота» 1967 год.