Разработка и использование катализаторов для синтеза аммиака
Содержание
1. Введение
2. Литературный обзор
2.1 Историко-технические аспекты производства и применения
катализаторов синтеза аммиака
2.2 Обзор научных достижений в области совершенствования
катализаторов синтеза аммиака за последние пять лет
2.3 Механизм восстановления железных катализаторов СА
2.3.1 Строение оксидного катализатора
2.3.2 Влияние на активность условий восстановления катализатора
2.3.3 Строение восстановленного катализатора
2.3.4 Механизм и кинетика восстановления катализатора
3. Экспериментальная часть
3.1 Принципиальная схема и описание термогравиметрической установки
восстановления катализаторов синтеза аммиака
3.2 Принципиальная схема и описание установки высокого давления для
испытания аммиачных катализаторов
3.3 Состав испытуемых катализаторов
4. Результаты и обсуждения
4.1 Восстановление катализаторов на термогравиметрической установке
4.2 Восстановление катализаторов на установке высокого давления
4.3 Выводы
5. Приложения
5.1 Охрана окружающей среды
5.1.1 Введение
5.1.2 Экологическая характеристика технологической схемы
5.1.3 Переработка и обезвреживание газообразных отходов
5.1.4 Переработка и обезвреживание жидких отходов
5.1.5 Переработка и обезвреживание твердых отходов
5.1.6. Экономическая оценка природоохранных предприятий
5.1.7 Заключение
5.2 Охрaнa труда
5.2.1 Опасные и вредные производственные факторы наосновных стадиях
выполняемой работы
5.2.2 Основные физико-химические, токсические и
пожаро-взрывоопасные свойства используемых в работе веществ
5.2.3 Режим личной безопасности
5.2.4 Производственная санитария
5.2.5 Техника безопасности
5.3 Экономическая часть
5.3.1 Технико-экономическое обоснование проведения дипломной
научно-исследовательской работы
5.3.2 Текущие затраты
5.3.3 Затраты на заработную плату и единый социальный налог
5.3.4 Амортизационные отчисления приборов и оборудования
5.3.5 Общеинститутские расходы
5.3.6 Смета затрат на проведение дипломной научно-исследовательской
работы
5.3.7 Выводы к экономической части
6. Список литературы
1.
Введение
Синтезированный аммиак используется как промежуточный продукт
для получения большого числа различных азотосодержащих соединений, таких как
азотная кислота, карбамид, аммофос и др. Себестоимость аммиака достаточно
высока и в настоящее время ведутся работы, направленные на снижение высокой
энергоёмкости производства, совершенствование аппаратуры и поиск новых
материалов для неё. Но наибольшее количество исследований посвящено разработке
новых и совершенствованию уже имеющихся катализаторов синтеза аммиака. Создание
высокоэффективных катализаторов позволило бы снизить температуру и давление
синтеза, повысить равновесную концентрацию продукта, что привело бы к
уменьшению себестоимости синтетического аммиака.
Каталитическую активность в отношении
реакции синтеза аммиака проявляют железо, осмий, уран, молибден, вольфрам и
другие металлы, имеющие незаполненные электронные оболочки.
На основании многочисленных исследований, проведенных еще в
1909-1912 гг. Бошем и Митташем, было установлено, что наиболее высокий выход
аммиака достигается при использовании железных катализаторов с добавками
оксидов металлов II и III групп периодической системы и оксида щелочного металла. Железный
катализатор проявляет активность при сравнительно низких температурах
450-600°С, при которых возможна высокая степень превращения, наиболее устойчив
к каталитическим ядам, а также доступен и дешев.
Основным компонентом современных катализаторов синтеза
аммиака является пористое железо, получаемое восстановлением магнетита Fe3O4 водородом или
азотоводородной смесью при 300-400°С. В процессе кристаллохимических
превращений образуется активная каталитическая фаза с энергетически
неуравновешенной кубической решеткой. В процессе работы катализатора под
воздействием температуры протекает рост кристаллитов железа, сопровождающийся
уменьшением количества энергетически неуравновешенных атомов железа, что
приводят к снижению его каталитической активности.
Для повышения продолжительности работы в
состав катализатора вводят промоторы - соединения, добавление которых в
небольших количествах увеличивает активность катализаторов, их селективность и
стабильность. Типичными промоторами являются щелочные, щелочноземельные,
амфотерные и кислые оксиды. Промоторы условно подразделяются на модифицирующие
- изменяющие характер и скорость элементарных стадий каталитических процессов и
структурообразующие - повышающие сопротивление катализатора механическим и
химическим разрушениям.
Процесс восстановления является важнейшей
стадией формирования катализатора. Во время восстановления образуется высокоразвитая
поверхность катализатора, мелкопористая структура, определенный химический
состав поверхности и т.д., что в конечном счёте определяет активность и
стабильность катализатора.
Восстановление катализаторов синтеза
аммиака можно проводить различными восстановителями: Н2, СО и их
смесями; в практике азотной промышленности для восстановления применяется
азотоводородная смесь.
Восстановление магнетита - основного
компонента катализатора - водородом протекает по реакции
Fe3O4+ 4Н2 → 3Fe + Н2О - 143 кДж
Цель данной работы - в процессе изучения восстановления
различных образцов катализаторов синтеза аммиака подобрать рациональные условия
этого процесса.
2.
Литературный обзор
2.1
Историко-технические аспекты производства и применения катализаторов синтеза
аммиака
При поиске эффективных катализаторов
только стадии синтеза аммиака в период 1901 - 1919 гг. в качестве катализаторов
синтеза было испытано более 4000 различных соединений. При этом наиболее
высокую каталитическую активность показал осмий. Однако Os существенно дороже
золота и платины и поэтому не мог использоваться в промышленном масштабе. Далее
в результате многочисленных исследований в основном остановились на губчатом
железе, промотированном оксидом алюминия в качестве структурного промотора и
поташом. Последняя добавка повышает скорость медленной стадии процесса -
диссоциативной хемосорбции азота [1]. Большинство промышленных катализаторов
синтеза аммиака и до настоящего времени содержат указанные компоненты.
Наибольший экономический эффект от
увеличения эффективности катализаторов стадии синтеза аммиака достигается в том
случае, если она является лимитирующей стадией производства и рост
производительности обеспечивается за счёт увеличения нагрузки на стадиях
подготовки газа.
Повышение активности катализаторов, как
правило, достигается за счёт введения промоторов, размера и формы
катализаторов, технологических особенностей их производства.
Следует отметить, что катализаторы с
крупными размерами частиц (6 - 10 мм) используются в конвекторах с аксиальным
потоком, тогда как мелкие (1,5 - 3,0 мм) - реакторах с радиальным потоком газа.
В течение ряда лет в бывшем СССР успешно эксплуатировался катализатор синтеза
аммиака СА - 1, устойчивый к воздействию перегрева и отравления
кислородсодержащими ядами [2, 3, 4]. Наряду с традиционно дробленным оксидным
катализатором, выпускаемом в виде зёрен неправильной формы, отечественной
промышленностью производится гранулированный катализатор СА-1 округлой формы и
предварительно восстановленный катализатор СА - 1В [5]. Кроме того, применялись
катализаторы типа СА-1 Н, предназначенные для работы при температурах в зоне
катализа в пределах 400 - 500 ºС, и высокотемпературный
катализатор СА - 2, допускаемая температура эксплуатации которого составляет
600 ºС.
Так, например, с 1987 по 1993 г на
агрегате аммиака ТЕС - 1 АО "АКРОН" применялись катализаторы,
производимые в г. Северодонецке и в г. Гродно СА - 2/СА - 2В, СА - 1В/СА - 1П,
а в последующие годы как на ТЕС - 1, так на ТЕС - 2 в основном используются
импортные катализаторы синтеза аммиака [6].
Среди ведущих зарубежных фирм
производителей катализаторов синтеза аммиака ведущими являются фирмы ICI, M. W. Kellogg Co., Halder Topsoe A/S и Ammonica Casale SA [7].
Фирма Haider Topsoe A/S уже в течение 60 лет
изготавливает два вида катализаторов: не восстановленный КМ и предварительно
восстановленный KMR, который после изготовления стабилизируется оболочкой для
лёгкости обработки и загрузки. При использовании катализатора KMR после начала нагревания
процесс выходит на стабильный режим через 1,5 сут. Срок службы катализатора,
как правило, превышает 10 лет.
В конце 1970-х гг. фирма Ammonica Casale SA для синтеза аммиака
разработала катализатор сферической формы с цериевым промотором. Его производят
смешением и сплавлением следующих компонентов, % (масс): оксиды железа - 26 -
30; оксиды алюминия и кальция по 2,0 - 3,5; оксиды магния - 0,1 - 0,5;
гидроксид кальция - 0,8 - 2,0 и диоксид кремния 0,2 - 0,5 %. Перед сушкой
добавляют раствор нитрата церия и получают порошок без окалины с содержанием
церия 0,2 - 2,6 % (по массе). Далее высушенную смесь гранулируют. Рассмотренный
катализатор имеет высокую активность при температурах 350-400 ºС и благодаря сферической форме - минимальный перепад давления
даже при малом размере частиц. Однако современные конструкции конвекторов
синтеза аммиака обеспечивают низкий перепад давления, поэтому использование
более дорогих катализаторов сферической формы не всегда оправдано.
Для процесса AMW производства аммиака
фирмой ICI создан новый катализатор, благодаря высокой активности которого,
стало возможным осуществлять синтез при низком давлении (7-8 МПа). Фирмой ICI в г. Клитеро
(Великобритания) построен завод по производству этого катализатора.
Катализаторы синтеза аммиака выпускают
такие известные зарубежные фирмы как BASF, Unated Catalyst Inc. (США), Societe
Chimque de la Grand Paroisse (Франция), Nors Hydro AS (Норвегия), Britisch Petroleum (Великобритания).
Фирма BASF изготавливает
катализаторы не восстановленной (S 6-10) и предварительно восстановленной (S 6-10 red) форм, причем
преимущество последнего состоит в снижении времени полного вывода процесса
синтеза аммиака на рабочий режим с 5 до 2 сут. и снижении количества
образующейся воды в процессе активации катализатора с 800 кг/м3 до
50 кг/м3. Оба катализатора в виде гранул неправильной формы
отличаются по составу: S 6-10 содержит оксиды железа, калия, кальция, алюминия,
магния при соотношении двухвалентного и трехвалентного железа 0,5 - 0,6, тогда
как S
6-10 red - железо вместо оксида железа, а все остальные компоненты
одинаковые с первым катализатором. Объемная плотность катализатора S 6-10 составляет 2,7 т/м8,
a S 6-10 red - 20 т/м3.
Катализатор S
6-10 становится активным при температуре 400 ºС, a S 6-20 red при 230 ºС, при этом необходимо поддерживать высокие скорости газового
потока с целью предотвращения отравления катализатора. Катализатор S 6 - 10 red рекомендуется
использовать только в первом слое реактора. Срок службы катализаторов фирмы BASF составляет 10 - 16 лет.
Фирмы Unated Catalyst Inc и ее филиал Catalys and Chemicals Europe (Бельгия) предлагают не
восстановленные катализаторы для синтеза аммиака С-73 двух видов: С 73-1-01 и С
73-2-01, отличающиеся концентрацией промоторов и температурой их прокаливания.
Катализатор С 78-2-01 рекомендуется для использования в верхнем слое, что
составляет 10-15 % от общего объема катализатора, а С 73-1-01 в остальном
объёме. Совместно с другими лицензиатами фирма Catalys and Chemicals Europe стала предлагать
катализатор предварительно восстановленной формы 73-1-RS.
Специалисты фирмы Nors Hydro AS [1] вырабатывают
катализаторы двух видов: не восстановленный AS-4 и предварительно
восстановленный AS-4-F формой частиц. Первый из названных катализаторов начал
использоваться фирмой с 1977 г. на собственной аммиачной установке, а затем
стал применяться на аммиачных установках других фирм. Химический состав и
физические свойства этих катализаторов отличаются незначительно от других
типов. Катализаторы AS-4 и AS-4-F выпускаются с размерами частиц от 1,6-3,0 до 12-21 мм.
Катализаторы AS-4 и AS-4-F выпускаются с размерами частиц от 1,6-3,0 до 12-21 мм. Эти
катализаторы обладают высокой термостабильностью и стойкостью к действию
кислорода, оксида и диоксида углерода, что обеспечивает более длительный срок
службы катализатора значительно более 10 лет, при работе даже с недостаточно
очищенным синтез-газом. Продолжительность восстановления катализатора
составляет 5 сут. для AS-4 и 1,5 сут. для AS-4-F. Восстановление и
активация катализатора AS-4 начинается при температуре 360 ºС и зависит от скорости нагрева. Давление поддерживается в
пределах 8-12 МПа. Активация катализатора AS-4-F начинается при
температуре 200 ºС.
Фирмой British Petroleum запатентован катализатор
для синтеза аммиака, промотированный рубидием или калием и содержащий
комплексное соединение карбонила рутения на графитовом носителе. Новый
рутениевый катализатор обладает большим сроком службы, чем традиционный
железный катализатор [8].
Разработку новых катализаторов для синтеза
аммиака проводит также фирма Montedison (Италия) в научном институте Donegani, где создан катализатор
с активностью на 50% выше промышленно используемых катализаторов. Этот
катализатор позволяет проводить синтез аммиака при относительно низком давлении
8-10 МПа.
В последние годы показана перспективность
мультипромотированных катализаторов синтеза аммиака, содержащих в своём составе
в различных сочетаниях Ru, Mo, Fe, Co, Ni, Cs [9, 10].
2.2 Обзор
научных достижений в области совершенствования катализаторов синтеза аммиака за
последние пять лет
Одним из наиболее рациональных путей интенсификации
химических производств, не требующих больших капитальных затрат, является
совершенствование существующих и разработка новых, более оптимальных
катализаторов. Интенсивные исследования по разработке эффективных катализаторов
синтеза аммиака как для условий, применяемых в настоящее время, так и для более
низких температур и давлений, производится в нашей стране и за рубежом.
В работе китайских учёных [11] рассматривается возможность
синтеза аммиака под низким давлением при использовании катализаторов типа
А-301. Основа данного катализатора - Fe1-xO. Испытание его
активности проводились в реакторе, где находился слой катализатора в виде
насадки. Его производительность достигала 1000 т/сутки NH3. Получены следующие
основные результаты: концентрации аммиака на выходе из реактора составляли
14,35 - 16,55, 15,24-16,66 и 17,2 - 18,8 %, а его давление на выходе из
реактора - соответственно 70,85 и 100 атм.
В статье [12] изложены основные подходы к
получению стабильных Fe-Ru систем и формированию каталитически активной
композиции. Способ приготовления железорутениевой композиции состоял в
получении гидроксидов железа и рутения при совместном осаждении растворов солей
исходных компонентов в щелочной среде (NH4OH). В качестве исходных
соединений использовали водные растворы солей Fe (N03) 3·9H20 (х. ч.) и RuOHCI3 (х. ч.). Осажденные
железорутениевые системы получали путем смешения водного раствора азотнокислого
железа со специально подготовленным водным раствором гидроксохлорида рутения с
последующим добавлением водного раствора аммиака до рН=8,5 и коагулянта.
Отработанная технология получения осажденной гидроксидной системы, включающая
подбор концентраций и условий растворения исходных солей и осадителя, рН среды
осаждения, времени созревания осадка, способа отмывки осадка от Cl - , NO3 - и отделения осадка от
маточного раствора, позволила добиться получения стабильной гидроксидной
химической композиции с воспроизводимыми свойствами (структурой, температурой фазовых
превращений, составом продуктов прокалки и восстановления). Показано, что в
оксидных железорутениевых системах большая часть рутения идет на образование
своего собственного оксида и только малая доля входит в кристаллиты гематита,
которые существуют в виде скопления различной степени дисперсности. Для
наиболее крупных кристаллитов Fe2-x Rux02 степень
легирования рутением невелика при х=0,005 - 0,001. Установлены требования к
сырью - его исходному химическому составу, условиям приготовления исходных растворов,
режимам прокалки и восстановления, обеспечивающим получение воспроизводимой от
партии к партии активной системы.
В работе [13] говорится о разработке эффективного метода
приготовления железного катализатора синтеза аммиака, позволяющий повысить его
активность и скорость восстановления на 15-25%. Традиционная окислительная
плавка чистого железа была заменена плавкой магнетита (суперконцентрата) в
мощном пучке ускоренных электронов. Одной из особенностей этого процесса было
достаточно резкое (до 20-25%) снижение содержания FeO в магнетите
катализатора. При традиционных методах плавок содержание FeO составляет 32-36%.
Установлено, что изменение первоначального (стехиометрического) соотношения Fe2+/Fe3+ не связано с реакциями с
участием кислорода воздуха или испарением, так как плавка чистого магнетита
показала полное химич. соответствие исходного и конечного продукта. Изменение
соотношения Fe2+/Fe3+ не связано так же с наличием гидроксильных групп у исходных
соединений, используемых в качестве промоторов.
В 2005 году [14] запатентован способ каталитического
получения аммиака, включающий стадии пропускания потока синтез-газа,
содержащего азот и водород, через три слоя катализатора, расположенных один
поверх другого, которые содержат катализатор на основе железа с магнетитом как
главной составной частью, который восстанавливают в течение процесса до
каталитически активной формы альфа-железа, получения указанного потока
синтез-газа объединением потока, который подают непосредственно в первый слой
катализатора, с другим потоком, который предварительно подогревают непрямым
теплообменом с продуктами, покидающими первый и второй слои катализатора, и
выделения конечного продукта, отличающийся тем, что перерабатываемый газ
пропускают через средний слой катализатора при объемной скорости от 0,65 до 2
объемной скорости, с которой перерабатываемый газ пропускают через верхний слой
катализатора. Реакцию проводят при объемном отношении между средним слоем
катализатора и верхним слоем катализатора от 0,5 до 1,5.
Ещё один патент [15]. Патентуется
катализатор синтеза аммиака, включающий в качестве каталитически активного
металла рутений, нанесенный на окись магния, и промотор, отличающийся тем, что
окись магния имеет удельную поверхность, по меньшей мере, 40 м2/г,
концентрация рутения составляет между 3 и 20 масс. % и содержание промотора
составляет между 0,2 и 0,5 молей на моль рутения, причём промотор представляет
собой щелочные металлы, щелочноземельные металлы, лантаниды и их смеси.
В работе [16] Исследовано влияние активного
угля как носителя на дисперсность металла и активность рутениевого катализатора
в синтезе аммиака. Рутениевые катализаторы получены с использованием в качестве
носителя активных углей (АУ) десяти типов, полученных из различного исходного
сырья. Пористая структура катализаторов и степень дисперсности частиц Ru изучены методами
адсорбции паров азота и хемосорбции СО. Отмечено, что дисперсность Ru тесно связана не только
с текстурой АУ, но и с его чистотой. Активность серии промотированных Ва Ru-катализаторов на АУ в
реакции синтеза аммиака измерена при температуре 45°С и давлении 10
МПа. Показано, что природа исходного сырья
сильно влияет на свойства АУ как носителя катализатора. На некоторых АУ,
характеризующихся высокими чистотой и удельной поаерхностью, большим объемом
пор и оптимальным распределением пор по размерам, Ru и Ва хорошо
диспергированы, и такие АУ могут быть успешно использованы для получения КТ
синтеза аммиака.
В Институте катализа (г. Новосибирск) для
синтеза аммиака при невысоких температурах и давлениях разработан катализатор
на основе рутения и щелочного промотора, нанесенных на углеродный материал cибунит. [17]
Исследовано влияние содержания активного компонента и
промотора, а также природы последнего на активность катализатора в реакции
синтеза аммиака. Катализатор готовили последовательными пропитками исходного
сибунита водными растворами карбамидного комплекса рутения и солей щелочных
металлов (KNO3, RbNO2, CsNO3) с соответствующими термообработками в аргоне и водороде.
Установлено, что рубидий является более эффективным промотором в Ru-М/Сибунит катализаторе.
Рутений-рубидиевые образцы более активны при 350°С, в то время как цезиевые -
при 375°С. Следовательно, использование рубидия в качестве промотора
предпочтительнее для проведения синтеза аммиака при более низких температурах.
В статье [18] cообщается о разработке
учеными-химиками США нового способа синтеза NH3 с применением нового
металлорганического катализатора, исходя из Zr, который фиксирует атомы
N, а органическая часть катализатора
смешивается с реагирующими газами. Химически инертные молекулы N2
активируются при обычных температурах, что позволяет проводить синтез NH3, в более мягких
условиях. Катализатор состоит из иона Zr и двух пятиугольных углеродных цепей. Чистота NНз при этом повышается.
2.3 Механизм
восстановления железных катализаторов СА
2.3.1
Строение оксидного катализатора
В местах контакта железа и промоторов образуются сложные
химические соединения, обуславливающие электронное и ионное состояние всего
катализатора и ответственные за процесс катализа. Природа таких соединений, их
структура, а вместе с тем структура и текстура всего катализатора
обуславливается, в первую очередь, распространением промоторов, что в свою
очередь зависит от химического состава и условий приготовления катализаторов.
При окислительной плавке катализатора промоторы, вследствие
их незначительных количеств по отношению к основной массе - магнетиту, а также,
вследствие вязкости расплава, образовывают, в первую очередь, соединения с
оксидами железа.
катализатор синтез аммиак восстановление
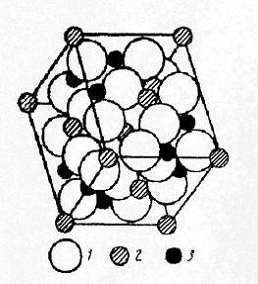
Рис.1 Структура шпинели.
- ионы кислорода, 2 - ионы Fe2+, 3 - ионы Fe3+
Распределение промоторов в окисленном катализаторе зависит от
того, насколько каждый промотор или соединение его с оксидами железа или
другими промоторами может входить в решётку магнетита.
Образование твёрдых растворов между двумя или более
соединениями обуславливается, как известно, соответствиями структур и размеров
кристаллических решёток этих соединений. Магнетит кристаллизуется в кубической
системе. Элементарная ячейка кристаллической решётки Fe3O4 содержит в качестве
обращённой шпинели 8 молекул Fe3O4, то есть между 32 плотно упакованными
кислородными ионами размещается в тетраэдрических междоузлиях 8 ионов Fe3+ и в октаэдрических
междоузлиях 8 ионов Fe2+ и 8 ионов Fe3+. Этим особым распределением ионов железа
объясняется большая электропроводность магнетита, так как полупроводники этого
типа обязаны своей электропроводности наличию в равнозначных
кристаллографических положениях ионов одного и того же элемента с различной
валентностью. [19]
Длина рёбер элементарного куба Fe3O4 составляет 8,380 Å. Для структур типа шпинели характерна возможность замещения ионов
железа ионами других металлов без изменения кристаллической структуры при
условии, что замещённые ионы отвечают определённым требованиям по их размерам и
валентности. Как показывают рентгеновские, микроскопические и другие
исследования, промоторы большей частью растворяются в магнетите.
Таким образом, железный промотированный катализатор синтеза
аммиака в окисленном состоянии представляет собой, в основном, магнетит, в
котором растворены различные шпинельные соединения и оксиды промоторов и
примесей. Промоторы, не вошедшие в решётку магнетита тем или иным путём,
образуют одну или несколько кристаллических фаз и стеклофаз, которые
располагаются по границам кристаллических зёрен магнетита и обволакивают их
[20].
2.3.2 Влияние
на активность условий восстановления катализатора
Восстановление является второй стадией приготовления
катализатора. От правильного подбора условий процесса восстановления, в
значительной мере зависят активность и устойчивость катализатора синтеза
аммиака.
Восстановление может проводиться различными реагентами: H2, N2+H2, CO и т.д. Однако, в
промышленности, как было сказано выше, в качестве восстановителя обычно
используется очищенная и осушенная азотоводородная смесь. [21]
Различные условия восстановления оказывают значительное
влияние на скорость и степень восстановления катализатора, а это, в свою
очередь, сказывается на формирование активной поверхности.
Наиболее важными факторами, влияющими на процесс
восстановления катализатора, являются температура и объёмная скорость.
При постоянной температуре восстановление со временем
прекращается и развивается дальше лишь с повышением температуры. Однако
повышение температуры ведёт к увеличению концентрации водяных паров, которые не
только тормозят скорость процесса, но также являются причиной собирательной
рекристаллизации и нормализации структуры железа, вследствие повторного
окисления и восстановления, что ведёт к необратимому снижению активности
катализатора.
Как влияет на процесс объёмная скорость? Соответствующим
изменением объёмной скорости можно в значительной мере нейтрализовать вредное
влияние высоких температур, поскольку от её величины зависит быстрота уноса
продуктов реакции (H2O), а следовательно и скорость процесса восстановления и активность
катализатора.
На процесс восстановления может также оказать влияние давление
газовой смеси. От величины давления зависят адсорбционные соотношения паров
воды, H2, N2, NH3, на поверхности катализатора. До температур 350-400°С
преимущественно адсорбируется водород и повышение давления ускоряет процесс
восстановления. От 375°С до 475°С повышение давления ускоряет реакцию синтеза
аммиака и, соответственно, замедляет восстановление, вследствие уменьшения
парциального давления водорода в газовой смеси и покрытия части поверхности
катализатора адсорбированным азотом.
На скорость восстановления и активность влияет степень
дробления катализатора. Уменьшение зернения ведёт к увеличению скорости
восстановления и, соответственно, повышению активности катализатора. Это
обуславливается диффузионными процессами.
Следует отметить, что степень восстановления и активность
катализатора также связаны между собой. Активность четырёхпромотированного
катализатора в процессе его восстановления проходит через максимум при степени
восстановления равной 96% [20].
2.3.3
Строение восстановленного катализатора
Активность катализатора определяется двумя факторами:
площадью общей поверхности и удельной активностью катализатора. Восстановленный
катализатор имеет пористую структуру и большую внутреннюю поверхность.
Величина внутренней поверхности зависит от многих факторов:
от химического состава, от условий окислительной плавки и от условий
восстановления катализатора. В основном, величина поверхности восстановленного
катализатора зависит от содержания в нём алюминия. Внедрение в катализатор,
содержащий оксид алюминия, К2О уменьшает поверхность. Введение в
двухпромотированный (Аl2O3+K2O) оксидов кальция и магния увеличивает немного
поверхность.
При восстановлении происходит не только развитие внутренней
поверхности катализатора, но и более сложные физико-химические процессы.
Многочисленные рентгеноструктурные и другие исследования катализатора синтеза
аммиака в восстановленном состоянии показывают, что состоит он из кристаллов,
внутренняя часть которых представляет чрезвычайно чистое железо. Химический
состав поверхности промотированных железных катализаторов синтеза аммиака
отличается от их среднего химического состава. Большая часть промоторов, таких
как К2О, Аl2O3 после восстановления оказывается в поверхностных
слоях катализаторов.
2.3.4
Механизм и кинетика восстановления катализатора
В результате исследований кинетики восстановления железа было
выяснено, что процесс развивается ступенчато и зонально.
Ступенчатость его заключается в том, что высший оксид при
взаимодействии с восстановителем переходит в такой низший оксид (в конечном
итоге в металл), с которым он может находиться в равновесии согласно диаграмме
состояний Fe-O.
Химическое превращение развивается последовательно, скачками, переходя через
все те химические соединения, которые могут существовать в данной системе.
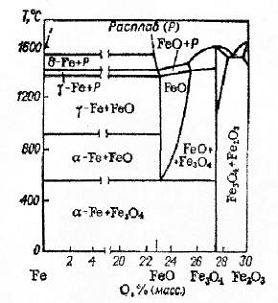
Рис.2 Диаграмма состояния системы Fe - O
Восстановление окиси железа в соответствии с этим принципом
протекает по следующим схемам:
I. Fe2O3 → Fe3O4 → FeO → Fe (для t > 572°C)
II. Fe2O3 → Fe3O4 → Fe (для t <572°C)
Зональность процесса состоит в том, что при восстановлении
каждая из новых фаз образует зону, окружающую зерно оксида, причём в ядре зерна
располагается высший оксид, а на периферии - металл.
Ступенчатость и зональность приводят к тому, что разрез
частично восстановленного оксида воспроизводит (также как окалина) в искажённом
масштабе диаграмму состояний железо - кислород.
Восстановление оксидов железа газами принадлежит к типу
реакций
ТВ I +ГАЗ I = ТВ II + ГАЗ II
и может в первом приближении рассматриваться как совокупность
диффузии газов через ламинарную газовую плёнку и поры твёрдого слоя продуктов
реакции, а также кристаллохимических превращений. В связи с этим можно ожидать
осуществление при подходящих условиях одного из трёх режимов восстановления:
кинетического, диффузионного и промежуточного. Кинетика процесса восстановления
зависит от многих факторов.
При исследовании скорости восстановления магнетита водородом
при атмосферном давлении установлено, что между lg ω и 1/T имеется линейная связь вплоть до 500-550°С, после чего она
разрушается. Это означает, что кажущаяся энергия активации процесса постоянная
и относится, собственно, к химической реакции. Другими словами, в указанном
интервале температур имеет место кинетический, а не смешанный или диффузионный
режим.
Попытки объяснить кинетические закономерности процессов
только термодинамическими данными привели исследователей к ошибочному выводу о
двухстадийном механизме восстановления оксидов металлов, которая предполагала,
что восстановлению предшествует диссоциация оксидов металла, а затем уже в
газовой фазе происходит соединение кислорода оксида с восстановителем. Взамен
этой схемы позже была разработана и экспериментально обоснована
адсорбционно-каталитическая теория механизма восстановления оксидов металлов.
По этой теории сначала проходит адсорбция газа-восстановителя на реакционной
поверхности, а затем следует отрыв кислорода от оксида, переход его к
адсорбированным молекулам восстановителя, сопровождающийся возникновением
соединения кислорода с восстановителем и, наконец, десорбция образовавшегося
соединения в газовую фазу.
Восстановление оксидов металлов принадлежит к топохимическим
реакциям. Общей особенностью таких процессов является стадия разрушения старой
и образование новой кристаллической решётки. Превращение на поверхности
твёрдого тела развивается таким образом, чтобы конфигурация атомов исходной
твёрдой фазы сохранялась (или почти сохранялась) и в новой твёрдой фазе.
Возникающая при указанном процессе кристаллическая решётка новой фазы
сопрягается с кристаллической решёткой исходной фазы подобными кристаллическими
плоскостями, параметры которых отличаются друг от друга минимально.
Сходность решеток старой и новой фаз
значительно облегчает построение первых слоев решетки новой фазы. Трудней
протекает кристаллизация, если она происходит на решетке с другой структурой.
Ориентирующие силы атомов исходной решетки стремятся расположить новую фазу в
соответствии со старой, что ведет к некоторой деформации решетки новой фазы
(псевдоморфизм).
В случае значительного отличия параметров
исходной и возникающей решеток, последняя кристаллизуется самостоятельно.
Перечисленные особенности возникающей
новой твердой фазы весьма рельефно проявляются в кинетике ряда топохимических
процессов, в частности, при восстановлении оксидов, обуславливая
автокаталитический характер хода реакции.
В условиях чисто кинетического режима
изменение скорости восстановления оксида со временем, модно разделить на три
периода:
-й - индукционный, связанный с
образованием зародышей новой фазы.
-й - автокаталитический. Развитие процесса
сосредотачивается вокруг возникших зародышей. Поверхность раздела твердых фаз
непрерывно растет, а вместе с нею увеличивается и скорость взаимодействия.
3-й период. Реакционные зоны, возникшие у различных
зародышей, сливаются в одну, поверхность которой непрерывно уменьшается с
дальнейшим течением процесса. Это вызывает соответствующее уменьшение скорости
реакции.
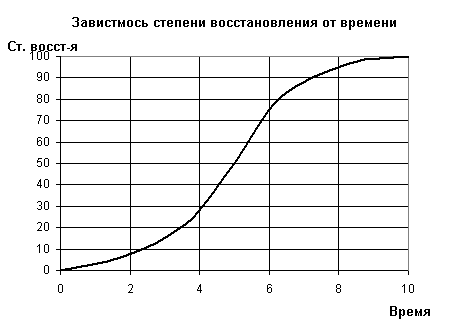
Рис.3. Зависимость степени восстановления от времени. I - индукционный период, II - автокаталитический период, III - диффузионный период
Таким образом, автокаталитический процесс характеризуется
максимумом скорости, ориентационно-размерным соответствием и зональностью, то
есть локализацией взаимодействия в сравнительно узких зонах контакта двух
твёрдых фаз. При высоких температурах кристаллохимические превращения стадий Fe3O4 → FeO и FeO → α - Fe осуществляются быстро и сливаются в одну.
При низких температурах, хотя FeO
термодинамически неустойчив, но из-за того, что лимитирующей стадией в процессе
восстановления являются кристаллохимические превращения, минимальная затрата
энергии будет при протекании превращений оксидов железа по схеме Fe3O4 → FeO → α - Fe, так как при этом обеспечивается минимальное
перемещение частиц. Механизм восстановления таков: вначале Fe3O4 восстанавливается
только до FeO
Fe3O4 + H2 = 3FeO +H2O
Эта реакция протекает с большим трудом, только по дефектным мостам
кристаллической решётки Fe3O4, причём водород способен хемосорбироваться только на пустых
кислородных местах или атомах железа, сместившихся со своих катионных мест. В
этот момент в газе-восстановителе особенно опасно присутствие кислорода и
кислородосодержащих соединений (Н2О, СО и т.п.), так как они имеют
большее сродство к дефектам решётки Fe3O4, чем водород.
Образовавшаяся FeO обладает
дефективной структурой, ряд катионных мест в ней не занят, по которым легко
перемещаются ионы Fe2+. Далее FeO
восстанавливается до атомов железа Fex, растворяющихся в решётке FeO, что может рассматриваться как образование активных центров
цепного процесса (зарождение цепи)
FeO + H2 = Fex + H2O+
Fex = FeO · Fex
По мере заполнения пустых мест в решётке FeO активные атомы Fe на границе
фаз FeO· Fex переходят в Fe3O4, восстанавливая его до FeO.
Образующаяся FeO восстанавливается водородом на границе с
газовой фазой до металла, атомы которого частично участвуют в построении
кристаллов α - Fe, а частично (Fex) вновь диффундируют в Fe3O4.
Скорость восстановления проходит через максимум и замедляется в
конце процесса, в 3-м периоде. Как указывают различные авторы, причиной
замедления восстановления оксидов железа в конце процесса является не только
уменьшение реакционной поверхности. Основной причиной следует считать
замедление реактивной диффузии атомов железа.
В процессе плавления промоторы
растворяются в магнетите, например, Аl3+ замещает Fe3+, а Са2+
замещает Fe2+. При восстановлении магнетита образуется пористая структура Fe; растворенные Аl2О3 и СаО
выходят из него и образуют, как показывают электронно-микроскопические снимки,
мелкие кристаллики на поверхности Fe. Таким образом, они действуют как структурные
промоторы и предотвращают спекание катализатора. Удельная поверхность Аl2, О3 в
катализаторе равна 30-40% от общей поверхности катализатора, хотя содержание
его - всего 2%. Проведённые Лачиновым, Рубинштейном и др. исследования
осаждённого железного катализатора синтеза аммиака, промотированного Al2O3 в широком интервале
концентраций (от 0 до 88% масс.) при P= 300 атм., позволили выявить, что с увеличением
содержания Al2O3 активность проходит через максимум, соответствующий 2,5 - 5 %
масс. Al2O3. При этом увеличивается поверхность и объём пор, а их радиус
уменьшается. При небольшом содержании Al2O3 структурирование заключается в одновременном
увеличении поверхности и повышении активности катализатора.
Гранулы восстановленного катализатора
состоят из кристалликов железа размером 15-20 нм и имеют пористую структуру с
высокоразвитой поверхностью (10-20 м2/г). Величина преобладающего
радиуса пор составляет 10-15 нм.
Оксид калия К2О (~1%) является не структурным, а
электронным промотором, так как он не предотвращает спекания Fe, но изменяет
хемосорбционные свойства по отношению к водороду и кинетику реакции. Возможно
также, что К2О способствует освобождению поверхности от частиц NH, NH2, и NH3, которые при высоком
давлении могут отравлять поверхность. К2О не внедряется в магнетит,
а присутствует в промотированном оксидами алюминия, кальция и калия
катализаторе в виде сложного калиевого феррита [3]. После восстановления
катализатора оксид калия практически равномерно распределяется по всем
железосодержащим фазам. Л.А. Рудницким [22] показано, что при возрастании
содержания промотора К2О происходит увеличение центров диссоциации
азота. Наличие на поверхности катализатора оксида калия снижает работу выхода
электрона и способствует ускорению процесса синтеза. Работа [23] показала, что
с увеличением содержания К2О термоустойчивость катализатора и
устойчивость к кислородосодержащим ядам падает. С другой стороны, оксид калия
увеличивает устойчивость катализатора к серосодержащим примесям [24].
СаО влияет как на структуру катализатора, так и на его
хемосорбционные свойства [20].
3.
Экспериментальная часть
3.1
Принципиальная схема и описание термогравиметрической установки восстановления
катализаторов синтеза аммиака
Кинетику восстановления изучают на гравиметрической установке
при атмосферном давлении в изотермических условиях и при ступенчатом подъеме
температур с использованием аналитических одночашечных весов типа "Labor".
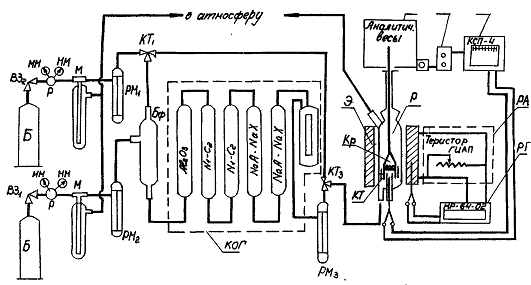
Рис.5 Схема лабораторной установки изучения
катализаторов термовесовым способом. Б - баллон; Р - редуктор; ММ - манометр; М
- маностат; РМ - реометр; КТ - кран трехходовой; Бф - буферная емкость; КОГ -
колонки очистки газа; Э - электропечь; Р - реактор; КТ - катализатор; В - весы;
ПГИАП - прибор ГИАП; Д - датчик ГИАП; З - запись; ТрГИАП-РТ - регулирование
температуры в печи; К - корзина.
Установка состоит из следующих основных узлов:
узел получения и очистки газа при атмосферном давлении,
реактор с печкой,
системы регулирования температуры и записи температуры и
веса.
Изменение веса регистрируется весами со встроенным
индукционным датчиком. Весы аналитические типа АДВ. Сигнал изменения веса передается
на КСП-4 для записи. Шкала КСП-4 откалибрована на 100 мг. Температура
регулируется теристором ГИАП, амперметром, задается МР-64-02 - милливольтметром
и записывается КСП-4.
На рис.5 представлена схема установки. Газы из баллонов,
находящихся в кабинах вне помещения, через маностаты М и реометры РМ1,2
смешиваются в емкости Бф и поступают на очистку от влаги, кислорода,
СО2 - КОГ. Далее газ через реометр РМ3 поступает в
реактор Р и проходит катализатор, находящийся в подвешенной корзине КР, где
идет процесс изменения веса образца. Реактор помещен в печь Э. Корзина с
исследуемым образцом на тросе подвешена к коромыслу весов.
Весы установлены на специальной плите со специальным
теплозащитным экраном из асбеста и воздушной прослойки.
Температура в зоне реакции контролируется хромель-алюмелевой
термопарой с помощью переносного потенциометра ПП.
Во избежания загорания восстановителя применяют
предохранительный поддув инертным газом.
Степень восстановления определяют по отношению убыли веса
образца к весу кислорода, связанного с восстанавливающимися компонентами
каталитической системы по формуле:
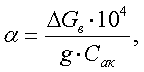 (11)
(11)
где α - степень
восстановления, %
g - навеска образца, предварительно прокаленная, г
ΔGв - изменение веса при восстановлении, г
Сак - коэффициент связи кислорода с
восстанавливающимися компонентами катализатора.
Исследование проводилось по следующей
методике:
. Загрузка катализатора
Навеску исследуемого образца в количестве
0,5-1,0 г помещает в кварцевую корзинку на предварительно насыпанный 1 см3
кварца. Помещают корзинку в реактор Р, зацепляя её за ось. Весы
уравновешиваются противовесами обычным способом по оптическому указателю,
устанавливая указатель на "10", так как ожидается уменьшение веса образца.
. Пуск в систему рабочего газа.
В качестве газа носителя использует азот,
подаваемый из баллона Б через маностат, необходимую скорость газа устанавливают
по реометру РМ1, затем газ проходит смеситель Бф, очистку КОГ и
через реометр РМ3 поступает на катализаторы затем выбрасывается в
атмосферу. После того как газ-носитель пущен, система окончательно
взвешивается.
. Включение в электросеть приборов.
После пуска в систему газа включаем все
приборы в сеть 220 В. Устанавливается рабочий ток и проверяют ход диаграммы
КСП-4, качество записи веса, при изменении веса образца система пишет наклонную
линию, а при его постоянстве - вертикальную.
. Прокалка образца.
При помощи теристора, амперметра и
милливольтметра регулирующего МР-64-02 устанавливают скорость нагрева и
необходимую температуру, при которой прокаливают образец катализатора.
. Восстановление.
В токе азота "чистого" после
прокалки образца катализатора устанавливают нужную температуру восстановления.
При этой рабочей температуре пускают в систему восстановитель и устанавливают
скорость газа по реометру MP3. С началом восстановления вертикальная линия
веса на КСП-4 отклоняется, дождя до конца ленты, начало линии переводят с
помощью разновесов на 0,01г., на начало шкалы. Восстановление считается законченным,
когда линия записи веса выходит на вертикальную прямую. После окончания
восстановления в систему пускают азот, охлаждают до комнатной температуры,
пассивируют подачей воздуха в азот, а затем прекращают поступление газа,
предварительно выключив все приборы.
Отработанная газовая смесь по линии сброса
отводится в атмосферу, разбавленная: 10-кратным объёмом азота.
3.2
Принципиальная схема и описание установки высокого давления для испытания
аммиачных катализаторов
Эксперимент по восстановлению аммиачных катализаторов
проводился в лаборатории ТНВ на стандартизированной установке высокого
давления. Реактор представлял собой четырехканальную колонну синтеза с
возможностью одновременного испытания трех образцов со стандартным образцом
сравнения.
Схема стандартной установки для
определения активности катализаторов синтеза аммиака под высоким давлением
приведена на рис.4.

Рис.4 Принципиальная схема установки высокого
давления
Азотоводородную смесь получают разложением
аммиака, поступающею из баллона 1, в прямом крекере 2 при температуре 500-600°С
при атмосферном давлении на железном плавленом катализаторе синтеза аммиака
СА-1В. Полученную азотоводородную смесь очищают в блоке абсорбционной очистки
низкого давления, состоящей из пяти последовательно соединенных стеклянных
скрубберов, заполненных на 1/8 своего объема стеклянной насадкой в виде колец
или капилляров. Скруббер 3 содержит воду для улавливания следов
неразложившегося аммиака, два последующих скруббера 4 заполнены 20% раствором
серной кислоты, подкрашенной индикатором метил-рот. Следующий скруббер 5
предназначен для осушки азотоводородной смеси концентрированной серной
кислотой. Последний полый скруббер 6 служит брызгоуловителем. Краны А и Б
предназначены для отсечения очистки низкого давления от основной схемы в
аварийных ситуациях. После блока абсорбционной очистки низкого давления газ
поступает в газгольдер 7, откуда через осушитель 8, заполненный силикагелем
марки КСК, нагнетается пятиступенчатым поршневым компрессором 9 в
маслоотделитель 10. Затем подается в блок очистки высокого давления через
систему аварийного малого блока 11, состоящего из двух вентилей: запорного и
регулировочного.
Для очистки газа от примесей масла и воды,
попадающих при прохождении потока через газгольдер и компрессор, предназначены
фильтры высокого давления 12, 13, содержащие активированный уголь марки АГ-3 и
силикагель соответственно.
Далее газ поступает в первую колонну
предкатализа 14, где на Al-Ni-Cr-Cu-катализаторе при 200-300°С происходит
гидрирование кислорода и кислородсодержащих соединений. Кислород, являющийся
продуктом распада кислородсодержащих соединений, взаимодействует с водородом с
образованием воды, которая улавливается в последующих фильтрах, заполненных
щелочью. Оксиды углерода, образующиеся при разложении органических соединений,
реагируют с водородом, получающийся при этом метан является инертной примесью и
не оказывает влияния на катализатор синтеза аммиака.
После первой колонны предкатализа
азотоводородная смесь проходит два фильтра 15, загруженных гранулированным
гидроксидом калия для осушки от влаги, образующейся при гидрировании примесей,
и поступает во вторую колонну предкатализа 16. На плавленом катализаторе
синтеза аммиака СА-1В при 250-300°С происходит окончательная очистка
азотоводородной смеси от кислородсодержащих соединений. После обеих колонн
предкатализа предусмотрен блок аварийных вентилей и вентилей для отбора проб на
анализ 17, позволяющий не только анализировать состав газа, но и отсекать
отдельные аппараты очистки высокого давления в аварийных ситуациях. Содержание
аммиака в газе после второй колонны предкатализа не должно превышать 0,1-0,2 об
%.
Через вентиль отбора проб второй колонны
предкатализа азотоводородная смесь поступает в два последующих фильтра 18,
загруженных таблетированньм гидроксидом калия, где улавливается влага,
образовавшаяся при гидрировании кислородсодержащих примесей. Последний фильтр
19 предназначен для очистки от механических примесей и щелочной пыли и загружен
ватой, просушенной при 90-100°С. Из блока очистки высокого давления газ
поступает в регулятор высокого давления 20 и колонну синтеза 21. Во избежание
потерь чистого газа аммиачноазотоводородную смесь, отходящую из колонны синтеза
и содержащую до 26 об %. аммиака, редуцируют до атмосферного давления и
направляют в крекер обратного газа 22, где при 500-600°С аммиак разлагается на
катализаторе СА-1. После обратного крекера газ поступает в блок абсорбционной
очистки низкого давления, в котором поглощаются следы неразложившегося аммиака.
Давление газа в колонне синтеза регулируется автоматически в пределах одной
атмосферы мембранным регулятором прямого действия. Температура в каналах
колонны измеряется хромель-алюмелевыми термопарами, соединенными с
потенциометрами типа КСП-4. Изотермические условия синтеза в колонне
поддерживаются автоматически за счет обогревающей электропечи. Регулирование
температуры осуществляется с помощью электронного потенциометра ЭПВ-А11.
Точность измерения температуры составляет ±1°С. Анализируемый газ на выходе из
каждого канала редуцируется регулировочным вентилем до атмосферного давления.
Скорость потока контролируется с помощью реометра. Содержание аммиака
определяется с помощью газоанализатора или объемным методом.
Испытанные на активность образцы
катализаторов охлаждают в потоке азотоводородной смеси до комнатной температуры
и пассивируют азотом с содержанием 0,1-0,2% кислорода в течение 8-10 ч или
воздухом при охлаждении образца жидким азотом в течение 3-5 мин.
Колонна синтеза аммиака предназначена для
одновременного испытания активности четырех образцов катализатора синтеза
аммиака.
Колонна выполнена из стали марки 1х14НВ2М.
В корпусе колонны по всей длине высверлены пять каналов, закрывающиеся
термопарными чехлами, которые уплотняются накидными гайками. Применение
многоканального реактора позволяет испытывать четыре образца в одинаковых
условиях относительно температуры, давления, объемной скорости, состава газовой
смеси и неконтролируемых факторов, что существенно увеличивает точность
эксперимента.
Азотоводородная смесь из очистки высокого
давления поступает в центральный канал колонны, где, проходя по винтовой нарезке
термопарного чехла, нагревается до температуры реакционной зоны. Через
отверстия, соединяющие центральный канал с четырьмя другими, попадает в рабочее
пространство каждого канала, которое имеет объем 5 мл и находится между дном
канала и термопарным чехлом Из рабочею пространства азотоводородная смесь
проходит между стенками канала и термопарного чехла и при открытом
регулировочном вентиле на выходе из канала с заданной скоростью поступает на
анализ или через обратный крекер в газгольдер [31].
В каждый канал колонны было загружено по 2
см3 образца.
Режим восстановления и испытания в чистой
АВС (Н2: N2 = 3:
).
Условия: Р = 50 атм, W=30000 час-1
Разогрев до 300°С со скоростью 30-35°С/час
Выдержка 2 часа.
Разогрев до 350°С со скоростью 25-30°С/час
Выдержка 2 час
Разогрев до 375°С со скоростью 10-15°С/час
Выдержка 4 часа
Разогрев до 400°С со скоростью 10-15°С
/час
Выдержка 4 часа
Разогрев до 425°С со скоростью 10-15°С/час
Выдержка 4 часа
Разогрев до 450°С со скоростью 5-10°С/час
Выдержка 4 часа
Разогрев до 475°С со скоростью 5-10°С/час
Выдержка 4 часа
Разогрев до 500°С со скоростью 5-10°С/час
Выдержка 4 часа
Разогрев до 525°С со скоростью 5-10°С/час
Выдержка 2 часа.
3.3 Состав
испытуемых катализаторов
За время выполнения дипломной работы на термогравиметрической
установке при атмосферном давлении и скорости 15000 обратных часов были
исследованы отечественные катализаторы СА-1В и СА-КЖ, а также китайский
А-110-1, их состав представлен в таблице 1.
К изучению были подобраны образцы, близкие по составу тем,
которые испытывались в дальнейшем в колонне при давлении 50 атм, с целью
определить оптимальный температурный режим восстановления на установке высокого
давления.
Табл.1. Состав катализаторов, испытанных на
термогравиметрической установке.
|
Катализатор
|
FeO
|
K2O
|
Al2O3
|
CaO
|
Фракция, мм
|
|
СА-КЖ
|
32
|
0,9
|
3,0
|
2,2
|
1,5 - 3
|
|
А-110-1
|
32,7
|
0,73
|
2,2
|
2,2
|
1,5 - 3
|
|
СА-1В
|
32
|
0,7
|
3,5
|
2,5
|
1,5 - 3
|
На установке высокого давления было проведено три серии
опытов, в каждой из которой исследовалось восстановление четырёх образцов,
одним из которых являлся стандартный катализатор СА-1В.
В первом цикле экспериментов к изучению было предложено два
железных катализатора синтеза аммиака производства Китая, один в оксидной
форме, другой в предварительно восстановленной. Образцы были закуплены у компании
Sud
Chemie AG
для загрузки в промышленные агрегаты на производстве. В третий канал колонны
был загружен образец осаждённого катализатора, подготовленного в лаборатории
кафедры ТНВ РХТУ.
Далее эксперимент продолжился со следующими образцами: двумя железными
осаждёнными и одним образцом, выполненным из углеродной основы (кокосовой
скорлупы) и нанесенным оксидом калия и металлическим рутением.
Третья и заключительная серия экспериментов была проведена с
тремя осаждёнными железными катализаторами с отличающимися условиями
приготовления и составом. В одном образце содержалось значительно меньше
структурообразующего промотора Al2O3, два других отличались
температурой прокалки. Так, катализатор № 8 прокаливался при температуре 700ºС, а катализатор №9 - при 500ºС. Катализатором
сравнения служил также стандартный СА-1В.
Условия восстановления во всех трёх сериях экспериментов были
следующими: давление 50 атмосфер, объёмная скорость 30000 обратных часов.
Данные по составу каждого из образцов представлены в таблице
2.
Табл.2. Состав катализаторов, испытанных на установке
высокого давления.
|
Серия
|
№
|
Катализатор
|
Состав, % масс.
|
|
|
|
FeO
|
K2O
|
Al2O3
|
CaO
|
С
|
Ru
|
|
I
|
1
|
Ammomax-10,оксидная форма
|
29,0
|
0,31
|
1,4
|
1,5
|
|
|
|
2
|
Ammomax-10,предварительно восстановленная форма
|
35,1
|
0,39
|
1,8
|
1,8
|
|
|
|
3
|
Осаждённый
железный-1
|
32,0
|
1,0
|
2,5
|
2,2
|
|
|
|
II
|
4
|
Осаждённый
железный - 2
|
34,0
|
0,8
|
3,0
|
2,0
|
|
|
|
5
|
Ru-содержащий, на углеродной основе
|
|
3,0
|
|
|
89,6
|
5,5
|
|
6
|
Осаждённый
железный - 3
|
32,0
|
1,0
|
1,4
|
1,8
|
|
|
|
III
|
7
|
Осаждённый
железный - 4
|
36,0
|
1,3
|
1,5
|
2,5
|
|
|
|
8
|
Осаждённый
железный - 5 t прокалки 700 ºС
|
34,0
|
1,5
|
3,5
|
2,4
|
|
|
|
9
|
Осаждённый
железный - 6 t прокалки 500 ºС
|
34,0
|
1,5
|
3,5
|
2,4
|
|
|
|
10
|
СА-1-В
|
32,0
|
0,8
|
3,2
|
2,4
|
|
|
4. Результаты
и обсуждения
4.1
Восстановление катализаторов на термогравиметрической установке
На рисунках 4, 5, 6 приведены зависимости скорости и степени
восстановления катализаторов синтеза аммиака СА-1-В, СА-КЖ и А-110-1 в токе
азотоводородной смеси стехиометрического состава от продолжительности процесса
при ступенчатом подъёме температуры.
Наблюдается общая тенденция для всех образцов -
восстановление промышленных катализаторов с заметной скоростью начинается при 350-400ºС и завершается при температуре около 500 ºС
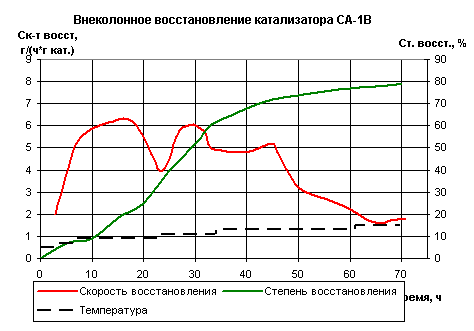
Рис.5. Внеколонное восстановление катализатора СА-1В
По данным графиков, представленных на
рис.5, можно предложить режим восстановления для катализатора СА-В. Видно, что
восстановление катализатора при 400°С и 425 происходит в сравнительно небольшие
промежутки времени, а именно: при 400°С - 2 часа, а при 425°С - 5 часов. При
повышении температуры до 450°С наблюдается увеличение скорости восстановления,
которая достигает своего максимума после 16 часов восстановления данного
образца. Затем скорость неизменно падает, что свидетельствует об окончании
процесса восстановления при данной температуре. Это означает, что режим
восстановления при 450°С можно было бы сократить примерно на 3 часа. Далее при
475°С максимум скорости наблюдается после 30 часов восстановления, затем
скорость начинает падать, свидетельствуя о завершении восстановительного
процесса, продолжительность которого можно сократить, примерно на 2 часа по
сравнению с результатом, полученным экспериментальным путём.
При 500°С образец восстанавливается за 43
часа, что видно из графика, затем скорость падает в течение 19 часов. На 7
часов можно было бы сократить восстановление при 500°С.
Максимальная скорость при 525°С
достигается примерно через 70 часов, затем скорость выходит на
"плато". Процесс восстановления образца СА-В закончен.
Таким образом, анализ режима
восстановления катализатора СА-В показал возможность сокращения общего времени
восстановления примерно на 12 часов.
Говоря о степени восстановления, следует
заметить, что до 500°С она растет более стремительно, нежели при более высоких
температурах. В интервале температур от 500°С до 525°С увеличение степени
восстановления не столь значительно. Восстановление длится 38 часов, причем а с
65 % при 500°С увеличивается до 80 % при 525°С, что говорит о
нецелесообразности дальнейшего подъёма температуры с целью увеличения степени
восстановления катализатора.
Рекомендации по температурному режиму
восстановления представлены в табл.3
Табл.3. Рекомендации по температурному режиму восстановления
ёкатализатора СА-1В
|
Температура, ºС
|
Фактическое
время выдержки, ч
|
Рекомендуемое
время выдержки, ч
|
|
400
|
2
|
2
|
|
425
|
5
|
5
|
|
450
|
15
|
12
|
|
475
|
11
|
9
|
|
500
|
28
|
21
|
|
525
|
10
|
9
|
|
Итого:
|
71
|
58
|
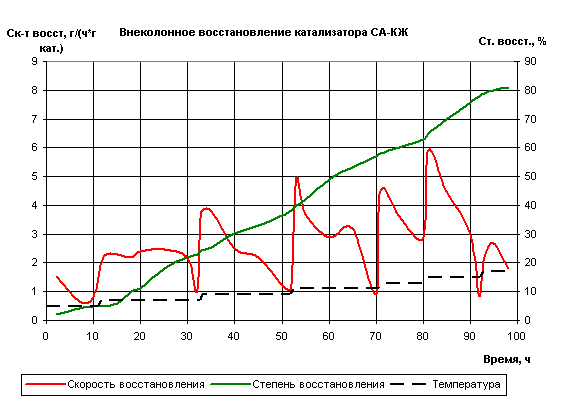
Рис.6 Внеколонное восстановление катализатора
СА-КЖ
Максимум скорости при 425°С был отмечен
после 35 часов с начала восстановления. Затем скорость снижалась. Опять же
режим восстановления можно сократить.
Из графика видно, что температуре 450°С
соответствует максимальная скорость восстановления, равная пяти г/ (ч·г кат),
достигнутая после 53 часов, и процесс длился ещё в течение 17 часов, из которых
4 часа оказались лишними.
График также показал, что время
восстановления образца при 475°С время выдержки можно снизить на три часа, а
при 500°С - на два часа. А при 525°С процесс можно было бы продлить, хотя
образец при данной температуре практически восстановился. То есть сокращение
общего времени восстановления катализатора СА-КЖ могло бы составить 15-17
часов.
Что касается степени восстановления, то
она монотонно возрастает на всем протяжении процесса. Максимальная степень
восстановления для данного катализатора равна 81,5
Табл.4. Рекомендации по температурному режиму восстановления
катализатора СА-КЖ
|
Температура, ºС
|
Фактическое
время выдержки, ч
|
Рекомендуемое
время выдержки, ч
|
|
375
|
12
|
9
|
|
400
|
20
|
18
|
|
425
|
20
|
18
|
|
450
|
18
|
15
|
|
475
|
10
|
7
|
|
500
|
12
|
10
|
|
525
|
4
|
3
|
|
Итого:
|
96
|
80
|
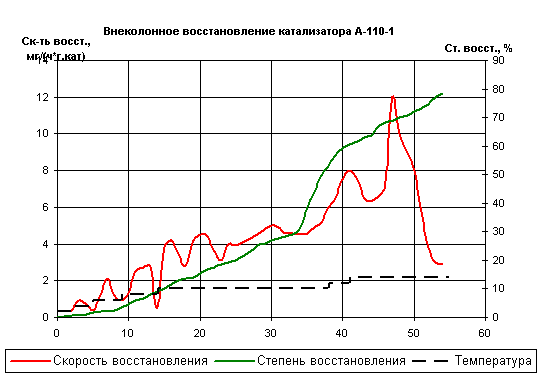
Рис.7 Внеколонное восстановление катализатора
А-110-1
На рисунке 7 показан оптимальный режим
восстановления катализатора А-101-1. Общее время процесса не превышает 55
часов, а степень восстановления при этом не меньше, чем у других образцов и
близка к 80 %. Таким образом, изучение внеколонного восстановления показало,
что для китайского образца А-110-1 общее время, затрачиваемое на
непроизводительный процесс в 1,3-1,5 раз меньше, чем для стандартных железных
плавленых катализаторов типа СА-1В. Сопоставление состава исследованных
катализаторов с результатами восстановления показало, что существует прямая
корреляция между содержанием А12O3 в образцах и временем
восстановления. Так в образце А-110-1 (1) содержание А12O3 составляет 2,2% против
3,5% для СА-В и как результат - резкое снижение выдержки температуры 450°С.
Табл.5. Рекомендации по температурному режиму восстановления
катализатора А-110-1.
|
Температура, ºС
|
Фактическое
время выдержки, ч
|
Рекомендуемое
время выдержки, ч
|
|
375
|
5
|
3,5
|
|
400
|
4
|
2,5
|
|
425
|
5
|
3,5
|
|
450
|
24
|
24
|
|
475
|
7
|
3,5
|
|
500
|
10
|
5,5
|
|
Итого:
|
55
|
42,5
|
Как показали результаты экспериментов на
термогравиметрической установке, максимальная температура, при которой
целесообразно проводить процесс восстановления для вышеописанных образцов,
равна 525ºС На установке высокого давления образцы катализаторов ранее
восстанавливали по отлаженной методике в интервале температур 350-500 ºС. Во время выполнения дипломной работы было предложено продолжить
восстановление в колонне при более высокой температуре - 525 ºС.
4.2
Восстановление катализаторов на установке высокого давления
Отсутствие кислородосодержащих веществ в
газе при восстановлении катализатора при пониженных температурах - основное
условие получения активного катализатора, механически прочного, с максимальным
сроком эксплуатации.
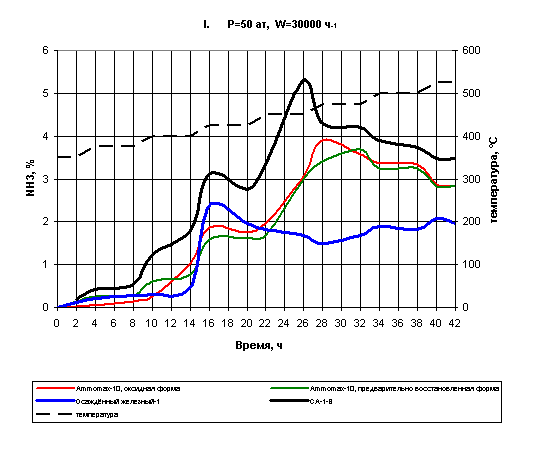
Рис.8 Восстановление катализаторов I
Как видно из графика на рис.6, все три катализатора, состав
которых показан в табл.2, при восстановлении показали меньший выход аммиака,
чем стандартный образец во всём изученном интервале температур. Так, если
максимальный % NH3 для катализатора СА-1В составил 5,3 %, то для китайских образцов
максимальный выход аммиака оказался равным 3,8 % и 3,6% (для оксидной и предварительно
восстановленной форм соответственно), а для железного осаждённого - 2,4 %.
Несмотря на то, что один из катализаторов AMMOMAX-10 предварительно восстановлен, ход кривых обоих китайских
образцов практически одинаков. При этом при температуре 375 ºС у двух катализаторов выход аммиака
составляет 0,2-0,4 %. С повышением температуры до 400 ºС предварительно восстановленный
катализатор в два раза быстрее восстанавливается, чем катализатор в оксидной
форме, это значит, что при данной температуре время выдержки предварительно
восстановленного катализатора можно сократить на два часа. При дальнейшем
повышении температуры до 425 ºС видно, что выход аммиака на оксидном катализаторе на
10-15% выше относительно выхода аммиака на предварительно восстановленном катализаторе.
При 400 ºС выход
аммиака растёт на протяжении всей выдержки одинаково для обоих образцов.
Оксидный катализатор практически полностью восстанавливается при 425 ºС в начале выдержки, показывая выход
аммиака 3,8% в то время как предварительно восстановленный образец на шесть
часов позже достигает максимума восстановления который соответствует
концентрации аммиака 3,6 %.
Полученные данные отличаются от поведения отечественного
предварительно восстановленного образца СА-1В, который на всём изученном интервале
температур имел выход аммиака выше, чем у аналогичного китайского образца.
Данный факт можно объяснить нерациональными условиями восстановления
катализатора АММОМАХ-10, а именно: возможно нарушен температурный режим
(вероятно, скорость нагрева оказалось высокой), неправильно подобрана скорость
газа-восстановителя. После восстановления катализатора вне колонны его
необходимо запассивировать. Вероятно, могли быть неправильно подобраны условия
пассивации. В связи с этим на данный момент можно предположить, что
использование в промышленных агрегатах китайского катализатора АММОМАХ-10,
предварительно восстановленного вне колонны, не выглядит перспективным.
Помимо плавленых железных катализаторов в первой серии опытов
исследовался железный осаждённый катализатор, приготовленный в лаборатории ТНВ
РХТУ. Его состав также представлен в таблице 2. Сам образец представлялся как
низкотемпературный, что подтверждается дальнейшим экспериментом.
При температурах 375 ºС и 400 ºС выход аммиака остаётся постоянным и составляет
0,5%. Это может означать, что при указанных температурах скорость
восстановления упала и выдержку можно сократить. Далее наблюдается резкий
подъём выхода аммиака при 425 ºС, однако при этой температуре происходит максимум
восстановления, после чего процент NH3 достаточно резко снижается до 1,5%.
Таким образом, опираясь на результаты данного эксперимента, можно
рекомендовать следующие технологические режимы для испытанных катализаторов:
Табл.6. Рекомендации по температурному режиму восстановления катализаторов
первой серии опытов.
|
Темпе-ратура, ºС
|
Фактическое
время выдержки, ч
|
Рекомендуемое
время выдержки для образцов, ч
|
|
|
АМОМАХ-10
(оксидная форма)
|
АМОМАХ-10(предварительно
восстановленная форма)
|
Осаждённый-1
|
|
375
|
2
|
2
|
2
|
2
|
|
подъём
|
2
|
2
|
2
|
2
|
|
400
|
4
|
2
|
2
|
2
|
|
подъём
|
2
|
2
|
2
|
3
|
|
425
|
4
|
2
|
2
|
2
|
|
подъём
|
2
|
2
|
2
|
2
|
|
450
|
4
|
4
|
4
|
4
|
|
подъём
|
2
|
2
|
2
|
0
|
|
475
|
4
|
2
|
4
|
0
|
|
подъём
|
2
|
0
|
0
|
0
|
|
500
|
4
|
0
|
0
|
0
|
|
подъём
|
2
|
0
|
0
|
0
|
|
525
|
4
|
0
|
0
|
0
|
|
Итого, ч
|
38
|
20
|
22
|
17
|
|
|
|
|
|
|
|
|
На рис.9 представлены результаты восстановления Ru-содержащего и двух
железных осаждённый катализаторов, подробный состав которых показан в табл.2.
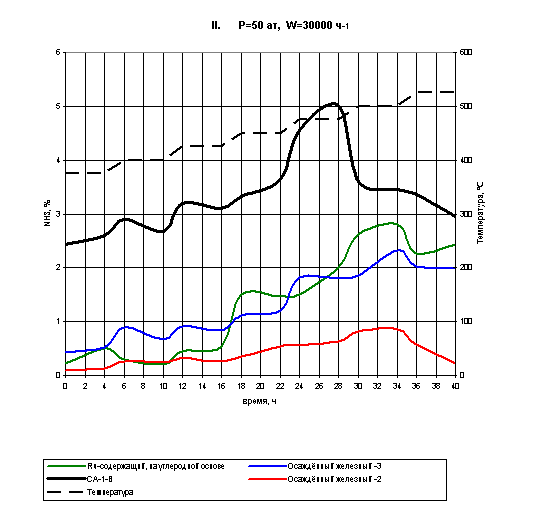
Рис.9. Восстановление катализаторов II
Из приведённых данных видно, что Ru-содержащий образец на
активном угле проявляет заметной активности вплоть до температуры 450 ºС, выход аммиака при этом составляет 0,3-0,5%. Начиная с
температуры 450 ºС содержание NH3 в канале с данным
образцом возрастает до знаения 1,5%, после чего восстановление прекращается до
следующего повышения температуры. Следовательно, на этом участке вполне
возможно сократить время выдержки катализатора. С повышением температуры до 500
ºС выход аммиака снова растёт, достигая максимального значения 2,8
%. При этом катализатор максимально восстанавливается, поэтому при более
высокой температуре его можно не выдерживать.
Осаждённый катализатор 2 (в табл.2 под №4) и осаждённый
катализатор 3 (в табл.2 под №6) показали следующие результаты. Оба катализатора
полностью восстанавливаются при температуре 500 ºС, однако катализатор 3
показывает выход аммиака в два раза больший, чем катализатор 2 в интервале
температур 375 - 450 ºС и в три раза - в
интервале 475 - 525 ºС. Максимальный выход
аммиака для осаждённого катализатора-2 составил 0,8 % при температуре 400 ºС, для осаждённого катализатора-3 - 2,4% также при 400 ºС
В итоге рекомендации по восстановлению данных образцов носят
следующий характер:
Табл.7. Рекомендации по температурному режиму восстановления
катализаторов второй серии опытов.
|
Темпе-ратура, ºС
|
Фактическое
время выдержки, ч
|
Рекомендуемое
время выдержки для образцов, ч
|
|
|
Осаждённый-2
|
Ru-содержащий,на углеродной основе
|
Осаждённый-3
|
|
375
|
2
|
1
|
2
|
1
|
|
подъём
|
2
|
2
|
2
|
2
|
|
400
|
4
|
2
|
2
|
2
|
|
подъём
|
2
|
2
|
2
|
2
|
|
425
|
4
|
1
|
2
|
2
|
|
подъём
|
2
|
2
|
2
|
2
|
|
450
|
4
|
1
|
3
|
1
|
|
подъём
|
2
|
2
|
2
|
2
|
|
475
|
4
|
1
|
2
|
1
|
|
подъём
|
2
|
2
|
2
|
2
|
|
500
|
4
|
4
|
4
|
4
|
|
подъём
|
2
|
0
|
0
|
0
|
|
525
|
4
|
0
|
0
|
0
|
|
Итого, ч
|
38
|
20
|
25
|
21
|
|
|
|
|
|
|
|
|
На рис.10 представлены кривые зависимости выхода аммиака от
времени при ступенчатом подъеме температуры для трёх осаждённых катализаторов,
состав которых показан в табл.2.
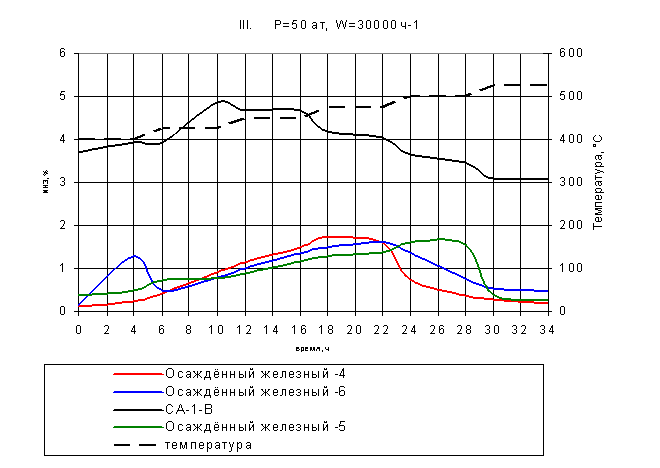
Рис.10. Восстановление катализаторов III
На осаждённом катализаторе-4 (в табл.2 под №7) с ростом
температуры происходит постеленное увеличение выхода аммиака с максимумом 1,8%
при температуре 475 ºС, в то время как наибольший
процент аммиака в канале с осаждённым катализатором-5 (в табл.2 под №8)
достигается при температуре 500 ºС и составляет 1,75%. Это
можно объяснить пониженным содержанием структурообразующего промотора А12O3 в катализаторе-4.
Быстрый рост выхода аммиака для осаждённого катализатора - 6 (в табл.2 под №9),
а затем резкий спад активности можно объяснить условиями приготовления данного
образца. Осаждённый катализатор-6 прокаливался при температуре 500 ºС, в то время как два других - при 700 ºС. Во время восстановления при температуре 400 ºС началось интенсивное испарение воды, что способствовало
перекрытию активных центров катализатора, что привело к резкому снижению выхода
аммиака. Наибольшего значения концентрация аммиака в канале с данным образцом
достигла при температуре 475 ºС и составила 1,6%.
Рекомендации по выдержке этих трёх катализаторов представлены
в таблице 8.
Табл.8. Рекомендации по температурному режиму восстановления
катализаторов третьей серии опытов.
|
Темпе-ратура, ºС
|
Фактическое
время выдержки, ч
|
Рекомендуемое
время выдержки для образцов, ч
|
|
|
Осаждённый-4
|
Осаждённый-5
|
Осаждённый-6
|
|
400
|
4
|
1
|
1
|
4
|
|
подъём
|
2
|
2
|
2
|
2
|
|
425
|
4
|
4
|
1
|
4
|
|
подъём
|
2
|
2
|
2
|
2
|
|
450
|
4
|
4
|
4
|
4
|
|
подъём
|
2
|
2
|
2
|
2
|
|
475
|
4
|
2
|
2
|
4
|
|
подъём
|
2
|
0
|
2
|
0
|
|
500
|
4
|
0
|
4
|
0
|
|
подъём
|
2
|
0
|
0
|
0
|
|
525
|
4
|
0
|
0
|
0
|
|
Итого, ч
|
34
|
17
|
20
|
22
|
4.3 Выводы
1. С целью изучения процесса восстановления аммиачных
катализаторов на термогравиметрической установке и установке высокого давления
был исследован ряд промышленных катализаторов (СА-1В, СА-КЖ, А-301-1,
АММОМАХ-10) и образцов, приготовленных в лабораторных условиях (железные
восстановленные катализаторы с различным содержанием промоторов и отличающимися
условиями приготовления).
. Результаты экспериментов, проведённых на
термогравиметрической установке позволили оптимизировать температурный режим
восстановления катализаторов синтеза аммиака на установке высокого давления:
образцы выдерживались в интервале температур 350-525°С.
. Анализ режима восстановления для P=50 атм., W=30000 ч-1
показал возможность сокращения времени выдержки при температурах: 375°С - до
одного часа, 400°С - до двух часов, 425°С - до трёх часов, 450°С - до трёх
часов, 475°С - до трёх часов, в зависимости от типа катализаторов. Для
китайских образцов на основе вюстита возможно прекращение выдержки уже при
475°С.
. Анализ внеколонного восстановления при атмосферном давлении
и W=15000 ч-1 показал
возможность сокращения времени выдержки при температурах 375°С - до трёх часов,
400°С - до двух часов, 425°С - до двух часов, 450°С - до трёх часов, 475°С - до
3,5 часов, 500°С - до семи часов, 525°С - до одного часа.
. Рациональные режимы восстановления позволили сократить
общее время процесса без потери активности на 13-16 часов при атмосферном
давлении и на 13-20 часов при давлении 50 атм.
5. Приложения
5.1 Охрана
окружающей среды
5.1.1
Введение
Охрана окружающей среды - это совокупность мероприятий,
направленных на рациональное использование, сохранение и воспроизводство
природных ресурсов, используемых человеком в народном хозяйстве. Сбережение
атмосферы Земли, её недр, фауны и флоры - залог сохранения природных условий
развития человеческого общества.
Воздействие населения планеты на её природу приобрело
глобальный характер с середины прошлого столетия. Из года в год из недр Земли
добывается более 100 млрд. т различных пород, топлива и выбрасываются в
атмосферу сотни миллионов тонн оксидов азота и углерода, CO2 и SO2, более 400 млн. т
твердых частиц сажи, золы и пыли; сбрасывается в реки, моря и океаны около 10
млн. т. нефти и нефтепродуктов, порядка 600 млрд. т бытовых и промышленных
стоков. Химическая промышленность входит в десяток основных источников
загрязнений, а также является одним из основных потребителей природных
ресурсов. В свою очередь неорганическая химия - одна из основных составляющих
отрасли, для неё характерны крупнотоннажность и энергоёмкость. Поэтому охрана
окружающей среды и рациональное использование природных ресурсов, несомненно,
важный вопрос в технологии неорганических веществ.
Прежде всего, необходимо уделять внимание очистке вредных выбросов.
Важно совершенствовать и внедрять новые технологические схемы производства,
позволяющие возвращать в цикл часть тепловых и материальных потоков, чтобы
использовать долю отходов в качестве вторичного сырья. Водопотребление должно
быть замкнутым.
5.1.2
Экологическая характеристика технологической схемы
С точки зрения экологии данная работа, посвященная вопросам
оптимизации условий восстановления катализаторов синтеза аммиака, что должно
позволить, в конечном счете, более рационально использовать сырьё и
энергоресурсы и снизить нагрузку на окружающую среду.
Цель данной дипломной работы - исследование процесса
восстановления катализаторов синтеза аммиака.
Процесс исследования катализаторов проходит по замкнутой
схеме. Аммиак из баллона поступает в прямой крекер и разлагается на
азото-водородную смесь (АВС) стехиометрического состава. Далее АВС после
очистки поступает в колонну с образцами, где образуется аммиак. разлагается на
азото-водородную смесь в обратном крекере и поступает в голову процесса.

Рис.11. Блок-схема процесса.
Как видно из схемы, образуются два вида отходов: раствор
сульфата аммония (NH4) 2SO4 (0,05М) с некоторым содержанием аммиака в
количестве около сорока литров за один цикл и катализаторная пыль (0,1 - 0,3
процента от загрузки 8 г, т.е.0,008 - 0,024 г).
Табл.9. Отходы производства.
|
Вид отходов
|
Количество
|
|
Раствор (NH4) 2SO4
(от 0,01 до 0,05М)
|
40 л
|
|
Катализаторная
пыль (Fe3O4)
|
0,008 - 0,024 г
|
5.1.3
Переработка и обезвреживание газообразных отходов
В процессе работы установки газообразные отходы не
образуются.
5.1.4
Переработка и обезвреживание жидких отходов
Табл.10. Жидкие отходы производства.
|
Состав стоков
|
Концентрация,
г/л
|
Температура
|
Общее
количество, м3
|
|
Вода,
содержащая аммиак, сульфат аммония
|
0,26,6
|
15-20
|
0,06
|
Сброс периодический, до 0,001 м3/час, загрязнен
механическими примесями, направляется в канализацию. Тип канализации -
хозяйственно-бытовая. (В лаборатории имеется 8 приемных устройств и 8
гидрозатворов, предназначенных для предотвращения проскока вредных веществ и
пожароопасных веществ (паров) из канализации в помещение и воспрепятствования
распространению огня в случае пожара).
5.1.5
Переработка и обезвреживание твердых отходов
Твердыми отходами являются отработанные катализаторы.
Отработанные катализаторы направляются на переработку на заводы-производители.
5.1.6
Экономическая оценка природоохранных предприятий
1. Оценка ущерба от загрязнений гидросферы.
Схема 1: Обезвреживание сточных вод.

Общая величина ущерба от загрязнения водной среды
определяется в соответствии с формулой [24]:
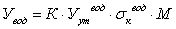 К = 1;
К = 1;
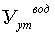 = 24000 руб/усл. т. - удельный ущерб, причиняемый народному
хозяйству сбросом в водоемы одной условной тонны загрязняющих веществ;
= 24000 руб/усл. т. - удельный ущерб, причиняемый народному
хозяйству сбросом в водоемы одной условной тонны загрязняющих веществ;
σквод
- показатель относительной опасности загрязнения водоемов;
σквод
= 2,6 (1, табл.5);
М - приведенная масса сбрасываемых в водоемы веществ (усл. т).
Приведенная масса загрязняющих веществ в годовом объеме сточных
вод может быть определена в условных тоннах, как:
М=∑Аiвод mi, где
mi - масса примесей i-го вида, поступающих в водные объекты, т/год;
Аiвод=1/ПДКврi, (1, табл.4) где
ПДКврi -
ПДК вещества в воде рыбохозяйственных объектов, мг/л.
mNH4+ = 6,6 г/л ∙ 0,001 ∙ 103 л ∙ 40 л/цикл
= 264 г/цикл = 0,000264 т/цикл
Табл.11. Ущерб окружающей среде
|
Вещество
|
Aiвод
|
mi
|
М
|
% после очистки
|
mi после обезвре-живания,
|
М после
обезвре-живания,
|
|
усл. т/т
|
т/цикл
|
усл. т/цикл
|
|
т/цикл
|
усл. т/цикл
|
|
NH+4
|
2
|
0,000264
|
0,000528
|
1
|
0,00000264
|
0,00000528
|
ВУ = 1· 24000 · 2,6 · 0,000528· 78 = 2570
руб/цикл=64250 руб/год
ФУ = 1· 24000 · 2,6 · 0,00000528 · 78 =
25,7 руб/цикл=642,5 руб/год
ПУвод = ВУ - ФУ = 2544,3 руб / цикл. =63607,5
руб/год
Всего ПУ = ПУвод = 2544,3 руб / цикл. = 63607,5
руб/год
Платы за сбросы загрязняющих веществ в размерах, не
превышающих установленные природопользователю предельно допустимые нормативы
сбросов, определяется по формуле:
Пн вод=Снi вод ∙ Мi вод, где
ставка платы за выброс 1 т загрязняющего вещества
Снi вод =Нбнi вод · Кэ вод
Коэффициент экологической ситуации и экологической значимости
поверхностного водного объекта Центральном регионе Кэ вод=1,2 (1,
табл.27).
Табл.12. Предотвращенный ущерб.
|
Вещество
|
Нбнi вод,руб/т
|
Снi вод, руб. /т
|
mi вод, тдо очистки
|
Пн вод,
руб.до очистки
|
mi вод, тпосле очистки
|
Пн вод,
рубпосле очистки
|
|
NH+4
|
5545
|
6654
|
0,000264
|
1,75
|
0,00000264
|
0,018
|
Таким образом, уменьшение платы за природопользование после
внедрения природоохранных мероприятий составит:
(Считаем, что всего в год 25 циклов.)
П − П’ = (1,75 - 0,018) · 25 = 43,3 руб/год.
5.1.7
Заключение
Представленные расчеты свидетельствуют о том, что технология
при данном методе изучения катализаторов синтеза аммиака является сравнительно
малоотходной. Результаты, полученные с помощью этого метода, позволят выбрать
более рациональный режим восстановления катализатора, что может способствовать
экономии энергоресурсов и сырья.
5.2 Охрaнa
труда
5.2.1 Опасные
и вредные производственные факторы наосновных стадиях
выполняемой работы
Дипломная работа выполнялась в лаборатории высоких давлений и
заключалась в исследовании процесса восстановления аммиачных катализаторов. В
процессе выполнения данной работы могли создаваться следующие вредные и опасные
факторы:
Физические факторы
повышенная температура поверхностей оборудования;
повышенное значение напряжения в электрической цепи,
замыкание которой может произойти через тело человека;
повышенный уровень шума на рабочем месте человека;
недостаточная освещенность на рабочем месте по ГОСТ 12.0.003
[26]
5.2.2
Основные физико-химические, токсические и пожаро-взрывоопасные свойства
используемых в работе веществ
Табл. 13. Свойства обращающихся в производстве веществ.
|
Наименование
|
Агрегатное
состояние
|
Физико-химические
свойства
|
Токсические
свойства
|
Средства
индивидуальной защиты
|
|
|
|
Токсический
характер действия на организм
|
ПДКР.З. мг/м3,
класс опасности
|
|
|
Водород
|
Бесцветный, не
имеющий запаха газ
|
удельный вес
0,09 г/л, плотность относительно воздуха 0,07, растворимость в воде 0,16
мг/100 г воды при 200С, молекулярный вес - 2,016
|
физиологически
инертен, при высоких концентрациях в воздухе вызывает, наркотическое чувство
вызывает при высоких давлениях
|
−
|
Шланговый
противогаз ПШ-1, ПШ-2, кислородный изолирующий противогаз КИП-7.
|
|
Азот
|
Бесцветный, не
имеющий запаха газ
|
удельный вес
1,28 г/л, плотность относительно воздуха 0,97, растворимость в воде 2 мг/100
г воды при 200С, молекулярный вес - 44,01
|
физиологически
инертен, оказывает удушающее действие из-за недостатка кислорода
|
−
|
Шланговый или
кислородный изолирующий противогаз
|
|
Аммиак
|
Бесцветный газ
с резким специфическим запахом
|
удельный вес
0,77 г/л, плотность относительно воздуха 0,596,tкип= - 330С, растворимость в
воде 702 объема/объем воды при 200С, молекулярный вес - 17,03
|
при небольших
концентрациях раздражает верхние дыхательные пути и глаза, вызывает удушье и
слезотечение, в высоких концентрациях возбуждает ЦНС, вызывая судороги, при
острых отравлениях может наступить смерть от отека легких и сердечной
недостаточности, при попадании в глаза возможна потеря зрения
|
20 класс 4
|
Фильтр. пром.
противогаз марки "КД" (серая коробка), при наличии других
газов-марки "М" (красная коробка), защитные перчатки, очки,
спецодежда
|
Пожаровзрывоопасные свойства веществ
Аммиак - горючий газ; температура самовоспламенения 650 0С;
область воспламенения в смеси с воздухом 15-28% об., 110-200 г/м3; в
смеси с кислородом 15-79%; минимальная энергия зажигания 680 мДж; максимальное
давление взрыва 6 кГ/см2. Максимальная взрывоопасная концентрация
14,3%.
Азот - негорюч.
Водород - горючий газ; температура самовоспламенения 510 0С;
область воспламенения 4,0 - 75%об., 3,3 - 62 г/м3; минимальная
энергия зажигания 0,017 мдж; максимальное давление взрыва6,7кГ /см2;
скорость возрастания давления взрыва 900 кГ /см2*сек. Минимальное
взрывоопасное содержание кислорода при разбавлении водородовоздушных смесей углекислым
газом 7,9% об., при разбавлении азотом 5,0% об. Для предупреждении взрыва при
аварийном истечении водорода и тушения факела в закрытых объемах необходима
минимальная огнегасительная концентрация углекислоты 62% об., азота 76% об. [27]
Табл.14 Санитарная классификация (по СН 245-63).
|
Вещество
|
Группа
производственных процессов
|
Ширина
санитарной защитной зоны, м
|
|
Аммиак
|
IIд
|
500
|
|
Водород
|
Ia
|
50
|
|
Азот
|
Ia
|
50
|
5.2.3 Режим
личной безопасности
Перед выполнением данной дипломной работы был проведен
инструктаж по технике безопасности при работе в химической лаборатории
/инструкция 6-ТБ/. Далее проходила стажировка на рабочем месте в течение
недели. Также были изучены инструкции:
− по электробезопасности для сотрудников и студентов
РХТУ им.Д.И. Менделеева
− по пожарной безопасности в РХТУ им.Д.И. Менделеева
/10-ТБ/.
В качестве средства индивидуальной защиты использовался
лабораторный халат.
5.2.4
Производственная санитария
Размер лаборатории
Помещение лаборатории имеет следующие размеры: общая площадь
помещения - 60 м2; высота помещения - 5 м; площадь, занимаемая
оборудованием - 28 м2; кубатура помещения - 300 м3;
В лаборатории работает − 4 человека, на одного человека
приходится - 15 м2 площади пола, 75 м3 воздуха. Эти
значения удовлетворяют нормам: нормативная площадь пола на одного работающего в
соответствии с [28] составляет 4,5 м2, норма кубатуры − 15 м3.
Вентиляция.
Помещение имеет естественную и искусственную вентиляцию.
Естественную вентиляцию обеспечивает неорганизованный приток
воздуха через оконные и дверные проемы.
Искусственная вентиляция осуществляется за счет
вентиляционной установки. В соответствии с паспортными данными лаборатория
оснащена вентиляционной вытяжной системой В-27. По способу организации
воздухообмена она является местной, предназначенной для отсоса вредных
выделений /газы, пары, пыль/ в местах их образования и удаления из помещения
/вытяжной шкаф/, при определенных условиях работы может выполнять роль
искусственной общеобменной вентиляции.
По паспортным данным [29] производительность вентиляционной
установки Q
- 5400 м3/ч.
При оценке эффективности работы общеобменной вентиляционной
установки в помещении лаборатории, необходимо учесть, что данная вентиляционная
установка работает и на две соседние лаборатории, объем которых составляет 775
м3. Эффективность работы установки оценивается по формуле: К = Q / V,
где Q − производительность вентиляционной установки, м3/ч;
V − суммарный объем вентилируемого помещения, м3
К = 5400 / (300 + 775) = 5 час-1
Такой результат соответствует норме 4-6 час-1.
Скорость воздуха в рабочем проеме вентиляционного шкафа
оценивается по формуле: V = Q / S ∙ 3600,где S - суммарная площадь сечения рабочих проемов (с
учетом шкафов в других лабораториях), м2
V = 5400/1,49 ∙ 3600 =1,01 м/с
Такая скорость воздуха в рабочем сечении вентиляционного
шкафа позволяет работать с веществами 2-го и 3-го классов опасности.
Метеорологические условия
По ГОСТУ 12.1.005-88 для работы легкой категории 16
предусмотрены нормы:
Топ = 21-23° С Тдоп = 20-24° С
Влажность: оптимальная - 40%, допустимая - 75%. Скорость
движения воздуха: оптимальная - 0,2 м/с, допустимая - 0,1-0,3 м/с. По
паспортным данным температура в холодное время года +20°С, таким образом,
нормативы соблюдаются.
Освещение
При работе в лаборатории используется боковое
естественное и искусственное освещение. Нормированное значение коэффициента
естественной освещенности КЕО - 1,5% при работе средней точности. Фактическое
значение КЕО - 1,5%. Для работ средней точности при искусственном освещении
значение нормативной освещенности равно 300 Лк. Значение фактической
освещенности совпадает с нормативным. В лаборатории используются люминесцентные
лампы типа ЛД-20. Для расчета числа люминесцентных ламп используют формулу:
n = (E ·S·z·k) / (F·u·m),
где F - световой поток одной
лампы, 1000 Лм;
Е - нормативная освещенность, 300 Лк;
S - площадь освещаемого
помещения, 60 м2;
z - поправочный
коэффициент светильника, 1,1;
к - коэффициент запаса, учитывающий
снижение освещенности при эксплуатации, 1,2;
u - коэффициент
использования, зависит от размеров и конфигурации помещения, высоты подвеса
светильников и индекса помещения, 0,52;
m - число ламп в
светильнике, 2
Индекс помещения:
I = S / с / (а + b),
где а - ширина помещения;
b - длина помещения,
с - высота помещения.
I = 60/5/ (10 + 6) = 0,75
n = (300 · 1,2 · 60 · 1,1) / (1000 · 0,52 · 2) = 22 штуки.
Фактически в лаборатории имеется 20 светильников,
следовательно, нормы по освещению не соблюдаются.
Шум
Источником шума в лаборатории является вентиляционная
установка. Характер шума - механический. Нормативный уровень звукового давления
при среднегеометрической частоте октановых полос 1000 Гц составляет 75 дБ [52].
Шумовые характеристики рабочего помещения в паспорте лаборатории не указаны,
поэтому сравнить их с нормативными данными нельзя.
Водоснабжение
Система водоснабжения в лаборатории хозяйственно-питьевая.
Источником горячей воды является ТЭЦ, холодной - городской водопровод. Источник
водоснабжения - городская сеть.
Канализация
Тип канализации - хозяйственно-бытовая. В лаборатории имеется
8 приемных устройств и 8 гидрозатворов, предназначенных для предотвращения
проскока вредных веществ и пожароопасных веществ (паров) из канализации в
помещение и воспрепятствования распространению огня в случае пожара.
Отопление
Тип отопления в лаборатории - водяное, центральное. В
холодное время года средняя температура в помещении +20°С, в теплое время года
+25°С [59].
5.2.5 Техника
безопасности
Безопасность при работе с аппаратами и сосудами под
давлением.
При работе с газовыми баллонами необходимо соблюдать
следующие меры безопасности.
В целях предотвращения неправильного использования баллонов,
в боковом штуцере баллонов с негорючими газами делают правую резьбу, а у
баллонов с горючими газами - левую резьбу.
Баллоны окрашивают в отличительные цвета и снабжают
соответствующими надписями. Так, находящийся в лаборатории баллон с аммиаком
желтого цвета, надпись "Аммиак" - черного цвета.
Отбор газа в емкости с более низким давлением производится
при помощи специального редуктора для данного газа.
Редуктор имеет манометры: один для высокого давления,
показывающий давление в баллоне, а другой для низкого давления, определяющий
давление на выходе. Для правильного использования баллонов в них должно быть
остаточное давление не менее 0,5 ат после полного отбора газа.
При навинчивании редуктора необходимо стоять сбоку от него во
избежание отравления газа при срыве редуктора. При использовании баллонов
следует соблюдать следующие правила:
) баллоны должны быть расположены на расстоянии не менее 1 м
от отопительных приборов;
) баллоны должны быть надежно закреплены в вертикальном
положении;
) запрещается использовать редукторы, не соответствующие
газам, а также неисправные редукторы и баллоны;
) баллоны с газами, поддерживающими горение, необходимо
хранить отдельно от других газов и веществ;
) при транспортировке баллонов необходимо применять меры для
предохранения баллонов от ударов (надеть резиновые кольца и т.д.).
Электробезопасность
В лаборатории используется переменный ток с частотой 50 Гц и
напряжением 127В, 220В и 380В. При выполнении экспериментальной части дипломной
работы использовались следующие электроприборы: обогреватели крекеров, колонны
синтеза, компрессор. Для питания силового оборудования и осветительных
приборов, согласно [59], применяется трёхфазная, трех проводная электрическая
сеть.
В помещении лаборатории возможно одновременное
соприкосновение с токоведущими и нетоковедущими частями приборов, что при
неправильном заземлении и других неполадках может привести к тяжелым травмам. Исходя
из этого, помещение лаборатории по опасности поражения людей электрическим
током относится ко второй категории помещений с повышенной опасностью.
Аппаратура, используемая при работе, имеет дополнительную
защиту, т.е. изоляцию, элемент для зануления и провод без заземляющей жилы для
присоединения к источнику питания в соответствии с ГОСТ 12.2.007-75, поэтому
аппаратура относится к классу 0,2.
Пожарная профилактика
Так как в лаборатории находятся горючие и трудно горючие
жидкости, твердые горючие и трудно горючие вещества и материалы, способные при
взаимодействии с водой, кислородом воздуха или друг другом только гореть (пожар
без взрыва), то в соответствии с паспортом лаборатории [29], помещение
относится к категории пожаровзрывоопасности "В".
По паспорту лаборатории класс взрывоопасное помещения по
ПУЭ-В-I-б.
Соответственно этому в помещении лаборатории имеются зоны, в которых при
нормальной эксплуатации взрывоопасные смеси горючих газов и паров ЛВЖ не
образуются, а возможны только в результате аварий или неисправностей. Горючие
газы и ЛВЖ имеются в небольшом количестве, недостаточном для создания
взрывоопасных смесей. Работы с горючими газами и ЛВЖ проводятся без применения
открытого пламени. В помещении лаборатории имеется внешний и внутренний водопровод,
асбестовое одеяло и ящик с песком на случай пожара и огнетушитель. Для
оповещения о пожаре имеется телефон.
Особое внимание должно быть уделено контролю состояния
электрической сети. Сети, питающие лабораторные щитки, должны быть защищены от
перегрузок. Запрещается подключать в штепсельные розетки осветительной сети
приборы, потребляющие ток большего напряжения, чем установлено для данного
щитка.
Лаборатория должна быть оснащена только выпускаемым
промышленностью оборудованием.
5.3
Экономическая часть
5.3.1
Технико-экономическое обоснование проведения дипломной научно-исследовательской
работы
Данная работа посвящена выбору рациональных условий
восстановления новых катализаторов синтеза аммиака. Цель этого исследования -
совершенствование действующей технологии восстановления катализаторов в
промышленности, что должно способствовать экономии ресурсов и снижению
энергозатрат на производство аммиака, а в конечном итоге - удешевлению
продуктов, полученных из него.
В промышленности аммиак используют при получении азотной
кислоты, в производстве азотных минеральных удобрений, в качестве хладагента.
Аммиачная вода является азотным удобрением. Нашатырный спирт используют в
медицине.
Чтобы представить масштабы производства аммиака, приведём
следующие данные: в ноябре 2006-го года выпуск синтетического аммиака в целом
по стране составил 951 тыс. тонн. При мировой цене 165$ за тонну продукта (по
данным журнала Fertilizer за ноябрь), снижение его себестоимости выгодно для
отрасли.
Экономический эффект данного производства достигается
совершенствованием химического состава катализаторов, за счёт введения
промоторов, выбора оптимальной формы и размера зерна.
Работа выполнялась на полупромышленной установке, которая
представляет собой реактор с каналами для исследования четырёх образцов
катализаторов одновременно и вспомогательное оборудование. Были произведены
исследования зависимости активности этих образцов от температуры, давления,
расхода газа. Полученные результаты показали, как ведёт себя каждый образец при
восстановлении и на основе этих данных даны рекомендации по выдержке
катализаторов при ступенчатом повышении температуры во время восстановления.
Настоящая дипломная работа носит научно-исследовательский
характер, посчитать экономический эффект от внедрения новых идей на
производство не представляется возможным из-за отсутствия данных по затратам на
производство единицы продукта в промышленности. Поэтому в экономической части
представлен расчёт затрат на проведение НИР, а именно: материальные,
энергетические, затраты на заработную плату и другие.
5.3.2 Текущие
затраты
Материальные затраты (См).
Величину материальных затрат на основные и
вспомогательные материалы, реактивы и топливо, израсходованные при выполнении
дипломной работы, можно определить [30]:
См = ∑Рi ·Ц i
Где Рi - количество
израсходованного i-ro материального ресурса; Цi -
планово-заготовительная цена единицы i-ro вида материального ресурса (руб.); i = 1,2, 3,. - виды
ресурсов.
Для расчета планово-заготовительной цены
затраты на доставку принимаем в размере 1% от цены приобретения и складываем их
с ценой приобретения.
Таблица 15. Расчет затрат на сырье, материалы, реактивы.
|
№
|
Наименование
|
Единица
измерения
|
Кол-во
|
Цена, руб. за
ед.
|
Транспортно-заготовительные
расходы
|
Планово-заготов.
цена, руб.
|
Сумма, руб.
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
1
|
Аммиак
|
л
|
1
|
37,5
|
1%
|
0,4
|
37,9
|
37,8
|
|
2
|
Кислота серная
(0,01н)
|
амп.
|
1
|
6,5
|
1%
|
0,1
|
6,6
|
6,6
|
|
3
|
Кислота серная
(0,1н)(фиксонал)
|
амп.
|
1
|
7
|
1%
|
0,1
|
7,1
|
7,1
|
|
4
|
Кислота серная
(1н)
|
л
|
1
|
68
|
1%
|
0,7
|
68,7
|
68,7
|
|
5
|
Индикатор
метиловый ор.
|
г
|
3
|
14
|
1%
|
0,1
|
14,1
|
42,4
|
|
ИТОГО
|
|
|
|
|
|
|
162,6
|
Энергетические затраты.
В состав энергетических затрат
входят затраты на электрическую энергию, пар, воду, холод, сжатый воздух,
непосредственно израсходованные на технологические цели при выполнении
исследования.
Расчет затрат на потребляемую
электроэнергию осуществляется следующим образом:
Сэн = ∑Рi·Цi = ∑Мi ·k·Тi ·Ц,
Где Рi - расход электроэнергии
на i-м виде оборудования; М -
паспортная мощность, кВт; k - коэффициент использования мощности (0,8 - 0,9), для расчетов
принимаем 0,8; Тi - время работы электрооборудования, ч; Ц - цена
1 кВт-ч электроэнергии.
Расчет затрат на
электроэнергию.
Таблица 16. Затраты на электроэнергию
|
№
|
Наименование
оборудования
|
Число единиц
оборудования
|
Номинальная
потребляемая мощность, кВт
|
Суммарная
потребляемая мощность, кВт
|
Время
|
Цена
|
Сумма затрат,
руб.
|
|
|
|
|
|
работы,
|
эл. эн., руб.
/кВт/ч
|
|
|
|
|
|
|
час
|
|
|
|
1
|
Печь
|
1
|
0,7
|
0,5
|
240
|
1,8
|
216
|
|
колонны
|
|
|
|
|
|
|
|
2
|
Печь крекера
|
2
|
0,7
|
0,5
|
240
|
1,8
|
432
|
|
|
|
|
|
|
|
|
|
3
|
Печь блока
|
2
|
0,3
|
0,25
|
240
|
1,8
|
216
|
|
4
|
Компрессор
|
1
|
2,7
|
2,5
|
12
|
1,8
|
27
|
|
|
ИТОГО:
|
|
|
|
|
|
891
|
Расчет затрат на воду.
Для выполнения дипломной работы требуется
около 30 л дистиллированной воды. Тариф на дистиллированную воду - 5,0 руб. /л.
Затраты на воду - 30·5,0=150 рублей.
Таблица 17. Стоимость приборов и посуды, используемых для
проведения работы
|
№
|
Наименование
приборов и посуды
|
Кол-во, шт.
|
Цена за ед.,
руб.
|
Сумма, руб.
|
|
1
|
Химический
стакан
|
3
|
14,3
|
42,9
|
|
2
|
Ступка
|
1
|
107,1
|
107,1
|
|
3
|
Колба мерная
1000 мл
|
1
|
261,0
|
261,0
|
|
4
|
Колба мерная
100 мл
|
2
|
28,0
|
56,0
|
|
5
|
Колба
коническая 250 мл
|
2
|
35,7
|
71,4
|
|
6
|
Воронка
коническая 36-50 мл
|
3
|
17,4
|
|
7
|
Бюретка 25мл
|
1
|
87,0
|
87,0
|
|
8
|
Палочка
стеклянная
|
1
|
2,0
|
2,0
|
|
|
ИТОГО:
|
|
|
679,6
|
5.3.3 Затраты
на заработную плату и единый социальный налог
Затраты на заработную плату включают в
себя заработную плату исполнителя дипломной работы (ЗПИ) и научного
руководителя (ЗПнр). Зарплата исполнителя определяется путем
умножения размера стипендии на число месяцев, отводимых на выполнение дипломной
работы.
ЗПИ = 600·6 = 3600 руб.
Среднечасовая зарплата определяется на
основе должностного оклада (Ок) и эффективного времени работы (Тэф)
с дипломником, которое для профессорско-преподавательского состава составляет
35 часов за все время дипломной работы.
Среднечасовая оплата по руководству,
рецензированию и консультированию составляет примерно 80 рублей.
ЗПнр = 35·90 = 2800 руб.
Сзп = ЗПИ + ЗПнр
= 3600 + 2800 = 6400 руб.
Дополнительная заработная плата
принимается 10% от основной, тогда:
Сд. зп = 0,1·5350 =
640 руб.
Единый социальный налог принимается в
размере 26 % от основной и дополнительной заработной платы:
Ссоц. страх. = 0,26·СзП
= 0,26· (6400+640) = 1830 руб.
5.3.4
Амортизационные отчисления приборов и оборудования
Сумма амортизационных отчислений определяется
исходя из стоимости используемого оборудования и приборов, годовых норм
амортизации и времени использования (в месяцах):
Сам = ∑ (Фi ·Нiа·Тi) / 100·12,
где Фi - стоимость
используемого оборудования и приборов; Нiа - годовая норма
амортизационных отчислений;
Тi - время работы
оборудования и приборов (в месяцах).
Таблица 18. Расчет амортизационных отчислений.
|
№
|
Наименование
оборудования
|
Стоимость, руб.
|
Срок
использования, мес.
|
Норма
амортизации, %
|
Сумма амор-
|
|
|
|
|
|
тизац.
|
|
|
|
|
|
отчислений
|
|
1
|
Печь колонны
|
3000
|
6
|
12
|
180
|
|
2
|
Печь крекера
|
2500
|
6
|
14
|
175
|
|
3
|
Печь блока
|
2700
|
6
|
12
|
162
|
|
4
|
Компрессор
|
25000
|
6
|
12
|
1500
|
|
5
|
Блок очистки
|
6000
|
6
|
13
|
390
|
|
6
|
Скруббер
|
500·5
|
6
|
12
|
150
|
|
7
|
Газгольдер
|
30000
|
6
|
12
|
1800
|
|
8
|
Фильтрвысокого
давления
|
5000
|
6
|
14
|
350
|
|
9
|
Колонна синтеза
|
10000
|
6
|
12
|
600
|
|
|
Итого
|
|
|
|
5307
|
5.3.5
Общеинститутские расходы
Общеинститутские (накладные) расходы,
включающие затраты на
страхование учебно-вспомогательного и
административно-управленческого персонала, отопление, освещение, вентиляцию,
содержание библиотеки,
общежития, ремонт зданий и прочие
хозяйственные расходы, принимаются в размере 100 % от суммы основной и
дополнительной заработной платы, учетом начислений:
Сн = Сзп + Сд.
зп = 6400+640 = 1830 руб.
5.3.6 Смета
затрат на проведение дипломной научно-исследовательской работы
В результате проведения всех вышеуказанных
расчетов составляем
смету затрат на выполнение дипломной
научно-исследовательской работы.
Таблица 19. Смета затрат на выполнение дипломной НИР.
|
№
|
Статьи расходов
|
Сумма, руб.
|
%
|
Примечание
|
|
1
|
Затраты на
сырье, материалы (основные и вспомогательные), реактивы
|
162,6
|
0,7
|
Из табл.1
|
|
2
|
Энергетические
затраты:электроэнергия,вода
|
891,0150,062400
|
4,10,7
|
Из табл.2
|
|
3
|
Основная
заработная плата:а) исполнителя работыб) руководителя работы
|
3600 2800
|
16,412,8
|
П.2.3
|
|
4
|
Дополнительная
заработная плата
|
640
|
2,9
|
П.2.3
|
|
5
|
Отчисления на
единый социальные налог
|
1830
|
8,3
|
П2.З.
|
|
6
|
Затраты на
приборы и посуду
|
679,6
|
3,1
|
Из табл.3.
|
|
7
|
Амортизация
приборов и оборудования
|
5307,0
|
24,2
|
Из табл.4.
|
|
8
|
Общеинститутские
расходы:
|
5885,0
|
26,8
|
П.2.5
|
|
ВСЕГО по смете:
|
21945,2
|
100
|
|
5.3.7 Выводы
к экономической части
Из приведенной выше сметы затрат видно,
что данная исследовательская работа является трудоемкой, а так же значительными
являются общеинститутские расходы, так как наибольший процент приходится на
заработную плату (36,2 %) и общеинститутские расходы (28,7%).
6. Список
литературы
1.
Тюкаева О.А. // Хим. Промышленность за рубежом. - 1987. - № 12. - С.1-50
.
Кузнецов Л.Д. и др. // Азотная пром-тъ. - НИИТЭхим - 1967. - №4. - С. 19.
.
Рабина, П.Д. Химия и технология азотных удобрений / П.Д. Рабина, Л.Д. Кузнецов,
Т.Я. Малышева и др. // Труды ГИАП. М.: - 1971. - Вып 11. - С.5
.
Дмитриенко Л.М. и др. // Труды 4-го Международного конгресса по катализу. М.:
Наука. - 1970. - Т.1. - С.328
.
Мищенко, Ш.Ш. и др. Химия и технология азотных удобрений. - М.: НИИТЭхим, 1971.
- Вып 11. - С.53, 66, 75.
.
Лачинов С.С., Овчаренко Б.Г. Авт. Свид. СССР 118222 // Б. И - 1964. - №14
.
Патрикевич Н.И. // Хим. промышленность за рубежом. - 1988. - № 2. - С.55-86
.
Бершанский В.П., Мнушкин ИЛ., СыркинА.М. // Сб. "Современные проблемы
истории естествознания в области химии, химической технологии и нефтяного
дела". - Уфа: Реактив, 2002. - С.184-192
.
S. M. Yunusov, V. A. Likholov, V. B. Shur. Applied
Catalysis A: General. 1997 (158) p.35-39.
. Claus J. Y. Jacobsen. Chem.commun., 2000, P 1057-1058.
. Huazhang, L. Opportunity of synthesis of ammonia under low
pressure at use of catalysts of series A-301/L. Huazhang, H. Zhangneg, L.
Xiaonian // Huagong xuebao =J. Chem. Ind. and Eng. - 2001. - №12. -
P.1063-1067.
12.
Бродская, И.Г. Разработка технологии рутениевого катализатора синтеза аммиака/
И.Г. Бродская, Л.М. Дмитриенко, Р.В. Чеснокова, Л.Д. Кузнецов // Катализаторы в
промышленности. - 2001. - № 3. - С.16-29.
.
Коваль, В.В. Некоторые особенности производства железного катализатора синтеза
аммиака методом электроннолучевой плавки / В.В. Коваль // Прикладные аспекты
химии высоких энергий: 1 Всероссийская конференция (с приглашением специалистов
стран СНГ), Москва, 30 окт. - 2 нояб., 2001: Тезисы докладов. М.: Изд-во РХТУ.
2001, С.148-149.
.
Пат.2262482 Российская Федерация, МПК7 С 01 С 1/04. Способ
каталитического получения аммиака [Текст] / Андреас Г. Э.; заявитель Хальдор
топсэе А/С. - № 2001103540/15; заявл.09.02.2001; опубл. 20.10.2005.
.
Пат.2267353 Российская Федерация МПК7 В 01 J 23/46, В 01 J 23/58. Катализатор
синтеза аммиака и способ его регенерации [текст] /Мулер М., Хинриксен О.,
Якобсен К.; Хальдкор топсоэ А/С. - № 2001118445/04; заявл.05.07.2001; опубл 10.01.2006.
Zheng, X. Effect of activated carbon as a support on metal
dispersion and activity of ruthenium catalyst for ammonia synthesis/ X. Zheng,
S. Zhang, J. Lin, J. Xu. // Chem. Res. Chin. Univ. - 2002. - № 4. - P.448-452.
.
Шляпин Д.А. Влияние условий приготовления на активность катализаторов Ru - М/сибунит
низкотемпературпературного синтеза аммиака /Д.А. Шляпин, Н.М. Добрынкин, Н.Б.
Шитова // Региональный научно-практический семинар Российского фонда
фундаментальных исследований "Пути коммерциализации фундаментальных
исследований в области химии для отечественной промышленности", Казань,
26-28 нояб., 2002 Научная программа. Труды семинара РФФИ. - Казань: УНИПРЕСС.
2002. С.115-116.
.
Constans, N. Облегченный способ
синтеза аммиака/ N. Constans // L'ammoniac sans peine. - 2004. - №374. - с.10-11
.
Крылов, О.В. Гетерогенный катализ / О.В. Крылов. - М.: Академкнига, 2004. - 679
с.
.
Егурбаев, С.Х. Изучение процесса восстановления отдельных компонентов железного
промотированного катализатора синтеза аммиака [текст]: дисс. …канд. техн. наук
/ С.Х. Егурбаев - М.: МХТИ, 1964. - 240 с.
.
Боресков, Г.К. Гетерогенный катализ / Г.К. Боресков. - М.: Наука, 1986. - 300с.
.
Рудницкий, Л.А. Механизм взаимодействия металлов с газами / Л.А. Рудницкий,
М.И. Иванов, П.Д. Рабина, Л.Д. Кузнецов // Кинетика и катализ. - 1968. - №89. -
С.36-41.
.
Кузнецов, Л.Д. Основы предвидения каталитического действия / Л.Д. Кузнецов,
П.Д. Рабина, В.С. Соболевский, Ш.Ш. Мищенко. // Сб. Азотная промышленность. -
1967. - №4. - С. 19.
.
Рогожкина, С.А. Исследование железного катализатора синтеза аммиака в
окисленном состоянии [текст]: дисс. … канд. техн. наук / С.А. Рогожкина - М.:
МХТИ, 1966. - 162 с.
.
Тарасова, Н.П. Выполнение раздела дипломной работы (проекта) “Охрана окружающей
среды от промышленных загрязнений" / Н.П. Тарасова, А.В. Малков, Т.В.
Гусева. - М.: РХТУ, 1997. - 68 с.
.
Макаров, Г.В. Методические указания по разделу "Охрана труда" в
дипломных проектах и работах / Г.В. Макаров - М.: МХТИ, 1990. - 29 c.
.
Баратов, А.Н. Пожаровзрывоопасность веществ и материалов и средства их тушения
/ А.Н. Баратов, А.Я. Корольченко, Г.Н. Кравчук и др. - М.: Химия, 1998. - 496
с.
.
Макаров, Г.В. Охрана труда в химической промышленности / Г.В. Макаров, А.Я.
Васин и др. - М.: Химия, 1989. - 496 с.
.
Паспорт лаборатории (отраслевая лаборатория синтеза аммиака).
.
Бурмистров, К.И. Методические указания по выполнению экономической части
дипломного проекта (работы) для студентов всех химико-технологических
специальностей / К.И. Бурмистров, Л.И. Маркина - М.: РХТУ, 1995. - 64 с.
.
Либерман, Е.Ю. Катализаторы синтеза аммиака: определение активности / Е.Ю.
Либерман, Н.В. Нефёдова, Т.В. Конькова - М.: РХТУ, 2002. - 48 с.