Выбор реактора для окисления диоксида серы
ВВЕДЕНИЕ
Под технологией в широком значении этого слова
понимают научное описание методов и средств производства в какой-то отрасли
промышленности. Процессы механической технологии основаны преимущественно на
механическом воздействии, изменяющем внешний вид или физические свойства
обрабатываемых веществ, но не влияющем на их химический состав. Процессы
химической технологии включают химическую переработку сырья, основанную на
сложных по природе химических и физико-химических явлениях.
Таким образом, химическая технология - это наука
о наиболее экономичных и экологически обоснованных методах химической
переработки сырых природных материалов в предметы потребления и средства
производства.
Современная химическая технология, используя
достижения естественных и технических наук, изучает и разрабатывает
совокупность физических и химических процессов, машин и аппаратов, оптимальные
пути осуществления этих процессов и управления ими при промышленном
производстве различных веществ, продуктов, материалов.
Химическая технология базируется на химических
науках, таких, как физическая химия, химическая термодинамика и химическая
кинетика, а также развивает закономерности этих наук в приложении к
крупномасштабным промышленным процессам, она тесно связана с экономикой, физикой,
математикой, кибернетикой, прикладной механикой, другими техническими науками.
По мере развития химической промышленности
содержание химической технологии обогащалось новыми сведениями,
закономерностями. Значительный прогресс науки в последние годы связан с
применением современных вычислительных средств для решения теоретических и
прикладных задач. Применение вычислительной техники не только позволило ставить
и решать сложные задачи, но и обогатило химическую технологию новыми подходами
к их решению, связанными с математическим моделированием и системными
исследованиями, также развивается кибернетика химико-технологических процессов.
Новые открытия тесно связывают науку с производством, что позволяет более
рационально использовать сырье и топливно-энергетические ресурсы, создавать
безотходные производства, где процессы протекают с высокими скоростями в
оптимальных условиях с получением продуктов высокого качества.
Химическая технология играет важную роль в
химической промышленности, которая является одной из ведущих отраслей народного
хозяйства, ей принадлежит определяющая роль в ускорении научно-технического
прогресса, повышении эффективности общественного производства и, материального
и культурного уровня жизни людей.
Химическая технология является материальной
базой химизации народного хозяйства. Цель химизации - интенсификация и
повышение эффективности промышленного и сельскохозяйственного производства,
улучшение условий труда и повышение уровня медицинского, культурного и бытового
обслуживания населения. Химизация обеспечивает: совершенствование структуры
сырьевого баланса, снижение затрат на производство и эксплуатацию изделий,
совершенствование топливно-энергетической базы путем интенсификации процессов и
комплексной переработки нефти, природного газа, сланцев и угля, использования
теплоты реакций, усиление охраны окружающей среды.
Материальной основой всех химико-технологических
процессов являются машины и аппараты химических производств. Эффективность
химического производства обеспечивается за счет систематического повышения его
технического уровня на основе использования мощных, непрерывных, малостадийных
и менее энергоемких аппаратов. Так, выбор и расчет аппарата, ректификационной
колонны, реактора является важным критерием, определяющим технологический
процесс.
Химико-технологический процесс представляет
собой совокупность операций, позволяющих получить целевой продукт из исходного
сырья. Скорость всех этапов операций будет зависеть от температурного режима,
наличия примесей, а самое главное - от гидромеханических, тепло- и
массообменных, химических процессов, протекающих в аппарате. Анализ единичных
процессов, их взаимного влияния позволяет разработать технологический режим и
рассчитать аппараты, реакторы, необходимые для проведения этих процессов в
оптимальных условиях (сочетание основных параметров - температуры, давления,
состав исходной реакционной смеси, катализаторов), т.е. таких, которые
позволяют получить наибольший выход продукта с высокой скоростью или обеспечить
наименьшую себестоимость.
Разработка и построение рациональной
технологической схемы, а соответственно и выбор реактора, аппарата - важная
задача химической технологии.
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОКИСЛЕНИЯ
ДИОКСИДА СЕРЫ
.1 Общие сведения о диоксиде серы
Диоксид серы S02 - это бесцветный газ, в 2,3
раза тяжелее воздуха, с резким запахом. Чистый 100%-ный S02 при атмосферном
давлении и -10°С сжижается. При растворении S02 в воде образуется слабая и
нестойкая сернистая кислота. Сырьем для производства диоксида серы могут быть
природные материалы и промышленные отходы, содержащие серу. В свою очередь SO2
активно используется для получения серной кислоты. Наиболее часто используется
контактный способ производства серной кислоты. Главной его стадией является
контактное окисление S02 в SO3; по названию этой операции именуется и весь
способ.
Контактное окисление диоксида серы является
типичным примером гетерогенного окислительного экзотермического катализа. Это
один из наиболее изученных каталитических синтезов. В СССР наиболее
основательные работы по изучению окисления S02 в SO3 и разработке катализаторов
проведены Г.К. Боресковым.
1.2 Термодинамика окисления диоксида
серы
Реакция окисления диоксида серы в триоксид
SO2 + O2 = 2SO3 + Q
обратима и степень окисления газа любого состава
строго определяется температурой и парциальными давлениями компонентов реакции:
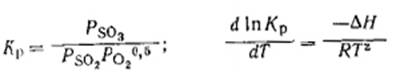
На основе данных по стандартным теплотам
образования изменениям энтальпий компонентов относительно значений при 298,15К
с помощью ЭВМ рассчитаны величины теплового эффекта и константы равновесия
реакции окисления S02 в интервале 400-625 и 650°С. Полученные уравнения имеют
следующий вид:
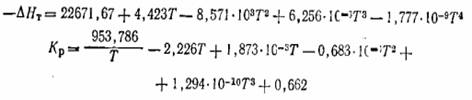
Для технических расчетов может быть использовано
предложенное нами уравнение:
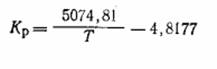
1.3 Ванадиевые катализаторы для
окисления диоксида серы
Окисление диоксида серы в настоящее время
проводят гетерогенно на ванадиевых катализаторах, которые к концу 30-х годов
полностью вытеснили платиновые.
В СССР почти одновременно было разработано три
технологических процесса изготовления катализаторов, один из них, предложенный
Г. К. Боресковым, был внедрен в промышленность. Этот катализатор (БАВ) до 1965
г. был единственным и его продолжали выпускать до конца 70-х годов. Недостатком
катализатора было то, что он изготовлялся как полупродукт, превращавшийся в
истинный катализатор при обработке низкоконцентрированным диоксидом серы, в
процессе которой хлор замещался на сульфатную группу и выделялся в атмосферу.
Эта операция (насыщение) проводится после загрузки катализатора в контактный
аппарат.
Другой катализатор - СВД изготовляется путем
смешения кремнеземистого носителя - диатомита с содержанием не более 3% Al2O3,
тонко измолотого пятиоксида ванадия и раствора KHSO4, последующего
гранулирования и прокаливания гранул.
Стремление повысить активность при низких
температурах привело к разработке катализатора СВС и катализатора Института
катализа -ИК-1-4. В отличие от катализатора СВД, эти катализаторы производятся
с использованием в качестве носителя осажденного силикагеля при применении
гидратированного пятиоксида ванадия по несколько отличающимся между собой
технологическим схемам.
Применение этих катализаторов при концентрации
газа 8-9% SO2 позволяет снизить температуру на входе в I слой катализатора до
405-410 °С.
Для переработки газов повышенной концентрации (
10-11% S02 ) был разработан катализатор ТС (термостабильный), более устойчивый
к термической инактивации, чем СВД. Катализатор ТС отличается от СВД тем, что в
качестве носителя используется модифицированный диатомит. Модифицирование
осуществляется обработкой слабыми растворами солей переходных металлов IV
периода или сульфата ванадия с последующим прокаливанием при температуре до 700
°С в течение 2-3 ч. При этом происходит образование ситалоподобных структур,
препятствующих превращению кремнезема в α-кристаллобалит,
который появляется при термической инактивации катализатора.
1.4 Механизм и кинетика окисления
диоксида серы
Со второй половины 60-х годов в СССР проведены
интенсивные исследования ванадиевых катализаторов. Изучены диаграммы состояния
систем: V2O5-K2S2O7 и VOSO4, влияние толщины слоя активного компонента на
степень его использования, исследованы механизм и кинетика окисления диоксида
серы.
Представление о механизме реакции базируется на
результатах исследования кинетики реакции стационарного состава активного
компонента.
Схема процесса может быть сформулирована
следующим образом:
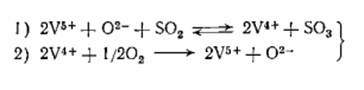
В первой стадии достигается равновесие, а вторая
стадия является медленной и определяет скорость процесса.
Предлагаемая схема является
окислительно-восстановительной и соотношение между двумя ступенями окисления
ванадия в условиях стационарного состояния катализатора определяет его
активность.
Стационарный состав катализатора не зависит от
концентрации кислорода в газовой фазе и определяется только соотношением
концентраций S0 2 и S03. Установлено, что при обработке катализатора инертным
газом в отсутствии кислорода наблюдается окисление четырехвалентной формы
ванадия, содержание которой возрастает после подачи реакционной смеси до
равновесного состояния. При справедливости рассмотренного механизма (А),
скорость каталитической реакции должна равняться скорости окисления катализатора
кислородом и быть меньше скорости восстановления. В действительности, в область
температур выше 420 °С скорость каталитической реакции много больше скорости
восстановления катализатора. В связи с этим вероятен механизм, в котором
процесс протекает по пути, не связанном с изменением валентного состояния
ванадия.
Схему такого процесса можно представить в
следующем виде:
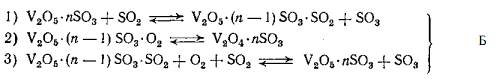
В этом случае скорость каталитической реакции
должна быть пропорциональна доле активного компонента в окисленной форме и по
этому механизму каталитическая реакция протекает в присутствии триоксида серы в
газовой фазе.
Скорости окисления четырехвалентного ванадия
кислородом и каталитической реакции в отсутствии триоксида серы близки и при
малых степенях превращения процесс протекает по окислительно-восстановительному
механизму, который может быть представлен схемой:
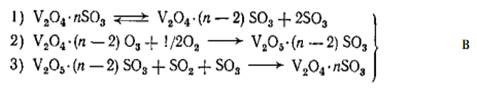
Стадия 1 в условиях протекания каталитической
реакции находится в равновесии. Стадия 2 является сложной и определяет скорость
протекания реакции. Порядок этой реакции по кислороду равен 1. Стадия 3
проходит с большой скоростью, что практически приводит к полному восстановлению
ванадия.
Таким образом, кинетические закономерности
достаточно сложны. Исследованию кинетики окисления диоксида серы на ванадиевых
катализаторах посвящено большое число работ, в которых предложены различные
уравнения для расчета массы катализатора, загружаемого в контактные аппараты.
В СССР применяют уравнение Института катализа:
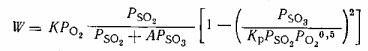 (1)
(1)
Постоянная А изменяется в пределах 0,8-1,0 в
зависимости от типа катализатора и температуры.
Область условий протекания реакции в
промышленных аппаратах: концентрация диоксида серы 4-12%, кислорода 6-13%. При
двойном контактировании их содержание на второй стадии снижается примерно до 1
и 4% соответственно. Температурный интервал 400-600 °С. Обычно процесс ведут до
степени превращения диоксида серы 98,0% при одинарном и 99,8% при двойном
контактировании.
Подробное изучение зависимости скорости реакции
от концентрации S02, S03 и 02 показало, что в области температур выше 470 °С во
всем интервале степеней превращения наблюдается первый порядок реакции по
кислороду. Скорость реакции является функцией отношения PSO3 : PSO2 . С
повышением,
концентрации кислорода может наблюдаться порядок
реакции ниже первого.
Понижение температуры существенно усложняет
зависимость скорости реакции от концентрации. В области низких температур и
степеней превращения скорость реакции пропорциональна концентрации кислорода,
не зависит от концентрации S02 и сильно тормозится S03.
Работа всех слоев катализатора в промышленных
аппаратах описывается кинетическим уравнением (1), кроме начала первого слоя,
где применимо уравнение, предлагаемое Институтом катализа, описывающее процесс
при допущении, что весь ванадий находится в четырехвалентном состоянии:
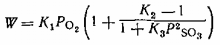 (2)
(2)
Применение кинетических уравнений к расчету
необходимого времени соприкосновения для достижения заданной степени конверсии
проводится при учете работы катализатора в контактном аппарате в адиабатических
условиях, т. е. без отвода выделяемой теплоты реакции. Это приводит к
непрерывному нагреванию слоя по мере продвижения газа. Степень нагрева
пропорциональна степени превращения и концентрации диоксида серы в газе.
2. ТЕПЛОВОЙ И МАТЕРИАЛЬНЫЙ БАЛАНС
АДИАБАТИЧЕСКИХ РИВ И РПС
.1 Материальный баланс РИВ
Реактор идеального вытеснения (РИВ) - такой
реактор, в котором отсутствуют продольное и радиальное перемещение, а
осуществляется только диффузия, концентрация реагентов изменяется в результате
химического превращения.
Рассмотрим реакцию aA+ bB=cC+dD, за начальные
условия примем V=const, zА°= const, хА=0, через некоторое время степень
превращения в реакторе станет равной хА+dxA, тогда = V·zA°·(1-xA)·MA/22.4, где
GFPA - физический приход, кг/с; V-объем смеси, м³/с;
22.4-молярный объем, м³/кмоль; MA
-молярная масса вещества А, кг/кмоль; zA°(1-xA) - концентрация оставшегося
реагента, кг/кмоль.= V·zA°·(1-xA)dxA·MA/22.4 -физический расход, кг/с= U·dV·MA
-количество вещества А, которое прореагировало в результате химической реакции,
где U -скорость реакции, кмоль/ м³с;
dV-изменение объема смеси, м³/с.
По закону сохранения действующих масс - приход
равен расходу вещества в ходе реакции:= GFRA + GCRA, или·zA°/22.4 - V·zA°·хА
/22.4 = U·dV + V·zA°/22.4 - V·zA°· хА/22.4 - V·zA° dхА/22.4,
сократим и получим уравнение материального
баланса для реактора идеального вытеснения:·zA° dхА/22.4 = UdV.
Обозначим, что Vr- объем реактора, м³;
тогда Vr = Vt, где V-расход смеси, м³/с;
t-время, с.
Изменение объема реактора: dVr = Vdt, т.к.
V=const, то zA° dxA/22.4 = Udt, преобразуем и получим /dt = U·22.4/ zA° -
уравнение МБ в дифференциальной форме.
Время, необходимое для достижения заданной
степени превращения найдем по формуле, отсюда следует, что чем больше скорость,
тем меньше время:
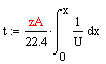
2.2 Тепловой баланс РИВ
Рассмотрим реакцию, протекающую без изменения
числа молей:
+ bB = cC+dD,
HFP-энергия, приносимая исходной газовой смесью
в объем реактора, кДж/с:
= V·Cp·(T-273),
= V·Cp·(T+dT-273) - энергия(теплота) на выходе
из реактора, кДж/с;СR = U·HUCR·dV -тепловой эффект химической реакции,
кДж/с.скорость реакции, кмоль/м³·с;
HUCR - удельный тепловой эффект реакции, кДж/кмоль; dV- изменение расхода
смеси, м³/с.
Тогда теплота прихода равна: HP = HFP + HСR,
кДж/с.
Теплота расхода будет равна: HR = HTO + HFR,
кДж/с.
HTO = K·F·ΔT·dV - энергия
теплообмена, кДж/с, где К-коэффициент теплопередачи, кДж/(м²·град·с);
F- удельная поверхность в единице реакционного объема, м²/м³;
ΔT- изменение температуры, град; dV- элементарный
реакционный объем, м³.
По закону сохранения энергии: HP= HR, т.е
энергия прихода равна энергии расхода, тогда·Cp·T - V·Cp·273 + U·HUCR·dV =
V·Cp·T + V·Cp·dT - V·Cp·273 + K·F·dT·dV, сократив, получим:·HUCR·dV = V·Cp·dT +
K·F·dT·dV - уравнение политермы, показывающее, что количество выделившейся
теплоты равно изменению температуры и теплоте, отобранной холодильником. В
адиабатическом режиме отсутствует теплообмен с окружающей средой, теплота идет
на изменение теплосодержания химической смеси, значит:= 22.4·Cp·dT/zA°,
кДж/кмоль;
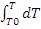
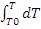 =
zA°·HUCR/(22.4·Cp)
=
zA°·HUCR/(22.4·Cp) 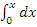
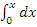 - уравнение
адиабаты в интегральной форме, проинтегрируем и получим:
- уравнение
адиабаты в интегральной форме, проинтегрируем и получим:
Т = Т0 ±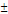 (zA°·HUCR/(22.4·Cp))x - уравнение адиабаты, здесь знак «+» для реакции
экзотермической, знак «-» для эндотермической реакции.= zA°·HUCR/(22.4·Cp) -
адиабатический коэффициент, показывающий на сколько изменится температура
реакции смешения, если ключевое вещество полностью прореагирует, град.
(zA°·HUCR/(22.4·Cp))x - уравнение адиабаты, здесь знак «+» для реакции
экзотермической, знак «-» для эндотермической реакции.= zA°·HUCR/(22.4·Cp) -
адиабатический коэффициент, показывающий на сколько изменится температура
реакции смешения, если ключевое вещество полностью прореагирует, град.
Подставив выражение для Ad в уравнение адиабаты,
получим T = Т0 ± Ad·x.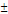
Система уравнений МБ и ТБ:
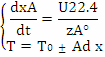
Решение системы позволит найти максимальное
значение степени превращения, например, для реакции первого порядка, получим:=
k·PA = k·P·zA = k·P·zA°·(1-x) - кинетическое уравнение реакции 1-го порядка
/dt= 22.4·k·P·(1-x),
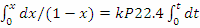
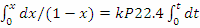 , после
интегрирования получим:= 1-
, после
интегрирования получим:= 1-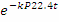
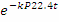 - уравнение
степени превращения для необратимой реакции 1-го порядка.
- уравнение
степени превращения для необратимой реакции 1-го порядка.
2.3 Материальный баланс РПС
Реактор полного смешения (РПС) - реактор, в
котором вновь поступающая порция реагента быстро распространяется по всему
объему реактора за счет перемешивания, и концентрация реагента остается
постоянной в любой точке реактора.
Рассмотрим реакцию aA+ bB = cC+dD, примем
V=const - объем смеси, zА° = const, хА = 0, хк - начальная и конечная степень
превращения соответственно,Vr = const -объем реактора, тогда = V·zA°·xA·MA/22.4
- физический приход в реактор, кг/с; V - расход смеси, м³/с;
zA° - концентрация реагента А, кг/кмоль; Vm = 22.4 - молярный объем, м³/кмоль.=
V·zA°·(1-xA)·dxA·MA/22.4 -физический расход, кг/с= U·Vr·MA - прореагировало в
реакторе в ходе химической реакции, кг/с, где Vr-объем реактора, м³.
По закону сохранения действующих масс - приход
равен расходу вещества в ходе реакции:
= GFRA + GCRA, кг/с
·zA°/22.4 = V·zA°/22.4 - V·zA°·хк/22.4 + U·Vr,
сократим:·zA°·хк/22.4 = U·Vr, учитывая, что Vr = Vt - объем реактора, м³,
получим
хк/t = 22.4·U/zA° - уравнение материального
баланса РПС.
Из уравнения МБ следует, что чем больше скорость
реакции, тем ниже время ее протекания и объем реактора.
2.4 Тепловой баланс РПС
Рассмотрим реакцию экзотермическую без изменения
числа молей:
+ bB=cC+dD
Т0 - начальная температура на входе в реактор,град;
Тк - конечная температура на выходе из реактора, град; хА=0 - начальная степень
превращения, хк -конечная степень превращения; Т-температура в реакторе, град;
V=const - расход смеси считаем постоянным, м³/с;
zA° -концентрация вещества А, кг/кмоль; Cp- удельная теплоемкость, Дж/моль
град, также постоянные величины; F- поверхность теплообмена на всем объеме
реактора, м²/м³;
Cp- удельная теплоемкость, Дж/(моль град), тогда= V·Cp·(T0-273), кДж/с -
теплота физического прихода;= V·Cp·(Tк -273) - энергия (теплота) физического
расхода, кДж/с;СR = U·∆HUCR·Vr - тепловой эффект химической реакции ,
кДж/с;= K·F·∆T - энергия теплообмена, кДж/с.
По закону сохранения энергии составим уравнение
теплового баланса:
HFP + HСR = HFR + HTO
·Cp·T0 - V·Cp·273 + U·∆HUCR·Vr = V·Cp·Tк -
V·Cp·273 + K·F·∆T, сократим·HUCR·Vr = V·Cp·(Tк - T0) + K·F·∆T -
уравнение политермы.= хк·zA°/(22.4·t) - скорость реакции, кмоль/(м³с),
Vr = Vt - объем реактора, м³,
подставим в уравнение политермы:
хк·zA°·Vt∆HUCR /(22.4·t) = V·Cp·(Tк - T0)
+ K·F·∆T
В данном случае режим адиабатический, значит
теплообмен с окружающей средой отсутствует, и слагаемое K·F·∆T пропадает,
тогда
хк·∆HUCR = 22.4·Cp·(Tк - T0)/ zA°, отсюдак
= T0 ±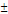 zA°·∆HUCR·хк/(22.4·Ср) - уравнение адиабаты РПС, где знак «+» для реакции
экзотермической, знак «-» для эндотермической реакции.
zA°·∆HUCR·хк/(22.4·Ср) - уравнение адиабаты РПС, где знак «+» для реакции
экзотермической, знак «-» для эндотермической реакции.
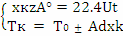
Совместное решение уравнений МБ и ТБ для РПС
позволяет найти конечную степень превращения: 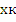
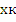 =
= 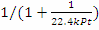
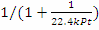
Рассмотрим необратимую реакцию первого порядка,
тогда = k·PA = k·P·zA = k·P·zA°·(1 - x) -кинетическое уравнение реакции 1-го
порядка, подставим в уравнение МБ и ТБ:
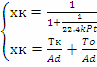
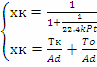
Для обратимой реакции первого порядка A ⇄
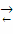 D:
= k1·PA - k2·PD = k1·P·zA - k2·P·zD = k1·P·zA°·(1-xk) - k2·P·zA°·xk =
k1·P·zA°·(1-(k2+k1)xk/k1)= 0 при условии равновесия, тогда k1 = (k1 + k2)·xr,
значит U = k1·P·zA°·(1-xk/xr), выразив хк, получим: хк = xr·22.4·t·k1·P/(xr +
22.4·t·k1·P). Система уравнений МБ и ТБ для обратимой реакции примет вид:
D:
= k1·PA - k2·PD = k1·P·zA - k2·P·zD = k1·P·zA°·(1-xk) - k2·P·zA°·xk =
k1·P·zA°·(1-(k2+k1)xk/k1)= 0 при условии равновесия, тогда k1 = (k1 + k2)·xr,
значит U = k1·P·zA°·(1-xk/xr), выразив хк, получим: хк = xr·22.4·t·k1·P/(xr +
22.4·t·k1·P). Система уравнений МБ и ТБ для обратимой реакции примет вид:


3. ПРОГРАММЫ
.1 Обоснование выбора
адиабатического реактора для синтеза аммиака
Сравнивая работу ректоров идеального вытеснения
и полного смешения в адиабатическом режиме при одном и том же времени, по
графикам зависимостей 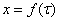 и
и 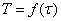 нашли
значение степени окисления и температуры, на основе этих данных вычислили
значение скорости реакции и получили, что скорость в РПС больше:
нашли
значение степени окисления и температуры, на основе этих данных вычислили
значение скорости реакции и получили, что скорость в РПС больше:
Возьмём τрив=
τрпс=22.4с
и найдём при этом значении времени x и T:
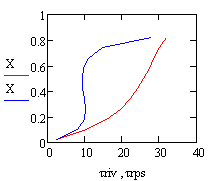
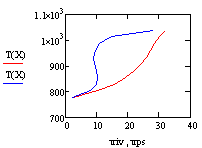
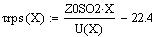
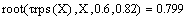
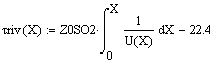
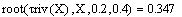
Получаем значения Хрив= 0.347 , Хрпс= 0.799.
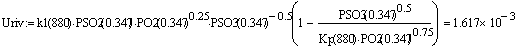
Температуры находим по графику Трив= 880 К ,
Трпс = 1028 К.
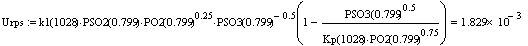
Отсюда видно, что скорость в РПС больше скорости
в РИВ, следовательно, за одно и тоже время в реакторе полного смешения будет
достигаться большая степень превращения.
Анализ полученных данных позволяет сделать вывод
о том, что для проведения синтеза необходимо выбрать реактор полного смешения.

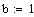
SO2 + O2 = 2 SO3
3.2 Программа расчёта
адиабатического коэффициента
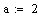
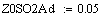
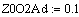
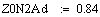
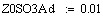
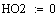
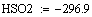
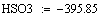
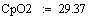
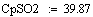
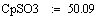
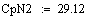
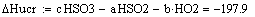
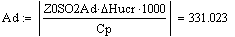
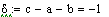
Адиабатический коэффициент зависит от начальной
концентрации ключевого реагента, от природы и свойств реагирующих веществ. Он
показывает, на сколько измениться температура реакции, если все ключевое
вещество прореагирует полностью.
3.3 Программа и анализ зависимости
объёма реактора от начальной температуры, давления и начальной концентрации
диоксида серы
VR=f(Т0,P,Z0SO2)
SO2 + O2 = 2 SO3
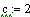
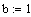
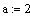
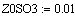
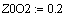
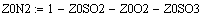
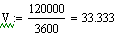
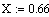
Задали диапазоны изменения исследуемых
параметров:
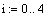
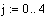
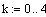
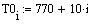
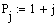
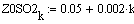
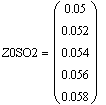
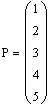

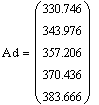
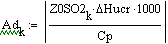
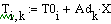
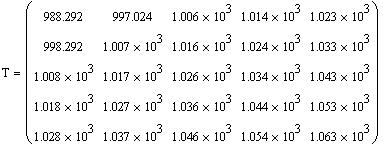
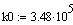
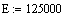
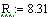
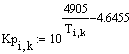
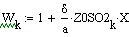
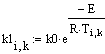
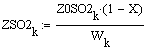
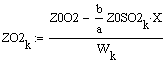
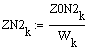
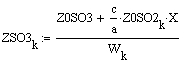
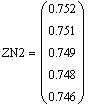
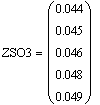
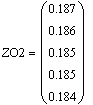
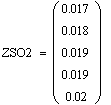


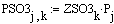
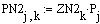


Таким образом, мы получили зависимости всех
величин, необходимых для определения скорости от трёх исследуемых параметров.
При определении скорости будем фиксировать 2 из них с целью получения
зависимости скорости от одного конкретного параметра.

Скорость от начальной температуры (фиксируем
P=1атм.;Z0SO2=0.05):
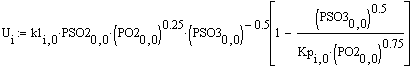
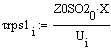


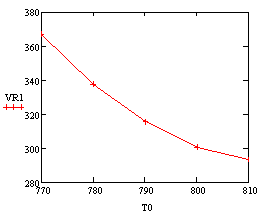
Вывод: при увеличении начальной температуры,
требуемый объём реактора уменьшатся, т.к. растёт скорость реакции, а
следовательно, уменьшается время её протекания.
Скорость от давления (фиксируем
T0=770K;Z0SO2=0.05):
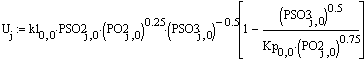

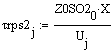
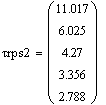

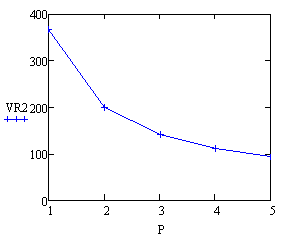
Вывод: при увеличении давления в реакторе, его
объём уменьшатся, т.к. растёт скорость реакции, а, следовательно, уменьшается
время её протекания.
Скорость от начальной концентрации диоксида серы
(фиксируем T0=770K;P=1атм.):

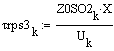
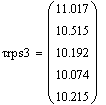

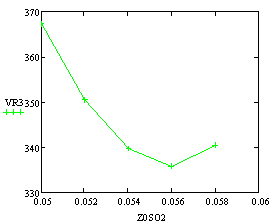
Вывод: при увеличении начальной концентрации
диоксида серы, объём реактора сначала уменьшается, а затем начинает
увеличиваться, т.к.сначала скорость реакции растёт быстрей увеличения начальной
концентрации диоксида серы, а затем рост начальной концентрации диоксида серы
начинает преобладать над ростом скорости.
СПИСОК ЛИТЕРАТУРЫ
сера диоксид окисление кинетика
1.
Васильев Б.Т., Отвагина М.И. Технология серной кислоты - М.: Химия, 1985г.
.
Мухленов И.П., Кузнецов Д.А., Авербух А.Я., Тумаркина Е.С., Фурмер И.Э. Общая
химическая технология - М.: Высшая шк., 1970 г.
.
Барон Н.М., Пономарёва А.М., Равель А.А., Тимофеева З.Н. Краткий справочник
физико-химических величин. Издание 10-е, испр. и дополн. СПб: ”Иван Фёдоров”,
2002 г.