Влияние давления на процесс в адиабатическом режиме идеального вытеснения и полного смешения при производстве водорода
Задание
на курсовой проект
Процесс конверсии
метана водяным паром.
1.
Исследовать влияние давления Т на процесс в адиабатическом режиме
идеального вытеснения и полного смешения. Сравнить изменение соотношения
объёмов реакторов (объёмов катализатора) в различных режимах.
2.
Построить графики зависимости:
Xp=f(Т) Xp=f(Р),
где Хр -
равновесная степень превращения; Т - температура, К (интервал 900-1200 К).
X=f(Т) U=f(h),
где X - степень превращения метана в
реакторе;
Т - температура в
зоне реакции (на выходе из реактора), К;
h - высота реакционной зоны, м;
U- скорость реакции.
X=f(S),
где X - текущая степень превращения,
S - время реакции, с.
VpиB=f(Т)
Vpnc=f(Т)
Vрпв/Vpnc=f(Т),
Где Vpив - объём реактора идеального вытеснения, м3;
Vpnc - объём реактора полного смешения м3.
Некоторые условия и
исходные данные процесса:
Производительность
реактора по аммиаку - 1360 т/сут. Исходная смесь состоит из метана и водяного
пара в соотношении 1:4, диапазон изменения температуры Т=900-1200К. Давление
газа на входе в реактор 30атм. Линейная скорость газа W=l м/с. Принять конечную степень
превращения Х2 =0, 9ХР. Остальные данные взять из
литературы.
Введение
Конверсия метана
природного газа с водяным паром - пока основной промышленный способ
производства водорода. Первичный продукт конверсии метана - это синтез-газ,
который, помимо получения водорода применяется для производства метанола,
высших спиртов, синтетического бензина и др. Предполагается применение
синтез-газа в качестве восстановительного агента для прямого восстановления
металлов (железа) из руд. Метод конверсии состоит в окислении метана водяным
паром или кислородом воздуха по следующим основным уравнениям реакций:
СН4+Н2О↔О
+ ЗН2-206кДж а)
СН4 +
0, 5О2 ↔ СО + 2Н2 + 35кДж б)
Конверсия гомологов
метана протекает аналогично. Далее осуществляют вторичную реакцию конверсии
оксида углерода с водяным паром:
СО + Н2О
↔ СО2 + Н2 + 4\кДж
Суммарно конверсия
метана с водяным паром происходит с поглощением теплоты:
СН4
+ 2Н2О ↔ СО2 +
4H2 -165кДж
При 800-1000°С значения
констант равновесия реакций (а) и (б) составляют 1, 4-104 и 1, 6-1011
соответственно и остаточное содержание метана мало. Но скорость достижения
равновесия без катализатора при этих температурах еще невелика.
Для каталитической
конверсии метана применяют никелевый катализатор на носителе - оксиде алюминия.
В присутствии никелевого катализатора равновесие быстро достигается уже при
800°С. Несмотря на то что содержание СН4 в равновесном газе повышается с
увеличением давления, конверсию метана выгодно проводить при повышенном
давлении для увеличения скорости реакции. При этом используется естественное
давление природного газа, при котором он подается на завод, - 1 - 4 МПа. При
повышении давления уменьшаются объем аппаратуры и трубопроводов.
В промышленности
реализуют конверсию метана при атмосферном или повышенном давлении с
применением катализаторов (каталитическая конверсия метана) или без
катализаторов (высокотемпературная конверсия метана). Применение катализаторов
увеличивает скороcть процесса и
позволяет снизить
температуру, поэтому преобладает каталитическая конверсия метана.
По характеру
применяемого окислителя каталитическая конверсия метана подразделяется на
парокислородную, которая проводится в одну ступень - окислением метана смесью
воздуха и водяного пара, и на паровоздушную, которая проводится в две ступени:
сперва окисление метана водяным паром (с подводом теплоты извне), а затем
смесью воздуха и водяного пара.
При парокислородной
конверсии метана потери теплоты в результате протекания эндотермической реакции
(а) компенсируются за счет протекания экзотермической реакции (б), а также
полного окисления метана кислородом. В каталитический реактор подается смесь
природного газа, водяного пара и воздуха, обогащенного кислородом (40 - 50% О2),
получаемого в цехе разделения воздуха. Температура в верхних слоях никелевого
катализатора поддерживается в пределах 1050 - 1100°С, а на выходе из реактора -
800- 900°С.
При паровоздушной
конверсии метана первую стадию процесса осуществляют в реакторе, в трубках
которого загружен катализатор, а недостаток теплоты восполняют сжиганием
природного газа в межтрубном пространстве реактора (рис. 1). Температуру в зоне
реакции поддерживают около 800°С.
конверсия метан
производство водород
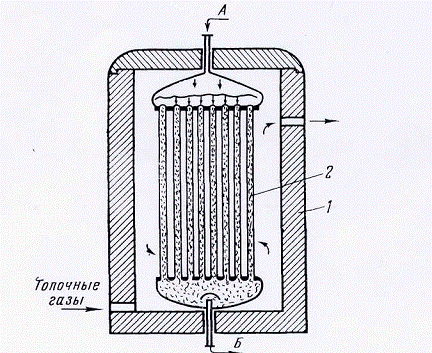
Рис. 1. Трубчатый
контактный аппарат с катализатором в трубах и обогревом топочными газами:
1 - огнеупорная
кладка; 2 - трубы с катализатором; А - исходная газовая смесь; Б - продукты
реакции.
В этих условиях в
газе остается около 8-10%СН4. Конверсию остаточного метана
осуществляют кислородом воздуха (по реакции б). На некоторых заводах
применяется высокотемпературная конверсия метана,
которая проводится
по реакции (б) при температуре около 1250°С. Газ, полученный этим методом,
содержит сажу, которая выделяется при промывании газа горячей водой под
давлением.
Продуктом конверсии
метана и его гомологов служит синтез-газ, содержащий от 10 до 15% СО. Для
получения водорода или азотоводородной смеси требуется дополнительная операция
- конверсия оксида углерода.
Конверсия оксида
углерода с водяным паром происходит по обратимой экзотермической реакции
СО + Н2О
↔СО2 +Н2+ 36, 6кДж(500°С)
Реакция происходит
без изменения объема и поэтому повышение давления увеличивает скорость
процесса, не изменяя равновесный выход водорода. Повышение содержания водяного
пара в исходной газовой смеси, и понижение температуры повышает равновесный
выход водорода, т. е. способствует более полному протеканию конверсии. Однако
при низких температурах скорость реакции конверсии СО мала даже в присутствии
катализаторов.
Для конверсии
оксида углерода применяют высокотемпературный железохромовый и
низкотемпературный цинк-хром-медный катализаторы. Железохромовый катализатор,
промотированный оксидами алюминия, калия и кальция, обеспечивает достаточную
скорость конверсии СО только при 430-500°С; в этих условиях в конвертированном
газе остается 2-4% непревращённого оксида углерода. В присутствии
низкотемпературного цинк-хром-медного катализатора конверсию СО можно проводить
при 200- 300°С и снизить остаточное содержание оксида углерода до 0, 2-0, 4%.
Цинк-хроммедный катализатор более чувствителен к контактным ядам -
серосодержащим соединениям, чем железохромовый. С целью приближения к
оптимальному температурному режиму, а также для увеличения срока службы
цинк-хром-медного катализатора конверсию СО ведут в две стадии: первую стадию в
присутствии высокотемпературного катализатора. Теплота реакции после первой
стадии конверсии СО используется в котле-утилизаторе, в результате чего
температура газа перед второй стадией конверсии СО на низкотемпературном
катализаторе понижается. Полученный конвертированный газ подвергают очистке от
диоксида углерода и непревращённого оксида углерода.
После удаления
примесей газ представляет собой азотоводородную смесь для синтеза аммиака или
водород - в том случае, если конверсия метана проводилась в отсутствие воздуха.
Принципиальная
технологическая схема конверсии метана природного газа для производства
азотоводородной смеси, применяемой в синтезе аммиака, показана на рис. 2.
Природный газ под давлением около 4 МПа проходит
подогреватель и подвергается очистке от серосодержащих соединений
каталитическим гидрированием их в сероводород с последующей адсорбцией H2S. Очищенный газ смешивают с водяным
паром в соотношении 3, 7: 1, подогревают в теплообменнике отходящими дымовыми
газами до ~380°С и подают на первую ступень конверсии метана в трубчатый
каталитический реактор. Конверсия метана с водяным паром по реакции (а)
происходит при 800-850°С в трубках с никелевым катализатором, обогреваемых
продуктами горения природного газа.
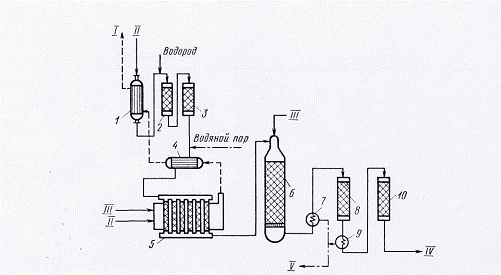
Рис. 2.
Технологическая схема конверсии метана природного газа: 1 - подогреватель
природного газа; 2 - реактор гидрирования сернистых соединений; 3 - адсорбер
сероводорода; 4 - теплообменник; 5 - трубчатый реактор - конвертор метана; 6 -
шахтный реактор - конвертор метана; 1, 9 -котёл-утилизатор; 8 - реактор
конверсии СО I ступени; 10 - реактор конвертор СО II ступени; I - отходящий дымовой газ; II - природный газ; III - воздух; IV - конвертированный газ;
V -
водяной пар к паровым турбинам.
После первой
ступени конверсии газ, содержащий 9-10% непревращённого метана, смешивают с
воздухом и подают на вторую ступень конверсии - паровоздушную в каталитический
реактор шахтного типа. На второй ступени конверсии СН4 соотношение
газ: пар составляет 1: 0, 8; температура 900- 1000°С поддерживается в реакторе
за счет теплоты экзотермической реакции окисления метана кислородом воздуха.
Теплота конвертированного газа после шахтного реактора используется в
котле-утилизаторе, вырабатывающем пар высоких параметров (10 МПа, 480°С).
Конвертированный газ после котлов-утилизаторов подают на двухступенчатую
конверсию оксида углерода. Конечный конвертированный газ подвергается очистке
от СО, СО2 и О2.
В последнее время
разработаны варианты включения ядерного реактора в систему конверсии метана
природного газа с целью снабжения теплотой эндотермической реакции (а),
происходящей в трубчатом реакторе, взамен сжигания природного газа. Для этого в
межтрубное пространство реактора направляют теплоноситель (гелий), нагретый в
ядерном реакторе до ~900°С. Теплота гелия, выходящего из трубчатого реактора
(около 700°С), используется в газовых турбинах, а также для подогрева исходной
газовой смеси, водяного пара и др.
1.
Материальный баланс
Материальный баланс
- вещественное выражение закона сохранения массы вещества, согласно которому по
всякой замкнутой системе масса веществ, вступивших во взаимодействие, равна
массе веществ, образовавшихся в результате взаимодействия. Применительно к
материальному балансу любого технологического процесса это означает, что масса
веществ, поступивших на технологическую операцию - приход, равна массе
полученных веществ - расходу. Материальный баланс составляют по уравнению
основной суммарной реакции с учетом параллельных и побочных реакций.
Материальный баланс
непрерывно действующих проточных реакторов составляется, как правило, для
установившегося (стационарного) режима, при котором общая масса веществ,
поступивших в аппарат за данный период времени, равна массе веществ, вышедших
из аппарата. Количество же всех веществ в аппарате постоянно, т. е. накопления
или убыли суммарного количества веществ не происходит.
.
Равновесие в технологических процессах
Химические процессы
делятся на обратимые и необратимые. Необратимые - протекают лишь в одном
направлении. Химические реакции, как правило, обратимы лишь в том отношении,
что в зависимости от условий они могут протекать как в прямом, так и в обратном
направлении. Однако в типичных производственных условиях многие реакции
практически необратимы. В гетерогенных системах обратимыми называют такие
процессы, в которых возможен переход вещества или теплоты как из одной фазы во
вторую, так и обратно.
Все обратимые
химико-технологические процессы стремятся к равновесию, при котором скорости
прямого и обратного процессов уравниваются, в результате чего соотношение
компонентов во взаимодействующей системе остается неизменным, пока не изменятся
внешние условия. При изменении же температуры, давления или концентрации одного
из компонентов равновесие нарушается, и в системе самопроизвольно происходят
диффузионные и химические процессы, ведущие к восстановлению равновесия в новых
условиях.
Влияние основных
параметров технологического режима на равновесие в гомогенных и гетерогенных
системах определяется принципом Ле Шателье. Согласно принципу Ле Шателье в
системе, выведенной из состояния равновесия, происходят изменения, направленные к ослаблению
воздействий, выводящих систему из равновесия. Константа равновесия служит для количественного изменения
подвижного равновесия.
Рассмотрим реакцию
aA + bB↔cC + dD
Скорость прямой
реакции
U=к1[А]а-[B]ь,
U2=k2*[C]C[D]\
где к1 и
к2-константы скорости прямой и обратной реакций, [А], [В], [С], [D]-молярные концентрации реагирующих
компонентов в данный момент.
Константа
равновесия вычисляется как отношение константы скорости прямой реакции к
обратной при равновесии, т. е при равенстве u1=u2:
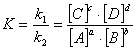
. Химические реакторы
Одним из основных
элементов любой химико-технологической системы (ХТС) является химический
реактор. Химическим реактором называется аппарат, в котором осуществляются
химические процессы, сочетающие химические реакции с массо- и теплопереносом.
Типичные реакторы -промышленные печи, контактные аппараты, реакторы с
механическим, пневматическим и струйным перемешиванием, варочные котлы,
гидрататоры и т. п.
Все аппараты,
расположенные до реактора, предназначены для подготовки сырья к химической
переработке; всё то, что находится после реактора, необходимо для разделения
получающихся в реакторе продуктов. От правильности выбора реактора и его
совершенства зависит эффективность всего технологического процесса.
Основные требования к
промышленным реакторам.
1. Максимальная производительность и интенсивность работы.
2. Высокий выход продукта и наибольшая селективность процесса. Они
обеспечиваются оптимальным режимом работы реактора: температурой, давлением, концентрацией
исходных веществ и продуктов реакции. Каталитический реактор должен так же
обеспечить эффективное применение катализатора.
3. Минимальные
энергетические затраты на перемешивание и транспортировку материалов через
реактор, а также наилучшее использование теплоты экзотермических реакций или
теплоты, подводимой в реактор для нагрева реагирующих веществ до оптимальных
температур.
4. Легкая
управляемость и безопасность работы. Эти условия обеспечиваются рациональной
конструкцией реактора и малыми колебаниями параметров технологического режима,
позволяющими легко автоматизировать работу реактора.
5. Низкая стоимость изготовления реактора и ремонта его. Это
достигается простотой конструкции и применением дешевых конструкционных
материалов: черных металлов, силикатных изделий, наиболее дешевых пластмасс.
6. Устойчивость работы реактора при значительных изменениях основных
параметров режима (С, Т, Р, со и др. ). Перечисленные требования взаимосвязаны
и в значительной степени противоречивы; рациональность их определяется влиянием
на себестоимость и качество продукции. Обычно не удается реализовать процесс в
реакторе таким образом, чтобы были удовлетворены одновременно все предъявляемые
к нему требования в виду их противоречивости. Приходится вырабатывать наиболее
рациональные и экономичные решения, обеспечивающие поддержание заданных
значений основных параметров процесса: времени реакции, температуры в различных
точках реакционной зоны, давления, степени перемешивания реагирующих веществ,
изменения концентраций реагентов по высоте (длине) реактора.
Модели идеальных
реакторов.
Степень
перемешивания реагирующих масс в реакторах непосредственно влияет на режим их
работы. Полное смешение обеспечивает постоянство параметров, в частности
температуры во всем реакционном объеме, а при идеальном вытеснении температура,
как правило, изменяется по высоте реакционного объема. В результате в реакторах
вытеснения меняется константа скорости реакции и соответственно скорости
процесса. При сравнении моделей идеальных реакторов вытеснения и смешения
условно принято постоянство температуры и соответственно константы скорости
реакции для всех типов реакторов. Модели идеальных реакторов, основные
зависимости их работы и характеристические уравнения приведены на рис. 3.
а) Реактор
идеального вытеснения (рис. 3, б)). В таком реакторе, например, трубчатом, все
частицы движутся в заданном направлении, не перемешиваясь с движущимися впереди
и сзади, и, полностью вытесняя подобно поршню находящиеся впереди частицы
потока (поршневое движение потока). Время пребывания всех частиц в аппаратах
идеального вытеснения одинаково.
б) Реактор
полного смешения проточный (рис. 3. в)). Проточный реактор смешения
представляет собой аппарат, в котором интенсивно перемешиваются реагенты,
например при помощи мешалки. В него непрерывно подаются реагенты и непрерывно
выводятся продукты реакции (рис. 25). Поступающие в такой реактор частицы
вещества мгновенно смешиваются с находящимися в нем частицами, т. е. равномерно
распределяются в объеме аппарата. В результате во всех точках реакционного
объема мгновенно выравниваются параметры, характеризующие процесс:
концентрации, степени превращения, скорости реакции, температуры и др.
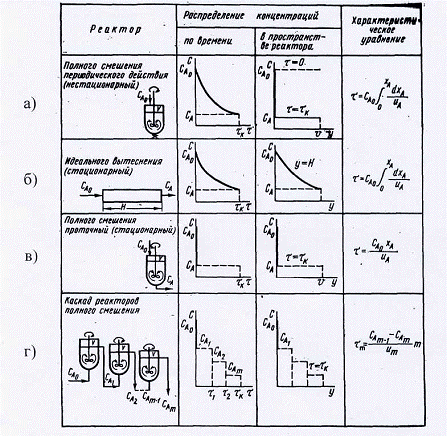
Рис. 3. Модели
идеальных реакторов.
в) Каскад
реакторов полного смешения (рис.3. г)). В
единичном реакторе полного смешения, вследствие того, что концентрации
реагентов мгновенно снижаются до конечной величины, скорость реакций при
больших степенях превращения невелика и потому для достижения высоких степеней
превращения требуются реакторы большого объема. Более целесообразна установка
ряда последовательно соединенных реакторов полного смешения - каскада
реакторов. В каскаде реакторов состав реакционной смеси изменяется при переходе
из одного аппарата в другой. При этом в каждой ступени каскада, как это
характерно для реакторов полного смешения, параметры процесса постоянны по
всему объему. Для определения числа теоретических ступеней каскада используют
большей частью алгебраический и графический методы.
г) Реактор
периодического действия (рис.3.а)).
Реакторы периодического действия работают при нестационарном технологическом
режиме. При этом независимо от степени перемешивания реагирующих масс
изменяются во времени не только концентрации реагентов, но и температура,
давление, а соответственно и константа скорости процесса. Если периодический
реактор работает в режиме полного смешения, то время,
необходимое для достижения заданной степени
превращения, рассчитывается по характеристическому уравнению, которое совпадает
с характеристическим уравнением реактора идеального вытеснения. Следовательно,
если были бы возможны одинаковые условия проведения процесса в реакторах
периодического действия и идеального вытеснения, то их объемы были бы равны
между собой. Однако условия протекания процессов в промышленных проточных
реакторах, как правило, лучше, чем в периодических.
Кроме того,
производительность реактора периодического действия ниже, чем реактора
идеального вытеснения, работающего непрерывно, потому что при использовании
периодически действующего реактора затрачивается некоторое время на загрузку
реагентов, после чего в нем происходит химическое превращение. По окончании
реакции производят опорожнение реактора, на что также требуется определенное
время. Следовательно, работа такого реактора складывается из чередующихся
циклов: загрузка - химическое превращение - разгрузка. При этом полезным
периодом работы реактора является стадия химических превращений, время которой
определяется по уравнению.
Рассмотрим реакцию
образования аммиака:
N2+3H2 ↔ 2NH3
Основой
материального баланса является тождество
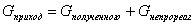
По справочным данным на
получение 1т аммиака расходуется 2635м3 азотоводородной смеси.
В нашем случае Gполуч=0,016т/с,
следовательно
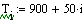

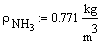
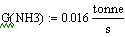
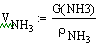
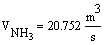
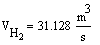
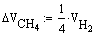
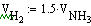
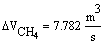
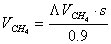
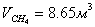
Далее идет расчет по реакции CH4 + H2O ↔ CO + 3H2 - 206кДж
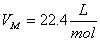
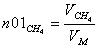
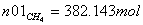
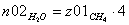
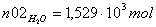
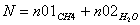
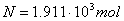
Молярные доли веществ в исходной
смеси
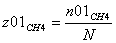
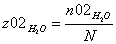 CH4=0.2
z02H2O=0.8 =1 b=1 c=1 d=3 λ = (c+d) - (a+b)
CH4=0.2
z02H2O=0.8 =1 b=1 c=1 d=3 λ = (c+d) - (a+b)
λ = 2
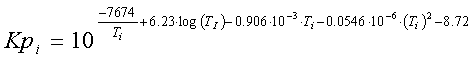

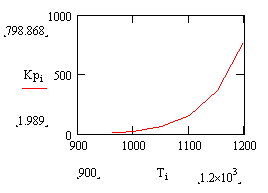
Рис. 1 График зависимости константы равновесия
от температуры
График имеет возрастающую зависимость, так как
реакция эндотермическая Е1>Е2 => ∆Е<0.
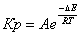
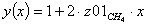
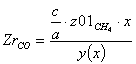
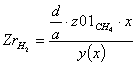
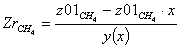
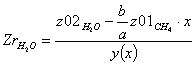
Равновесная степень превращения:
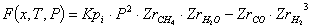
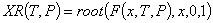

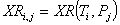

С увеличением
температуры равновесная константа скорости реакции Кр возрастает, вместе с тем
равновесная концентрация метана Zp в смеси убывает пропорционально Кр.
В формуле для
расчёта Zp начальных компонентов постоянное. При росте Кр числитель растёт.
Следовательно, с ростом температуры степень превращения метана увеличивается.
Теоретически до 1, а практически до Хр.
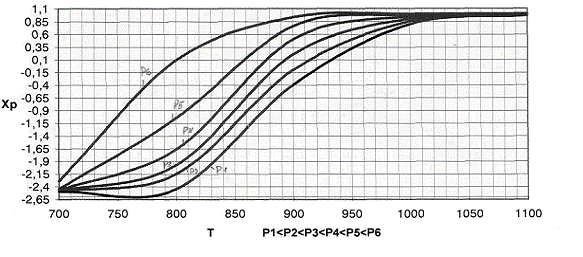
Рис.3 График
зависимости практической равновесной степени превращения от давления.
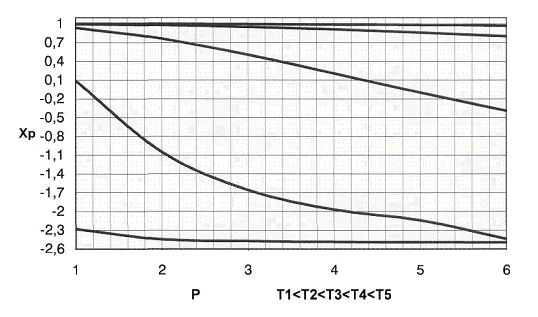
В формуле 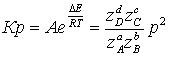 Кр
не зависит от давления => с увеличением р числитель убывает, а знаменатель
увеличивается. Поэтому повышение давления негативно сказывается на протекании
реакции (степень превращения метана снижается). Область отрицательных значений
Хр соответствует протеканию обратной реакции.
Кр
не зависит от давления => с увеличением р числитель убывает, а знаменатель
увеличивается. Поэтому повышение давления негативно сказывается на протекании
реакции (степень превращения метана снижается). Область отрицательных значений
Хр соответствует протеканию обратной реакции.
Кинетика
CH4
+
H2O
↔
CO + 3H2
-
206кДж
a=1 b=1 c=1 d=3 λ
= (c+d) - (a+b)
λ = 2
Мольные доли вещества исходной
смеси: 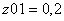
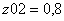
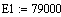

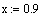
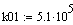
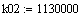
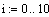
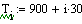
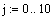
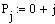
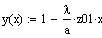
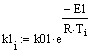
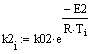
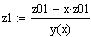
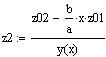
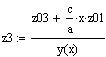

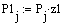

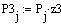
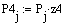
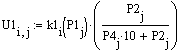
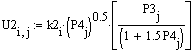

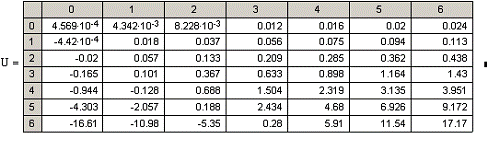
Рис.5 Зависимость скорости
прямой реакции от температуры.
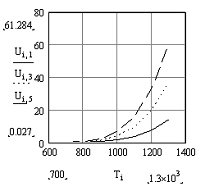
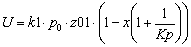

при Т↑→Кр↑→U↑. Так
как прямая реакция идет с увеличением объема та при повышении давления скорость
прямой реакции уменьшается.
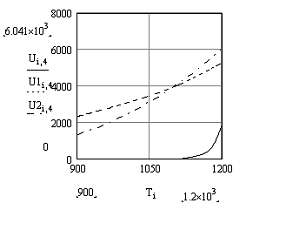
Рис.6 График зависимости скорости прямой,
обратной и суммарной скорости реакции от температуры
Скорость прямой реакцииU1
При Т↑→К1 ↑ → U1
↑
Cкорость обратной
реакции U2
При Т↑→К1 ↑ → U2
↑
Суммарная скорость реакции
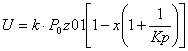
При Т↑ → Кр↑ →∆С↑
→U↑
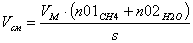
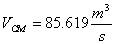
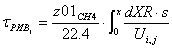

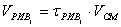
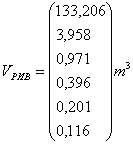
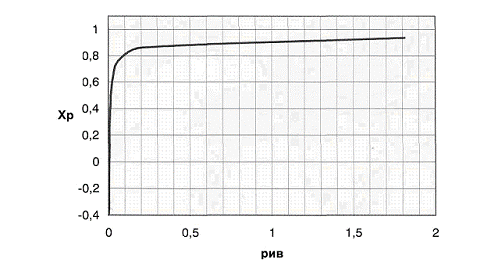
Рис. 7 График зависимости
степени превращения от времени реакции в реакторе идеального вытеснения.
С увеличением
времени пребывания реакционной смеси в реакторе идеального вытеснения трив
степень превращения метана ХR увеличивается до максимально возможной величины (Х2), поскольку
эти параметры связаны прямо пропорциональной зависимостью.
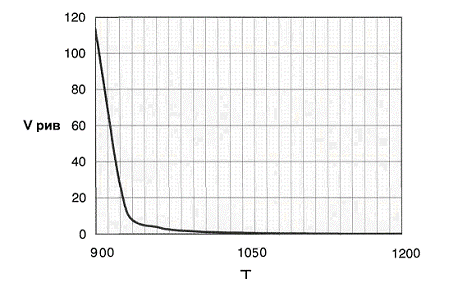
Рис.8 График зависимости объема реактора
идеального вытеснения от температуры.
При увеличении
температуры в реакторе константа реакции увеличивается. В связи с этим
суммарная скорость реакции Ur увеличивается, а время пребывания смеси в реакторе, связанное с Ur по закону обратной
пропорции, убывает, и объём реактора может быть уменьшен.

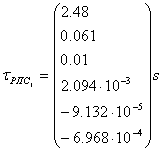
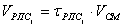
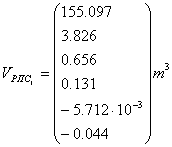
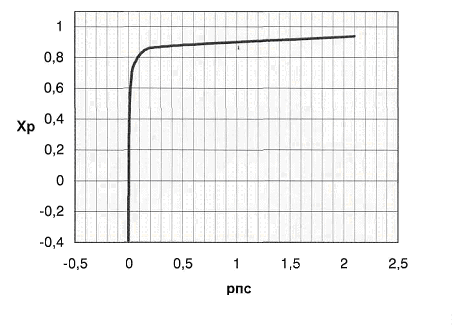
Рис. 9 График зависимости
степени превращения от времени реакции в реакторе полного смешения.
С увеличением
времени пребывания реакционной смеси в реакторе полного смешения трпс
степень превращения метана ХR увеличивается до максимально возможной величины (Х2), поскольку
эти параметры связаны прямо пропорциональной зависимостью.
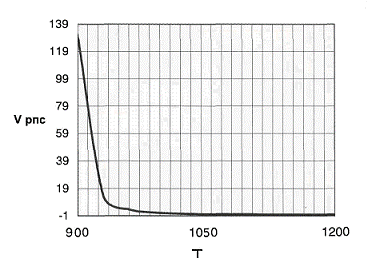
Рис. 10 График зависимости объема реактора
полного смешения от температуры.
С увеличением
времени пребывания реакционной смеси в реакторе полного смешения трпс
степень превращения метана ХR увеличивается до максимально возможной величины (Х2), поскольку
эти параметры связаны прямо пропорциональной зависимостью.

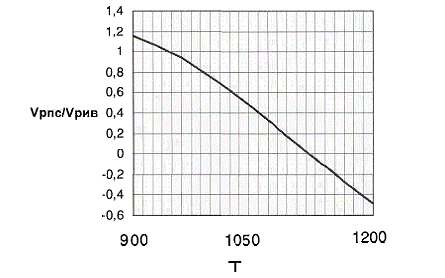
При увеличении
температуры уменьшение объёма реактора полного смешения Vpnc менее интенсивно,
чем уменьшение объёма реактора идеального вытеснения Vpив: отношение их объёмов
снижается. При использовании температуры до 950К рациональнее использовать
реактор идеального вытеснения (Vpnc/Vривi>l -> Vpив<Vpnc), далее - реактор полного смешения (Vpnc/VPиB<1 -► Vрив>Vpnc).
Заключение
В ходе
разработки курсового проекта были сделаны следующие выводы:
1. увеличение температуры увеличивает константу равновесия реакции и
увеличивает скорость протекания реакции;
2. увеличение времени протекания процесса способствует более полному
расходованию метана;
3. длина (высота) реактора играет важную роль, поскольку с её
увеличением степень превращения метана стремительно возрастает;
4. для данного процесса более выгодным с точки зрения затрат на
изготовление оказывается аппарат близкий по свойствам к реактору идеального
вытеснения.
Список использованной литературы
1. Общая химическая технология (Под
ред. проф. И.П. Мухленова, часть 1,2, М, в.ш., 1984)
. Справочник азотчика, М.-Л., Химия,
1967, т.1,2.
. Н.Н. Плетоханова. Лекции.