Генная инженерия
ФГОУ ВПО
«АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Кафедра
«Пищевая биотехнология и технология продуктов питания»
ГЕННАЯ
ИНЖЕНЕРИЯ
методические
указания
к проведению
практических занятий
для студентов
IV курса
специальности
080401.65 «Товароведение и экспертиза товаров»
(в области
таможенной деятельности)
АСТРАХАНЬ,
2011
Составитель:
Афанасьев В.Е., к.б.н., доцент преподаватель кафедры «Прикладная биология
и микробиология»
Рецензент:
Цибизова М.Е., к.т.н., зав. кафедрой «Пищевая биотехнология и технология
продуктов питания»
Генная инженерия: методические указания к проведению практических занятий
для студентов IV курса специальности 080401.65 «Товароведение и экспертиза
товаров» (в области таможенной деятельности) / АГТУ; Сост.: В.Е. Афанасьев -
Астрахань, 2011. - 56 с.
Методические указания к проведению практических занятий по дисциплине
«Генная инженерия» для IV курса специальности 080401.65 «Товароведение и
экспертиза товаров» (в области таможенной деятельности).
Данные методические указания содержат описания методов, используемых для
создания гибридных ДНК, введения их в реципиентные клетки, при скрининге
клонов, секвенировании и амплификации ДНК. Приведен список вопросов,
предусмотренных рабочей программой дисциплины «Генная инженерия» для
самостоятельного изучения студентами, вопросы итогового контроля и список
литературы, рекомендуемой для освоения курса.
Методические указания утверждены на заседании методического совета по
специальности 080401.65 «Товароведение и экспертиза товаров» (в области
таможенной деятельности) «29» 04. 2011 г., протокол № 11.
© Астраханский государственный технический университет
СОДЕРЖАНИЕ
Введение
Методы конструирования рекомбинантных ДНК in vitro
Методы введения рекомбинантных ДНК в клетки
Методы идентификации клонов, содержащих рекомбинантные ДНК
Методы секвенирования
Амплификация последовательности ДНК in vitro
Генетически модифицированные микроорганизмы и их
использование
Получение трансгенных растений, устойчивых к неблагоприятным
факторам внешней среды
Получение трансгенных растений с улучшенными пищевыми
свойствами
Конструирование трансгенных растений - продуцентов целевых
белков
Создание и применение трансгенных животных
Генотерапия
Краткий словарь терминов
Вопросы для самостоятельного изучения
Вопросы итогового контроля
Список рекомендуемой литературы
ВВЕДЕНИЕ
Генная инженерия (синонимы: генетическая инженерия, ДНК-технологии) - это
отрасль биологической технологии, задачей которой является конструирование in vitro новых молекулярных генетических систем и последующее
встраивание их в геномы организмов. Иными словами, методами генной инженерии в
лабораторных условиях генетический материал из одного организма (который
принято называть источником или донором генов) переносится в другой организм
(называемый хозяином или реципиентом). Целью данных манипуляций является
получение организмов с новыми заданными полезными для человека генетически
обусловленными свойствами.
Перенос генов методами генной инженерии дает возможность преодолевать межвидовые
барьеры и осуществлять передачу отдельных наследственных признаков от одних
организмов другим, не родственным им (например, от животных бактериям), чего
нельзя достичь методами традиционной селекции.
Вне зависимости от применяемых конкретных методов, типовой
генноинженерный эксперимент можно представить в виде последовательности из
четырех этапов:
) получение фрагмента (или смеси фрагментов) ДНК путем расщепления
исходной молекулы с помощью специфических ферментов - эндонуклеаз рестрикции
(рестриктаз);
2) конструирование in vitro рекомбинантных молекул ДНК,
состоящих из фрагментов, полученных на первом этапе, и небольших автономно
реплицирующихся в клетке-реципиенте структур (плазмид, фагов, вирусов), носящих
название векторов;
) введение рекомбинантных молекул ДНК в клетку-реципиент;
) отбор клонов, несущих нужную рекомбинантную молекулу.
Важнейшим источником донорских молекул ДНК, используемых в генной
инженерии, являются фрагменты генетического материала различных организмов.
Вторым источником могут быть двунитевые дезоксирибонуклеиновые кислоты,
полученные на основе однонитевой ДНК комплементарной мРНК эукариотических
организмов (дн-кДНК). Подобные копии применяются для экспрессии в бактериях
важных с медицинской точки зрения белков человека и животных. Третий источник -
искусственные молекулы ДНК, полученные путем химико-ферментативного синтеза.
Практическое занятие №1
Тема: Методы конструирования рекомбинантных ДНК in vitro
Конструирование рекомбинантных молекул ДНК, независимо от выбранного метода,
сводится к следующим задачам:
) Получение целевого фрагмента (или смеси фрагментов) ДНК путем
разрезания с помощью рестриктаз молекулы ДНК, выделенной из конкретного
организма.
2) Разрезание векторной молекулы с помощью рестриктазы в
определенном участке (сайте рестрикции).
) Вставка и последующее вшивание целевого фрагмента ДНК в вектор в
месте разреза.
Впервые подобная операция была произведена в 1972 г. группой американских
генетиков из Стенфордского университета под руководством Пола Берга. Ими была
получена in vitro гибридная молекула, состоящей из ДНК вируса SV40 и ДНК фага λdvgal. Использованный при этом алгоритм
действий получил название коннекторного метода. В 1980 г. за свое открытие Пол
Берг был удостоен Нобелевской премии в области химии.
Принцип коннекторного метода (см. рис. 1). К 3'-концам одного из
рекомбинируемых in vitro фрагментов ДНК с помощью фермента
терминальная трансфераза достраивают одноцепочечные сегменты определенной
длины, состоящие из адениновых нуклеотидов (олиго(dA)-сегменты), а к концам другого фрагмента - комплементарные
им олиго(dT)-сегменты (состоящие из тиминовых
оснований) примерно такой же длины. При смешении полученных таким образом
фрагментов формируются кольцевые структуры за счет водородных связей между
олиго(dA)- и олиго(dT)-последовательностями. Одноцепочечные бреши гибридных
молекул ДНК застраивают с помощью ДНК-полимеразы и цепи ковалентно сшивают в
лигазной реакции.
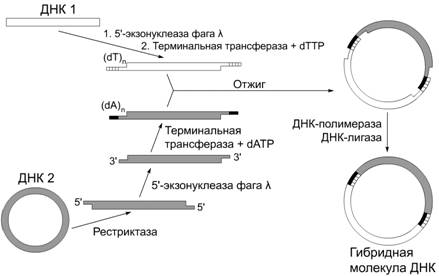
Рис. 1. Схема коннекторного метода создания рекомбинантных ДНК
На следующий год после экспериментов П. Берга, другой американский
биохимик С. Коэн с сотрудниками предложил более простой метод конструирования
гибридных молекул ДНК, основанный на применении двух ферментов: рестриктазы и
ДНК-лигазы. Рестриктазно-лигазный метод быстро завоевал популярность и
используется до сих пор как наиболее простой и надежный.
Принцип рестриктазно-лигазного метода. Данный метод состоит из трех
этапов (см. рис. 2):
1) рестриктазой класса II специфически разрезают молекулы ДНК на фрагменты, имеющие
идентичные взаимокомплементарные липкие концы;
) препараты различных молекул ДНК, гидролизованных
одной и той же рестриктазой, смешивают, и при определенных условиях липкие
концы разных фрагментов ДНК реассоциируют за счет комплементарного
взаимодействия;
) с помощью ДНК-лигазы происходит ковалентное
связывание ассоциированных фрагментов ДНК.
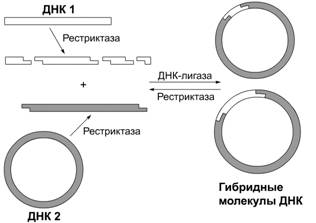
Рис. 2. Схема рестриктазно-лигазного метода создания рекомбинантных ДНК
Рестриктазно-лигазный метод, по сравнению с коннекторным методом, находит
более широкое применение в генно-инженерных манипуляциях, поскольку он более
прост биохимически и, кроме того, дает возможность легко выщепить встроенный
фрагмент из гибридной молекулы ДНК, что часто бывает важно при переносе
фрагмента в другое генетическое окружение.
Данный метод позволяет использовать в каждом конкретном эксперименте
одновременно две рестриктазы. Комбинируемые молекулы ДНК при этом могут иметь
разные липкие концы. В этом случае фрагменты объединяются в строго определенной
ориентации относительно друг друга. При смешении же фрагментов, полученных
после гидролиза одной рестриктазой, возможны различные их ориентации в
формирующихся гибридных молекулах ДНК. Более того, в процессе лигазной реакции
может происходить ковалентное объединение не только двух, но и трех, а также
большего числа фрагментов.
По такой схеме могут быть ковалентно соединены in vitro два и более любых фрагмента, полученных при гидролизе
молекул ДНК одной и той же рестриктазой. Однако в первоначальном виде метод
имеет существенное ограничение, связанное с тем, что с помощью рестриктаз
(особенно одного фермента) в каждом конкретном случае можно получить лишь
специфический, строго определенный набор фрагментов изучаемой ДНК. Для
преодоления этого недостатка была разработана модификация, основанная на
использовании линкерных молекул (линкеров) - синтетических сегментов ДНК,
содержащих в своем составе последовательности, узнаваемые рестриктазами. Метод
предложили Р. Шеллер с сотрудниками в 1977 г. Он позволяет достаточно просто
рекомбинировать in vitro практически любые фрагменты ДНК.
Модификация рестриктазно-лигазного метода с
использованием линкеров. Разработанный подход включает следущие операции (рис.
3):
1) по тупым или липким концам фрагмента ДНК,
который предполагается рекомбинировать, с помощью лигазы фага Т4 пришивают
короткие синтетические двухцепочечные сегменты, имеющие участки узнавания
определенной рестриктазы;
2) полученный фрагмент обрабатывают выбранной
рестриктазой, в результате чего образуются липкие концы;
) полученный фрагмент рекомбинируют in vitro с другими молекулами ДНК по обычной схеме
рестриктазно-лигазного метода.
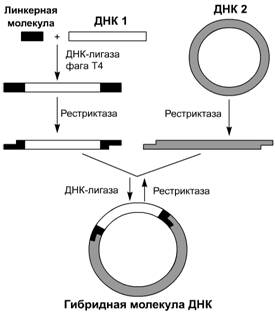
Рис. 3. Схема создания рекомбинантных ДНК с использованием линкерных
молекул
Использование линкерных молекул делает
рестриктазно-лигазный метод рекомбинации фрагментов ДНК in vitro универсальным, поскольку исходные фрагменты можно
получать самыми различными способами.
Практическое занятие №2
Тема: Методы введения рекомбинантных ДНК в
клетки
Для введения в клетку рекомбинантных ДНК, сконструированных на основе
бактериальных и дрожжевых плазмид или вирусов эукариот, разработано множество
различных по своей эффективности и сложности методов. Процесс проникновения
экзогенной ДНК в клетку называется трансформацией, а трансформированные клетки
принято называть трансформантами. Термином трансфекция обозначается введение в
клетки ДНК или РНК вируса с последующим образованием вирусного потомства.
Эффективность трансформации обычно невысока. Рекомбинантный геном включается в
среднем лишь в одну из примерно 1000 клеток. Однако данный недостаток
компенсируется применением эффективных методов скрининга, позволяющих быстро
идентифицировать трансформированные клетки.
Трансформация чужеродной ДНК происходит только в компетентные клетки, то
есть в те клетки, стенки которых стали проницаемыми для ДНК.
Метод CaCl2-зависимой трансфекции. Разработан
М. Манделем и А. Хигом в 1970 г. Клетки бактерий подвергаются обработке ледяным
(0° С) раствором CaCl2 с
последующим выдерживанием при 42°С в течение 1,5 минут (тепловой шок). При этом
происходит локальное разрушение клеточной стенки и клетки становятся способными
к поглощению молекул ДНК из внешней среды. Наиболее успешно происходит
поглощение фаговой ДНК, несколько хуже - плазмидной. Эффективность метода
составляет до 10-4 БОЕ на одну молекулу ДНК фага λ.
Метод ЭДТА-лизоцимных сферопластов. Сферопласты - живые бактериальные или
дрожжевые клетки, с почти полностью разрушенной клеточной стенкой. Обычно
сферопласты бактерий получают путем обработки клеток раствором бактерицидного
фермента лизоцима. Лизоцим гидролизует пептидогликан стенок бактерий, разрушая
полисахаридные цепи до дисахаридных фрагментов. Внешняя мембрана грамнегативных
бактерий защищает пептидогликановый слой от воздействия ферментов. Поэтому
перед использованием лизоцима клетки грамнегативных бактерий обрабатывают
комплексообразующим агентом этилендиамининтетраацетатом (ЭДТА), который
связывает двухвалентные ионы, стабилизирующие внешнюю мембрану. В результате
часть липополисахаридов высвобождается из мембраны и она становится проницаема
для лизоцима.
Эффективность метода составляет до 10-3 БОЕ на одну молекулу ДНК фага λ,
что на порядок выше, чем
при использовании метода CaCl2-зависимой
трансфекции, однако, из-за сложности и плохо воспроизводимых результатов данный
метод не получил широкого распространения.
Электропорация. Это физический метод повышения компетентности клеток
путем кратковременного (5-20 мс) воздействия на них электрическим полем высокой
напряженности (1-15 кВ/см). При этом в результате электропробоя происходит
образование пор в липидных мембранах. Количество трансформантов при этом может
достигать 80 % выживших клеток - столь высокой результативности не удается
добиться иными существующими методами.
В настоящее время электропорация благодаря простоте и эффективности
становится наиболее популярным методом трансформации как про-, так и
эукариотических клеток, чему способствует также серийное производство
электропораторов.
ДЭАЭ-декстрановый метод. Применяется для введения ДНК в клетки млекопитающих. Открыт в 1968 г. Дж.
Мак-Катченом и Дж. Пагано.
Поликатион диэтиламиноэтилдекстран (ДЭАЭ-декстран) значительно
увеличивает эффективность
трансфекции клеток животных нуклеиновой кислотой вируса SV40. Очищенную ДНК вируса SV40 инкубируют сначала в растворе с ДЭАЭ-декстраном,
варьируя его концентрацию
от 100 до 3000 мкг/мл. Затем эту смесь наносят на монослой клеток, который через определенный
промежуток времени отмывают от поликатиона и заливают средой. В процессе
последующей инкубации на монослое появляются бляшки лизированных клеток. Эффективность
трансфекции ДНК вируса SV40 таким методом составляет (1-10) · 106
БОЕ на 1 мкг ДНК. На
эффективность трансфекции влияют молекулярная масса (наилучшие результаты
достигаются при использовании поликатиона с молекулярной массой 106 Да) и
концентрация применяемого ДЭАЭ-декстрана.
Механизм действия ДЭАЭ-декстрана окончательно не установлен, но известно,
что он связывается с
нуклеиновыми кислотами и частично предохраняет их от деградации нуклеазами. ДЭАЭ-декстран также
взаимодействует с
клеточной мембраной и, по-видимому, за счет этого увеличивает эффективную
концентрацию ДНК на
поверхности клеток и стимулирует пиноцитоз, хотя сам при этом клетками не захватывается.
ДЭАЭ-декстрановый метод довольно прост и дает высоковоспроизводимые
результаты. К недостаткам метода можно отнести то, что для некоторых культур
клеток ДЭАЭ-декстран может быть токсичен при использовании его в высокой
концентрации. Кроме того, эффективность трансфекции может существенно зависеть
от качества препарата ДЭАЭ-декстрана.
Кальций-фосфатный метод. Является модификацией
ДЭАЭ-декстранового метода. На монослой клеток КВ, предварительно обработанных
ДЭАЭ-декстраном, наносят ДНК аденовируса Аd5 в растворе СаCl2.
При этом эффективность трансфекции повышается в 10-100 раз. Аналогичные
результаты получаются, когда клетки не обрабатывают ДЭАЭ-декстраном. Поскольку
в питательной среде присутствуют фосфаты, при добавлении раствора хлорида кальция
образуется осадок фосфата кальция. Удаление этого осадка из среды приводит к
потере инфекционности ДНК. Таким образом, трансфекция происходит в результате
соосаждения вирусной ДНК и образующихся микрокристаллов фосфата кальция на
клеточный монослой.
На примере ДНК вируса простого герпеса показано, что
сразу после соосаждения с фосфатом кальция вирусная ДНК становится устойчивой к
разрушению ультразвуком, но комплекс фосфат кальция - ДНК остается
чувствительным к ДНКазе в течение 4 ч. При взаимодействии этого комплекса с
культурой клеток животных ДНК становится устойчивой к ДНКазе уже в течение
первого часа. ДНК образует с фосфатом кальция прочный комплекс, который при
оптимальных условиях поглощают практически все реципиентные клетки.
Эффективность поглощения клетками комплекса фосфат кальция - ДНК в значительной
степени зависит от рН, при котором формировался этот комплекс, и концентрации
ДНК. Важно, чтобы осадок фосфата кальция получился мелкодисперсным. Но даже в
оптимальных условиях проведения трансфекции данным методом лишь в 1-5 % клеток
комплекс достигает ядра. По-видимому, проникновение ДНК из цитоплазмы в ядро
является критическим этапом, наиболее сильно влияющим на эффективность
трансфекции клеток вирусной ДНК.
Кальций-фосфатный метод обычно более эффективен, чем
ДЭАЭ-декстрановый, при трансфекции линейными вирусными ДНК и заметно уступает
последнему при использовании кольцевых молекул ДНК. Вероятно, образование
микрокристаллов фосфата кальция и соосаждение с ними молекул ДНК сопровождается
нарушением структуры части этих макромолекул. Особенно данный эффект
сказывается на лабильных кольцевых молекулах ДНК, которые после разрыва цепей и
перехода в линейную форму уже не инфекционны. ДЭАЭ-декстрановый метод, как
более мягкий, обеспечивает значительно большую эффективность проникновения
кольцевых молекул ДНК в клетки животных в неповрежденном виде, хотя в целом
доля клеток, поглотивших ДНК при обработке ДЭАЭ-декстраном, существенно меньше,
чем при трансфекции кальций-фосфатным методом.
Метод инфекции. Под инфекцией в данном случае
подразумевается введение в клетку рекомбинантных ДНК, упакованных в вирусные
частицы (рекомбинанты, сконструированные с использованием λ-векторов или космид).
Для упаковки используют рекомбинантные молекулы,
вектором в которых выступает ДНК фагов, утративших в результате мутации
способность инициировать синтез белков-капсомеров. При помещении ДНК таких
фагов в концентрированный экстракт лизогенных по данному вирусу клеток (в них
содержаться все необходимые белки), происходит сборка in vitro вирусных частиц. Сформированными таким способом
частицами можно заражать бактериальные клетки и получить фаговое потомство.
В капсид упаковываются молекулы ДНК, близкие по
размеру фаговому геному, поэтому в бактериальные клетки попадает лишь ДНК
заданного размера. Кроме того, в капсиды не упаковываются многочисленные
побочные продукты лигазной реакции.
Метод позволяет эффективно клонировать чужеродную
генетическую информацию в клетках бактерий.
Микроинъекция вирусных молекул ДНК. Метод впервые воспроизведен А. Грессманом в 1970 г. при
введения молекул ДНК в
культивируемые клетки млекопитающих. Процедура
заключается во введении в
клетку (цитоплазму или ядро) малых объемов жидкости (около 10-8 мкл) с помощью стеклянного микрокапилляра. Эксперимент проводится на предметном столике
микроскопа с применением
микроманипуляторов и микрошприцев. Используя эту методику, удалось изучить биологическую активность молекул
ДНК разных вирусов. К достоинствам метода относится то, что определенное
количество препарата ДНК можно ввести в выбранную область клетки, в частности в
ядро. Недостатком метода является его сложность и невысокая производительность.
Кроме того, по-видимому, он применим лишь к небольшим молекулам ДНК, так как
при продавливании через микрокапилляр целостность больших молекул ДНК будет нарушаться
вследствие гидродинамического сдвига. В силу отмеченных недостатков метод
микроинъекции ДНК используется крайне редко.
Практическое занятие №3
Тема: Методы идентификации клонов, содержащих
рекомбинантные ДНК
Идентификация клонов, несущих нужные гибридные (рекомбинантные) молекулы
ДНК, называется скринингом.
Фенотипический скрининг. Этот метод требует наличия в гибридной молекуле
одного или более маркёров. Под маркёром в данном случае понимается ген, кодирующий
легко обнаруживаемый фенотипический признак. Клоны, имеющие данный признак (или
признаки) являются обладателями нужной гибридной молекулы.
Часто в качестве маркёров выступают гены, обуславливающие устойчивость
клеток к определенным антибиотикам или антиметаболитам. При высеве на
питательную среду, содержащую этот антибиотик или антиметаболит, будут расти
только клетки трансформантов. Особенно хорошо данная система селекции
отработана для бактерий, так как получены векторные плазмиды, детерминирующие
устойчивость трансформированных клеток сразу к нескольким антибиотикам. Если
векторная плазмида определяет устойчивость к двум антибиотикам и при встройке в
нее экзогенного фрагмента ДНК нарушается одна из генетических детерминант
устойчивости к антибиотикам, то клоны клеток, содержащих такие гибридные ДНК,
легко отличить от трансформантов, включающих исходный вектор, на средах с
каждым антибиотиком в отдельности.
Например, если векторная плазмида детерминирует устойчивость одновременно
к тетрациклину и ампициллину (ТсrАрr) и при встройке в нее чужеродного
фрагмента нарушается ген устойчивости к ампициллину, то гибридная плазмида
будет обусловливать фенотип клетки-хозяина ТсrАрs, т. е.
устойчивость к тетрациклину и чувствительность к ампициллину. Плазмиды после
встройки в них фрагментов ДНК вводят в клетки, культуру высевают на чашки с
агаризованной питательной средой, в которую добавлен тетрациклин. При этом
вырастают колонии клеток, содержащих или исходную векторную плазмиду, или
гибридные плазмиды. Затем колонии перепечатывают на чашки с ампициллином и
чашки с тетрациклином. Те колонии, которые после перепечатки будут расти на
среде с тетрациклином и не дадут роста на среде с ампициллином, содержат
гибридные плазмиды. Простота манипуляций обусловила широкое использование
данного типа векторов для клонирования самых различных фрагментов ДНК. Однако
такие плазмиды не позволяют осуществлять прямой отбор гибридных клонов - сразу
после высева трансформантов на селективную среду и появления колоний.
В последние годы получен ряд векторных плазмид, предназначенных для
прямой селекции трансформантов, содержащих гибридные плазмиды. Такие векторы
обычно имеют гены, потенциально летальные для чувствительных
клеток-реципиентов, и могут трансформировать эти клетки только после
инактивации данных генов встраиванием в них фрагментов ДНК.
Скрининг с помощью гибридизации. Нужную нуклеотидную последовательность в
образце ДНК можно обнаружить с помощью ДНК-зонда, спаривающегося только с
искомой последовательностью. Для этого ДНК сначала переводят в одноцепочечную
форму, подвергнув ее тепловой обработке или воздействию щелочью. В этих
условиях водородные связи между основаниями разрываются и цепи расходятся
(происходит денатурация). Если теперь медленно снизить температуру, то произойдет
их воссоединение (ренатурация). При этом, если в растворе присутствует
одноцепочечный ДНК-зонд, он тоже будет ренатурировать с ДНК, специфически
спариваясь с комплементарными участками. В результате образуется гибридная ДНК,
т. е. двухцепочечная молекула, цепи которой принадлежат двум разным ДНК (рис.
4).
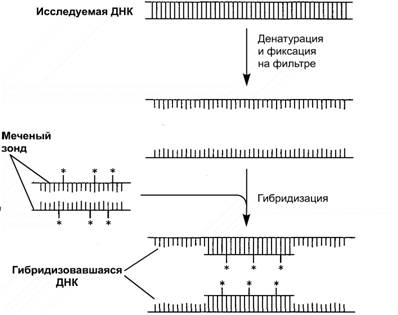
Рис. 4. ДНК-гибридизация
Принцип метода. ДНК-мишень подвергают денатурации и одноцепочечные
молекулы необратимо «пришивают» к твердой подложке (нитроцеллюлозному или
найлоновому фильтру). Эту процедуру обычно проводят при высокой температуре.
Провести гибридизацию непосредственно на поверхности питательной гелевой среды,
на которой культивировались микроорганизмы, невозможно, поскольку зонд не может
в нее проникнуть. Перенос ДНК из геля на фильтр носит название Саузерн-блоттинга
в честь Эдвина Саузерна, который изобрел этот метод. Затем фильтр инкубируют с
одноцепочечным ДНК-зондом, меченным радиоизотопом или другой меткой. Если
нуклеотидные последовательности зонда и ДНК-мишени комплементарны, то
происходит их спаривание (т. е. гибридизация). Гибридные молекулы можно
визуализировать радиоавтографическим или другим методом, зависящим от природы
метки.
Радиоавтографический метод широко применяется для локализации
радиоактивного материала. Для регистрации радиоактивных зон на исследуемый
образец накладывают рентгеновскую пленку, в которой под действием
радиоактивного излучения из бромида серебра образуется металлическое серебро.
«Засвеченные» участки, соответствующие радиоактивным зонам, наблюдаются
визуально после проявления пленки.
Если комплементарность между зондом и ДНК-мишенью отсутствует, то
гибридизации не происходит, и результат получается отрицательным.
Обычно размер зонда варьирует от 100 до 1000 п. н., хотя можно
использовать как более крупные зонды, так и зонды меньшего размера. Для
гибридизации, т. е. для образования стабильного комплекса, необходимо, чтобы на
участке длиной 50 нуклеотидов совпадало более 80% из них, но это зависит от
условий реакции.
Радиоиммунологический скрининг. Данный метод применяется в случае, если
клонируемый ген активно экспрессируется в клетке-хозяине. Продукцию экспрессии
гена - белок или его часть, можно обнаружить иммунологическими методами.
В основу метода положена способность молекул иммуноглобулинов связываться
с полистиролом или поливинилом. Необходимым условием является наличие у
исследуемого белка не менее двух антигенных детерминант, что дает ему
возможность связывать по крайней мере две разные молекулы иммуноглобулинов.
Принцип метода. Колонии трансформантов перепечатывают идентичным образом
на две чашки с агаризованной питательной средой и чашки инкубируют до получения
колоний необходимого размера. Затем на одной из чашек лизируют бактериальные
клетки и прижимают к поверхности среды поливиниловый диск с адсорбированными на
нем специфическими антителами. При этом на диске происходит иммуносорбция
антигена. После промывания диска на него наносят 125I-меченные антитела (препарат поликлональных иммуноглобулинов)
к белку искомого гена. Таким образом, при наличии в чашке специфического белка
(антигена), на фильтре образуется комплекс «антитело 1-антиген-антитело 2».
Первое антитело служит для прикрепления комплекса к фильтру, второе является
маркером, позволяющим выявить колонии, в которых образовался комплекс, методом
радиоавтографии.
Из соответствующих колоний с матричных чашек бактерии пересевают на
питательные среды и проводят анализ содержащихся в них гибридных плазмид.
Практическое занятие №4
Тема: Методы секвенирования
Генетическая инженерия как отрасль биотехнологии во многом обязана своим
успешным развитием появлению относительно простых методов, позволяющих
достаточно быстро определить последовательность нуклеотидов в исследуемых
фрагментах ДНК.
Дидезоксинуклеотидный метод секвенирования ДНК. Дидезоксинуклеотид - это
полученный искусственным путем нуклеотид, лишенный 2'- и 3'-гидроксильных групп
при углеродных атомах сахарного кольца (рис. 5, А). У дезоксинуклеотида,
входящего в норме в состав ДНК, отсутствует только 2'-гидроксильная группа
(рис. 5, Б).
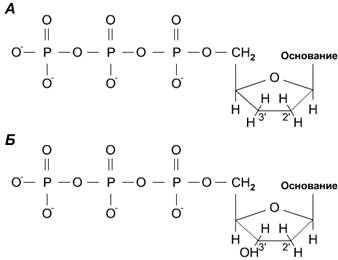
Рис. 5. Отличие дидезоксинуклеотида от дезоксинуклеотида
А - дидезоксинуклеотид: отсутствуют 2' и 3'-гидроксильные группы в
дезоксирибозном кольце; Б - дезоксинуклеотид: отсутствует только
2'-гидроксильная группа.
Удлинение цепи во время репликации ДНК происходит в результате
присоединения очередного нуклеозидтрифосфата к 3'-гидроксильной группе
последнего нуклеотида растущей цепи. И если таким очередным присоединяемым
звеном является дидезоксинуклеотид, то синтез ДНК останавливается, поскольку
следующий нуклеотид не может образовать фосфодиэфирную связь. Остановка синтеза
ДНК - это ключевой этап дидезокси-метода, но чтобы осуществить секвенирование в
полном объеме, необходимо выполнить целый ряд условий.
Первый шаг стандартной процедуры дидезокси-секвенирования состоит в
гибридизации синтетического олигонуклеотида длиной 17-20 звеньев со
специфическим участком одной из цепей клонирующего вектора, соседствующим со
вставкой. Этот олигонуклеотид является праймером, поставляющим 3'-гидроксильную
группу для инициации синтеза. Раствор с праймером распределяют по четырем
пробиркам, в каждой из которых находятся четыре дезокси-нуклеотида, dATP, dСТР,
dGТР и dTТР (один из них - изотопно меченный), и один из четырех
дидезоксинуклеотидов (ddАТР, ddСТР, ddGТР или ddTТР). Концентрацию каждого
дидезоксинуклеотида подбирают таким образом, чтобы он оказался включенным по
всем позициям в смеси растущих цепей, а не только в первой встретившейся ему
позиции. По окончании ферментативного синтеза при участии ДНК-полимеразы в
каждой пробирке оказывается уникальный набор олигонуклеотидов, каждый из
которых содержит праймерную последовательность.
Далее в пробирки добавляют формамид, чтобы обеспечить расхождение цепей,
и проводят электрофорез в полиакриламидном геле на четырех дорожках (по числу
пробирок). Это позволяет разделить одноцепочечные фрагменты ДНК, даже если они
различаются по длине всего на один нуклеотид. На радиоавтографе обнаруживается
набор полос, отвечающих меченым фрагментам ДНК, сопоставление которых позволяет
прямо «прочитать» нуклеотидную последовательность секвенируемого сегмента ДНК.
Секвенирование ДНК с помощью вектора на основе фага М13. Метод
основывается на применении фага М13 E. coli в качестве вектора. ДНК этого фага
представляет собой одноцепочечную кольцевую молекулу. Когда им инфицируют E. coli, сначала образуется двухцепочечная репликативная
форма фаговой ДНК, а одноцепочечные кольцевые молекулы, которые затем
упаковываются в вирионы, синтезируются на этой двухцепочечной молекуле как на
матрице. Клетки, инфицированные М13, не подвергаются лизису; в них непрерывно
образуются новые одноцепочечные молекулы ДНК М13, которые, проходя через
клеточную мембрану, одеваются белковой оболочкой и выходят в окружающую среду.
ДНК М13 содержит несущественную часть, которую можно заменить нужным фрагментом
ДНК; при этом инфекционность рекомбинантных вирусных частиц сохранится.
М13-система имеет следующие преимущества: выделенная двухцепочечная
репликативная форма может функционировать как плазмида, а одноцепочечная
фаговая ДНК - использоваться в качестве матрицы для секвенирования ДНК. Все это
позволяет использовать фаг М13 как комбинированную систему для клонирования и
секвенирования ДНК.
Принцип метода. Обычно нужный фрагмент ДНК длиной примерно 500 п. н. встраивают
в полилинкер, который является частью клонированного в РФ-ДНК фага М13
модифицированного гена lacZ'
(рис. 6). Рекомбинантной вирусной ДНК трансформируют компетентные клетки E. coli и высевают их на чашки со средой, содержащей субстрат
X-Gal. При его гидролизе β-галактозидазой образуется продукт,
имеющий синюю окраску. На чашках появляются белые (бесцветные) и синие колонии.
Первые отвечают клеткам, инфицированным фагом М13 со вставкой, нарушившей рамку
считывания гена lacZ', вторые -
клеткам, инфицированным фагом М13 с функциональным геном lacZ', не несущим вставки. Из белых
колоний выделяют фаговые частицы, а из них - одноцепочечную ДНК со вставкой.
Для секвенирования последней отжигают выделенную ДНК с праймером, который
гибридизуется с последовательностью вблизи вставки, затем проводят
дидезокси-секвенирование, электрофорез и радиоавтографию и «прочитывают»
нуклеотидную последовательность вставки.
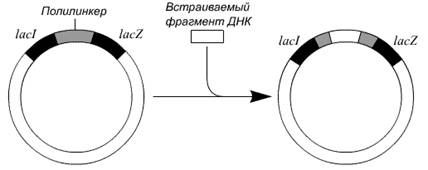
Рис. 6. Вставка фрагмента ДНК в репликативную форму ДНК фага М13
Практическое занятие №5
Тема: Амплификация последовательности ДНК in vitro
Для решения широкого круга задач, связанных с изучением и модификацией
генома, довольно часто возникает необходимость получения множества копий
определенного фрагмента ДНК. Процесс многократного копирования данного
фрагмента называется амплификацией.
Амплификация ДНК методом ПЦР. Ферментативный метод амплификации
фрагментов ДНК, получивший название полимеразной цепной реакции (ПЦР), был
разработан К. Маллисом с сотрудниками в 1985 г.
Процедура состоит из многократного последовательного повторения трех
реакций: денатурации, ренатурации и синтеза (рис. 7).
К целевому образцу двунитевой ДНК добавляют в избыточном количестве два
синтетических олигонуклеотида-праймера, размером около 20 нуклеотидов, каждый
из которых комплементарен одному из 3'-концов антипараллельных цепей целевого
сегмента ДНК.
Препарат подвергают термической денатурации, выдерживая его при
температуре 95º С в течение 1 минуты, затем медленно охлаждают до ~55º
С. При этом в процессе
отжига (ренатурации), происходит гибридизация олигонуклеотидов-праймеров с
комплементарными последовательностями нитей целевой ДНК. После этого вносят
фермент ДНК-полимеразу и дезоксинуклеозидтрифосфаты, служащие «строительным
материалом», что запускает реакцию синтеза комплементарных цепей целевой ДНК.
После завершения синтеза, вновь повторяют денатурацию и ренатурацию, что
приводит к гибридизации праймеров, находящихся в избытке, не только с цепями
исходной ДНК, но и с вновь синтезированными. Внесение в препарат новой порции
ДНК-полимеразы инициирует второй цикл полимеразной реакции. При использовании
термостабильных полимераз (например, Taq, выделенной из термофильных бактерий Thermus aquaticus), повторного внесения фермента в
каждом новом цикле не требуется.
Многократное повторение описанной процедуры позволяет провести 30 и более
циклов ферментативного синтеза. При этом число амплифицируемых сегментов ДНК с
каждым циклом удваивается (увеличивается экспоненциально). Таким образом,
используя ПЦР, можно in vitro обогащать препарат ДНК целевым
фрагментом в миллион и более раз.
Все реакции проводят в пробирках, погруженных в термостат. Смена
температурного режима и его поддержание осуществляется автоматически. Каждый
цикл обычно длится 3-5 мин.

Рис. 7. Схема амплификации ДНК методом ПЦР (показаны первые два цикла)
К недостаткам метода можно отнести то, что при полимеразной реакции
происходят ошибочные включения некомплементарных нуклеотидов в цепь с частотой
1,1 · 10-5 в одном цикле. Синтезированные последовательности ДНК, содержащие
ошибки, в следующих циклах ПЦР амплифицируются экспоненциально. После 30 циклов
частота ошибок в амплифицированной ДНК может достигать 0,25 %.
Преодолеть данную проблему можно добавлением в препарат дополнительного
фермента - полимеразы GB-D, выделенной из Pirococcus sp. GB-D обладает корректирующей
3'-5'-эндонуклеазной активностью и может удалять ошибочно введенные
некомплементарные нуклеотиды из растущей цепи ДНК.
Метод ПЦР находит самое разнообразное использование в молекулярной
биотехнологии. Он используется для секвенирования, для повышения эффективности
клонирования целевых фрагментов геномов, для детекции патогенных
микроорганизмов, для тонкого анализа хромосомной рекомбинации и т.д. С помощью
этого метода удалось клонировать фрагменты митохондриальной ДНК из ископаемых
останков человека возраст которых семь тысяч лет! В генетическом анализе,
позволяющем установить отцовство или выявить преступника, также используется
метод ПЦР.
Практическое занятие №6
Тема: Генетически модифицированные
микроорганизмы и их использование
трансгенный генетический модифицированный
Началом промышленной генетической инженерии принято считать 1980 год
(всего через 8 лет после работы Берга!), когда в США был выдан первый патент на
модифицированный штамм микроорганизма, способного разлагать нефть. Еще через
два года был разрешен для клинического использования полученный из бактерии
первый лекарственный препарат - человеческий инсулин.
Сейчас прикладная промышленная микробиология развивается по нескольким
основным направлениям:
) производство продуктов биосинтеза трансгенных микроорганизмов,
например, антибиотиков, гормонов, ферментов и витаминов;
) использование биомассы микроорганизмов - производство медицинских
вакцин, различных дрожжей, белково-витаминных концентратов и заквасок для
получения кисломолочных продуктов и силосования кормов;
) биотехнологии, основанные на уникальных способностях некоторых бактерий
производить органические кислоты, этанол, углеводы и метан. Сюда же можно
отнести и переработку некоторых отходов с возможностью получения полезных
соединений, в первую очередь, горючих газов.
Трансгенные микроорганизмы в медицине
К самому большому классу лекарств, получаемых путем микробного синтеза,
относятся антибиотики. По разнообразию и показаниям к применению они занимают
первое место среди продукции мировой фармацевтической промышленности. Сегодня
известно более 6000 видов антибиотиков, более 100 из которых находят применение
в медицинской практике, в том числе при лечении таких тяжелых заболеваний, как
туберкулез, менингит, плеврит, пневмония. Отдельные антибиотики применяют при
лечении онкозаболеваний. Объем мирового рынка антибиотиков увеличивается в
последнее время на 10-20% в год и составляет более 23 млрд долларов.
Особое место среди лекарственных средств занимают ферменты. Они имеют
белковую природу, то есть состоят из аминокислот. Это вызывает значительные
трудности для их получения традиционным фармацевтическим путем - химическим синтезом.
Генная инженерия дает возможность обеспечить многих нуждающихся самыми
различными ферментами. Например, при лечении заболеваний пищеварительных
органов применяются протеолитические ферменты. Эти же ферменты используют при
лечении ожоговых поражений и различных ран для удаления некротических тканей.
При лечении патологии обмена веществ применяют также липазы, расщепляющие жиры.
Протеиназы с фибринолитическим действием используют для растворения тромбов, а
антикоагулянты, например плазмин, эффективны при лечении инфаркта миокарда. С
помощью таких препаратов, как стрептокиназа и урокиназа, лечат тромбоз
коронарных сосудов сердца, легких, конечностей. но-инженерных методик.
Важный вклад микробной биотехнологии в медицину состоит в получении
профилактических препаратов, причем этот вид продукции не имеет дублера в
химической промышленности. В первую очередь это производство вакцин против
различных инфекций. Необходимый антиген можно получить с помощью непатогенного
(аттенуированного) микроорганизма, полученного генно-инженерными методами, и
таким образом избежать опасностей, связанных с применением обычных вакцин.
Только в США, в результате массовой вакцинации, за последние 45 лет
заболеваемость полиомиелитом снизилась в 4000 раз. Также быстро снизилась заболеваемость
корью, краснухой, дифтерией после введения соответствующих вакцин в практику.
Антивирусные, антиопухолевые и иммуномодулирующие агенты, такие как
интерфероны и интерлейкины сейчас также синтезируются генетически
модифицированными организмами.
Интерферон - белок, синтезируемый организмом в ответ на вирусную
инфекцию, изучают сейчас как возможное средство лечения рака и СПИДа.
Понадобились бы тысячи литров крови человека, чтобы получить такое количество
интерферона, какое дает всего один литр бактериальной культуры.
Синтез гормонов человека с помощью трансгенных микроорганизмов
Вторым классом лекарственных препаратов, производимых биотехнологическим
путем, являются гормоны. В медицинских целях применяются два основных типа
гормонов, различающихся по молекулярному строению: стероидные и пептидные.
Среди стероидных гормонов можно выделить кортизон и преднизолон, которые широко
применяют при лечении различных аллергических заболеваний, в том числе такого
тяжелого, как бронхиальная астма, а также ревматоидного артрита и других
недугов. Другой обширной группой стероидов являются половые гормоны, такие как
эстроген, широко применяемые для оральной контрацепции и лечения ряда
заболеваний.
Пептидные гормоны сейчас практически целиком производятся путем синтеза с
помощью генетически модифицированных микроорганизмов.
В настоящее время кишечная палочка (E. coli) стала поставщиком таких
важных гормонов как инсулин и соматотропин. Ранее инсулин получали из клеток
поджелудочной железы животных, поэтому стоимость его была очень высока. Для
получения 100 г кристаллического инсулина требуется 800-1000 кг поджелудочной
железы, а одна железа коровы весит 200-250 грамм. Это делало инсулин дорогим и
труднодоступным для широкого круга диабетиков. В 1978 году исследователи из
компании "Генентек" впервые получили инсулин в специально
сконструированном штамме кишечной палочки. Инсулин состоит из двух
полипептидных цепей А и В длиной 20 и 30 аминокислот. При соединении их
дисульфидными связями образуется нативный двухцепочечный инсулин. Было
показано, что он не содержит белков E. coli, эндотоксинов и других примесей, не
дает побочных эффектов, как инсулин животных, а по биологической активности от
него не отличается. Впоследствии в клетках E. coli был осуществлен синтез
проинсулина, для чего на матрице РНК с помощью обратной транскриптазы
синтезировали ее ДНК-копию. После очистки полученного проинсулина его расщепили
и получили нативный инсулин, при этом этапы экстракции и выделения гормона были
сведены к минимуму. Из 1000 литров культуральной жидкости можно получать до 200
граммов гормона, что эквивалентно количеству инсулина, выделяемого из 1600 кг
поджелудочной железы свиньи или коровы.
Соматотропин - гормон роста человека, секретируемый гипофизом. Недостаток
этого гормона приводит к гипофизарной карликовости. Если вводить соматотропин в
дозах 10 мг на кг веса три раза в неделю, то за год ребенок, страдающий от его
недостатка, может подрасти на 6 см. Ранее его получали из трупного материала,
из одного трупа: 4-6 мг соматотропина в пересчете на конечный фармацевтический
препарат. Таким образом, доступные количества гормона были ограничены, кроме
того, гормон, получаемый этим способом, был неоднороден и мог содержать
медленно развивающиеся вирусы. Компания "Genentec" в 1980 году разработала
технологию производства соматотропина с помощью бактерий, который был лишен
перечисленных недостатков. В 1982 году гормон роста человека был получен в
культуре E. coli и животных клеток в институте Пастера во Франции, а с 1984
года начато промышленное производство инсулина и в СССР. При производстве
интерферона используют как E. coli, S. cerevisae (дрожжи), так и культуру
фибробластов или трансформированных лейкоцитов. Аналогичными методами получают
также безопасные и дешевые вакцины.
Практическое занятие №7
Тема: Получение трансгенных растений, устойчивых
к неблагоприятным факторам внешней среды
Создание трансгенных растений позволяет решить целый комплекс проблем,
как агротехнических и продовольственных, так и технологических,
фармакологических и т.д. Сегодня выделяется два основных направления, по
которым развивается генная инженерия растений. Первое направление, получившее
неудачное название «молекулярная селекция» (molecular breeding),
специализируется на решении новыми методами традиционных селекционно-генетических
проблем повышения продуктивности сельскохозяйственных растений и их защиты от
различных биотических и абиотических стрессовых факторов. Второе направление,
названное «метаболической инженерией», специализируется на получении и использовании
трансгенных растений в качестве биореакторов, продуцирующих ценные для
промышленности и медицины органические соединения (подробнее данное направление
будет рассмотрено на восьмом практическом занятии).
Создание гербицидоустойчивых растений
На протяжении всей истории существования земледелия одной из насущных
проблем этой отрасли является засорение посевов культурных растений сорняками.
В современной России потери урожая от сорняков достигает по некоторым культурам
20 %. Для борьбы с ними широко применяются гербициды. И хотя на смену прежним
экологически опасным гербицидам широкого спектра действия, обладающим
токсичностью для млекопитающих и длительно сохраняющимся во внешней среде,
приходят новые, более совершенные и безопасные соединения, однако и они
обладают недостатком - подавляют рост не только сорняков, но и культурных
растений. Такие высокоэффективные гербициды, как, глифосат, атразины интенсивно
изучаются на предмет выявления механизма толерантности к ним некоторых
сорняков. Так, на полях, где широко используют атразин, довольно часто
появляются атразинустойчивые биотипы у многих видов растении.
Изучение механизма устойчивости к гербицидам с целью получения методами
генетической инженерии культурных растений, обладающих этим признаком, включает
следующие этапы: выявление биохимических мишеней действия гербицидов в
растительной клетке: отбор устойчивых к данному гербициду организмов в качестве
источников генов устойчивости: клонирование этих генов: введение их в
культурные растения и изучение их функционирования.
Существуют четыре принципиально различных механизма, которые могут
обеспечивать устойчивость к тем или иным химическим соединениям, включая
гербициды: транспортный, элиминирующий, регуляционный и контактный.
Транспортный механизм устойчивости заключается в невозможности проникновения
гербицида в клетку. При действии элиминирующего механизма устойчивости
вещества, попавшие внутрь клетки, могут разрушаться с помощью индуцируемых
клеточных факторов, чаще всего деградирующих ферментов, а также подвергаться
тому или иному виду модификации, образуя неактивные безвредные для клетки
продукты. При регуляционной резистентности белок или фермент клетки,
инактивирующийся под действием гербицида, начинает усиленно синтезироваться,
ликвидируя таким образом дефицит нужного метаболита в клетке. Контактный
механизм устойчивости обеспечивается изменением структуры мишени (белок или
фермент), взаимодействием с которым связано повреждающее действие гербицида.
Установлено, что признак гербицидоустойчивости является моногенным, то
есть признак детерминируется чаще всего одним-единственным геном. Это очень
облегчает возможность использования технологии рекомбинантной ДНК для передачи
этого признака. Гены, кодирующие те или иные ферменты деструкции и модификации гербицидов,
могут быть с успехом использованы для создания гербицидоустойчивых растении
методами генетической инженерии.
Традиционные методы селекции создания сортов, устойчивых к гербицидам,
очень, длительны и малорезультативны. Наиболее широко применяемый за рубежом
гербицид глифосат (коммерческое название Roundup) подавляет синтез важнейших
ароматических аминокислот, воздействуя на фермент
5-енолпирувилшикимат-З-фосфатсинтазу (ЕПШФ-синтаза). Известные случаи
устойчивости к этому гербициду связаны либо с повышением уровня синтеза этого
фермента (регуляционный механизм), либо с возникновением мутантного фермента,
нечувствительного к глифосфату (контактный механизм). Из устойчивых к
глифосфату растений был выделен ген ЕПШФ-синтазы и поставлен под промотор вируса
мозаики цветной капусты. С помощью Ti-плазмиды эта генетическая конструкция
была введена в клетки петунии. При наличии одной копии гена в регенерированных
из трансформированных клеток растениях синтезировалось фермента в 20 - 40 раз
больше, чем в исходных растениях, но устойчивость к глифосфату увеличилась
только в 10 раз.
К числу наиболее распространенных гербицидов, используемых при обработке
зерновых культур, относится атразин. Он подавляет фотосинтез, связываясь с
одним из белков фотосистемы II и прекращая транспорт электронов. Устойчивость к
гербициду возникает в результате точечных мутаций в этом пластохинон
связывающем белке (замена серина на глицин), вследствие чего он теряет
способность взаимодействовать с гербицидом. В ряде случаев удалось осуществить
перенос гена мутантного белка в чувствительные к атразину растения с помощью
Ti-плазмиды. Интегрированный в хромосому растений ген устойчивости был снабжен
сигнальной последовательностью, которая обеспечивала транспорт синтезируемого
белка в хлоропласты. Химерные растения проявляли значительную устойчивость к
таким концентрациям атразина, которые вызывали гибель контрольных растений с
геном белка дикого типа. Некоторые растения способны инактивировать атразин
путем отщепления остатка хлора ферментом глутатион-S-трансфераза. Этот же
фермент инактивирует и другие родственные гербициды триазинового ряда
(пропазин, симазин и др.).
Существуют растения, естественная устойчивость которых к гербицидам
основана на детоксикации. Так, устойчивость растений к хлорсульфурону может
быть связана с дезактивацией молекулы гербицида путем его гидроксилирования и
последующего гликозилирования введенной гидроксильной группы.
Создание растений, устойчивых к вирусам
Устойчивость растений к тем или иным патогенам чаще всего является
сложным мультигенным признаком.
Одновременная передача нескольких локусов трудна даже методами генной
инженерии, не говоря о классических методах селекции. Более простым является
другой путь. Известно, что у устойчивых растений при атаке патогенов изменяется
метаболизм. Накапливаются такие соединения, как Н2О2, салициловая кислота,
фитоаллексины. Повышенный уровень этих соединений способствует противостоянию
растения в борьбе с патогенами. Вот один из примеров, доказывающий роль
салициловой кислоты в иммунном ответе растений. Трансгенные растения табака,
которые содержат бактериальный ген, контролирующий синтез салицилат гидролазы
(этот фермент разрушает салициловую кислоту), были неспособны к иммунному
ответу. Поэтому изменение генно-инженерным путем уровня салициловой кислоты или
выработки в растениях в ответ на патоген Н2О2 может быть перспективным для
создания устойчивых трансгенных растений.
В фитовирусологии широко известен феномен индуцированной перекрестной
устойчивости растений к вирусным инфекциям. Сущность этого явления состоит в
том, что заражение растения одним штаммом вируса предотвращает последующую
инфекцию этих растений другим вирусным штаммом. Молекулярный механизм
подавления вирусной инфекции пока неясен. Показано, что для иммунизации
растений достаточно введения отдельных вирусных генов, например генов капсидных
белков. Так, ген белка оболочки вируса табачной мозаики перенесли в клетки
табака и получили трансгенные растения, у которых 0,1% всех белков листьев был
представлен вирусным белком. Значительная часть этих растений при инфицировании
вирусом не проявляла никаких симптомов заболевания. Возможно, что
синтезирующийся в клетках белок оболочки вируса мешает вирусной РНК нормально
функционировать и формировать полноценные вирусные частицы. Установлено, что
экспрессия капсидного белка вируса табачной мозаики, вируса мозаики люцерны,
вируса огуречной мозаики, Х-вируса картофеля в соответствующих трансгенных
растениях (табак, томаты, картофель, огурцы, перцы) обеспечивает высокий уровень
их защиты от последующей вирусной инфекции. Причем у трансформированных
растений не отмечалось снижения фертильности, нежелательного изменения ростовых
и физиологических характеристик исходных экземпляров и их потомства. Полагают,
что индуцированная устойчивость растений к вирусам обусловлена особым
антивирусным белком, очень похожим на интерферон животных. Представляется
возможным методом генетической инженерии усилить экспрессию гена, кодирующего
этот белок, путем его амплификации или подстановки под более сильный промотор.
Создание растений, устойчивых к насекомым-вредителям
Создание таких растений является одной из важнейших для сельского
хозяйства. Даже такая развитая страна, как США, несмотря на огромное количество
вносимых на поля пестицидов (более 400 тыс. т в год), теряет около трети урожая
сельскохозяйственных культур в результате деятельности насекомых-вредителей.
Так, ущерб от поражения посевов кукурузы кукурузным мотыльком (Ostrinia nubialis) в этой стране составляет около
миллиарда долларов в год.
Кроме того, тысячи тонн инсектицидов, расходуемых ежегодно, наносят ущерб
окружающей среде. Известно, что лишь 5 % внесенных инсектицидов срабатывают по
назначению, остальные 95 % попадают в окружающую среду, уничтожая многие виды
насекомых, среди которых немало полезных. Решение этой проблемы легло на плечи
молекулярных биологов.
Учеными было обнаружено, что почвенная бактерия Bacillus thuringiensis продуцируют целую группу так
называемых Cry-белков (другое название - Bt-токсины), являющихся природными
инсектицидами, селективно (избирательно) действующими в отношении разных групп
насекомых.
Попадая в кишечный тракт насекомого, Bt-токсин соединяется со специфичными участками клеток,
образующих кишечный эпителий и создают ионоселективные каналы в клеточных
мембранах. В результате клетки разбухают от поступающих в них чрезмерных
количеств воды и гибнут.
Важными свойствами Bt-токсинов
являются их нетоксичность для теплокровных животных и термонестабильность
(разрушаются при тепловой обработке). Таким образом, исключена возможность
отравления данными токсинами человека и домашних животных.
Для создания растений с инсектицидными свойствами в их геном был
пересажена кодирующая область гена Cry-белка, поставленная под контроль промотора гена, эффективно экспрессирующегося
в клетках растений. Таким образом, инсектицид накапливается в достаточных
количествах непосредственно в тканях растений и влияет только на тех насекомых,
которые эти растения поедают.
Линии растений, получившие устойчивость к вредителям подобным образом
называются Bt-культурами, или Bt-растениями. Первые Bt-культуры были созданы в 90-х годах
прошлого века, и с тех пор их число увеличилось до нескольких десятков. В их
числе линии картофеля, устойчивые к поеданию колорадским жуком, линии кукурузы,
устойчивые к поеданию кукурузным мотыльком, линии хлопка, устойчивые к
различным вредителям. В Китае получено более 50 Bt-культур, в том числе рис, пшеница, сорго, кочанная капуста,
перец, яблоня, киви, цитрусовые и другие.
Вместе с тем, появляется все больше свидетельств того, что использование
Bt-растений может иметь долгосрочный негативный эффект, экономический ущерб
которого пока трудно оценить. При культивировании Bt-растений наблюдается
накопление Bt-токсинов в почве в результате действия многих факторов: выделений
корней, отложения пыльцы, разложения растительных остатков. Это приводит, в
частности, к снижению биологической активности почв, занятых генетически
модифицированными растениями.
Практическое занятие №8
Тема: Получение трансгенных растений с
улучшенными пищевыми свойствами
Улучшение качества запасных белков
Для человека и млекопитающих необходимым условием нормальной
жизнедеятельности является наличие в рационе восьми незаменимых аминокислот.
Однако ни один из широко используемых в пищу белков семян не содержит
сбалансированного набора всех этих аминокислот. Так, белки семян злаков
содержат крайне мало лизина и триптофана, а запасные белки бобовых дефицитны по
серосодержащим аминокислотам - метионину и цистеину. Введение в эти белки дополнительных
количеств дефицитных аминокислот могло бы ликвидировать аминокислотный
дисбаланс.
Методами традиционной селекции удалось существенно повысить содержание
лизина в запасных белках злаковых. Во всех этих случаях часть проламинов
(спирторастворимые запасные белки злаковых) заменялась другими белками,
содержащими много лизина. Однако у таких растении уменьшались размеры зерна и
снижалась урожайность. По-видимому, проламины необходимы для формирования
нормального зерна, и их замена другими белками отрицательно влияет на
урожайность. Учитывая это обстоятельство, для улучшения качества запасного
белка зерновых нужен такой белок, который не только отличался бы высоким
содержанием лизина и треонина, но и мог полноценно заменить определенную часть
проламинов при формировании зерна.
Растения могут производить и белки животного происхождения. Так,
встраивание в геном растений Arabidopsis thaliana и Brassica napus химерного
гена, состоящего из части гена запасного 25-белка арабидопсиса и кодирующей
части для нейропептида - энкефалина, приводило к синтезу химерного белка до 200
нг на 1 г семени. Два структурных белковых домена были связаны
последовательностью, узнаваемой трипсином, что давало возможность в дальнейшем
легко изолировать чистый энкефалин.
В другом эксперименте удалось после скрещивания трансгенных растений, в
одном из которых был встроен ген гамма-субъединицы, а во втором - ген
каппа-субъединицы иммуноглобулина, получить у потомства экспрессию обеих цепей.
В результате растение формировало антитела, составляющие до 1,3% суммарного
белка листьев. Также было показано, что в растениях табака могут собираться
полностью функциональные секреторные моноклональные иммуноглобулины.
Секреторные иммуноглобулины обычно выделяются в ротовую полость и желудок человека
и животных и служат первым барьером на пути кишечных инфекций. В упомянутой
выше работе получили продукцию в растениях моноклональных антител, которые были
специфичны для Streptococcus mutans - бактерий, вызывающих зубной кариес.
Предполагается, что на основе таких моноклональных антител, продуцируемых
трансгенными растениями, удастся создать действительно антикариесную зубную
пасту. Из других белков животного происхождения, которые представляют интерес
для медицины, показана продукция в растениях человеческого β-интерферона.
Разработаны также подходы, позволяющие получать бактериальные антигены в
растениях и использовать их в качестве вакцин. Получен картофель,
экспрессирующий олигомеры нетоксичной субъединицы β-токсина холеры. Эти трансгенные
растения могут быть использованы для получения дешевой вакцины от холеры.
Жиры
Важнейшим сырьем для получения разного рода химических веществ являются
жирные кислоты - основной компонент растительного масла. По своей структуре это
углеродные цепи, которые обладают различными физико-химическими свойствами в
зависимости от своей длины и степени насыщения углеродных связей. В 1995 году
была закончена экспериментальная проверка и получено разрешение от федеральных
властей США на выращивание и коммерческое использование трансгенных растений
рапса с измененным составом растительного масла, включающего вместе с обычными
16- и 18-членными жирными кислотами также и до 45% 12-членной жирной кислоты -
лаурата. Это вещество широко используется для производства стиральных порошков,
шампуней, косметики.
Экспериментальная работа заключалась в том, что был клонирован ген
специфической тиоэстеразы из растения Umbellularia californica, где содержание лаурата в жире
семян достигало 70%. Структурная часть гена этого фермента под контролем
промотора-терминатора гена белка, специфического для ранней стадии
семяобразования, была встроена в геном рапса и арабидопсиса, что и привело к
увеличению содержания лаурата в масле этих растений.
Из других проектов, связанных с изменением состава жирных кислот, можно
упомянуть работы, ставящие целью повышение или снижение содержания ненасыщенных
жирных кислот в растительном масле. Интересными представляются эксперименты с
петрозелиновой кислотой - изомером олеиновой кислоты, где двойная связь
находится за шестым углеродным членом. Эта жирная кислота входит в состав масла
кориандра и определяет его более высокую температуру плавления (33°С), в то
время как при наличии олеиновой кислоты температура плавления составляет только
12°С. Предполагается, что после переноса генов, определяющих синтез
петрозелиновой кислоты, в растения - продуценты растительного масла удастся
производить диетический маргарин, содержащий ненасыщенную жирную кислоту. Кроме
того, из петрозелиновой кислоты очень легко получать лаурат путем окисления
озоном. Дальнейшее изучение специфики биохимического синтеза жирных кислот,
по-видимому, приведет к возможности управлять этим синтезом с целью получения
жирных кислот различной длины и различной степени насыщения, что позволит
значительно изменить производство детергентов, косметики, кондитерских изделий,
затвердителей, смазочных материалов, лекарств, полимеров, дизельного топлива и
многого другого, что связано с использованием углеводородного сырья.
Полисахариды
Проводится работа по созданию трансгенных растений картофеля и других
крахмалнакапливающих культур, в которых это вещество будет находиться в
основном в виде амилопектина, то есть разветвленной форме крахмала, или же в
основном только в виде амилозы, то есть линейных форм крахмала. Раствор
амилопектина в воде более жидкий и прозрачный, чем у амилозы, которая при
взаимодействии с водой образует ригидный гель. Так, например, крахмал,
состоящий в основном из амилопектина, по-видимому, будет иметь спрос на рынке
производителей различных питательных смесей, где сейчас в качестве наполнителя
используется модифицированный крахмал. Генетической модификации могут
подвергаться также геномы пластид и митохондрий. Такие системы позволяют
значительно увеличить содержание продукта в трансгенном материале.
Трансгенные растения в фармакологии
В настоящее время не вызывает сомнений, что многие продукты, потребляемые
с фруктами, овощами и злаками, могут проявлять фармакологические эффекты и
блокировать развитие сердечно-сосудистых, раковых и других заболеваний. К таким
природным соединениям растений относятся сульфорафан из брокколи, резвератрол
из винограда, генистеин из сои, эпигаллокатехин-3-галлат из зеленого чая.
Ранее было практически невозможно с помощью селекции создать растения с
повышенным содержанием витаминов. Однако с развитием биохимии растений стало
более ясным, какие метаболические пути являются критическими для биосинтеза
витаминов. Например, для синтеза β-каротина (провитамина А) в растениях
необходима фитоен-синтетаза. Этот фермент участвует в конденсации двух молекул
геранил-геранил дифосфата. Ген фитоен-синтетазы из нарцисса введен в рис и
экспрессирован в эндосперме риса. Таким образом, получен «золотой рис», который
может помочь 2 млрд. человек, страдающих от дефицита витамина А, для которых
рис - основная пища. Получены трансгенные растения рапса (канолы),
экспрессирующие ген фитоен-синтетазы, в семенах которых значительно повысилось
содержание каротиноидов. Выявлена экспрессия этого же фермента в клубнях
картофеля, что приводило к повышенному синтезу каротиноидов и лютеина.
Недавно получены трансгенные растения земляники с повышенным синтезом
L-аскорбиновой кислоты. Эти растения отличались суперэкспрессией гена
НАДФ-зависимой Д-галактуронат-редуктазы (GalUR). Созданы растения сои с повышенным
в пять раз содержанием витамина Е в семенах. Получены растения арабидопсиса с
повышенным содержанием фолатов за счет экспрессии в них бактериального гена
ГТФ-циклогидролазы-1 (EcGCH).
Практическое занятие №9
Тема: Конструирование трансгенных растений -
продуцентов целевых белков
Конструирование трансгенных растений - продуцентов целевых белков
Растения являются удобной, безопасной и экономически выгодной
альтернативой для продукции различных белков, вакцин и антител по сравнению с
системами экспрессии на основе микроорганизмов, культур животных клеток или
трансгенных животных. За последние 20 лет множество ценных белков эффективно
экпрессировано в растениях. Это белки человеческой сыворотки, регуляторы роста,
антитела, вакцины, промышленные ферменты, биополимеры и реагенты для
молекулярной биологии. Растительные системы имеют перспективы успешного
использования для производства рекомбинантных белков в промышленном масштабе.
Рекомбинантные белки, экспрессируемые в растениях
Первым фармацевтически значимым белком, экспрессированным в растениях
табака и подсолнечника в 1986 г., явился человеческий гормон роста. С тех пор
множество других ценных белков были синтезированы в самых различных растениях
(табл. 1).
Среди разнообразия рекомбинантных белков, продуцируемых растениями есть
белки, используемые в молекулярно-биологических исследованиях (авидин),
молочные белки, используемые в качестве пищевых добавок (казеин) и
белки-полимеры для медицинских и промышленных целей (коллаген и эластин).
Ценные биологически активные пептиды можно получать, встраивая их в состав
запасных белков семян. Так, последовательность ДНК, кодирующая пентапептидный
нейрогормон животных лейэнкефалин была встроена в ген 2S альбумина запасного
белка семян Arabidopsis thaliana. Экспрессия этого гена в трансформированных
растениях рапса и арабидопсиса позволила получить их семена с высоким
содержанием рекомбинантного белка. Целевой пептид легко выделялся из
рекомбинантного белка с помощью специфического протеолитического расщепления.
Примеры фармацевтически ценных белков, синтезируемых трансгенными
растениями, приведены в табл. 1. Многие из этих белков представляют собой
продукты крови человека, такие как человеческий сывороточный альбумин (годовое
производство более 500 тонн), цитокины и другие сигнальные молекулы.
Таблица 1
Некоторые белки, синтезируемые трансгенными растениями
|
Белок
|
Область применения
|
Растение
|
|
Соматотропин
|
Гормон роста
|
Табак, подсолнечник
|
|
Энкефалины
|
Передозировка наркотических веществ
|
Табак
|
|
Человеческий сывороточный альбумин
|
Цирроз печени, ожоги, хирургия
|
Табак, картофель
|
|
Эпидермальный фактор роста
|
Стимуляция роста клеток кожи и роговицы
|
Табак
|
|
α-Трихосантин
|
Терапия СПИДа
|
Nicotiana bethamiana
|
|
α-Интерферон
|
Гепатиты В и С, опоясывающий лишай, вирусные бородавки
|
Рис, турнепс, картофель
|
|
β-Интерферон
|
То же
|
Табак
|
|
γ-Интерферон
|
Хронический грануломатоз, лейшманиоз, лепра
|
Табак
|
|
Эритропоэтин
|
Анемия
|
Табак
|
|
Гирудин
|
Ингибитор тромбина
|
Рапс
|
|
Глюкоцереброзидаза
|
Болезнь Гоше
|
Табак
|
|
α,β-Гемоглобин
|
Заменитель крови
|
Табак
|
|
β-Казеин
|
Пищевая добавка
|
Картофель
|
|
Гранулоцит-макрофаг-колониестимулирующий фактор
|
Антираковая терапия
|
Табак
|
|
Коллаген
|
Заживление ран
|
Табак
|
|
Лактоферрин
|
Бактериальные инфекции
|
Картофель
|
|
TNF-α
|
Фактор некроза опухолей
|
Картофель
|
|
Трипсин
|
Расщепление белков
|
Кукуруза
|
|
Лизоцим
|
Инфекционные заболевания
|
Рис
|
|
Эластин
|
Восстановление повреждённых сухожилий, стенок сосудов
|
Табак, картофель
|
До недавнего времени большинство белков экспрессировали в трансгенном
табаке и экстрагировали из листьев. В основном, эти белки синтезировались на
низком уровне, обычно менее 0.1% от растворимого белка клеток. В последние годы
стали использовать другие системы трансформации и экспрессии, позволяющие
нарабатывать белки в больших количествах. Более высокие уровни экспрессии
получены в различных растениях с помощью обычной агробактериальной
трансформации. Так гирудин, слитый с олеозином (белком из масляных телец), в
семенах трансгенной канолы экспрессировался на уровне 0,3%. Трансформация
хлоропластов геном человеческого гормона роста давала уровень экспрессии до 7%,
а геном человеческого сывороточного альбумина - более 11% от растворимого белка
клеток.
Некоторые белки, синтезируемые трансгенными растениями, уже производятся
некоторыми западными компаниями или будут выпущены на рынок в ближайшие 5 лет.
Например, авидин, трипсин и β-глюкуронидаза, выделяемые из
трансгенной кукурузы, производятся фирмой Sigma-Aldrich (США). В скором времени
должны быть подготовлены к промышленному производству коллаген, липаза,
лактоферрин, лизоцим, синтезируемые трансгенными растениями. Следует отметить
перспективность получения модифицированных растений, экспрессирующих новые
формы антимикробных пептидов.
Экспрессия рекомбинантных антител в трансгенных растениях
В 1989 г. Хиаттом с соавторами впервые достигнута экспрессия антител в
растениях табака. Таким образом, было показано, что растения могут собирать
сложные функциональные гликопротеины, состоящие из нескольких субъединиц.
Типичные антитела представляют собой тетрамеры из двух идентичных тяжелых и
двух легких цепей, однако есть более сложные формы, например секреторные
антитела, представляющие собой димеры обычных антител и включающие две
дополнительные полипептидные цепи. Если у животных для сборки таких антител
нужны два типа клеток, то у растений эта сборка антител проходит в одной
клетке. Для этого получено четыре различных типа трансгенных растений,
синтезирующих отдельные цепи иммуноглобулинов. Скрещивание между этими
трансформантами дало потомство, способное к сборке антител в одной клетке.
Такие антитела обладали иммуногенностью, они накапливались в клетках в
количестве до 1,3% от суммарного растворимого белка.
Кроме полноразмерных иммуноглобулинов в растениях успешно синтезированы
разные их производные: Fab-фрагменты (fragment antigen binding), одноцепочечные
вариабельные фрагменты (single-chain variable fragment, scFv), биспецифичные
вариабельные фрагменты. Данные о синтезе некоторых антител трансгенными
растениями приведены в табл. 2.
Таблица 2
Антитела, синтезируемые трансгенными растениями
|
Применение
|
Антиген
|
Тип антител
|
Растение
|
Уровень экспрессии
|
|
Онкология (рак кишечника, легких, опухоли эпителиального
происхождения
|
Раково-эмбриональный антиген человека
|
Мышино-человеческие химерные антитела IgG1 (cT84.66), scFv
T84.66, T84.66/G68
|
табак
|
1-12 мг/кг СВ*
|
|
|
scFvT84.66
|
пшеница
|
50-900 нг/г СВ
|
|
|
|
рис
|
1.5-29 мкг/г СВ
|
|
Нейтрализация вируса бешенства
|
Белок вируса бешенства
|
Моноклональные антитела mAb SO57
|
табак
|
3 мкг/г СВ 0.07% РБ
|
|
ИФА-диагностика
|
Антитела против человеческого IgG
|
C5-1 IgG
|
люцерна
|
0.13-1.0% РБ
|
|
Предотвращение зубного кариеса
|
Поверхностный антиген стрептококка SAI/II
|
Guy’s 13 IgG IgA/G sIgA/G
|
табак
|
200-500 мкг/г СВ 5-8% РБ
|
|
Терапия рака толстой кишки
|
Поверхностный антиген
|
CO-17 A IgG
|
Nicotiana benthamiana
|
Нет данных
|
|
Лечение герпеса типа 2
|
Белок вируса герпеса HSV-2
|
IgG, IgA, DigA или sIgA IgG1 Fab и F(ab′)2
|
рис, соя
|
Нет данных
|
|
Иммуноаффинная очистка рекомбинантного HBsAg
|
Поверхностный антиген вируса гепатита В (HBsAg)
|
scFv
|
табак
|
0.031%-0.22% РБ
|
*(РБ - растворимый белок; СВ - сырой вес)
Антитела, полученные в растениях, могут быть одними из первых
фармакологических белков, нарабатываемых в промышленных масштабах. Во многих
исследованиях антитела получают в семенах злаковых и бобовых растений, что дает
преимущество при их долговременном хранении при обычной температуре без потери
активности. В семенах ячменя содержание диагностических антител достигало 150
мг/г веса семян. Из многих бобовых только горох и соя используются в настоящее
время в качестве продуцентов рекомбинантных белков. Хотя соя дает сравнительно
небольшой урожай по сравнению с кукурузой и рисом, содержание белка в семенах
сои очень высокое - свыше 40%. Описан синтез человеческих антител к вирусу
генитального герпеса в листьях и семенах сои. Горох дает такой же урожай, как и
соя и содержание белка в его семенах такое же, однако цена его выращивания на
50% выше. В горохе были экспрессированы одноцепочечные антитела. Одни из таких
антител против ракового антигена синтезировались на низком уровне под контролем
семяспецифичного легуминового А-промотора. Другие антитела экспрессировались
под семенным промотором USP и их синтез достигал 2% от общего белка семян.
Семяспецифичный промотор фасоли был использован для экспрессии одноцепочечных
антител в Arabidopsis thaliana. По сравнению с промотором 35S РНК вируса
мозаики цветной капусты (CaMV 35S), экспрессия под контролем которого составила
до 1% от растворимого белка, промотор фасоли arc5-I дал выход антител до 36% от
растворимого белка в семенах арабидопсиса, причем антитела сохраняли
антиген-связывающую активность и аффинность.
Кроме того, антитела в растениях были получены методом агроинфильтрации,
а также с использованием векторов на основе вирусов. Преимущества этих двух
систем в том, что можно получить миллиграммы белка за несколько дней вместо
нескольких месяцев, которые требуются для получения трансгенных либо
транспластомных линий растений.
Практическое занятие №10
Тема: Создание и применение трансгенных животных
На протяжении тысячелетий человек создавал новые породы животных,
совершенствуя методы традиционной селекции. Для получения улучшенных
генетических линий подобным образом требуется проведение множества раундов
скрещиваний и отбора, каждый раз используя в качестве производителей животных
наилучшими характеристиками. В результате подобных манипуляций со временем
можно получить более или менее чистые линии высокопродуктивных пород животных.
Данная стратегия считается весьма успешной, однако она требует больших временны́х и материальных затрат. Кроме того,
после того, как улучшенная генетическая линия получена, вводить новые признаки
методом скрещиваний и отбора становится затруднительно, поскольку могут быть
утеряны ранее приобретенные полезные признаки, а также приобретены «вредные»
гены, ухудшающие породу. Для преодоления этих затруднений необходима абсолютно
новая стратегия, каковая и была разработана в рамках генной инженерии.
Идея генетического изменения животных путём введения в их геном нужной
человеку генетической информации была впервые реализована в 80-х годах ХХ
столетия. С тех пор животные, чей геном был трансформирован, называются
трансгенными, а сам процесс их получения называется трансгенной технологией или
трансгенозом.
В общих чертах новые генетически трансформированные линии (породы)
животных получают по следующей схеме, разработанной на мышах:
) клонированный ген вводят в ядро оплодотворённой яйцеклетки;
2) трансформированные оплодотворённые яйцеклетки имплантируют в
реципиентную женскую особь (успешное развитие эмбриона млекопитающих в иных
условиях невозможно);
) отбирают потомков, родившихся из имплантированных яйцеклеток,
которые содержат клонированный ген во всех клетках;
) скрещивают между собой трансгенных животных и получают новую
генетическую линию.
Трансгенные технологии разрабатывались и совершенствовались на
лабораторных мышах. Трансгенные мыши сыграли свою роль в исследовании
возможности синтеза лекарственных веществ, а также в моделировании различных
генетических болезней человека, что необходимо при выработке стратегий борьбы с
этими заболеваниями.
Так, трансгенные мыши использовались при изучении секреции белка CFTR, нарушения в котором приводят к
возникновению муковисцидоза. Муковисцидоз - это распространённая генетическая
болезнь, поражающая в странах Европы одного из 2500 новорожденных. Болезнь
возникает вследствие мутации в гене CF, кодирующем белок CFTR,
который в норме служит каналом для ионов хлора, проходящих через клеточную
мембрану. В результате блокирования этого потока в некоторых органах, особенно
в лёгких и поджелудочной железе, начинает скапливаться слизь, которая
становится источником тяжёлой бактериальной инфекции. Загустевшая слизь
забивает протоки, нарушается нормальная работа органов и симптомы муковисцидоза
усиливаются. Продолжительность жизни больных муковисцидозом в настоящее время
составляет 25-30 лет. Для изучения действия белка CFTR необходимо получить его в достаточном количестве. Для
этого были получены трансгенные линии мышей, несущих ген CF под контролем регуляторных
последовательностей гена β-казеина - одного из белков молока. В результате, в
молоке трансгенных мышей содержался белок CFTR в форме, позволяющей его экстракцию.
Кроме того, были разработаны «мышиные» модели таких генетических
заболеваний человека, как болезнь Альцгеймера, артрит, мышечная дистрофия,
образование опухолей, гипертония, дисфункция эндокринной системы и многие
другие.
Трансгенный крупный рогатый скот. Молочные железы крупного рогатого скота
являются удобным «биореактором» для производства многих необходимых человеку
веществ, прежде всего, белковой природы. Коровы-рекордсменки дают в год до 10
000 л молока с содержанием белка до 35 г/л. Таким образом, теоретически, стадо
из 20 трансгенных коров в год может выдать столько белка С, используемого для
предотвращения тромбообразования, что покроет всю потребность человечества в
этом препарате. Одной трансгенной коровы достаточно для получения требуемого
ежегодно количества фактора IX
(фактора Кристмаса), который вводят больным гемофилией для повышения
свертываемости крови.
Для создания трансгенных коров используется модифицированная схема
трансгеноза мышей методом микроинъекций ДНК. Процедура включает следующие
этапы:
) Сбор ооцитов (яйцеклеток) коров, забитых на скотобойне.
2) Созревание ооцитов in vitro.
) Оплодотворение бычьей спермой in vitro.
) Центрифугирование оплодотворённых ооцитов для концентрирования
желтка, который в нормальных яйцеклетках мешает визуализации мужского
пронуклеуса с помощью светового микроскопа.
) Микроинъекция ДНК в мужской пронуклеус.
) Развитие эмбрионов in vitro.
) Имплантация одного эмбриона реципиентной самке во время течки.
Описанный выше метод, как показала практика, результативен, однако
эффективность его весьма низка. Так, из 2470 оплодотворенных трансгенных
яйцеклеток удалось получить двух трансгенных телят. Работа по
усовершенствованию техники трансгеноза ведётся.
Одна из целей трансгеноза крупного рогатого скота - изменение содержания
в молоке различных компонентов. Так, количество сыра, получаемого из молока,
прямо пропорционально содержанию в нём κ-казеина. Увеличение количества этого
белка в молоке возможно при помощи гиперэкспрессии трансгена этого белка. Ещё
один пример: если обеспечить экспрессию гена лактазы в клетках молочной железы,
то можно получить молоко, не содержащее лактозы. Такое молоко незаменимо для
людей, не переносящих лактозу - после употребления молока или молочных
продуктов у них возникает серьёзное желудочное расстройство.
Весьма перспективно создание домашних животных с наследственной устойчивостью
к бактериальным и вирусным инфекциям и паразитарным инвазиям. Наиболее
обнадёживающими в настоящее время являются предварительные результаты,
полученные при введении мышам, кроликам и свиньям генов, кодирующих
моноклональные антитела. Идея этого подхода заключантся в том, чтобы снабдить
трансгенное животное наследуемым механизмом защиты, позволяющим обойтись без
иммунизации при помощи прививок.
Практическое занятие №11
Тема: Генотерапия
Лечение заболеваний с помощью генов получило название генотерапии. Сейчас
в мире насчитывается порядка 400 проектов, посвященных лечению с помощью
генотеропии. Разработке программы генной терапии предшествуют тщательный анализ
тканеспецифической экспрессии соответствующего гена, идентификация первичного
биохимического дефекта, исследование структуры, функции и внутриклеточного
распределения его белкового продукта, а также биохимический анализ
патологического процесса. Все эти данные учитываются при составлении
соответствующего медицинского протокола.
Апробацию процедуры генокоррекции наследственного заболевания проводят на
первичных культурах клеток больного, в которых в норме функционально активен
данный ген. На этих клеточных моделях оценивают эффективность выбранной системы
переноса экзогенной ДНК, определяют экспрессию вводимой генетической
конструкции, анализируют ее взаимодействие с геномом клетки, отрабатывают
способы коррекции на биохимическом уровне. Используя культуры клеток, можно
разработать систему адресной доставки рекомбинантных ДНК, однако проверка надежности
работы этой системы может быть осуществлена только на уровне целого организма.
Поэтому такое внимание в программах по генной терапии уделяется экспериментам
in vivo на естественных или искусственно полученных моделях соответствующих
наследственных болезней у животных.
Успешная коррекция генетических дефектов у таких животных и отсутствие
нежелательных побочных эффектов генной терапии являются важнейшей предпосылкой
для разрешения клинических испытаний. Таким образом, стандартная схема
генокоррекции наследственного дефекта включает серию последовательных этапов.
Она начинается созданием полноценно работающей (экспрессирующейся) генетической
конструкции, содержащей смысловую (кодирующую белок) и регуляторную части гена.
На следующем этапе решается проблема вектора, обеспечивающего эффективную, а по
возможности и адресную доставку гена в клетки-мишени. Затем проводится
трансфекция (перенос полученной конструкции) в клетки-мишени, оценивается
эффективность трансфекции, степень коррегируемости первичного биохимического
дефекта в условиях клеточных культур (in vitro) и, что особенно важно, in vivo
на животных - биологических моделях. Только после этого можно приступать к
программе клинических испытаний.
Существует два типа генотерапии: заместительная и корректирующая.
Заместительная генотерапия заключается во вводе в клетку неповрежденного
гена. Внесенная копия заменит по функциям сохранившийся в геноме больного
дефектный ген. Все проводимые сегодня клинические испытания используют внесение
в клетку дополнительных количеств ДНК.
При корректирующей терапии предполагается замена дефектного гена
нормальным в результате рекомбинации. Пока этот метод на стадии лабораторных
испытаний, так как эффективность его еще очень низка.
В зависимости от способа введения экзогенных ДНК в геном пациента генная
терапия может проводиться либо в культуре клеток (ex vivo), либо
непосредственно в организме (in vivo). Клеточная генная терапия или терапия ex
vivo предполагает выделение и культивирование специфических типов клеток пациента,
введение в них чужеродных генов, отбор трансфецированных клеток и реинфузию их
тому же пациенту.
Примером может служить лечение комбинированного иммунодефииицита.
Комбинированный иммунодефицит может быть результатом дефекта гена
аденозиндезаминазы. Впервые попытка лечения такого больного методами
генотерапии была предпринята в США в 1990 г. У больного ребенка извлекли
Т-лимфоциты, трансформировали ретровирусным вектором, введя нормальный ген
аденозиндезаминазы и вернули клетки в организм. Введение приходится повторять.
Более эффективна аналогичная трансформация стволовых клеток костного мозга.
Генная терапия in vivo основана на прямом введении клонированных и
определенным образом упакованных последовательностей ДНК в специфические ткани
больного. В настоящее время не существует общедоступного метода культивирования
клеток легких, поэтому при легочных заболеваниях единственный способ доставить
чужеродный ген - это ввести его прямо в организм. Муковисцидоз - весьма
распространенное среди людей белой расы тяжелое наследственное заболевание
легких, которое поражает, например, в семьях из Центральной Европы одного
новорожденного из 2500 и для которого установлен дефектный ген, кодирующий
белок-регулятор трансмембранной проводимости. Основное проявление дефектного
гена - пневмония. Поражаются все эпителиальные клетки. Основная проблема - как
доставить ген в клетки, покрытые слизью, которая препятствует трансформации.
Неповрежденную копию "гена заболевания", включенную в аденовирусный
вектор или липосому, вводят в форме аэрозоля в дыхательные пути больного.
Для коррекции нарушения при прогрессирующей мышечной дистрофии Дюшенна
(заболевании мальчиков, связанном с дефектами Х-хромосомы) нормальный ген,
кодирующий белок дистрофии, пытались прямо вкалывать в мышечные волокна,
используя либо "голую" ДНК, либо аденовирусный вектор. Другие
исследователи трансплантировали больному миобласты после генетической
коррекции. Ранее неподвижный ребенок приобретал способность двигаться! К
сожалению, во всех этих опытах удается получить только временный
терапевтический эффект, и процедура введения гена должна неоднократно
повторяться.
Список наследственных заболеваний, которые пытаются или планируют лечить
генами, велик. Это и ревматоидный артрит, и фенилкетонурия, и заболевания, связанные
с недостатком гормонов (инсулина, эритропоэтина, гормона роста). В случае
хронической анемии, связанной с дефицитом эритропоэтина, на основании опытов на
животных предлагается принципиально новый подход к лечению. Так как каждая из
наших клеток содержит один и тот же геном, можно заставить фибробласты кожи,
которые в норме не производят эритропоэтина, синтезировать этот гормон. Для
этого нужно ввести в геном новую контролирующую область и тем самым снять
запрет со считывания (экспрессии) гена эритропоэтина, присутствующего, но
"молчащего" в фибробластах.
Практически в любой области медицины либо начаты клинические испытания
лечения наследственных заболеваний с помощью генотерапии, либо в опытах на
животных разрабатываются подходы к такому лечению. По мере усовершенствования
методов доставки генов и контроля их экспрессии список заболеваний, к которым
можно применять генотерапию, будет безусловно расширяться.
Генотерапия применима не только к наследственным заболеваниям. Предстоит
решить проблему лечения генами "чумы XX века" - синдрома
приобретенного иммунодефицита (СПИД), возникающего при заражении вирусом
иммунодефицита человека (ВИЧ). ВИЧ представляет собой ретровирус, поражающий
Т-лимфоциты и макрофаги. Болезнь удалось бы победить, если бы были найдены
новые гены, введение которых в зараженные ВИЧ лимфоциты останавливало бы
дальнейшее размножение вируса. Предложено множество хитроумных способов борьбы
со СПИДом с помощью привнесенных генов. Все они основаны на новейших данных о
строении и функционировании генома ретровируса. Например, вводя прямо в мышцы
больного ретровирусные векторы, несущие отдельные гены ВИЧ, ученые рассчитывали
на то, что гены ВИЧ после внедрения в ДНК хромосом хозяина смогут дать
информацию для синтеза вирусных белков и произойдет "противоСПИДная"
иммунизация больного этими белками. Однако еще не получено ощутимых
результатов, которые сулили бы успех в борьбе с вирусом дикого типа, коварство
которого заключается в его изменчивости.
Огромные перспективы открывает использование генотерапии для лечения
онкологических заболеваний. Многолетние усилия ученых привели к пониманию того,
что рак - это генетическое заболевание и его развитие происходит многостадийно,
в результате серии генетических нарушений, накапливающихся в клетке. Следовательно,
каждый из таких отдельных генетических эффектов может стать точкой приложения
генотерапевтического подхода.
КРАТКИЙ СЛОВАРЬ ТЕРМИНОВ
Амплификация ДНК (лат. amplificatio - усиление, увеличение) - увеличение
числа копий молекул ДНК, либо увеличение числа копий гена в геноме организма. В
генной инженерии часто применяется амплификация молекул ДНК методом ПЦР (см.).
Антиген - вещество (обычно белки, реже полисахариды), вызывающее у
животных иммунный ответ (образование антител).
Антитело - белок (иммуноглобулин), образуемый иммунной системой организма
животных в ответ на введение антигена и способный вступать с ним в
специфическое взаимодействие.
Бактериофаг (часто произносится и пишется сокращенно - фаг) - вирус,
паразитирующий на бактериях. Состоит из ДНК или РНК, упакованной в белковую
оболочку - капсид.
Блоттинг - перенос молекул ДНК, РНК или белка из геля, в котором шёл
электрофорез, на фильтр (мембрану).
Вакцина - препарат ослабленного или убитого инфекционного агента (вируса,
бактерии и т. п.) или его отдельных компонентов, несущих антигенные
детерминанты, способный вызывать образование иммунитета к данной инфекции у
животных (человека). Кроме того, в последнее время появились вакцины,
произведенные методами генной инженерии (примером такой вакцины может служить
вакцина против гепатита B).
Вектор (в генетике) - молекула нуклеиновой кислоты, чаще всего ДНК,
используемая в генетической инженерии для передачи генетического материала
другой клетке. Вектор представляет собой либо искусственно модифицированную
плазмиду (см.), выделенную из клеток бактерии, либо искусственно
модифицированный геном бактериофага (см.) или другого вируса, либо конструкцию,
объединяющую в себе фрагмент плазмиды и фагового генома. В связи с этим принято
различать плазмидные, фаговые и плазмидно-фаговые векторы. Зачастую вертор
содержит также один или более генетических маркёров (см.), необходимых для
успешного скрининга (см.).
Ген - структурная и функциональная единица наследственности,
контролирующая развитие определенного признака или свойства. Материально ген
представляет собой участок молекулы ДНК, несущий целостную информацию о
строении одной молекулы белка или одной молекулы РНК. В составе гена, помимо
кодирующей области, имеются регуляторные участки, отвечающие за частоту экспрессии
данного гена (см. также: промотор, экспрессия гена).
Генетическая карта - схема расположения структурных генов и регуляторных
элементов в хромосоме.
Генетически модифицированные источники (ГМИ) - таковыми считаются все,
присутствующие в продуктах, генетически модифицированные организмы (бактерии,
грибы, животные и растения). ГМИ могут присутствовать в продуктах питания, либо
являться биореакторами при производстве лекарственных средств (гормонов
человека, антибиотиков, вакцин и пр.) и витаминов.
Генетически модифицированные продукты (ГМП) - продукты питания, в состав
которых входят ГМИ.
Генетически модифицированный организм (ГМО) - живой организм, генотип
которого был искусственно изменён при помощи методов генной инженерии. Синоним:
трансгенный организм.
Гено́м - совокупность всех генов организма; его полный хромосомный
набор.
Гетеродуплекс (см.: дуплекс).
Гибридная ДНК (см.: рекомбинантная ДНК).
ГМО (см. генетически модифицированный организм).
ГМИ (см. генетически модифицированные источники).
ГМП (см. генетически модифицированные продукты).
Денатурация - нарушение пространственной структуры молекулы в результате
разрыва внутри- или межмолекулярных нековалентных связей. Под денатурацией ДНК
или РНК понимается разрушение водородных связей в дуплексах и расхождение
составляющих их нитей.
ДНК-полимеразы - класс ферментов, играющих ключевую роль в репликации
ДНК. Катализируют реакцию присоединения следующего нуклеотида к 3’ концу
синтезируемой нуклеотидной цепочки. Подбор нужного нуклеотида осуществляется
путём использования комплементарной нити в качестве матрицы. Различают
ДНК-зависимые ДНК-полимеразы (синонимы: обратные транскриптазы, ревертазы),
использующие в качестве матрицы комплементарную цепь ДНК, и РНК-зависимые
ДНК-полимеразы, катализирующие синтез нити ДНК на РНК-матрице (см. обратная
транскрипция).
Дуплекс - двунитевая молекула нуклеиновой кислоты, закрученная в форме
спирали. Нити в дуплексах соединяются водородными связями по принципу
комплементарности азотистых оснований. Как правило, ДНК в клетках присутствует
в виде дуплекса - двойной спирали (однонитевыми ДНК представлены геномы
некоторых вирусов), частично переходя в однонитевую форму во время актов
транскрипции и репликации. РНК также способна образовывать дуплексы. Кроме
того, существуют гетеродуплексы, одна из нитей которых представлена молекулой
ДНК, а другая - молекулой РНК.
Интерфероны - белки, синтезируемые клетками позвоночных в ответ на
вирусную инфекцию, подавляющие развитие вирусов.
Капсид - оболочка вируса, состоящая из белков-капсомеров.
Компетентность (генетическая) - способность клеток поглощать чужеродную
ДНК из внешней среды (см.: трансформация).
Комплементарность (в генетике) - свойство азотистых оснований
образовывать с помощью водородных связей парные комплексы аденин-тимин (или
урацил) и гуанин-цитозин при взаимодействии цепей нуклеиновых кислот.
Космида - вектор, содержащий cos-сайт ДНК фага λ.
Линкер - короткий синтетический олигонуклеотид, применяемый для
соединения фрагментов ДНК in vitro; обычно содержит участок узнавания
определённой рестриктазой. Если линкер содержит несколько сайтов узнавания
различными рестриктазами, он называется полилинкер.
Липкие концы - комплементарные однонитевые участки ДНК, расположенные на
концах дуплексов ДНК.
Локус - участок ДНК (хромосомы), где расположена определённая
генетическая детерминанта. Близкий по значению термин: сайт.
Маркёр (синоним: маркерный ген) - ген в рекомбинантной ДНК, кодирующий
хорошо различимый селективный признак.
Молекулярное клонирование - технология многократного копирования
фрагментов ДНК, осуществляемая путем встраивания целевого фрагмента в геном
живого организма (например, бактерии), вируса или в живые клетки культуры
тканей и последующего размножения трансформантов.
Нокаут гена - целенаправленное внесение определенных мутаций (вплоть до
полного удаления фрагмента ДНК из генома), приводящих к избирательной
инактивации гена.
Нуклеазы - общее название ферментов, расщепляющих молекулы нуклеиновых
кислот.
Обратная транскрипция - это процесс образования двуцепочечной ДНК на
матрице одноцепочечной РНК. Осуществляется при участии ферментов обратных
транскриптаз (см. ДНК-полимеразы). В генной инженерии этот процесс используется
для создания новых генов на основе имеющихся матричных РНК.
Отжиг (см.: ренатурация).
Плазмиды - дополнительные факторы наследственности, расположенные в
клетках вне хромосом и представляющие собой кольцевые (замкнутые) или линейные
молекулы ДНК. Обнаружены у большинства прокариот и некоторых низших грибов.
Каждая плазмида имеет точку начала репликации (ori), что дает ей возможность автономно реплицироваться в
клетке и наследоваться дочерними клетками. Это свойство позволяет использовать
их в генной инженерии в качестве вектора.
Полилинкер (см.: линкер).
Полимера́зная цепная реакция (ПЦР) - метод амплификации молекул ДНК,
позволяющий добиться значительного увеличения малых концентраций определённых
фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (пробе). Метод
ПЦР широко используется не только в генной инженерии, но и в судебно-медицинской
экспертизе, генетической генеалогии, молекулярной филогенетике и других
областях науки и технологии.
Праймер (англ. primer) - это короткий фрагмент нуклеиновой кислоты,
который служит стартовой точкой при репликации ДНК. Праймеры необходимы ДНК-полимеразам,
так как ферменты этого класса могут только наращивать существующую цепь, но не
начинать ее синтез «с нуля».
Пролиферация - размножение клеток.
Промотор - участок гена, узнаваемый РНК-полимеразой как стартовая
площадка для начала транскрипции. От структуры промотора в значительной степени
зависит уровень экспрессии генов (см.). Различают сильные промоторы -
обеспечивающие высокий уровень экспрессии генов в клетке-хозяине и слабые
промоторы, обеспечивающие более низкий уровень экспрессии. «Сила» промотора
зависит от того, в клетках какой ткани или какого организма он находится, а
также от положения гена в хромосоме.
ПЦР - (см. полимера́зная цепная реакция).
Рекомбинантная ДНК (синоним: гибридная ДНК) - молекула ДНК, созданная
путём искусственного соединения фрагментов ДНК различного происхождения.
Ренатурация - восстановление исходной пространственной структуры молекул.
В отношении нуклеиновых кислот ренатурация означает восстановление двунитевой
структуры за счет образования водородных связей между комплементарными
основаниями (у этого процесса есть и другое название - отжиг), которые были
разрушены при денатурации (см.).
Рестриктазы (синоним: эндонуклеазы рестрикции) - ферменты из класса
гидролаз, катализирующие реакцию гидролиза (разрезания) молекул нуклеиновых
кислот в определенных участках. Каждая рестриктаза узнаёт специфический участок
ДНК длиной 4-6 пар нуклеотидов (сайт рестрикции). В генной инженерии являются
одним из основных инструментов при создании рекомбинантных ДНК (см.). Чаще
всего используются т.н. рестриктазы второго класса, гидролизующие ДНК внутри
сайта рестрикции или на небольшом, фиксированном расстоянии от него.
Рестрикты
- фрагменты ДНК, образовавшиеся после её гидролиза рестриктазой
<http://ru.wikipedia.org/wiki/Рестриктаза> (см.).
Рестрикция
- разрезание на фрагменты молекулы ДНК или РНК с помощью ферментов-рестриктаз
(см.).
Сайт
(генетический) - участок молекулы ДНК, РНК или белка, в котором локализована
определенная генетическая детерминанта, мутация, участок узнавания определенной
рестриктазой (сайт рестрикции) и т.п.
Секвенирование
- установление последовательности нуклеотидов в молекулах нуклеиновых кислот
или последовательности аминокислотных остатков в белках (полипептидах).
Скрининг
- выявление и отбор организмов, несущих в геноме рекомбинантную ДНК.
Трансген
- чужеродный фрагмент ДНК, переносимый при помощи генно-инженерных манипуляций
в геном определенного организма. Трансген может быть выделен из биологического
объекта или синтезирован искусственно. Организм, получившийся в ходе переноса и
встраивания в геном трансгена, называют трансгенным.
Трансгеноз
(синоним: трансгенез) - процесс переноса и встраивания генетического материала
из организма одного вида, в организм другого вида.
Трансге́нный организм (синоним: генетически модифицированный
организм) - живой организм, в геном которого искусственно введен ген другого
организма.
Трансфе́кция - процесс введения нуклеиновой кислоты в клетки
человека и животных невирусным методом. Аналогичный процесс в отношении
бактерий, дрожжей и растений называется трансформация.
Трансформация
(см. трансфекция).
Фаг
(см. бактериофаг).
Химера
(в генетике) - организм или часть организма, состоящие из генетически
разнородных тканей или клеток.
Целевой
фрагмент ДНК - участок ДНК, несущий гены, которые необходимо перенести в геном
вновь создаваемого трансгенного организма (см. трансген). Эти гены кодируют
фенетические признаки, ради которых создается трансгенный организм (например:
способность синтезировать инсулин человека трансгенными бактериями,
устойчивость к колорадскому жуку у трансгенного картофеля и пр.).
Экспрессия
гена - это процесс, в ходе которого наследственная информация от гена
(последовательности нуклеотидов ДНК) преобразуется в функциональный продукт -
РНК или белок. Экспрессия генов может регулироваться на всех стадиях процесса:
и во время транскрипции, и во время трансляции, и на стадии посттрансляционных
модификаций белков. При введении в геном организма чужеродных генов кране важно
предугадать уровень (частоту) их экспрессии на новом месте. Недостаточно
высокий уровень экспрессии целевых генов может служить причиной неудачи
эксперимента по созданию трансгенного организма.
Эндонуклеазы
рестрикции (см.: рестриктазы).
Вопросы для самостоятельного изучения
1. История развития генетической инженерии.
2. Схема типового эксперимента в генной инженерии.
. Источники ДНК для клонирования.
. Плазмидные, фаговые и плазмидно-фаговые векторы
. Векторы, сконструированные на основе фага М13
. Векторы на основе фага λ
. Челночные векторы
. Сегмент-направленный мутагенез in vitro.
. Олигонуклеотид-направленный мутагенез in vitro.
. Оптимизация экспрессии генов, клонированных в прокариотических
системах.
. Экспрессия генов при участии сильных регулируемых промоторов.
. Использование для экспрессии различных микроорганизмов.
. Использование бактерий рода Agrobacterium для создания генетически
модифицированных растений.
. Строение и функции плазмид Ti и Ri.
. Структура Т-области плазмид Ti.
. Синтез в организмах чужеродных белков медицинского назначения.
. Синтез съедобных вакцин трансгенными растениями.
. Трансгенные растения с новыми биотехнологическими свойствами.
. Трансгенные животные в фундаментальных исследованиях.
. Биотехнологическое применение трансгенных животных.
Вопросы итогового контроля
1. Опишите коннекторный метод создания рекомбинантных ДНК
2. Опишите рестриктазно-лигазный метод создания рекомбинантных ДНК
. Линкеры и полилинкеры - что это, для чего используются?
. Что такое генетическая компетентность клеток? Опишите один из химических
методов ее искусственного повышения
. Физические методы повышения компетентности клеток
. Рестриктазы какого класса используются в генной инженерии и
почему?
. Фенотипический скрининг
. Что такое и для чего применяется блоттинг? Опишите саузерн-блоттинг
. Дидезоксинуклеотидный метод секвенирования
. Полимеразная цепная реакция и её применение
. Плазмидные векторы
. Плазмидно-фаговые векторы
. Использование бактерий в создании трансгенных растений
. Строение плазмид Ti
. Строение Т-ДНК
. Устойчивость трансгенных растений к насекомым-вредителям
. Устойчивость трансгенных растений к вирусам.
. Устойчивость трансгенных растений к неблагоприятным условиям
среды
. Повышение пищевой ценности растений методами генной инженерии
. Растения с измененным вкусом и внешним видом плодов
. Трансгенная соя и содержащие её продукты питания
. Генетически модифицированные сорта риса
. Трансгенный картофель
. Трансгенные сорта кукурузы
. Трансгенные томаты
. Улучшение сохранности и качества плодов и овощей методами генной
инженерии
. Создание растений-биореакторов биологически активных белков
. Трансгенные овцы и козы
. Трансгенные свиньи и их использование
. Трансгенные породы птиц
. Трансгенный крупный рогатый скот
. Опыты по трансгенозу мышей. Применение трансгенных мышей
. Улучшение пород рыб с помощью трансгеноза
. Молочные железы животных как биореактор необходимых человеку
веществ
. Биосинтез гормонов человека в трансгенных микроорганизмах
. Съедобные вакцины
. Генная терапия in vivo
. Генная терапия ex vivo
. ДНК-технологии в профилактике отторжения трансплантированных
органов
. Синтез антисмысловых РНК
. Использование ДНК-технологий в криминалистике. Метод
«генетических отпечатков пальцев»
. Возможные последствия употребления продуктов, содержащих ГМИ в
пищу
. Государственный контроль за производством пищевых продуктов и
пищевых добавок, содержащих ГМИ
. Контроль экспериментов с рекомбинантными ДНК
. Чем опасны ГМО для окружающей среды?
. Контроль за высвобождением генетически модифицированных
организмов в окружающую среду
. Правила маркировки продуктов, содержащих ГМИ, принятые в России
и других странах
. Методы определения ГМИ в продуктах питания
Список рекомендуемой литературы
1. Щелкунов
С.Н. Генетическая инженерия: учеб. пособие для вузов. ─ 2-е изд., испр. и
доп. ─ Новосибирск: Сибир. университет. изд-во, 2004. ─ 496с.:ил. ─
ISBN 5-94087-098-8
2. Егорова
Т.А., Клунова С.М., Живухина Е.А. Основы биотехнологии : учеб. пособие для
студентов вузов. ─ М.: Academia, 2003. ─ 208с. : ил. ─ (Высшее образование). ─ ISBN
5-7695-1022-6
. Красноштанова
А.А., Крылов И.А., Бабусенко Е.С. Основы биотехнологии: учеб. Пособие. ─
М.: РХТУ, 2001. ─ 84с.:ил. ─ ISBN 5-7237-0270-X
. Бакай
А.В., Кочиш И.И., Скрипниченко Г.Г. Генетика: учебник для вузов. ─ М.:
КолосС, 2006. ─ 448с.: ил. ─ ISBN 5-9532-0325-Х
. Иванов
В.И. [и др.] Генетика: учебник для вузов / под ред. В.И.Иванова. - М.:
Академкнига, 2006. ─ 247с.: ил. ─ ISBN 5-94628-146-1
. Франк-Каменецкий
М.Д. Век ДНК. ─ М.: Книжный дом "Университет", 2004. ─
239 с. ─ ISBN 5-98227-017-2
. Глик
Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. ─
М.: Мир, 2002. ─ 589 с. ─ ISBN 5-03-003328-9