Проблемы генной инженерии
Курсовая работа
Определение термодинамических
характеристик процессов плавления и испарения CsY (pta) 4 методами
дифференциальной сканирующей калоримерии и статической тензиметрии
Содержание
Введение
Получение и применение исследуемого вещества
Дифференциальная сканирующая калориметрия (ДСК)
Тензиметрический метод исследования зависимости давления от
температуры
Описание тензиметрической установки и методика проведения
эксперимента
Экспериментальная часть
Выводы
Список литературы
Введение
Целью данной работы является определение термодинамических
характеристик процессов плавления, испарения и сублимации тетракис-
(2,2-диметил-6,6,6-трифторгексан-3,5-дионато) иттрата (III) цезия CsY (pta) 4 методами
дифференциальной сканирующей калориметрии (ДСК) и статической тензиметрии. Эти
два метода в совокупности позволяют определить температуру плавления и
зависимость давления паров от температуры. Из полученных данных рассчитаны
энтальпии и энтропии процессов плавления, испарения и сублимации. Нами была проведена
статистическая обработка полученных результатов с доверительным
интервалом 0,95.
Получение
и применение исследуемого вещества
В настоящее время β-дикетонатные комплексы
металлов являются одним из наиболее изучаемых классов координационных соединений.
Причиной этого служит ряд очень важных физико-химических свойств β-дикетонатов металлов: достаточно высокое давление пара при низких
температурах, термическая стабильность, относительная простота получения,
устойчивость при хранении, что обуславливает разнообразное практическое
применение β-дикетонатных комплексов
металлов.
Как химические реагенты, β-дикетонаты металлов используются в различных лабораторных
синтезах, прежде всего органических и механохимических. Также β-дикетонатные комплексы металлов находят применение в
аналитической химии (газовая хроматография), в физической химии (спектроскопия
ЯМР) и в других областях химии. Одной из наиболее важных областей применения β-дикетонатов металлов является получение металлосодержащих плёнок
и покрытий методом химического осаждения из газовой фазы - MOCVD (Metal Organic Chemical Vapor Deposition). MOCVD является методом с
широчайшим набором применений. В частности, такие технологии требуются для
изготовления электронных умножителей на основе микроканальных пластин из оксида
магния, внутрь каналов которых допируется микроскопический слой цезия, имеющего
очень малое значение работы выхода электрона.
Суть метода MOCVD состоит в следующем: исходное соединение
(прекурсор) - в данном случае это β-дикетонат металла -
подвергают нагреванию и переводят в парообразное состояние, потом с помощью
газа-носителя переносят пары вещества к нагретой подложке, на которой под
действием высокой температуры и (если требуется) газообразных реагентов
происходит распад β-дикетоната металла на
твёрдую металлсодержащую фазу, формирующую материал покрытия, и газообразную
фазу, которую удаляют из сферы реакции. Полученные методом MOCVD плёнки используются в
качестве защитных, оптических, электрохромных и др. покрытий, а также при создании
тонкоплёночных электролитов для твёрдооксидных топливных элементов, электродов
для электродиализных установок, легировании металлов, производстве транзисторов
в различных микросхемах, полупроводников и сверхпроводников.
β-дикетонат ML получают при кипячении
раствора β-дикетона в малополярном
растворителе со стехиометрическим количеством щелочи. Далее полученный комплекс
используют в получении β-дикетонатных комплексов
других металлов.
Тетракис-хелаты лантаноидов, содержащие катионы щелочных
металлов, получают в среде малополярных растворителей, например, CCl4. Схема реакции:
ML + LnX → 3MX↓ + M [LnL4]
где М - катион щелочного металла, L -
пивалоилтрифторацетилацетон, трифторацетилацетон, гептафторацетилацетон, X - Cl, NO3, OCOCH3, Ln - металл группы лантаноидов.
β-дикетонаты цезия
применяются для нанесения тонких пленок цезия, но сами комплексы β-дикетонов с цезием неустойчивы вследствие несоответствия между
размерами Cs+ (тенденция к образованию комплексов с КЧ>8) и его степенью
окисления (+1), поэтому иттрий в тетракис-
(2,2-диметил-6,6,6-трифторгексан-3,5-дионато) иттрате (III) цезия обеспечивает
устойчивость комплекса, а также обеспечивает летучесть соединения, иначе Cs (pta) 4 невозможно
было бы использовать в MOCVD.
сканирующая калориметрия статическая тензиметрия
Дифференциальная сканирующая калориметрия (ДСК)
Для определения теплоты и температуры плавления тетракис -
(2,2-диметил - 6,6,6 - трифторгексан-3,5-дионато) иттрата (III) цезия используется
дифференциальный сканирующий калориметр теплового потока.
При нагревании контейнера с веществом с постоянной скоростью
температура образца не соответствует температуре окружения. Она несколько ниже,
но тоже меняется с постоянной скоростью. Примерно постоянная разница в
температурах между образцом и окружением обеспечивает постоянный поток тепла к
образцу.
Поглощая тепло, образец массы m и теплоемкости c нагревается согласно:
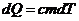
Продифференцировав уравнение, получаем выражение для теплового
потока:
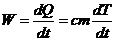 .
.
Теплота, расходуемая на нагревание контейнера с веществом,
измеряется через ЭДС термопары:
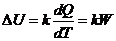 ,
,
где коэффициент k
[Вольт/ватт], зависящий от температуры - чувствительность калориметра, значение
которого определяется посредством калибровки.
Скорость нагревания 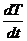 обозначим
буквой β. Если известна чувствительность калориметра
k, то теплоемкость вещества можно определить, измеряя ЭДС на
термопаре ΔU при
нагревании с постоянной скоростью:
обозначим
буквой β. Если известна чувствительность калориметра
k, то теплоемкость вещества можно определить, измеряя ЭДС на
термопаре ΔU при
нагревании с постоянной скоростью:
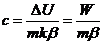 .
.
Таким образом, в калориметре теплового потока формируется градиент
температуры, обеспечивающий поток тепла. Измеряется разность температур с
помощью блока термопар, а через неё с учетом температурной зависимости
коэффициента калибровки рассчитывается поглощаемое образцом тепло.
Основной частью калориметра (рис.1) является небольшой
термостатированный блок с регулируемой температурой (1), расположенный
во внешней камере, в которой поддерживается температура окружающей среды (2).
Две тонких жаропрочных трубки (3) проходят насквозь через камеру и блок:
их средняя часть служит экспериментальной камерой. Эта средняя зона
охватывается калориметрическим флюксметром (4) с термопарами, которые
соединяют ее термически с термостатированным блоком (1).
Этот принцип измерения успешно используется на протяжении многих
лет в калориметрах Тиан-Кальве: термостатированный блок устанавливает в образце
нужную температуру; флюксметр измеряет теплообмен между образцом и блоком.
Концы трубок служат для ввода и извлечения образцов; они соединены
также с трубками атмосферного контроля. Расположение полностью симметрично.
Быстрое охлаждение блока достигается за счет принудительной циркуляции газа (5).
Вспомогательное питание жидким азотом обеспечивает охлаждение ниже температуры
окружающей среды. Высокоэффективный электронный программируемый регулятор
контролирует температуру. Цифровое устройство обрабатывает поступающую
информацию.
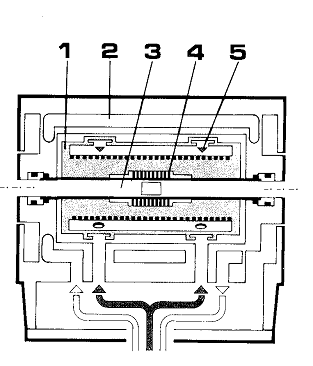
Рис.1 Принципиальная схема дифференциального сканирующего
калориметра
Тензиметрический
метод исследования зависимости давления от температуры
Методы тензиметрии применяются при изучении гомо- и
гетерогенных равновесий с участием газовой или паровой фазы. Они, с одной
стороны, связаны с химическими превращениями в парогазовых средах, их кинетикой
и термодинамикой, с другой - позволяют понять сущность химических превращений в
конденсированных средах и в ряде случаев количественно охарактеризовать их.
Согласно одной из возможных классификаций методы тензиметрии
делятся на статические, динамические и эффузионные. Большинство
из них, помимо основного измеряемого параметра, позволяют установить и
некоторые другие. Например, статистическими методами можно определить как
основной параметр - общее давление насыщенного и ненасыщенного пара, так и
дополнительный - плотность ненасыщенного пара (если известны объем реакционной
камеры и массовое количество перешедшего в пар вещества). Это очень важно,
поскольку количество независимо измеряемых параметров обусловливает число
независимых уравнений, неизвестными в которых являются парциальными давления
компонентов пара. Имея такие уравнения и зная качественный состав пара,
совместным решением можно найти численные значения парциальных давлений.
Основная черта статических методов тензиметрии - наличие
замкнутого объема и известной массы изучаемого вещества. Процессы разложения
нелетучих веществ, одним из продуктов диссоциации которых является газ
(например, разложение карбонатов), изучают обычно с помощью статистического
метода, в качестве датчика используют мембранный или спиральный нуль -
манометр. Детектором разницы давлений здесь служат тонкая мембрана или
тонкостенная спираль.
Динамические методы тензиметрии характеризуются отсутствием
строго равновесного состояния системы вследствие одностороннего переноса
вещества из одной температурной зоны в другую. При проведении эксперимента
конденсированная фаза взаимодействует с непрерывно циркулирующей газовой фазой.
К динамическим методам относятся метод потока и циркуляционный метод.
Кинетические (эффузионные) методы применяются при определении
малых давлений пара в интервале 10-2-10-3 Па. Давление
пара определяется на основе измерения скорости испарения вещества с открытой
поверхности или скорости истечения пара в вакуум через отверстие камеры. Далее
по измеренной скорости вычисляют давление пара на основе
молекулярно-кинетической теории, при этом применяется в основном метод
Ленгмюра, торзионный метод и наиболее распространенный метод Кнудсена.
Для наших целей наиболее подходящим является метод
статической тензиметрии.
Описание
тензиметрической установки и методика проведения эксперимента
Схема установки измерения давления пара статическим методом
изображена на рис.2. Исследуемое вещество содержится в рабочей камере (1) мембранного
нуль-манометра. Плоская мембрана (2), являющаяся чувствительным
элементом прибора, разделяет рабочую (1) и компенсационную (3) камеры.
В последней (3) расположен механический усилитель перемещений (4) с
указателем (5), а также нить сравнения (6). Давление в изучаемой
системе вызывает прогиб мембраны относительно нулевого положения. Изменением
внешнего давления можно компенсировать прогиб мембраны и измерить это давление
с помощью ртутного манометра (7) и катетометра КМ-8 с ошибкой не более ±
0.05 торр. Для более точной фиксации нулевой точки использовалась оптическая
система регистрации нулевого положения мембраны (8). Чувствительность
используемых нуль-манометров была 0.05-0.1 торр, что при 30-кратном увеличении
соответствовало сдвигу изображения подвижного штока на 0.3 мм. Предельная
ошибка измерения давлений не превышала 0.3 торр.
Для нагрева мембранных нуль-манометров служила трехсекционная
печь сопротивления (9), каждая из обмоток которой управлялась независимо
с помощью собственной термопары датчика (10) и регулятора ПИТ-3 (11)
(рис.1).
Такая конструкция позволяла поддерживать в трех точках печи
одинаковую температуру.
Отклонения от этой температуры на длине 140 мм не превышали
0.5 К, что было установлено специальными измерениями с помощью контрольной Pt-Pt/Rh термопары (12),
перемещаемой внутри рабочей зоны печи. Контрольная термопара предварительно
была прокалибрована по реперным веществам (In, Pb, Cd, Sb).
Рис.2. Схема тенизиметрической установки.
Тензиметрическая установка была прокалибрована по давлению
насыщенного пара стандартных веществ нафталина и ртути, в итоге предельная
ошибка в измерении температуры составила 0,5 К.
Давление измеряли методом температурных площадок (то есть при
полном термостатировании нуль - манометра), на которые выходили в ходе опытов
как от более низких, так и от более высоких температур ("прямой" и
"обратный" ход). Совпадение давлений, измеренных на прямом и обратном
ходах - критерий того, что измеренные давления относятся к равновесной системе.
Экспериментальная
часть
Определение температуры плавления, энтальпии и
расчет энтропии плавления CsY (pta) 4 методом
ДСК.
Для определения температуры плавления мы измеряли зависимость
изменения теплового потока от температуры на дифференциальном сканирующем
калориметре SETARAM 111G. Перед проведением измерений прибор был прокалиброван в диапазоне
температур 80-270 ºС по реперным веществам
(нафталин, бензойная кислота, индий, олово и висмут). Отличие температур и
энтальпий плавления, полученных для реперных веществ, не отличалось от справочных
данных более чем на 2%.
Подготовка измерений
В предварительно взвешенную ампулу поместили необходимое
количество предварительно измельчённого (в нашем эксперименте масса навески
составляла не больше 0.02г.; во всех экспериментах мы старались подбирать
одинаковое количество вещества для достижения более точных и сходящихся
результатов). Пустую ампулу взвесили, поместили в нее необходимое количество
образца, снова взвесили для оценочного определения массы помещенного вещества.
Ампула была запаяна под вакуумом, взвешена на аналитических весах. По разности
масс определили массу навески. В качестве объекта сравнения использовалась
пустая ампула.
Ход измерений
Далее на приборе были установлены следующие параметры
измерения:
· начальная температура нагрева - 490К
(предварительно зная приблизительную температуру плавления образца, которую
можно взять из справочных таблиц, либо проведя эксперимент при большой скорости
нагрева);
· чувствительность измерения - 1
(подбирается так, чтобы пик фазового перехода полностью попал на ленту
самописца);
· конечная температура - 520К
(устанавливалась с запасом);
· скорость
нагрева - 2ºC/мин.
Во всех экспериментах сохраняли данные начальные условия.
Ампулу с образцом поместили в отсек для образца, а ампулу
сравнения в отсек сравнения. Включили нагрев и наблюдали поглощение тепла
вблизи температуры плавления. График, полученный в ходе измерения, обработали
на ПК. Провели калибровочное измерение, для этого поместили в прибор
калибровочные блоки и нагревали при условиях эксперимента. Вблизи температуры
плавления (± 1º) подали на блоки 0.2 Дж, и записали пик
выделения тепла.
Обработка результатов измерений
На полученном графике измерения провели базовую и восходящую
линии, по точке пересечения определили температуру плавления образца. Обработали
отсканированное изображение на ПК. Посчитали площадь пика (см2).
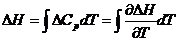
По отношению площадей нашли энергию, необходимую для перевода
нашей навески в жидкую фазу, т.е. энтальпию фазового перехода. Посчитали мольную энтальпию и
энтропию фазового перехода.

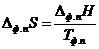
Опыт повторили с разными навесками вещества для получения выборки
результатов. Все эксперименты проводились однократно, т.к. измерения показали,
что при повторных плавлениях образца последний постепенно разлагается, тем
самым внося погрешность в определение термодинамических характеристик данного
вещества.
Полученные результаты занесли в таблицу:
|
M, г
|
∆плН,
кДж/моль
|
Тпл,
ºС
|
|
0.0114
|
22.4
|
214
|
|
0.0153
|
22.6
|
214
|
|
0.0140
|
23.5
|
217
|
|
0.0125
|
22.7
|
217
|
|
0.0129
|
23.0
|
215
|
После обработки результатов (построения доверительного
интервала с доверительной вероятностью 0.95 для пяти измерений) получили
результат
∆плН = 22.84 ± 0.54 кДж/моль
Тпл, = 215.40 ± 1.90 ºС
∆плS = 46.77 ± 1.98 Дж/моль*К
Определение зависимости давления паров от
температуры, расчет энтальпии испарения и энтропии испарения CsY (pta) 4
тензиметрическим методом.
Открытую ампулу с исследуемым веществом поместили в рабочую
камеру предварительно прогретого в вакууме в течение 1,5 часов (для дегазации)
мембранного нуль-манометра. Объем камеры определили по весу заполняющей ее воды
- в итоге объем камеры 7± 0,05 мл. Для учета остаточного давления измерили
давление при комнатной температуре 296,55 К. Провели измерения давления паров
вещества в зависимости от температуры для навески 0,0457 г. По полученным
данным по методу наименьших квадратов построили график зависимости ln (p-p0) (торр) от величины
1000/Т (К), и, пользуясь уравнением Клайперона - Клаузиуса, рассчитали энтропию
и энтальпию испарения CsY (pta) 4 и погрешность измерения этих
величин с доверительным интервалом 0,95.
|
N
|
Т, К
|
Рнасыщ,
торр
|
(Рнасыщ - P0/T0*T) торр
|
ln ( (Рнасыщ - P0/T0*T) /760)
|
1000/T
|
|
1
|
296,55
|
2,505
|
0
|
-
|
3,37211
|
|
2
|
490,77
|
9,43
|
5,28447
|
-4,96855
|
2,03761
|
|
3
|
496,04
|
10,21
|
6,01995
|
-4,83824
|
2,01597
|
|
4
|
501,02
|
12,47
|
8,23788
|
-4,52457
|
1,99593
|
|
5
|
506,56
|
14,89
|
10,61109
|
-4,27142
|
1,97410
|
|
6
|
491,01
|
8,74
|
4,59244
|
-5,10891
|
2,03662
|
492,33
|
9,01
|
4,85129
|
-5,05407
|
2,03116
|
|
8
|
493,47
|
9,29
|
5,12166
|
-4,99984
|
2,02647
|
|
9
|
499,10
|
11,38
|
7,1641
|
-4,66424
|
2,00361
|
|
10
|
512,15
|
18,24
|
13,91387
|
-4,00043
|
1,95255
|
Р0/Т0 = 2,505/296,55 =
0.008447(p/p0) = - ∆сублH/RT+∆сублS/R
∆сублH=106,5 ± 2,3 кДж/моль
∆сублS=174,8 ± 2,3 Дж/моль*К
R2=0,9809
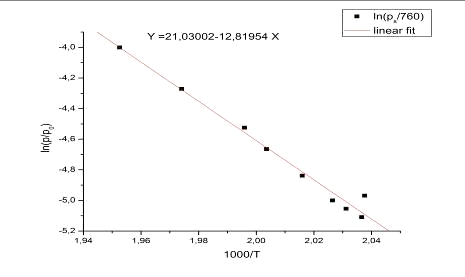
Расчет энтальпии и энтропии испарения
Исходя из данных энтальпий и энтропий плавления и испарения
рассчитали величины энтальпии и энтропии сублимации:
∆испH= (106,50-22,84) =83,66
кДж/моль
∆испS= (174,8-46,77) =128,03
Дж/моль*К
Выводы
Методом ДСК измерены температура и энтальпия плавления,
рассчитана энтропия плавления CsY (pta) 4. Методом статической тензиметрии
были определены энтальпии и энтропии процесса сублимации CsY (pta) 4. Для
энтальпии и энтропий процессов испарения и плавления были рассчитаны
погрешности определения с доверительным интервалом 0,95. Из полученных данных
рассчитаны энтальпия и энтропия процесса испарения.
Список
литературы
1. И.М.
Жарский, Г.И. Новиков. "Физические методы исследования в неорганической
химии", М.: Высшая школа, 1988.
2. Пармон
В.Н. "Лекции по химической термодинамике", Н-ск.: НГУ, 2004.
. Зеленина
Л.Н., Хасин А.А. "Практикум по физической химии. Фазовые равновесия, часть
2", Н-ск.: НГУ, 2005.
. Курсовая
работа по неорганической химии студента 741 группы Воробьева А.А., 2008.
. Дребущак
В.А., Шведенков Г.Ю. "Термический анализ", Н-ск.: НГУ, 2003.