Полноценные и неполноценные белки
Дипломная работа
ОБРАЗОВАНИЕ НИТРАТНЫХ КОМПЛЕКСОВ
НИТРОЗОРУТЕНИЯ В АЗОТНОКИСЛЫХ РАСТВОРАХ
Оглавление
1. Введение
.1 Личный вклад дипломника
. Литературный обзор
.1 Состояние нитрозорутения в
азотнокислых растворах
.1.1 Нитрокомплексы нитрозорутения
.1.2 Нитронитратокомплексы
нитрозорутения
.1.3 Нитратокомплексы
нитрозорутения
.2 Нитратокомплексы рутения,
выделенные в виде кристаллических фаз
. Экспериментальная часть
.1 Исходные реагенты,
аппаратура и методы измерений
.2 Синтез исходных рутенийсодержащих
соединений и исследование их превращений
.3 Синтез комплексов
нитрозорутения
. Результаты и обсуждение
.1 Поведение [RuNO(NO2)4OH]2-
в азотнокислых растворах
.2 Синтез исследование
нитратсодержащих комплексов нитрозорутения
. Выводы
. Список литературы
1. Введение
Успешное развитие атомной энергетики связано с решением проблемы надежной
локализации радиоактивных отходов. С другой стороны, радиоактивные отходы
содержат ценные в прямом и техническом смысле металлы с уникальными свойствами
и в значительном количестве. Среди продуктов деления - значительное количество
благородных металлов, преимущественно в виде смеси стабильных изотопов.
Динамика накопления платиновых металлов в отработанном ядерном топливе (ОЯТ) по
данным МАГАТЭ [] представлена в табл. 1. Из прогноза следует, что к тридцатым
годам нынешнего столетия в отходах ОЯТ содержание Pd, Rh и Ru станет близко к
их мировым запасам. Поэтому ОЯТ рассматривается в мире как мощный потенциальный
источник запасов платиновых металлов для мировой экономики и новейшей техники.
Табл.
1. Динамика накопления отработавшего топлива и содержания в нем платиновых
металлов в сопоставлении с изменениями мировых запасов
|
Год
|
Количество облученного
топлива, т.
|
Накопление платиновых,
металлов в облученном топливе, т.
|
Мировые запасы платиновых
металлов, т.
|
|
1990
|
~ 70000
|
Ru: 7,4 Rh: 8,4
Pd: 91,8
|
Ru: 3220 Rh: 770
Pd: 8520
|
|
2000
|
173000-181000
|
Ru: 364-381 Rh:
71-75 Pd: 218-228
|
Ru: 3090 Rh: 620
Pd: 6870
|
|
2030
|
676000-832000
|
Ru: 1423-1752
Rh: 280-344 Pd: 850-1047
|
Ru: 2870 Rh: 370
Pd: 4100
|
В зависимости от типа реактора, режима горения топлива и времени его
хранения в литературе [] указываются концентрации Ru от 0,7 до 29,4 г на литр жидких отходов, причем доля
неактивного рутения в азотнокислых растворах ОЯТ во много раз больше, чем доля
его радиоактивных изотопов.
В азотнокислых растворах переработки ОЯТ по технологии ПУРЕКС рутений в
основном представлен в виде нитрозокомплексов. Координация рутения до
октаэдрической дополняется координированными нитрат-, нитрит- и
гидроксид-ионами, а также молекулами воды. Наличие координированного
нитрит-иона обусловлено присутствием в системе стационарной концентрации
азотистой кислоты (до 10-2 моль/л), образующейся при радиолизе HNO3 []. Количественные соотношения
различных нитрозокомплексов рутения в реальных и модельных азотнокислых
растворах ОЯТ сильно зависят от многих факторов, таких как кислотность,
содержание нитрат-иона и азотистой кислоты, температура, предыстория раствора и
т.д.
Литературные данные о временах, необходимых для установления равновесия в
азотнокислых растворах нитрозорутения, очень противоречивы. Для
нитрозонитратных растворов эти результаты колеблются от нескольких часов до
многих месяцев. Можно лишь однозначно утверждать, что состав равновесных растворов
зависит от условий старения, а скорость установления равновесия сильно растет с
увеличением температуры. Также можно считать доказанным, что моноядерные
нитрозонитратные комплексы рутения заметно более лабильны, чем нитрозонитритные
соединения.
Вплоть до конца прошлого века идентификация состава комплексов рутения в
таких растворах проводилась косвенными методами (хроматография, экстракция).
Современные физические методы предоставляют новые возможности для исследования
состава растворов. Так, одним из наиболее информативных методов исследования
состояния равновесия и доминирующих в растворе комплексных форм является метод
ЯМР с использованием ядер центрального атома, лигандов и растворителя 99Ru,
14N, 15N, 17O, позволяющий наблюдать за
системой in situ, без разделения и выделения комплексов.
Собственно
говоря, до настоящего времени координацию нитрат-аниона к рутению в таких
растворах и удавалось наблюдать только методом ЯМР []. При испарении этих
растворов в твердую фазу выделяются хорошо растворимые стеклообразные смеси
веществ, зачастую рентгеноаморфные []. Одной из причин образования
рентгеноаморфных продуктов может являться полимеризация нитратоаквакомплексов
посредством мостиковых ОН- и NO3-групп, как это обнаружено для комплексов родия [1].
Избежать полимеризации, или затруднить этот процесс, можно на модельных
системах, зафиксировав часть координационных мест в нитрозокомплексе рутения
прочно связанными с ним лигандами. Синтез и установление структурных
характеристик модельных нитратокомплексов нитрозорутения позволит судить о
способах координации нитрат-иона к рутению в растворах ОЯТ, геометрии
комплексов и их константах устойчивости.
Целью
настоящей работы было исследование процесса разрушения нитритных комплексов
рутения в азотнокислых растворах методом ЯМР, установление доминирующих форм и
оценка кинетических и термодинамических параметров реакции вхождения
нитрат-иона во внутреннюю сферу нитрозорутения, а также синтез и установление
структурных характеристик модельных нитратокомплексов нитрозорутения.
.1 Личный
вклад дипломника
Все синтезы нитрозокомплексов рутения, приведенные в экспериментальной
части, осуществлены автором работы. Так же автором выполнен анализ ЯМР 14N и 15N спектров с помощью программы NutsPro 6.0 [], соотнесение химсдвигов, анализ ИК-спектров и
дифрактограмм.
Рентгенофазовые и рентгеноструктурные исследования проведены в
лаборатории кристаллохимии ИНХ СО РАН к.х.н. с.н.с. И.А. Байдиной и к.х.н.
м.н.с. И.В. Корольковым.
ИК спектры и спектры ЯМР были записаны в лаборатории оптических методов
исследования ИНХ СО РАН н.с. Н.И. Алферовой и н.с. С.В. Ткачевым.
СТА (ТГ, ДСК и АВГ-МС) ТГА и были записаны в лаборатории химии редких
платиновых металлов ИНХ СО РАН м.н.с. П.Е. Плюсниным.
2.
Литературный обзор
Исследование
азотнокислых растворов рутения, моделирующих растворы ОЯТ, наиболее активно
проводилось в 50-70-е гг прошлого столетия. Результаты этих исследований
обобщены и детально проанализированы в обзоре Ферстерлинга, вышедшем в 1983
году [2]. В последние годы, с появлением новых инструментальных методов, перед
учеными открылись новые возможности для исследования поведения рутения в
модельных азотнокислых растворах.
В
обзоре Федотова [] обобщены данные ЯМР по химсдвигам комплексов платиновых
металлов на различных ядрах. В обзоре озвучена гипотеза, основанная на
эмпирических закономерностях: химсдвиг донорного атома в основном зависит от
лиганда в транс-положении, его транс-влияния. Химсдвиг донорного атома на
определенной транс-координате комплексной частицы, так называемый координатный
химсдвиг, является характеристикой этой транс-координаты. Благодаря этой
закономерности, появляется возможность из данных по ЯМР спектроскопии растворов
комплексных соединений платиновых металлов выявлять присутствующие в них
транс-координаты, а часто и идентифицировать структуру комплексной частицы.
Из
обобщенных в обзоре экспериментальных данных следует, что для нитрозорутениевых
комплексов координатные химсдвиги азотсодержащих лигандов проявляются в
спектрах ЯМР на ядрах 14N и 15N в следующих областях: O2N-Ru-X (98
м.д. - 68 м.д.), H3N-Ru-X (-410 м.д. - -440 м.д.), где X = O2N-, H3N-, H2O-, HO-группы.
В
работах [1, 4, ] показано, что координатные химсдвиги координированной
нитрозогруппы проявляются в следующих областях: ON-Ru-OH2 (-16 м.д. - -24 м.д.), ON-Ru-OH (-31 м.д. - -38 м.д.). К
координированному нитрат-иону относятся сигналы с химсдвигами в области -9 м.д. - -11 м.д.
Попытки
получения кристаллических фаз нитратных комплексов рутения и определения их
строения методами структурного анализа на протяжении длительного времени
заканчивались неудачей. Лишь в последние 15 лет появилось несколько работ,
посвященных исследованию индивидуальных нитратных комплексов рутения, в
основном не содержащих координированной нитрозогруппы. Первый нитратный комплекс
рутения, синтезированный обменной реакцией хлорокомплекса с нитратом серебра в
ацетоновом растворе, был исследован методом РСА в 1994 г.
2.1 Состояние
нитрозорутения в азотнокислых растворах
При
растворении облученного ядерного топлива в азотной кислоте образуется летучий
тетраоксид рутения, дающий при взаимодействии с HNO3 и окислами
азота комплексы нитрозорутения (RuNO3+), в том числе и нитратные. Наиболее прочно рутений
связан с нитрозогруппой. Соединения нитрозорутения легко обнаружить методом ИК
спектроскопии по характерным интенсивным полосам в области 1830-1960 см-1 [2].
Приводится следующая зависимость для различных лигандов по силе связывания с
рутением:
NO3- < OH- < NO2- [2, 5]
Транс-положение
к нитрозогруппе в большинстве комплексов нитрозорутения особенно лабильно из-за
сильного транс-влияния нитрозогруппы [2, , ]. В соответствии с работой [] в
транс-положении к NO-группе в растворах HNO3 должен
происходить быстрый обмен между H2O и NO3-. Вероятность занятия этого положения H2O и NO3-
зависит от типа лигандов в других положениях комплекса. В работах [2, 9] пришли
к выводу, что транс-влияние RuNO(III) группы не приводит к стабильному связыванию лиганда.
В
азотнокислых растворах отработанного ядерного топлива существуют нитратные,
смешанные нитрат-нитритные и чистые нитритные комплексы нитрозорутения.
Равновесие можно изобразить следующим образом [2, ]:
RuNO(III)-нитратные
комплексы + HNO2 = HNO3 + RuNO(III)-смешанные комплексы;
RuNO(III)-смешанные
комплексы + HNO2 = HNO3 + RuNO(III)-нитритные комплексы.
Положение
равновесия определяется текущей концентрацией HNO2 в
азотнокислом растворе, температурой и составом газовой фазы над раствором. Лишь
при строгом сохранении определенных реакционных условий удается получить
растворы, содержащие только один тип нитрозокомплексов.
При
распаде ядерного топлива окислительно-восстановительные реакции, протекающие в HNO3,
приводят к образованию больших количеств окислов азота и HNO2
[2], поэтому вышеупомянутое равновесие может быть сильно смещено в сторону стабильных
нитритных комплексов.
.1.1
Нитрокомплексы нитрозорутения
Нитрокомплексы
нитрозорутения образуют большую группу соединений рутения, которые существуют в
растворах ядерного топлива. Доля нитрокомплексов в общем содержании рутения в
реальных растворах по различным литературным данным составляет от 9 до 80 %
[2].
Для
нитрозорутения наибольшее количество координированных нитрогрупп содержится в
тетранитрокомплексах: M2[RuNO(NO2)4OH]·xH2O, где M это Na, K или Rb. Тетранитрокомплексы образуются при взаимодействии
хлоридных, нитрозилхлоридных и нитрозилнитратных комплексов рутения с нитритами
щелочных металлов. В настоящее время опубликованы структуры натриевой, калиевой
и смешанной по катионам солей [, , ]. Кроме того, в литературе описана
кристаллическая структура Pb[RuNO(NO2)4OH]·0,5H2O []. Тетранитрокомплексы относятся к самым стабильным
соединениям нитрозорутения в водных растворах.
В
литературе встречаются данные о получении двойных комплексов, содержащих анион
[RuNO(NO2)4OH]2- и комплексный катион. Синицын с сотрудниками
синтезировали [RuNO(NH3)4OH][RuNO(NO2)4OH]·H2O и [RuNO(NH3)4Cl][RuNO(NO2)4OH] []. В работе [] описана кристаллическая структура [RuNO(NH3)4Cl][RuNO(NO2)4OH].·Бельским
и Кокуновой синтезирован [Co(NH3)5Cl][RuNO(NO2)4OH], в работе приводится описание кристаллической
структуры полученного комплекса [].
В
ряде работ, посвященных исследованию влияния цветных металлов на экстракцию
рутения в форме [RuNO(NO2)4OH]2-, обнаружено образование гетерометаллических
комплексов [RuNO(NO2)4OHMLm], где M = Zn2+, Cu2+, Co2+, Ni2+ и m = 1-3 [, , , ]
Na2[RuNO(NO2)4OH]·2H2O
может быть перекристаллизован из воды. При повышении температуры наблюдается
гидролиз вплоть до осаждения нитрозогидроокиси рутения [5]. Процесс гидролиза
обратим. Действие разбавленной HNO3 или HClO4 на водный раствор тетранитрокомплекса приводит к
образованию динитрокомплекса:
[RuNO(NO2)4OH]2- + 2H2O +
2H+·® [RuNO(NO2)2OH(H2O)2] + 2HNO2 [5, 12].
В
работе [12] при гидролизе тетранитрокомплекса был выделен оранжево-коричневый
кристаллический продукт, растворимый в воде и кислородсодержащих органических
растворителях (ТБФ), относимый автором к динитрокомплексу по данным элементного
анализа на металл, азот и кислород.
В
работе [8] с помощью ЯМР спектроскопии на ядрах 14N, 15N, 17O и
99Ru изучены водные растворы [RuNO(NO2)4OH]2−.
В спектрах ЯМР−15N авторы наблюдали сигналы с химсдвигами −37,8
м.д. и 94,3 м.д., c соотношением интенсивности 1:4, отнесенные к
транс-координатам HO−Ru−NO и O2N−Ru−NO2 соответственно. В спектрах ЯМР−14N
этой комплексной форме отвечают сигналы на −35 м.д. и 94 м.д. Аналогичное
отнесение сигналов проведено в работе [], посвященной исследованию поведения [RuNO(NO2)4OH]2- в нитритной щелочной среде.
Тринитрокомплекс
[RuNO(NO2)3(H2O)2] нестабилен и мало изучен. Он возникает при
гидролизе тетранитрокомплекса и при обработке RuNO (III)
нитратных растворов окислами азота [2].
С
помощью ЯМР−15N в работе [8] исследована водная фаза после экстракции
ТБФ нитрованных растворов, проведено следующее отнесение сигналов: −32,7
м.д., 80,1 м.д., 96,3 м.д. к [RuNO(NO2)3(H2O)OH]−. В работе [24] сигналы в спектре ЯМР−15N с
химсдвигами -32,7 м.д., 90,1 м.д. и 96,7 м.д. и отношением
интенсивности 1:1:2 относят к [RuNO(NO2)3(OH)2]2-.
Совсем
недавно взаимодействием K2[RuNO(NO2)4OH] с разбавленной азотной кислотой при комнатной
температуре была выделена в виде малорастворимой кристаллической фазы димерная
тринитритная соль нитрозорутения, K2[RuNO(NO2)3(m-OH)]2,
[]. В работе определена кристаллическая структура полученного соединения (Рис. 1).
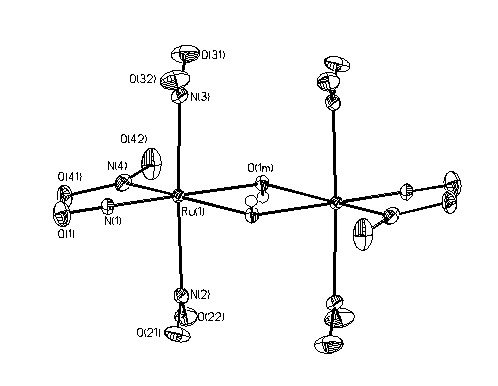
Рис.
1 Фрагмент кристаллической структуры K2[RuNO(NO2)3(m-OH)]2
В
работе [4] авторы предполагают, что сигналы с химсдвигами 84,4 м.д., 84,7 м.д.
(HO−Ru−NO2) и 90,7 м.д. (O2N−Ru−NO2)
(при C(H+) = 0.06 M) относятся к [RuNO(NO2)3(m-OH)]22- и [RuNO(NO2)3(Н2O)(OH)]-. Интерпретация этих сигналов
осложняется тем, что лигандное окружение рутения в этих комплексах очень
близко.
Динитрокомплекс
присутствует в слабо- и среднеазотнокислых растворах. Стоит заметить, что в
реальных растворах ядерного топлива динитритный комплекс превалирует над всеми
другими комплексными состояниями нитрозорутения.
В
спектрах ЯМР 15N азотнокислого раствора Na2[RuNO(NO2)4OH],
авторы работы [8] наблюдали два интенсивных сигнала с химсдвигами −23
м.д. и 77 м.д. с соотношением интенсивности 1:2. Эти сигналы авторы относят к
цис-[RuNO(NO2)2(H2O)2OH]. В спектрах ЯМР 15N водной фазы
после экстракции ТБФ нитрованных растворов наблюдаются сигналы с химсдвигами −27,2
м.д. и 79,1 м.д. отнесенные в работе к к цис-[RuNO(NO2)2(H2O)3]+.
Аналогичные
результаты получены в работе [4], опубликованной несколько лет назад. В
интервале кислотности 2,7 - 0,12 моль/л одной из доминирующих форм рутения
является [RuNO(NO2)2(H2O)3]+. При снижении кислотности до 0,06 моль/л в
растворе доминируют тринитро- и тетранитрокомплексы нитрозорутения(II).
В
работе [24] сигналы в спектре ЯМР 15N с химсдвигами -27,5 м.д. и 104,4 м.д. и отношением интенсивности 1:2 относят к транс-[RuNO(NO2)2(H2O)(OH)2]-.
Мононитритный
комплекс с аква- или гидроксильными группами в качестве лигандов до сих пор не
выделен в чистом виде. Он возникает при гидролизе более нитрированных нитритных
комплексов. Так, в спектрах ЯМР 15N щелочного нитритного раствора [Ru(NO2)6]4- или [RuNO(NO2)4OH]2-, выдержанного 35 суток,
наблюдаются сигналы с химсдвигами -41,8 м.д. и 87,5
м.д. равной невысокой интенсивности [24]. Авторы относят эти сигналы к
мононитроформе [RuNO(NO2)(H2O)(OH)3]-. В спектре ЯМР 15N,
записанном через год после приготовления раствора [Ru(NO2)6]4-, доля мононитрокомплекса составляет 23 %. В процессе старения раствора
происходит смещение линий в спектрах ЯМР 15N, относимых к
мононитроформе, и падение интенсивности сигналов в спектрах ЯМР 99Ru.
Предполагается, что это связано с появлением в растворе димерной мононитроформы
[RuNO(NO2)(H2O)(OH)2(m-OH)]22-.
При
кипячении нитритных комплексов нитрозорутения в азотной кислоте средних
концентраций и последующем разделении на фракции с помощью хроматографии или
других методов, получается большое количество фракций неопределенного состава,
о строении которых можно сказать лишь приближенно.
2.1.2
Нитронитратокомплексы нитрозорутения
В
работе [9] проведено хроматографическое разделение нитронитратных комплексов
нитрозорутения и определены времена полупревращения для процессов акватации (С(HNO3)
= 0,45 М) и вхождения нитрат-иона во внутреннюю координационную сферу (С(HNO3)
= 10 М) при температуре 0 °C. На Рис. 2 представлена схема превращений
нитритнонитратных комплексов нитрозорутения, представленная авторами в работе.
В
работе [12] обработкой азотнокислого раствора нитрозонитратов рутения смесью
окислов азота при 50 ºС была получена красно-коричневая стекловидная фаза,
растворимая в полярных органических растворителях. На основании данных
элементного анализа авторами сделано предположение, что продуктом является [RuNO(NO2)(NO3)2(H2O)2].
В
ряде работ, проанализированных в обзоре [2], хроматографическими методами при
варьировании концентрации азотной кислоты были выделены фракции, содержащие
предположительно [RuNO(NO2)(NO3)2(H2O)2], нитритные комплексы нитрозорутения и
мононитратные комплексы [RuNO(NO2)2(NO3)(H2O)2], [RuNO(NO2)(NO3)(H2O)2]+.
В
последние годы методом ЯМР на ядрах 14N, 15N, 17O и
99Ru показано, что в азотнокислых растворах, обработанных
нитритом натрия в интервале кислотности 2,7 - 0,12 моль/л доминирующими формами
рутения являются [RuNO(NO2)2(NO3)(H2O)2]0 и упомянутая выше динитроформа
[RuNO(NO2)2(H2O)3]+ [4]. К нитратодинитроформе авторы относят сигналы с химсдвигами
-10,8 м.д., 63,5 м.д. и 64,1 м.д. (транс-координаты O2NO−Ru−NO2, O2N−Ru−OH2 и
O2N−Ru−ONO2 соответственно).
.1.3
Нитратокомплексы нитрозорутения
Около
половины рутения, содержащегося в растворах ядерного топлива, находится в них в
виде нитрозонитратных комплексов [2]. По данным работ [11, ] в азотнокислых
растворах существуют несколько взаимосвязанных равновесий между нитратными
комплексами рутения, которые представлены на Рис. 3. Константы скорости реакции
ki, приведенные в табл. 2, определены в работе [26] (A0 -
многоядерный катионный комплекс без NO3-).
Приготовление
растворов, содержащих нитратокомплексы нитрозорутения, проводят кипячением
нитрозогидроокиси рутения в 8-14 М HNO3 в течение часа, что приводит
к образованию тринитратного комплекса [RuNO(H2O)2(NO3)3]
[5, 11, 26, , , ,].
Кроме
того, растворы нитратных комплексов нитрозорутения получают прямым
восстановлением RuO4 с помощью NO в растворе HNO3
или в CCl4. Предполагается, что при этом образуется димерное
соединение [(RuNO(η2-NO3)2)2(μ2-O)]. В случае синтеза в CCl4 затем
проводится экстракция 8 М HNO3. Дальнейшее нагревание азотнокислого раствора
приводит к образованию в основном тринитрата нитрозорутения [2, 5, ].
Табл.
2. Константы скорости для реакций, представленных на Рис. 3
|
С(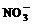 ), Mki·103, мин-1 ), Mki·103, мин-1
|
|
|
k1
|
k2
|
k5
|
k8
|
k9
|
k3
|
k4
|
k6
|
k7
|
k10
|
|
3
|
|
|
|
|
20
|
|
|
|
|
280
|
|
6,1
|
1,65
|
17,9
|
8,1
|
74,0
|
³17,0
|
36,5
|
4,3
|
0,7
|
11,1
|
³102
|
|
8,1
|
3,0
|
32,5
|
13,5
|
144
|
³68
|
37,4
|
4,5
|
0,72
|
11,7
|
³270
|
Нитратные растворы исследовались с помощью множества косвенных методов,
но все они не позволяли определить истинного строения соединений. Зачастую
формулы выводились из элементного анализа, который «не видит» ни геометрических
изомеров, ни случаев полимерии. Только в последние двадцать лет при
использовании ЯМР спектроскопии были получены надежные сведения о геометрии
комплексных частиц в азотнокислых растворах рутения.
2.2
Нитратокомплексы рутения, выделенные в виде кристаллических фаз
Поскольку из азотнокислых растворов рутения не удается выделить
индивидуальных нитратных комплексов в кристаллическом состоянии, следует
обратить внимание на нитратные комплексы рутения, образующиеся в других
системах.
Первая работа, посвященная достаточно надежной характеризации таких
комплексов, была опубликована в 1978 году. Кричлоу и Робинсон [] синтезировали
из [RuH2(CO)(PPh3)3] ряд
карбонил-нитратных комплексов рутения: [Ru(NO3)2(CO)(PPh3)2], [RuH(NO3)(CO)(PPh3)2], [Ru(NO3)2(CO)2(PPh3)2]. Кроме того, обработкой
концентрированной HNO3 раствора [RuH2(CO)(PPh3)3] или [Ru(OCOCH3)H(CO)(PPh3)3] в бензоле ими выделен [Ru(NO3)3(NO)(PPh3)(OPPh3)]
с выходом 56 % и 31 % соответственно. Идентификацию полученных соединений
проводили с помощью ИК спектроскопии и ЯМР 31P.
Спустя 16 лет Стидом и Точером были предложены методики синтеза [Ru(h3:h3-C10H16)Cl(NO3)], [Ru(h3:h3-C10H16)(NO3)2] и [Ru(h3:h3-C10H16)(NO3)2L], (L = CO, Py) [].
[Ru(h3:h3-C10H16)Cl(NO3)] получен перемешиванием раствора [{Ru(h3:h3-C10H16)Cl(m-Cl)2}2] в ацетоне с двумя эквивалентами AgNO3. Введение четырех эквивалентов AgNO3 позволило получить 16 е- комплекс [Ru(h3:h3-C10H16)(NO3)2].
В структуре данного комплекса h3:h3-C10H16 формирует тригонально-бипирамидальное окружение рутения, в
экваториальной плоскости находятся два координированных нитрат-иона, для
которых dRu-O = 2,55 Å. Рутений в целом имеет сильно
искаженное псевдотетраэдрическое окружение. Взаимодействие [Ru(h3:h3-C10H16)(NO3)2] с CO и пиридином приводило к образованию [Ru(h3:h3-C10H16)(NO3)2L], где L = СO и Py соответственно. Все полученные комплексы, содержащие
координированный NO3- охарактеризованы с помощью
ИК-спектроскопии, 1H-ЯМР. Комплексы Ru(h3:h3-C10H16)Cl(NO3)] и [Ru(h3:h3-C10H16)(NO3)2] - первые из нитратокомплексов
рутения, охарактеризованных методом РСА.
В последующие 10 лет было определено еще несколько кристаллических
структур таких комплексов. Геометрические характеристики координированных
нитратогрупп в соединениях рутения (расстояния и валентные углы) представлены в
табл. 1 Приложения.
В работе [] предложена методика синтеза ряда дирутениевых комплексов,
содержащих мостиковый нитрат-ион: [Ru2(CO)4(m,h2-NO3)2L2], где L = PPh3, PPh2(allyl),
PPh2Me, PPhMe2, PMe3.
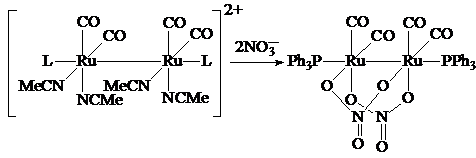
В
колбе Шленка растворяли [Ru2(CO)4(MeCN)4L2][BF4]2 и NaNO3 в MeOH. Затем раствор нагревали до 65º С и выдерживали 1 час. При охлаждении раствора до
комнатной температуры выпадал желто-оранжевый осадок, который затем
отфильтровывали и подвергали перекристаллизации из CH2Cl2.
Выход продукта реакции составляет 91 %. Полученные соединения охарактеризованы
методами ИК, ЯМР 31P и 1H спектроскопии. Данные элементного анализа на углерод,
азот и водород хорошо согласуются с теоретическими. Методом РСтА определена
кристаллическая структура [Ru2(CO)4(m,h2-NO3)2(PPh3)2].
Кроме
того, из [Ru2(CO)4(m,h2-NO3)2(PPh3)2]
были получены [Ru2(CO)4(h1-NO3)2(m-X)2(PPh3)2], где X = Br, I.
Соединения выделены в виде оранжево-желтых кристаллов при перемешивании
раствора [Ru2(CO)4(m,h2-NO3)2(PPh3)2]
в CH2Cl2 с соответствующим галогеном в течение 10 минут при
комнатной температуре, с последующей отгонкой растворителя. Затем продукт
перекристаллизовывали из смеси CH2Cl2 и гексана. Выход составил 94 % для [Ru2(CO)4(h1-NO3)2(m-I)2(PPh3)2]
и 90 % для бромпроизводного. Полученные соединения охарактеризованы методами
ИК, ЯМР 31P и 1H спектроскопии. Данные элементного анализа на углерод,
азот и водород хорошо согласуются с теоретическими. Методом РСтА определена
кристаллическая структура [Ru2(CO)4(h1-NO3)2(m-I)2(PPh3)2].
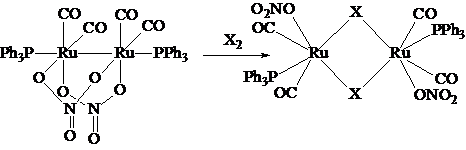
Гош и Чакраворти [] синтезировали RuII(η1-RL)(PPh3)2CO(η2-NO3) (R = Ph, p-MeC6H4, L = 4-метил-6-(NR-имино)фенолято-C2,O). Обработка дихлорметан-ацетонового раствора RuII(η2-RL)(PPh3)2(CO)Cl избытком водного раствора нитрата натрия при перемешивании
привела к изменению цвета с фиолетового на желтый. Из реакционной смеси
выделили продукт в виде блестящих желтых кристаллов. Соединения
охарактеризованы методами УФ, ИК (табл. 3) и ЯМР-1H спектроскопии, РСтА, элементного анализа на углерод, водород
и азот.
Табл.
3. Линии в ИК нитратокомплексов рутения
|
Соединение
|
n(NO), см-1
|
n3(NO3-), см-1
|
|
цис-[Ru(NO)(ONO2)(bpy)2](PF6)2∙H2O
|
1941
|
957
|
1522 1263
|
|
[RuNO(pdma)Cl(NO3)2]
|
1865 (ос)
|
1000 (ср)
|
1477 (ос) 1262 (ос)
|
|
a-[Ru(azpy)2(NO3)2]
|
|
989
|
1484 1274
|
|
RuII(η1-RL)(PPh3)2CO(η2-NO3)
|
|
1010
|
1520 1255
|
Готце с сотрудниками предложили методику синтеза a-[Ru(azpy)2(NO3)2], azpy = 2-(фенилазо)пиридин, a относится к изомеру, для которого координированные
пары лигандов ONO2, N(py) и N(azo) находятся в цис-, транс- и цис- положениях
соответственно []. Твердый AgNO3
добавляли к водной суспензии a-[Ru(azpy)2Cl2].
Полученный раствор перемешивали при 40 °С в течение 7 дней. Затем фильтрованием отделяли AgCl. К фильтрату добавляли 2,5-кратный
избыток этанола, после чего на ротационном испарителе отгоняли растворитель.
Сухой остаток растворяли в хлороформе, фильтровали. Далее раствор
концентрировали, отгоняя растворитель на ротационном испарителе, поддерживая
температуру 40 °С.
К раствору добавляли диэтиловый эфир. В результате были выделены пурпурные
кристаллы продукта. Выход составил 78%. Вещество охарактеризовано с помощью
РСтА, ИК (
Табл.
3), ЯМР 1H. Данные элементного анализа на углерод, азот и
водород хорошо согласуются с теоретическими.
Каталано
и Крейг синтезировали ряд комплексов [Ru2(6,6′-Me2dppz)(η6-p-cymene)2X2]n+,
где 6,6′-Me2dppz = 2,2′-(1H-pyrazole-3,5-diyl)bis(6-methylpyridine), а X = Cl-, NO3-, NO2- (n = 1), H2O, CH3CN (n = 3) []. Полученные соединения охарактеризованы
методами ЯМР 1H и УФ спектроскопии, методом РСтА определена
кристаллическая структура. Комплексы, содержащие координированные нитрит- и нитрат-ионы
охарактеризованы также с помощью ИК спектроскопии.
Као
с сотрудниками в работе [] приводят методики синтеза ряда нитрато-комплексов
рутения: (h5-Cp)Ru(CO)(L)ONO2, где L = AsPh3, PPh3, P(p-anisyl)3, P(o-anisyl)3, P(OPh)3.
Перед
приготовлением реакционной смеси колбу продували азотом, чтоб избежать контакта
с влагой. Раствор (h5-Cp)Ru(CO)(L)Cl в CH2Cl2 перемешивали с AgNO3 в течение
18 часов в темноте. Затем реакционную смесь фильтровали и концентрировали
раствор испарением растворителя. После добавления диэтилового эфира и гептана
из раствора осаждался мелкокристаллический желто-оранжевый осадок продукта
реакции. Для полученных соединений выход составляет от 77 до 89 %. Соединения
охарактеризованы методами ЯМР 13С и 1H спектроскопии. Данные
элементного анализа на углерод, азот и водород хорошо согласуются с
теоретическими. Методом РСтА определена кристаллическая структура (h5-Cp)Ru(CO)(AsPh3)ONO2.
Ксю
синтезировал первый дирутениевый комплекс, содержащий координированный нитрат -
Ru2(DMBA)4(NO3)2, где DMBA = N,N’-диметилбензамидинат
[]. В атмосфере аргона готовили раствор Ru2(DMBA)4Cl2 в
тетрагидрофуране, затем добавляли пятикратный избыток AgNO3, при этом
окраска раствора с темно-коричневой на зеленую. После перемешивания в течение
двух часов, реакционную смесь отфильтровывали, фильтрат экстрагировали
хлороформом. Удаление растворителя из экстракта давало темно-зеленые кристаллы.
Вещество охарактеризовано с помощью РСтА, Масспектроскопии, ИК, УФ, определены
его электрохимические характеристики.
В
настоящее время структурно охарактеризованы лишь два нитратокомплекса рутения,
содержащих координированную нитрозогруппу. Кои взаимодействием гран-[RuNO(pdma)Cl3],
pdma = 1,2-фениленбис(диметиларсин) с AgNO3
в ацетонитриле при комнатной температуре получил [RuNO(pdma)Cl(NO3)2]
с выходом 64 % []. Соединение охарактеризовано ИК спектроскопически (
Табл.
3). Данные элементного анализа на углерод, азот и водород хорошо согласуются с
теоретическими. Методом РСтА определена структура данного соединения.
Мукаида с сотрудниками синтезировали цис-[Ru(NO)(ONO2)(bpy)2]X2∙H2O, где Х = ClO4-,
PF6- []. К водной суспензии цис-[Ru(NO2)2(bpy)2]∙H2O добавляли HNO3
(конц.) до С(HNO3) = 1,5 M и выдерживали при 80º С три часа, накрыв часовым стеклом.
Затем раствор упаривали в два раза. При добавлении в раствор NH4PF6 выпадали оранжевые кристаллы продукта, которые
отфильтровывали, промывали холодной водой и высушивали на воздухе. Выход составил
76 %. Вещество охарактеризовано ИК (
Табл.
3) и ЯМР 13С спектроскопически, вольтамперометрически, с помощью РСтА
установлена структура.
Анализ литературных данных показывает, что для синтеза нитратокомплексов
рутения часто используются специальные условия: высокореакционноспособные
координационноненасыщенные исходные рутенийсодержащие комплексы, лигандный
обмен в органических растворителях.
Наиболее адекватными моделями аквакомплексов нитро- и
нитратонитрозорутения являются амминокомплексы, поскольку молекулы аммиака и
воды весьма близки по целому ряду параметров (заряд, размер, дипольный момент,
способность к образованию водородных связей и т.д.). Синтез и установление
структурных характеристик нитратоамминокомплексов нитрозорутения, образующихся
в крепких азотнокислых растворах, позволит судить о способах координации
нитрат-иона к рутению в растворах отработанного ядерного топлива, геометрии
образующихся комплексов, их константах устойчивости и получить другую
фундаментальную информацию о состоянии рутения в этих растворах.
Результаты
работы [40] позволяют предположить, что нитратоамминокомплексы нитрозорутения
могут быть получены в виде индивидуальной кристаллической фазы при обработке
нитроамминокомплексов азотной кислотой.
3.
Экспериментальная часть
.1 Исходные
реагенты, аппаратура и методы измерений
В работе использовались: дистиллированная вода, водный раствор аммиака
марки о.с.ч., соляная кислота х.ч., нитрит натрия х.ч., этиловый
спирт-ректификат, ацетон х.ч., диэтиловый эфир (медицинский), азотная кислота
(16,6 М) о.с.ч. Реагенты обогащенные изотопом 15N: кислота азотная-15N (wm(H15NO3) = 47 %,
обогащение по изотопу 15N: 98
%), нитрит натрия-15N (обогащение по
изотопу 15N: 95 %).
В качестве исходных рутенийсодержащих соединений были использованы
треххлористый рутений марки ч. с содержанием рутения 46,51 % производства КЗЦМ,
(NH4)2[RuNOCl5] и ос-[RuNO(NH3)2Cl3], синтезированные и идентифицированные в лаборатории химии
редких платиновых металлов ИНХ СО РАН.
Рентгенографические исследования соединений проведены на дифрактометре
ДРОН-3М (R = 192 мм, CuKa
излучение, Ni-фильтр, детектор сцинтилляционный с амплитудной дискриминацией) в
области углов 2q от
5 до 50о при комнатной температуре. Образцы наносили тонким слоем на гладкую
сторону стандартной кварцевой кюветы. Практически все дифрактограммы, за
исключением транс-[RuNO(NH3)2(NO3)2(H2O)]NO3∙H2O, полностью проиндицированы по данным
исследований отобранных монокристаллов, что подтверждает однофазность
полученных продуктов. Дифрактограммы транс-[RuNO(NH3)2(NO3)2(H2O)]NO3∙H2O содержат ряд
«лишних» линий, что свидетельствует о наличии кристаллических фаз иного
строения в составе этого продукта.
Параметры элементарных ячеек и экспериментальные интенсивности для
расшифровки кристаллических структур полученных комплексов измерены на
автоматических дифрактометрах Bruker AXS P4 и Enraf-Nonius СAD-4 (MoKa-излучение, графитовый монохроматор, q/2q-сканирование в области углов q 1,5-30° при комнатной температуре и при температуре жидкого азота).
Структуры расшифрованы стандартным методом тяжелого атома и уточнены в
анизотропно-изотропном (для Н) приближении, атомы водорода заданы
геометрически. Все расчеты проведены по комплексу программ SHELX-97 [].
ИК спектры поликристаллических образцов в виде суспензии в вазелиновом и
фторированном масле или в таблетках KBr записывали на спектрофотометрах Specord IR-75 и Scimitar FTS 2000 в области
3800-400 см-1.
Спектры
ЯМР 14N и 15N водных растворов записывали на спектрометре CXP-300
“Bruker” на частотах 21,68 и 30,42 МГц соответственно. Спектры ЯМР 15N
накапливали с периодом 100 с. Химические сдвиги (ХС) в шкале d (м. д.) отсчитывали от линий внешних эталонов: 1 М NaNO3 (14N)
или K15NO3 (15N). Погрешность определения d зависит от ширины линии и составляет для 15N не более 0,1 м. д. для
14N - не более 2 м. д. Полученные спектры ЯМР обрабатывали с помощью пакета
программ Nuts Pro 6,0 [6].
Термогравиметрический
анализ полученных соединений проводили на двух приборах. Основную часть ДТА
осуществляли на дериватографе Paulic-Erdey Q-1000, модифицированном для
съемки в различных газовых средах с оцифровкой аналогового сигнала. Масса
навесок составляла 100-200 мг при точности определения массы 0,1 мг. Потерю
массы, зафиксированную термовесами TG 209 F1 Iris®
фирмы NETZSCH, контролировали дополнительными взвешиваниями на
аналитических весах (точность 0,1 мг) до и после нагревания. Разложение
проводили в токе гелия (скорость потока 30 мл/мин) в открытом Al2O3-тигле
при скоростях нагрева 10 °С/мин. В качестве стандарта на термопаре сравнения
применяли прокаленный до 1000 °С Al2O3.
Полученный массив данных: T (°C), TG (относительные единицы, о.е.), DTG
(о.е.), DTA (°C) - обрабатывали с помощью пакета программ OriginPro 7,5 [].
Синхронный
термический анализ (СТА), который включал в себя одновременное проведение
термогравиметрических определений (TГ), дифференциальной сканирующей
калориметрии (ДСК) и масс-спектрометрического анализа выделенного газа (АВГ-МС)
проводили на термоанализаторе Netzsch STA 409 PC Luxx,
выпускаемый с прилагаемым пакетом программ по обработке результатов, среди
которых для расчета тепловых эффектов и анализу термогравиметрических данных
нами была использована Proteus analysis []. Масса навесок
составляла ~10 мг. Разложение соединений проводили в токе гелия 60 мл/мин в открытом
Al2O3-тигле при скорости нагрева 10 °С/мин. Стандарт тот же. Для изучения состава газообразных продуктов
термолиза прибор был совмещен с газовым анализатором, масс-спектрометром QMS
100 Series.
Операции
взвешивания проводили на аналитических весах ВЛА-М и технических весах ВЛТК,
точность взвешивания ±0,2 мг и ±0,1 г
соответственно.
.2 Синтез
исходных рутенийсодержащих соединений и исследование их превращений
Использованные в работе комплексные соединения рутения синтезированы нами
по методикам, опубликованным в следующих работах: Na2[Ru15NO(15NO2)4OH]·2H2O - [], транс-[RuNO(NH3)2(NO2)2OH] -
[], ос-[RuNO(NH3)3(NO2)OH]Cl*0,5H2O - [], ос-[RuNO(NH3)3(H2O)Cl]Cl2 - [], транс-[RuNO(NH3)4OH]Cl2
[]. ИК спектры полученных препаратов хорошо согласуются с опубликованными в
этих работах и в [], дифрактограммы полностью совпадают с приведенными в банке
дифракционных данных для поликристаллов PDF [] и теоретическими дифрактограммами, построенными по
монокристальным данным.
Приготовление растворов для ЯМР-исследований.
Растворением 0,5 ммоль Na2[Ru15NO(15NO2)4OH]·2H2O в 5 мл воды был
приготовлен 0,1 М водный раствор тетранитрокомплекса. Азотнокислые растворы
рутения для исследования методом ЯМР готовили следующим образом: к водному
раствору Na2[Ru15NO(15NO2)4OH]·2H2O добавляли порциями обогащенную по
изотопу 15N концентрированную азотную кислоту
при комнатной температуре. Спектры ЯМР 15N полученных растворов регистрировали непосредственно сразу
после добавления HNO3 и повторно
спустя несколько десятков дней. Составы растворов и характеристики их спектров
ЯМР приведены в Табл. 2 и 3 Приложения.
Спектры ЯМР 14N были записаны
для раствора 0,08 г транс-[RuNO(NH3)2(NO3)2(H2O)]NO3∙H2O в 3 мл воды и раствора, полученного
нагреванием взвеси 0,145 г гран-[RuNO(NH3)2(NO3)3] в 3 мл воды до полного растворения.
Исследование поведения нитроамминокомплексов нитрозорутения в
азотнокислых растворах.
К навеске 0,10 г (3,6·10-4 моль) ос-[RuNO(NH3)3(NO2)OH]Cl*0,5H2O добавляли 12 мл 3 М HNO3, нагревали раствор до кипения и кипятили в течение
получаса. Окраска раствора при этом постепенно меняется с желто-коричневой на
красную. После охлаждения и частичного испарения раствора при комнатной
температуре из раствора выделились оранжево-коричневые кристаллы комплекса ос-[RuNO(NH3)3(H2O)Cl](NO3)2, строение
которого было установлено методами РСА и ИК спектроскопии.
Навеску 0,50 г (1,8×10-3 моль) транс-[RuNO(NH3)2(NO2)2OH] нагревали с 15 мл 3 М HNO3. Реакционную смесь кипятили до
прекращения газовыделения и перехода окраски раствора из желтой в красную.
Полученный красный раствор упарили до объема 2 мл. К охлажденному
сиропообразному раствору темно-красного цвета добавили 1 мл воды и оставили при
комнатной температуре. Через несколько суток из раствора выделились
желто-оранжевые кристаллы комплекса транс-[RuNO(NH3)2(NO3)2(H2O)]NO3∙H2O, строение
которого было установлено методами РСА, ИК и ЯМР 14N спектроскопии.
Исследование поведения комплекса транс-[RuNO(NH3)4OH]Cl2 в азотнокислых растворах.
Взаимодействие с 8 М HNO3.
Навеску 0,49 г (1,7·10-3 моль) транс-[RuNO(NH3)4OH]Cl2 частично растворяли в 7,5 мл H2O. Затем добавляли
7,5 мл 16,6 М HNO3, при этом наблюдалось помутнение
раствора, количество осадка значительно увеличивалось. Далее раствор с осадком
нагревали до полного растворения осадка, и образования темно-желтого раствора.
Полученный раствор продолжали нагревать при умеренном кипении. Окраска раствора
при этом постепенно менялась с темно-желтой на оранжевую, начинал выпадать
желто-оранжевый мелкокристаллический осадок. Раствор нагревали до тех пор (в
общей сложности около часа), пока наблюдалось выпадение осадка. Реакционную
смесь охлаждали до комнатной температуры. Затем раствор охлаждали ледяной
водой, при этом наблюдалось выпадение еще некоторого количества
мелкокристаллического осадка. Осадок отфильтровывали через воронку с пористым
стеклянным фильтром (40 пор). При промывании водой существенная часть
кристаллического продукта растворялась. Оставшийся на фильтре продукт
промывали~ 1 мл спирта и эфира и сушили в токе воздуха.
Перекристаллизацией полученного продукта из горячего водного раствора
были получены кристаллы комплекса транс-[RuNO(NH3)4NO3](NO3)2, строение которого было установлено методами РСА, ИК.
Испарение водного промывного раствора при комнатной температуре привело к
кристаллизации желтых кристаллов в виде хорошо ограненных призм. Анализом
полученных кристаллов методами РСА, ИК установлено строение комплекса: транс-[RuNO(NH3)4(Н2О)](NO3)3.
Взаимодействие с 16,6 М HNO3.
К навеске 0,49 г (1,7·10-3 моль) транс-[RuNO(NH3)4OH]Cl2 добавляли 15 мл 16,6 М HNO3, и при этом наблюдалось изменение характера и
интенсивности окраски желтого осадка. Полученную реакционную смесь нагревали.
Уже при слабом нагревании было заметно выделение красно-коричневых газообразных
продуктов реакции, становящееся бурным при нагревании реакционной смеси до
кипения. Кипячение в течение 2-3 минут приводило к почти полному растворению
исходного осадка и образованию мутного желто-оранжевого раствора. В течение
следующих 2-3 мин кипячения газовыделение практически прекращалось, раствор
становился прозрачным, интенсивность его окраски падала, и из него выделялся
новый, более плотный осадок желто-оранжевого цвета. Продолжение нагревания при
умеренном кипении приводило к медленному растворению этого осадка. Окраска
раствора при этом постепенно менялась на насыщенную красную. По истечении 50
минут с начала нагревания выпадало небольшое количество нового
мелкокристаллического осадка красного цвета. Охлаждение реакционной смеси до
комнатной температуры приводило к значительному увеличению количества этого
красного осадка. Осадок отфильтровывали через воронку с пористым стеклянным
фильтром (40 пор), промывали 1 мл воды, спирта и эфира и сушили в токе воздуха.
Сухой осадок имеет красно-коричневую окраску. Состав и строение образовавшегося
комплекса - гран-[RuNO(NH3)2(NO3)3] было установлено методами ИК и ЯМР 14N спектроскопии.
Эксперименты по определению состава газообразных продуктов реакции.
Были проведены эксперименты по определению состава газообразных продуктов
реакции при синтезе транс-[RuNO(NH3)4NO3](NO3)2
и гран-[RuNO(NH3)2(NO3)3].
Грушевидную колбу на 100 мл с реакционной смесью соединяли через обратный
холодильник, охлаждаемый проточной водой, с газовым шприцем. Полученную систему
перед началом нагревания реакционной смеси продували аргоном. Реакционную смесь
в обоих случаях готовили, добавляя 60 мл 16,6 М HNO3 к навеске 2 г транс-[RuNO(NH3)4OH]Cl2. Затем реакционную смесь нагревали до кипения. При синтезе
транс-[RuNO(NH3)4NO3](NO3)2 соединение газового шприца с
реакционной системой перекрывали через 10 минут после начала нагревания. В
случае синтеза гран-[RuNO(NH3)2(NO3)3] образец газовой фазы, собравшийся в газовом шприце в
первые 20 минут, содержащий газообразные продукты реакции получения транс-[RuNO(NH3)4NO3](NO3)2 сбрасывали в атмосферу. Затем
систему продували аргоном, подключали газовый шприц и собирали порцию
газообразных продуктов реакции в течение последующих 30 минут. Для анализа
газовой фазы методом ИК спектроскопии газовую кювету продували аргоном, затем
заполняли при низкой скорости подачи газа порцией газообразных продуктов
реакции из газового шприца и проводили запись ИК спектра. В случае
Масс-спектроскопического анализа газовый шприц с образцом газовой фазы
непосредственно присоединяли к входу масс-спектрометра.
В
результате дальнейших исследований при варьировании различных параметров
эксперимента (продолжительность нагревания, C(HNO3),
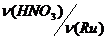 ) были выявлены оптимальные условия выделения каждого
из полученных комплексов в виде индивидуальной фазы и с наибольшим выходом,
которые приведены в следующем разделе.
) были выявлены оптимальные условия выделения каждого
из полученных комплексов в виде индивидуальной фазы и с наибольшим выходом,
которые приведены в следующем разделе.
.3 Синтез
комплексов нитрозорутения
Синтез нитрата ос-хлороакватриамминнитрозорутения (II)
Навеску 0,10 г (3,6·10-4 моль) ос-[RuNO(NH3)3(H2O)Cl]Cl2 растворяли в 1,5 мл воды, затем
добавляли 1,5 мл 16,6 М HNO3.
Кристаллизация оранжево-коричневого продукта реакции начиналась практически
сразу после добавления кислоты. Добиваясь полноты осаждения продукта реакции,
раствор выдерживали при комнатной температуре в течение нескольких часов.
Кристаллический продукт отфильтровывали через воронку с пористым стеклянным
фильтром (40 пор), промывали 1 мл спирта и эфира и сушили в токе воздуха. Выход
ос-[RuNO(NH3)3(H2O)Cl](NO3)2 составил 62
%.
Синтез моногидрата нитрата транс-динитратоаквадиамминнитрозорутения (II)
Навеску 0,5 г транс-[RuNO(NH3)2(NO2)2OH]
растворяли в 15 мл 3 M HNO3 при нагревании. Полученный раствор
кипятили на плитке до прекращения выделения оксидов азота, после чего испаряли
на водяной бане до минимального объема. К охлажденному сиропообразному раствору
темно-красного цвета добавляли несколько капель воды до резкого уменьшения
вязкости и оставляли при комнатной температуре. По истечению несколько часов из
раствора выделяется желтый мелкокристаллический осадок целевого комплекса,
который отфильтровывали, промывали водно-спиртовой смесью, спиртом и эфиром и
сушили в токе воздуха. Выход составляет 45 - 50 %.
Синтез нитрата транс-акватетраамминнитрозорутения (II)
Навеску 0,12 г (4,2×10-4 моль) [RuNO(NH3)4OH]Cl2 растворяли в 10 мл воды, затем добавляли 10 мл 6 М HNO3 и выдерживали раствор при комнатной
температуре. Спустя сутки появлялись желтые кристаллы продукта реакции. Желтый
кристаллический продукт отфильтровывали через воронку с пористым стеклянным
фильтром (40 пор). Выход транс-[RuNO(NH3)4(H2O)](NO3)3 составляет 20-30 %. Выход
комплекса может быть значительно увеличен до близкого к количественному при
испарении маточного раствора до минимального объема при комнатной температуре.
Синтез нитрата транс-нитратотераамминнитрозорутения (II)
В круглодонной колбе с обратным холодильником к навеске 0,13 г (4,4·10-4
моль) [RuNO(NH3)4OH]Cl2 добавляли 5 мл 16,8 М HNO3. При этом наблюдалось изменение
характера и интенсивности окраски желтого осадка. Последующее нагревание
реакционной смеси до кипения сопровождалось бурным выделением красно-коричневых
газообразных продуктов реакции, происходило почти полное растворение исходного
осадка и образованию мутного желто-оранжевого раствора. В течение следующих 2-3
мин кипячения газовыделение практически прекращалось, раствор становился
прозрачным, интенсивность его окраски падала, и из него выделялся новый, более
плотный осадок желто-оранжевого цвета. Затем реакционную смесь охлаждали до
комнатной температуры. Желтый кристаллический продукт отфильтровывали через
воронку с пористым стеклянным фильтром (40 пор), промывали 1 мл воды, спирта и
эфира. Выход транс-[RuNO(NH3)4(NO3)](NO3)2
составляет 80-95 %.
Для очистки полученный кристаллический продукт реакции перекристаллизовывали
из горячей воды.
Синтез гран-тринитратодиамминнитрозорутения (II)
В круглодонной колбе с обратным холодильником к навеске 0,52 г (1,8·10-3
моль) [RuNO(NH3)4OH]Cl2
добавляли 15 мл 16,8 М HNO3.
в круглодонной колбе с обратным холодильником. При этом наблюдалось изменение
характера и интенсивности окраски желтого осадка. Последующее нагревание
реакционной смеси до кипения сопровождалось бурным выделением газообразных
продуктов реакции красно-коричневой окраски. Кипячение в течение 2-3 минут
приводило к почти полному растворению исходного осадка и образованию мутного
желто-оранжевого раствора. В течение следующих 2-3 мин кипячения газовыделение
практически прекращалось, раствор становился прозрачным, интенсивность его
окраски падала, и из него выделялся новый, более плотный осадок
желто-оранжевого цвета. Продолжение нагревания при умеренном кипении приводило
к медленному растворению этого осадка. Окраска раствора при этом постепенно
менялась на насыщенную красную. По истечении 50 минут с начала нагревания выпадало
небольшое количество нового мелкокристаллического осадка красного цвета.
Охлаждение реакционной смеси до комнатной температуры приводило к значительному
увеличению количества этого красного осадка. Осадок отфильтровывали через
воронку с пористым стеклянным фильтром (40 пор), промывали 1 мл воды, спирта и
эфира и сушили в токе воздуха. Сухой осадок имеет красно-коричневую окраску.
Выход гран-[RuNO(NH3)2(NO3)3]
составляет 60 %.
4. Результаты
и обсуждение
.1 Поведение
[RuNO(NO2)4OH]2-
в азотнокислых растворах
Состав, строение и взаимопревращения комплексных форм рутения,
доминирующих в реакции взаимодействия нитрозотетранитрокомплекса рутения с
азотной кислотой, исследованы нами методом ЯМР на ядре 15N. Первичные данные (химические сдвиги
и относительные интенсивности сигналов) приведены в Приложении (табл. 3).
При отнесении линий в спектрах мы руководствовались последовательностью
появления сигналов в ходе процесса, принципом смещения положения равновесия и
однозначной связью интенсивности сигналов индивидуальных форм с их
концентрацией, а также гипотезой о близком положении линий ЯМР ядер азота на
одинаковых транс-координатах в разных комплексах. Поскольку каждая комплексная
форма рутения в исследованной системе содержит одну координированную нитрозогруппу,
относительная интенсивность сигнала от этой группы пропорциональна доле этой
формы в растворе. Оценку относительного содержания комплексных форм мы
проводили из соотношения интенсивностей сигнала соответствующей нитрозогруппы и
свободного нитрат-иона с учетом аналитических концентраций рутения и введенной
в систему азотной кислоты.
В
спектре ЯМР 15N исходного 0,1 М водного раствора Na2[Ru15NO(15NO2)4OH]
(Рис. 4.) в области химсдвигов координированной нитрозогруппы присутствуют два
сигнала: на -37,8 м.д. и -32,3 м.д. В области химсдвигов координированной
нитрогруппы наблюдаются сигналы на 89,4 м.д. и 96,1 м.д. с соотношением
интенсивностей 1 : 2, а так же интенсивный сигнал на 94,0 м.д.
В
соответствии с результатами работ [8, 24] интенсивные сигналы на -37,8 м.д. и
94,0 м.д. с соотношением интенсивностей 1 : 4, отвечающие транс-координатам HO-Ru-NO и O2N-Ru-NO2
соответственно, мы отнесли к исходной комплексной форме [RuNO(NO2)4OH]2-
(форма А).
Три
сигнала на -32,3 м.д., 89,4 м.д. и 96,1 м.д. с соотношением интенсивностей 1 :
1 : 2, отвечающие транс-координатам HO-Ru-NO, HO-Ru-NO2 и
O2N-Ru-NO2 мы отнесли к [RuNO(NO2)3(H2O)OH]-
(форма Б), в соответствии с результатами работ [4, 24]. Эта форма
нитрозорутения образуется в растворе в соответствии со следующим равновесием:
На
232,5 м.д. присутствует сигнал от NO2-, по интенсивности равный
сигналам транс-координат HO-Ru-NO, HO-Ru-NO2, отвечающих [RuNO(NO2)3(H2O)OH]-.
Так же наблюдается малоинтенсивный сигнал 208,8 м.д. в области химсдвигов,
обычно относимых к свободной азотистой кислоте. Однако от протонированной и
депротонированной форм нитрит-иона должен наблюдаться один обменный сигнал,
поэтому линию 208,8 м.д., следует отнести к координированной азотистой кислоте HO2N-Ru-NO2
либо к координированной нитритогруппе ONO-Ru-NO2.
Подкисление
водного раствора до C(H15NO3) = 0,10 M, приводит к кардинальному
изменению ЯМР 15N спектра. В области химсдвигов координированной
нитрозогруппы присутствуют уже пять сигналов на -28,0 м.д., -27,7 м.д., -15,3
м.д., -14,9 м.д., и -8,8 м.д. В области химсдвигов координированной нитрогруппы
наблюдаются семь сигналов: два в области, отвечающей транс-координате H2O-Ru-NO2
(65,7 м.д. и 67,4 м.д.), пять в области, отвечающей транс-координатам HO-Ru-NO2 и
O2N-Ru-NO2 (79,7 м.д., 82,4 м.д., 84,0 м.д., 87,3 м.д., и 88,7
м.д.). Наиболее интенсивные сигналы на -14,9 м.д., и 88,7 м.д. с соотношением
интенсивностей 1 : 4, отвечают исходной комплексной форме [RuNO(NO2)4OH]2-.
Изменение химических сдвигов сигналов этой формы относительно нейтрального
раствора, особенно заметное для координированной нитрозогруппы, связано с
частичным протонированием координированной гидроксогруппы и с изменением
координаты HO-Ru-NO на H2O-Ru-NO:
[RuNO(NO2)4OH]2- + H+ = [RuNO(NO2)4(H2O)]-.
Кроме
того, в области химсдвигов азотистой кислоты (либо нитритогруппы) наблюдается
уже три сигнала: 201,5 м.д., 202,5 м.д., 203,2 м.д.
Анализ
ЯМР 15N спектров полученного раствора, записанных спустя 1
день, 8 дней и 22 дня после подкисления показал, что количество сигналов в
спектре остается постоянным, постепенно падает интенсивность сигналов,
отвечающих исходной тетранитро-форме А и синхронно возрастает интенсивность
остальных сигналов в областях транс-координат ON-Ru-OH2, HO-Ru-NO2, H2O-Ru-NO2 и
O2N-Ru-NO2. Это связано с протонированием координированных
нитрогрупп и дальнейшим образованием тринитро-формы Б, в соответствии со
следующим равновесием:
[RuNO(NO2)4OH]2- + H2O + H+ = [RuNO(NO2)3(H2O)OH]- +
HNO2;
Проведенный
анализ интенсивностей сигналов в ЯМР спектрах азотнокислых растворов с С(H15NO3)
= 0,10-0,15 М показал, что сигналы с химсдвигами -14,5 м.д., 65,8 м.д., 79,5
м.д., 84,8 м.д. имеют примерно равную интенсивность, появляются одновременно и
синхронно возрастают при подкислении и выдерживании раствора. Эти сигналы были
отнесены нами к димерной тринитроформе [RuNO(NO2)3(m-OH)]22- (форма В), строение калиевой соли которой было
установлено методом РСА в работе [25]. Форма В появляется в растворе при подкислении
в результате установления следующего равновесия:
2[RuNO(NO2)4OH]2- + 2H+ = [RuNO(NO2)3(m-OH)]22- + 2HNO2.
Впервые
форма В регистрируется в ЯМР спектре раствора, записанного сразу после
подкисления до С(H15NO3) = 0,10 М. В этом растворе доля формы В составляет
9-12 %, Последующее подкисление и выдерживание раствора приводит к постепенному
росту доли формы В вплоть до 35 % в растворе с С(H15NO3)
= 0,15 М через 47 дней после подкисления (Рис. 5.). Дальнейшее подкисление
приводит к монотонному уменьшению доли формы В и в спектре ЯМР 15N,
записанном сразу после подкисления раствора до С(H15NO3)
= 0,70 М доля этой формы составляет 3-4 %.
Изменение
C(H15NO3) с 0,15 до 0,24 M не приводят к
существенным качественным изменениям в спектрах, но изменяется соотношение
интенсивностей сигналов (Рис. 6.). Наблюдается синхронный рост сигналов с
химсдвигами -23,6 м.д. и 60,4 м.д., интенсивности которых относятся, как 1 : 2.
Учитывая положение сигналов, мы их отнесли к транс-координатам H2O-Ru-NO и H2O-Ru-NO2
соответственно, а следовательно к комплексной форме гран-[RuNO(NO2)2(H2O)3]+
(форма Г). Цис-динитро-форма Г образуется в результате протонирования и выхода
из внутренней координационной сферы рутения второй нитрогруппы:
[RuNO(NO2)3(m-OH)]22- + 4H2O + 4H+ = 2[RuNO(NO2)2(H2O)3]+
+
2HNO2
Доля
цис-динитроформы Г достигает своего максимума в свежеприготовленном растворе,
подкисленном до С(H15NO3) = 0,65 М, где составляет 47-56 %. При
дальнейшем подкислении доля формы Г постепенно падает, и в свежеприготовленном
растворе подкисленном до С(H15NO3) = 4,00 М составляет величину 8-9 %.
В
спектрах ЯМР 15N, записанных для растворов с С(H15NO3) > 0,24 М, наблюдается симбатный рост четырех линий равной интенсивности
с химсдвигами -20,5 м.д., -11,1 м.д., 63,1 м.д. и 63,3 м.д (см. Рис. 7.). В
соответствии с результатами, полученными в работе [4], эти сигналы мы отнесли к
транс-координатам H2O-Ru-NO, O2N-Ru-ONO2, H2O-Ru-NO2,
и O2NO-Ru-NO2
соответственно и, как следствие, к комплексной форме цис-[RuNO(NO2)2(NO3)(H2O)2]
(форма Д). Образование этой формы связано с ростом концентрации свободного
нитрат-иона по мере увеличения С(H15NO3) и конкуренцией между H2O и NO3-
за место во внутренней координационной сфере нитрозорутения:
[RuNO(NO2)2(H2O)3]+ + NO3- =
[RuNO(NO2)2(NO3)(H2O)2] + H2O.
Доля
формы Д в растворе растет с увеличением концентрации азотной кислоты с
0,24-0,65 М, в растворах с С(H15NO3) = 0,65-3,20 М она практически постоянна, и
составляет величину порядка 12-13 %.
Мы
провели оценку константы равновесия вхождения нитрат-иона во внутреннюю сферу
нитрозодинитрокомплекса (Табл. 4.). Расчет отношения концентраций форм рутения
был проделан нами двумя способами: из отношения интенсивностей сигналов
соответствующих нитрозогрупп (KNO) и из отношения интенсивностей сигналов соответствующих
нитрогрупп (KNO2):
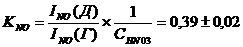 (P=0,95);
(P=0,95);
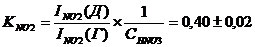 (P=0,95)
(P=0,95)
Полученные
результаты хорошо согласуются между собой, что подтверждает правильность
отнесения линий в спектрах и адекватность предложенной методики оценки
константы. Отметим, что спектры каждого из растворов записывались сразу после
приготовления растворов (время записи около 2 часов) и спустя несколько
десятков дней после приготовления. Как можно видеть из данных таблицы, значения
констант не имеют явной тенденции к увеличению или уменьшению с увеличением
времени выдерживания раствора. Это свидетельствует о том, что двух часов вполне
достаточно для установления равновесия между этими двумя формами.
Химические
сдвиги идентифицированных нами комплексных форм рутения и значения
аналитической концентрации HNO3 в растворе, при которых эти формы являются
доминирующими, приведены в Табл. 5.
С
повышением концентрации азотной кислоты до 2,3 М и выше, спектры ЯМР 15N
заметно усложняются (Рис. 8.). Падает интенсивность сигналов азотсодержащих
лигандов, возрастает количество линий, отвечающих координированной
нитрозогруппе, а сами линии заметно уширяются. Все это указывает на образование
полимерных комплексных форм рутения, первые предположения о существовании
которых в азотнокислых растворах нитрозорутения высказаны в работах [2, 5, ]. В
работах [2, 4, 10] предполагается, что эти формы содержат мостиковые
гидроксогруппы.
Помимо
гидроксидных мостиков, комплексы могут объединяться в олигомеры и за счет
бидентатно-мостиковой координации нитрат-ионов. Так, в работах [1, ] методом
ЯМР 103Rh, 14N, 15N и 17O показано, что в модельных азотнокислых
нитритно-нитратных растворах ОЯТ существенная часть родия существует в виде
олигомерных комплексных форм, содержащих мостиковые гидроксо- и нитрато-группы.
Примеры этих форм представлены на Рис. 9.
В
ходе проведенных исследований остался не до конца выясненным еще один вопрос. В
неподкисленном растворе нитрозотетранитрогидроксорутената наблюдаются две линии
с химсдвигами свободного нитрита и азотистой кислоты, вместо одного обменного
сигнала. При подкислении раствора сначала происходит постепенное увеличение
количества и интенсивности линий в этой области, затем количество линий и их
интенсивность уменьшаются (Рис.). Авторы [4] также наблюдали набор линий в
области химсдвигов ~200 м.д. в спектре ЯМР 15N
нитритно-нитратного азотнокислого раствора рутения и предположили, что эти
линии могут относиться к протонированной координированной нитрогруппе или, как
её еще можно назвать, координированной азотистой кислоте, либо к
координированному атомом кислорода нитрит-иону. Точное отнесение сигналов в
этой области к конкретным химическим формам пока представляется затруднительным.
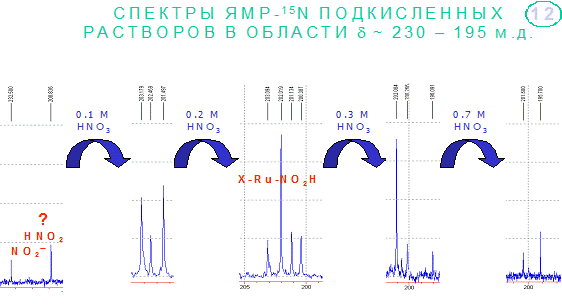
Рис. 2. Изменения спектров ЯМР 15N 0,1 М водного раствора Na2[Ru15NO(15NO2)4OH] в области
химсдвигов 230-200 м.д., наблюдаемые при подкислении раствора
4.2 Синтез
исследование нитратсодержащих комплексов нитрозорутения
Колебательные частоты свободного и координированного нитрат-иона,
проявляющиеся в ИК спектрах описанных в литературе соединений (по данным
Накомото []), представлены в табл. 4.
Табл. 4. Линии в ИК спектрах внешнесферного и координированного NO3-
|
n1, см-1
|
n2, см-1
|
n3, см-1
|
n4, см-1
|
|
NO3-(свободн.)
|
1050 - 1018
|
831 - 807
|
1400 - 1350 (ос)
|
726 - 697
|
|
NO3-(коорд.)
|
1035 - 970 (с)
|
830 - 815
|
1530 - 1480 1290 - 1250
|
800 - 760
|
Отнесение линий в ИК спектрах полученных нами соединений, межатомные
расстояния и валентные углы в кристаллических структурах приведены в Приложении
(Табл. 4 и 5-7).
ос-[RuNO(NH3)3(H2O)Cl](NO3)2.
В
ИК спектре полученного ос-[RuNO(NH3)3(H2O)Cl](NO3)2 присутствуют частоты характерные для
внешнесферного нитрат-иона: n3(NO3-)вн + ds(NH3) (1356 см-1), n1(NO3-)вн (1049 см-1), n2(NO3-)вн (823 см-1), n4(NO3-)вн (726 см-1 и 702 см-1) и отсутствуют частоты,
характерные для координированного нитрат-иона. Частота ν(NO)
проявляется в области характерной для комплексов, содержащих транс-координату H2O-Ru-NO (1914 см-1). В спектре присутствуют
полосы колебаний координированной воды: ν(H2O) + n(NH3) (3198 см-1) и δ(H2O)
(1600 см-1). Остальные частоты в спектре сходятся с частотами ИК спектров
триамминовых комплексов нитрозорутения [46, 47, ].
Кристаллическая
структура данного соединения в литературе ранее не была описана. Полученный
нами ос-[RuNO(NH3)3(H2O)Cl](NO3)2 был охарактеризован методом монокристального
рентгеноструктурного анализа (Пр. гр. Cc; a = 13,792(1) Å, b = 6,911(1) Å, c = 12,358(1) Å; b = 111,86(1)°; R =
0,019). Межатомные расстояния и валентные углы приведены в Приложении (Табл.
5).
Кристаллическая
структура относится к островному типу, построена из комплексных катионов [RuNO(NH3)3Сl(H2O)]2+
и внешнесферных нитрат-анионов (NO3)- (Рис. 1. в Приложении).
Координационный
полиэдр рутения слегка искаженный октаэдр, в экваториальной плоскости которого
находятся три молекулы аммиака и атом хлора. Расстояния Ru-N лежат в узком интервале Ru-N 2,089 - 2,102 (ср.2,095) Å, длина связи Ru-Cl
равна 2,373 Å. Нитрозо-группа и молекула воды занимают аксиальные
позиции. Расстояние Ru-O(W)
2,051 Å, геометрия фрагмента Ru-NO (1,726, 1,146 Å и 177,1°) обычна и согласуется с литературными данными [46,
47]. Отклонения валентных углов от 90° на атоме Ru не
превышают 6,8°. Атом рутения смещен из экваториальной плоскости в
сторону NO-группы на 0,16 Å.
В
структуре два кристаллографически независимых внешнесферных аниона (NO3)-,
средние значения длин связей N-O и валентных
углов O-N-O в них имеют оценки 1,253 Å и 120°. Угол между нормалями к
плоскостям двух независимых анионов составляет 86,1°.
Таким
образом, кипячение раствора ос-[RuNO(NH3)3(NO2)OH]Cl в 3 М HNO3 приводит к удалению координированной нитро-группы,
протонированию гидроксо-группы и вхождению внешнесферного хлорид-иона во
внутреннюю сферу нитрозорутения, координации нитрат-иона не происходит.
Продуктом реакции является ос-[RuNO(NH3)3(H2O)Cl](NO3)2.
[RuNO(NH3)3(NO2)OH]Cl + 2 HNO3 =
[RuNO(NH3)3(H2O)Cl](NO3)2 + “HNO2”.
Полученный
в ходе этой реакции триамминовый комплекс может быть синтезирован с
существенным выходом по более простой методике: взаимодействием ос-[RuNO(NH3)3(H2O)Cl]Cl2 с
8 М HNO3 при комнатной температуре:
[RuNO(NH3)3(H2O)Cl]Cl2 + 2 HNO3 =
[RuNO(NH3)3(H2O)Cl](NO3)2 + 2 HCl.
транс-[RuNO(NH3)2(NO3)2(H2O)]NO3·H2O.
В ИК спектре полученного транс-[RuNO(NH3)2(NO3)2(H2O)]NO3·H2O присутствуют частоты,
характерные для внешнесферного и координированного нитрат-иона: n3(NO3-)вн + ds(NH3)
(1385 см-1),
n1(NO3-)вн (1048 см-1), n2(NO3-)вн (824 см-1), n4(NO3-)вн (723 см-1 и 691 см-1), n3(NO3-)коорд (1515 см-1), n1(NO3-)коорд (971 см-1), n2(NO3-)коорд (824 см-1), n4(NO3-)коорд (790 см-1 и 761 см-1). Частота ν(NO)
проявляется в области характерной для комплексов, содержащих транс-координату H2O-Ru-NO (1923 см-1). В спектре присутствуют
колебательные частоты координированной и кристаллизационной воды: ν(H2O)коорд
+ ν(NH3) (3212 см-1), ν(H2O)кр
(3503 см-1) и δ(H2O) + dd(NH3)
(1635 см-1). Остальные частоты в спектре сходятся с частотами ИК спектров
диамминовых комплексов нитрозорутения [, , ]].
Растворением
80 мг транс-[RuNO(NH3)2(NO3)2(H2O)]NO3·H2O в 3 мл воды был приготовлен раствор и затем записан
спектр ЯМР 14N. В спектре наблюдается сигнал на -13,2 м.д.,
отвечающий транс-координатам O2NO-Ru-OH2 и O2NO-Ru-ONO2. Присутствие одного сигнала от двух разных
транс-координат объясняется близким транс-влиянием координированных
нитратогруппы и воды. Близкие значения химсдвигов (63,2 м.д. и 62,9 м.д.) для
транс-координат O2N-Ru-OH2 и O2N-Ru-ONO2 наблюдалась для формы [RuNO(NO2)2(NO3)(H2O)2]
в работе [4] и в наших исследованиях методом ЯМР 15N поведения [RuNO(NO2)4OH]2-
в азотнокислых растворах. Сигналы на -28,8 м.д. и -396,8 м.д отвечают
химсдвигам транс-координат ON-Ru-OH2 и H3N-Ru-NH3 соответственно, а так же сигнал от свободного
нитрат-иона на -0,7 м.д. Соотношение интенсивности сигналов в спектре: INO:INH3:INO3коорд:INO3-
= 0,9:2:1,3:1,7.
Пониженная доля координированного нитрата связана с тем, что в воде
происходит акватация:
[RuNO(NH3)2(NO3)2(H2O)]+ + H2O = [RuNO(NH3)2(NO3)(H2O)2]2+ +
NO3-.
Аквакомплексы нитрозорутения подвергаются частичному депротонированию,
т.к. являются кислотами средней силы. Это предположение подтверждается тем, что
в сигнал на -28,8 м.д. находится в области, отвечающей как химсдвигам транс-координаты
ON-Ru-OH2, так транс-координаты ON-Ru-OH.
[RuNO(NH3)2(NO3)(H2O)2]2+ = [RuNO(NH3)2(NO3)(H2O)OH]+ + H+
Кристаллическая структура данного соединения в литературе ранее не была
описана. Полученный нами транс-[RuNO(NH3)2(NO3)2(H2O)]NO3·H2O был охарактеризован методом монокристального
рентгеноструктурного анализа (Пр. гр. P21; a = 6,629(1) Å, b = 13,439(1) Å, c = 7,018(1) Å; b = 114,28(1)°; R = 0,0166). Межатомные расстояния и валентные углы приведены
в Приложении (Табл. 6).
Кристаллическая структура относится к островному типу, построена из
комплексных катионов состава [RuNO(NH3)2(NO3)2(H2O)]+, внешнесферных нитрат-анионов (NO3)- и молекул кристаллизационной воды
(Приложение, Рис. 2.).
Координационный полиэдр рутения слабо искаженный октаэдр ос-RuN3O3, не имеющий элементов симметрии, в экваториальной плоскости
которого попарно в транс-положениях находятся по два атома азота молекул
аммиака и два атома кислорода нитрат-ионов. Аксиальные позиции заняты
нитрозогруппой и атомом кислорода от координированной молекулы воды (расстояние
Ru-OН2О 2,037(2) Å). Отклонения валентных углов на атоме Ru от идеальных 90° не превышают 8.7°.
Средние
расстояния Ru-NNH3 лежат в
обычных для нитрозоамминокомплексов рутения пределах [46] и составляют 2,093 Å. Геометрия фрагмента Ru-N-O также
согласуется с литературными данными (средние значения: 1,727(2), 1,150(3) Å, 178,5(2)°),
например []. Атом рутения смещен из экваториальных плоскостей в сторону
нитрозогруппы на 0.20 Å.
Среднее
значение длин связей Ru-ОNO3 2,035 Å практически совпадает с длиной связи Ru-OH2O
(2,037 Å), угол между нормалями к плоскостям двух
координированных NO3-групп равен 56,1°.
Наблюдается значительное отклонение от 180°
транс-угла О(7)-Ru-О(5) (на 17,7°).
В координированных нитратогруппах длины связей N-O,
также, как и величины углов ONO, заметно различаются. Координация атома кислорода
приводит к некоторому увеличению расстояния O-N
(1,313 и 1,332 Å) по сравнению с концевыми атомами кислорода в
координированных (1,213 - 1,239 Å) и свободном (1,248 - 1,268 Å) нитрат-ионах. Аналогичное явление наблюдается и в других структурно
охарактеризованных нитратокомплексах рутения [33, 34, 37, 40].
Координированный
нитрат-ион (как и свободный) - плоский треугольник с суммой углов 360о, однако
значение величины угла ONO для концевых атомов кислорода заметно больше120о и
составляет 124,4±0,2о. В свободном нитрат-ионе валентные углы
отклоняются от 120о не более чем на 1,3о. Длины связей N-O
довольно близки (1,258±0,020 Å),
причем некоторое их увеличение связано с образованием водородных связей с
молекулами координированной (2,62 Å) и кристаллизационной воды (2,76 Å). Молекула кристаллизационной воды образует еще одну водородную связь -
с молекулой координированной воды (2,62 Å).
Проекция
структуры вдоль направления Х приведена в Приложении на Рис. 3. В структуре
просматривается слоистый характер, шесть расстояний между центрами катионов Ru×××Ru в слое имеют
оценки 6,629 - 7,412 Å, в слоях отмечено межкатионное расстояние ONO3××× ONO3 ~2,89 Å между нитратогруппами соседних катионов. Первой линии
на дифрактограмме 020 соответствует межслоевое расстояние d =
6,719 Å. Между катионными слоями располагаются внешнесферные
анионы NO3- и молекулы кристаллизационной воды, которые
связывают структурные единицы водородными связями в единый каркас. Помимо
водородных связей, образуемых молекулами воды, многочисленные Н-связи образуют
амминогруппы комплексного катиона с кратчайшими оценками N-H×××O ~3 Å. Отметим межионное расстояние О×××О между атомами кислорода нитрозогруппы и внешнесферного
аниона, равное 2,87 Å.
Кипячение
транс-[RuNO(NH3)2(NO2)2OH] в HNO3 3 М до изменения окраски раствора с желтой на
красную с последующим упариванием приводит к протонированию координированной
гидроксогруппы, удалению двух координированных нитрогрупп и вхождению на их
место двух нитрат-ионов:
[RuNO(NH3)2(NO2)2OH] + 3HNO3  [RuNO(NH3)2(NO3)2(H2O)]NO3·H2O + 2“HNO2”
[RuNO(NH3)2(NO3)2(H2O)]NO3·H2O + 2“HNO2”
При
дальнейшем нагревании комплекса наблюдаются два эндотермических эффекта в
температурных интервалах 85-125оС (потеря массы 3,32 %) и 150-185о С (потеря
массы 2,61 %), с максимумами при 105 оС и 170о С соответственно. В газовой фазе
на этой ступени регистрируются молекулы аммиака и воды. Однако, теоретические
потери массы каждой из этих молекул по отдельности и в сумме заметно больше
наблюдаемых величин, что позволяет предположить два параллельных маршрута
разложения безводного [Ru(NO)(NH3)2(NO3)2(H2O)](NO3):
[Ru(NO)(NH3)2(NO3)2(H2O)](NO3) = [Ru(NO)(NH3)(NO3)3(H2O)] + NH3;
[Ru(NO)(NH3)2(NO3)2(H2O)](NO3) = [Ru(NO)(NH3)2(NO3)3](NO3) + H2O;
В
интервале температуры 190-270оC (потеря массы 45,07 %) наблюдается три
экзотермических эффекта с максимумами при температуре 195оC,
225оC и 257оC. Ступени потери массы на этих стадиях не разделены, а
в газовой фазе регистрируются N2, N2O, NO, H2O.
В
этом же температурном интервале разлагается и нитрат аммония, при термолизе
которого протекают следующие процессы []:
NH4NO3 = N2O + 2 H2O (190-245 оC)
NH4NO3 = N2 + 2 NO + 4 H2O (250-300 оC)
NH4NO3 = 2 N2 + O2 + 4 H2O (>300 оC).
По всей видимости, окисление координированного аммиака координированным и
внешнесферным нитрат-ионом происходит по схожим механизмам. Помимо этого, в
нашем случае прибор регистрирует и газообразный аммиак, не подвергшийся
окислению, по-видимому, в силу кинетических причин.
Экзотермический эффект при температуре ~ 400 oC, по данным [], отвечает распаду группировки RuNO3+ с образованием RuO2. Рентгенофазовый анализ показал,
что в нашем случае твердым остатком прокаливания также является диоксид рутения
(масса остатка 34,52 %, рассчитано на RuO2 34,61%). Поскольку единственным газообразным продуктом, зафиксированным
нами на этой ступени является N2O, мы можем предложить стехиометрию
реакции, происходящей на последней стадии разложения:
(RuNO)2O3 = 2RuO2 + N2O.
транс-[RuNO(NH3)4(H2O)](NO3)3.
В
ИК спектре полученного транс-[RuNO(NH3)4(H2O)](NO3)3 присутствуют частоты, характерные для
внешнесферного нитрат-иона: n3(NO3-)вн + ds(NH3) (1360 см-1), n1(NO3-)вн (1040 см-1), n2(NO3-)вн (823 см-1), n4(NO3-)вн (718 см-1) и отсутствуют частоты, характерные для координированного нитрат-иона. Частота ν(NO)
проявляется в более коротковолновой области (1935 см-1), в
сравнении с обычно характерной для комплексов, содержащих транс-координату H2O-Ru-NO. Заметное
уширение линий, отвечающих валентным (~3200
см-1) и деформационным
колебаниям (~1600 см-1) координированного аммиака,
указывает на вклад в эти линии колебаний координированной молекулы воды.
Остальные частоты в спектре сходятся с частотами ИК спектров тетраамминовых
комплексов нитрозорутения [49, ].
Кристаллическая
структура данного соединения в литературе ранее не была описана. Полученный
нами транс-[RuNO(NH3)4(H2O)](NO3)3 был охарактеризован методом монокристального
рентгеноструктурного анализа (Пр. гр. I41/a; a =
18,280(1) Å, b = 18,280(1) Å, c = 15,129(1) Å; R = 0,0244). В Табл. 7. Приложения приведены межатомные
расстояния и валентные углы в транс-[RuNO(NH3)4(H2O)](NO3)3.
Структура
относится к островному типу, построена из комплексных катионов [RuNO(NH3)4(H2O)]3+
и внешнесферных нитрат-анионов (NO3)- (Рис. 4. в Приложении).
Координационный
полиэдр рутения слегка искаженный октаэдр, в экваториальной плоскости которого
находятся четыре молекулы аммиака, расстояния Ru-N
лежат в узком интервале Ru-N 2,100 - 2,107 (ср.2,104) Å. Нитрозо-группа и молекула воды занимают аксиальные
позиции. Расстояние Ru-O(W) 2,042 Å, геометрические характеристики фрагмента Ru-NO -
1,732, 1,137 Å и 176,6° -
согласуются с литературными данными [, ]. Отклонения валентных углов от 90° на центральном атоме Ru не превышают 5,5°.
Атом рутения смещен из экваториальной плоскости в сторону NO-группы
на 0,11 Å.
В
структуре три кристаллографически независимых внешнесферных аниона (NO3)-,
длины связей N-O в них меняются в интервале 1,239 - 1,278 (ср.1,250) Å, среднее значение валентных углов O-N-O
равно 120°.
В
кристаллах структурные фрагменты связаны водородными связями. Координированная
молекула воды образует две водородные связи Ow-H…O с
кислородами аниона (N6) - 2,61 и аниона (N7) - 2,59 Å. Все аммиачные группы комплексного катиона участвуют в
многочисленных N-Н…O связях, с кратчайшими оценками 2,90 (2,02) Å. Следует отметить наличие межмолекулярных контактов N-O…O
кратчайший из которых составляет 2,74 Å. Расстояния между центрами катионов Ru…Ru в
структуре лежат в интервале 7,176 - 7,994 Å.
Таким
образом, одним из продуктов кипячения транс-[RuNO(NH3)4OH]Cl2 в
8 М HNO3 в течение 1 часа является транс-[RuNO(NH3)4(H2O)](NO3)3.
Химизм процесса образования этого комплекса сводится к протонированию
координированной гидроксогруппы и осаждению соответствующей нитратной соли:
[RuNO(NH3)4OH]Cl2 + 3HNO3 = [RuNO(NH3)4(H2O)](NO3)3 +
2HCl.
По этой причине для получения этого комплекса в чистом виде и с высоким
выходом реакцию с азотной кислотой следует проводить при комнатной температуре.
транс-[RuNO(NH3)4(NO3)](NO3)2.
В ИК спектре полученного транс-[RuNO(NH3)4(NO3)](NO3)2 присутствуют частоты, характерные для внешнесферного и координированного нитрат-иона: n3(NO3-)вн + ds(NH3) (1382 см-1), n1(NO3-)вн
(1049 см-1), n2(NO3-)вн (828 см-1), n4(NO3-)вн (717
см-1), n3(NO3-)коорд (1526 см-1), n1(NO3-)коорд
(996 см-1), n2(NO3-)коорд (828 см-1), n4(NO3-)коорд
(789 см-1). Частота ν(NO) проявляется в более коротковолновой
области (1928 см-1), в сравнении с характерной для комплексов, содержащих
транс-координату H2O-Ru-NO. В спектре отсутствуют колебательные
частоты координированной и кристаллизационной воды. Остальные частоты в спектре
сходятся с частотами ИК спектров тетраамминовых комплексов нитрозорутения [].
Кристаллическая структура данного соединения в литературе ранее не была
описана. Полученный нами транс-[RuNO(NH3)4NO3](NO3)2
был охарактеризован методом РСА (Пр. гр. I-4; a = 7,821(1) Å, b = 7,821(1) Å, c = 9,781(2) Å; R = 0,05). Cтруктура
относится к островному типу, построена из комплексных катионов [RuNO(NH3)4NO3]2+
и внешнесферных нитрат-анионов (NO3)-.
Координационный полиэдр рутения слегка искаженный октаэдр, в экваториальной
плоскости которого находятся четыре молекулы аммиака, среднее расстояние Ru-N 2,11 Å. Аксиальные позиции занимают координированный
монодентатно нитрат-ион (Ru-O 2,07 Å) и нитрозогруппа (Ru-N 1,74 Å), разупорядоченные по двум позициям. Внешнесферные
нитрат-ионы также разупорядочены. Более точное описание структурных данных пока
не представляется возможным вследствие низкого совершенства полученных
монокристаллов.
Термограмма транс-[RuNO(NH3)4NO3](NO3)2
в атмосфере гелия приведена на Рис. 9. Приложения. Во избежание теплового
взрыва образец массой 1,6 мг разбавляли Al2O3, что
значительно понизило чувствительность ДТА. Тем не менее, из полученных данных
можно сделать следующие качественные выводы. В отличие от содержащего воду
транс-[RuNO(NH3)2(NO3)2(H2O)](NO3)·H2O, тетраамминный комплекс устойчив до
температуры 240°С.
В интервале 240-300°С
(максимум экзотермического эффекта при 280оС), как и в предыдущем случае,
происходит окисление координированных молекул аммиака нитрат-ионами. Вторая
ступень потери массы (300-400°С) со слабым экзотермическим эффектом, по-видимому, соответствует
удалению координированной нитрозогруппы. Рентгенофазовый анализ показал, что и
в этом случае твердым остатком прокаливания является диоксид рутения.
Таким образом, кипячение транс-[RuNO(NH3)4(H2O)](NO3)3 в крепкой азотной кислоте (> 8
М) приводит к замещению координированной воды на нитрат-ион с последующим
образованием малорастворимого транс-[RuNO(NH3)4(NO3)](NO3)2:
[RuNO(NH3)4(H2O)]3+ + NO3- = [RuNO(NH3)4(NO3)]2+ + H2O;
[RuNO(NH3)4(NO3)]2+ + 2NO3- = [RuNO(NH3)4(NO3)](NO3)2¯.
Оптимальным методом синтеза транс-[RuNO(NH3)4NO3](NO3)2 является обработка транс-[RuNO(NH3)4OH]Cl2 концентрированной HNO3 при кипячении в течение 5 минут.
В
ИК спектре газообразных продуктов этой реакции (Рис. 5 в Приложении)
присутствуют линии отвечающие νs(H2O) (3554 см-1), νN-O(N2O)
(2237 см-1 и 2211 см-1), νN-O(NOCl)
(1810 см-1 и 1790 см-1), νas(NO2)
(1628 см-1 и 1602 см-1), νN-N(N2O)
(1301 см-1 и 1270 см-1), νN-Cl(NOCl)
(605 см-1), dd(N2O) (586 см-1). Наличие в
спектре линий N2O невысокой интенсивности связано с частичным
окислением координированного аммиака концентрированной азотной кислотой.
Отнесение полос проведено в соответствии с данными работы [53].
Масс-спектр
газообразных продуктов реакции приведен на Рис. 7 Приложения. Отсутствие в
спектре сигнала, отвечающего NOCl, связано с тем, что при рабочем давлении
масс-спектрометра (~10-9 атм.) он разлагается на NO и Cl2.
В остальном подтверждается качественный состав газообразных продуктов,
идентифицированных методом ИК спектроскопии. Наличие перечисленных частиц и
газообразного хлора и свидетельствует о правильности предложенной стехиометрии
реакции. Присутствие N2 и O2 связано с остаточным давлением этих газов после
откачивания воздуха из рабочей камеры спектрометра, либо с недостаточной
герметизацией при сборе пробы газовой фазы.
На
основании проведенных исследований можно предложить следующую схему
последовательных процессов, протекающих при пятиминутном кипячении транс-[RuNO(NH3)4OH]Cl2 в
концентрированной азотной кислоте:
[RuNO(NH3)4OH]2+
+ H+ = [RuNO(NH3)4(H2O)]3+ (1),
3 Cl- + 4 H+ + NO3- = NOCl +
Cl2 + 2 H2O (2),
[RuNO(NH3)4(H2O)]3+
+ NO3- = [RuNO(NH3)4(NO3)]2+ (3),
[RuNO(NH3)4(NO3)]2+
+ 2 NO3- = [RuNO(NH3)4(NO3)](NO3)2¯ (4).
Суть
процессов сводится к следующему: протонирование координированной гидроксогруппы
(1), окисление внешнесферного хлорид-иона с образованием и последующим
выделением в газовую фазу NOCl и Cl2 (2), замещение координированной молекулы воды на
нитрат-ион во внутренней координационной сфере нитрозорутения (3) и образование
труднорастворимой желтой кристаллической фазы транс-[RuNO(NH3)4(NO3)](NO3)2
(4). Суммарное уравнение в молекулярной форме, описывающее процессы (1-4),
выглядит следующим образом:
3 [RuNO(NH3)4OH]Cl2 + 11 HNO3 (16,5 M) =
= 3 [RuNO(NH3)4NO3](NO3)2¯ + 2
NOCl + 2 Cl2 + 7 H2O.
гран-[RuNO(NH3)2(NO3)3].
В
ИК спектре полученного [RuNO(NH3)2(NO3)3] присутствуют частоты, характерные для
координированного нитрат-иона: n3(NO3-)коорд (1501 см-1 и 1270 см-1), n1(NO3-)коорд (985 см-1), n2(NO3-)коорд (843 см-1), n4(NO3-)коорд (788 см-1 и 768 см-1). Частоты, характерные для внешнесферного нитрат-иона, в спектре отсутствуют. Частота ν(NO) проявляется
в более коротковолновой области (1937 см-1), в сравнении с характерной
для комплексов, содержащих транс-координату H2O-Ru-NO. В спектре
отсутствуют колебательные частоты координированной и кристаллизационной воды.
Остальные частоты в спектре сходятся с частотами ИК спектров цис-диамминовых
комплексов нитрозорутения [57].
Нагреванием
145 мг [RuNO(NH3)2(NO3)3] в 3 мл воды был приготовлен раствор и затем
записан его спектр ЯМР 14N (Рис.). В спектре наблюдается сигнал на -409,2 м.д.,
смещенный на 12,4 м.д. в сильное поле по сравнению с сигналом, соответствующим
транс-координате H3N-Ru-NH3 в спектре ЯМР 14N водного
раствора транс-динитратодиаммина. Это означает, что транс-партнером координированной
молекулы аммиака является не NH3, а какая-то другая частица. Сигналы -12,0 м.д. и
-27,1 м.д. отвечают координированному нитрат-иону и нитрозогруппе
соответственно, сигнал -0,7 м.д. - свободному нитрат-иону. Соотношение
интенсивности сигналов в спектре: INO:INH3:INO3коорд:INO3-
= 1:2:0,7:2,3, что отвечает составу RuNO(NH3)2(NO3)3.
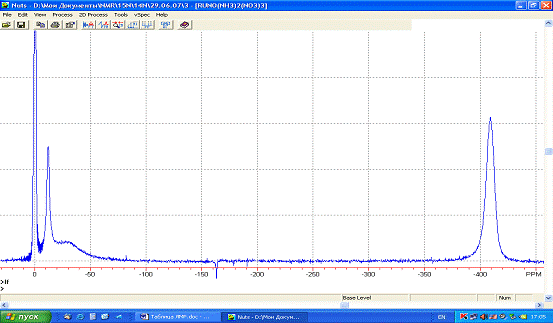
Рис.
3. Спектр ЯМР 14N раствора, полученного нагреванием взвеси гран-[RuNO(NH3)2(NO3)3]
в воде
Наличие свободного нитрат-иона, отсутствующего по данным ИК, связано с
тем, что в воде происходит акватация тринитратного комплекса:
[RuNO(NH3)2(NO3)3] + H2O = [RuNO(NH3)2(NO3)2(H2O)]+ + NO3-;
[RuNO(NH3)2(NO3)2(H2O)]+ + H2O = [RuNO(NH3)2(NO3)(H2O)2]2+ +
NO3-.
Промежуточное между характерными для транс-координат ON-Ru-OH2 (-17 - -21
м.д.) и ON-Ru-OH (-34 - -38
м.д.) значение химсдвига координированной нитрозогруппы связано с тем, что
образующиеся аквакомплексы нитрозорутения подвергаются частичному
депротонированию, т.е. являются кислотами средней силы:
[RuNO(NH3)2(NO3)(H2O)2]2+ = [RuNO(NH3)2(NO3)(H2O)OH]+ + H+.
Отсутствие в комплексе транс-координаты H3N-Ru-NH3 позволяет предположить, что полученный комплекс имеет
граневое строение.
Обработкой [RuNO(NH3)2(NO3)3] разбавленной соляной кислотой при нагревании был получен
трихлородиамминный комплекс:
[RuNO(NH3)2(NO3)3] + 3 HCl (2ºM) = [RuNO(NH3)2Cl3]¯ + 3 HNO3.
ИК
спектр и дифрактограмма этого комплекса совпадают с описанными в [57, ] для
гран-[RuNO(NH3)2Cl3]. Термодинамическая стабильность транс-изомеров выше
чем цис-изомеров, поэтому, получив цис-диамминовый хлоридный комплекс мы с
уверенностью можем сказать, что исходный тринитратодиамминовый комплекс также
был цис-диамминным.
Термограмма
[RuNO(NH3)2(NO3)3] в атмосфере гелия приведена на Рис. 10.
Приложения. Анализу был подвергнут образец с очень низкой массой (0,9 мг),
разбавленный оксидом алюминия, вследствие чего экзотермические эффекты при
разложении комплекса не проявились. Качественно термограмма выглядит
практически так же, как термограмма транс-[RuNO(NH3)4NO3](NO3)2,
отличие состоит лишь в том, что обе ступени потери массы смещены на ~ 20°С в область более низких температур. Твердый остаток от прокаливания
комплекса, по данным РФА, как и в предыдущих двух случаях - диоксид рутения.
Таким
образом, обработка транс-[RuNO(NH3)4OH]Cl2, транс-[RuNO(NH3)4(H2O)](NO3)3
или транс-[RuNO(NH3)4(NO3)](NO3)2 концентрированной HNO3 при
продолжительном кипячении приводит к образованию гран-[RuNO(NH3)2(NO3)3].
В
ИК спектре газообразных продуктов реакции (Рис. 6. в Приложении) присутствуют
линии, отвечающие νs(H2O)
(3494 см-1 и 3467 см-1), νN-O(N2O)
(2236 см-1 и 2214 см-1), νN-N(N2O)
(1299 см-1 и 1273 см-1), dd(N2O)
(589 см-1). Отнесение полос проведено в соответствии с данными
работы [53].
Масс-спектр
газообразных продуктов реакции приведен на Рис. 8. Приложения. Отсутствие в
спектре сигнала, отвечающего N2O, связано с тем, что при рабочем давлении
масс-спектрометра (~10-9 атм.) он подвергается диспропорционированию на NO и N2.
Присутствие H2O, N2 и O2 связано с разгерметизацией прибора при сборе пробы
газовой фазы.
Уравнение,
описывающее процесс образования тринитратодиамминокомплекса, выглядит следующим
образом:
[RuNO(NH3)4(NO3)](NO3)2 ¯ + 2 HNO3 (16,5 M) 
 [RuNO(NH3)2(NO3)3]¯ + 2 N2O + 4 H2O
[RuNO(NH3)2(NO3)3]¯ + 2 N2O + 4 H2O
Суть
процесса сводится к окислению двух молекул координированного аммиака с
выделением в газовую фазу N2O и вхождению двух нитрат-ионов во внутреннюю
координационную сферу нитрозорутения с образованием труднорастворимой кристаллической
фазы гран-[RuNO(NH3)2(NO3)3].
Наибольший
выход гран-[RuNO(NH3)2(NO3)3] (~60 %) достигается при проведении этой реакции в
течение 1 часа. Более продолжительное кипячение (2-4 ч) приводит к уменьшению
выхода продукта реакции вплоть до 30 %, что связано с дальнейшим окислением
координированного аммиака.
5. Выводы
азотнокислый раствор
нитрозорутений
1. В работе смоделировано поведение нитрозорутения в нитритно-нитратных
азотнокислых растворах отходов переработки ОЯТ. В азотнокислых растворах комплекс
[RuNO(NO2)4OH]2- подвергается протонированию по гидроксо- и нитрогруппам, что
приводит к удалению координированных нитрогрупп и сопровождается полимеризацией
комплексов. Доминирующими комплексными формами рутения в нитритно-нитратных
азотнокислых растворах при собственной концентрации рутения 0,1 моль/л являются
[RuNO(NO2)4(H2О)]- (СоHNO3 ~
0,1 М), [RuNO(NO2)3(m-OH)]22- (СоHNO3 ~ 0,2 М), гран-[RuNO(NO2)2(H2O)3]+ (СоHNO3
> 0,25 М) и [RuNO(NO2)2(NO3)(H2O)2]0 (СоHNO3 > 0,65 М).
2. Константа равновесия вхождения нитрат-иона во внутреннюю сферу
нитрозодинитротриаквакомплекса, оцененная методом ЯМР 15N, составляет величину порядка 0,39 ± 0,02.
3. Наличие хлорид-ионов в разбавленных азотнокислых растворах
нитрозокомплексов рутения препятствует координации нитрат-иона и приводит к
образованию нитрозохлорокомплексов рутения.
4. Кипячение транс-[RuNO(NH3)2(NO2)2OH]
рутения в 3 М HNO3 с последующим упариванием раствора
до минимального объема приводит к полному удалению координированных нитрогрупп,
протонированию гидроксогруппы и монодентатной координации двух нитрат-ионов.
5. При взаимодействии транс-[RuNO(NH3)4OH]Cl2 с
концентрированной азотной кислотой последовательно протекают следующие
процессы:
протонирование координированного гидроксид-иона;
окисление внешнесферных хлорид-ионов и замещение
координированной молекулы воды на нитрат-ион;
6. Список
литературы