Выбор реактора для проведения процесса окисления монооксида азота
ВЫБОР
РЕАКТОРА ДЛЯ ПРОВЕДЕНИЯ ПРОЦЕССА ОКИСЛЕНИЯ МОНООКСИДА АЗОТА
Задание на курсовую работу
.Обосновать выбор реактора (адиабатический РИВ
или адиабатический РПС) для синтеза аммиака. Рассчитать адиабатический
коэффициент - Аd.
.Проанализировать изменения объема реактора WR
от Т0, Р и X если через
реактор, выбранный по пункту 1, проходит 100000м3/ч исходной смеси.
Введение
реактор
аммиак азот окисление
Под технологией, в широком значении этого слова,
понимают научное описание методов и средств производства в какой-то отрасли
промышленности. Химическая технология представляет собой переработку, в
процессе которой превалируют химические и физико-химические явления, что
приводит к коренному изменению состава, свойств и строения вещества.
Таким образом, химическая технология - это
естественная, прикладная наука о способах и процессах производства продуктов
(предметов потребления и средств производства), осуществляемых с участием
химических превращений технически, экономически и социально целесообразным
путем.
Химическая технология базируется на химических
науках, таких, как физическая химия, химическая термодинамика и химическая
кинетика. Предмет ее изучения - химическое производство; цель - создание
целесообразного способа производства необходимых человеку продуктов; методы -
экспериментальный, моделирование и системный анализ.
Химическая технология играет важную роль в
химической промышленности, которая является одной из ведущих отраслей народного
хозяйства, ей принадлежит определяющая роль в ускорении научно-технического
прогресса, повышении эффективности общественного производства и, материального
и культурного уровня жизни людей.
Материальной основой всех химико-технологических
процессов являются машины и аппараты химических производств. Эффективность
химического производства обеспечивается за счет систематического повышения его
технического уровня на основе использования мощных, непрерывных, малостадийных
и менее энергоемких аппаратов. Так, выбор и расчет аппарата, ректификационной
колонны, реактора является важным критерием, определяющим технологический
процесс.
Химико-технологический процесс представляет
собой совокупность операций, позволяющих получить целевой продукт из исходного
сырья. Скорость всех этапов операций будет зависеть от температурного режима,
наличия примесей, а самое главное - от гидромеханических, тепло- и
массообменных, химических процессов, протекающих в аппарате.
Разработка и построение рациональной
технологической схемы и выбор реактора - важная задача химической технологии.
Технология синтеза аммиака
В 1913 г. впервые был получен в промышленном
масштабе аммиак каталитическим синтезом из азота и водорода. Так была решена
важнейшая проблема: проблема связывания азота, которую уже давно пытались
разрешить многие ученые из разных стран. Ее решение давало возможность получить
азот в связанном состоянии, в виде аммиака NН3, который переводился в
аммонийные соли, или каталитическим окислением в азотную кислоту и ее соли. А
уже из этих продуктов можно было неограниченно получать всевозможные
азотсодержащие вещества, которые так необходимы буквально во всех отраслях
народного хозяйства.
Синтез аммиака идет без образования побочных
продуктов. Тепловой эффект реакции при температуре 500 ͦС для давления 30
МПа составляет 55,8 кДж/моль.
+3H2==2NН3 - ∆H
Синтез аммиака - это типичный
гетерогенно-каталитический процесс, протекающий через ряд стадий:
.Диффузия азота и водорода из газового объема к
поверхности зерен катализатора и внутри пор зерен.
.Активированная (химическая) адсорбция газов на
катализаторе.
.Взаимодействие азота с водородом на поверхности
катализатора.
.Десорбция аммиака и диффузия его в объем
газовой фазы.
Определяющей стадией процесса является
активированная адсорбция азота.
По уравнению реакции:
+3H2==2NН3
видно, что она проходит с резким уменьшением
объема (в 2 раза). Следовательно, по принципу Ле-Шателье, для проведения этого
процесса необходимо высокое давление. Эта реакция экзотермична, следовательно,
выход аммиака будет тем больше, чем ниже температура. Также выход зависит от
таких параметров технологического режима, как давление, время соприкосновения
газа с катализатором, состава газовой смеси, активности катализатора,
конструкции аппарата. Если система находится в состоянии, не слишком удаленном
от равновесия, то скорость процесса можно приближенно посчитать по уравнению
М.И. Темкина:
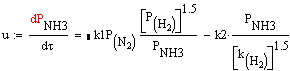
где k1-
константа скорости синтеза аммиака;
k2- константа
скорости разложения аммиака;
k- константа
скорости, пропорциональная k1;
р- парциальное давление.
Очень важным для успешного проведения синтеза
аммиака является правильный подбор катализаторов для этой реакции, так как даже
при высокой температуре реакция протекает медленно. Лучшим катализатором
оказался железный катализатор с добавками оксидов алюминия и калия:
+ Аl2O3 + К2О
Он показал большую активность и стойкость к
перегревам и вредным примесям в азотоводородной смеси. Сероводород и другие
содержащие серу соединения отравляют железный катализатор необратимо. А
кислород и кислородные соединения отравляют железный катализатор обратимо, но
очень сильно.
Очень большое значение для правильного
проведения процесса синтеза аммиака в промышленности имели и имеют исследования
кинетики этой реакции, т. е. определение зависимости скорости реакции от
концентрации реагирующих веществ, или в применении к реакциям между газами от
парциальных давлений реагирующих газов в газовой реакционной смеси.
Промышленные системы синтеза аммиака в
зависимости от применяемого давления азотоводородной смеси подразделяются на:
. Установки, работающие при низких давлениях
(100-200 aт).
. Системы, работающие при средних давлениях
(280-350 aт).
. Системы, работающие при высоких давлениях
(450-1000 aт).
Наиболее распространены системы, работающие при
среднем давлении, так как при этих условиях удачно решаются вопросы выделения
аммиака при достаточной скорости процесса в контактном аппарате.
Азотоводородная смесь при прохождении через слой катализатора не полностью
превращается в аммиак. В газе на выходе из контактного аппарата содержании
аммиака составляет 14-20%. Газовая смесь, выходящая из контактного аппарата,
охлаждается, аммиак конденсируется и отделяется от газа, а непрореагировавшая
азотоводородная смесь при помощи циркуляционного компрессора возвращается вновь
в контактный аппарат. Свежая азотоводородная смесь в количестве, отвечающем
массе образовавшегося в контактном аппарате аммиака, добавляется к оборотной
смеси.
Содержание аммиака можно вычислить по формуле:

где С - объемное содержание аммиака в
азотоводородной смеси,%.
Расход свежего газа находится из следующего
уравнения:
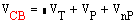
где VT-
теоретический расход смеси;VP
- количество газов, растворенных в аммиаке;Vпр
- количество удаляемых из цикла азотоводородной смеси, метана и аргона.
Объем газовой смеси на входе в колонну синтеза
(м3):
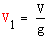
где V-
объемная скорость,ч-1; g-
производительность катализатора.
Объем газовой смеси на выходе из колонны
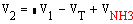
где VNH3-
объем образовавшегося в колонне аммиака.
Производительность колонны синтеза аммиака
(м3/ч):

где С1 - объемное содержание аммиака на входе в
колонну, %; а С2 - объемное содержание аммиака на выходе из колонны.
Колонна синтеза - основной, наиболее важный
аппарат установки для получения синтетического аммиака. Конструкция колонны
должна быть надежной и обеспечивать безопасную и длительную работу. Водород и
аммиак, содержащиеся в газовой смеси, при повышенной температуре действуют на
сталь, снижая ее прочность. Особенно опасно обезуглероживание стали при высоких
температурах под действием водорода, проникающего в сталь.
Основные условия высокой и стабильной
производительности установок синтеза аммиака:
)высокая степень очистки азотоводородной смеси
от каталитических ядов и инертных примесей;
)поддержание соотношения N2:
H2 , близкого к 1:3;
)оптимальная температура процесса по длине
каталитической зоны;
)снижение содержания аммиака на входе в
контактный аппарат;
)совершенная конструкция аппарата (колонна
синтеза).
Тепловой и материальный баланс адиабатических
РИВ и РПС
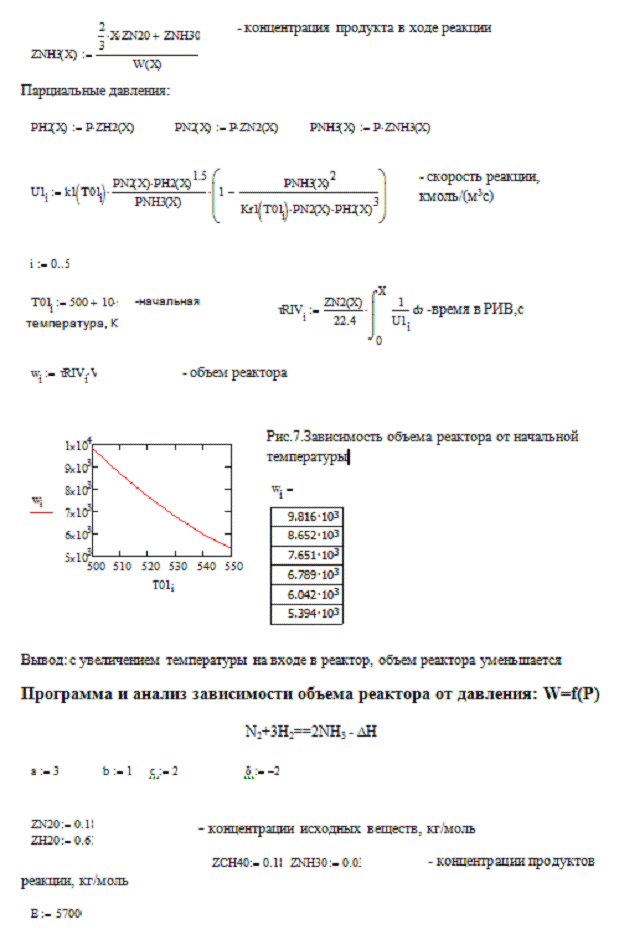
Материальный баланс РИВ
Реактор идеального вытеснения - такой реактор, в
котором отсутствуют продольное, радиальное перемещение, а осуществляется только
диффузия, концентрация реагентов изменяется в результате химического
превращения.
Рассмотрим реакцию aA+
bB=cC+dD
,
за начальные условия примем V=const,
zА°= const,
хА=0, через некоторое время степень превращения в реакторе станет равной хА+dxA,
тогда
GFPA = V zA°xA MA/22.4,
- физический приход, кг/с; V-объем
смеси, м³/с;
22.4-молярный объем, м³/кмоль;
MA - масса
молярная вещества А, кг/кмоль; zA°(1-xA)
- концентрация оставшегося реагента, кг/кмоль; zA°хА-
концентрация прореагировавшего реагента, кг/кмоль.
GCRA= UdVMA
-количество вещества А, которое прореагировало в результате химической реакции,
где U -скорость реакции,
кмоль/ м³с;
dV-изменение объема
смеси, м³/с.
По закону сохранения действующих масс- приход
равен расходу вещества в ходе реакции:
GFPA= GFRA
+ GCRA , или
V
zA°/22.4 - V
zA° хА/22.4 = UdV
+ V zA°/22.4
- V zA°
хА/22.4 - V
zA° dхА/22.4,
сократим и получим уравнение материального
баланса для реактора идеального вытеснения:
V
zA° dхА/22.4
= UdV.
Обозначим, что Vr-
объем реактора, м³; тогда Vr=
Vt,
где V-расход
смеси, м³/с;
t-время, с.
Изменение объема реактора: dVr=Vdt,
т.к. V=const,
то zA° dxA/22.4=Udt,
преобразуем и получим
dxA/dt=U22.4/
zA° - уравнение МБ в
дифференциальной форме.
Время, необходимое для достижения заданной
степени превращения найдем по формуле, отсюда следует, что чем больше скорость,
тем меньше время:
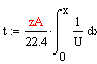
Тепловой баланс РИВ
Рассмотрим реакцию, протекающую без
изменения числа молей
aA+ bB=cC+dD ,
Т0 - начальная температура на входе
в реактор,град; хА=0 - начальная степень превращения, х-конечная степень
превращения; Т-температура в реакторе, град; Т+dT- изменение
температуры в ходе реакции, град; V=const - расход
смеси считаем постоянным, м³/с; zA°
-концентрация вещества А, кг/кмоль,и удельная теплоемкость
Cp,Дж/(моль
град), также постоянные величины, тогда
HFP-энергия,
приносимая исходной газовой смесью в объем реактора, кДж/с:
HFP =VCp(T-273),
HFR= VCp(T+dT-273) -
энергия(теплота) на выходе из реактора, кДж/с;
HСR=UHUCRdV -тепловой эффект
химической реакции, кДж/с.
U-скорость
реакции,кмоль/м³с; HUCR - удельный
тепловой эффект реакции, кДж/кмоль;
dV- изменение
расхода смеси, м³/с.
Тогда теплота прихода равна: HP=HFP + HСR, кДж/с.
Теплота расхода будет равна: HR=HTO + HHR, кДж/с.
HTO =KFdTdV - энергия
теплообмена, кДж/с, где К-коэффициент теплопередачи, кДж/(м²град с); F- удельная
поверхность в единице реакционного объема,м²/м³; dT- изменение
температуры, град; dV- элементарный реакционный объем, м³.
По закону сохранения энергии: HP= HR, т.е
энергия прихода равна энергии расхода, тогда
VCpT- VCp273 + UHUCRdV= VCpT + VCpdT- VCp273 + KFdTdV, сократив,
получим:
UHUCRdV= VCpdT + KFdTdV - уравнение
политермы, показывающее, что количество выделившейся теплоты равно изменению
температуры и теплоте, отобранной холодильником. В адиабатическом режиме
отсутствует теплообмен с окружающей средой, теплота идет на изменение
теплосодержания химической смеси, значит:
HUCRdx=22.4 CpdT/zA° ,
кДж/кмоль;
Т=Т0 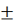
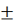 (zA°HUCR/(22.4 Cp))x - уравнение
адиабаты, здесь знак «+» для реакции экзотермической, знак «-» для
эндотермической реакции.
(zA°HUCR/(22.4 Cp))x - уравнение
адиабаты, здесь знак «+» для реакции экзотермической, знак «-» для
эндотермической реакции.
Ad=zA°HUCR/(22.4Cp) -
адиабатический коэффициент, показывающий на сколько изменится температура
реакции смешения, если ключевое вещество полностью прореагирует, град.
Система уравнений МБ и ТБ:
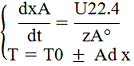
Решение системы позволит найти
максимальное значение степени превращения, например, для реакции первого
порядка, получим:
U=kPA=kPzA=kP zA°(1-x)
-кинетическое уравнение реакции 1-го порядка
dx/dt= 22/4kP(1-x),
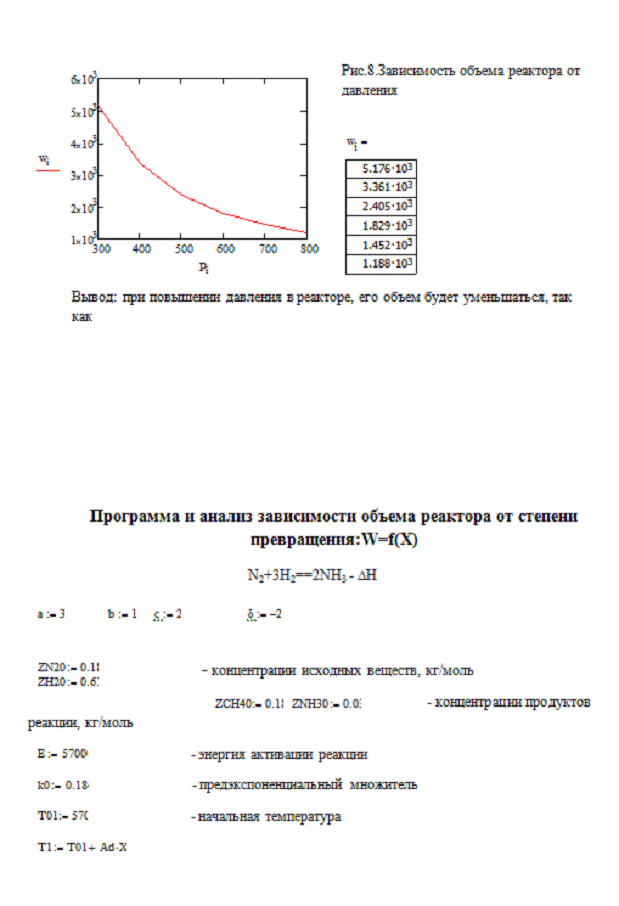
Материальный баланс РПС
Реактор полного смешения - реактор,
в котором вновь поступающая порция реагента быстро распространяется по всему
объему реактора за счет перемешивания и концентрация реагента остается
постоянной в любой точке реактора.
Рассмотрим реакцию aA+ bB=cC+dD ,
примем V=const-объем
смеси, zА°= const, хА=0,
хк-начальная и конечная степень превращения соответственно,Vr=const -объем
реактора, тогда
GFPA = V zA°xA MA/22.4 -
физический приход в реактор,кг/с;
V -расход
смеси,м³/с; zA°-концентрация
реагента А, кг/кмоль; Vm =22.4 - молярный объем, м³/кмоль.
GFRA= V zA°(1-xA) dxA MA/22.4
-физический расход, кг/с
GCRA= UVrMA -
прореагировало в реакторе в ходе химической реакции, кг/с, где Vr-объем
реактора, м³.
По закону сохранения действующих
масс - приход равен расходу вещества в ходе реакции: GFPA= GFRA + GCRA , кг/с
V zA°/22.4= V zA°/22.4 - V zA°хк/22.4 + UVr, сократим:
V zA°хк/22.4= UVr , учитывая,
что Vr= Vt - объем
реактора, м³,
получим
хк/t= 22.4U/ zA° -
уравнение материального баланса РПС
Из уравнения МБ следует, что чем
больше скорость реакции, тем ниже время ее протекания и объем реактора.
Тепловой баланс РПС
Рассмотрим реакцию экзотермическую
без изменения числа молей
aA+ bB=cC+dD
Т0 - начальная температура на входе
в реактор,град; Тк-конечная температура на выходе из реактора, град; хА=0 -
начальная степень превращения, хк -конечная степень превращения; Т-температура
в реакторе, град; V=const - расход
смеси считаем постоянным, м³/с; zA°
-концентрация вещества А, кг/кмоль; Cp- удельная
теплоемкость, Дж/моль град, также постоянные величины; F-
поверхность теплообмена на всем объеме реактора, м²/м³; Cp- удельная
теплоемкость, Дж/(моль град), тогда
HFP =VCp(T0-273), кДж/с
- теплота физического прихода;
HFR= VCp(Tк -273) -
энергия(теплота) физического расхода, кДж/с;
HСR=U∆HUCRVr - тепловой
эффект химической реакции , кДж/с;
HTO =KF∆T - энергия
теплообмена, кДж/с.
По закону сохранения энергии
составим уравнение теплового баланса:
HFP + HСR
= HFR + HTO
VCpT0 - VCp273
+ U∆HUCRVr
= VCpTк - VCp273
+ KF∆T,
сократим
UHUCRVr
= VCp(Tк
- T0) + KF∆T
- уравнение политермы.
U= хк zA°/(22.4
t) - скорость
реакции, кмоль/(м³с), Vr=
Vt - объем реактора,
м³,
подставим
в уравнение политропы:
хк zA°/(22.4
t) Vt∆HUCR
= VCp(Tк
- T0) + KF∆T
В данном случае режим адиабатический, то
теплообмен с окружающей средой отсутствует, и слагаемое KF∆T
пропадает, тогда
хк ∆HUCR
= 22.4 Cp(Tк
- T0)/ zA°,
отсюда
Tк = T0 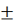
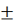 zA°∆HUCR хк/(22.4
Ср)- уравнение адиабаты РПС, где знак «+» для реакции экзотермической, знак «-»
для эндотермической реакции.
zA°∆HUCR хк/(22.4
Ср)- уравнение адиабаты РПС, где знак «+» для реакции экзотермической, знак «-»
для эндотермической реакции.
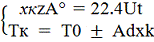
Cовместное
решение уравнений МБ и ТБ для РПС позволяет найти конечную степень превращения:
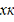
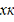 =
= 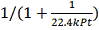
Рассмотрим необратимую реакцию
первого порядка, тогда U=kPA=kPzA=kP zA°(1-x)
-кинетическое уравнение реакции 1-го порядка, подставим в уравнение МБ и ТБ:
Для обратимой реакции первого
порядка A 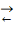
 D:
D:
U=k1PA -k2PD=k1PzA -k2PzD=k1P zA°(1-xk)-k2P zA°xk=k1PzA°(1-(k2+k1)xk/k1)
U=0 при
условии равновесия, тогда k1=(k1+k2)xr, значит U= k1P zA°(1-xk/xr), выразив
хк, получим: хк= xr22.4tk1P/(xr+22.4 tk1P). Система
уравнений МБ и ТБ для обратимой реакции примет вид:


Выбор адиабатического реактора для синтеза NH3
При сравнении работы реакторов полного смешения
и идеального вытеснения, провели некоторый анализ зависимостей степени
превращения, температуры и скорости реакции от времени пребывания в реакторе.
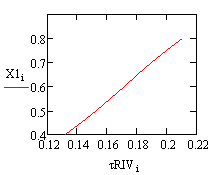
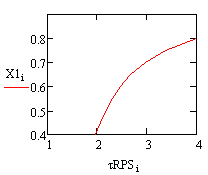
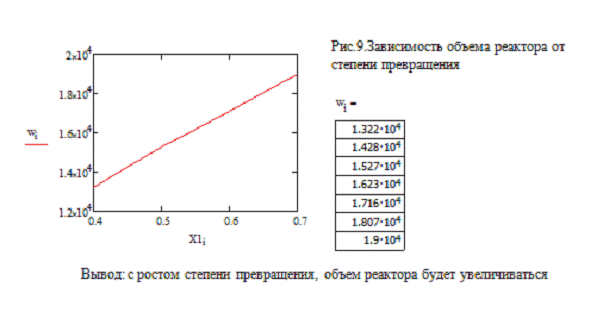
Рис. 1. Зависимость степени превращения Рис. 2.
Зависимость степени превращения от времени в РИВ от времени в РПС
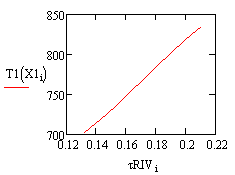
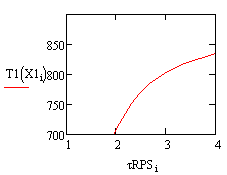
Рис. 3. Зависимость температуры Рис. 4.
Зависимость температуры от времени в РИВ от времени в РПС
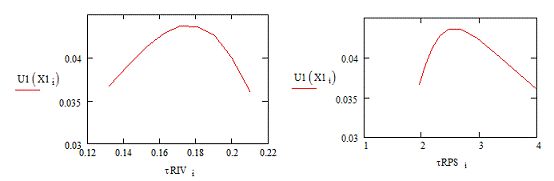
Рис.5. Зависимость скорости реакции от Рис.6.
Зависимость скорости реакции от времени в РИВ времени в РПС
Время на проведение реакции в реакторе полного
смешения потребуется больше, чем в реакторе идеального вытеснения, что может
привести к большим энергетическим затратам. Также необходимо учитывать тот
факт, что в РИВ эффективнее протекают реакции при меньших тепловых эффектах.
Таким образом, для данной реакции выбран реактор идеального вытеснения.




Список литературы
1. Бесков В.С., Сафронов В.С. Общая
химическая технология и основы промышленной экологии: Учебник для вузов. - М.:
Химия, 1999. 472 с.
2. Кутепов А.М., Бондарева
Т.И., Беренгартен М.Г. Общая химическая технология: Учеб. для техн. вузов- Изд.
2-е испр. и доп. М.: Высшая шк., 1990.-520 с.