Фенилкетонурия
Московская
Медицинская академия им. И.М.Сеченова
Кафедра
медицинской генетики
Реферат
Фенилкетонурия
Выполнила: студентка 4 курса
лечебного факультета
33 группы Алиева С.М.
Москва
2004
ФЕНИЛКЕТОНУРИЯ - тяжелое наследственное заболевание, которое характеризуется
главным образом поражением нервной системы.
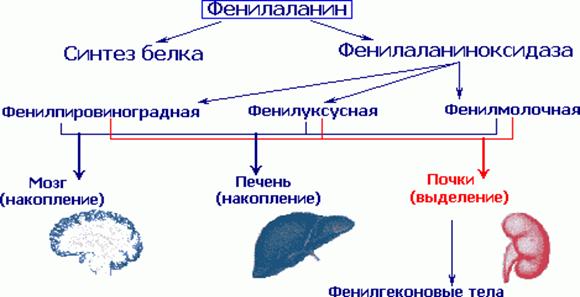
Этиология и патогенез. В результате мутации
гена, контролирующего синтез фенилаланингидроксилазы, развивается
метаболический блок на этапе превращения фенилаланина в тирозин, вследствие
чего основным путем преобразования фенилаланина становится дезаминирование и
синтез токсических производных - фенилпировиноградной, фенил-молочной и
фенилуксусной кислот. В крови и тканях значительно увеличивается содержание
фвнилаланина (до 0,2 г/л и более при норме 0,01-0,02 г/л). Существенную роль в
патогенезе болезни играет недостаточный синтез тирозина, который является
предшественником катехоламинов и меланина. Заболевание наследуется по
аутосомно-рецессивному типу.
Фенилкетонурия (ФКУ) - тяжелое наследственное заболевание,
наступающее вследствие врожденного дефекта фермента, отвечающего в организме
человека за нормальный обмен фенилаланина (одной из незаменимых аминокислот,
входящих в состав белка).
При заболевании нарушаются обменные процессы, особенно важные для
развивающегося мозга ребенка. В крови и других жидкостях организма
накапливается в большом количестве фенилаланин и повышено образуются такие
вещества как фенилпировиноградная, фенилмолочная и фенилуксусная кислоты,
которые выделяются в повышенных количествах с мочой. Следствием нарушенного
обмена в мозге является тяжелое психическое недоразвитие. Если не предпринято
своевременное лечение, то больные на всю жизнь остаются глубокими инвалидами.
Поступающий в организм фенилаланин идет на построение белковой цепи или
превращается в тирозин. Отсутствие в печени фермента фенилаланингидроксидазы
препятствует нормальному превращению фенилаланина пищи в тирозин. Поэтому
фенилаланин используется лишь при синтезе белка, а избыток накапливается в
клетках печени и попадает в кровоток, где количество фенилаланина является
токсичным для клеток мозга. Почки не справляются с его реабсорбцией, в
результате чего он выводится с мочой. Именно наличие этого фенилкетона в моче
дало основание назвать соответствующее патологическое состояние
фенилкетонурией.
Варианты ФКУ
Фенилкетонурия 1.
Классическая
фенилкетонурия (ФКУ) описана А.Folling.,1934г.
Заболевание наследуется
аутосомно-рецессивно и вызвано мутацией гена, локализующегося в длинном плече
12 хромосомы.
В основе болезни лежит
дефицит фермента фенилаланин-4-гидроксилазы, обеспечивающего превращение
фенилаланина в тирозин. В результате метаболического блока происходит
значительное накопление в тканях и жидкостях больного организма фенилаланина и
таких его производных, как фенилпировиноградная, фенилмолочная, фенилуксусная
кислоты, фенилэтиламин, фенилацетилглютамин, и др.
В патогенезе ФКУ имеют значение следующие механизмы:
-
Прямое токсическое действие на ЦНС фенилаланина и его производных;
- Расстройства транспорта
аминокислот;
- Нарушение метаболизма
гормонов;
- Нарушение обмена
моноаминовых нейромедиаторов (катехоламинов и серотонина);
- Нарушение функции печени - диспротеинемия,
генерализованная гипераминоацидемия, повышение ДФА, метаболический ацидоз,
нарушение окислительной и белковосинтезирующей функции клеточных органелл.
Частота классической ФКУ
среди новорожденных по данным массового скрининга в среднем колеблется от
1:5000 до 1:10000 по разным регионам России.
Фенилкетонурия 2.
Впервые атипичная ФКУ
описана I.Smith, 1974г. Заболевание связано с дефицитом
дигидроптеридинредуктазы.
Заболевание наследуется
аутосомно-рецессивно. Генный дефект локализуется в коротком плече 4 хромосомы,
участке 4р 15.3.
В результате
недостаточности дигидроптеридинредуктазы нарушается восстановление активной
формы тетрагидробиоптерина, участвующего в качестве кофактора в
гидроксилировании фенилаланина, тирозина, и триптофана.
Частота заболевания
составляет 1:100000 новорожденных.
Рано начатое лечение
способствует нормализации фенилаланина в крови, однако не предупреждает появление
клинической симптоматики, которая развивается в начале второго полугодия жизни.
Фенилкетонурию 2 называют диеторезистентной ФКУ.
Фенилкетонурия 3.
Этот вариант болезни
описал S. Kaufman в 1978 г. Заболевание наследуется аутосомно-рецессивно и связано
с недостаточностью 6-пирувоилтетрагидроптерин синтетазы, участвующей в процессе
синтеза тетрагидробиоптерина. Развивающиеся при этом расстройства сходны с
нарушениями, наблюдаемыми при ФКУ 2.
Частота болезни
составляет 1:30000 новорожденных. Фенилкетонурия 3 также диеторезистентна.
Другие варианты ФКУ:
Эти формы ФКУ
связаны с нарушением альтернативных путей обмена фенилаланина. Формируется
метилминдальная ацидурия и парагидроскифенилуксусная ацидурия.
·
Материнская фенилкетонурия.
Заболевание
развивается у потомков женщин, страдающих ФКУ и не получающих диету в зрелом
возрасте. Патогенез мало изучен, предполагается, что он сходен с патогенезом
остальных форм ФКУ. Тяжесть поражения плода коррелирует с уровнем фенилаланина
в плазме матери. Так как эмбрион особенно чувствителен к тератогенным
воздействиям , рекомендуется начинать диету еще до наступления беременности. В
суточном рационе использовать менее 15-20 мг/кг фенилаланина. При это важно
избегать дефицита незаменимых аминокислот.
·
Клиническая фенилкетонурия.
При рождении
больные фенилкетонурией не отличаются от других новорожденных. Манифестация ФКУ
происходит обычно в возрасте 2-6 месяцев.
Дети с фенилкетонурией (ФКУ) рождаются без каких-либо признаков болезни. Однако
уже на втором месяце можно заметить некоторые физические признаки: посветление
волос, радужек глаз, что особенно заметно у детей, родившихся с темными
волосами. Многие дети очень быстро и чрезмерно прибавляют в весе, однако
остаются рыхлыми, вялыми. У большинства из них рано зарастает большой родничек.
Чаще всего явные признаки болезни обнаруживаются на 4-6 месяце жизни, когда
дети перестают реагировать радостью на обращение к ним, перестают узнавать
мать, не фиксируют взгляд и не реагируют на яркие игрушки, не переворачиваются
на живот, не сидят. В течение многих лет соответствующим диагностическим тестом
служит реакция между фенилпировиноградной кислотой, которая выделяется с мочой
ребенка, и хлорным железом. При положительной реакции появляется типичное зеленое
окрашивание. Кроме того, образуются и выводятся с мочой другие аномальные
метаболиты, такие как фенилмолочная и фенилуксусная кислоты. Последнее
соединение «пахнет мышами», так что болезнь легко диагностировать по запаху;
именно так она и была впервые обнаружена.
По мере
прогрессирования болезни могут наблюдаться эпилептиформные приступы -
развернутые судорожные и бессудорожные типа кивков, поклонов, вздрагиваний,
кратковременных отключений сознания. Гипертония отдельных групп мышц
проявляется своеобразной "позой портного" (поджатые ноги и согнутые
руки). Могут наблюдаться гиперкинезы, атаксия, тремор рук, иногда парезы по
центральному типу. Дети нередко белокурые со светлой кожей и голубыми глазами,
у них часто отмечаются экзема, дерматиты. Обнаруживается склонность к
артериальной гипотензии.
Первыми
проявлениями болезни служат:
-
вялость ребенка, отсутствие интереса к окружающему;
-
повышенная раздражительность, беспокойство;
-
срыгивание, рвота;
- судорожные эквиваленты: спонтанный рефлекс Моро,
спонтанный рефлекс Бабинского, сосательные автоматизмы, приапизм у мальчиков,
атетозные движения;
-
судорожный синдром;
-
заплесневелый, мышиный, волчий запах мочи и пота.
При отсутствии лечения формируется задержка статико-моторного и психоречевого
развития, умственная отсталость достигает, как правило, глубокой степени (идиотия или
имбецильность, глубокая психическая инвалидность).
Дигностика фенилкетонурии
Чрезвычайно важно установить диагноз в доклинической стадии или по
крайней мере не позднее 2-го месяца жизни, когда могут проявиться первые
признаки болезни. Для этого всех новорожденных обследуют по специальным
профаммам скрининга, выявляющего повышение концентрации фенилаланина в крови
уже в первые недели жизни. Оптимальные сроки
обследования новорожденных - 5-14-день жизни . Каждого ребенка, у которого обнаруживаются признаки
задержки развития или минимальная неврологическая симптоматика, необходимо
обследовать на патологию обмена фенилаланина. Используют микробиологический и
флюорометрический методы определения концентрации фенилаланина в крови, а также
пробу Фелинга на фенилпировиноградную кислоту в моче (прибавление нескольких
капель 5% раствора треххлористого железа и уксусной кислоты к моче больного
приводит к появлению зеленой окраски пятна на пеленке). Эти и другие подобные
методы относятся к категории ориентировочных, поэтому при положительных
результатах требуется специальное обследование с использована ем точных
количественных методов определения содержания фенилаланина в крови ц моче (хроматография
аминокислот, использование аминоанализаторов и др.), которое осуществляется
централизованными биохимическими лабораториями.
Дети требуют специального наблюдения и лечения в
медико-генетических центрах (кабинетах поликлиник).
Дифференциальный диагноз проводят с внутричерепной родовой
травмой, внутриутробными инфекциями.
ФКУ может быть
диагностирована на основе обнаружения следующих признаков:
o
стойкой
гиперфенилаланинемии (более 240 ммоль/л);
o
вторичного
дефицита тирозина;
o
экскреции
фенилкетонов с мочой (проба Феллинга на экскрецию фенилпировиноградной
кислоты).
В настоящее время, согласно приказу Минздрава России № 316 от 30.12.93
проведение неонатального скрининга на ФКУ стало обязательным. Скрининирующие
тесты должны быть простыми, недорогими и информативными.
Этим требованиям отвечают методы, используемые для ранней диагностики ФКУ:
o
метод
флюоресцирующих антител (лабораторный комплекс "Флюороскан",
позволяющий проводить 800 проб в час);
o
метод
тонкослойной хроматографии.
Оптимальные сроки
обследования новорожденных - доношенных, зрелых - 5-6 день жизни; недоношенных,
незрелых, больных - 10-14 день жизни.
Трактовка результатов:
1 группа.
Уровень
фенилаланина не превышает 200 ммоль/л (1-3 мг%) - норма;
2 группа.
Уровень
фенилаланина составляет 200-500 ммоль/л (3-10 мг%) - гиперфенилаланинемия. В
эту группу входят дети с транзиторной гиперфенилаланинемией, вследствие
незрелости ферментных систем печени и больные ФКУ. За данной группой проводится
наблюдение по следующему плану: если в течение 6 недель при еженедельном
исследовании уровень фенилаланина остается менее 500 ммоль/л, контроль за
уровнем фенилаланина крови проводят до 1 года первоначально каждые 3 месяца, а
затем каждые 6 мес. жизни. При уровне более 500 ммоль/л назначается
диетотерапия.
3 группа.
Уровень
фенилаланина превышает 500 ммоль/л (более 10 мг%), диагностируется ФКУ и с
момента постановки диагноза назначается диетотерапия.
В настоящее время разрабатываются и внедряются молекулярно-генетические методы
диагностики генного дефекта при ФКУ. Прямая диагностика мутантного гена
проводится с помощью синтетических олигонуклеотидных зондов, этот метод
пригоден для дородовой диагностики ФКУ и выявления гетерозиготного
носительства.
Помимо молекулярно-генетического анализа, выявление гетерозигот может
осуществляться биохимическими тестами после нагрузки фенилаланином в дозе 25
мг/кг.
Диеторезистентные формы ФКУ диагностируют при помощи:
o
исследования
биоптеринов мочи ;
o
перорального
нагрузочного теста с тетрагидробоиптерином (через 4-6 часов после однократной
дачи нагрузки в дозе 7,5 мг/кг массы тела происходит резкое снижение и
нормализация уровня фенилаланина в крови с одновременным повышением уровня
тирозина);
o
исследования
активности дигидроптеридинредуктазы и 6-пирувоилтетрагидроптерин синтетазы в
культуре кожных фибробластов, эритроцитах, гепатоцитах.
Наследственность
Болезнь наследуется по рецессивному типу: т.е. болеют сестры и братья из одной
семьи, а родители здоровы, хотя и являются гетерозиготными носителями гена ФКУ.
Ген фенилкетонурии встречается в среднем у 1-2 на 100 человек, но болезнь может
возникнуть лишь в том случае, если и мать и отец ребенка являются носителями
этого гена, и ребенок унаследует его в двойном наборе. Поэтому болезнь встречается
значительно реже, чем распространен ген. Больные ФКУ (обладатели двух
патологических генов) могут иметь детей с фенилкетонурией только при вступлении
в брак с носителями таких же генов. При вступлении в брак с лицами свободными
от гена ФКУ, дети не болеют этим заболеванием.
Лечение фенилкутонурии и
прогноз
Если
ничего не предпринимать, фенилкетонурия приводит к весьма тяжелым последствиям
- развивается олигофрения. К счастью, этот трагический исход можно
предотвратить, если поставить правильный диагноз при рождении. В наши дни это
легко осуществимо в ходе массового обследования (скрининга) новорожденных с
целью выявления ФКУ.
Главным
способом лечения является диетотерапия, ограничивающая поступление в организм
фенилаланина; приступить к ней нужно немедленно после установления диагноза.
При ранней
диагностике это гарантирует нормальное нервно-психическое развитие ребенка.
Диетотерапия,
как единственный эффективный метод лечения ФКУ, должна применятся с первых
месяцев жизни ребенка, тогда поражение мозга не разовьется. Важно ограничить
количество потребляемого фенилаланина таким образом, чтобы обеспечить его
поступление в организм в количествах, необходимых и достаточных для роста и
развития, но предотвратив его накопление в жидкостях тела. Кроме диетотерапии
необходим постоянный медицинский контроль за умственным и физическим развитием
ребенка.
Назначают
белковые гидролизаты (цимогран, лефанолак, берлофен, гипофенат) или
аминокислотные смеси, лишенные фенилаланина, которые становятся главными продуктами питания,
обеспечивающими потребность в белке: "Лофенолак", "Фенилфри"
(США), "Берлофен", "Апонти", "Гипофенат" у детей
до 4-5 лет и "Нофелан" - у детей старше 5 лет. Белковые гидролизаты
вводят с фруктовыми и овощными соками, пюре, супами.
Лечение
проводят под контролем содержания фенилаланина в крови, добиваясь поддержания
его уровня в пределах 0,03-0,04 г/л.
Строгое
ограничение белков животного происхождения требуется на протяжении первых 2-3
лет жизни. Наиболее
рационально отменять диетическое лечение в возрасте 7-8 лет.
-Препараты
с промедиаторным действием:
1.Наком (комбинация карбиДОФА и левоДОФА) - доза 100-375 мг/сутки в
течение 3-4 недель, перерыв между курсами 1,5-2 месяца;
2.Лево-дофа - доза 10-15 мг/кг в сутки;
3.5-окситриптофан - доза 10 мг/кг сутки.
-Ноотропные
препараты
-Витамины
-ЛФК,
массаж
При
диеторезистентных формах лечение включает назначение тетрагидробиоптерина -
доза 10-20 мг/кг в сутки.
Профилактика фенилкетонурии
1.
Выявление
гетерозиготных носителей. Большое значение имеет специальное наблюдение за
семьями риска, т. е. за такими семьями, где уже имелись дети с фенилкетонурией.
Новорожденные из этих семей должны быть подвергнуты обязательному
биохимическому исследованию и при показаниях к раннему лечению.
2.
Внедрение
программ массового скрининга новорожденных для раннего выявления ФКУ и
своевременного назначения диетотерапии. Выявление и лечение детей по программам
массового скрининга также позволяет предупредить развитие тяжелой психической
инвалидности.
3.
Пренатальная
диагностика: Предложен ДНК-зонд для пренатальной диагностики фенилкетонурии в
семьях высокого риска.