Хром и пигменты на его основе
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ
АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
БЕЛГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ
НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ УНИВЕРСИТЕТ
(НИУ "БелГУ")
БИОЛОГО-ХИМИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА ОБЩЕЙ ХИМИИ
Курсовая работа
студента дневного отделения 1 курса
группы 84001302
Хром и пигменты на его основе
Титова Евгения Николаевича
Научный руководитель:
кандидат химических наук,
доцент Л.А. Дейнека
Белгород 2014
Содержание
Введение
1. Литературный обзор
1.1 Хром
1.1.1 Историческая справка
1.1.2 Распространение хрома в природе
1.1.3 Получение хрома
1.1.4 Физические и химические свойства хрома
1.1.5 Применение хрома и его соединений
1.1.6 Соединение хрома (II)
1.1.7 Соединение хрома (III)
1.1.8 Соединение хрома (VI)
1.2 Неорганические пигменты на основе хрома
1.2.1 Хромовые пигменты
1.2.2 Окись хрома
1.2.3 Изумрудная зелень
2. Экспериментальная часть
2.1 Реактивы, оборудование
2.2 Методики исследования
2.2.1 Синтез Оксида хрома.
2.2.2 Синтез Изумрудной зелени.
3. Результаты и обсуждения результатов
3.1 Получение оксида хрома (III)
3.2 Получение изумрудной зелени
Вывод
Список литературы
Введение
Хром (лат. Cromium), обозначается символом Cr, химический элемент VI группы, побочной
подгруппы системы химических элементов Д.И. Менделеева, атомный номер 24,
атомная масса 51,996.
Хром используется в быту и промышленности. Многие сорта
нержавеющей стали содержат больше 17% хрома. Им покрывают изделия для защиты от
коррозии. Так же хром является микроэлементом, необходимый для нормального
развития и функционирования человеческого организма. В биологических процессах
принимает участие только хром (III). Он участвует в регуляции уровня крови и
глюкозы. Хромиты окрашены в темный цвет, имеют металлический блеск. Широко
используются в огнеупорной промышленности. Магнезитохромитый кирпич -
огнеупорный материал для печей и других металлургических агрегатов [1].
Целью курсовой работы является: Изучить способы получения и
свойства хрома и его соединений. Изучить и установить значение этого элемента в
промышленности. Изучить способы получения неорганических пигментов на основе
хрома.
Задачи:
Изучить свойства хрома и способы его получения;
Изучить свойства соединений хрома и способы их получения;
Изучить способы получения неорганических пигментов на основе
хрома;
Получить неорганические пигменты на основе хрома.
1.
Литературный обзор
1.1 Хром
1.1.1
Историческая справка
Минерал, в котором содержался хром, был открыт в
Екатеринбурге в 1766 г. Леманном и назван "сибирским красным
свинцом". Сейчас этот минерал называется крокоитом. Формула - PbCrO4. Несколько лет спорили о
составе этого минерала, пока, в 1797 г. химик Воклен выделил из него металл,
который назвали хромом. Воклен обработал крокоит поташем K2CO3: хромат свинца
превратился в хромат калия. Затем его обработали соляной кислоты хромат калия
был превращен в окись хрома и воду. Нагрев зеленый порошок окиси хрома в
графитовом тигле с углем, Луи Воклен получил новый металл.
В дальнейшем оказалось, что Луи получил не чистый металл, а
его карбид. Его друзья уговорили ученого назвать элемент "хром" из-за
яркой окраски. Так и утвердилось новое название элемента [3].
Ганс Гольдшмидт в 1894 г. открыл алюмотермический метод,
который помог получить металлический хром [2].
1.1.2
Распространение хрома в природе
В земной коре хрома - 0,02%. Важнейшей хромовой рудой
является хромистый железняк (FeO∙Cr2O3). Встречается он в Южной Африке, Греции.
Хромовая руда носит название хромитов или хромистого железняка (так как всегда
содержит железо). Также огромное техническое значение имеет свинцовая руда (PbCrO4). Добываю ее Бразилии и
на Урале [3].
Интересным минералом является смарагд (природный). Его
интерес в том, что собой он представляет окрашенный в глубокий темно-зеленый
цвет берилл, в котором алюминий замещен хромом [3].
В основном хром - металл глубинных зон Земли. Так же в
метеоритах ученые обнаружили хром (2,7∙10-1 %). Известно свыше
20 минералов хрома [4].
1.1.3
Получение хрома
В основном для получения хрома и его соединений используют
хромистый железняк. Если нужно получить не чистый хром, а его сплав с железом,
то хромистый железняк восстанавливают углем в электрических печах:
FeO∙Cr2O3 + 4C = Fe +
2Cr +4CO [13]
Для получения чистого хрома используют алюмотермическое
восстановление:
Cr2O3 + 2Al = Al2O3
+2Cr + 130 ккал. [12].2O3
+ CrO3 +4Al = 3Cr + 2Al2O3 [3].
Очень чистый металл серого цвета выделяется при
электролитическом восстановлении соединений Cr:
2Cr2 (SO4) 3 +
6H2O + 12e = 4Cr + 3O2 + 6H2SO4
Сплавлением хромита железа с карбонатом кальция на воздухе
получают чистый хром:
4Fe (CrO2) 2 + 8Na2CO3
+ 7O2 = 8Na2CrO4 + 2Fe2O3
+8CO2 [1]
1.1.4
Физические и химические свойства хрома
Хром - серебристый металл с плотностью 7200 кг/м3.
Определить температуру плавления очень тяжело, так как малейшем влиянии
кислорода влияет на величину этой температуры. Но ученые смогли определить
температуру плавления и она равна 1907 оС, а температура кипения
хрома 2671 оС. Чистый хром вязок и ковок. При загрязнении становится
хрупким и твердым. Удельный вес хрома 7,2. Он почти не окисляется на воздухе.
Электронная конфигурация атома хрома: [Ar] 3d54s1.
Степени окисления проявляет: +2, +3, +6, наиболее устойчиво соединение Cr+3.
Очень редко прояляются соединение +1,+4, +5 [1].
Очень малоактивный металл. Но может образовывать
соединения со фтором (CrF3). Обычный хром реагирует с кислотами:
+ 2HCl = CrCl2 + H2 [11]
Но если в процессе добавить азотную кислоту, то
реакция прекращается - хром - пассивирует.
При нагревании металлический хром реагирует с
галогенами, серой и некоторыми другими элементами:
+ 3Cl2 = 2CrCl3
При нагревании хрома с расплавленной содой,
нитратами щелочных металлов получают хроматы (VI):
Cr + 2Na2CO3 + 3O2
= 2Na2CrO4 + 2CO2
Хром - инертный металл, при нагревании становится
довольно активным.
При нагревании выше 600 оС хром
сгорает в кислороде:
Cr + 3O2 = 2Cr2O3
С азотом реагирует при температуре выше 1000 оС
с образованием нитридов:
Cr + N2 = 2CrN
Cr +N2 = 2Cr2N
Реагирует с бором, углеродом и кремнием с
образованием боридов, карбидов и силицидов:
+ 2B = CrB2
Cr + 3C = Cr2C3+ 2Si = CrSi
С водородом не взаимодействует.
В раскаленном состоянии хром реагирует с водой:
Cr + 3H2O = Cr2O3 + 3H2
Концентрированная азотная и серная кислоты пассивируют хром
[15]. Хром может растворятся только при нагревании:
Cr + 6H2SO4 (конц.) = Cr2 (SO4) 3 + 3SO2 +6H2O
Cr +6HNO3 = Cr (NO3) 3
+ 3NO2 + 3H2O
Хром реагирует с расплавами щелочей с образованием хромитов:
Cr + 6KOH = 2KCrO4 + 2K2O + 3H2
Хром - активный металл, способен вытеснять металлы из
растворов их солей:
Cr + 3CuCl2 = 2CrCl3 + 3Cu [1].
1.1.5
Применение хрома и его соединений
Мировым лидером в производстве высокочистого хрома является
фирма Bell Metals. Хром применяется для приготовления различных сталей. Стали
содержащие хром, почти не ржавеют. Хром широко применяется для хромирования
изделий. Покрытые пленкой изделия не ржавеют и становятся очень устойчивыми.
Хром зарядом +3 входит в состав минерала - рубине. Соединениями хрома
протравливают ткани при крашении. При добавлении к бронзе или латуни хрома,
возрастает их твердость. Соли хрома (III) используют в красильной промышленности, так же
они являются хорошими восстановителями. Хроматы и дихроматы очень хорошие
окислители. Применяют их при изготовлении органических красок. Многие другие
соли хрома использую в качестве минеральных красок. Но при изготовлении красок
надо учитывать то, что они ядовиты [4].
1.1.6
Соединение хрома (II)
Соединения хрома двухвалентного малоустойчивые. При
растворении в кислотах хром сначала переходит преимущественно в двухвалентное
соединение, но затем быстро переходит в трехвалентный хром.
Растворы солей хрома (II) окрашены в голубой
цвет. Но безводные соли, окрашены в другие цвета, тогда как содержащие воду
соли хрома (II) имеют голубой цвет [3].
Химические свойства и получение соединений хрома (II)
Гидроксид хрома (II) - вещество желтого цвета.
Реагирует с концентрированными кислотами (образует соли хрома
(II) синего цвета), но с
разбавленными кислотами и щелочами не реагирует:
Cr (OH) 2 + H2SO4 (конц.) = CrSO4
+ 2H2O (OH) 2 + H2SO4 (разб.) =
Желтый гидроксид хрома (II), на воздухе быстро
окисляется с
образованием зеленого метагидроксида хрома (III).
4Cr (OH) 2 + O2 + = 4CrO
(OH) + 2H2O [14].
Получают при взаимодействии солей хрома (II) со щелочами без
кислорода:
CrCl2 + 2NaOH = Cr (OH) 2 + 2NaCl
Хлорид хрома (II) - блестящие белые
кристаллы.
В растворах окисляется кислородом воздуха (сильный
восстановитель):
CrCl2 + O2 + 4HCl = 4CrCl3 + 2H2O
Без окислителя восстанавливает даже воду:
CrCl2 + 2H2O = 2CrOHCl2 + H2
Получаются восстановлением солей хрома (III):
2CrCl3 + 3Zn + 4HCl = 2CrCl2
+ 3ZnCl2 + 2H2
Оксид хрома (II) - кристаллическое вещество
красного (черного) цвета.
Окисляется при температуре свыше 100 оС:
CrO + O2 = 2Cr2O3 [16].
Реагирует с соляной кислотой (сильный восстановитель), но не
реагирует с разбавленной серной и азотной кислотой и щелочами:
CrO + 6HCl = 2CrCl3 + H2 + 2H2O
Получают окислением амальгамы хрома кислородом воздуха или
термическим разложением карбонила:
2Cr/Hg + O2 = 2CrO + 2Hg(CO) 6
= CrO + 5CO + C [5].
1.1.7
Соединение хрома (III)
Самым устойчивым соединением являются соединения хрома (+3).
Химические свойства и получения соединений хрома (III)
Гидроксид хрома (III) - цвет вещества зависит
от многих условий (от голубого и зеленого до черно-фиолетового), хорошо
разлагается:
Cr (OH) 3 = Cr2O3 + 3H2O
Является амфотерным элементом (реагирует с кислотами и
щелочами):
2Cr (OH) 3 + 6HCl = 2CrCl3
+ 3H2O(OH) 3 + 3NaOH = Na3 [Cr (OH) 6]
хром неорганический пигмент соединение
Получается при действии водного раствора аммиака на соли
хрома или при пропускании углекислого газа через щелочной раствор
гексагидроксохромата (III) натрия:
CrCl3 + 3NH3 + 3H2O
= Cr (OH) 3 + 3NH4Cl3 [Cr (OH) 6] +
3CO2 = Cr (OH) 3 + 3NaHCO3
Оксид хрома (III) - темно зеленый порошок
имеет металлический блеск.
Проявляет амфотерные свойства:
Cr2O3 + 2KOH = 2KCrO2 + H2O
Cr2O3 + Na2CO3 = 2NaCrO2 + CO2
Сплавление с кислотным реагентом (проявляет основные
свойства):
Сr2O3 + 3SO3 = Cr2 (SO4) 3
Cr2O3 + 3K2S2O7 = Cr2 (SO4) 3 + 3K2SO4
Получают при термическом разложении дихромата аммония или
восстановлением дихромата калия коксом:
(NH4) 2Cr2O7 = Cr2O3
+ N2 + 4H2O
K2Cr2O7 +3C =
2Cr2O3 + 2K2CO3 + CO2
В щелочной среде устойчивое соединение, но в кислой
разрушается:
KCrO2 + HCl (недост.) + H2O = Cr (OH) 3 + KCl
KCrO2 + 4HCl (изб.) = CrCl3 + NaCl + 2H2O
Соединения хрома (III) являются окислителями и восстановителями:
1) 2CrCl3 + 3H2O2
+10KOH = 2K2CrO4 + 6KCl + 8H2O
) 2CrCl3 + 3Zn +4HCl = 2CrCl2
+ 3ZnCl2 +2H2
1) Cr3+ - восстановитель
) Cr3+ - окислитель [6].
1.1.8
Соединение хрома (VI)
Очень токсичные соединения. Является канцерогеном (вызывает
опухоли). Шестивалентный хром транспортируется в клетки человека с помощью
сульфатно-транспортного механизма. Химические свойства и получение соединений
хрома (VI). Основными соединением хрома (VI) являются хромовые
кислоты, которые в свободном состоянии не выделены. Хроматы - это соли хромовой
кислоты. Имеют желтую окраску (хроматы), а оранжевую окраску (дихроматы).
Хроматы устойчивы в щелочной среде, дихроматы в кислой. При нагревании
дихроматы разлагаются:
K2Cr2O7 = 4K2CrO4 + 2Cr2O3 + 3O2
Соли хрома (VI) являются окислителями:
1) K2Cr2O7 + 3 (NH4) 2S + H2O = 2Cr (OH) 3 + 3S +6NH3 + 2KOH (нейтральная среда)
2) K2Cr2O7
+ 3K2SO3 + 4H2SO4 = Cr2
(SO4) 3 + 4K2SO4 + 4H2O (кислая среда)
) 2K2CrO4 + 3 (NH4)
2S + 2KOH + 2H2O = 2K3 [Cr (OH) 6]
+ 3S +6NH3 (щелочная среда)
Получить соли калия можно при сплавлении хромистого железняка
с карбонатами при температуре выше 1000 оС:
4FeCr2O4 + 8K2CO3
+ 7O2 = 8K2CrO4 + Fe2O3 +
8CO2
Оксид хрома (VI) - темно-красное вещество
(кристаллическое вещество).
Реагирует с водой:
CrO3 + H2O = H2CrO4
CrO3 + H2O = H2Cr2O7
Реагирует с основаниями и основными оксидами:
CrO3 + 2NaOH = Na2CrO4
+ H2O3 + BaO = BaCrO4
Оксид хрома (VI) является сильным окислителем:
CrO3 + 3C = 2Cr2O3 + 3CO2
Получают при разложении хромата калия с серной кислотой при
температуре:
K2CrO4 + 2H2SO4
= CrO3 + 2KHSO4 + H2O [7].
1.2
Неорганические пигменты на основе хрома
Пигменты (лат. Pigmentum - краска) - это очень высокодисперсные вещества,
нерастворимы в воде и других органических растворителях. Придают солям цвет и
противокоррозийные и другие свойства [8].
Пигменты людям были известны еще в глубокой древности.
Цветные рисунки найденные в Альтамирской пещере в Испании свидетельствуют
этому. В качестве пигмента древние люди использовали в основном уголь. В
древнем Египте людям было известно 3 красных пигмента: пурпур, киноварь и охра
и зеленые пигменты на основе силикатов меди.
Но только в первой половине XVIII в. появляются отдельные
отрасли производства пигментов.
В 1797г. был описан метод получения хромовокислого свинца, но
производить его стали только в 1818г. В наше время этот желтый пигмент
используют в живописи и промышленности.
Раньше люди использовали пигменты только для окрашивания, но
сейчас его используют в качестве защиты изделия от коррозии [9].
Классификация пигментов:
) По химическому составу и цвету:
. Ахроматические
2. Белые
. Черные
. Серые
. Хроматические
2) По значению специальных пигментных свойств:
. Пигменты - красящие вещества
2. Пигменты - наполнители
3) По назначению:
. Общего назначения
2. Для противокорозийных материалов
. Придание предметам специальных свойств
. Для художественных красок
4) По влиянию на коррозию
. Антикоррозионные
2. Коррозионно-нейтральные
. Стимуляторы [8].
1.2.1
Хромовые пигменты
Многие из соединений трехвалентного хрома окрашены либо в фиолетовый,
либо в зеленый цвет. Пигментами хрома зеленого цвета являются:
) Изумрудная зелень (гидрат окиси хрома) - Cr2O3 ∙ n H2O;
2) Соединения типа шпинелей;
) Окись хрома - Cr2O3;
) Силикаты или фосфаты хрома;
Но практическое и очень важное значение имеет изумрудная
зелень и окись хрома.
Хромовые шпинели и силикаты применяются в керамической
промышленности, но фосфаты хрома не имеют практического значения. В широких
предел для соединений хрома характерно изменение окраски при постоянном
химическом составе. Окраска хромовых соединений зависит от температуры
раствора, наличия избытка кислоты и т.д. [9].
1.2.2 Окись
хрома
Впервые окись хрома была получена в 1809 г. при прокаливании
хромовой ртути:
Hg2CrO4 2Cr2O3 + 8Hg + 5O2
Но затем были открыты и другие способы получения окиси хрома.
Например, прокаливанием смеси серы с хромпиком, хлористым аммонием или углем.
Окись хрома представляет собой зеленый пигмент с оттенками от
желтого до синего цвета. Имеет ярко выраженные пигментные свойства:
. нерастворимость в кислотах и щелочах.
2. устойчив к свету.
Используется для малярных работ, для производства
художественных красок, для живописи и для печати денежных знаков.
В природе окись хрома не встречается. Искусственно его
получают прокаливанием:
Cr (OH) 3 прокаливание Cr2O3 + 3H2O
K2Cr2O7 + S прокаливание Cr2O3 + K2SO4
Cr2 (SO4) 3 прокаливание Cr2O3 + 3SO3
Формула изумрудной зелени: Cr2O3 ∙ n H2O. Вода может быть удалена
из соединения без изменения цвета пигмента. Но вот удаление абсолютно всей воды
приводит к полному разрушению пигмента. Так же изумрудная зелень содержит
примеси безводной окиси хрома и борного ангидрида. Цвет изумрудной зелени -
изумрудно-зеленый. Так же как и у окиси хрома очень хорошо выражены пигментные
свойства:
. Стойкость к свету.
2. Не реагирует ни с кислотами, ни с щелочами [9].
2.
Экспериментальная часть
2.1 Реактивы,
оборудование
Получение оксида хрома:
. Дихромат калия
2. Активированный уголь
. Фарфоровая ступка
. Фарфоровый тигель
. Муфельная печь
. Дистиллированная вода
. Фарфоровый стакан
. Воронка
. Фильтр
. Сушильный шкаф
Получение изумрудной зелени:
. Борная кислота
2. Дихромат калия
. Фарфоровая ступка
. Фарфоровый тигель
. Муфельная печь
. Дистиллированная вода
. Фарфоровый стакан
. Воронка
. Фильтр
. Сушильный шкаф
2.2 Методики
исследования
2.2.1 Синтез
Оксида хрома.
Рассчитанное количество дихромата калия помещают в фарфоровую
ступку и измельчают в порошок. Добавляют рассчитанное количество угля и смесь
измельчают в течение 20-30 мин. до получения тонкодисперсного однородного
вещества. Порошок насыпают в фарфоровый тигель на половину его объема и прокаливают
в течение 60-80 мин в муфельной печи при 650-700 оС. Размолотый
полуфабрикат переносят в фарфоровый стакан вместимостью 1л и промывают 3-4 раза
дистиллированной водой. Затем пигмент сушат при 100-150 оС [10].
.2.2 Синтез
Изумрудной зелени.
При составление шихты борную кислоту берут в большом избытке.
Рассчитанное количество дихромата калия и борной кислоты растирают в фарфоровой
ступке в течение 15-20 мин до получения однородной массы. Полученную шихту
насыпают в фарфоровый тигель на половину его объема и прокаливают в течение
30-40 мин в муфельной печи при 500-600оС.
После охлаждения полученный сплав измельчают в фарфоровой
ступке и обрабатывают водой. Затем пигмент сушат при 75-80 оС [10].
Высушенный пигмент измельчают в фарфоровой ступке.
3. Результаты
и обсуждения результатов
3.1 Получение
оксида хрома (III)
В ходе эксперимента предполагаем получить 1,7 г - Cr2O3
2K2Cr2O7 + 3C +
2H2O = 2Cr2O3 + 3CO2 + 4KOH
1) n (Cr2O3) = 1,7г. / 152г. /моль =
0,01 моль
2) n (C) = x/3 = 0,01/2; x=0,015 моль
3) n (K2Cr2O7)
= y/2 = 0,01/2;
y= 0,01 моль
4) m (C) = 0,015 моль ∙12г. /моль = 0,18г.
5) m (K2Cr2O7) = 0,01 моль ∙ 294г. /моль = 2,94г.
)
Помещают в фарфоровую ступку 2,94 г. дихромата калия и
измельчают его. Добавляют 0,18 г. активированного угля и смесь измельчают в
фарфоровой ступке в течение 20-30 мин. до получения однородного порошка
(рис.1).

Рис. 1 Дихромат калия и активированный уголь
Порошок высыпают в фарфоровый тигель на половину его объема и
прокаливают 60-70 мин. в муфельной печи при 650-700 оC. После прокаливания
смесь охлаждают и переносят фарфоровую ступку наливают дистиллированную воду в
соотношении полуфабрикат: вода =1: 0,5.
Размолотый полуфабрикат переносят в фарфоровый стакан и
промывают 3-4 раза водой. Суспензию отфильтровывают на воронке Бюхнера и осадок
промывают 5-6 раз водой. После этого пигмент сушат при 100-105 оC до постоянной массы.
Для улучшения цвета пигмента его подвергают вторичному
прокаливаю при 700-800 оC в течение 40-60 мин. Вторичное прокаливание
улучшает цвет пигмента [10].
Масса пигмента после прокаливания составила 0,48 г.
Рассчитаем выход продукта реакции:
7) Ŋ=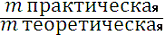
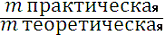 =
= 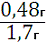
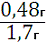 =0,28 г или 28 %
=0,28 г или 28 %
3.2 Получение
изумрудной зелени
В ходе эксперимента предполагаем получить 1,7 г - Cr2O3 ∙ 2H2O
3K2Cr2O7 + 44H3BO3
= 3Cr2 (B4O7) 3 + 2K3B4O7
+ 66H2O + 5O2
Cr2 (B4O7) 3
+ 20H2O = 12H3BO3 + Cr2O3 ∙
2H2O
1) n (Cr2O3 ∙
2H2O) = 1,7г. / 188г. /моль = 0,009 моль
2) n (Cr2 (B4O7)
3) = x/1 = 0,009/1; x = 0,009 моль
3) n (H3BO3)
= y/32 = 0,009/2; y = 0,132 моль
4) n (K2Cr2O7)
= z/3 = 0,009/3; z = = 0,009 моль
) m (H3BO3) = 0,132 моль ∙ 61г. /моль = 8г.
6) m (K2Cr2O7) = 0,009 моль ∙ 294г. /моль = 2,646г.
Помещают в фарфоровую ступку 8г. борной кислоты, измельчают и
добавляют 2,646г. дихромата калия и смесь измельчают в течении 20-30 мин. до
получения однородного порошка (рис.2).

Рис. 4 Борная кислота и дихромат калия
Порошок высыпают в фарфоровый тигель на половину его объема и
прокаливают 30-40 мин. в муфельной печи при 550-600 оС.
После прокаливания смесь охлаждают и переносят в фарфоровую
ступку (для измельчения). Наливают дистиллированную воду в соотношении
полуфабрикат: вода =1: 0,5. Размолотый полуфабрикат переносят в фарфоровый
стакан и промывают 3-4 раза водой. Суспензию отфильтровывают на воронке Бюхнера
и осадок промывают 5-6 раз водой. После этого пигмент сушат при 75-80 оC. Для улучшения цвета
пигмента его подвергают вторичному прокаливаю при 650-680 оC в течение 3-4 ч.
Вторичное прокаливание улучшает цвет пигмента делая его более светлее [10].
Масса полученного пигмента составила 1,54 г
Рассчитаем выход продукта реакции:
8) Ŋ=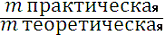
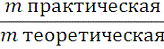 =
= 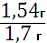
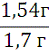 =0,9 г или 90 %
=0,9 г или 90 %
Ошибка: 10 %.
Вывод
· Изучены химические свойства и способы
получение хрома.
· Изучены химические свойства и способы
получения соединений хрома (II III и VI). Изучено применение в промышленности.
· Изучены способы получения пигментов на
основе хрома.
· Получены пигменты: оксид хрома и
изумрудная зелень.
Список
литературы
1. http://ru.
wikipedia.org/wiki/%D5%F0%EE%EC#. D0. A5. D0. B8. D0. BC. D0. B8. D1.87. D0.
B5. D1.81. D0. BA. D0. B8. D0. B5_. D1.81. D0. B2. D0. BE. D0. B9. D1.81.
D1.82. D0. B2. D0. B0
2. http://www.alhimikov.net/otkritie_elementov/Cr.html
3. Реми
Г. "Курс неорганической химии" с.142-147
. http://ido.
tsu.ru/schools/chem/data/res/neorg/uchpos/text/g4_10_5.html
6. http://ido.
tsu.ru/schools/chem/data/res/neorg/uchpos/text/g4_10_6.html
<http://ido.tsu.ru/schools/chem/data/res/neorg/uchpos/text/g4_10_6.html>
. http://ido.
tsu.ru/schools/chem/data/res/neorg/uchpos/text/g4_10_7.html
<http://ido.tsu.ru/schools/chem/data/res/neorg/uchpos/text/g4_10_7.html>
. Пигменты. Единая
Торговая Марка. с.3
. Беленький Е.Ф. Химия
и технология пигментов. Издание третье. с.11-14 с.529-543
. Лидин Р.А.
"Химические свойства неорганических веществ" Часть 2. с.144-145
. Некрасов Б.В.
"Основы общей химии" Том.1 изд.3-е.
. Балятинская Л.Н.,
Фофанов Г.М. "Конспект лекций по дисциплине "Неорганическая
химия", Химия элементов и их соединений c.57
. Степин Б.Д. "Неорганическая
химия" 1994 с.449
. Гончаренко Л.И.
"Химия. Учебно-практический справочник" 2014 с.70
. Рудзимис Г.Е.
"Химия. Неорганическая химия" 9 класс стр.68