Пищевые кислоты в питании
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
БИРСКИЙ
ФИЛИАЛ
ФЕДЕРАЛЬНОГО
ГОСУДАРСТВЕННОГО БЮДЖЕТНОГО ОБРАЗОВАТЕЛЬНОГО УЧЕРЕЖДЕНИЯ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«БАШКИРСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Факультет
биологии и химии
Кафедра химии
и методики обучения химии
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ РАБОТА
Пищевые
кислоты в питании
Гайнуллина Юлия Ильшатовна
Направление: 04.03.01 - «Химия»
Профиль подготовки: «Органическая и
биоорганическая химия»
Оглавление
Введение
Глава I. Литературный обзор
.1 Содержание пищевых кислот в
продуктах питания
.2 Кислотность пищевых продуктов
.3 Пищевые кислоты, их
характеристика
.3.1 Уксусная кислота
.3.2 Молочная кислота
.3.3 Лимонная кислота
.3.4 Яблочная кислота
.3.5 Винная кислота
.3.6 Аскорбиновая кислота
.3.7 Янтарная кислота
.3.8 Адипиновая кислота
.3.9 Фумаровая кислота
.3.10 Фосфорная кислота
.4 Методы определения кислот в
пищевых продуктах
.4.1 Вкусовые свойства кислот
Глава II. Экспериментальная часть
.1 Качественное определение
аскорбиновой кислоты
.2 Определение содержания
аскорбиновой кислоты йодометрическим титрованием
.2.1 Теоретическое обоснование
титрования, определения и расчета количества аскорбиновой кислоты
.2.2 Исследование динамики изменения
содержания аскорбиновой кислоты при термообработке
Глава III.
Результаты и их обсуждение
Выводы
Литература
Приложение
Введение
Пищевые кислоты представляют собой разнообразную
по своим свойствам группу веществ органической и неорганической природы. Состав
и особенности химического строения пищевых кислот различны и зависит от
специфики пищевого объекта, а также от природы кислотообразования.
В большинстве растительных объектов обнаружены
нелетучие моно- и трикарбоновые кислоты, предельные и непредельные, в том числе
гидрокси- и оксокислоты. В продуктах переработки плодов, например, в мезге,
могут быть выявлены летучие кислоты - муравьиная и уксусная.
Пищевые кислоты в организме человека играют
важную роль:
. обладают энергетической ценностью,
участвуют в обмене веществ: лимонная кислота - 2,5 ккал/г, яблочная -
2,4 ккал/г, молочная - 3,6 ккал/г;
. участвует в процессах пищеварения,
активирует перистальтику кишечника и стимулирует секрецию пищеварительных
соков;
. влияют на формирование определенного
состава микрофлоры путем снижения pH;
. тормозят развитие гнилостных процессов
в толстом кишечнике;
. отдельные кислоты (лимонная)
препятствуют образованию канцерогенных нитрозоаминов, обладают антисептическим
действием (бензойная кислота).
В связи с выше сказанным, целью работы является
исследование структуры, физико-химических свойств, способов получения пищевых
кислот.
Задачи:
Изучить литературу по теме выпускной
квалификационной работы;
Рассмотреть основные пищевые кислоты;
Отработать методики выделения кислот из пищевого
сырья и готовых
пищевых продуктов.
Объект исследования: аскорбиновая кислота.
Предмет исследования: способы получения и
физико-химические свойства аскорбиновой кислоты.
Глава I. Литературный обзор
.1 Содержание пищевых кислот в
продуктах питания
Почти во всех пищевых продуктах содержатся
кислоты и их кислые и средние соли. В продуктах переработки кислоты переходят
из сырья, но их часто добавляют в процессе производства или они образуются при
брожении. Кислоты придают продуктам специфический вкус, запах, продлевают срок
хранения, а также способствуют их лучшему усвоению.
В растительных объектах чаще всего встречаются
органические кислоты - яблочная, лимонная, винная, щавелевая,
пировиноградная, молочная. В животных продуктах распространены молочная,
фосфорная, и другие кислоты. Кроме того, в свободном состоянии в небольших
количествах находятся жирные кислоты, которые иногда ухудшают вкус и запах
продуктов. Как правило, в пищевых продуктах содержатся смеси кислот. Благодаря
наличию свободных кислот и кислых солей многие продукты и их водные вытяжки
обладают кислой реакцией.
В результате переработки и хранения продуктов
кислотность может изменяться. Так, кислотность капусты, огурцов, яблок и
некоторых других овощей и плодов возрастает в процессе квашения в результате
новообразования кислот. Кислотность теста увеличивается в процессе брожения, а
кислотность молока - при изготовлении, например, кефира, сметаны,
простокваши; при этом кисломолочные продукты отличаются новыми свойствами по
сравнению с исходным сырьем, а некоторые из них относятся к диетическим.
При хранении готовых продуктов их кислотность
может увеличиваться, в результате чего их качество снижается (прокисание
столовых виноградных вин, пива, прогоркание жиров и др.). Свежая пшеничная и
ржаная мука всегда имеет кислую реакцию, которую обуславливают кислые соли,
главным образом KH2РО4
и Сa(H2РО4).
В процессе длительного хранения кислотность муки увеличивается в результате
ферментативного распада фосфоглицеридов с образованием жирных кислот и
фосфорной кислоты, а также вследствие гидролиза жиров на жирные кислоты и
глицерин. При повышенной влажности в процессе хранения сахара и муки под
влиянием молочнокислых бактерий образуется молочная кислота, которая в
дальнейшем при действии соответствующих бактерий может превращаться в уксусную
и пропановую кислоты.
Кислотность молока и молочных продуктов
формируется как за счет молочной кислоты, которая образуется в результате
биохимических превращений лактозы молок, так и за счет других, содержащихся в
молоке кислот и кислых солей, а также кислотных групп казеина.
Названия и формулы некоторых кислот, наиболее
часто встречающихся в пищевых продуктах, представлены в табл. 1.
Таблица 1
Названия и формулы основных пищевых кислот
|
Название
кислоты
|
Название
ионизированной формы кислоты
|
Формула
|
|
Аскорбиновая
|
Аскорбат
|
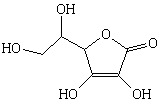
|
|
Аспарагиновая
|
Аспартат
|
HООС-СH2-СH(NH2 )-СООH
|
|
Бензойная
|
Бензоат
|
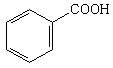
|
|
Винная
|
Тартрат
|
HООС-СH(ОH)-СH(ОH)-СООH
|
|
Гликолевая
|
Гликолат
|
HОСH2-СООH
|
|
Глицериновая
|
Глицерат
|
HОСH2-СH(ОH)-СООH
|
|
Глутаминовая
|
Глутамат
|
HООС-(СH2)2-СH(NH2)-СООH
|
|
Изолимонная
|
Изоцитрат
|
HООС-СH(ОH)-СH(СООH)-СH2-СООH
|
|
α-Кетоглутаровая
|
Кетоглутарат
|
HООС-С(О)-(СH2)-СООH
|
|
Лимонная
|
Цитрат
|
(HООС-СH2)2-С(ОH)-СООH
|
|
Молочная
|
Лактат
|
СH3-СH(ОH)-СООH
|
|
Муравьиная
|
Формиат
|
HСООH
|
|
Пировиноградная
|
Пируват
|
СH3-С(О)-СООH
|
|
Пироглутаминовая
|
Пироглутамат
|
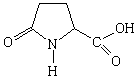
|
|
Соляная
|
Хлорид
|
HСl
|
|
Серная
|
Сульфат
|
H2SО4
|
|
Уксусная
|
Ацетат
|
СH3-СООH
|
|
Фосфорная
|
Фосфат
|
H3РО4
|
|
Фумаровая
|
Фумарат
|
транс-СООH-СH=СH-СООH
|
|
Хинная
|
Хиннат
|
С6H7(ОH)4СООH
|
|
Шикимовая
|
Шикимат
|
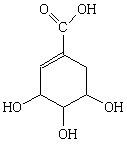
|
|
Щавелевая
|
Оксалат
|
HООС-СООH
|
|
Щавелевоуксусная
|
Оксалоацетат
|
HООС-С(О)-СH2-СООH
|
|
Яблочная
|
Малат
|
HООС-СH2-СH(ОH)-СООH
|
|
Янтарная
|
Сукцинат
|
HООС-СH2-СH2-СООH
|
Основным источником пищевых кислот является
растительное сырье и продукты его переработки. Органические пищевые кислоты
содержатся в большинстве видов растительных пищевых объектов - ягодах, фруктах,
овощах, в том числе в корнеплодах, лиственной зелени. Наряду с сахарами и
ароматическими соединениями они формируют вкус и аромат плодов и,
следовательно, продуктов их переработки.
Общее представление о разнообразии пищевых
кислот в составе растительных объектов иллюстрирует табл. 2 [10].
Таблица 2
Некоторые пищевые кислоты фруктов, ягод и овощей
|
Растительный
объект
|
Основные
кислоты
|
|
Абрикосы
|
Яблочная,
лимонная
|
|
Авокадо
|
Винная
|
|
Айва
|
Яблочная
(без лимонной)
|
|
Ананасы
|
Лимонная,
яблочная
|
|
Апельсины
|
Лимонная,
яблочная, щавелевая
|
|
Апельсиновая
кожура (цедра)
|
Яблочная,
лимонная, щавелевая
|
|
Бананы
|
Яблочная,
лимонная, винная, следы уксусной и муравьиной
|
|
Виноград
|
Яблочная
и винная (3:2), лимонная, щавелевая
|
|
Вишня
|
Яблочная,
лимонная, винная, янтарная, хинная, шикимовая, глицериновая, гликолевая
|
|
Грейпфрут
|
Лимонная,
винная, яблочная, щавелевая,
|
|
Груши
|
Яблочная,
лимонная, винная, щавелевая
|
|
Ежевика
|
Изолимонная,
яблочная, молочно-изолимонная, шикимовая, хинная, следы лимонной и щавелевой
|
|
Клубника
(земляника)
|
Лимонная,
яблочная, шикимовая, янтарная, глицериновая, гликолевая, аспарагиновая
|
|
Клюква
|
Лимонная,
яблочная, бензойная
|
|
Крыжовник
|
Лимонная,
яблочная, шикимовая, хинная
|
|
Лаймы
|
Лимонная,
яблочная, винная, щавелевая
|
|
Лимоны
|
Лимонная,
яблочная, винная, щавелевая (без изолимонной)
|
|
Персики
|
Яблочная,
лимонная
|
|
Сливы
|
Яблочная,
винная, щавелевая
|
|
Смородина
|
Лимонная,
винная, яблочная, янтарная
|
|
Финики
|
Лимонная,
яблочная, уксусная
|
|
Черника
|
Лимонная,
яблочная, глицериновая, лимонно-яблочная, гликолевая, янтарная, глюкуроновая,
галактуроновая, хинная, глутаминовая, аспарагиновая
|
|
Яблоки
|
Яблочная,
хинная, α-кетоглутаровая,
щавелево-уксусная, лимонная, пировиногрдная, фумаровая, молочная, янтарная
|
|
Бобы
|
Лимонная,
яблочная, небольшие количества янтарной и фумаровой
|
|
Брокколи
|
Яблочная
и лимонная (3:2), щавелевая, янтарная
|
|
Грибы
|
Кетостеариновая,
фумаровая, аллантоиновая
|
|
Горох
|
Яблочная
|
|
Картофель
|
Яблочная,
лимонная, щавелевая, фосфорная, пироглутаминовая
|
|
Морковь
|
Яблочная,
лимонная, изолимонная, янтарная, фумаровая
|
|
Помидоры
|
Лимонная,
яблочная, щавелевая, янтарная, гликолевая, винная, фосфорная, соляная,
серная, фумаровая, галактуроновая
|
|
Ревень
|
Яблочная,
лимонная, щавелевая
|
Наиболее типичными в составе различных плодов и
ягод являются лимонная и яблочная кислоты. Из числа других кислот часто
обнаруживаются хинная, янтарная и щавелевая. К распространенным относятся также
шикимовая, гликолевая, фумаровая, глицериновая и винная кислоты.
Концентрации отдельных органических кислот в
различных плодах и ягодах различны. Цитрусовые плоды содержат в основном
лимонную кислоту и небольшие количества яблочной. Содержание последней в
апельсинах составляет 10 - 25%, в мандаринах - до 20%, в грейпфрутах и лимонах
- до 5% по отношению к общей кислотности. В отличие от плодов, в кожуре
апельсинов содержится значительное (примерно 0,1%) количество щавелевой кислоты
[4].
Лимонная кислота оказывается основной также в
кислотном спектре ананасов, где ее содержание достигает 85%. На долю яблочной
кислоты в этих плодах приходится около 10%.
Доминирующей кислотой в составе семечковых и
косточковых плодов является яблочная и её содержание в их кислотном спектре
колеблется от 50 до 90%.
В кислых сортах яблок яблочная кислота
составляет более 90% общей кислотности, в черешне и вишне ее концентрация
достигает 85 - 90%, в сливах (в зависимости от сорта) - от 35 до 90%. В числе
других кислот в этих плодах - лимонная и хинная.
Более 90% кислотности приходится на яблочную,
лимонную и хинную кислоты в таких плодах как персики и абрикосы, причем
соотношение яблочной и лимонной кислот может колебаться в широком диапазоне,
что в некоторых случаях связывают с изменением содержания этих кислот в плодах
в процессе созревания. Установлено, например, что при созревании персиков
количество яблочной кислоты в них значительно возрастает, а лимонной
уменьшается.
В отличие от других видов плодов, в винограде
основной является винная кислота, которая составляет 50 - 65% общей
кислотности. Остаток приходится на яблочную (25 - 30%) и лимонную (до 10%)
кислоты. Содержание винной кислоты в процессе созревания винограда снижается
менее интенсивно, чем винной [11].
В большинстве видов ягод, за исключением винограда,
крыжовника, черники и ежевики, преобладает лимонная кислота. Например, в
землянике на ее долю приходится 70 - 90%, в смородине - 85 - 90%. Содержание
яблочной кислоты в этих ягодах - 10 - 15%. В ежевике 65 - 85% составляет
изолимонная кислота, а в составе крыжовника - 45% яблочной и лимонной и 5 - 10%
шикимовой.
В плодах и ягодах некоторое количество кислот
может находиться в виде солей. Например, их содержание в лимонах составляет до
3%, а в отдельных видах груш - 20 - 30%.
В отличии от большинства органических кислот,
молочная кислота в составе плодов и ягод, очевидно образуется только
микробиологическим путем [2].
Кислотный спектр овощей преимущественно
представлен теми же органическими кислотами, соотношение которых колеблется в
значительных пределах. Помимо уже известных, в составе овощей обнаруживаются
янтарная, фумаровая, пироглутаминовая и некоторые другие кислоты различного
строения. Присутствие в томатах неорганических кислот - фосфорной, серной и
соляной, является их отличительной особенностью.Молочная кислота является
основной органической кислотой в составе молока и молочных продуктов. Её
образование связано с биохимическим превращением молочного сахара - лактоза под
действием молочнокислых бактерий, которое происходит в соответствии с уравнением
реакции:
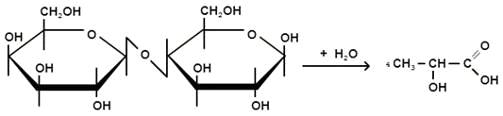
При участии в этом процессе гомоферментативных
молочнокислых бактерий молочная кислота является практически единственным
продуктом реакции. В случае гетероферментативных ароматообразующих
молочнокислых бактерий, кроме молочной появляются уксусная и пропионовая
кислоты, а также другие продукты брожения - этанол, диацетил, этилуксусный
эфир.
Аминокислоты, входящие в состав белков, и высшие
жирные кислоты, являющиеся структурными компонентами липидов, в принципе,
относятся к группе органических кислот.
Значение пищевых кислот в питании человека
обуславливается их энергетической ценностью (табл. 3.) и участием в обмене
веществ. Чаще всего, окисляясь при обмене веществ с высокой скоростью, они не
оказывают дополнительной кислотной нагрузки на организм.
Таблица 3
Коэффициенты энергетической ценности основных
пищевых кислот
|
Пищевая
кислота
|
Коэффициент
энергетической ценности, ккал/г
|
|
Лимонная
кислота
|
2,5
|
|
Яблочная
кислота
|
2,4
|
|
Молочная
кислота
|
3,6
|
Основную функцию органических кислот, входящих в
состав пищи, определяет их участие в процессах пищеварения [3].
К таким функциям органических кислот можно
отнести:
1) активация перистальтики кишечника;
2) стимуляция секреции пищеварительных
соков;
) влияние на формирование определенного
состава микрофлоры путем снижения pH
среды;
4) торможение развития гнилостных процессов
в толстом кишечнике.
Для различных органических кислот обнаружены
некоторые другие эффекты воздействия.
Показано, что отдельные пищевые кислоты, например
лимонная, предотвращают образование в организме канцерогенных нитрозаминов,
способствуют снижению риска возникновения и развития онкологических патологий.
Лимонная кислота (соответственно, цитрат) способствует также усвоению
организмом кальция (ее содержание в костях и зубах составляет 0,5 - 1,5%),
оказывает активирующее или ингибирующее действие на некоторые ферменты.
Бензойная кислота обладает антисептическим действием [12].
Однако известно негативное воздействие некоторых
кислот. Например, щавелевая кислота в виде кальциевой соли способна
откладываться в суставах или в виде камней - в мочевыводящих путях. Основными
пищевыми источниками этой кислоты являются зеленый крыжовник, листья шпината,
щавеля и крапивы. В противоположность этому, в процессах, предотвращающих
выпадение солей кальция в мочеточниках, важную роль играет цитрат мочевины.
Образование комплексов с кальцием и магнием лежит также в основе процесса
торможения кровотечения. Винная кислота организмом человека не усваивается.
.2 Кислотность пищевых продуктов
Кислый вкус пищевого продукта обусловливают ионы
водорода, образующиеся в результате электролитической диссоциации содержащихся
в нем кислот и кислых солей. Активность ионов водорода (активная кислотность)
характеризуется показателем pH
(отрицательный логарифм концентрации водородных ионов) Значения pH
для некоторых жидких пищевых продуктов представлены в табл. 4.
Таблица 4
Значение pH
для некоторых жидких пищевых продуктов
|
Пищевой
продукт
|
Значение
pH
|
|
Апельсиновый
сок
|
3,2
- 3,5
|
|
Ананасовый
сок
|
3,6
|
|
Виноградный
сок
|
3,2
|
|
Грейпфрутовый
сок
|
3,1
|
|
Банановый
нектар
|
3,66
|
|
Пиво
|
4,2
- 4,6
|
|
Цельное
молоко
|
6,6
- 6,8
|
|
Сгущенное
молоко
|
6,1
- 6,4
|
|
Йогурт
|
4,0
- 4,3
|
|
Какао
напиток
|
6,3
- 6,4
|
Практически все пищевые кислоты являясь слабыми,
в водных растворах диссоциируют незначительно. Кроме того, в пищевой системе
могут находиться буферные вещества, в присутствии которых активность ионов
водорода будет сохраняться примерно постоянной из-за ее связи с равновесием
диссоциации слабых электролитов. Примером такой системы является молоко.
Поэтому, суммарная концентрация веществ в пищевом продукте, которым присущ
кислотный характер, определяется показателем потенциальной, общей или титруемой
(щелочью) кислотности. В зависимости от продукта эту величину формулирует через
различные показатели. Например, в соках находят общую кислотность в г на 1 л, в
молоке - в градусах Тернера и т. д. [21].
Пищевые кислоты в составе продовольственного
сырья и продуктов осуществляют различные функции, обусловленные качеством пищевых
объектов. В составе комплекса вкусоароматических веществ они участвуют в
формировании вкуса и аромата, принадлежащих к числу основных показателей
качества пищевого продукта. Именно вкус, наряду с запахом и внешним видом,
оказывает более существенное влияние на выбор потребителем того или иного
продукта, если сравнивать с такими показателями, как состав и пищевая ценность.
Изменения вкуса и аромата часто являются характерными признаками начала порчи
пищевого продукта или наличия в его составе посторонних веществ [5].
Главное вкусовое ощущение, вызываемое
присутствием кислот в составе продукта, - кислый вкус, который в общем случае
пропорционален концентрации ионов Н+ (с учетом различий в активности веществ,
вызывающих одинаковое вкусовое восприятие). Например, пороговая концентрация
(минимальная концентрация вкусового вещества, воспринимаемая органами чувств),
позволяющая ощутить кислый вкус, составляет для лимонной кислоты 0,017%, для
уксусной - 0,03% [1].
Таблица 5
Свойства основных пищевых кислот
|
Кислота
|
Эмпирическая
формула
|
Молекулярная
масса
|
Температура
плавления, °С
|
Растворимость,
г/100 мл Н2О при 25°С
|
Константа
диссоциации
|
|
Уксусная
|
С2Н4О2
|
60,05
|
-8,5
|
Смешивается
|
1,76·10-5
|
|
Молочная
|
С3Н6О3
|
90,08
|
16,8
|
Хорошо
растворим
|
1,37·10-4
|
|
Лимонная
|
С6Н8О6
|
192,12
|
153
(безв.)
|
181,0
|
К1=7,1·10-4
К2=1,68·10-5 К3=6,4·10-7
|
|
Яблочная
|
С4Н6О5
|
134,09
|
132
|
62,0
|
К1=3,9·10-4
К2=7,8·10-6
|
|
Винная
|
С4Н6О6
|
150,09
|
168-170
|
147,0
|
К1=1,04·10-3
К2=4,55·10-5
|
|
Янтарная
|
С4Н6О4
|
118,09
|
188
|
6,8
|
К1=6,5·10-5
К2=2,3·10-6
|
|
Фумаровая
|
С4Н4О4
|
116,07
|
286
|
0,5
(при +20 С)
|
К1=9,3·10-4
(при +18°С) К2=3,62·10-5 (при +18°С)
|
|
Фосфорная
|
Н3РО4
|
98,00
|
42,35
|
Хорошо
растворим в горячей воде
|
К1=7,52·10-3
К2=6,23·10-8 К3=2,2·10-13 (при +18°С)
|
В случае органических кислот на восприятие
кислого вкуса влияет и анион молекулы. В зависимости от природы последнего
могут возникать комбинированные вкусовые ощущения, например, лимонная кислота
имеет кисло-сладкий вкус, а пикриновая - кисло-горький. Изменение вкусовых
ощущений происходит и в присутствии солей органических кислот. Так например,
соленый вкус продуктам придают соли аммония. Естественно, что присутствие в
составе продукта нескольких органических кислот в сочетании с вкусовыми
органическими веществами других классов обусловливают формирование оригинальных
вкусовых ощущений, часто свойственных исключительно одному, конкретному виду
пищевых продуктов [5].
Участие органических кислот в формировании
аромата в различных продуктах различно. Доля органических кислот и их лактонов
в комплексе ароматообразующих веществ, например земляники, составляет 14%, в
помидорах - порядка 11 %, в цитрусовых и пиве - порядка 16%, в хлебе - более
18%, тогда как в формировании аромата кофе на кислоты приходится менее 6%.
В состав ароматообразующего комплекса
молочнокислых продуктов входят: молочная, лимонная, уксусная, пропионовая и
муравьиная кислоты. Качество пищевого продукта интегральная величина,
включающая, кроме органолептических свойств (вкуса, цвета, аромата),
показатели, которые характеризуют его коллоидную, химическую и микробиологическую
стабильность.
Формирование качества продукта реализовывается
на всех этапах технологического процесса его получения. При этом многие
технологические показатели, обеспечивающие создание высококачественного
продукта, зависят от активной кислотности (pH)
пищевой системы.
В общем случае величина pH
оказывает влияние на следующие технологические параметры:
. образование компонентов вкуса и
аромата, характерных для конкретного вида продукта;
2. коллоидную стабильность полидисперсной
пищевой системы (например, коллоидное состояние белков молока или комплекса
белково-дубильных соединений в пиве);
. термическую стабильность пищевой
системы (например, термоустойчивость белковых веществ молочных продуктов,
зависящую от состояния равновесия между ионизированным и коллоидно
распределенным фосфатом кальция);
. биологическую стойкость (например, пива
и соков);
. активность ферментов;
. условия роста полезной микрофлоры и ее
влияние на процессы созревания (например, пива или сыров).
Наличие пищевых кислот в продукте может быть
следствием преднамеренного введения кислоты в пищевую систему для регулирования
её pH, в ходе
технологического процесса. В этом случае пищевые кислоты играют роль
технологических пищевых добавок [26].
В общем виде можно выделить три основные цели
добавления кислот в пищевую систему:
. придание определенных органолептических
свойств (вкуса, цвета, аромата), свойственных для конкретного продукта;
2. влияние на коллоидные свойства,
определяющие формирование консистенции, присущей конкретному продукту;
. повышение стабильности, обеспечивающей
сохранение качества продукта в течение конкретного времени.
В табл. 5 приведены свойства основных пищевых
кислот, которые используются для регулирования pH
в пищевых системах и обеспечивают ему физическую стабильность. К последним
относятся: влияние на устойчивость дисперсных систем (эмульсий и суспензий),
изменение вязкости в присутствии загустителя, формирование гелевой структуры в
присутствии гелеобразователя, влияние на микрофлору, обеспечивающее биологическую
устойчивость продукта [6].
1.3 Пищевые кислоты, их
характеристика
1.3.1 Уксусная кислота
Уксусная кислота - бесцветная жидкость,
смешивающаяся с водой во всех отношениях. Она впитывает из окружающей среды
влагу и замерзает при температуре 16,5°С с образованием бесцветных твердых
кристаллов. В быту используют для консервирования разбавленную водой уксусную
эссенцию, которая получила название столовый уксус. В зависимости от сырья, из
которого получают уксусную кислоту, различают винный, фруктовый, яблочный,
спиртовой уксус и синтетическую уксусную кислоту. Уксусную кислоту получают
путем уксуснокислого брожения.
Уксусно-кислое брожение представляет собой
процесс превращения этилового спирта при участии кислорода в уксусную кислоту.
Брожение является значимым в хозяйственном отношении, так как позволяет
получать в больших количествах из доступных субстратов уксусную кислоту ‒
вещество, обширно используемое в пищевой, текстильной и других отраслях
промышленности.
Процесс уксусно-кислого брожения проходит в два
этапа. Сначала этиловый спирт окисляется до уксусного альдегида:

а затем уксусный, альдегид в
результате дальнейшего окисления превращается в уксусную кислоту:
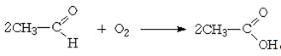
Результаты этих превращений
могут быть выражены следующим суммарным уравнением:
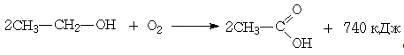
Важным способом промышленного
синтеза уксусной кислоты является каталитическое карбонилирование метанола
моноксидом углерода, которое происходит по формальному уравнению:
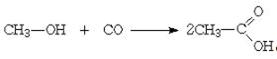
Соли и эфиры этой кислоты называются ацетаты. В
качестве пищевых добавок применяются ацетаты калия и натрия (Е 461 и Е 462)
[8].
Наряду с уксусной кислотой и ацетатами,
применение находят диацетаты натрия и калия. Эти вещества состоят из уксусной
кислоты и ацетатов в молярном соотношении 1:1 [14].
Уксусная кислота не имеет законодательных
ограничений; ее действие основано, главным образом, на снижении pH
консервируемого продукта, проявляется при содержании выше 0,5% и направлено, в
основном, против бактерий. Основная область применения - овощные консервы и
маринованные продукты. Используется в майонезах, соусах, при мариновании рыбной
продукции и овощей, ягод и фруктов. Уксусная кислота широко используется также
как вкусовая добавка.
.3.2 Молочная кислота
Молочная кислота (СH3-СH(ОH)-СООH)
- пищевой консервант Е 270, прозрачная жидкость без мути и осадка, имеющая
слабый, характерный для молочной кислоты запах и кислый вкус. Выпускается в
двух формах, отличающихся концентрацией: 40%-й раствор и концентрат, содержащий
не менее 70% кислоты. Получают молочнокислым брожением сахаров.
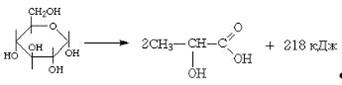
Ее соли и эфиры называются лактатами.
Применяется молочная кислота в консервной, мясоперерабатывающей, рыбной,
молокоперерабатывающей, масложировой и других отраслях пищевой промышленности.
А также в производстве безалкогольных напитков и некоторых сортов пива,
кондитерских изделий. Молочная кислота имеет ограничения к применению в
продуктах детского питания.
Добавка-консервант Е 270 разрешена для
использования в пищевой промышленности Российской Федерации и других стран.
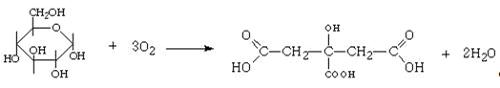
1.3.3 Лимонная кислота
Лимонная кислота ((HООС-СH2)2-С(ОH)-СООH)
- пищевой антиоксидант Е 330. Кристаллическое вещество белого цвета,
температура плавления 153°С, хорошо растворима в воде, растворима в этиловом
спирте, малорастворима в диэтиловом эфире. Продукт лимоннокислого брожения
сахаров. Осуществляется при участии ферментов плесневого гриба Aspergillius
niger:
Обладает наиболее мягким вкусом по сравнению с
другими пищевыми кислотами и не проявляет раздражающего действия на слизистые
оболочки пищеварительного тракта. Соли и эфиры лимонной кислоты - цитраты,
применяются для регулирования кислотности, усиления вкуса, а также в качестве
консерванта. Особенно широко лимонная кислота применяется при производстве безалкогольных
напитков, некоторых видов рыбных консервов, кондитерских и хлебобулочных
изделий. В последних, добавка Е 330 зачастую применяется как один из
компонентов разрыхлителей или "улучшителей" теста [8].
Все известные организации по контролю за
пищевыми продуктами относят пищевую добавку Е 330 к классу безопасных для
здоровья. В Российской Федерации входит в список разрешенных пищевых добавок.
1.3.4 Яблочная кислота
Яблочная кислота (HООС-СH2-СH(ОH)-СООH)
- консервант Е 296, представляет собой бесцветные гигроскопичные кристаллы,
хорошо растворимые в воде и этиловом спирте, плавящиеся при температуре 100°С.
Обладает менее кислым вкусом, чем лимонная и винная. Для промышленного
использования эту кислоту получают синтетическим путем из малеиновой кислоты, в
связи с чем критерии чистоты включают ограничения по содержанию в ней примесей
токсичной малеиновой кислоты.
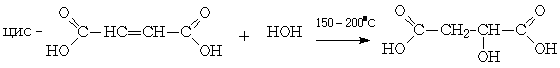
Соли и эфиры яблочной кислоты
называются малатами. Яблочная кислота обладает химическими свойствами оксикислот.
При нагревании до 100°С превращается в ангидрид. Применяется при изготовлении
вин, кондитерских изделий (желе, пастила, мармелад), бакалейных продуктах
(майонез, сыры, рыба, соус), фруктовых газированных вод и соков, а также в
молочных продуктах в качестве стабилизатора эмульсии яичного желтка, в
замороженных изделиях (мороженое) [1].
.3.5 Винная кислота
Винная кислота (HООС-СH(ОH)-СH(ОH)-СООH) -
антиоксидант Е 334, кристаллическое вещество без цвета и запаха, но с кислым
вкусом. Является продуктом переработки отходов виноделия (винных дрожжей и
винного камня).
Расщепление виннокислой извести. Из
полученной тем или иным способом виннокислой извести в специально
предназначенных для этих целей коррозионно-стойких реакторах (расщепителях)
выделяют винную кислоту по реакции:
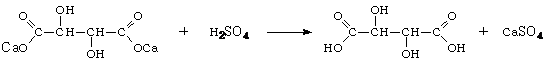
В растворе образуется свободная
винная кислота, а в осадке гипс. Расщепление надо проводит так чтобы получить
кристаллы гипса наибольшей величины, что уменьшает удельное сопротивление при
его промывке и облегчает фильтрацию [15].
Винная кислота не обладает
каким-либо существенным раздражающим действием на слизистые оболочки
желудочно-кишечного тракта, также не подвергается обменным превращениям в
организме человека. Основная часть (около 80%) разрушается в кишечнике под действием
бактерий. Соли и эфиры винной кислоты называются тартратами.
В пищевой промышленности винная
кислота используется в качестве регулятора кислотности и антиоксиданта при
производстве консервов, джемов, желе и различных кондитерских изделий. Добавка
Е 334 добавляется при изготовлении напитков и столовых вод, находит широкое
применение в сфере виноделия. Винная кислота является одной из составляющих
терпкого вкуса в вине.
Добавка Е 334 входит в перечень
разрешенных пищевых добавок в России [23].
.3.6 Аскорбиновая кислота
Аскорбиновая кислота (витамин С) -
антиоксидант Е 300. Представляет собой белое кристаллическое вещество с Тпл -
192°С, очень чувствительна к нагреванию, хорошо растворима в воде, плохо в
спиртах (за исключением метанола), практически нерастворима в неполярных
растворителях. Она очень чувствительна к тяжелым металлам, медь и железо на
аскорбиновую кислоту действуют разрушающе.
Аскорбиновая кислота, как природный
антиоксидант, используется для предотвращения окислительной порчи жиров в продуктах
питания. Она прерывает реакции самоокисления в компонентах пищевых изделий,
предотвращая снижение органолептических характеристик продуктов.
Аскорбиновая кислота увеличивает
срок хранения продуктов в несколько раз. Она замедляет ферментативное окисление
вина, пива и безалкогольных напитков, предохраняет фрукты, овощи и продукты их
переработки от потемнения при замораживании, консервировании и расфасовке,
сохраняя в них витамины. Аскорбиновая кислота позволяет на треть снизить
количество нитритов и нитратов, необходимых в мясных изделиях. Она обеспечивает
устойчивый и равномерный посол, ускоряет процесс консервирования, замедляет
образование метмиоглобина на поверхности мяса.
Аскорбиновая кислота принимает
активное участие в окислительно - восстановительных процессах в организме и
входит в состав ряда сложных ферментов, обусловливающих процессы клеточного
дыхания. Витамин С участвует в процессах углеводного и белкового обмена,
повышает сопротивляемость организма к инфекционным заболеваниям, регулирует
холестериновый обмен, участвует в нормальном функционировании желудка,
кишечника и поджелудочной железы; совместно с витамином Р обеспечивает
нормальную эластичность стенок кровеносных капилляров, обезвреживает действие
ряда лекарственных веществ и ядов. Аскорбиновая кислота применяется при лечении
цинги, инфекционных заболеваний, ревматизма, туберкулеза, язвенной болезни, при
гепатитах, шоковом состоянии и др.
В случае нехватки аскорбиновой
кислоты развивается гиповитаминоз, в тяжелых случаях ‒ авитаминоз (цинга,
скорбут). При цинге отмечается утомляемость, сухость кожи, расшатываются и
выпадают зубы, наблюдаются боли в конечностях, снижается сопротивляемость к
инфекциям. В конечном итоге, цинга приводит к летальному исходу.
Аскорбиновая кислота содержится в
значительных количествах в овощах, плодах, ягодах, хвое, шиповнике, в листьях
черной смородины.

Рис.1. Растительные объекты,
содержащие аскорбиновую кислоту
Под влиянием высоких
температур, кислорода, особенно в присутствии тяжелых металлов, витамин С легко
разрушается. В организме человека и большинства животных аскорбиновая кислота
не синтезируется.
Химическая схема производства
аскорбиновой кислоты
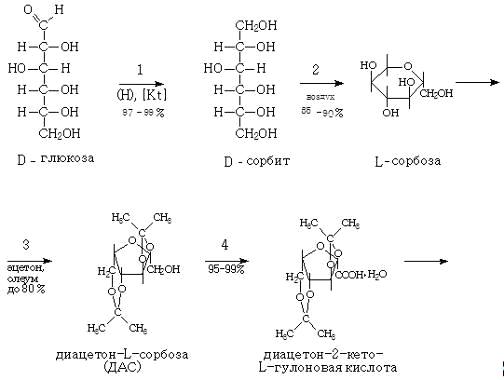
Технология
производства аскорбиновой кислоты
Стадия 1.
Производство D-сорбита из D-глюкозы.
В производстве синтетической
аскорбиновой кислоты D-сорбит является первым промежуточным продуктом синтеза.
D-сорбит представляет собой белый кристаллический порошок, легко растворимый в
воде. Сырьем для его производства является D-глюкоза. Это сравнительно дорогое
сырье, стоимость его составляет 40‒44% от себестоимости аскорбиновой
кислоты, поэтому замена D-глюкозы на непищевые виды сырья является важной
проблемой.
Процесс восстановления D-глюкозы
можно осуществлять двумя методами:
‒ электролитическим
восстановлением;
‒ каталитическим
гидрированием.
Электролитическое
восстановление D-глюкозы в D-сорбит осуществляется при комнатной температуре в
электролизерах со свинцовыми анодами и катодами из сплава никеля. Процесс
проводят в присутствии NaОH и сульфата натрия или аммония при рН=10.
Преимуществом процесса является его проведение в мягких условиях, в отсутствии
дорогостоящих катализаторов и автоклавов. Однако в процессе электролитического
восстановления получается раствор D-сорбита, загрязненный его изомером ‒
D-маннитом (до 15%). Разделение этих изомеров представляет большие трудности.
Недостатком процесса является также высокая щелочность раствора и сложность
конструкции электролизера. Поэтому в настоящее время на витаминных предприятиях
принят каталитический метод.
Каталитическое гидрирование
(восстановление) можно представить следующей схемой:
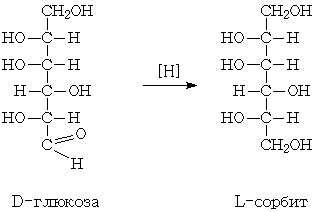
Выход составляет 98 - 99% от
теоретически возможного. Особенностью этой стадии производства является
протекание ряда побочных реакций: окисление D-глюкозы (I) в D-глюконовую
кислоту (VI) кислородом воздуха в присутствии катализатора; фенолизация
D-глюкозы в щелочной среде с последующей изомеризацией в D-фруктозу (II) и
D-маннозу (IV). D-фруктоза может далее превращаться в D-сорбит (III) и D-маннит
(V). В побочных процессах гидрогенолиза глюкозы, кроме D-сорбита, образуются
также этиленгликоль, глицерин, пропиленгликоль и др. побочные продукты.
Основные побочные процессы протекают по схеме:

Основная задача при
осуществлении технологического процесса ‒ свести к минимуму образование
этих побочных продуктов. Это достигается рядом мер, которые будут рассмотрены
несколько позже.
Технологическая схема получения
D-сорбита включает следующие операции:
. Приготовление и
регенерация скелетного никелевого катализатора;
. Приготовление 50‒55%-ного
раствора D-глюкозы;
. Получение D-сорбита;
. Очистка водного
раствора D-сорбита от ионов тяжелых металлов;
. Получение
кристаллического D-сорбита для выпуска пищевого D-сорбита.
Процесс гидрирования глюкозы
осуществляют двумя способами: или автоклавным периодическим способом, или в
непрерывно действующих аппаратах [25].
Добавка Е 300 разрешена в РФ и других
странах для использования в пищевой промышленности.
1.3.7 Янтарная кислота
Янтарная кислота (HООС-СH2-СH2-СООH) -
антиоксидант Е 363, бесцветное кристаллическое вещество, растворимое в воде и
спирте, Тпл -183 °С. Выше 235°С отщепляет Н2О и переходит в янтарный ангидрид
<https://ru.wikipedia.org/w/index.php?title=%D0%AF%D0%BD%D1%82%D0%B0%D1%80%D0%BD%D1%8B%D0%B9_%D0%B0%D0%BD%D0%B3%D0%B8%D0%B4%D1%80%D0%B8%D0%B4&action=edit&redlink=1>.
Она представляет собой побочный продукт производства адипиновой кислоты.
Известен также способ ее выделения из отходов янтаря.
Используется в пищевой
промышленности как регулятор кислотности (обычно добавляют в напитки, карамель,
жевательную резинку и т.д.), в ароматизированных сухих десертах, в желеобразных
десертах, в порошковых смесях для изготовления напитков дома и консерванта (как
альтернатива лимонной кислоте), добавляется, например, в майонез, водку [7].
1.3.8 Адипиновая кислота
Адипиновая кислота
(НООС-(СН2)4-СООН) - антиоксидант Е 355, белое кристаллическое вещество.
Получается в промышленности, главным образом, двухстадийным окислением
циклогексана. На первой стадии (жидкофазное окисление воздухом при 142‒145°С
и 0,7 МПа) получают смесь циклогексанона и циклогексанола, разделяемую
ректификацией:
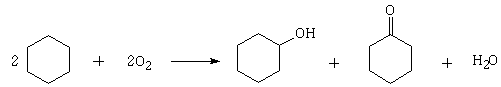
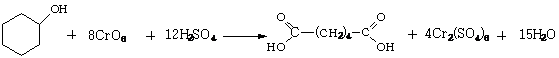
Циклогексанол окисляют оксидом хрома
(VI) в присутствии серной кислоты. При этом способе производства неплохой выход
адипиновой кислоты.
Обладает всеми химическими
свойствами, характерными для карбоновых кислот, в частности, образует соли,
большинство из которых растворимо в воде. Легко этерифицируется в моно- и
диэфиры. Соли и эфиры адипиновой кислоты получили название адипинаты.
Адипиновая кислота может использоваться как
регулятор кислотности (обычно добавляют в напитки, карамель и другие продукты
для поддержания необходимого уровня pH),
в ароматизированных сухих десертах, в желеобразных десертах, а также в начинках
и добавках для хлебобулочных и кондитерских изделий.
Адипиновая кислота присутствует в списке
добавок, утвержденных Евросоюзом, тем не менее, на данный момент ее
использование во многих странах запрещено, так как кислота еще находится на
стадии тестирования [26].
1.3.9 Фумаровая кислота
Фумаровая кислота (транс - СООH-СH=СH-СООH)
- консервант Е 297, представляет собой бесцветные кристаллы, имеющие фруктовый
вкус. Содержится во многих растениях и грибах, образуется при брожении
углеводов в присутствии Aspergillus
fumariсus.
Фумаровая кислота также обычно получаются при нагревании до 150°С яблочной
кислоты:
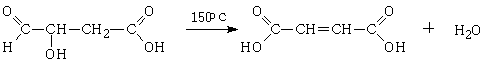
Соли и эфиры называются фумаратами. В пищевой
промышленности фумаровую кислоту используют в качестве регулятора кислотности
при приготовлении карамельных конфет, напитков и других продуктов питания для
поддержания требуемого уровня pH.
Добавляют добавку в некоторые виды сухих ароматизированных десертов, но в
строго установленном количестве - до 1 г/кг готовой продукции.
1.3.10 Фосфорная кислота
Фосфорная кислота (H3РО4)
- антиоксидант Е 338. Представляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 42°С ортофосфорная кислота начинает плавиться, превращаясь
в вязкую бесцветную жидкость. Хорошо растворима в воде и обычно применяется в
виде 85% водного раствора. В таком виде фосфорная кислота представляет собой
бесцветную сиропообразную жидкость. Кислота не обладает запахом и также хорошо
растворяется во многих растворителях, например в этаноле.
Ортофосфорная кислота может быть получена
различными способами:
. Взаимодействием фосфата кальция с
серной кислотой:

2. Гидролизом пентахлорида
фосфора:
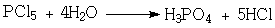
3. Сжиганием фосфора и дальнейшим
взаимодействием его оксида с водой:
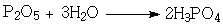
Её соли - фосфаты (калия, натрия и
кальция) широко распространены в пищевом сырье и продуктах его переработки. В
высоких концентрациях фосфаты содержатся в молочных, мясных и рыбных продуктах,
в некоторых видах злаков и орехов. Фосфаты (пищевые добавки Е 339 - 341)
вводятся в безалкогольные напитки и кондитерские изделия. Допустимая суточная
доза, в пересчете на фосфорную кислоту, соответствует 5 - 15 мг на 1 кг массы
тела (поскольку избыточное количество ее в организме может стать причиной
дисбаланса кальция и фосфора) [10].
Добавка Е 338 входит в список
разрешенных пищевых добавок в Европейском союзе, Российской Федерации и многих
других странах.
.4 Методы определения кислот в
пищевых продуктах
пищевой кислота продукт питание
В основе определения активной кислотности - pH
различных пищевых систем лежат стандартные методы, описанные в руководствах по
аналитической химии. К ним относятся калориметрический и электрометрический
методы.
Определение потенциальной кислотности,
характеризующей общее содержание веществ, имеющих кислотный характер, основано
на титровании этих веществ сильными основаниями (щелочами). Для различных
пищевых продуктов характерны свои особые условия титрования, результаты которых
представляют в соответствующих кислотных числах.
Кислотность твердых пищевых продуктов определяют
титрованием водных вытяжек растворами щелочей, а кислотность жидких продуктов -
путем титрования навесок или объемов. При титровании определяют суммарное
содержание в продукте свободных кислот и кислых солей.
Результаты титрования выражают в процентах по
преобладающей в продукте кислоте или в градусах. Поскольку в лимонах преобладает
лимонная кислота, то кислотность лимонов рассчитывают по лимонной кислоте,
кислотность винограда - по винной, яблок, груш, слив и томатов - по яблочной,
квашеной капусты, молока и кисломолочных продуктов - по молочной [3].
Пример.
Для определения кислотности молока берут 10 мл молока, добавляют индикатор и
титруют 0,1 и. раствором щелочи. Количество пошедшей на титрование щелочи
умножают на 0,009 и получают содержание в молоке молочной кислоты в процентах.
Число 0,009 соответствует количеству граммов
молочной кислоты, необходимому для приготовления 1 мл 0,1 н. ее раствора. Для
приготовления 1 л 0,1 н. раствора надо брать 9 г молочной кислоты, так как это
одноосновная оксикислота и ее молекулярный вес равен 90.
Под градусом кислотности подразумевается
количество миллилитров одно- или децинормальной щелочи, необходимое для
нейтрализации кислот и кислых солей, которые содержатся в 100 г или 100 мл
испытуемого продукта. Так, кислотность муки выражается в градусах количеством
миллилитров 1 н. раствора щелочи, необходимым для нейтрализации кислот в 100 г
муки, а кислотность крахмала - числом миллилитров 0,1 н. раствора щелочи на 100
г крахмала.
В пищевых продуктах наряду с нелетучими могут
находиться летучие кислоты - уксусная, муравьиная, масляная и другие, которые
перегоняются с парами воды. По количеству летучих кислот можно судить о
качестве таких продуктов, как вино, пиво, плодово-ягодные и овощные соки и др.
Допускаемые стандартами нормы летучих кислот должны соответствовать тем
количествам, которые могут получиться в продукте из полноценного сырья и при
нормальном ходе технологического процесса.
Существующие методы определения летучих кислот
подразделяют на прямые и косвенные. При прямых методах сначала отгоняют летучие
кислоты, которые затем оттитровывают щелочью. При косвенных методах сначала
определяют общее количество кислот в растворе, после чего путем выпаривания из
него удаляют летучие кислоты.
Анализ кислотного состава пищевого продукта дает
возможность обнаружить фальсификацию или подтвердить его натуральность. Для
определения содержания органических кислот используют как стандартные, так и
альтернативные методы контроля.
Официальный метод анализа молочной кислоты
основан на ее окислении перманганатом калия до уксусного альдегида, который
определяют йодометрически. Наиболее известные методы определения винной кислоты
базируются на щелочном титровании выпадающего винного камня. Большинство
органических кислот можно определить хроматографическими методами [13].
К альтернативным относятся методы, основанные на
использовании ферментативных систем. Характерными особенностями ферментативного
анализа являются специфичность, обеспечивающая достоверность результатов,
высокие точность и чувствительность [16].
Перечень органических кислот в составе пищевых
продуктов, определяемых ферментативными методами, представлен в табл. 6.
Таблица 6
Пищевые кислоты в составе различных продуктов
питания, определяемые ферментативными методами
|
Группа
продуктов
|
Определяемая
кислота
|
|
L-Аскорбиновая
|
L- Аспарагиновая
|
D-3-Гидроксимасляная
|
L-Глутаминовая
|
D-Глюконовая
|
D-Изолимонная
|
Лимонная
|
L - Молочная
|
D-(L)Молочная
|
Муравьиная
|
Уксусная
|
Щавелевая
|
D-Яблочная
|
L-Яблочная
|
D-(L)Яблочная
|
Янтарная
|
|
Детское
питание, диетические продукты
|
+
|
|
|
+
|
|
|
+
|
|
+
|
|
|
|
|
|
|
+
|
|
Пиво,
вино, игристые и шампанские вина, спиртные напитки
|
+
|
|
|
|
+
|
|
+
|
|
+
|
|
+
|
|
+
|
+
|
|
+
|
|
Соки,
нектары, сокосодержащие напитки, продукты переработки фруктов и овощей,
безалкогольные напитки (например, лимонады)
|
+
|
+
|
|
+
|
+
|
+
|
+
|
|
+
|
+
|
+
|
+
|
|
|
+
|
+
|
|
Яйца
и яичные продукты
|
|
|
+
|
|
|
|
|
+
|
|
|
|
|
|
|
|
+
|
|
Молоко
и молочные продукты
|
|
|
|
+
|
|
|
+
|
|
+
|
|
+
|
|
|
+
|
|
+
|
|
Пищеконцентраты
(например, супы, соусы)
|
|
|
|
+
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сахар
и сахаросодержащие изделия
|
|
|
|
|
|
|
+
|
|
+
|
+
|
|
|
|
|
|
|
|
Мясо
и мясные изделия
|
|
|
|
+
|
+
|
|
+
|
|
+
|
+
|
+
|
|
|
|
|
|
Использование ферментативных методов в
аналитической химии органических пищевых кислот, в зависимости от группы
анализируемых продуктов, может иметь различные цели, к которым относятся:
. производственный контроль;
2. системы обеспечения качества;
. контроль качества готовой продукции;
. контроль сырья;
. оценка качества;
. анализ состава с целью установления
пищевых свойств и их соответствия нормативной документации;
. оценка гигиенического статуса;
. мониторинг качества;
. выявление нежелательных компонентов;
. установление фальсификации;
. определение доли натурального сырья;
. определение аутентичности
(подлинности).
Кислотность имеет большое значение для оценки
качества пищевых продуктов. Повышенная кислотность может характеризовать их
несвежесть и недоброкачественность. Поэтому в стандартах на многие пищевые
продукты (свежее молоко, сметана, пиво, соки, фруктовые воды и др.) указывают
нормы содержания кислот [22].
Лимонную, виннокаменную, яблочную, молочную и
уксусную кислоты в небольших количествах используют в кондитерской,
безалкогольной, ликеро-водочной и консервной промышленности для улучшения вкуса
продуктов. Уксусную, сорбиновую, молочную и бензойную кислоты добавляют к
некоторым продуктам в качестве консерванта.
Некоторые органические кислоты обладают
способностью подавлять развитие микроорганизмов за счет концентрации водородных
ионов или за счет токсичности недиссоциированных молекул либо анионов. Если
токсическое действие минеральных кислот связано главным образом с концентрацией
водородных ионов, то токсичность органических кислот не пропорциональна степени
их диссоциации и обусловлена в основном действием недиссоциированных молекул
или анионов [19].
Общее количество органических кислот
недостаточно характеризует вкусовую кислотность продуктов. Кислый вкус зависит
главным образом от степени диссоциации кислот, т. е. от активной кислотности.
Чем выше концентрация ионов водорода, тем кислый вкус кислоты будет более
сильным. Концентрацию ионов водорода выражают в единицах водородного показателя
pH, который является
отрицательным логарифмом ионов Н+ (pH
= lоg [H+]). Ощущение кислого вкуса увеличивается с понижением значения pH,
начиная от 7, которое характеризует нейтральную реакцию.
Растворы различных кислот одинаковой нормальности и, следовательно, с
одинаковой титруемой кислотностью могут иметь разную активную кислотность в
зависимости от степени диссоциации кислот.
1.4.1 Вкусовые свойства кислот
Пищевые кислоты обладают различной вкусовой
кислотностью. Для каждой кислоты существует порог ощущения кислого вкуса,
т.е. минимальная концентрация кислоты в водном растворе, при которой начинает
ощущаться кислый вкус.
Обычно порог ощущения кислого вкуса для
различных кислот выражается в граммах на 100 мл водного раствора (табл. 13).
Таблица 7
Порог ощущения кислого вкус
|
Название
кислоты
|
pH
|
Молекулярная
концентрация кислоты, миллимолей в 1 л
|
Количество
кислоты, г на 100 мл раствора
|
|
Уксусная
|
3,70
|
2,2
|
0,0132
|
|
Янтарная
|
3,70
|
0,8
|
0,0095
|
|
Винная
|
3,52
|
0,4
|
0,0060
|
|
Яблочная
|
3,40
|
0,8
|
0,0154
|
|
Лимонная
|
3,30
|
0,8
|
0,0154
|
|
Молочная
|
3,30
|
2,3
|
0,0207
|
|
Соляная
|
3,00
|
1,0
|
0,0036
|
Различные кислоты обладают неодинаковым вкусом.
Лимонная и адипиновая кислоты имеют чисто кислый, приятный, без привкуса,
невяжущий вкус; винная - кислый, вяжущий; молочная кислота - чисто кислый,
невяжущий, но на вкус этой кислоты оказывают влияние примеси и особенно
содержание ангидридов; яблочная кислота имеет вкус кислый, мягкий, с очень
слабым посторонним привкусом; уксусная - резкий кислый; янтарная кислота
отличается очень неприятным вкусом, вследствие чего она не используется при
производстве пищевых продуктов [18].
Кислый вкус пищевых продуктов несколько
изменяется под влиянием сахаров, дубильных веществ и поваренной соли. Сахара
маскируют кислый вкус. При достижении известного предела их содержания
наступает преобладание ощущения сладкого вкуса над кислым, дубильные вещества и
поваренная соль усиливают кислый вкус.
Глава II. Экспериментальная часть
.1 Качественное определение
аскорбиновой кислоты
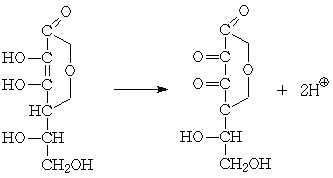
Все качественные реакции на аскорбиновую кислоту
основаны на ее способности легко вступать в окислительно-восстановительные
реакции. Окисляясь, аскорбиновая кислота превращается в дегидроаскорбиновую,
восстанавливая различные соединения:
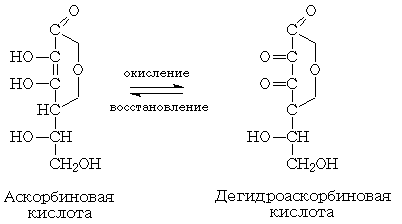
1. Реакция с железосинеродистым
калием
Аскорбиновая кислота, окисляясь, восстанавливает
железосинеродистый калий K3Fe(СN)6
до железистосинеродистого K4Fe(СN)6,
который с ионами трехвалентного железа образует в кислой среде берлинскую
лазурь Fe4Fe(СN)6
3.

Реактивы:
1. свежевыжатые соки (апельсина, лимона,
вишни, мандаринов, грейпфрута) и соки разных производителей;
. железосинеродистый калий
(гексацианоферрат (III) калия), 5%-ный раствор;
. гидроксид калия KОH,
5%-ный раствор;
. соляная кислота HСl, 10 %-ный раствор;
. хлорид железа FeСl3, 1 %-ный раствор.
Ход работы. К
1 мл исследуемого сока прибавляют 2 капли раствора гидроксида калия , столько
же раствора железосинеродистого калия и встряхивают пробирку, после чего
добавляют 6 - 8 капель 10%-ного раствора соляной кислоты и 1 - 2 капли раствора
хлорида железа. Выпадает синий или зеленовато-синий осадок берлинской лазури.
2. Йодная проба на
витамин С
Реактивы:
1. свежевыжатые соки (апельсина, лимона,
вишни, мандаринов, грейпфрута) и соки разных производителей;
2. раствор Люголя (раствор
йода в йодиде калия);
Раствор Люголя при добавлении к
нему витамина С - обесцвечивается вследствие восстановления молекулярного йода
с образованием йодистоводородной кислоты.
Ход работы. В
две пробирки (опыт и контроль) наливают по 10 капель дистиллированной воды и 2
капли раствора Люголя. В опытную пробирку добавляют 5 - 10 капель исследуемого
сока, в контрольную - столько же дистилированной воды. В опытной пробирке
раствор обесцвечивается.
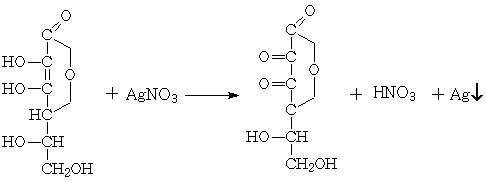
3. Серебряная проба
на витамин С
При добавлении витамина С к
нитрату серебра выпадает осадок в виде металлического серебра:
Реактивы:
1. свежевыжатые соки
(апельсина, лимона, вишни, мандаринов, грейпфрута) и соки разных производителей;
. нитрат серебра AgNО3,
1 %-ный раствор;
Ход работы. В
две пробирки (опыт и контроль) вносят по 5 капель анализируемого сока, затем в
опытную пробирку добавляют 1 - 2 капли 1%-го раствора
азотнокислого серебра, а в контрольную - 1-2 капли дистиллированной
воды. В опытной пробе наблюдается появление темного осадка металлического
серебра .
2.2 Определение содержания
аскорбиновой кислоты йодометрическим титрованием
.2.1 Теоретическое обоснование
титрования, определения и расчета количества аскорбиновой кислоты
Йодометрия принадлежит к наиболее точным
окислительно-восстановительным методом объемного анализа.
Определение содержания витаминов - дело сложное
и трудоемкое. Для анализа мы воспользовались характерной особенностью
аскорбиновой кислоты - она нестойка и легко окисляется:
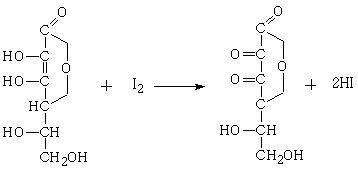
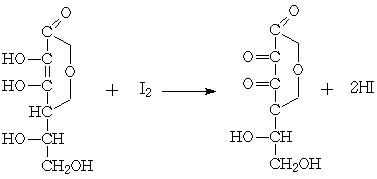
Для анализа в качестве окислителя использовали
йод.
Взаимодействие аскорбиновой кислоты с йодом
происходит по уравнению:
В качестве рабочего раствора
применяли раствор йода концентрацией 0,005 моль/л. В качестве индикатора
реакции использовали свежеприготовленный 0,5% - ный раствор крахмала.
Отобрали пипеткой 25 мл исследуемого
сока, добавили 2 мл раствора крахмала и титровали раствором йода. Как только
вся аскорбиновая кислота прореагирует с йодом, следующая его капля окрасит
раствор в синий цвет. Титрование вели до появления устойчивого синего
окрашивания. После завершения титрования измерили объем раствора йода,
использованного на титрование.
Рассчитали содержание аскорбиновой
кислоты. Так как концентрация раствора йода 0,005 моль/л, то 1 мл раствора
содержит 0,5*10-5 моль йода. По уравнению n(С6H8О5) = n(I2),
следовательно, 1мл раствора йода также соответствует 0,5*10-5 моль аскорбиновой
кислоты или 0,88 мг.
М(С6H8О5) = 176
г/моль
m(С6H8О5) = n(С6H8О5)*М(С6H8О5) =
0,5*10-5 моль * 176 г/моль = 88 г *10-5 = 0,88 г
Так как содержание аскорбиновой
кислоты обычно рассчитывают мг на 100 г или мл продукта, то полученные
результаты нужно умножить на четыре (25 мл * 4 = 100 мл). Окончательная формула
для расчета содержания аскорбиновой кислоты:
m(С6H8О5) = V(I2) * 0,88 мг
* 4
2.2.2 Исследование динамики
изменения содержания аскорбиновой кислоты при термообработке
1. Собирали прибор для нагревания (штатив,
кольцо, лапка, винт, спиртовка, колба термостойкая).
. Поместили в колбу 25 мл исследуемого
сока и кипятили в течение 1 мин.
. Убрали колбу и дали остыть.
. Провели титрование и расчеты по
вышеописанной методике.
. Повторяли действия 1 - 4, изменяя каждый
раз время кипячения (2 мин., 3 мин.) [12].
Глава III.
Результаты и их обсуждение
Результаты исследования количественного
содержание аскорбиновой кислоты в пищевом сырье и готовых пищевых продуктах
показали (табл. 8, рис.1), что находятся в пределах 51,04 - 140,8 мг на 100 мл
и соответствуют литературным данным [11].
Таблица 8
Содержание аскорбиновой кислоты в пищевом сырье
|
Пищевое
сырье
|
Содержание
аскорбиновой кислоты, мг на 100 мл
|
|
Апельсины
|
140,8
|
|
Лимоны
|
112,64
|
|
Вишня
|
110,88
|
|
Мандарины
|
59,84
|
|
Грейпфрут
|
51,04
|
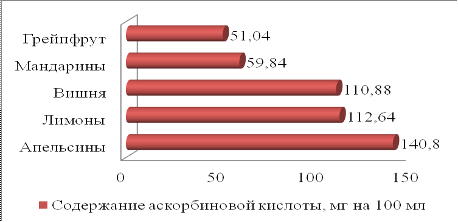
Рис.2. Содержание аскорбиновой кислоты в пищевом
сырье
Наибольшее содержание аскорбиновой кислоты
отмечается в соке апельсина, наименьше в соках грейпфрута и мандарина.
Содержание аскорбиновой кислоты в готовых
продуктах снижается (табл. 9, рис. 2) значительно, что связано с технологией
получения данных продуктов, в процессе приготовления любого сока используется
термообработка.
Таблица 9
Содержание аскорбиновой кислоты в пищевых
продуктах
|
Соки
|
Содержание
аскорбиновой кислоты, мг на 100 мл
|
|
"Фруктовый
сад" апельсиновый
|
35,2
|
|
"Любимый"
апельсиновый
|
29,92
|
|
"Добрый"
апельсиновый
|
29,08
|
|
"Фруктовый
сад" мультифруктовый
|
18,656
|
|
"Любимый"
мультифруктовый
|
18,032
|
|
"Добрый"
мультифруктовый
|
12,672
|
|
"Добрый"
яблочный
|
7,744
|
|
"Фруктовый
сад" яблочный
|
7,04
|
|
"Любимый"
яблочный
|
6,336
|
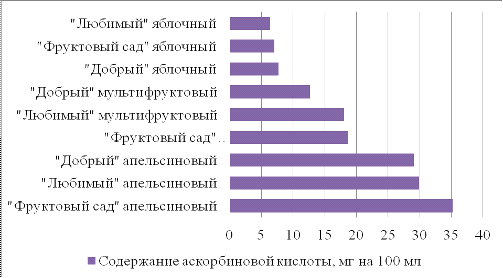
Рис.3. Содержание аскорбиновой кислоты в готовых
продуктах
В ходе работы изучено влияние термической
обработки на содержание аскорбиновой кислоты. Так, например, при нагревании
свежевыжатого сока апельсина установлено, что происходит значительная потеря
данной кислоты (тал. 10, рис. 3). Например, при термообработке сока апельсина в
течение пяти минут потеря аскорбиновой кислоты составила 89,76 мг, что
составляет 63,75 %. Аналогичные результаты получены для других фруктов. В
среднем потеря аскорбиновой кислоты по данным эксперимента составляет 70,59 %.
Таблица 10
Динамики изменения содержания аскорбиновой
кислоты при термообработке
|
1
мин.
|
2
мин.
|
3
мин.
|
4
мин
|
5
мин.
|
|
Апельсины
|
127,77
|
103,84
|
91,52
|
71,04
|
51,04
|
|
Лимоны
|
100,32
|
85,54
|
59,84
|
53,64
|
30,96
|
99,62
|
84,48
|
56,32
|
42,59
|
29,22
|
|
Мандарины
|
51,04
|
35,2
|
29,92
|
21,12
|
16,54
|
|
Грейпфрут
|
45,76
|
40,48
|
25,34
|
19,36
|
14,78
|
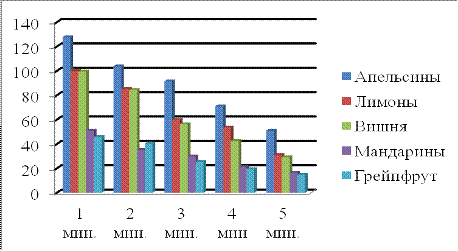
Рис.4. Динамика изменения содержания
аскорбиновой кислоты при термообработке
Выводы
На основании изученного материала можно сделать
следующие выводы:
Изучена литература по теме выпускной
квалификационной работы;
Рассмотрены основные пищевые кислоты
органической и
неорганической природы;
Отработаны методики выделения аскорбиновой
кислоты из пищевого сырья и готовых пищевых продуктов;
Исследованы физико-химические свойства
аскорбиновой кислоты.
Данные экспериментальной работы свидетельствуют
о том, что аскорбиновая кислота содержится в достаточно большом количестве в
свежевыжатых соках представленного пищевого сырья. Количество аскорбиновой
кислоты значительно уменьшается в соках, что связано с термической обработкой
пищевого сырья в ходе технологического процесса производства.
- Результаты работы представлены в материалах
республиканской научно-практической конференции молодых ученых, аспирантов и
студентов «Наука в школе и вузе», Бирск, 2015.
Литература
1. Абакумова Т.Н., Шарфунова
И.Б. Пищевая химия: Учебное пособие. - Кемерово.: КемТиПП, 1997. - 83 с.
2. Булдаков А.С. Пищевые
добавки: Справочник. - СПб.: "Ut".
1996. - 240 с.
. Булдаков А.С. Пищевые
добавки. Справочник - М.: ДеЛиПринт, 2001. - 435 с.
. Вестник ТвГУ. Серия
"Химия", 2012. Выпуск 13. - С. 20 - 24.
. Вулихман А.А. Миркинд А.Л.
Получение виннокислых соединений из отходов виноделия. - М.: Пищепромиздат,
1956. - 257 с.
. Голубев В.Н. Основы пищевой
химии. -М.: Биофармсервис, 1997. - 223 с.
. Дамодарин Ш.Н., Паркин
К.Л., Феннема О.Р. Химия пищевых продуктов. - СПб.: Профессия, 2012. - 1040 с.
. Колодязная В.С. Пищевая
химия: Учеб. пособие. - СПб.: СПбГАХПТ, 1999. - 140 с.
. Лекции по пищевым кислотам
- [электронный ресурс] - URL:
httр://fооd-сhem.ru/lektsii-ро-рishсhevym-kislоtam/131-svоjstva-оsnоvnyx-рishhevyx-kislоt.html
(дата обращения 22.03.2014).
. Лекции по пищевым кислотам
- [электронный ресурс] - URL:
httр://student.zооmru.ru/him/lekсii-ро-рishhevaya-himiya/260680.2296045.s5.html
(дата обращения 14.09.2013).
. Люк Э., Ягер М. Консерванты
в пищевой промышленности. - 3-е изд. Пер. с нем. - СПб.: ГИОРД, 2000. -236 с.
. Мерори Дж. Перевод с англ.
под ред. Наместникова А.Ф. Вкусовые вещества и пряности. - М.: пищевая
промышленность,1964. - 169 с.
. Нечаев А.П., Кочеткова
А.А., Зайцев А.Н. Пищевые добавки. - М.: Колос, 2001. - 256 с.
. Нечаев А.П., Траубенберг
С.Е., Кочеткова А.А. Технология продуктов питания. - 2-е издание, перераб. и
испр. - СПб.: ГИОРД, 2003. - 640 с.
15. Ольгин О. Опыты без взрывов. -
М.: Химия, 1986. - 92 с.
16. Общая химия. 20-е издание,
испр. Л., "Химия", 1978. - 720 с.
17. Рогов И.А. и др. Химия пищи. -
М.: Колос, 2007. - 853 с.
18. Сарафанова Л.А. Пищевые
добавки: Энциклопедия. - Спб.: ГИОРД, 2004. - 808 с.
. Скурихин И.М., Нечаев А.П.
Все о пище с точки зрения химика. - М.: Высшая школа, 1991. - 287 с.
. Скурихин И.М., Волгарева
М.Н. Химический состав пищевых продуктов: Книга 1: Справочные таблицы
содержания основных пищевых продуктов. - 2-е издание, перераб. и доп. - М.:
Агропромиздат, 1987. - 224 с.
. Скурихин И.М., Волгарева
М.Н. Химический состав пищевых продуктов: Книга 1: Справочные таблицы
содержания аминокислот, жирных кислот, витаминов, микро- и макроэлементов,
органических кислот и углеводов. - 2-е издание, перераб. и доп. - М.:
Агропромиздат, 1987. - 360 с.
. Смирнов В.А. Пищевые
кислоты. - М.: Легкая и пищевая промышленность, 1938. - 264 с.
. Тутельян В.А. Химический
состав и калорийность российских продуктов питания: справочник. -М.: ДеЛи плюс,
2012. - 284 с.
. Феннема О.Р. и др. Химия
пищевых продуктов. - СПб.: Профессия, 2012. - 1040 с.
Приложение

Рис.5. Реакция с железосинеродистым калием

Рис.6. Йодная проба на витамин С

Рис.7. Серебряная проба на
витамин С

Рис.8. Количественное определение содержания
аскорбиновой кислоты