Оптимизация керамической технологии
Содержание
Введение
. Способы выращивания
монокристаллов
.1 Выращивание из раствора в
расплаве
.2 Метод Врейнеля
.3 Метод Бриджмена
.4 Метод Чохральского
.5 Метод зонной плавки
.6 Гидротермальное выращивание
.7 Способ выращивания монокристаллов
из паровой фазы
. Кристаллизация и
рекристаллизация твердых тел
.1 Кристаллизация
.2 Рекристаллизация
. Сущность метода совместного
осаждения
. Ферриты, как фазы
переменного состава
.1 Структура ферритов
.2 Дефектность ферритов
.3 Нестехиометрия ферритов
5. Особенности
строения P
 -Т - фазовых диаграмм на примере
марганец-цинковых ферритов
-Т - фазовых диаграмм на примере
марганец-цинковых ферритов
. Задача
Выводы
Список источников
Введение
Перспективность керамики, как
материала будущего, объясняется не только доступностью сырья и низкими
затратами на производства, но, также, ее многофункциональностью, безопасностью
в эксплуатации и экологическими преимуществами производства.
В применении керамических материалов
перспективными являются:
разработка пластичной керамики на
основе чистых тугоплавких оксидов металлов; для создания бронепокрытий,
защитных покрытий ракет и других летательных аппаратов, которые обеспечивают
защиту от коррозии в экстремальных условиях и от радиолокационного обнаружения;
использование графитопластов в
химической промышленности для изготовления теплообменной и иной аппаратуры,
работающей в агрессивных средах;
применение корундовой керамики с
высокой, по сравнению с другими видами, теплопроводностью в ядерной технике;
создание специальных видов керамики,
таких как материалы на основе ферритов, используемых в технике высоких энергий,
пьезокерамические изделия для радиотехники, акустики и вычислительной техники,
керамические твердые электролиты с различной проводимостью.
Возможности оптимизации керамической
технологии связаны с увеличением однородности, дисперсности шихты, с ростом
активности готового материала за счет интенсификации предшествующих стадий
технологического процесса и создания необходимой поверхности для повышения
скорости гетерофазных процессов при последующем спекании. Рассмотрение
указанных вопросов является важной и актуальной задачей технологии
сегнетоэлектрических материалов.
Пьезокерамические элементы находят
применение в телефонах, микрофонах, звукоснимателях, ультразвуковых устройствах,
сейсмоприёмниках, системах зажигания двигателей внутреннего сгорания,
высоковольтных трансформаторах, управляющих реле, аппаратах медицинской
диагностики и многих других устройствах.
Поэтому развитие и совершенствование
всех отраслей промышленности силикатных материалов имеет первостепенное
значение.
1. Способы выращивания монокристаллов
.1 Выращивание из раствора в расплаве
(спонтанная кристаллизация)
В качестве легкоплавких флюсов используют обычно
PbO, PbF2, B2O3, Bi2O3,
V2O5 и др. Кристаллизация происходит при охлаждении ниже
точки насыщения. Основными достоинствами метода является то, что кристаллизацию
можно проводить значительно ниже температуры плавления получаемого материала.
Недостатки: загрязнение элементами флюса, необходимость в очень точном
регулировании температуры, использование дорогостоящих платиновых материалов
тиглей [1].

Рис. 1.1. Принципиальная схема установки для
выращивания кристаллов из расплава в растворе.
- кристаллизационная печь,2 циллиндрический
карборундовый экран, 3 - нагревательные силитовые стержни, 4 - под печи, 5 -
тигель,
-устройство для вертикального перемещения,
- устройство для реверсивного вращения,
- термопара-датчик, 9-контрольные термопары
К флюсам предъявляются следующие требования: они
не должны быть летучими и токсичными, по возможности минимально входить в
состав монокристаллов (если не являются их компонентами), должна быть умеренная
вязкость расплавов [1].
Например, для выращивания кристаллов
феррограната (ЖИГ) берут шихту, содержащую в мольн. %: 10 Y2O3,
20,4 Fe2O3, 36,8 PbO 27,1 PbF2, 5,5 B2O3.
Состав кристаллизующегося целевого продукта Y3Fe5O12
не соответствует по соотношению концентрации основных компонентов составу
расплава, как и в случае кристаллизации ферритовых кристаллов из раствора,
который был рассмотрен нами выше. Процессы роста монокристаллов при реализации
их технологии подчиняются, собственно говоря, тем же основным термодинамическим
и кинетическим закономерностям, что и синтез порошковых и пленочных материалов.
Так важнейшим фактором является высокотемпературная фазовая диаграмма
компонентов шихты в области ликвидуса и солидуса. Рост кристаллов протекает
через возникновение зародышей, которые могут в зависимости от температуры и
химических потенциалов компонентов растворяться или расти далее, т.е. могут
обладать критическими размерами и т.д. [1].
По данному варианту температура выдержки
расплава 1250-1300оС (15 часов), скорость охлаждения после этого до
кристаллизации 0,3-0,5 град/час. Кристаллизацию прекращают при 950-1000оС
и удаляют оставшийся расплав, полученные кристаллы очищают кипячением в азотной
кислоте. Скорость вращения тигля при выращивании 20 об/мин, вращение
осуществляют 15 с в одну сторону и 15 с в другую с 5-секундной паузой[1].
.2 Метод Вернейля
Метод Вернейля реализуется путем просыпки
маленьких порций порошковой шихты в трубчатую печь, где эта шихта расплавляется
во время падения в кислородно-водородном пламени и питает каплю расплава на
поверхности затравки. Затравка при этом вытягивается постепенно вниз, а капля
пребывает на одном и том же уровне по высоте печи. Преимущества данного метода:
отсутствие флюсов и дорогостоящих материалов тиглей; отсутствие необходимости
точного контроля температуры; возможность контроля за ростом монокристалла.
Недостатки: из-за высокой температуры роста кристаллы имеют внутренние
напряжения; стехиометрия состава может нарушаться вследствие восстановления
компонентов водородом и испарения летучих веществ. Скорость выращивания -
несколько мм/час[1].
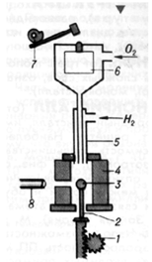
Рис .1.2. Схема установки для выращивания
монокристаллов по методу Вернейля
- механизм опускания кристалла,
- кристаллодержатель,
-растущий кристалл,4 - муфель, 5 - горелка,
- бункер, 7 - механизм встряхивания, 8 -катетометр.
1.3 Метод
Бриджмена
Метод Бриджмена - зарождающиеся в нижней части
тигля с расплавом монокристаллы служат затравкой. Тигель опускается в более
холодную зону печи. Нижняя часть тигля - коническая. Скорость выращивания -
также несколько мм/час[1].
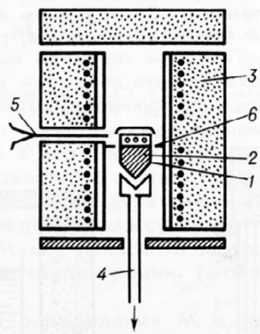
Рис.1.3. Схема установки для выращивания
монокристаллов по методу Стокаберга-Бриджмена
- тигель с расплавом, 2 - кристалл,
- печь, 4 - холодильник,
- термопара, 6 - тигель с экраном
.4 Метод Чохральского
По методу Чохральского производят вытягивание
вверх на затравку монокристалла из ванны с расплавом. Нагрев обычно
осуществляют при помощи СВЧ излучения. Для снятия возникающих напряжений
используют дополнительную печь, через которую проходит выращиваемый кристалл и отжигается
[1].
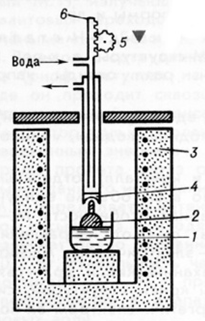
Рис. 1.4. Схема установки для выращивания
монокристаллов по методу Чохральского
- тигель с расплавом, 2 - кристалл,
- печь, 4 - холодильник,
,6 - механизм вытягивания.
.5 Метод зонной плавки
Зонная плавка заключается в прогонке зоны
расплава по длине заготовки монокристалла, одновременно в зоне расплава
концентрируются примеси и происходит очистка кристалла, конечную часть которого
затем удаляют. Нагрев осуществляется индукционным, радиационно-оптическим или
другим методом. Скорость выращивания по методам 4 и 5 близка к таковой для 2 и
3 методов. При реализации трех последних способов необходимо регулирование
газовой среды выращивания[1].
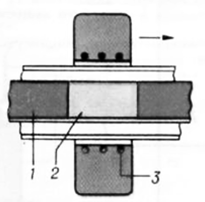
Рис. 1.5. Схема устройства для зонной плавки
.6 Гидротермальное выращивание
Исходные оксиды или готовый сложный оксид
растворяют в водных растворах кислот или щелочей для реализации
гидротермального метода. Выращивание проводят в автоклавах с защитными
коррозионно-стойкими вкладышами, например, для ферритов при 375-725оС и
давлении 1800-2000 атм. Из-за разницы температур в верхней и нижней зонах
автоклава вверху выделяется кристалл. Скорость выращивания - от долей мм до
нескольких мм в сутки. Выращиваемые монокристаллы обычно имеют высокое качество
и характерную кристаллографическую огранку, т.к. растут в условиях более или
менее близких к равновесным [1].
.7 Способ выращивания монокристаллов из паровой
фазы
Что выращивание крупных монокристаллов (весом в
десятки или сотни граммов) из паровой фазы не может иметь практического
использования ввиду малых скоростей роста, присущих этому методу. Поэтому
процессы роста из паровой фазы считаются применимыми лишь для выращивания
эпитаксиальных пленок и в отдельных случаях для получения, например, небольших
пластинчатых монокристаллов самых различных веществ. Высокопроизводительные
методы выращивания монокристаллов из расплавов, как правило, не могут
обеспечить необходимой высокой однородности свойств при получении
диссоциирующих соединений с высокими температурами плавления, а также твердых
растворов двух полупроводников все более широко используют различные методы
выращивания из паровой фазы [1].
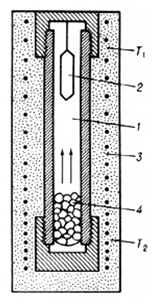
Рис. 1.6. Схема автоклава для гидротермального
синтеза
- раствор, 2 - криcталл, 3 - печь, 4 - вещество
для кристаллизации (T1<T2).
Однако не следует думать, что метод выращивания
из паровой фазы автоматически устраняет все причины неоднородности кристаллов.
Процессы выращивания монокристаллов из паровой фазы являются не менее
чувствительными к колебаниям внешних условий и состава питающей фазы, чем
методы выращивания из расплавов. Но влияние этих колебаний может быть
значительно сглажено, благодаря малым скоростям роста, которые способствую!
приближению к равновесию между наращиваемыми слоями кристалла и паровой фазой.
Все методы выращивания монокристаллов из паровой фазы (в виде пленок или
объемных кристаллов) можно разделить на три большие группы, отличающиеся
методом доставки атомов от источника к растущему кристаллу.
Состав растущего кристалла практически идентичен
составу источника, а паровая фаза состоит только из атомов или молекул,
образующих источник и кристалл; процесс состоит из возгонки или испарения с
последующей конденсацией паров [1].
Источник состоит из газообразных молекул
сложного состава, содержащих атомы кристаллизующегося вещества. Кристалл
заданного состава образуется в результате химической реакции, происходящей на
его поверхности (или вблизи нее) и приводящей к выделению атомов
кристаллизующегося вещества: методы диссоциации или восстановления газообразных
химических соединений [1].
Состав паровой фазы отличен от состава кристалла
и состава источника; паровая фаза состоит из молекул, образованных атомами
вещества источника и атомами посторонних химических элементов, не входящих в
состав кристалла. Выделение атомов кристаллизующегося вещества происходит в
результате реакции диспропорционирования или диссоциации газообразных молекул:
метод реакций переноса (газотранспортных реакций). [1]
2. Кристаллизация и рекристаллизация твёрдых тел
.1 Кристаллизация
Для осуществления процесса кристаллизации в
растворе необходимо создать пересыщение. По способам его создания различают два
основных метода кристаллизации: 1) охлаждение горячих насыщенных растворов
(изогидрическая кристаллизация) и 2) удаление части растворителя путем
выпаривания (изотермическая кристаллизация) [8].
Растворимость большинства веществ
уменьшается с понижением температуры. Поэтому при охлаждении горячих растворов
возникает пересыщение, обусловливающее выделение кристаллов. Этот метод получил
название изогидрической кристаллизации, поскольку при его осуществлении
количество растворителя (например, воды) остается постоянным [8].
На диаграмме растворимости
охлаждение горячего ненасыщенного раствора, имеющего температуру ti и концентрацию С)
(точка А), до конечной температуры tz условно можно изобразить линией АС, которая пересекает кривую
растворимости в точке В, характеризующей насыщенное состояние раствора при
температуре t'1. Если кристаллизация раствора начинается только после его
охлаждения до температуры t2, при которой и
заканчивается полное снятие пересыщения, то процесс кристаллизации изобразится
линией CD, а конечное состояние раствора - точкой D на кривой растворимости,
соответствующей равновесной концентрации С2 [8].
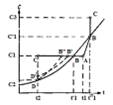
Рис. 2.1. Диаграмма растворимости
В том случае, если раствор не
способен к образованию сколько-нибудь заметного пересыщения, процесс его
охлаждения и кристаллизации изобразится линией ABD.
В зависимости от скорости охлаждения раствора и его
способности образовывать пересыщение реальный процесс может протекать также по
линиям AB'D'D или AB''D[8].
Изотермическая кристаллизация заключается в том,
что вещества кристаллизуются при неизменной температуре. Между жидкой фазой и
газообразной устанавливается равновесие при данной температуре. Если уменьшить
концентрацию паров над раствором, то растворитель будет испаряться, при этом
концентрация раствора увеличивается и растворенное вещество кристаллизуется.
Такого вида кристаллизация может происходить под вакуумом, в эксикаторах над
водоотнимающими веществами. Изотермическую кристаллизацию проводят в
установках, позволяющих упаривать растворы. В частности, в лабораторном
кристаллизаторе Чернова - Ковзуна[8].
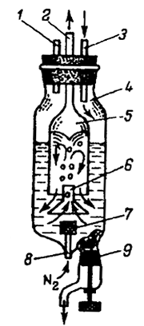
Рис. 2.2. Кристаллизатор Чернова-Ковзуна
Растворитель многократно испаряется и
конденсируется. Кристаллизация вещества в этой установке происходит следующим
образом. В стеклянную колонку 7 помещают стеклянный перфорированный стакан 8 с
веществом, требующим перекристаллизации, а в стеклянную колонку 3 заливают
растворитель до середины расширенной части при открытом кране 6, соединяющем
две колонки. Растворитель должен заполнить две колонки до одного уровня. Пар
кипящего растворителя конденсируется на стенках холодильника и стекает в стакан
с веществом, растворяя его [8].
Раствор перетекает в колонку испарения и
подвергается там кристаллизации. После того как почти все вещество перейдет из
колонки 7 на фильтр 5, весь раствор спускают и снимают с колонки 3 нижнюю часть
с фильтром и кристаллами [8].
При добавлении к раствору вещества,
понижающего растворимость выделяемой соли, можно вызвать пересыщение раствора и
кристаллизацию. Подобный метод кристаллизации получил название высаливания [8].
Вещества, добавляемые в раствор,
обычно имеют одинаковый ион с кристаллизуемой солью. Характерными примерами
процессов высаливания являются: кристаллизация железного купороса из травильных
растворов при добавлении в них концентрированной серной кислоты; высаливание NaCl из рассолов за счет
введения в них хлористого магния или хлористого кальция; получение безводного
сульфата натрия добавлением к его растворам NaCl; высаливание поваренной
солью хлористого бария из гидросульфидных щелоков и др. [8]
Высаливающее вещество лучше вводить
в раствор в виде насыщенного раствора, так как при добавлении твердого
высаливателя на нем может осаждаться кристаллизующаяся соль, что вызовет
замедление или даже прекращение растворения осадителя [8].
Введение органических растворителей
в водные растворы неорганических солей увеличивает эффективность процесса
кристаллизации, обеспечивая высокую степень извлечения соли из раствора и
возможность получения продукта в чистом виде. Недостатком этого способа
является сравнительно высокая стоимость органических растворителей, регенерация
которых требует проведения дополнительных операций (например, ректификации и
дистилляции) и связана с некоторой потерей реагента [8].
Выделение кристаллической фазы из
раствора можно осуществить за счет пересыщения, возникающего в результате
химических реакций. Такой химический метод кристаллизации используется в аналитической
практике, а также в ряде химических производств.
В производстве кальцинированной соды
промежуточный продукт (бикарбонат натрия NaHCО3) также
получают вследствие химической реакции, протекающей при абсорбции
аммиачносоляным раствором двуокиси углерода. Эта реакция может быть выражена
суммарным уравнением:[8]
NaCl + NH3 + СО2 + Н2О
-> NaHCО3 + NH4Cl
В образующемся растворе наименее
растворимой солью является бикарбонат натрия, который выпадает в виде
кристаллического осадка и служит для получения кальцинированной соды [8].
Другими способами получения
кристаллических продуктов в результате химических реакций являются:
кристаллизация хлористого аммония при нейтрализации газообразным аммиаком
водных растворов NH4C1, насыщенных хлористым водородом; осаждение мелкокристаллического
сульфата бария при обработке растворов солей бария (например, ВаС12)
серной кислотой или сернокислыми солями (например, Na2SО4); кристаллизация
нитрата бария при сливании насыщенных растворов хлористого бария и
азотнокислого аммония и др. [8]
2.2 Рекристаллизация
Рекристаллизацией называют
зарождение и рост новых зерен с меньшим количеством дефектов строения; в
результате рекристаллизации образуются совершенно новые, чаще всего равноосные
кристаллы [2].
Зарождение новых зерен при
рекристаллизации происходит в участках с наибольшей плотностью дислокаций,
обычно на границах деформированных зерен. Чем выше степень пластической
деформации, тем больше возникает центров рекристаллизации. Они представляют
собой субмикроскопические области с минимальным количеством точечных и линейных
дефектов строения. Эти области возникают путем перераспределения и частичного
уничтожения дислокаций; при этом между центром рекристаллизации и
деформированной основой появляется высокоугловая границах [2].
С течением времени образовавшиеся
центры новых зерен увеличиваются в размерах вследствие перехода атомов от
деформированного окружения к более совершенной решетке; при этом большеугловые
границы новых зерен перемещаются в глубь наклепанного металла [2].
Рассмотренная стадия
рекристаллизации называется первичной рекристаллизацией или рекристаллизацией
обработки [2].
По завершении первичной
рекристаллизации происходит рост образовавшихся зерен при увеличении выдержки
или температуры; эта стадия рекристаллизации называется собирательной
рекристаллизацией. Этот процесс самопроизвольно развивается при достаточно
высоких температурах в связи с тем, что укрупнение зерен приводит к уменьшению
свободной энергии металла из-за уменьшения поверхностной энергии (чем крупнее
кристаллы, тем меньше суммарная поверхность границ) [13].
Рост зерен происходит в результате
перехода атомов от одного зерна к соседнему через границу раздела; одни зерна
при этом постепенно уменьшаются в размерах и затем исчезают, а Другие становятся
более крупными, поглощая соседние зерна. С повышением температуры рост зерен
ускоряется. Чем выше температура нагрева, тем более крупными окажутся
рекристаллизованные зерна [13].
Первичная рекристаллизация полностью
снимает наклеп, созданный при пластической деформации; металл приобретает
равновесную структуру с минимальным количеством дефектов кристаллического
строения. Свойства металла после рекристаллизации близки к свойствам
отожженного металла. [13]

Рис. 2.3.
Схемы изменения твердости (а) и пластичности (б) наклепанного металла при
нагреве
3. Сущность метода совместного осаждения
Совместное осаждение - переход в осадок примесей
(микрокомпонентов), сопутствующий осаждению основного вещества
(макрокомпонента) из раствора, расплава или пара, содержащих несколько веществ.
Совместное осаждение происходит тогда, когда раствор (пар) пересыщен в
отношении вещества, образующего осадок, или расплав переохлажден. Совместное
осаждение начинается лишь по истечении определенного периода; длительность его
можно менять от микросекунд до десятков часов, изменяя исходное пересыщение
(переохлаждение), интенсивность перемешивания, чистоту и температуру среды, из
которой выделяется осадок. Совместное осаждение протекает в две стадии: оно
начинается с захвата примеси в ходе роста частиц осадка при его выделении и
завершается его перераспределением её между осадком и средой. Принципиальная
технологическая схема синтеза при использовании метода совместного осаждения
представлена на Рис. 3.1.[3].
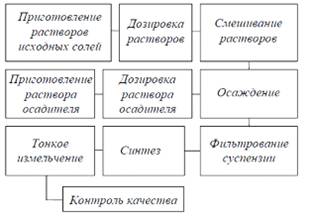
Рис. 3.1. Принципиальная технологическая схема
синтеза при использовании метода совместного осаждения.
Стремление обеспечить максимальную гомогенность
синтезируемого материала привело к интенсивным работам по химическим методам
синтеза. При этих методах из растворов солей выделяют твердую фазу с однородным
распределением компонентов[3].
В химических методах синтеза систем типа ЦТС
используют:) Водные растворы нитратов металлов;) Смеси
водных растворов Pb(NO3)2
и хлоридов Ti
и Zr;) Растворы
алкогулянтов металлов в безводных органических растворителях.
При осаждении в качестве осадителя используют
растворы аммиака (NH4OH)
или бикарбоната аммония (NH4HCO3)
в которые добавляют растворы солей. Полнота осаждения достигается введением
избытка осадителя и поддержания кислотности среды pH>8.
Схема промышленной установки для получения материалов по технологии совместного
осаждения представлена на рис. 3.2.
Что метод совместного осаждения довольно просто
может быть осуществлен при любом сочетании компонентов, образующих
труднорастворимые соединения, но он не может быть применен в том случае, когда
в состав материала должен входить компонент, который не образует
малорастворимых соединений, или такие соединения растворяются в избытке
осадителя [11].
Порошки, полученные описанным методом подвергают
обжигу, при котором происходит термическое разложение (с целью удаления летучих
компонентов) и синтез соответствующих(с целью удаления летучих компонентов) и
синтез соответствующих материалов.[11]
4. Ферриты, как фазы переменного состава
4.1 Структура ферритов
Известно несколько типов структур,
которые при наличии в них парамагнитных ионов группы железа и других переходных
элементов обладают ферримагнитными свойствами. К таким структурам относятся
структуры типа: шпинели, магнетоплюмбита (гексагональные ферриты), граната,
перовскита (ортоферриты) [4].
Ферриты первых трех типов структур
применяют на практике, их строение и свойства относительно хорошо изучены, а
природа их магнетизма укладывается в представления, развитые Неелем. Ферриты со
структурой типа перовскита практического применения пока не нашли, неясен также
механизм возникновения у них магнетизма [4].
Ферриты - ионные соединения, в
которых анионом является кислород. При описании кристаллических решеток ионных
соединений можно исходить из принципа плотнейшей упаковки анионов, так как
размеры последних, как правило, значительно больше размеров кати онов [4].
Анионы могут образовывать плотнейшую
упаковку по одному из возможных типов, а катионы располагаются в пустотах,
образующихся при укладке анионов [4].
Геометрически заполнить шарами
пространство можно бесчисленным количеством способов, однако в реальных
соединениях наиболее часто встречаются два случая.
На слой шаров А, плотно уложенных на
плоскости, второй плоский слой шаров В можно наложить только одним способом, а
именно: каждый шар В второго слоя положить в лунку, образуемую тремя шарами А
нижнего слоя. При этом получается два плотноупакованных слоя[4].
Третий слой можно укладывать
по-разному.
По первому способу укладки центры
шаров первого и третьего слоев оказываются на одной прямой, перпендикулярной
плоскости укладки, т. е. третий слой повторяет первый. С учетом принятых
обозначений получаем чередование слоев АВА. Если, четвертый слой повторяет
второй и т. д., то получается чередование слоев по типу АВАВАВ…; возникающая
решетка отвечает гексагональной сингонии [4].
По второму способу укладки каждый
Шар С третьего слоя оказывается в лунке, образуемой шарами второго слоя. Однако
под шарами третьего слоя нет шара в первом слое. Получаемый третий слой
отличается от первого и второго. Схематически этот вариант показан на рис. 4.1
б, где для наглядности шары на плоскости несколько раздвинуты. При дальнейшей
поочередной повторяемости слоев А, В и С получим решетку типа АВСАВСАВС,
отвечающую кубической сингонии [4].
В обоих случаях плотность заполнения
пространства одинакова - 74,05%, одинаково координационное число шаров - 12,
однако симметрия в расположении шаров различна, что и приводит к различию в
свойствах кристаллов при прочих равных условиях [4].
Элементарная ячейка гексагональной
упаковки базисной плоскостью совпадает с плоскостью плотнейшей упаковки,
которая перпендикулярна оси симметрии шестого порядка. Постоянная решетки в
базисной плоскости а = 2r (r- радиус шара). Высота элементарной ячейки е равна удвоенной
высоте тетраэдра, образованного четырьмя шарами (рис. 4.1 а) [4].
Упаковка АВСАВС… приводит к
появлению элементарной ячейки в виде гранецентрированного куба (рис. 4.1 б)
Элементраная ячейка кубического типа), в котором плоскость плотноупакованных
шаров совпадает с плоскостью. Шары, находящиеся в вершинах куба, одновременно
являются вершинами тетраэдров, образуемых ими с тремя шарами в центрах граней
куба [5].
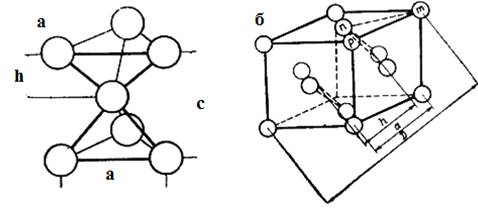
Рис 4.1. а) часть элементарной ячейки
гексагонального типа; б) элементарная ячейка кубического
типа(гранецентрированный куб)
Как указывалось, плотность
заполнения шарами пространства при плотнейших упаковках составляет 74,05%,
остальная часть пространства - 25,95% - остается в виде пустот между шарами[5].
В плотнейших упаковках можно
выделить пустоты двух типов. Одни пустоты - тетраэдрические - образуются
четырьмя шарами, расположенными в вершинах тетраэдра (рис. 4.2. а)
Тетраэдрические и октаэдрические пустоты). Другие пустоты - октаэдрические -
образуются восемью щарами, расположенными в вершинах октаэдра (рис. 4.2., б)
[5].
Рис. 4.2. Тетраэдрические (а) и
октаэдрические (б) пустоты.
Название шпинель происходит от
природного минерала - благородной шпинели MgAl2O4. При замене в указанной формуле А13+ на Fe3+ получаются феррит-шпинели [9].
Обычно формула шпинели в общем виде
такова: Me Fe204 (Me - двухвалентный катион
одного из следующих металлов - Со2+, Fe2+, Ni2+, Zn2+, Mg2+, Mn2+ или комбинация 0,5 ат.% Li+ + + 0,5 ат. % Fe3+ и т. д.)[9].
Кристаллическую структуру шпинели
можно рассматривать с позиций теории плотнейших упаковок. Анионы О2-
образуют плотную кубическую гранецентрированную упаковку, а катионы Ме2+
и Fe3+ располагаются в
пустотах. В элементарную ячейку входят восемь формульных единиц MeFe204. Таким образом, 32 аниона О2- образуют
плотноупакованную кубическую гранецентрированную элементарную ячейку шпинели.
Узлы, занимаемые О2- обычно обозначают как 32с-узлы[9].
При плотной упаковке анионов О2-
в элементарной ячейке образуется 64 тетраэдрических и 32 октаэдрических
пустоты. В этих пустотах и располагаются катионы Ме2+ и Fe3+, занимающие 8 тетраэдрических пустот (обозначают 8а) и 16
октаэдрических пустот (обозначают 16d) [9].
Элементарную ячейку шпинели можно
условно разбить на 8 отдельных кубиков-октантов с ребрами, равными половине
параметра ячейки. При этом одинаковое расположение ионов будет наблюдаться в
октантах, соприкасающихся ребрами (рис. 4.3. а) Разделение элементарной ячейки
шпинели на октанты с одинаковым расположением ионов). Таким образом, можно
ограничиться рассмотрением расположения ионов только в двух октантах, так как в
остальных эти варианты будут повторяться [9].
Расположение ионов в двух октантах
элементарной ячейки шпинели показано на рис. 4.3. б) (Расположение ионов в
октантах ячейки шпинели) Видно, что тетраэдрические пустоты - или 8а-узлы -
находятся в четырех из восьми вершин куба и в одном октанте в центре куба; в
соседнем октанте центр куба не занят. Октаэдрические пустоты - 16й-узлы -
находятся только в том октанте, где в центре нет 8а-узла. Образование
октаэдрической пустоты для иона I происходит с участием двух ионов О2-
(пунктир), находящихся вне пределов данных октанов [9].
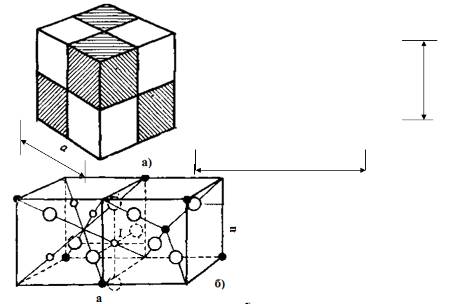
Рис. 4.3 а) Разделение элементарной ячейки
шпинели на октанты с одинаковым расположением ионов; Рис. 4.4. б) Расположение
ионов в октантах ячейки шпинели.[9]
Иногда эти ферриты называют гексагональными.
Структуру природного минерала магнетоплюмбита - РЬFe7,5Mn3,5Al0,5Ti0,5О19 - имеет только один представитель гексагональных
ферритов - гексаферрит бария BaFe12О19 [5].
Гексаферрит бария - первое
соединение, детально исследованное и получившее широкое применение. Возможно,
по этой причине название «ферриты со" структурой магнетоплюмбита»
привилось и к другим соединениям, имеющим уже несколько отличную структуру[5].
В настоящее время известно много
гексагональных ферритов, а если учесть возможность изоморфных замещений в них,
то в будущем количество гексагональных ферритов увеличится. Эти ферриты имеют
следующие составы:
М-BaFe12O19 или BaО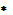
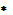 6Fe2О3
6Fe2О3
W - BaMe2Fе16О27
или ВаО 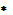
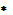 2МеО
2МеО 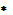
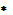 8Fe2О3
8Fe2О3
Y-Ba2Me2Fe12022
или 2ВаО 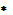
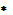 2МеО
2МеО 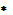
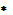 6Fe2О3
6Fe2О3
Z - Ba3Me2Fe24О41 или ЗВаО 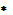
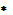 2МеО
2МеО 
 12Fe2О3
12Fe2О3
Кроме перечисленных выше гексагональных
соединений символом S обозначена
структура шпинели, записанная в удвоенном виде - Me2Fe4О8, что сделано для
удобства последующего описания гексагональных структур [5].
К гексагональным ферритам с известными
допущениями можно подходить с позиций плотнейших упаковок. При этом плотнейшую
упаковку образуют ионы О2- и Ва2+, имеющие примерно
одинаковые размеры, а ионы Fe3+
и Ме2+ размещаются в пустотах. Все гексагональные ферриты имеют один
и тот же параметр элементарной ячейки в базисной плоскости (а = 4,88 А) и
весьма различные значения параметра С [5].
Для описания кристаллографических структур
гексагональных ферритов удобно провести условное разделение структур по
гексагональной оси на отдельные блоки. В этом случае получается, что
элементарные ячейки всех гексагональных ферритов можно построить из трех видов
блоков, характерных для структур М, Y
и S. В структуру
гексагональных ферритов входят блоки, отвечающие кубической структуре шпинели,
обычно такие блоки обозначают буквой S
[5].
В гексагональной плотной упаковке базисная
плоскость является плоскостью плотнейшей упаковки, в кубической же упаковке
такой плоскостью является плоскость (111);
поэтому шпинельные блоки, входящие в структуру гексагональных ферритов,
вырезаются из решетки шпинели в направлении оси (111)
[5].
Ферриты с кристаллической решеткой,
изотипной классическому гранату - Ca3Fe2(SiО4)3
или ЗСаО • Fe203 • 3SiО2 - имеют
общую формулу Me3Fe2(FeО4)3
(Me
- трехвалентный ион иттрия или одного из лантанидов.). Иногда формулу
феррит-гранатов пишут в удвоенном виде - ЗМе2О3 • 5Fe2О3.
В элементарную ячейку входит восемь
формульных единиц Me3Fe2(FeО4)3,
или четыре ЗМе2О3 • 5Fe2О3, т. е. всего 160 атомов. Структура гранатов сложна,
пространственное изображение ее на бумаге вряд ли возможно [10].
В элементарную ячейку входят 96 атомов
кислорода, которые образуют при упаковке три типа пустот - октаэдрические,
тетраэдрические и додекаэдрические. Появление нового типа пустот,
представляющих двенадцатигранник, составленный из пятиугольников, говорит о
том, что укладку ионов кислорода уже невозможно считать плотнейшей. Кроме того,
фактическое расположение ионов кислорода по кристаллографическим осям не
полностью отвечает кубической симметрии, однако эти искажения решетки малы и
рентгенографически не улавливаются. Три указанных выше типа пустот занимают
ионы Fe3+
и Ме3+[10].
Кристаллическая структура феррит-гранатов
отличается тем, что ионы Fe3+
и Ме3+ стабильно занимают только определенные пустоты; в
октаэдрической и тетраэдрической подрешетках всегда находятся ионы Fe3+,
в додекаэдрической-Ме3+; совместное нахождение обоих типов ионов в
одной какой-либо подрешетке не наблюдается [10].
Каждый ион О2- расположен
в вершине одного тетраэдра, одного октаэдра и двух додекаэдров. Таким образом,
ион О2- имеет в качестве соседей: по одному иону Fe3+ в положениях 24а и 16d на расстояниях 1,88 и 2,00 АО и по два иона Ме3+
в положении 24с на расстояниях 2,43 и 2,37 А0.
Ферриты являются фазами переменного состава,
поэтому для них характерно наличие всех видов дефектов, которые наблюдаются в
твердых телах. Реальное распределение ионов в кристаллической решетке позволяет
объяснить, а иногда и предсказать многие свойства ферритов [7].
При спекании ферритов находящийся в них кислород
стремится к динамическому равновесию с кислородом атмосферы спекания. При этом
сумма отрицательных и положительных зарядов реагирующих веществ всегда равна
нулю [7].
В случае недостатка парциального давления
кислорода, атомы кислорода с поверхностного слоя феррита переходят в окружающую
среду. При этом в поверхностном слое возникают избыточные катионы и анионные
вакансии, которые стремятся равномерно распределиться в феррите и мигрируют из
поверхностного слоя вглубь материала [7].
В результате этого состав ферритов отклоняется
от стехиометрического и возникает, так называемое, разупорядочение структуры.
Основными видами разупорядочения в ферритах
являются:
а) точечные дефекты [вакансии, внедренные атомы
(ионы), антиструктурные дефекты;
б) протяженные дефекты (дислокации),
простирающиеся на многие элементарные ячейки;
в) электронные дефекты, представляющие локальные
нарушения распределения зарядов в структуре [7].
При обозначении точечных дефектов используют
символику, предложенную Крегером и Винком. Строчной буквой обозначают сорт
дефектов, а подстрочной - кристаллографическую позицию, в которой расположен
данный дефект [7].
Вакансии представляют собой незанятые узлы
кристаллической решетки. Их обычно обозначают символом Vi, где i - сорт
атомов (VA - вакансия в А-узле и т.д.). Такие дефекты называют дефектами Шоттки
[7].
Внедренные атомы (ионы) - это атомы (ионы),
занимающие в структуре такие положения, которые в упорядоченном кристалле
должны быть свободными. Этот тип дефектов принято обозначать буквами Вi, Ci
[7].
Антиструктурные дефекты характерны для
химических соединений и представляют собой атомы (ионы), расположенные в
местах, предназначенных в решетке для атомов (ионов) другого сорта. Их
обозначают АВ, ВА, ВС, СВ и т.д.
В химических соединениях число возможных
точечных дефектов значительно увеличивается. Даже для бинарного кристалла АnBm
возможно образование двух видов вакансий -VA иVВ, а также двух видов
антиструктурных дефектов АВ и ВА. Точечные структурные дефекты могут привести к
локальному нарушению зарядовой электронейтральности в ферритах, что может
явиться причиной электронного разупорядочения. Так, вакансия отрицательного
иона (аниона) означает недостаток отрицательного заряда и является ловушкой для
электронов. Следовательно, чтобы сохранить электронейтральность, такая вакансия
должна будет захватить электрон. При этом образуется электронный центр, который
называется F-центром [7].
При замещении одного катиона другим, имеющим
больший заряд, электрон большую часть времени локализуется не на анионе, а на
катионе, который и является электронным центром. Вакансия же катиона или его
замещение катионом с меньшей валентностью приводит к дефициту положительного
заряда и появлению ловушек для положительно заряженных дырок. Такие дефекты
называют V-центрами [7].
Представление о центрах, как точечных дефектах,
является достаточно условным, поскольку эти центры являются особыми
электронными конфигурациями групп атомов (ионов), захватившими электрон или
дырку. Считают, что в качестве положительно заряженных центров следует
рассматривать катионы, занимающие междоузельное положение, а также
несвойственные им узлы кристаллической решетки. Их обозначают Сi•,Bi••,CB•
(точками
обозначают эффективный заряд иона) [7].
В качестве отрицательно заряженных центров
рассматривают вакансии анионов. Их обозначают VB′, VC′′
(штрихами обозначают число электронов, необходимых для полного заполнения
"оболочки" вакансиями). Однако, в большинстве случаев в ферритах
дефекты встречаются в виде парных дефектов.
В бинарных и более сложных кристаллах можно
выделить шесть видов разупорядочения: из которых 3 - симметричных, а 3 -
асимметричных.
К симметричным дефектам относятся:
. Разупорядочение по Шоттки
(совокупность вакансий анионов и катионов - VA +VK;
. Междоузельное разупорядочение, т.е.
дефекты внедрения- Ai +Ki;
. Антиструктурное разупорядочение - СВ
+ВС, происходящее вследствие локализации катионов одного сорта в позициях,
характерных для катионов другого сорта [12].
Асимметричными дефектами являются:
. Дефекты по Френкелю (совокупность
вакансий и междоузельных атомов VA +Ai;
. Вакансии и атомы (ионы), занимающие
чужие узлы VС + СВ илиVB + ВС, когда вакансия иона С, а также связанный с ней
ион С в позиции В-иона или наоборот;
. Междоузельные ионы одного вида, а также
ионы другого вида, занимающие чужие узлы Ci +ВС или Вi +СВ.
В реальных структурах ферритов, содержащих
разновалентные ионы, число видов разупорядочения может быть значительно больше.
Основной причиной, приводящей к нестехиометрии ферритов, является изменение
химического состава [12].
Кроме этого существуют еще несколько причин,
приводящих к нестехиометрии. Это - различие в летучести компонентов, входящих в
состав ферритов; различие в энергиях образования простых веществ из входящих в
состав ферритов компонентов; различия электронных конфигураций катионов;
введение элементов с валентностью, отличающейся от валентности основных ионов,
и др. [12]
Взаимодействие точечных дефектов приводит, как
правило, к локальным искажениям кристаллической решетки. Однако упорядочение
дефектов может привести к образованию сверхструктуры или структуры сдвига.
Образование сверхструктуры происходит путем ассимиляции вакансий или внедренных
атомов (ионов). Одинаковые по заряду дефекты, стремящиеся занять наиболее
удаленные друг от друга позиции, по мере увеличения их концентрации под
действием отталкивающих сил размещаются в вполне определенных кристаллографических
узлах [12].
Полное упорядочение вакансий или внедренных
атомов (ионов) при определенной их концентрации приводит к образованию
сверхструктуры (структуры сдвига) [12].
В результате взаимодействия упорядоченных
дефектов они становятся менее подвижными, чем неупорядоченные. Упорядочение
дефектов может происходить путем перегруппировки координационных полиэдров. При
этом уменьшается отношение кислород-металл внутри некоторых плоскостей
кристаллов ферритов, рассматриваемых как плоскости кристаллографического
сдвига. Эти плоскости становятся поверхностями соприкосновения двух блоков
кристалла, имеющих неизменную идеальную структуру [12].
Общей особенностью структур, возникающих при
упорядочении дефектов, является то, что каждый занятый узел таких структур
слабо смещен относительно узла основной структуры, имеющей меньший размер
элементарной ячейки и более высокую симметрию [12].
Основным типом упорядочения, отвечающим за
формирование кооперативных магнитных и электрических свойств ферритов является
упорядочение катионов, находящихся в различных валентных и спиновых состояниях.
Однако следует отметить, что единой модели,
описывающей взаимодействие точечных дефектов, образование сверхструктур,
упорядочение и аннигиляцию дефектов в настоящее время не существует.
4.3 Нестехиометрия ферритов
Изучение влияния кислородной
нестехиометрии на свойства феррита затруднено в первую очередь поиском
компромиссных условий, обеспечивающих одновременно точно заданную равновесную
кислородную нестехиометрию и приемлемо низкие магнитные потери. Простейшим и
наиболее точным способом сохранения равновесной кислородной нестехиометрии
является закалка от высоких температур. В закаленных образцах кроме кислородной
нестехиометрии сохраняются распределения катионов по А- и В-подрешеткам
шпинельной структуры, сложившиеся при высокотемпературном равновесии. Однако,
как показывают экспериментальные измерения, значительные микронапряжения и даже
возможность появления микротрещин при резкой закалке образцов приводят к очень
большим магнитным потерям и сильному разбросу свойств образцов, нивелирующих
влияние собственно нестехиометрии [6].
Снижение скорости охлаждения
образцов приводит к уменьшению микронапряжений и соответственно к снижению
магнитных потерь и разброса свойств, но при этом увеличивается степень
возможного изменения кислородной нестехиометрии и катионного распределения,
заложенных при высокотемпературном равновесии.
Образцы в виде кольцевых
сердечников (
 (36 х 24) х 8 мм) из
феррита марки 2500 НМС-2 при непрерывном гравиметрическом контроле массы
спекали при 1330 °С в течение 3 ч на воздухе в вертикальной трубчатой печи.
Затем их охлаждали до 1000 °С, понижая одновременно таким образом, что
зависимость (Т) соответствовала изоконцентрате, т.е. постоянному содержанию
кислорода. Температуру понижали ступенчато через 25 °С с 20-минутной выдержкой
на каждой ступени, причем изменяли в момент снижения температуры. После
выдержки при 1000 °С образцы в токе аргона или смеси СО и СО2
выдвигали в холодную зону трубчатой печи со скоростью 3,5 мм/мин. Это
обеспечивало среднюю скорость охлаждения 60 °С/мин, которая позволяла сохранить
равновесную кислородную нестехиометрию с точностью
(36 х 24) х 8 мм) из
феррита марки 2500 НМС-2 при непрерывном гравиметрическом контроле массы
спекали при 1330 °С в течение 3 ч на воздухе в вертикальной трубчатой печи.
Затем их охлаждали до 1000 °С, понижая одновременно таким образом, что
зависимость (Т) соответствовала изоконцентрате, т.е. постоянному содержанию
кислорода. Температуру понижали ступенчато через 25 °С с 20-минутной выдержкой
на каждой ступени, причем изменяли в момент снижения температуры. После
выдержки при 1000 °С образцы в токе аргона или смеси СО и СО2
выдвигали в холодную зону трубчатой печи со скоростью 3,5 мм/мин. Это
обеспечивало среднюю скорость охлаждения 60 °С/мин, которая позволяла сохранить
равновесную кислородную нестехиометрию с точностью 
 <0,1-10-3.
Согласно результатам рентгенофазового и микроструктурного анализов вторая фаза
не выделяется из-за распада однофазной шпинели. На микрофотографиях видны
характерные признаки вторичной рекристаллизации, протекавшей при максимальных
температурах обжига. Размеры зерен керамики в образцах ферритов с различной
кислородной нестехиометрией практически не различаются. Мелкозернистые участки
с размером зерна 4-35 мкм (~ 70%) чередуются с крупными зернами 50-120 мкм (~
30%). Следовательно, рассматриваемые ниже различия в свойствах определяются не
различной микроструктурой образцов, а различным содержанием в них кислорода.
Изложенная методика обжига и закалки образцов позволила получить прямую
информацию о влиянии кислородной нестехиометрии на электромагнитные свойства
марганец-цинковых ферритов [6].
<0,1-10-3.
Согласно результатам рентгенофазового и микроструктурного анализов вторая фаза
не выделяется из-за распада однофазной шпинели. На микрофотографиях видны
характерные признаки вторичной рекристаллизации, протекавшей при максимальных
температурах обжига. Размеры зерен керамики в образцах ферритов с различной
кислородной нестехиометрией практически не различаются. Мелкозернистые участки
с размером зерна 4-35 мкм (~ 70%) чередуются с крупными зернами 50-120 мкм (~
30%). Следовательно, рассматриваемые ниже различия в свойствах определяются не
различной микроструктурой образцов, а различным содержанием в них кислорода.
Изложенная методика обжига и закалки образцов позволила получить прямую
информацию о влиянии кислородной нестехиометрии на электромагнитные свойства
марганец-цинковых ферритов [6].
Зависимости параметра
элементарной ячейки, температуры Кюри, намагниченности насыщения и удельного
сопротивления при комнатной температуре от кислородной нестехиометрии у имеют
отчетливо выраженный экстремальный характер. В точке кислородной стехиометрии 
 = 0 параметры ячейки и
намагниченность насыщения максимальны, а температура Кюри и удельное сопротивление
ми нимальны. С увеличением нестехиометрии в сторону как избытка (
= 0 параметры ячейки и
намагниченность насыщения максимальны, а температура Кюри и удельное сопротивление
ми нимальны. С увеличением нестехиометрии в сторону как избытка (
 > 0), так и
недостатка (
> 0), так и
недостатка (
 < 0) кислорода значения
а и
< 0) кислорода значения
а и 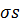
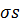 снижаются, ари Тс- повышаются. Скорость изменения всех указанных
параметров при увеличении недостатка кислорода значительно выше, чем при его
избытке. Однако в связи с тем, что протяженность области нестехиометрического
дефицита кислорода значительно меньше протяженности области его
нестехиометрического избытка, суммарные изменения близки между собой [6].
снижаются, ари Тс- повышаются. Скорость изменения всех указанных
параметров при увеличении недостатка кислорода значительно выше, чем при его
избытке. Однако в связи с тем, что протяженность области нестехиометрического
дефицита кислорода значительно меньше протяженности области его
нестехиометрического избытка, суммарные изменения близки между собой [6].
Обсуждаемые свойства
структурно-чувствительны, и наблюдаемый экстремальный характер их изменений
подтверждает правильность определения точки кислородной стехиометрии. Для
плотноупакованной структуры шпинели следует ожидать, что дефектами
нестехиометрии являются ионные вакансии: катионов при 
 > 0 и кислорода при
> 0 и кислорода при 
 < 0. Накопление
ионных вакансий по мере отклонения от стехиометрического состава приводит к
всевозрастающему сжатию элементарных ячеек из-за электростатического
отталкивания ионов, составляющих ближайшие сферы окружения вакансий.
Интенсивность этого процесса значительно выше при образовании вакансий в
плотноупакованной кислородной подрешетке, чем в катионных подрешетках. Это
объясняет значительно большую скорость снижения периода ячейки в области
недостатка кислорода.
< 0. Накопление
ионных вакансий по мере отклонения от стехиометрического состава приводит к
всевозрастающему сжатию элементарных ячеек из-за электростатического
отталкивания ионов, составляющих ближайшие сферы окружения вакансий.
Интенсивность этого процесса значительно выше при образовании вакансий в
плотноупакованной кислородной подрешетке, чем в катионных подрешетках. Это
объясняет значительно большую скорость снижения периода ячейки в области
недостатка кислорода.
Снижение параметра ячейки при
отклонении в любую сторону от стехиометрического состава способствует усилению
сверхсменного взаимодействия между катионами в магнитных подрешетках, что
приводит к наблюдаемому повышению температуры Кюри [6].
Температурный
коэффициент Втах практически не зависит от содержания кислорода.
Важным условием для многих практических применений марганец-цинковых ферритов
является отрицательность температурного коэффициента магнитных потерь. Из
полученных данных видно, что для выполнения этого условия в феррите необходимо
поддерживать определенное содержание избыточного кислорода (
 > 5
> 5
 10-3 6].
10-3 6].
Для практического
применения важно также обеспечить минимальный уровень магнитных потерь, что
достигается еще более медленным охлаждением образцов, чем в описанных выше
экспериментах. К сожалению, при этом радикально изменяется распределение
катионов, установившееся при высокотемпературном равновесии, возрастает
вероятность изменения содержания кислорода и появляются градиенты свойств по
объему [6].
Влияние условий обжига в
вакууме на свойства ферритов изучено достаточно подробно, а газотермических
режимов - не столь детально. Наиболее приближен к равновесию (при 
 = 20
= 20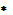
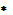 10-3) V
режим, который является самым окислительным. Его маршрут пересекает
высококислородную границу шпинельного поля при наиболее высокой (~1100°С)
температуре, что связано с повышенной опасностью распада шпинельной фазы при
охлаждении [6].
10-3) V
режим, который является самым окислительным. Его маршрут пересекает
высококислородную границу шпинельного поля при наиболее высокой (~1100°С)
температуре, что связано с повышенной опасностью распада шпинельной фазы при
охлаждении [6].
При охлаждении по I-IV режимам от 1330 до
1200°С феррит окисляется в среде воздуха при атмосферном давлении. При
температурах ниже 1200°С феррит сначала восстанавливается, а затем, при еще
более низких температурах, окисляется. Интенсивность восстановления и окисления
усиливается от IV к I режиму[6].
Охлаждение по ступенчатым программам
приводит к окислению феррита в интервале температур 1330-1300 °С, затем - к
восстановлению при 1300 °С и окислению во время дальнейшего охлаждения [6].
Таблица 4.1. Электромагнитные свойства Mn-Zn-ферритов
марки 2500НМС-2 в зависимости от содержания кислорода
|
Содержание кислорода   , 10-3Электромагнитные
параметры , 10-3Электромагнитные
параметры
|
|
|
Руд, Вт/м3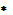 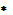 ГцB100mах Т ГцB100mах Т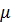 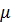 н н
|
|
|
|
100°С
|
25°С
|
|
25°С
|
100°С
|
|
15
|
5,9
|
8,1
|
0,343
|
5890
|
6010
|
|
10
|
5,6
|
7,8
|
0,350
|
6000
|
5970
|
|
5
|
7,1
|
7,7
|
0,338
|
5490
|
5100
|
|
1
|
9,8
|
7,9
|
0,318
|
4480
|
3520
|
5. Особенности строения 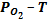
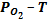 - фазовых диаграмм на примере
марганец-цинковых ферритов
- фазовых диаграмм на примере
марганец-цинковых ферритов
Твердые растворы системы MnFe2О4
- ZnFe2О4
обладают наибольшим значением магнитной проницаемости по сравнению со всеми
другими феррит-шпинелями и их твердыми растворами. Промышленность выпускает
марганеццинковые ферриты с проницаемостью до 6000; в лаборатории получены
ферриты с проницаемостью до 20000. Несмотря на это, промышленное производство
ферритов рассматриваемой системы началось значительно позднее, чем производство
никельцинковых ферритов. Причины этого кроются в серьезных технологических
трудностях, связанных с получением марганцевых ферритов [9].
Марганцевая шпинель MnFe2О4
устойчива выше 1200°С, при охлаждении происходит окисление марганца по схеме:
Mn2+-е
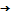
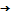 MnЗ+
MnЗ+
Марганцевая шпинель при этом
распадается на Мn2О3
и Fe2О3,
которые образуют между собой твердые растворы [9].
Таким образом, получить MnFe2О4
обжигом на воздухе практически невозможно - неизбежно появление ионов Мn3+, а это
ведет к ухудшению свойств ферритов [9].
Быстрое охлаждение марганцевых
ферритов в интервале 1100-250°С позволяет в известной мере избежать окисления Мn2+ в Мn3+ и, тем самым,
сохранить магнитные свойства, однако механические свойства таких ферритов
весьма низки.
Фактически промышленное производство
марганеццинковых ферритов началось после разработки режимов охлаждения в
вакууме и в инертных средах. В таком случае удается избежать окисления Мn2+ и получать
ферриты со стабильными свойствами.
В производстве марганцевых ферритов
давление кислорода оказывает влияние не только на разупорядоченность феррита,
как полупроводника, но и на валентное состояние ионов марганца. Отсюда вытекает
важность учета такого фактора, как давление кислорода, для технологии
марганцевых ферритов и построения диаграмм состояния с участием окислов
марганца[9].
В системе MnFe2O4 - ZnFe2O4 существует
непрерывный ряд твердых растворов, однако линии ликвидуса и солидуса не
определены. Построение этих линий затруднено из-за летучести ZnFe2O4 и
нестабильности валентных состояний ионов марганца. Чистый MnFe2O4 плавится
при 1580 °С, однако состав феррита, возможно, отличается от стехиометрического.
Твердые растворы ферритов марганца и
цинка образуются во всем интервале концентраций нагреванием при 1200 °С [9].
Определение области
шпинелеобразования в системе Mn-Zn-Fe-О не
проведено; весьма малочисленны также исследования в области псевдотройной
диаграммы MnO-ZnO-Fe2O3. Последняя
диаграмма имеет наибольшее значение для технологии, так как сырьем являются
именно эти окислы [9].
Система MnO- Fe2O3 может быть
построена в атмосферных условиях только для температур выше 1000° С, так как
при более низких температурах устойчива Мn2O3. Диаграмма
равновесия Мn2O3-Fe2O3 была
определена на воздухе. Фактически эта диаграмма до 1000 °С соответствует
равновесию в системе Мn2O3-Fe2O3, а выше
1000 °С в системе MnO-Fe2O3 [9].
Диссоциация Мn2O3 происходит
примерно при 900°С и с увеличением содержания Fe2O3 повышается
до 1000° С. Выше 1000°С появляется фаза
шпинели MnFe2O3, которая
устойчива до 1600°С. Из диаграммы состояния так же следует, что при обжиге
марганцевых ферритов температура спекания (1300- 1400 °С) совпадает с
температурой области устойчивости шпинели, однако при охлаждении в интервале
900-1000 °С происходит валентное превращение марганца, которое приводит к
распаду шпинели[9].
Предотвращение этого распада и
является основной задачей технологии марганцевых ферритов[9].
В области составов, соответствующих
стехиометрической шпинели (х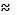
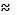 1), наблюдается аномальное изменение
хода зависимостей, что связывают с равновесием:
1), наблюдается аномальное изменение
хода зависимостей, что связывают с равновесием:
Mn2++Fe2+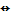
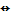 Mn3++Fe3+
Mn3++Fe3+
Получение
стехиометрической шпинели с 
 =0 даже при весьма малых
давлениях кислорода невозможно. Видно также, что величина
=0 даже при весьма малых
давлениях кислорода невозможно. Видно также, что величина 
 при х
при х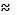
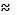 1 весьма существенно
зависит от изменения давления кислорода. Следовательно, для получения
качественных изделий необходима стабильность режима охлаждения марганцевых
ферритов. Полностью избежать перевода Мn2+
в Мn3+, очевидно, не удастся даже при полном отсутствии кислорода в
системе, так как возможно образование Мn3+
по схеме
1 весьма существенно
зависит от изменения давления кислорода. Следовательно, для получения
качественных изделий необходима стабильность режима охлаждения марганцевых
ферритов. Полностью избежать перевода Мn2+
в Мn3+, очевидно, не удастся даже при полном отсутствии кислорода в
системе, так как возможно образование Мn3+
по схеме
Mn2++Fe2+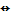
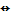 Mn3++Fe3+
Mn3++Fe3+
Третья двойная диаграмма
- МnО-ZnO ограничивающая
треугольник МnО-ZnO-Fe2O3,
не исследована, отсутствуют также данные о растворимости этих соединений друг в
друге. Учитывая, что МnО
имеет кубическую структуру типа NaCl,
a ZnO гексагональную, большой растворимости этих соединений друг в
друге вряд ли можно ожидать [9].
Поэтому трудно сказать, соответствует ли
представленный разрез составу при 1370 °С, или же в процессе охлаждения произошло
его изменение. На диаграмме можно выделить несколько полей сосуществования
равновесных фаз. Наиболее важна область I, где имеется одна фаза со структурой
шпинели. В этой области фактически лежат все составы промышленных ферритов [9].
Область II
соответствует двухфазному равновесию шпинели с Fe2O3,
область III - также двухфазному равновесию шпинели с ZnO.
О равновесии фаз в области IV нет сведений, однако, исходя из общих правил, в
данной области равновесия возможны три фазы: шпинель - ZnO-МnО
в области составов со структурой шпинели линии ОМ и О'М' фиксируют границы
тетрагонального искажения кубической решетки шпинели при введении избытка МnО
(ОМ-по данным рентгенографии, О'М' - по данным микроскопии) [7].
Тетрагональное искажение кубической решетки
шпинели с введением избытка МnО
указывает на появление в системе гаусманита Мn3O4,
т.е.
точки составов начинают выпадать из поля данной тройной диаграммы. Связано это,
как указывалось, с отсутствием контроля за давлением кислорода при построении
изотермического разреза. Твердые растворы шпинели с Fe2O3
в данном случае, как и в системе NiO-ZnO-Fe2O3,
являются метастабильными.
Для марганцевых ферритов диаграммы состав -
свойство, полученные различными авторами, имеют значительные расхождения
численных величин. Причины понятны из изложенного выше. Зависимость свойств
марганцевых ферритов от давления кислорода приводит к большому их разбросу, так
как стабильно выдержать этот параметр в технологии трудно.
Значения магнитной проницаемости,
значительно отличаются, а если учесть, что были получены ферриты с
проницаемостью 20000, то можно оценить роль технологических факторов в
получении марганцевых ферритов. Несмотря на различие в численных величинах,
максимум свойств наблюдается при х 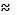
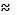 0,5.
0,5.
а) tg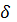
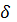 = f(х);
= f(х);
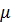
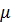 о = f(x); б) tспек = 13700С’
о = f(x); б) tспек = 13700С’
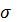
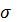 = f(x); a = f(x)
= f(x); a = f(x) 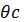
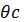 =f(x)
=f(x)
При спекании марганеццинковых ферритов не
следует забывать, что возможно испарение цинка, так как температура спекания
лежит в интервале 1300-1400 °С, а диссоциация ZnFe2O4
при этих температурах велика [7].
По виду диаграммы, состав - свойство можно
судить о влиянии неточностей при изготовлении шихты. Даже при значительных
отклонениях от стехиометрических составов образцы Mn1xZnxFe2O4
будут однофазными и со структурой шпинели [7].
Значения магнитной проницаемости для образцов
рассматриваемой системы (Зависимость некоторых свойств ферритов Mn1-xZnxFe2O4 от состава) значительно различаются
и весьма существенно зависят от режима охлаждения, вернее от характера газовой
среды при охлаждении.
Несмотря на то, что введение избыточных МnО
и ZnO не приводит к
образованию второй фазы, магнитная проницаемость уменьшается [7].
Очевидно, что растворение в шпинели МnО,
имеющей решетку типа NaCl,
приводит к напряжениям в решетке, а это и ведет к снижению начальной магнитной
проницаемости. Если считать, что фактически в твердый раствор вступает не МnО,
а гаусманит Мn3O4,
то все равно последний имеет тетрагональную решетку, которая также будет
вызывать напряжение в структуре шпинели [7].
Наличие тетрагонального искажения решетки
шпинели при большом избытке МnО
говорит о частичном окислении МnО
в Мn3О4,
который, по всей вероятности, и образует твердые растворы со шпинелью.
Из сказанного следует, что диаграмму
(Зависимость начальной магнитной проницаемости ферритов Mn1-xZnxFe2O4 от избытка оксилов) вряд ли можно
считать равновесной, хотя ценность ее для технологии несомненна.
Влияние избытка Fe2O3
на магнитную проницаемость марганеццинковых ферритов аналогично таковому в
системе NiO-ZnO-Fe2O3.
При небольшом избытке Fe2O3
магнитная проницаемость увеличивается, проходит через максимум и затем резко
падает. Обычно промышленные составы марганеццинковых ферритов имеют небольшой
избыток Fe2O3
(2-3 мол. %), что связано с указанным повышением магнитной проницаемости при
избытке Fe2O3.
Влияние избытков окислов MnO,
ZnO, Fe2O3
на другие свойства аналогично их влиянию на магнитную проницаемость. Например,
в случае удельной намагниченности насыщения (Зависимость некоторых свойств
ферритов системы MnO-ZnO-Fe2O3
от
избытка оксилов ), несмотря на
распад твердого раствора шпинели с Fe2O3
при содержании Fe2O3
более 50 мол. %, резкого уменьшения величины а до
значений, присущих исходным стехиометрическим ферритам, не наблюдается, как это
характерно для системы NiO-ZnO-Fe2O3[7].
Очевидно, в данном случае часть Fe2O3
при термической обработке переходит в Fe3O4
и при распаде метастабильных твердых растворов шпинели Fe2O3
магнетит, образующий стабильные твердые растворы с марганеццинковой шпинелью,
из раствора не выпадает. Таким образом, образующаяся при распаде твердого
раствора шпинель представляет собой не исходную марганеццинковую шпинель, а ее
раствор с Fe3O4,
что подтверждается также изменением параметра решетки. С увеличением избытка Fe2O3
в составах параметр решетки шпинели стремится к 8,39 А0 -величине
параметра решетки магнетита [7].
Некоторые свойства марганеццинковых ферритов
можно улучшить введением малых добавок, при этом, как правило, уменьшается
магнитная проницаемость.
Таким образом, ферриты системы MnO-ZnO-Fe2O3
обладают хорошими электромагнитными свойствами, однако получить стабильные
свойства в данной системе труднее, чем в системе NiO-ZnO-
Fe2O3.
Тем не менее, марганеццинковые ферриты производятся все в большем количестве.
6. Задача
Решение
PbO=232,2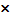
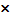 0,95=212,0400
0,95=212,0400
SrO=103,6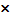
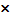 0,05=5,1810
0,05=5,1810
ZrO2=123,22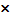
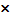 0,52=64,0744
0,52=64,0744
TiO2=79,90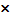
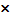 0,48=38,352
0,48=38,352
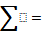
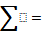 319,6474
319,6474
Nb2O5=319,6474
 0,02=6,3929
0,02=6,3929
PbO=326,0403
 0,018=5,8687
0,018=5,8687
 331,909
331,909
Процентный состав
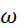
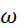 (PbO)
(PbO)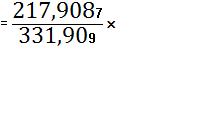
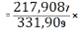 100%=65,6531%
100%=65,6531%
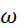
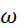 (SrO)
(SrO)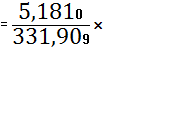
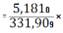 100%=1,5610%
100%=1,5610%
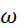
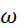 (ZrO2)
(ZrO2)
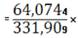 100%=19,3048%
100%=19,3048%
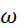
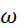 (TiO2)
(TiO2)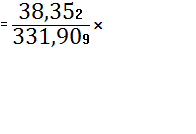
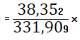 100%=11,5550%
100%=11,5550%
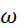
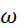 (Nb2O5)
(Nb2O5)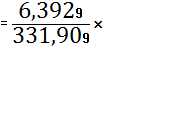
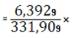 100%=1,9261%
100%=1,9261%
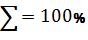
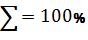
PbO - 65,6531%65,6531%- 1,5610%
1,5610%
ZrO2 - 19,3848% + 5%=24,3048%
TiO2 - 11,5550% 11,5550%2O5
- 1,9261%1,9261%
Расчет навесок с учетом погрешности
PbO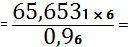
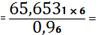 0,4103 (кг)
0,4103 (кг)
SrO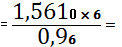
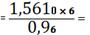 0,0098 (кг)
0,0098 (кг)
ZrO2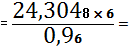
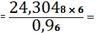 0,1519 (кг)
0,1519 (кг)
TiO2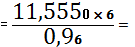
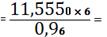 0,0722 (кг)
0,0722 (кг)
Nb2O5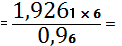
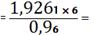 0,0058(кг)
0,0058(кг)
Корректировка состава
Пересчет компонентов по ZrO2.
(PbO) 65,6531 -
19,3048
X - 24,3048 X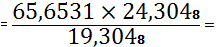
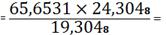 82,6574%
82,6574%
PbO необходимо
добавить 82,6574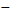
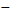 65,6531=17,0043%
65,6531=17,0043%
(SrO) 1,5610 -
19,3048
X - 24,3048 X
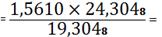 1,9653%
1,9653%
SrO необходимо
добавить 1,9653 - 1,5610=0,4043%
(TiO2) 11,5550 -
19,3048
X - 24,3048 X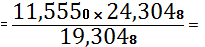
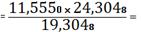 14,5478%
14,5478%
TiO2 необходимо
добавить 14,5478 - 11,5550=2,9928%
(Nb2O5) 1,9261 -
19,3048
X - 24,3048 X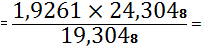
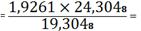 2,4250%
2,4250%
Nb2O5 необходимо
добавить 2,4250 - 1,9261=0,4989%
В усреднитель необходимо добавить
следующее количество компонентов для корректировки:
PbO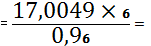
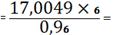 0,1188 (кг)
0,1188 (кг)
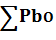 =0,4103+0,1188=0,5291 (кг)
=0,4103+0,1188=0,5291 (кг)
SrO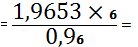
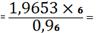 0,0123 (кг)
0,0123 (кг)

 =0,0098+0,0123=0,0221 (кг)
=0,0098+0,0123=0,0221 (кг)
TiO2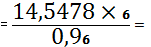
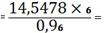 0,0909 (кг)
0,0909 (кг)

 2=0,0722+0,0909=0,1631
(кг)
2=0,0722+0,0909=0,1631
(кг)
Nb2O5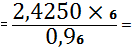
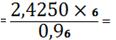 0,0152 (кг)
0,0152 (кг)
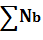 2O5=0,0058+0,0152=0,021
(кг)
2O5=0,0058+0,0152=0,021
(кг)
Таким образом, в усреднителе:
PbO =0,5291
(кг)
SrO =0,0221
(кг)
ZrO2=0,1519 (кг)
TiO2=0,1631 (кг)
Nb2O5=0,021 (кг)
монокристалл плавка феррит
нестехиометрия
Выводы
По данной работе можно сделать следующие выводы:
. Основными способами выращивания
монокристаллов являются: выращивание монокристаллов из раствора в расплаве;
метод Вернейля, метод Чохральского; метод Бриджмена; метод зонной плавки;
гидротермальное выращивание; выращивание из паровой фазы. Различия между
методами в технологических установках, схемы которых приведены в работе.
. Описаны процессы кристаллизации и
рекристаллизации. Кристаллизация подразделяется на изотермическу,
изогидрическую, кристаллизацию высаливанием и кристаллизацию в ходе химической
реакции. Процесс рекристаллизации проходит в две стадии: первичная
рекристаллизация, а затем собирательная рекристаллизация.
. Рассмотрен метод совместного
осаждения, сущность которого заключается во взаимодействии щелочных агентов с
водными растворами солей, содержащих катионы разных металлов в том соотношении,
которое необходимо получить в готовом материале. Преимуществами метода
являются: возможность получения смеси исходных компонентов на молекулярном
уровне, снижение температуры синтеза порошков и спекание керамики при
температуре 50-100 оC
за счет высокой дисперсности порошков, выигрыш в электрофизических свойствах
при получении простых составов. Недостатками метода являются: громоздкость
технологических схем, трудность перехода от одного к другому, отсутствие
возможности получения многокомпонентных составов из-за различных условий
осаждения входящих элементов.
. Рассмотрены ферриты, как фазы
переменного состава, что связано с различными видами их нестехиометрии и
дефектности. Приведены структуры ферритов (структура граната, структура
шпинели, структура магнеплюмбита), а также описаны их особенности.
5. Подробно описаны 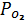
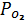 -Т фазовые диаграммы Mn-Zn-ферритов и
рассмотрены правила их построения, структура и правила пользования ими.
-Т фазовые диаграммы Mn-Zn-ферритов и
рассмотрены правила их построения, структура и правила пользования ими.
. Решена задача по расчету
исходной смеси и корректировку ее состава по методу растворной химии.
Список источников
1. Нашельский, А.Я.
Производство полупроводниковых материалов/ А.Я. Нашельский. - М.: Металлургия,
1989. - 272с.
. Арзамасов, Б.Н.
Материаловедение/ Б.Н. Арзамасов. - М.: Машиностроение, 1986. - 384с.
. Нагаенко, А.В. Изучение
методов получения нанопорошков системы ЦТС/ А.В. Нагаенко. - Ростов-н/Д.: ЮФУ,
2009. - 40с.
. Журавлев, Г.И. Химия и
технология ферритов/ Г.И. Журавлев. - Л.: Химия, 1970. - 192с.
. Смит,
Я.
Ферриты/
Я.Смит.
-
М.: Philips
Technical Library, 1959. -
504с.
6. Прилипко, Ю.С.
Функциональная керамика. Оптимизация технологии/ Ю.С. Прилипко. - Донецк: Норд
Пресс, 2009. - 368с.
. Матусевич, Л.Н.
Закономерности кристаллизации из растворов/ Л.Н. Матусевич. - М.: Химия,
1986.-304с.
. Левин, Б.Е. Физико-химические
основы получения, свойства и применение ферритов/ Б.Е. Левин. - М.:
Металлургия, 1979.-471с.
. Шольц, Н.Н. Ферриты для
радиочастот/ Н.Н. Шольц. - М.Л.: Энергия, 1966,-258с.
. Окадзаки, К.Т. Технология
керамических диэлектриков/ К.Т. Окадзаки. - М.: Энергия, 1976.-336с.
. Третьяков, Ю.Д. Точечные
дефекты и свойства неорганических материалов/ Ю.Д. Третьяков. - М.:Знание,
1974.-64с.
. Епифанов, Г.И. Физика
твердого тела/ Г.И. Епифанов/ Г.И. Епифанов. - М.: Высшая школа, 1978.-200с.