|
IIIБ
|
IVБ
|
VБ
|
VIБ
|
VIIБ
|
VIIIБ
|
|
Sc2C3
|
TiC
|
V2C
|
Cr7C3
|
Мn3С
|
Fe3C; Co3C
|
|
ScC2
|
|
VC
|
Сr3С2
|
Мn3С2
Мn7С3
|
Ni3С; Со2С
|
|
Y2C Y2C3
YC2
|
ZrC
|
Nb2C NbC
|
Мо2С
Мо3С2
|
TеС
|
-
|
|
LaC2
|
HfC
|
Та2С
ТаС
|
W2C
W2C3
WC
|
Rec
|
-
|
1.8 Гидриды d-элементов
Соединения d-металлов
с водородом резко отличаются от водородных соединений s-
и р-элементов. Водородные соединения большинства s-элементов
(т.е. щелочных и щелочноземельных металлов) образуют солеобразные гидриды типа NaH
или CaH2.
Это соединения определенного состава, имеющие структуры, характерные для ионных
соединений. При электролизе таких гидридов водород выделяется на аноде, что
свидетельствует о наличии в этих соединениях иона Н-.
С водородом d-металлы
образуют необычные соединения, которые называются фазами внедрения. Если приближенно
рассматривать атомы как шары, то кристаллическую решетку можно представить себе
как результат правильной укладки шаров. При самой плотной упаковке между шарами
всегда будут иметь место пустоты. Например, при гексагональной и кубической
плотной упаковке между атомами возникают октаэдрические и тетраэдрические
пустоты (рис. 1). Фазы внедрения получаются за счет заполнения октаэдрических
или тетраэдрических пустот небольшими по размерам атомами неметаллов: водорода
(ra=0,46 А), углерода
(rа = 0,77 А), азота (rа
= 0,71 ),
бора (rа
= 0,57
),
бора (rа
= 0,57 ).
).
Рис. 3. Пуcтоты
в кубической плотной упаковке: а) тетраэдрические; б) октаэдрические
Однако не следует рассматривать фазы внедрения
как результат чисто механического заполнения пустот меньшими по размеру
атомами. Пустоты, достаточные для внедрения в них атомов водорода, имеются в
структуре любого металла, но далеко не во всех случаях это внедрение
действительно происходит.
Взаимодействие d-металлов
с водородом часто сопровождается довольно большими энергетическими эффектами,
что свидетельствует о наличии химического взаимодействия между металлом и
водородом (так ведут себя титан, цирконий, иттрий, гафний, ниобий, тантал).
Поглощение водорода d-металлами
протекает сложным образом. Фазы внедрения, образующиеся при поглощении водорода
d-металлами, имеют
переменный состав. Предельное содержание в них водорода зависит от температуры
и давления. Например, в системе титан - водород можно непрерывно увеличивать
содержание водорода до 18 %. Очень чистый металлический титан не поглощает
водород до 300 - 400 °С, но если нагреть его до 900 °С, а затем охладить в
атмосфере водорода до 300 - 400 °С, то такой активированный титан будет
поглощать большое количество водорода - вплоть до состава TiH2.
Необыкновенно большой активностью по отношению к
водороду отличается палладий, один объем которого способен при обычной
температуре поглотить более 700 объемов водорода. Кристаллическая решетка
металла при этом заметно деформируется, становится хрупкой, и его поверхность
покрывается трещинками.
Поглощая водород, металл сохраняет свою
кристаллическую структуру, хотя и несколько изменяет параметры решетки. Такие
гидриды называются металлообразными или металическими, они обладают
электропроводностью, металлическим блеском и другими характерными признаками
металлических веществ.
Вопрос о природе связи в соединениях d-металлов
с водородом сложен и пока еще до конца не выяснен. Некоторые переходные металлы
практически не поглощают водород. Их гидриды могут быть получены лишь косвенным
путем, например, при взаимодействии галогенида металла с алюмогидридом лития в
растворе эфира с последующей термической диссоциацией Me[AℓH4]2:
MeCℓ2 + 2Li[AℓH4]
= Me[AℓH4]2 + 2LiCℓ;
Me[AℓH4]2
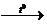 MeH2
+ 2Aℓ+ 3H2.
MeH2
+ 2Aℓ+ 3H2.
В настоящее время таким путем получены гидриды
почти всех переходных металлов, при этом состав их близок к стехиометрическому.
Гидриды эти неустойчивы и при небольшом повышении температуры разлагаются на
металл и водород. Таковы гидриды NiH2,
FeH2,
CrH3,
ZnH2,
CdH2.
2. Элементы IБ группы (подгруппа меди)
.1 Общая характеристика элементов IБ группы
К подгруппе меди относятся три элемента - Cu,
Ag, Au.
Подобно атомам щелочных металлов, атомы этих элементов содержат на высшей
электронной оболочке по одному электрону. Теоретически в атомах элементов
подгруппы меди в (n-1)d
- состоянии должны находится девять электронов. Однако вследствие устойчивости d10
-конфигурации
энергетически оказывается более выгодным переход одного из ns
электронов в (n-1)d
- состояние. Поэтому Cu,
Ag, Au
в s-состоянии внешнего
слоя имеют по одному электрону, а в (n-1)d
подуровне 10 электронов. Структура (n-1)d10ns1
более устойчива, чем структура (n-1)d9ns2.
Некоторые физические константы элементов
подгруппы меди приведены в таблице. У элементов подгруппы меди радиусы атомов
меньше радиусов атомов элементов главной подгруппы. Первая энергия ионизации
элементов подгруппы меди существенно выше, чем у их аналогов. Это приводит к
большим различиям в химических свойствах металлов обоих групп. Если элементы
подгруппы лития очень активные металлы, то элементы подгруппы меди -
малоактивные металлы. Они с трудом окисляются (слабые восстановители), однако
их ионы легко восстанавливаются, их гидроксиды являются слабыми основаниями. В
то же время 18-электроный слой, устойчивый у других элементов (подгруппа
цинка), здесь ещё не вполне стабилизировался и способен к частичной потере
электронов, поэтому элементы подгруппы меди, проявляют не только степень
окисления +1, но и +2, и +3.
Особая устойчивость степени окисления +1 у
серебра объясняется прочностью конфигурации 4d10,
которая образуется уже у палладия, предшествующего серебру в периодической
системе.
Медь, серебро, золото имеют большую плотность,
высокие температуры плавления и кипения.
Все элементы подгруппы меди могут образовывать
как катионные, так и анионные комплексы. По мере повышения степени окисления
тенденция к образованию анионных комплексов возрастает. Все растворимые
соединения меди, серебра, золота - ядовиты. По степени токсичности действия на
окружающую среду, медь относят ко второму классу тяжелых металлов.
Природные ресурсы. Содержание меди в земной коре
0,01%.Однако, она чаще, чем другие металлы встречается в самородном состоянии.
Иногда эти самородки достигают значительной величины.
Важнейшие минералы меди - халькопирит или медный
колчедан CuFeS2,
медный блеск - Cu2S,
куприт - Cu2О,
малахит - (CuОН)2,СО3.
В настоящее время медь добывают из руд, которые
подразделяются на сульфидные и оксидные; 80% меди выплавляют из сульфидных руд.
Содержание серебра в земной коре составляет 10-5%.
Являясь малоактивным металлом, серебро встречается в самородном состоянии.
Большую часть серебра получают из его соединений. Это Ag2S
- серебряный блеск или аргентит.
В качестве примесей серебро присутствует во всех
медных и свинцовых рудах.
Золото встречается в природе исключительно в
самородном состоянии: в вид мелких зерен, вкрапленных в кварц или содержащихся
в кварцевом песке. В небольших количествах золото встречается в сульфидных
рудах меди, железа, свинца. Содержание золота составляет 5∙10-7%
(масс).
Золото отделяется от песка и измельченной
кварцевой породы промыванием водой, которая уносит частицы песка как более
легкие или обработкой песка жидкостями, растворяющими золото. Лучшим методом
отделения золота от пустой породы является цианидный метод, по которому золото
растворяется в растворе NaCN
в присутствии кислорода, образуя комплексный анион [Au(CN)2]−:
Au + O2 + 8NaCN + 2H2O
= 4Na[Au(CN)2] + 4NaOH.
Из полученного раствора золото вытесняют цинком:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4]
+2Au.
Подобным образом получают серебро из аргентита:
Ag2S + 4NaCN = 2Na[Ag(CN)2]
+ Na2S.
Этот метод был разработан в 1843 г. П.Р.
Багратионом; в настоящее время наиболее распространен в металлургии золота.
Свойства. Медь, серебро, золото - мягкие,
блестящие металлы, имеют окраску: медь - красноватую, серебро -
серебристо-белую, золото - желтую. Все эти металлы могу быть получены в виде
тончайшей проволоки или фольги. Из 1 г. золота можно вытянуть проволоку
длиной3,5 км. Обладают высокой электро- и теплопроводностью; серебро самый
электропроводящий из металлов.
Золото является главным валютным металлом
большинства стран. Ввиду мягкости золото употребляется в сплавах с медью,
платиной. Ювелирные изделия изготовляют из сплава золота с медью, содержащего
чаще всего 58,3% золота (583 проба). Этот сплав менее ковок и более тверд.
Соляная и разбавленная серная кислота не
действуют на эти металлы, однако медь в присутствии кислорода воздуха может
растворятся в соляной кислоте с образованием соответствующих солей:
2Cu +4HCl + O2 = 2H[CuCl2]
+2H2O
В очень концентрированной соляной кислоте медь
может быть растворена с образованием комплексного соединения:
2Cu
+ 4НCl = 2H[CuCl2]
+ H2
дихлорокупрат
(I) водорода
За счет образования малодиссоциированного
комплексного иона электродный потенциал системы:
Cu + 2Cl−
− e = [CuCl2]−
сдвигается в область отрицательных значений, в
результате чего оказывается возможным окисление меди ионом водорода.
Медь и серебро растворяются в концентрированных
серной и азотной кислотах:
Сu + 2Н2SO4
= CuSO4 +SO2↑ + 2H2O
конц
Сu + 4НNO3
= Cu(NO3)2 +2NO + 2H2O
разб+ 2НNO3
= AgNO3 +NO2 + H2O
конц
Золото - один из наиболее малоактивных металлов,
в электрохимическом ряду напряжений металлов оно занимает последнее место.
Золото растворяется в «царской водке», а также при нагревании в 98% растворе
селеновой кислоты Н2SeO4:
Au + НNO3
+ 4HCl = H[AuCl4]
+NO + H2O
Для элементов подгруппы IБ,
как и для других побочных подгрупп наблюдается стабилизация высших степеней
окисления с увеличением их порядкового номера. Ионы Au+
в водных растворах диспропорционируют на Au0
и Au+3;
в водной среде Au+
существует только в виде прочных комплексов, например [Au(CN)2]‒.
Соли меди, серебра и золота взаимодействуют с
сульфидами щелочных металлов и с H2S
с образованием нерастворимых осадков - Сu2S,
Ag2S,
CuS, Au2S3.
Соединения элементов подгруппы IБ
значительно различаются, поэтому рассмотрим их отдельно для каждого элемента.
.2. Медь
С кислородом медь образует два оксида СuО
(черный), Сu2О (красный). СuО - оксид меди (II)
получается при нагревании меди до 400-500оС в присутствии кислорода,
при температуре выше 1100о Сu2О и О2:
CuO
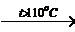 2Cu2O
+ O2
2Cu2O
+ O2
Оксид меди (II)
получают термическим разложением основного карбоната меди:
(CuOН)2СО3
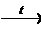 2Cu2O
+ Н2О+ СO2
2Cu2O
+ Н2О+ СO2
Оксид меди (II)
легко восстанавливается водородом:
CuO + Н2
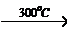 Cu
+ Н2O
Cu
+ Н2O
При действии на Cu2O
соляной кислотой получается бесцветный раствор хлорида меди (I)
CuCl; при разбавлении
водой выпадает белый творожистый осадок не растворимый в воде.
Хлорид меди (I)
может быть получен восстановлением хлорида меди (II)
в солянокислой среде.
Для соединений меди характерно
диспропорционирование :
Cu+
= Cu2+
+ Cu
CuCl(к) = CuCl2(p)
+ Cu(к)
Оксид меди (II)
получают также прокаливанием нитрата меди (II):
Cu(NO3)2
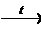 2
CuO + 2NO2+
O2
2
CuO + 2NO2+
O2
Гидроксид меди (II)
Cu(OН)2
- очень слабое амфотерное основание, которое уже при слабом нагревании
разлагается:
Cu(OН)2
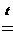 CuO
+ Н2О
CuO
+ Н2О
Оба оксида Cu2O
и CuO не взаимодействуют
с водой. С кислотами реагируют с образованием солей Cu+
и Cu2+.
Легко растворяются в водном растворе аммиака с образованием комплексных
соединений:
Сu2О
+ 4NН3 + + H2O
→
2[Сu(NН3)2]OH
(бесцветный);
СuО
+ 4NН3 + H2O
→
2[Сu(NН3)4](OH)2
(темносиний).
При сплавлении СuО
со щелочами образуются темно-синие купраты (II):
СuО
+ NаО = Nа2СuO2
купрат
натрия
Растворы солей меди (II)
в большинстве своем имеют кислую реакцию, а со слабыми кислотами образуют
основные соли. Для меди (II)
характерны как катионные, так и анионные комплексы. При растворении солей меди
(II) в воде или при
взаимодействии СuО (черного
цвета) и Сu(OH)2
(голубого цвета) с кислотами, образуются голубые аквакомплексы [Сu(ОН2)6]2+,
такую же окраску имеют большинство кристаллогидратов, например Сu(NО3)2∙6Н2О
Аминокомплексы образуются при действии аммиака
на раствор солей меди (II):
Сu(ОН)
2 + 4NН3 +2 Н2О
= [Сu(NН3)4(ОН2)2](ОН)2
Анионные комплексные ионы образуются при
взаимодействии гидроксида меди (II)
концентрированными растворами щелочей:
Сu(ОН)
2 + 2NаОН = Nа2[Сu(ОН)4]
яркосиний
Сu(ОН)
2 + 2ОН‒ =
[Сu(ОН)4]2‒,
что свидетельствует о слабых кислотных свойствах
Сu(ОН) 2.
Нерастворимы сульфид CuS, карбонат (основной
карбонат) оксалат CuС2О4 и фосфат Cu3(РО4)2.
Основной карбонат меди (зеленовато-голубой
осадок) образуется при действии соды на сульфат меди (II):
2CuSО4
+ 2Na2CO3 + H2O → (CuOH)2CO3
+ 2Na2SO4 + CO2
Под действием восстановителей соли меди (II)
могут восстанавливаться до солей меди (I):
CuSO4 + 4KI = 2СuI↓
+ I2 + 2K2SO4
I‒
‒
2e → I2 │1+2
+ e →
Cu+
│2
Растворы солей меди (II)
имеют в большинстве случаев кислую реакцию среды, так как в результате
гидролиза образуются основные соли и кислота:
Cu2+
+
HOH = CuOH+
+ H+
(рН<7)
Качественная реакция на ион меди (II):
CuSO4
+ K4[Fe(CN)6]
= Cu2[Fe(CN)6]
+ K2SO4
осадок
кирпично-красного цвета
.3 Серебро
Кислород не окисляет серебро даже при
нагревании. С халькогенами, пниктогенами, углеродом серебро взаимодействует при
повышенных температурах. Серебряные предметы чернеют под воздействием
находящегося в воздухе сероводорода; на поверхности образуется черный налет
сульфида серебра:
Ag + 2H2S
+ O2
= 2Ag2S
+ 2H2O
При действии щелочи на раствор соли серебра,
образуется не гидроксид AgOH, а оксид Ag2O,
так как AgOH распадается
на оксид серебра и воду:
2 AgNO3
+ 2NaOH = Ag2O↓
+ 2NaNO3
+ H2O
Ag2O
мало растворим в воде, однако придает ей щелочную реакцию; AgOH
является сильным основанием. Последнее подтверждается тем, что соли серебра не
гидролизуются.
Серебро обладает большой склонностью к
комплексообразованию. Если к раствору нитрата серебра прибавить избыток цианида
калия, то образуется комплексная соль:
AgNO3
+ KCN = AgCN↓
+ KNO3;
AgСN
+ KCN = K[Ag(CN)2]
Многие труднорасворимые соединения серебра легко
растворяются в водном растворе аммиака, образуя комплексные соединения:
AgCl+ 2NH3 = [Ag(NH3)2]Cl;
Ag2О+
4NH3
+ Н2О = 2[Ag(NH3)2](ОН)2.
Бромид серебра легко растворяется в тиосульфате
натрия:
AgBr+ 2Nа2S2O3
= Na3[Ag(S2O3)2] + NaBr
Эта реакция имеет место при закреплении
фотоматериалов гипосульфитом.
.4 Золото
Для золота характерны два оксида Au2O
и Au2O3;
Au2O
- основной оксид; Au2O3
- амфотерный с преобладанием кислотных свойств. Для соединений золота (I)
характерно диспропорционирование :
3AuCl
+KCl = K[AuCl4
+ 2Au
Au+
= Au3+
+ 2Au
Из бинарных соединений золота (III)
известны: Au2O3,
AuF3,
AuCl, AuBr3,
Au(OH)3.
В воде растворимы лишь AuCl3
и AuBr3,
состоящие из димерных плоских молекул. Au(OH)3
легко растворяется в щелочах, образуя гидроксоаураты (III):
NaOH + Au(OH)3
= Na[Au(OH)4]
Растворение в кислотах Au(OH)3
происходит за счет образования анионных комплексов:
Au(OH)3. + 4НNO3
= H[Au(NO3)4] +3H2О
Нитрато- и цианоаураты (III)
водорода выделены в свободном состоянии. Кислотный характер галогенидов Au(III)
проявляется в их исключительной склонности давать галогеноаураты (III):K[АuCl4],
К[AuBr4]
и т.д.
Особая склонность Au(III)
к образованию анионных кмплексов проявляется при гидролизе его тригалогенидов.
AuCl3
+
HOHDH[AuOHCl3]
Ионы золота обладают большой окислительной
способностью и сами при этом восстанавливаются до металла:
H[AuCl4]
+3FeSO4
→Au↓ + Fe2(SO4)3
+ FeCl3
+HCl
Все соединения золота легко разлагаются при
нагревании с выделением металлического золота.
Применение элементов подгруппы меди. Медь широко
применяется в народном хозяйстве. Особенно много идет её для изготовления
проводов. В больших количествах медь идет на производство сплавов: бронзы
(сплав меди с оловом), латуни (сплав меди с цинком), мельхиора (сплав меди с
никелем) и др.Сплавы меди применяют для изготовления различной аппаратуры,
деталей машин и инструментов, а также художественно-промышленных изделий.
Медный купорос CuSO4∙5H2O
применяют как протраву при побелке. Соединения меди используются для борьбы с
вредителями сельскохозяйственных культур.
Серебро применяется в радиоэлектронике. На
основе серебра и золота изготовляют проводники и низкоомные резисторы с высокой
стабильностью характеристик. Серебро и золото используют для получения защитных
покрытий на выводах и корпусах микросхем. Серебро идет на изготовление
фотобумаги и фотопленки, эмульсионный слой которых содержит бромид серебра.
В реактивной и космической технике применяют
серебряно-цинковые аккумуляторы, отличающиеся большой энергоемкостью и
мощностью. Значительное количество серебра идет на изготовление предметов
домашнего обихода и украшений.
Золото является эквивалентом денег, и большая
часть его сосредоточена в хранилищах банков. Это ограничивает его
использование. Ввиду мягкости золото употребляется в сплавах с серебром или
медью. Эти сплавы применяются для электрических контактов. Для
зубопротезирования, в ювелирном деле.
2.5 Биологическая роль элементов IБ
группы
Медь - необходимый микроэлемент живых
организмов. Серебро и золото примесные микроэлементы. Их соединения применяют в
медицине.
Медь - биогенный элемент, содержащийся в тканях
животных и растений. Общая масса меди в организме взрослого человека примерно
100 мг. Примерно 30% этого количества содержится в мышцах. Печень и мозг тоже
богаты медью. Соединения меди токсичны. Наиболее важными, с физиологической
точки зрения, являются белки - цитохромоксидаза и супероксиддисмутаза.
Цитохромоксидаза состоит из семи белковых
субъединиц и четырех связанных с ними активных центров: двух молекул гема,
связывающих ионы железа, и двух ионов меди, непосредственно связанных с
белковыми субъединицами. Такая структура цитохромоксидазы обеспечивает передачу
четырех электронов из дыхательной цепи и осуществление реакции:
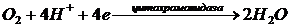
При неполном восстановлении кислорода в
дыхательной цепи образуется супероксид анион радикал:
О2 + ē →
О2−
Супероксид-анион обладает еще более высокой
окислительной способностью, чем пероксид водорода. Взаимодействие радикала О2−
с органическими соединениями клетки приводит к нарушению нормального
развития клетки. Повреждающее действие супероксид-аниона предотвращается
медь-содержащим ферментом супероксиддисмутазой (СОД), которая катализирует реакцию
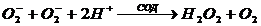
Образующийся при этом пероксид водорода
разлагается каталазой. Ежедневно организму требуется 2,5-5 мг. меди. При
недостатке меди может развиться - медьдефицитная анемия. При дефиците меди
нарушается нормальное развитие соединительных тканей и кровеносных сосудов.
Высокое сродство металлов IБ
группы к сере определяет большую энергию связи М-S, а это в свою очередь
обуславливает определенный характер их поведения в биологических объектах.
Например, ионы Ag+
и Cu+2 реагируют с дитиловыми ферментами микроорганизмов по схеме:
Рис.2.1
Токсическое действие соединенй меди обусловлено
тем, что, что ионы меди взаимодействуют с тиольными -SH-группами
(связывание) и аминогруппами- NH2
(блокирование белков). При этом могут образовываться биокластеры хелатного
типа:
Рис. 2.2
3. Элементы IIБ
группа (подгруппа цинка)
.1 Общая характеристика элементов II Б группы
Элементы этой подгруппы - цинк, кадмий, ртуть -
полные электронные аналоги друг друга, каждый в своем периоде является
последним элементом d-семейства,
у них завершена d-электронная
конфигурация, валентные электроны (n-1)d10ns2.
На внешней электронной облочке цинк, кадмий, ртуть, содержат два электрона и
восемнадцать электронов на предыдущей электронной оболочке. Цинк и его аналоги
отличаются от d-элементов и в
большей степени проявляют сходство с р-элементами больших периодов.
У атомов цинка, кадмия и ртути, как и у атомов
подгруппы меди (n-1)d
подуровень целиком заполнен и вполне стабилен. Удаление с него электронов
требует очень большой затраты энергии. Поэтому рассматриваемые элементы
проявляют в своих соединениях максимальную степень окисления +2. Только ртуть
образует соединения, в которых её степень окисления равна +1.
Характерной особенностью элементов подгруппы
цинка, сближающей их с элементами подгруппы меди, является их склонность к
комплексообразованию.
В отличие от элементов главных подгрупп элементы
подгруппы цинка труднее окисляются, проявляют меньшую реакционную способность и
обнаруживают более слабые металлические свойства. Свойства цинка, кадмия и
ртути приведены в табл. 3.1
Природные ресурсы. Важнейшие минералы цинка,
кадмия и ртути: ZnS
- цинковая обманка, HgS
- киноварь, ZnCO3
-
галмей, CdS - гринокит.
Природные соединения цинка входят в состав полиметаллических сульфидных руд,
которые содержат пирит FeS2,
галенит PbS,
халькопирит CuFeS2
и в меньшем количестве ZnS.
Ртуть является редким элементом и встречается в самородном состоянии.
Получение. Для выделения цинка полученный после
обогащения концентрат ZnS,
подвергается обжигу, а образовавшийся оксид ZnO
восстанавливается углем:
2ZnS + 3O2 → 2ZnO +
2SO2;О + C → Zn + CO.
Таблица 3.1 Свойства элементов подгруппы цинка
|
Свойства
элементов
|
Zn
|
Cd
|
Hg
|
|
Распространенность
в земной коре, масс. доля %
|
8,3∙1
0-3
|
1,3
∙10-5
|
7∙10-6
|
|
Атомный
радиус, нм
|
0,127
|
0,154
|
0,157
|
|
Условный
радиус иона Ме2+, нм
|
0,083
|
0,103
|
0,110
|
|
Тпл,
С°
|
419,4
|
321,3
|
-33,87
|
|
Ткип,
С°
|
906,4
|
766,6
|
356,8
|
|
Энергия
ионизации I→I-,
эВ
|
9, 39
|
8,99
|
10,43
|
|
E° Мe2+
/ Me,
B
|
-
0, 76
|
-
0, 402
|
0, 854
|
|
Плотность,
г/см 3
|
7,14
|
8,65
|
13,55(ж)
|
|
ОЭО
|
1,5
|
1,7
|
1,8
|
|
Степень
окисления
|
+2
|
+2
|
+
1,+2
|
Другой способ заключается в том, что руду,
содержащую ZnS, обжигают,
а затем обрабатывают в разбавленной H2SO4:
ZnO + H2SO4
→
ZnSO4 +
H2O.
Полученный раствор сернокислого цинка подвергают
электролизу.
Кадмий, сопутствующий цинку, извлекают из
образующихся при гидрометаллургическом производстве растворов азотной кислоты.
Ртуть получают обжигом киновари:
HgS + O2
→ Hg + SO2↑.
От большинства примесей ртуть очищают промывкой
20 %-ным раствором HNO3.
Ртуть и ее соединения очень ядовиты. При
действии малых концентраций ртути, она накапливается в организме, и тяжелые
последствия этого могут проявиться не сразу. Давление насыщенных паров ртути
при комнатной температуре составляет приблизительно 0,1 Па, поэтому возможно
отравление парами ртути.
Свойства. Цинк и кадмий - серебристо-белые
мягкие металлы, а ртуть - единственный металл находящийся при комнатной
температуре в жидком состоянии.
По химической активности подгруппа цинка
уступает щелочно-земельным металлам. В подгруппе цинка с ростом атомной массы
химическая активность металлов падает, о чем свидетельствуют значения
стандартных потенциалов (см. табл.26). Цинк - химически активный металл, легко
растворяется в кислотах и при нагревании в щелочах:
Zn + HCℓ= ZnSO4 + H2;
Zn + H2SO4 = ZnSO4 + H2.
разб
Эти реакции идут медленно, так как образующийся
атомарный водород покрывает поверхность цинка.
Zn + H2SO4 =
ZnSO4 + SO2 + H2O;
конц.
Zn + 10HNO3 = 4Zn(NO3)2
+NH4NO3 +3H2O;
разб.+ 2NaOH +
2H2O = Na2[Zn(OH)4] + H2↑.
Ртуть окисляется только в кислотах-окислителях,
если кислота в избытке, то образуются соли Hg2+,
а при недостатке - соли Hg22+:
3Hg + 8HNO3 → 3Hg
(NO3)2 +2NO + 4H2O;
конц.
Hg + 8HNO3 → 3Hg2(NO3)2
+ 2NO + 4H2O.
разб.
Металлический Zn
вытесняет менее активные металлы и восстанавливает H2CrO4,
HMnO4
соли железа (III) и олова (IV):
5Zn + 2KMnO4 +8H2SO4
= 2MnSO4 +5ZnSO4 + K2SO4 + 8H2O;
разб.
+ CuSO4 = ZnSO4 + Cu.
3.2 Свойства цинка и кадмия
Оксиды и гидроксиды щелочноземельных металлов
проявляют основные свойства, а оксиды и гидроксиды элементов подгруппы цинка
обладают амфотерными или очень слабо выраженными основными свойствами. Свойства
кислородных соединений элементов подгруппы цинка приведены в табл. 3.2.
На воздухе цинк и кадмий теряют свой блеск, так
как покрываются оксидной пленкой. Оксиды Zn,
Cd образуются при
взаимодействии металлов с кислородом, а также при нагревании и прокаливании их
гидроксидов.
ZnCO3
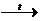 Zn
O + CO2;
оксид цинка - рыхлый белый порошок, желтеющий при нагревании, но при охлаждении
сново становящийся белым. При сильном накаливании кадмий сгорает, и
превращается в бурый оксид кадмия. С другой стороны оксид кадмия получают
разложением нитрата кадмия:
Zn
O + CO2;
оксид цинка - рыхлый белый порошок, желтеющий при нагревании, но при охлаждении
сново становящийся белым. При сильном накаливании кадмий сгорает, и
превращается в бурый оксид кадмия. С другой стороны оксид кадмия получают
разложением нитрата кадмия:
Сd(NO3)2
= 2CdO + 4NO2
+ O2;
оксид кадмия - порошок бурого цвета.
Таблица 3.2 Кислородсодержащие соединения
элементов подгруппы IIБ
|
Элемент
|
Степень
окисления
|
Оксиды
|
Гидроксиды
|
Соли
|
|
|
Формула
|
Характер
|
Формула
|
Название
|
Формула
|
Название
|
|
Zn
|
+2
|
ZnO, белый
|
Амфотерный
|
Zn(OH)2
|
Гидроксид
Zn (II)
|
Zn+2
|
Соли
цинка (II)
|
|
|
|
|
H2ZnO2
|
Цинковая
кислота
|
ZnO22-
|
Цинкаты
|
|
|
|
|
H2[Zn(OH)4]
|
Тетрагидроксоцинкат
водорода
|
[Zn(OH)4]2-
|
Тетрагидроксоцинкаты
|
|
Cd
|
+2
|
CdO, корич.
|
Слабый
амфотерный
|
Cd(OH)2
|
Гидроксид
кадмия
|
Cd 2+
|
Соли
кадмия (II)
|
|
Hg
|
+1
|
Hg2О, черный
|
Основной
|
Нет
|
нет
|
Hg22+
|
Соли
ртути (I)
|
|
+2
|
HgO, желтый
|
Основной
|
|
|
Hg2+
|
Соли
ртути (II)
|
Гидроксид цинка Zn(OH)2
выпадает в виде белого осадка при действии щелочей на растворы солей цинка:
ZnSO4
+ 2NaOH = Zn(OH)2
+Na2SO4
Осадок легко растворяется в кислотах с
образованием солей цинка и в избытке щелочей с образованием цинкатов. Таким
образом, гидроксид цинка - амфотерное соединение. С NaOH
протекают реакции:
Zn(OH)2
+ 2NaOH = Na2ZnO2
+ 2H2O
-в расплавах;
Zn(OH)2
+ 2NaOH = Na2[Zn(OH)4]
- в водных растворах.
В твердом состоянии выделены гидроксоцинкаты,
отвечающие формулам: Na[Zn(OH)3],
Na2[Zn(OH)4],
Ba2[Zn(OH)6].
Растворение металлического цинка в щелочах тоже сопровождается образованием
гидроксоцинкатов, например:
Zn+ 2NaOH
+ 2H2O
= Na2[Zn(OH)4]
+ Н2↑.
Гидроксид цинка растворяется также в водном
растворе аммиака. При этом образуются комплексные ионы:
Zn(OH)2 + 4NH3
= [Zn(NH3)4] 2+ + 2OH‒.
Zn(OH)2
- слабый электролит. Все соли цинка подвергаются гидролизу в водной среде.
При нагревании металлический цинк и кадмий
взаимодействуют с неметаллами S,
Se, F,
P, As,
образуя соответствующие соединения.
Кадмий - очень ковкий и тягучий металл в чистом
состоянии. Он не взаимодействует с Н2О даже при кипячении, так как
покрывается тонкой защитной пленкой Cd(OH)2,
однако при очень высоких температурах кадмий энергично разлагает воду:
Cd + Н2О
= Cd(OH)2
+ H2
↑.
Восстановительные свойства садмия выражены
слабее, чем у цинка. В щелочах кадмий не растворяется, а медленно окисляется
при нагревании в разбавленной серной и соляной кислотах::
Cd + H2SO4 =
CdSO4 + H2.+ 2Сl
= CdCl2 + H2.
Металлический кадмий и его соли очень токсичны.
Нельзя допускать контакта металлического кадмия с пищевыми продуктами.
Отравление кадмием сопровождается нарушением общего состояния, а также
повреждением костей.
Элементы подгруппы цинка образуют галиды типа ЭГ2.
Важнейшими из них являются хлориды цинка и ртути. Cоли
цинка и кадмия обладают ионной природой. Соли цинка сильно гидратированы (ZnSO4
∙ 7Н2О), соли кадмия - в меньшей степени.
Элементы подгруппы цинка склонны к
комплексообразованию (К.Ч. = 4; 6), например:
ZnCℓ2
+ 6NH4OH
= [Zn(NH3)6]Cℓ2
+ 6H2O;
Cd(OH)2 + 4KCNS = K2[Cd(CN)4]
+ 2KOH;
2KI
+ HgI2
= K2[HgI4].
Хлориды, бромиды, иодиды и сульфаты кадмия
образуют в водных растворах аутокомплексы: Cd[CdCℓ4];
Cd[CdBr4];
Cd[CdI4];
Cd[Cd(SO4)2],
например:
CdCℓ2
= Cd[CdCℓ4];
CdBr2
= Cd[CdBr4].
Большинство соединений кадмия бесцветно или
белого цвета, за исключением CdO
(коричневый), CdS (желтый).
Соли кадмия и сильных кислот токсичны и не склонны к гидролизу. Гидроксид
кадмия обладает слабыми амфотерными свойствами, кислотные свойства он проявляет
в меньшей степени, чем Zn(OH)2.
Однако при длительном кипячении взвеси Cd(OH)2
в концентрированных щелочах образуются гидроксокадматы.
Cd(OH)2 + 2Ba(OH)2
= Ba2[Cd(OH)6].
3.3 Соединения ртути
Ртуть растворяет многие металлы, образуя твердые
или жидкие сплавы, называемые амальгамами. Единственным металлом, не образующим
амальгаму, является железо, поэтому ртуть перевозят в железной таре.
Высокая устойчивость электронной пары ртути 6s2
накладывает отпечаток на ее свойства и обусловливает ее существенные отличия от
цинка и кадмия.
Для ртути (I)
характерны производные кластерного радикала Hg22+.
В радикале Hg22+
атомы связаны между собой ковалентной связью -Hg-Hg-.
В производных Hg22+
степень окисления Hg
равна + 1, однако ртуть двухвалентна и в этих соединениях, но одна единица
валентности каждого атома ртути затрачивается на связь с другим атомом ртути.
Эта связь сохраняется и в равстворах солей ртути (I).
Которые содержат ионы ртути. Таким образом. Состав солей ртути (I),
содержащий одновалентный кислотный остаток r, следует изображать не
эмпирической формулой HgR, а фор мулой Hg2R2 (например,
Hg2Cl2
).
Одна из особенностей ртути заключается в том.
Чьто для неё неизвестны гидроксиды. При действии щелочей на растворы солей
ртути (I) получается
буровато-чербоние осадок оксида ртути (I).
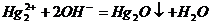
Точно также из солей ртути (II)щелочи
осаждают оксид ртути (II):
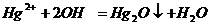
Образующийся осадок имеет желтоватый цвет.
Hg2O
- основной оксид, однако его основные свойства выражены слабо, поэтому многие
соли ртути подвергаются гидролизу с образованием оксо-солей. Соединения ртути (I)
в зависимости от условий протекания реакций проявляют восстановительные и
окислительные свойства:
Hg2Cℓ2
+ Сℓ2 = 2HgCℓ2,
Hg2Cℓ2
- восстановитель;
Hg2Cℓ2
+ SnCℓ2
= 2Hg + SnCℓ4
, Hg2Cℓ2
- окислитель.
Хлорид ртути (I)
Hg2Cl2
(каломель) практически нерастворим в воде. Соединения ртути (I)
склонны к реакциям диспропорционирования с выделением свободной ртути и
соединений ртути (II):
Hg2(CN)2
= Hg(CN)2
+ Hg;
Hg2S = HgS + Hg;22+
= Hg + Hg2+.
Большинство производных ртути (I)
малоустойчивы, бесцветны и трудно растворимы в воде, действием окислителей их
переводят в соединения ртути (II):
3Hg2Cℓ2
+ 8HNO3 = HgCℓ2 + 3Hg(NO3)2 +
2NO + 4H2O.
Соединения ртути (II)
HgCℓ2
- сулема, устойчива на воздухе, токсична, растворяется в воде, спирте, эфире,
сероуглероде. Сулема - сильнейший яд! Обычно сулему получают нагревая сульфат
ртути (II) с хлоридом
натрия:
HgSO4
+ 2NaCl = Na2SO4
+ HgCl2
При нагревании сулема разлагается:
HgCℓ2
= Hg + Сℓ2.
В водных растворах сулема подвергается
гидролизу:
HgCℓ2
+ НОН = Hg(OH)Cℓ
+ HCℓ;
Hg2+
+ HOH D
HgOH+ +H+
pH<7.
В растворах молекулы хлорида ртути ассоциированы
и склонны к образованию аутокомплексов:
HgCℓ2
= Hg[HgCℓ4].
При действии щелочей на растворы солей ртути (II)
получается желтый осадок оксида ртути (II)
HgO:
Hg(NO3)2 +
2NaOH → HgO + 2NаNO3
+ H2O.
Для восстановления сулемы до каломели используют
в качестве восстановителя тетрахлоростаннит (II)
водорода:
HgCℓ2
+ H2[SnCℓ4]
= Hg2Cℓ2
+ H2[SnCℓ6];2Cℓ2
+ H2[SnCℓ4] = 2Hg + H2[(SnCℓ6)].
Водный раствор сулемы практически не проводит
электрического тока. Сулема - одна из немногих солей, которая почти не
диссоциируют в водном растворе на ионы. Это объясняется сильной поляризующейся
способностью иона Hg2+.
Ртуть обладает рядом специфических свойств. Она
образует особо прочные связи с углеродом, поэтому цианид ртути Hg(CN)2
практически не диссоциирует на ионы; её алкильные и арильные производные,
например Hg(C2Н5)2 и Hg(C6Н5)2,
настолько устойчивы, что выдерживают почти без разложения длительное кипячение
в воде. Устойчивость связи Hg - C также свидетельствуют об особенной склонности
ртути к образованию ковалентных соединений. По отношению к аммиаку соединения
ртути ведут себя не так, как соединения кадмия и ртути, например:
ℓ2 + 2NH3 = HgNH2Cℓ
+ NH4Cℓ.
Применение цинка разнообразно. Из цинка готовят
сплав с алюминием, медью, магнием, которые имеют промышленное значение.
Значительная часть цинка идет на нанесение покрытий на железные и стальные
изделия, которые защищают основной металл от коррозии.
Оксид цинка ZnO применяется для изготовления
белой масляной краски (цинковые белила), в медицине и косметике (для
изготовления различных мазей); значительная часть оксида цинка используется в
качестве наполнителя резины.
Сульфат цинка ZnSO4 ∙ 7H2О
(цинковый купорос) применяется при крашении и ситцепечатании, в медицине.
Сульфид цинка ZnS обладает способностью
люминесцировать - испускать холодное свечение при действии лучистой энергии.
Явление люминесценции широко используется в науке и технике. Большое значение
приобрел люминесцентный анализ.
Сульфид кадмия применяется для изготовления
желтой краски и цветных стекол.
Каломель Hg2Cℓ2
применяют для изготовления каломельных электродов и как катализатор в
органических реакциях.
Сулема HgCℓ2
ядовита, применяется в медицине как сильное дезинфицирующее средство, в
сельском хозяйстве - для протравы семян, дубления кожи и т. д.
Оксид ртути (II)
HgO имеет две
модификации: красную и желтую. Обе формы ядовиты. Красную модификацию HgO
используют для изготовления специальных красок, которыми красят морские суда.
Желтая модификация HgO
применяется для изготовления мазей при глазных и кожных заболеваниях.
Чистую ртуть используют в химической
промышленности (как катод при электролизе NaOH),
а также для получения многих органических соединений, в атомной энергетике, в
медицине для приготовления зубных амальгам, в горном деле для амальгамирования
золота (извлечение золота из руд).
Пары ртути ядовиты; попадая в организм, они
легко адсорбируются белковыми молекулами и понижют иммунитет.
Ртуть применяется во многих физических и
химических приборах, например, термометрах, барометрах, манометрах, ареометрах,
в полярографических установках.
.4 Биологическая роль d-элементов IIБ-группы
Цинк, кадмий, ртуть - микроэлементы. В организме
взрослого человека содержится 1,8 г цинка, 50 мг кадмия, 13 мг ртути.
Кадмий и ртуть - примесные элементы. Около 70%
ртути сосредоточены в жировых и мышечной ткани: кадмий локализуется в почках.
Печени, легких, поджелудочной железе.
Цинк - необходимвый элемент всех растений и
животных. В организме цинк сосредотиочен в мышцах (65%), костях (20%),
остальное приходится на плазму крови, печень, эритроциты. Ион цинка входит в
состав более 40 металлоферментов, катализирующих гидролиз эфиров и белков.
Наиболее изучен бионеорганический комплекс цинко - фермент карбоангидраза,
Белковый лиганд, связанный с Zn2+, представляет активный центр
ферменета. Цинка в ферменте 0,22%. Наличие цинка необходимое условие
увталитической активности карбоангидразы (КА), которая обеспечивает гидратацию
СО2:
СО2 + Н2О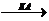
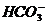 + Н+
+ Н+
Протекание этой реакции обуславливает нормальное
дыхание.
Цинк образует бионеорганический комплекс с
инсулином - гормоном, регулирующим содержание сахара в крови. При недостатке
цинка в растениях нарушается белковый и углеводнвый обмен, тормозится синтез
хлорофилла и витаминов. Дефицит цинка устраняется при использовании
цинкосодержащих удобрений.
Токсичность соединений IIБ-группы увеличивается
от цинка к ртути. Водорастворимые соединения оказывают раздражающее действие на
кожу. При попадании внутрь организма вызывают отравление.
Токсичны и сами металлы. При вдыхании паров
цинка (воздух цинковых производств) появляется «металлическая» лихорадка,
отравление парами ртути получило название «болезнь сумащедшего шляпочника».
Токсичность ртути связана с агглютинацией
(склеиванием, слипанием) эритроцитов, ингибированием ферментов. Например,
сулема HgCℓ2
вызывает изменение размеров, осматческую хрупкость и снижение деформируемости
эритроцитов, которая необходима для их продвижения по каппилярам.
Токсичность кадмия с его сродством к нуклеиновым
кислотам. В результате его присоединения к ДНК нарушается её функционирование.
Хроническая интоксикация кадмием и ртутью может
нарушить минерализацию костей. Это связано с близостью ионных радиусов Cd2+
(97 пм), Hg2+
(110 пм), Са2+ (95 пм). Поэтому токсичные элементы могут замещать
кальций. Это приводит к образованию апатита несовершенной структуры вследствие
искажения параметров кристаллического компанента костной ткани. В результате
снижается прочность костей.
Соединения Zn,
Cd, Hg
могут вызывать нарушение белкового обмена, что проявляется в выделении белков
плазмы через почки (протеинурия).
Токсичное действие соединений группы IIБ на
организм вызывается еще и тем, что ионы этих металлов выступают во
взаимодействии с сульфидгидрильными SH-группами белков, ферментов и
аминокислот.
При взаимодействии ионов металлов с SH-группами
образуются слабодиссоциирующие и, как правило, нерастворимые соединения.
Поэтому блокирование сульфидрильных групп приводит к подавлению активности
ферментов и свертыванию бкелков. Ионы двухвалентных металлов блокируют
одновременно две SH-группы:
Рис. 3.3
В реакциях подобного типа ионы металлов
выступают акцепторами, а сера - донором электронов.Hg
Наиболее выражено химическое сродство SH-группам
у ртути. Очевидно, это связано с тем, что комплексообразующие свойства ртути
выше и она образует более прочные связи с серой.группы входят в состав более
100 ферментов, активность которых может быть подавлена из-за блокирования этих
групп. пОэтому очевидно, насколько важно знать механизм блокирования и методы
лечения при отравлении организма металлами.
Известно, что токсичные свойства элементов
зависят от той химической формы, в кАкой они попадают в организм. Наиболее
токсичны те формы, которые растворяются в липи и легко проникают через мембрану
в клетку.
В литературе описан случай массового отравления
ртутью в Японии. Неорганические соединения ртути под действием ферментов
микроорганизмов превращались в метилртуть:
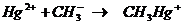
карбанион
метилртуть
Метилртуть накапливаясь в рыбе, а затем с пищей
поступает в организм человека. Из-за того, что CH3Hg+растворяется
в липидах, она накапливается в организме, в том числе в мозге. Постепенно
концентрируясь метилртуть вызывает необратимые разрушения в организме в том
числе и смерть.
Таким образом, по характеру функционирования и
воздействия на организм металлы IIб-группы можно разделить на
жизненнонеобходимый элемент Zn и токсические примесные элементы Сd и Hg.
4. Элементы IIIБ группы
(подгруппа скандия)
Скандий Sc,
иттрий Y, лантан La
и актиний Ас составляют подгруппу скандия. d-Элементы
III группы
периодической системы Д.И. Менделеева - полные электронные аналоги с
конфигурацией валентных электронов (п - 1)d1ns2.
Основные константы скандия и его аналогов приведены в табл. 28.
Таблица 4.1 Свойства элементов подгруппы скандия
|
Свойства
|
Элементы
|
|
21Sc
|
39Y
|
57La
|
89Ac
|
|
Содержание
в земной коре, % (мол.доли)
|
3 10-4
|
2,6
10-4
|
2,5
10-4
|
510-15
|
|
Атомная
масса
|
44,956
|
88,905
|
138,91
|
[227]
|
|
Валентные
электроны
|
3d14s2
|
4d15s2
|
5d16s2
|
6d17s2
|
|
Металлический
радиус атома, нм
|
0,164
|
0,181
|
0,187
|
0,203
|
0,083
|
0,97
|
0,104
|
0,111
|
|
Энергия
ионизации Э Э+,эВ
|
6,562
|
6,22
|
5,58
|
5,1
|
|
Плотность,
г, см3
|
3,0
|
4,47
|
6,16
|
10,1
|
|
Тпл,0С
|
1541
|
1528
|
920
|
1050
|
|
Ткип,0С
|
2850
|
3322
|
3450
|
3590
|
|
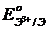 ,
В ,
В
|
-2,08
|
-2,37
|
-2,52
|
-2,6
|
Скандий и его аналоги, каждый в своем периоде,
являются первыми d-элементами,
то есть у них начинают заполняться d-орбитали
предвнешнего слоя. Наличие лишь одного электрона в d-состоянии
обусловливает малую устойчивость d1s2-конфигурации
и отражается на всех свойствах элементов подгруппы скандия. В частности, в
отличие от других d-элементов
скандий и его аналоги проявляют постоянную степень окисления +3.
Сопоставление электронных структур атомов и
ионов скандия, галлия и алюминия показывает, что по строению внешних
электронных слоев невозбужденных атомов элементы подгруппы скандия не имеют
ничего общего с алюминием, тогда как электронная структура трехзарядных ионов
этих элементов одинакова:
Al (2,8,3) → Al3+(2,8);(2,9,2)
→ Al3+(2,8);(2,18,3) → Ga3+(2,18).
В ряду Sc-Y-La-Ac
усиливаются признаки металлических элементов. Скандий напоминает алюминий и
является амфотерным элементом, а его а налоги
по свойствам приближаются к щелочно-земельным металлам.
налоги
по свойствам приближаются к щелочно-земельным металлам.
В земной коре элементы подгруппы скандия очень
распылены и отдельных минералов не образуют. Содержание в земной коре скандия,
иттрия и лантана порядка 10-3% (масс). Актиний содержится в меньшем
количестве [порядка 10-3% (масс).], так как оба его природные
изотопы 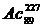 и
и
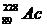 -
радиоактивны. Из-за этого их трудно выделить в чистом (без примесей) состоянии.
-
радиоактивны. Из-за этого их трудно выделить в чистом (без примесей) состоянии.
Свойства. Иттрий, лантан, актиний - белые
металлы, скандий имеет желтоватый оттенок.
Скандий и его аналоги по химической активности
уступают лишь щелочным и щелочно-земельным металлам. В ряду Sc-Y-La-Ас
химическая активность этих элементов заметно возрастает, о чем свидетельствуют,
в частности, значения их электродных потенциалов 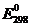 (табл.
29). При более или менее сильном нагревании все они реагируют с большинством
неметаллов, а при сплавлении - с металлами.
(табл.
29). При более или менее сильном нагревании все они реагируют с большинством
неметаллов, а при сплавлении - с металлами.
В электрохимическом ряду напряжений Sc
и его аналоги находятся далеко впереди водорода (см. значения 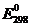 ).
Скандий пассивируется водой, а лантан уже при обычных условиях медленно
разлагает воду:
).
Скандий пассивируется водой, а лантан уже при обычных условиях медленно
разлагает воду:
La + 6Н2О
= 2La(OH)3
+ ЗН2.
Рассматриваемые металлы легко взаимодействуют с
разбавленными кислотами, причем разбавленную азотную кислоту они
восстанавливают до NH4NO3:
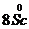 + 30HNО3
=
+ 30HNО3
= 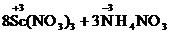 +
9Н2О.
+
9Н2О.
В свободном состоянии Sc,
Y и La
получают электролизом расплавленных хлоридов или металлотермическим методом.
Соединения элементов подгруппы скандия. В
соответствии с усилением в ряду Sc-Y-La-Ас
признаков металличности в том же ряду у соединений Э(III)
ослабевают кислотные и усиливаются основные признаки.
Оксиды скандия, иттрия и лантана образуются при
нагревании этих металлов с кислородом.
Оксиды Э2О3 - тугоплавкие
белые кристаллические вещества с высокими энтальпиями образования (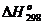 от -1650 до - 2000 кДж/моль.
от -1650 до - 2000 кДж/моль.
Взаимодействие La2O3
с водой сопровождается выделением теплоты (гашение):
La2O3
+ ЗН2О = 2La(OH)3,
H < 0.
Активность взаимодействия с водой в ряду Sc2О3-Y2O3-La2О3-Ас2О3
возрастает от оксида скандия до оксида актиния
В ряду гидроксидов Sc(OH)3-Y(OH)3-La(OH)3-Ас(ОН)3
усиливаются основные признаки и возрастает растворимость в воде. Так, Sс(ОН)3
амфотерен, a
La(OH)3
- довольно сильное основание. В обычных условиях La(OH)3
взаимодействует с кислотами, поглощает CO2,
из аммонийных соединений при нагревании вытесняет аммиак. При нагревании Sс2O3
или Sс(ОН)3 с
основными оксидами или щелочами образуются оксоскандиаты (III)
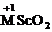 ,
а в растворах образуются гидроксоскандиаты:
,
а в растворах образуются гидроксоскандиаты:
3NaOH
+ Sc(OH)3
= Na3[Sc(OH)6].
При взаимодействии гидроксида скандия с
кислотами образуются соли:
2Sс(ОН)3
+ 3H2SO4 = Sc2(S04)3 + 6Н20.
Таблица 4.2 Кислородные соединения элементов
подгруппы скандия
|
Название
элемента
|
Степень
окисления
|
Оксиды
|
Гидроксиды
|
Соли
|
|
|
Формула
|
Характер
|
Формула
|
Название
|
Формула
иона
|
Название
|
|
Скандий,
Sc
|
+3
|
Sc2О3
|
Амфотерный
|
Sc(ОН)3
|
Гидроксид
скандия
|
Sc3+
|
Соли
скандия (III)
|
|
|
|
|
НScО2
|
Оксоскандиат
водорода
|
ScО2-
|
Скандиаты
|
|
|
|
|
Н3[Sc(ОН)6]
|
Гидроксоскандиат
водорода
|
[Sc(ОН)6]3-
|
Гидроксоскандиаты
|
|
Y, итрий
|
+3
|
Y2О3
|
Осн.
|
Y(ОН)3
|
Гидроксид
иттрия
|
Y3+
|
Соли
иттрия
|
|
La, лантан
|
+3
|
La2О3
|
Осн.
|
La(ОН)3
|
Гидроксид
лантана
|
La3+
|
Соли
лантана
|
В ряду галогенидов ScHaℓ3-YHaℓ3-LaHaℓ3-АсНаℓ3
также наблюдается усиление основных признаков. Так, к образованию комплексных
галогенидов в растворах склонен лишь фторид скандия ScF3,
для которого известны фтороскандиаты 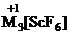 .
Фтороскандиаты s-элементов I
группы растворимы в воде и довольно устойчивы. Что же касается фтороиттриатов,
то они получаются лишь при сплавлении YF3
с фторидами таких типичных металлов, как цезий, рубидий (Cs3[YF6],
Rb3[YF6]).
Из фторолантанатов достаточно устойчиво только производное цезия Cs3[LaF6].
.
Фтороскандиаты s-элементов I
группы растворимы в воде и довольно устойчивы. Что же касается фтороиттриатов,
то они получаются лишь при сплавлении YF3
с фторидами таких типичных металлов, как цезий, рубидий (Cs3[YF6],
Rb3[YF6]).
Из фторолантанатов достаточно устойчиво только производное цезия Cs3[LaF6].
Фториды Sc(III)
и его аналогов существенно отличаются от остальных галогенидов: они тугоплавки
(т. пл. 1450-1550°С), негигроскопичны, в воде не растворяются. Хлориды, бромиды
и йодиды (т.пл. 800-900°С), напротив, гигроскопичны и легко гидролизуются,
образуя оксогалогениды ЭОНаℓ.
Подобно алюминию, скандий и его аналоги образуют
двойные соли, например, 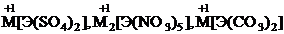 . Образованием
двойных солей объясняется растворение карбонатов скандия и его аналогов в
насыщенных растворах карбонатов щелочных металлов и аммония:
. Образованием
двойных солей объясняется растворение карбонатов скандия и его аналогов в
насыщенных растворах карбонатов щелочных металлов и аммония:
К2СО3 + La2(CО3)3
= 2K[La(CО3)2].
С малоактивными неметаллами скандий и его аналоги
образуют тугоплавкие соединения интерметаллического типа, например: ScB2,
YB2,
LaB6,
ЭSi2,
YC2,
LaC2,
ScC и др.
Применение. Скандий, иттрий и лантан являются
компонентами ряда сплавов, используемых в современной технике. Наибольшее
применение находят соединения Sc,
Y, La.
Оксиды Sc,
Y, La
используют как катализаторы. Оксид иттрия используют для изготовления
прозрачной огнеупорной керамики. Соединения Sc,
Y, La
широко применяют в качестве люминофоров и активаторов в цветном телевидении.
Ряд лазерных материалов содержит иттрий.
Соединения элементов подгруппы скандия применяют
в полупроводниковой технике.
5. Элементы IVБ
группы (подгруппа титана)
В четвертую побочную подгруппу входят элементы:
титан Ti, цирконий Zr,
гафний Hf и
искусственно полученный курчатовий Кu.
Элемент 104 был получен группой ученых под руководством Г.Н. Флерова (1964) при
облучении в мощном ускорителе плутония-242 (Z=94)
ядрами неона - 22 (Z=94):
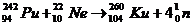
Новый элемент был назван курчатовием в честь выдающегося
ученого И.В. Курчатова (в США этот элемент назвают резерфодием.) В весомых
количествах курчатовий не получен, его свойства исследуются с использованием
единичных атомов.
d-Элементы IV
группы - титан Ti,
цирконий Zr, гафний Hf
и курчатовий Кu полные электронные
аналоги с конфигурацией валентных электронов(n
- 1)d2ns2.
Они образуют подгруппу титана.
Таблица 5.1 Свойства элементов подгруппы титана
|
Свойства
|
22Ti
|
40Zr
|
72Hf
|
104Ku
|
|
Атомная
масса
|
47,90
|
91,22
|
178,49
|
[261]
|
|
Валентные
электроны
|
3d24s2
|
4d25s2
|
5d26s2
|
6d27s2
|
|
Металлический
радиус атома, нм
|
0,146
|
0,160
|
0,159
|
0,16
|
|
Условный
радиус иона Э4+, нм
|
0,064
|
0,082
|
0,082
|
0,078
|
|
Энергия
ионизацииЭ0àЭ++е,эВ
|
6,82
|
6,84
|
7,5
|
-
|
|
Содержание
в земной коре, %
|
6∙10-1
|
2∙10-2
|
3,2∙10-4
|
-
|
|
Пл.,г/cм3
|
4,50
|
6,50
|
13,1
|
~18
|
|
Тпл,
оС
|
1668
|
1855
|
~2230
|
~2100
|
|
Ткип,оС
|
~3169
|
~4340
|
~4110
|
~5550
|
|
Еоэ4+/э,
В
|
-1,17
|
-1,529
|
-1,70
|
-
|
|
Еоэ3+/э,
В
|
-1,21
|
-
|
-
|
-
|
Как видно из приведенных данных (см. табл. 5.2),
в ряду Ti - Zr
- Hf несколько
увеличиваются первые энергии ионизации. При переходе от Ti
к Zr возрастают атомные
и ионные радиусы, а цирконий и гафний из-за лантаноидного сжатия имеют почти
одинаковые размеры атомов и ионов. Поэтому свойства Zr
и Hf очень близки и их
разделение при совместном присутствии - одна из сложнейших проблем неорганической
технологии.
Таблица 5.2 Степени окисления титана и
структурные единицы его соединений
|
Степень
окисления элемента
|
Координационное
число
|
Структурные
единицы
|
Примеры
|
|
+2
|
6
|
Октаэдр
|
ТiO,
TiF2, TiCl2
|
|
+3
|
6
|
>>
|
[Ti(OH2)6]3+, [TiF6]3-, Ti2O2, TiCl3
|
|
+4
|
4
|
Тетраэдр
|
TiCl4, BaTiO3
|
|
+4
|
6
|
Октаэдр
|
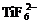 ,
TiO2,
CaTiO3
(перовскит), FeiO3
(ильменит) ,
TiO2,
CaTiO3
(перовскит), FeiO3
(ильменит)
|
В отличие от элементов подгруппы германия в
подгруппе титана с возрастанием атомного номера элементов устойчивость степени
окисления повышается. Для титана и его аналогов наиболее характерна степень
окисления +4, но известны также соединения Ti(III)
и реже Ti(II).
Так, для титана устойчивы оксиды ТiO,
Тi2О3,
ТiO2
и фториды TiF2,
TiF3,
TiF4,
a для циркония и
гафния - ZrO2,
НfО2 и ZrF4,
HfF4.
Для титана типично координационное число 6, реже
4. Для циркония и гафния характерны более высокие координационные числа 7 и 8.
Природные соединения. В земной коре титан
довольно распространен, встречается главным образом в виде минералов: рутила ТiO2,
ильменита FeTiО3
и перовскита СаТiO3.
Цирконий и гафний - рассеянные элементы; из наиболее важных минералов циркония
можно назвать циркон ZrSiO4
баддалеит ZrO2.
Гафний самостоятельных минералов не образует, а всегда сопутствует цирконию.
Поскольку при высоких температурах Ti,
Zr и Hf
проявляют высокую химическую активность, выделение их в чистом виде
представляет значительные трудности. Обычно эти металлы получают
магнийтермическим и натрийтермическим восстановлением тетрагалогенидов в
атмосфере аргона или гелия:
TiCℓ4+
2Mg = 2MgCℓ2 + Ti;
K2[ZrF6]
+ 4Na = 4NaF
+ 2KF + Zr.
Свойства. Титан, цирконий и гафний - металлы
серебристо-белого цвета. Титан относится к легким, а цирконий и гафний - к
тяжелым металлам. Все они тугоплавки, имеют одинаковый тип кристаллической
решетки. Высокие температуры плавления Ti,
Zr, Hf
свидетельствуют о металлоковалентном характере связи в кристаллах.
Чистые металлы хорошо поддаются механической
обработке. Следует отметить, что у металлов, содержащих в качестве примесей О,
N, С, Н, пластичность, ковкость, тягучесть, твердость, прочность на разрыв и
другие механические характеристики резко изменяются.
При обычной температуре металлы подгруппы титана
коррозионно устойчивы на воздухе, что объясняется наличием на их поверхности
защитной пленки ЭО2. При нагревании же их химическая активность
заметно возрастает. Так, при температуре красного каления они сгорают в
кислороде, образуя ЭO2,
при 800 оС активно реагируют с азотом, образуя нитриды ЭN.
С галогенами взаимодействуют при 150- 400°С, образуя ЭНа14 и т.д. В
порошкообразном состоянии эти металлы пирофорны.
Титан, цирконий и гафний химически устойчивы во
многих агрессивных средах. В азотной кислоте все они пассивируются. В отличие
от циркония и гафния титан при нагревании растворяется в соляной кислоте,
образуя в восстановительной атмосфере аквакомплексы Ti
(III) - [Ti(OH2)6]3+:
2Ti0 + 6OH+3
+6H2O = 2[Ti+3(OH2)6]3+
+3H2.
Цирконий и гафний взаимодействуют с кислотами
лишь в тех случаях, когда создаются условия их окисления и образования анионных
комплексов Э(IV).
Мелкораздробленные Zr,
Hf и Ti,
относительно легко растворяются во фтороводородной кислоте:
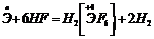 .
.
Мелкораздробленные титан, цирконий, гафний также
окисляются в смеси азотной и плавиковой кислот:
3Э0+4HNO3+18HF=3H2[ЭF6]+4NO+8H2O;
3Zr+4HNO3+18HCℓ=3H2[ZrCℓ6]+4NO+8H2O.
Мелкораздробленные титан, цирконий и гафний
взаимодействуют при нагревании с концентрированной серной кислотой:
Ti+4H2SO4
=Ti(SO4)2
+2SO2+4H2O.
Цирконий и гафний, в (меньшей степени - титан),
устойчивы в растворах щелочей.
Используемые в металлургии титан и цирконий
получают в виде ферротитана и ферроциркония (15 - 20% Ti
или Zr) путем
совместного восстановления углем минералов титана или циркония из железных руд.
Титан благодаря легкости, высокой термической и
коррозионной устойчивости - важный конструкционный материал. Он используется
для строительства самолетов, подводных лодок, химических реакторов и пр.
Цирконий (освобожденный от гафния) и его некоторые сплавы применяются в атомной
энергетике в качестве конструкционных материалов, отражающих нейтроны. Масштабы
применения гафния более ограничены: он также используется в атомной энергетике
как поглотитель нейтронов; применяется в электронной технике (катоды
телевизионных трубок).
Металлические и металлоподобные соединения.
Порошки титана, циркония и гафния поглощают водород, кислород и азот. При этом
растворенные неметаллы переходят в атомное состояние и принимают участие в
образовании химических связей. Наряду с сильно делокализованной возникает
локализованная связь. Благодаря этому система приобретает повышенную твердость
и хрупкость. Способность Ti,
Zr и Hf
поглощать газы используется для получения глубокого вакуума, удаления газов из
сплавов и т.д.
Гидриды Ti,
Zr и Hf
- хрупкие металлоподобные порошки серого или черного цвета. Их идеализированный
состав отвечает формуле ЭН2, они являются промежуточными веществами
между твердыми растворами и солеподобными (ионными) гидридами типа СаН2.
Разложение гидридов титана, циркония и гафния
используется для получения металлов в порошкообразном состоянии и для нанесения
их на поверхность соответствующих изделий.
Характер взаимодействия титана и его аналогов с
металлами зависит от положения последних в периодической системе. Так, с
близкими к нему по свойствам хромом и ванадием титан образует непрерывный ряд
твердых растворов замещения (табл. 5.3).
Таблица 5.3 Твердые растворы замещения ряда d-элементов
в титане
|
Элементы
|
Ti
|
V
|
Cr
|
Mn
|
Fe
|
Co
|
Ni
|
|
Валентные
электроны
|
d2s3
|
d3s2
|
d5s1
|
d5s2
|
d6s2
|
d7s2
|
d8s2
|
|
Растворимость
в Ti, %
(мол.дол)
|
-
|
100
|
100
|
28
|
20
|
13
|
10
|
В ряду Mn
- Fe - Со - Ni
возможность образования твердых растворов с титаном уменьшается и, наоборот,
усиливается склонность к образованию интерметаллических соединений.
Соединения Ti
(IV), Zr
(IV), Hf
(IV). Для титана и его
аналогов известны тетрагалогениды ЭНаℓ4, диоксиды ЭО2,
дисульфиды ЭS2, дисульфаты Э(SО4)2 и т.п.
Кроме того, известны многочисленные производные анионных комплексов Э (IV)
- титанаты, цирконаты и гафнаты:
Таблица 5.4
|
ЭНаℓ4
|
ЭО2
|
ЭS2
|
Э(SO4)2
|
|
[ЭНаℓ6]2-
|
ЭО32-
|
ЭS32-
|
[Э(SO4)3]2-
|
При нагревании в атмосфере кислорода титан,
цирконий, гафний сгорают с образованием диоксидов (табл. 5.5)
Диоксиды ЭO2 - тугоплавкие белые
вещества с высокими значениями энтальпий образования и энергиями Гиббса:
Таблица 5.5
|
TiO2
|
ZrO2
|
HfO2
|
|
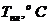
|
1870
|
2850
|
2900
|
|
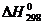 ,
кДж/моль ,
кДж/моль
|
-944
|
-1100
|
-1118
|
|
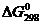 ,
кДж/моль ,
кДж/моль
|
-889
|
-1043
|
-1061
|
Химически диоксиды титана, циркония, гафния
довольно инертны. Диоксиды этих элементов имеют амфотерный характер. В кислотах
и щелочах не растворяются. Лишь при длительном нагревании ЭО2 медленно
взаимодействуют с кислотами, а при сплавлении медленно взаимодействуют со
щелочами и основными оксидами:
BaO +TiO2
=BaTiO3.
Таблица 5.6 Кислородосодержащие соединения
титана (IV), циркония (IV), гафния(IV)
|
Элемент
|
Степень
окисления
|
Оксиды
|
Гидроксиды
|
Соли
|
|
|
Формула
|
Характер
|
Формула
|
Название
|
Формула
иона
|
Название
|
|
Ti
|
+3
|
TiO3
|
Основной
|
TiO3∙nH2O
|
Гидроксид
титана (III)
|
TiO3+
|
Соли
титана (III)
|
|
Ti
|
+4
|
TiO2
|
Амфотерный
|
TiO2∙nH2O
|
Гидроксид
титана (IV).
|
TiO2+,
|
Соли
титанила
|
|
|
|
|
H2TiO3*
|
Титановая
кислота
|
TiO32-
|
Титанаты
|
|
Zr
|
+4
|
ZrO2
|
То
же
|
ZrO2∙nH2O
|
Гидроксид
циркония (IУ).
|
ZrO2+
|
Соли
цирконила
|
|
|
|
|
H2ZrO3*
|
Циркониевая
кислота
|
ZrO32-
|
Цирконаты
|
|
Hf
|
+4
|
HfO2
|
_”_
|
HfO2∙nH2O
|
Гидрооксид
гафния (IУ).
|
HfO2+
|
Соли
гафнила
|
|
|
|
|
H2HfO3*
|
Гафиниевая
кислота
|
HfO32-
|
Гафнаты
|
Из диоксидов наиболее широкое применение находит
диоксид титана TiO2.
Вследствие химической инертности он используется в качестве наполнителя в
производстве пластмасс, красок, резины, а ZгО2
- для изготовления огнеупорных тиглей и плит. Разработана технология получения
крупных прозрачных кристаллов ZrO2
с примесью НfО2, названных фианитами. Они имеют высокий показатель
преломления, отличаются высокой твердостью, прочностью, исключительной
химической стойкостью. Их применяют в технике и для изготовления украшений.
Из тетрагалогенидов ЭHаℓ4
хлориды, бромиды и иодиды в твердом состоянии имеют молекулярные решетки.
Тетрафториды полимерны.
Галогениды Э(IV)
обычно получают нагреванием ЭО2 с углем в атмосфере галогена:
ЭО2 + 2С + 2Сℓ2= ЭСℓ4
+2СО.
Тетрагалогениды молекулярной структуры летучи,
химически активны. Из них наиболее широко используется ТiCℓ4,
в основном для получения металлического титана и ТiO2. Иодиды Э(IV)
при высоких температурах (1000-1400 °С) распадаются на йод и металл, что
используется, как указывалось, для получения особо чистых Ti,
Zr и Hf.
Гидроксиды Э(IV)
- студенистые осадки переменного состава ЭО2∙nН2О.
Свежеполученные осадки (б-форма) имеют относительно большое число ОН-групп.
Поэтому они более реакционноспособны (растворимы в кислотах), чем
«состарившиеся» осадки (в-форма), в которых ОН-группы замещены на О-мостики.
Гидроксид титана (IV)
растворим в концентрированных щелочах; гидроксиды циркония (IV)
и гафния (IV) с щелочами
практически не взаимодействуют.
Гидратированные ионы Ti4+,
Zr4+
и Hf4+
вследствие большого заряда в растворах существовать не могут, так как сильно
гидролизуются. При гидролизе производных Э(IV)
образуются устойчивые оксокатионы:
TiCℓ4
+ HOH = TiOCℓ2
+ 2HCℓ;
Ti4+
+ Н2О = TiO2+
+ 2Н+.
Катионы TiO2+,
ZrO2+,
HfO2+
называются соответственно титанион, цирконион, гафнион. Они настолько
устойчивы, что соответствующие галогенопроизводные, например TiOCℓ2(хлорид
титанила), ZrOBr2(бромид
цирконила) и т.п., существуют в твердом состоянии и обладают солеобразным
характером.
При дальнейшей полимеризации полиядерные
комплексы разрастаются до размеров коллоидных частиц. Возможно даже выделение
свободных гидроксидов ЭО2-nН2О.
В многоядерных комплексах молекулы воды и
ОН-группы могут замещаться на имеющиеся в растворе анионы. Поэтому при
взаимодействии оксидов или гидроксидов с кислотами образуются не средние соли,
а соответствующие оксо- и гидроксопроизводные типа ЭОХ2, где (Х=Cℓ-,
Br-,
I-,
NO3-,
1/2SO42-):
Ti(OH)4 + 2НCℓ =
TiOCℓ2+ 3H2O;2
+ H2SO4
= TiOSO4
+ H2O.
Соединения простого состава получают лишь в
неводных растворах. Так, Ti(SO4)2 образуется при
взаимодействии TiCℓ4
и SО3 в жидком хлориде сульфурила SO2Cℓ2
или сплавлением ТiO2 с дисульфатом:
TiCℓ4
+ 4SO3
= Ti(SO4)2+
2SO2Cℓ2;
TiO2
+ 2K2S2O7
= Ti(SO4)2
+ 2K2SO4.
Из анионных комплексов Э (IV)
относительно более просты по составу галогенопроизводные. Наиболее устойчивы в
растворах и легко образуются фторокомплексы, например:
KF+TiF4=K2[TiF6]
Производные других анионных комплексов Э(IV)
обычно образуются при сплавлении соответствующих соединений, например:
KCℓ + ЭСℓ4
= К2[ЭСℓ6];
КОН + ЭО2 = К3ЭО3 +
Н2О;
СаСО3 + TiO2
=CaTiO3
+ CO2.
Структура оксотитанатов часто соответствует
структурному типу перовскита СаТiO3
и ильменита FеТiO3. Большинство оксотитанатов, оксоцирконатов и
оксогафнатов представляют собой смешанные оксиды. В воде они не растворяются, а
производные щелочных металлов гидролизуются.
Для титана и его аналогов весьма характерны
анионные комплексы, в которых роль лиганда играет пероксид-радикал О22-.
Пероксотитанаты и пероксоцирконаты образуются при действии Н2О2
на соответствующие соединения, например:
Э(SO4)2
+ Н2О2 = H2[Э(О2)(SO4)2];
Ti(SO4)2+H2O2
=H2[Ti(O2)(SO4)2].
Растворы соединений Ti
(IV) приобретают
желто-оранжевую окраску. Эта реакция лежит в основе аналитических методов
обнаружения соединений Ti(IV)
и пероксида водорода.
Соединения Тi (III).
Как указывалось, степень окисления +3 отчетливо проявляется лишь у титана.
Производные Ti(III)
получают восстановлением соединений Ti
(IV), например,
водородом при высоких температурах:
0C
2TiO2
+ H2
= Ti2O3
+ Н2О;
6500C 2TiCℓ4
+ H2 = 2TiCℓ3 + 2НCℓ.
В соответствии с устойчивым координационным
числом титана (III)
его оксид Ti2O3
(фиолетовый) имеет структуру типа б-Аℓ2О3; хлорид
ТiСℓ3 (фиолетовый) - слоистую структуру; в кислых растворах
существует аквакомплекс [Тi(ОН2)6]3+, который
входит в состав ряда кристаллогидратов титановых квасцов M+1Ti(SO4)2∙12Н2О
и придает им фиолетовую окраску.
В воде Ti2O3
практически не растворяется. Грязно-фиолетовый осадок Тi2О3∙nН2O,
получаемый при добавлении щелочи в растворы солей Ti
(III), является
основным; так как при дальнейшем добавлении щелочи он не растворяется.
Производные Ti
(III) - восстановители.
Например, они легко окисляются кислородом воздуха:
TiCℓ3
+ O2
+ 2H2O
= 4TiOCℓ2
+ 4HCℓ.
Окисление соединений Ti(III)
в кислых растворах сопровождается исчезновением фиолетовой окраски за счет
образования соединений Ti(IV).
Для соединений Ti(III)
возможны также реакции диспропорционирования. Так, при нагревании до 400 °С TiCℓ3
распадается согласно уравнению:
2Ti+3Cℓ3(k)
= Ti+2Cℓ2(k)+Ti+4Cℓ4(г).
Реакция эндотермична, но сопровождается большим
возрастанием энтропии, поскольку один из продуктов - газ. При дальнейшем
нагревании ТiСℓ2 также диспропорционирует:
Тi2+Сℓ2(к) = Тi0(к)
+ Ti4+Cℓ4(г).
Хотя эта реакция еще более эндотермична,
возрастание энтропии обеспечивает протекание процесса, но уже при более высокой
температуре.
Применение титана, циркония, гафния и их
соединений. По коррозионной стойкости даже в морской воде титан превосходит все
нержавеющие стали и цветные металлы. Поэтому он и его сплавы находят различное
применение в машиностроении, авиа- и судостроении, турбостроении, в
производстве вооружения. Добавка 0,1% Ti
резко повышает качество стали. Сталь с добавлением Zr
используется в изготовлении бронированных плит и щитов, стволов орудий и пр.
Эти металлы связывают азот и кислород, растворенные в стали, что предотвращает
образование раковин и делают сталь однородной.
Способность прочно связывать газы позволяет
использовать Ti и Zr
как геттеры в технике высокого вакуума. Из титана и циркония изготавляют детали
вакуумных приборов, работающих при высокой температуре и вместе с тем
поглощающих газы при эксплуатации прибора. Для этих целей особенно пригодны
пластичные, очень чистые титан и цирконий, получаемые тетраиодидным методом
(99,95% Ti и 99,99% Zr).
Примесь кислорода или азота в количестве 0,1% резко понижает пластичность этих
металлов, делая их непригодными для прокатки.
Чистый, свободный от гафния цирконий применяют
для конструкций ядерных установок (стенки ядерных реакторов), так как он
тормозит, и мало поглощает нейтроны и выдерживает действие высокой температуры.
Гафний же сильно поглощает нейтроны, поэтому цирконий освобождают от примеси
гафния, который обычно присутствует в цирконии в количестве приблизительно 2%.
Накопление гафния, выделенного из природных соединений циркония, заставило
искать области его использования в технике. В настоящее время гафний
рекомендован для изготовления антенн, прочных высокоэмиссионных электродов и в
качестве добавки к электродным массам наряду с другими металлами. Он предложен
как материал для геттеров на медной и никелевой основе и как добавка к
вольфраму в целях задержки рекристаллизации последнего.
Из диоксида титана TiO2
готовят хорошие белила. Диоксиды титана и циркония используют в конденсаторах,
керамических материалах, эмалях, глазурях, тугоплавких стеклах. Карбид титана
применяют в качестве компонента режущих металлокерамических твердых сплавов с
другими карбидами. Карбид титана TiC
с различными связками (Co,
Ni, Cr
и др.) употребляют как жаропрочный материал для изготовления деталей в реактивной
технике, лопастей газовых турбин, работающих при 1000оС. Карбиды
титана и циркония используются для изготовления абразивных материалов,
высокотемпературных тиглей, электродов дуговых ламп, как промежуточные продукты
для получения тетрахлоридов, из которых затем получают особо чистые титан и
цирконий.
6. Элементы группы VБ
(подгруппа ванадия)
Побочные элементы V
группы - ванадий V, ниобий Nb,
тантал Та и нильсборий Ns
-входят в подгруппу ванадия.
Электронная конфигурация валентных электронов
ванадия и тантала (n-1)d3ns2,
ниобия (n-1)d4ns1.
Поэтому их высшая степень окисления + Низшие степени окисления +2, +3, +4 мало
характерны для ниобия и тантала, больше характерны для ванадия, очень большое
различие элементов подгрупп VA
и VB заключается в том,
что элементы побочной подгруппы не образуют газообразных гидридов, а дают
твердые растворы и металлоподобные гидриды.
В отличие от подгруппы мышьяка в подгруппе
ванадия по мере увеличения атомного номера элемента уплотняются электронные
оболочки атомов. Об этом свидетельствует рост в ряду V-Nb-Та
первой энергии ионизации и характер изменения атомных и ионных радиусов (табл.
6.1). Вследствие лантаноидного сжатия атомные и ионные радиусы Nb
и Та практически одинаковы, поэтому ниобий и тантал по свойствам ближе друг к
другу, чем к ванадию.
Таблица 6.1 Свойства элементов подгруппы ванадия
|
Свойства
элементов
|
23V
|
41Nb
|
73Ta
|
|
Атомная
масса
|
50,942
|
92,906
|
180,948
|
|
Валентные
электроны
|
3d34s2
|
4d45s1
|
5d36s2
|
|
Металлический
радиус атома, нм
|
0,134
|
0,145
|
0,146
|
|
Условный
радиус иона Э+5, нм
|
0,040
|
0,066
|
0,066
|
|
Энергия ионизацииЭ0àЭ+,
эВ
|
6,74
|
6,88
|
7,89
|
|
Содержание
в земной коре,% (мас.доли)
|
6 ∙ 10-3
|
2 ∙ 10-4
|
1,8 ∙ 10-5
|
|
ОЭО
|
1,9
|
1,7
|
1,6
|
|
Температура плавления, оС
|
1900
|
2470
|
3000
|
|
Температура кипения, оС
|
3400
|
4760
|
5500
|
|
Плотность, г/см3
|
5,96
|
8,57
|
16,6
|
|
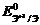 ,
В ,
В
|
-0,835
|
-1,099
|
 - -
|
Ванадий в соединениях имеет степень окисления
+2, +3, +4 и + Для ниобия и тантала, как и для других 4d-
и 5d-элементов,
наиболее устойчива высшая степень окисления, т.е. + Высшая степень окисления
ванадия стабилизируется во фторо- и оксопроизводных.
Устойчивые координационные числа ванадия,
отвечающие соответствующим степеням окисления, приведены в табл. 6.2
Первые ядра нильсбория были синтезированы под
руководством Г.Н. Флерова в Дубне (1970) бомбардировкой америция-243 ядрами
неона-22 с энергией порядка 120 МэВ; в США этот элемент называют ганием На.
Таблица 6.2 Степени окисления ванадия и
структурные единицы его соединений
|
Степень
окисления
|
Координационное
число
|
Структурная
единица
|
Примеры
соединений
|
|
+2
|
6
|
Октаэдр
|
[V(OH2)6]2+, VO
|
|
+3
|
4
|
Тетраэдр
|
[VCl4]-
|
|
6
|
Октаэдр
|
[V(OH2)6]3+,[VF6]3-,V2O3
|
|
+4
|
4
|
Тетраэдр
|
VCl4
|
|
6
|
Октаэдр
|
VO2,[VO(OH2)5]2+
|
|
+5
|
4
|
Тетраэдр
|
VO43-,VOCl3
|
|
|
Тригональная
бипирамида
|
VF5
|
Природные соединения. Ванадий в земной коре
более распространен, чем медь, цинк и свинец, но его соединения редко
встречаются в виде крупных месторождений. Ванадий относится к рассеянным
элементам. Содержится в железных рудах, высокосернистых нефтях. Наиболее важные
его минералы - патронит VS2,
ванадинит РЬ5(VО4)3 Сℓ. Ниобий и тантал
почти всегда встречаются совместно, чаще всего в составе ниобат-танталатовых
минералов типа МЭ2О6 (М = Fe,
Mn).
В случае преобладания тантала минерал М(ТаО3)2
называется танталатом, при преобладании ниобия - колумбитом M(NbO3)2.
Получение. Ниобий и тантал получают электролизом
оксидов Э2О5 в расплавленных комплексных фторидах, например, K2[TaF7],
K2[NbF7].
Вследствие близости свойств ниобия и тантала их
отделение друг от друга представляет значительные трудности. Особо чистые
металлы получают термическим разложением иодидов.
Для получения ванадия, ниобия и тантала их
природные соединения сначала переводят в оксиды либо в простые или комплексные
галогениды, которые далее восстанавливают металлотермическим методом:
V2O3 + 3Ca =
3CaO + 2V;2[NbF7] + 5 Na = 2KF + 5 NaF + Nb.
Для технических целей обычно выплавляют
феррованадий, феррониобий и ферротантал. Основной потребитель ванадия - черная
металлургия. Физико-химические свойства V,
Nb и Ta
позволяют использовать их при создании атомных реакторов. Ниобий в большей
степени, чем тантал представляет интерес как конструктивный материал для особо
агрессивных сред в химической промышленности.
Cвойства. Элементы V,
Nb, Ta
- серые тугоплавкие металлы с объемноцентрированной решеткой. Физико-химические
свойства ванадия, ниобия и тантала существенно зависят от их чистоты. Например,
чистые металлы ковки, тогда как примеси (особенно О, Н, N и С) сильно ухудшают
их пластичность и повышают твердость.
В обычных условиях V
и особенно Nb и Та
отличаются высокой химической стойкостью. Ванадий на холоду растворяется лишь в
царской водке и концентрированной HF,
а при нагревании - в HNO3
и в концентрированной H2SО4.
2V +6HF = 2VF3 +3H2;+4H2SO4
(конц)
= VOSO4 +2SO2 +3H2O;+ 6H2NO3
(конц)
= VO2SO3 +5NO2 +3H2O;
V + 5H2NO4 (конц)
+3HCℓ= 3VO2Cℓ + 5NO2 +4H2O.
В данных реакциях ванадий окисляется до V(III)
и V(V)
соответственно
Ниобий и тантал растворяются в смеси
фтороводородной и азотной кислот с образованием отвечающих их высшей степени
окисления анионных фторокомплексов:
3Та
+ 5HNO3 + 21 HF = 3H2[TaF7] + 5NO + 10H2O.
Ванадий, ниобий и тантал взаимодействуют также
при сплавлении со щелочами в присутствии окислителей, т.е. в условиях,
способствующих образованию отвечающих их высшей степени окисления анионных
оксокомплексов:
Э + 5О2 + 12KOH = 4K3[ЭO4]
+ 6H2O.
При нагревании металлы окисляются кислородом до
Э2О5, фтором - до ЭF При высокой температуре они
реагируют также с хлором, азотом, углеродом и др.
Ванадий, ниобий и тантал между собой и с
металлами, близко расположенными к ним в периодической системе элементов
(подгруппы железа, титана и хрома), образуют металлические твердые растворы. По
мере увеличения различий в электронном строении взаимодействующих металлов
возможность образования твердых растворов уменьшается, а интерметаллических
соединений, например типа Co3V,
Fe3V,
Ni3V,
Aℓ2V
и др., - возрастает.
Интерметаллические соединения ванадия и его
аналогов придают сплавам ценные физико-химические свойства. Так, ванадий резко
повышает прочность, вязкость и износоустойчивость стали. Ниобий придает сталям
повышенную коррозионную стойкость и жаропрочность. В связи с этим большая часть
добываемого ванадия и ниобия используется в металлургии для получения
инструментальной и конструкционной сталей.
Сплавы на основе карбидов, нитридов, боридов и
силицидов ниобия и тантала отличаются твердостью, химической инертностью и
жаростойкостью.
Соединения V(II).
Из производных соединений, в которых элементы подгруппы ванадия проявляют степень
окисления +2, относительно более устойчивы соединения ванадия. Координационное
число ванадия (II)
равно 6, что отвечает октаэдрическому строению его структурных единиц в
соединениях.
Оксид ванадия (II)
VO имеет
кристаллическую решетку типа NaCℓ.
Он серого цвета, обладает металлическим блеском и сравнительно высокой
электрической проводимостью. Получают VO
восстановлением V2О5
в токе водорода. С водой VO
не взаимодействует, но как основной оксид довольно легко реагирует с
разбавленными кислотами:
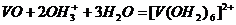 .
.
Ион [V(ОН2)6]2+
фиолетового цвета. Такую же окраску имеют кристаллогидраты, например M2SO4,VSO4∙6H20,
VSO4∙7H2O,
VCℓ2∙6H2O.
Соединения V(II)
- сильные восстановители. Фиолетовые растворы производных [V(ОН2)6]2+
довольно легко окисляются до [V(OH2)6]3+,
и их окраска становится зеленой. В отсутствие окислителей (например, кислорода
воздуха) растворы соединений V(II)
постепенно разлагают даже воду с выделением водорода.
Производные Nb(II)
и Та(II) относятся
к соединениям кластерного типа.
Соединения V(III).
Координационное число ванадия (III)
равно 6. По структуре соединения V(III)
аналогичны однотипным производным Аℓ(III). Черный оксид ванадия (III)
V2O3
имеет кристаллическую решетку типа корунда а-Аℓ2О3.
Из щелочных растворов соединений V(III)
выделяется зеленый гидроксид V(ОН)3 переменного состава V2O3
∙ nH2О. Эти соединения амфотерны, но с преобладанием основных
свойств. Так, V2O3 и V(OH)3
растворяются в кислотах:
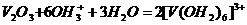 .
.
Образующиеся аквакомплексы [V(OH2)6]3+
и производимые от них кристаллогидраты VСℓ3∙6Н2О,
VI3
∙ 6Н2О имеют зеленую окраску. Фиолетовую окраску имеют
ванадиевые квасцы M+1[V(S04)2]
∙ 12H2O,
которые при растворении дают зеленые растворы.
Тригалогениды ванадия VHaℓ3
- кристаллические вещества. Трихлорид VCℓ3
имеет слоистую структуру. С соответствующими основными галогенидами VHaℓ3
образуют галогенованадаты -производные ионов [VHaℓ6]3-
и [V2Cℓ9]3-:
KF + VF3
= K3[VF6];
KCℓ + 2VCℓ3
= K3[V2Cℓ9].
Производные ванадия (III)
- сильные восстановители; в растворах они довольно легко окисляются кислородом
воздуха до производных V(IV).
Тригалогениды при нагревании диспропорционируют:
VCℓ3(к)
= VCℓ2(к)
+ VCℓ4(г).
Эта реакция эндотермична, и ее протекание
обусловлено энтропийным фактором (за счет образования летучего VCℓ4).
Производные Nb(III)
и Та(III) в основном
относятся к соединениям кластерного типа.
Соединения V(IV).
При обычных условиях степень окисления +4 для ванадия наиболее характерна.
Соединения V(III)
довольно легко окисляются до производных V(IV)
кислородом, а соединения V(V)
восстанавливаются до производных V(IV).
Координационное число ванадия (IV)
равно 6, а также 4
Из производных V(IV)
известны синий VО2,
коричневый VF4
и
красно-бурый VCℓ4,
а также оксогалогениды типа VOHaℓ2.
Диоксид VО2
образуется при осторожном восстановлении V2O5
водородом, a тетрахлорид
ванадия VCℓ4-
при окислении ванадия (или феррованадия) хлором.
Диоксид ванадия имеет кристаллическую решетку
типа рутила ТiO2. Молекула VCℓ4,
как и молекула ТiCℓ4, имеет тетраэдрическую форму.
По сравнению с однотипными производными V(II)
и V(III),
бинарные соединения V(IV)
проявляют кислотные свойства более отчетливо. Так, нерастворимый в воде VO2
относительно легко взаимодействует при нагревании со щелочами. При этом
образуются оксованадаты (IV)
бурого цвета, чаще всего состава M2[V4O9]:
4VO2 + 2KOH = K2[V4O9]
+ H2O.
Еще легче VO2
растворяется в кислотах. При этом образуются не простые аквакомплексы V4+,
а аквапроизводные оксованадила VO2+,
характеризующиеся светло-синей окраской:
VO2
+ 2H+ +4H2O
= [VO(OH2)5]2+.
Таблица 6.3 Кислородные соединения элементов
подгруппы ванадия
|
Обозначение
элемента
|
Степень
окисления
|
Оксиды
|
Гидрооксиды
|
Соли
|
|
|
Формула
|
Характер
|
Формула
|
Название
|
Формула
иона
|
Название
|
|
V
|
+2
|
VO
|
Основной
|
V(OH)2
|
Гидроксид
ванадия(II)
|
V2+
|
Соли
ванадия(II)
|
|
+3
|
V2O3
|
Основной
|
V2O3∙nH2O
|
Гидроксид
ванадия(III)
|
V3+
|
Соли
ванадия(III)
|
|
+4
|
VO2
|
Амфотерный
|
VO2∙nH2O
|
Гидрооксид
ванадия(IV)
|
VO2+
|
Соли
ванадила
|
|
+5
|
V2O5
|
Кислотный
|
HVO3
|
Ванадиевая
кислота
|
VO-3
|
Ванадаты
|
|
Nb
|
+5
|
Nb2O5
|
Кислотный
|
HNbO3
|
Ниобиевая кислота
|
NbO-3
|
Ниобаты
|
|
Ta
|
+5
|
Ta2O5
|
Кислотный
|
HTaO3
|
Танталовая кислота
|
TaO-3
|
Танталаты
|
Для V(IV)
весьма типичны производные анионных комплексов оксованадила типа K2[VOF4],
(NH4)3[VOF5].
Тетрагалогениды ванадия легко гидролизуются. Так,
в воде VCℓ4
мгновенно переходит в VOCℓ2
(дихлорид ванадила):
VCℓ4
+ H2O
= VOCℓ2
+ 2HCℓ.
Для ниобия и тантала известны диоксиды ЭО2
и тетрагалогениды ЭНаℓ4. В этих соединениях проявляется связь
металл - металл, т.е. они относятся к кластерам.
Соединения V(V),
Nb(V),
Ta(V).
В ряду V(V)
- Nb(V)
- Ta(V)
устойчивость кислородных соединений возрастает. Об этом, в частности,
свидетельствует сопоставление энергий Гиббса образования однотипных соединений,
например:
Таблица 6.4
|
V2O5(к)
|
Nb2O5(к)
|
Та2О5(к)
|
|
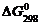 ,
кДж/моль ,
кДж/моль
|
-1427
|
-1776
|
-1908
|
Для ванадия (V)
известны лишь оксид V2О5
и фторид VF5,
тогда как для ниобия (V)
и тантала (V) известны и все
другие галогениды ЭНаℓ Для ванадия (V),
характерны оксогалогениды типа ЭОНаℓ3. Все указанные
соединения типично кислотные. Некоторые отвечающие им анионные комплексы
приведены ниже:
Таблица 6.5
|
ЭF5
|
ЭOF3
|
Э2O5
|
|
[ЭF6]-
|
[ЭOF5]2-
|
[ЭO4]3-,
[ЭО3]-
|
Оксиды - красный V2O5
(т. пл. 670 °С), белый Nb2O5
(т. пл. 1490 °С) и Та2О5 (т. пл. 1870 °С) - тугоплавкие
кристаллические вещества. Оксиды имеют высокие энтальпии образования и энергии
Гиббса. Значения ДHo298 и ДGo298
для Nb2O5
и Та2O5 близки (следствие лантаноидного сжатия) и заметно
отличаются от таковых для V2O
Оксид ванадия (V) получают
термическим разложением NН4VО3:
NH4VO3
= V2O5
+ 2NH3
+ H2O.
Он весьма плохо растворим в воде (0,007 г/л при
25 °С), образует кислый раствор светло-желтого цвета, довольно легко
растворяется в щелочах, а в кислотах - лишь при длительном нагревании. Оксиды Nb
(V) и Та (V)
химически неактивны, в воде и кислотах практически не растворяются, а со
щелочами реагируют лишь при сплавлении:
Э2О5 + 2KOH
= 2KЭO3
+ H2O
Оксованадаты (V),
оксониобаты (V) и оксотанталаты (V)
- кристаллические вещества сложного состава и строения. О многообразии и
сложности состава можно судить по характеру соответствующих диаграмм плавкости.
Соединения типа М+1ЭО3 и М+13ЭО4,
в большинстве своем это полимерные соединения. Так, NaNbO3
кристаллизуется по типу перовскита, a
Fe(NbO3)2,
Мn(ТаО3)2
являются смешанными оксидами со структурой типа рутила. В воде растворимы лишь
производные s-элементов первой группы и NH+4.
Из ванадатов наибольшее значение имеет NH4VO3
- исходное вещество для получения других соединений ванадия.
Пентагалогениды ванадия, ниобия и тантала
легкоплавки, летучи, растворяются в органических растворителях, химически
активны.
Пентафторид ванадия VF5
- вязкая жидкость (т. пл. 19,5 °С), по строению подобен SbF
Будучи кислотными соединениями, пентагалогениды легко гидролизуются, образуя
аморфные осадки гидратированных оксидов:
VCℓ5
+ 5H2O
= V2O5
+ 10HCℓ.
Галогениды Э(V)
реагируют с соответствующими основными галогенидами с образованием анионных
комплексов [ЭF6]-, например:
KF + VF5
= K2[VF6];
2KF + TaF5
= K2[TaF7]
Оксогалогениды легко гидролизуются с
образованием гидратированных оксидов Э2O5∙nН2О
и HНaℓ
ЭОНаℓ3 + 3Н2О = Э2О5
+ 6 ННаℓ.
VOF3+3H2O=V2O5+6HF.
Оксогалогениды вступают также во взаимодействие
с основными галогенидами, например:
KF + VOF3
= K2[VOF5];
KF + NbOF3
= K2[NbOF6].
При взаимодействии с водными растворами,
содержащими KF и HF,
Nb2O5
дает K2[NbOF5],
а Та2О5 образует K2[TaF7]:
Nb2O5
+ 4KF + 6HF
= 2K2[NbOF5]
+ 3H2O;
Ta2O5
+ 4KF + 10HF
= 2K2[TaF7]
+ 5H2O.
Производные ванадия (V)
в кислой среде проявляют окислительные свойства, например, окисляют
концентрированную соляную кислоту:
V2O5
+ 6HCℓ = 2VOCℓ2
+ Cℓ2
+ 3H2O.
Для перевода же ниобия (V)
и в особенности тантала (V)
в более низкие степени окисления требуются энергичные восстановители и
нагревание.
Соединения ванадия используются в химической
промышленности в качестве катализаторов (производство серной кислоты), а также
применяются в стекольной и других отраслях промышленности.
Применение ванадия, ниобия и тантала. Тантал с
его высокой газопоглотительной способностью и высокими конструкционными
качествами - один из лучших вакуумных материалов. Из его компактных заготовок,
отожженных в вакууме, вытягивают проволоку диаметром 0,15 мм и выше, прокатные
листы толщиной от 0,03 до 0,2 мм, изготовляют бесшовные тянутые трубки
диаметром 15-40 мм с толщиной стенок 0,3 - 2,0 мм и длиной до 700 мм. Тантал
применяют для изготовления катодов косвенного накала, анодов и сеток
генераторных ламп. При 600-700оС освобожденный от газа тантал
начинает поглощать газы, выделяемые другими деталями вакуумных приборов. Эти
газы прочно удерживаются танталом до температур порядка 1250оС, что
и определяет рабочие температуры вакуумных приборов с деталями из тантала,
которые улучшают и поддерживают вакуум.
Ниобий применяют главным образом в виде
танталониобиевых сплавов. Тантал ввиду его исключительной пассивности
используют в химическом машиностроении, а также для изготовления медицинских
инструментов. Благодаря тому что тантал способен срастаться с живыми тканями,
не вызывая болезненных явлений, им пользуются для замены участков поврежденных
костей в человеческом организме.
Карбиды ниобия и тантала применяют в твердых
жаропрочных сплавах, а нитрид ниобия NbN
- в радиотехнике и автоматике в качестве детектора радиоволн, в конструкциях
трубок для передачи изображений, для сверхпроводящих болометров
(высокочувствительных приборов для измерения лучистой энергии). В этих случаях
используют способность нитрида ниобия переходить в сверхпроводящее состояние
при 15К. Добавление NbC
к NbN повышает точку
перехода в сверхпроводящее состояние до 17,8 К.
Ванадий как таковой, а также феррованадий
используют для улучшения свойств специальных сталей, идущих на изготовление
паровозных цилиндров, автомобильных и авиационных моторов, осей и рессор
вагонов, пружин, инструментов и т.д. Малое содержание ванадия, подобно титану и
марганцу способствует раскислению сталей, а большое - увеличивает твердость
сплавов. Ниобий и тантал, как дорогие материалы, применяют для легирования
сталей только в тех случаях, когда необходима устойчивость по отношению к
высокой температуре и активным реагентам. Сплавы алюминия с присадкой ванадия
используют как твердые, эластичные и устойчивые к действию морской воды
материалы в конструкциях гидросамолетов, глиссеров, подводных лодок. Ниобий и
ванадий - частые компоненты жаропрочных сплавов. Ниобий применяют при сварке
разнородных металлов; V2O5
служит хорошим катализатором для получения серной кислоты контактным методом.
Свойства Ta2O5
используют для изготовления из него высококачественных электролитических
танталовых конденсаторов и выпрямителей, лучших, чем алюминиевые.
7. Элементы VIБ
группы (подгруппа хрома)
Шестую побочную подгруппу (подгруппа хрома)
образуют металлы: хром, молибден, вольфрам и искусственно полученный сиборгий.
Электронная конфигурация хрома и молибдена имеет
вид (n-1)d5ns1,
вольфрама (n-1)d4ns2.
Внешняя электронная оболочка атомов элементов содержит один или два электтрона,
что обуславливает металлический характер этих элементов и их отличие от
элементов главной подгруппы. Максимальная степень окисления у элементов
подгруппы хрома равна шести, так как, помимо внешнгих электронов
Как видно из приведенных в табл. 37 данных в
ряду Cr - Mo
- W увеличивается
энергия ионизации, т.е. уплотняются электронные оболочки атомов, в особенности
при переходе от Mo
к W. Вольфрам,
вследствие лантаноидного сжатия, имеет атомный радиус, близкий к атомному
радиусу молибдена.
В ряду Cr
-Mo -W
наблюдается повышение температуры плавления. Это объясняется усилением в
металле ковалентной связи, возникающей за счет d-электронов.
Вольфрам - самый тугоплавкий из всех металлов. Как и в других подгруппах d-элементов,
с ростом атомного номера элемента в ряду Cr
- Mo - W
химическая активность элементов заметно понижается.
Таблица 7.1 Свойства элементов подгруппы хрома
|
Свойства
|
Хром,
Cr
|
Молибден,
Mo
|
Вольфрам,
W
|
|
Содержание
в земной коре, % (масс.)
|
8∙10-3
|
6∙10-5
|
1∙10-5
|
|
Плотность,
г/см3
|
7,2
|
10,2
|
19,3
|
|
Тпл,
◦С
|
1890
|
2620
|
3380
|
|
Ткип,
◦С
|
2642
|
4830
|
5930
|
|
Энергия
ионизации, эВ
|
6,77
|
7,10
|
7,98
|
|
Атомный
радиус, нм
|
0,127
|
0,137
|
0,140
|
|
Характерные
степени окисления
|
+2,
+3, +6
|
+4,
+6
|
+4,
+6
|
|
Стандартный
электродный потенциал, В
|
-0,744(Cr3+/Cr)
|
-0,2(Mo3+/Mo)
|
-0,15(W+3/W)
|
Природные ресурсы. Эти элементы встречаются
только в виде соединений. Основной минерал хрома - хромит, или хромистый
железняк FeO∙Cr2O3; молибдена - молибденит MoS2;
вольфрама - шеелит CaWO4,; (Fe,Mn)WO4
- вольфрамит.
Получение. В промышленности получают как чистый
хром, так и его сплав с железом (феррохром). Чистый хром получают
восстановлением его оксида алюминием:
Cr2O3
+ 2Al = Al2O3+2Cr
или кремнием:
Cr2O3
+ 3Si + 3CaO
→
4Cr + 3CaSiO3
(добавление СаО предотвращает образование
силицидов).
Хром получают восстановлением хромистого
железняка алюминием:
3FeO∙Cr2O3
+ 8Al = 3Fe + 6Cr + 4Al2O3.
Для производства молибдена молибденовые руды
подвергают флотации и перерабатывают пирометаллургическим методом:
2MoS2 + 7O2→
2MoO3 + 4SO2
MoO3 + 3H2 =
Mo + 3H2O.
Молибден выделяется в виде порошка.
Вольфрам получают восстановлением WO3
водородом при 850-1200°С и последующим спеканием образовавшегося порошка:
WO3
+ 3H2
→ W + 3H2O.
Свойства. Cr,
Mo, W
- парамагнитные серебристо-белые металлы, очень твердые (царапают стекло) и
тугоплавкие. Вольфрам - самый тугоплавкий из металлов.
Рассматриваемые металлы стоят в ряду напряжений
перед водородом, однако они мало подвержены коррозии благодаря образованию на
их поверхности тонкой оксидной пленки. Хром растворяется в разбавленной соляной
и серной кислотах с образованием солей хрома (II)
Cr + 2HCl = CrCl2 + H2↑;+
H2SO4 = CrSO4 + H2↑.
Соединения хрома (II)
неустойчивы и легко окисляются до соединений хрома (III).
В отличие от железа, которое пассивируется
только концентрированной НNО3, пассивирование хрома вызывается как
концентрированной, так и разбавленной НNО3, царской водкой, а также
другими сильными окислителями.
Молибден растворяется в азотной кислоте, царской
водке и концентрированной серной кислоте:
Мо + 2НNО3
= МO3
+2NO + H2O
Вольфрам растворяется царской водке и смеси
плавиковой и азотной кислот:
W + 8HF + 2HNO3 = H2[WF8]
+ 2NO + 4H2O.
В присутствии окислителей Cr,
Mo, W
реагируют со щелочными расплавами:
Э + 3NaNO3
+ 2NaOH = Na2ЭO4
+ 3NaNO2
+ H2O;
W + 3NaNO3
+ 2NaOH = Na2WO4
+ 3NaNO2
+ H2O;
↑вольфрамат
натрия
2Mo+2Na2CO3+3O2→2Na2MoO4+2CO2.
↑молибдат
натрия
При нагревании Cr,
Мо и W начинают
окисляться кислородом воздуха (с образованием оксидов), фтором (с образованием
фторидов CrF3, MoF6,
WF6),
хлором (с образованием хлоридов CrCl3,
MoCl6,
WCl6),
и другими простыми веществами (халькогенами, пниктогенами).
Cr + 3/2О2
= Cr2О3;
W+3O2 = 2WO3;
Мо+3О2 = МоО3;
Cr + 3F2
= 2 CrF3;
Mo + 3F2 = MoF6;
+ 3Cl2 = 2CrCl3.
Оксиды молибдена и вольфрама летучи, их пленки
не защищают металл от дальнейшего окисления. Кислородные соединения хрома,
молибдена, вольфрама приведены в табл. 7.2
Таблица 7.2 Кислородные соединения элементов
подгруппы VIБ
|
Название
элемента
|
Степень
окисления
|
Оксиды
|
Гидрооксиды
|
Соли
|
|
|
Формула
|
Характер
|
Формула
|
Название
|
Формула
иона
|
Название
|
|
Хром,
Сr
|
+2
|
СrO
|
Осн.
|
Сr(OH)2
|
Сr2+
|
Соли
хрома (II)
|
|
+3
|
Сr2O3
|
Амфотерный
|
Сr(OH)3
|
Гидроксид
хрома (III)
|
Сr3+
|
Соли
хрома (III)
|
|
|
|
|
НСrO2
|
Хромистая
кислота
|
СrО2-
|
Хромиты
|
|
|
|
|
Н3[Сr(OH)6]
|
Гексагидроксохромит
водорода
|
[Сr(ОH)6]3-
|
Гексагидросохромиты
|
|
+6
|
СrO3
|
Кисл.
|
Н2СrO4
|
Хромовая
кислота
|
СrО42-
|
Хроматы
|
|
|
|
|
Н2Сr2O7
|
Дихромовая
кислота
|
Сr2О72-
|
Дихроматы
|
|
Молибден,
Mo
|
+6
|
МоO3
|
Кисл.
|
Н2МоO4
|
Молибденовая
кислота
|
МоO42-
|
Молибдаты
|
|
Вольфрам,W
|
+6
|
WO3
|
Кисл.
|
Н2WO4
|
Вольфрамовая
кислота
|
WO42-
|
Вольфраматы
|
Все эти металлы взаимодействуют с углеродом,
образуя карбиды W2C, WC, Mo2C, MoC.
При расчтворении хрома в соляной кислоте
получается раствор голублгл цвета, содержащий хлорид хрома СrCl2.
Если к этому раствору прилить щелочь, то выпадает желтый осадок гидроксид хрома
(II) Сr(ОН)2.
Бинарные соединения хрома (II),
а также Cr(ОН)2 проявляют основные свойства. Оксид CrО получить
трудно. Гидроксид Cr(ОН)2 (желтый) взаимодействует только с
кислотами:
(ОН)2 + 2ОН3+ +
2Н2О = [Cr(ОН2)6 ]2+,
образующиеся при этом аквакомплексы имеют синий
цвет, такую же окраску имеют кристаллогидраты, например, Cr(CℓO4)2∙6H2O.
Будучи сильными восстановителями соли хрома (II)
в растворах легко окисляются кислородом воздуха:
4[Cr(OH2)6]2+
+ O2 +4H+ = 4 [Cr(OH2)6]3+
+ 2H2O,
а при отсутствии окислителя даже восстанавливают
воду:
CrCℓ2
+ 2H2O
= 2Cr(OH)Cℓ2
+ H2;
 В.
В.
Оксид хрома (III) Cr2O3
получают при прокаливании Cr(OН)3, (MH4)2Cr2O7,
Cr(NO3)3 ∙ nH2O, например:
Cr(OH)3 Cr2O3
+ 3H2O;
Cr2O3
+ 3H2O;
(MH4)2Cr2O7 Cr2O3 + N2 +4H2O.
Cr2O3 + N2 +4H2O.
Оксид хрома (III) Cr2O3 -
темнозеленый порошок, а в кристаллическом состоянии - черный с металлическим
блеском.
Оксид хрома (III) тугоплавок (т.пл. 2265оС),
химически инертен; в воде, кислотах, щелочах не растворяется. Его амфотерная
природа проявляется при сплавлении с соответствующими соединениями. При
сплавлении же Cr2O3 со щелочами и соответствующими
основными оксидами образуются оксохроматы (III),
называемые хромитами:
КОН + Cr2O3 = 2КСrO2
+ Н2О.
кислотный
присплавливании с силикатами оксид хрома (III)
окрашивает их в зеленый цвет. Поэтому служит для окраски стекла и фарфора.
Гидроксид хрома (III)
образуется при взаимодействии солей хрома (III)
со щелочами:
CrCℓ3+3NaOH=Cr(OH)3+3NaCℓ.
Гидроксохроматы (III)
получаются также при обработке солей хрома (III)
избытком щелочи
CrCl3+6NaOH→Na3[Cr(OH)6]+3NaCℓ.
Гидроксид хрома (III)
амфотерен и при растворении в растворах щелочей образует гидроксохромиаты:
Cr(OH)3+3Na(OH)=
Na3[Cr(OH)6].
Гидроксид хрома (III)
имеет переменный состав Cr2O3
∙
nH2O.
Это многоядерный слоистый полимер, в котором роль лигандов играют группы ОН-
и OH2,
а роль мостиков - ОН-группы. Свежеполученный Cr(OH)3
- аморфный осадок. Хорошо растворяется в присутствии кислот и щелочей, которые
вызывают разрыв связей в полимерах:
Cr(OH)3
+ 3ОН+3 = [Cr(H2O)6]+3
(сине-фиолетовый раствор),
основной
Cr(OH)3
+ 3ОН- = [Cr(OH)6]3-
(изумрудно-зеленый раствор).
кислотный
Получение гидроксида хрома (III) и его переход в
катионные [Cr(H2O)6]+3 и анионные [Cr(OH)6]3-
комплексы можно выразить суммарным уравнением:
ОН+3 ОН-
[Cr(H2O)6]+3
D Cr(OH)3
D [Cr(OH)6]3-.
Соединения хрома (III)
проявляют восстановительные свойства:
Cr2(SO4)3
+ KClO3 + 10KOH = 2K2CrO4 + 3K2SO4
+ KCl +5H2O
Аквакомплекс [Cr(OH2)6]3-
входит в состав ряда кристаллогидратов, например, в хромокаливые квасцы KCr(SO4)2
∙12H2O.
Триоксиды
- кристаллические вещества: СrО3
(темно-красный), МоО3 (белый), WO3
(желтый).
При нагревании СrО3 довольно легко
разлагается, выделяя кислород, а МоО3 и WO3 в газовую
фазу переходят без разложения. Триоксид хрома - энергичный окислитель; со
многими окисляющимися веществами он реагирует со взрывом. Триоксид хрома СrО3
ядовит.
Триоксид хрома СrО3 в отличие от МоО3
и WO3 легко растворяется в воде, образуя хромовую кислоту, т.е.
является кислотным оксидом:
СrО3 + Н2О =Н2СrО4.
Кислотная природа МоО3 и WO3
проявляется при растворении в щелочах:
КОН + МоО3 = К2МоО4
+ Н2О.
Тетраоксохромат (VI)
водорода Н2СrО4
в свободном состоянии не выделен. В водном растворе - это сильная кислота; она
называется хромовой.
Растворимы в воде оксохроматы (VI),
оксомолибдаты (VI) и оксовольфраматы (VI) s-элементов первой группы, а также Mg2+
и Ca2+. Ионы 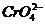 имеют желтую
окраску, ионы
имеют желтую
окраску, ионы 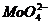 и
и 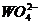 бесцветны.
бесцветны.
Для Мо (VI) и W (VI) известны многочисленные
производные полимерных оксоанионов весьма сложного состава и строения.
Способность к полимеризации иона 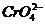 выражена
менее отчетливо, тем не менее известны, например, K2Cr2O7
- дихромат, K2Cr3O10
- трихромат, K2Cr4O13
- тетрахромат.
выражена
менее отчетливо, тем не менее известны, например, K2Cr2O7
- дихромат, K2Cr3O10
- трихромат, K2Cr4O13
- тетрахромат.
Полихроматы образуются при действии кислот на
хроматы. Так, если на концентрированный раствор хромата калия подействовать
кислотой, то его окраска сначала станет красно-оранжевой, потом изменится до
более темной за счет образования дихроматов, затем трихроматов и т.п.
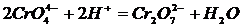 ;
;
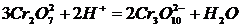 .
.
В результате подкисления раствора дихромата
калия концентрированной серной кислотой при охлаждении выделяются темно-красные
кристаллы триоксида хрома:
K2CrO4 + H2SO4
= CrO3 + K2SO4 + H2O.
Если же действовать на растворы полихроматов
щелочью, процесс идет в обратном направлении и, в конечном счете, получается
снова хромат. Взаимные переходы хромата и дихромата можно выразить уравнением
обратимой реакции:
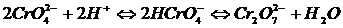 .
.
Соединения хрома (VI)
- сильные окислители, они переходят в окислительно-восстановительных процессах
в производные Сr (III).
В нейтральной среде образуется гидроксид хрома (III).
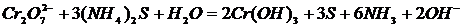 ;
;
в кислой среде - производные катионного
комплекса [Cr(H2O)6]+3:
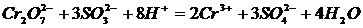 ,
,
в щелочной - производные анионного комплекса [Cr(OH)6]3-:
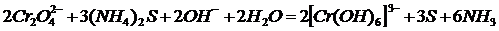 .
.
Наибольшая окислительная активность оксохроматов
(VI) наблюдается в
кислой среде:
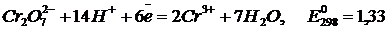 В.
В.
Окислительная способность соединений хрома (VI)
используется в химическом анализе и органическом синтезе.
Окислительные свойства производных Мо(VI)
и W(VI)
проявляются лишь при взаимодействии с наиболее сильными восстановителями,
например с водородом, в момент его выделения.
Из производных хрома и его аналогов применяются
главным образом соединения самого хрома. Так, оксид хрома (III)
Cr2O3 используется для приготовления красок в качестве
катализатора, CrO3 - для электролитического получения хрома и
хромированных изделий.
.1 Биологическая роль элементов VIБ группы
Хром Cr,
молибден Mo, вольфрам W
- микроэлементы живых организмов.
Хром обнаруживается в растительных и животных
организмах. В организме взрослого человека содержится примерно 6 г Cr (0,1%).
Металлический хром нетоксичен, в соединениях Cr
(III) и Cr(VI)
опасны для здоровья. Они вызывают раздражение кожи, что приводит к дерматитам.
Есть предположение, что производные Cr(VI)
обладают канцерогенными свойствами. 0,25-0,3 дихромата калия вызывают летальный
исход. Соединения хрома (VI)
применяются как фунгициды (протравливающие вещества, фунгис - гриб, цедере -
убивать). Соединения хрома (III) благоприятно влияют на рост растений.
Нельзя пройти мимо аномальных свойств
металлического хрома. При 37оС у него резко меняется модуль
упругости, коэффициент линейного расширения, внутреннее трение, электросопротивление.
Такое поведение ждет своего объяснения и, возможно, найдет применение в
медицине. Молибден - относится к металлам жизни, является одним из важнейших
биоэлементов.
В биохимических процесса молибден участвует в
степенях окисления V и VI. В этом состоянии он создает устойчивые оксоформы.
Молибден образует устойчивые оксокомплексы: [МоО3(ОН)2]
и, видимо, поэтому входит в состав ферментов, обеспечивающих перенос оксогрупп.
В крови преобладает Мо(VI),
если лигандом будет кислород, то образуются устойчивые изополимолибдат-ионы:
Избыточное содержание молибдена в пище нарушает
метаболизм Са+ и РО43-, вызывая снижение
прочности костей - остеопарозы.
Возможно, происходит связываниеМоО42-
и РО43- в форномолибденовые комплексы состава [РМо12О40]3-,
[РМо11О39]7-, [Р2Мо17О61]10-.
Такие комплексы можно рассматривать как кислотные остатки
гетерополимолибденовых кислот. С кальцием эти остатки дают нерастворимые
кристаллики. Не исключено. Что эти користаллики инициируют отложение солей
мочевой кислоты и вызывают заболевание подагрой. Подагра деформирует суставы,
оправдывая свой буквальный перевод, как «капкан для ног».
Кроме кислородных комплексов, молибден образует
галогенидные (Наl-),
тиоцианатные (NCS-) и цианидные (CN-)
комплексы.
Молибден входит в состав различных ферментов.
Молибден является важнейшим микроэлементом
растений, так как биологически активные вещества с его участием обеспечивают
мягкую фиксацию азота: превращают в аммиак или азотосодержащие продукты. По
сравнению с другими промышленно важными металлами молибден малотоксичен.
Потребление молибдена с продуктами питания 0,1-0,3 мг/сут, но необходимое
дневное поступление не установлено. Дефицит молибдена вызывает уменьшение
активности ксантиндегидрогеназы в тканях. Избыточное содержание молибдена
вызывает остеопорозы.
Вольфрам - микроэлемент. Его роль в организме
изучена недостаточно. Анионная форма вольфрама легко адсорбируется в
желудочно-кишечном тракте. Металлический вольфрам и его катионные формы не
адсорбируется в организме. О гомеостазе вольфрама у млекопитающих сведений нет.
8. Элементы группы VIIБ (подгруппа марганца)
Седьмую побочную подгруппу образуют металлы:
марганец, технеций, рений и искусственно полученный борий.
Мn,
Тс, Re - полные электронные аналоги с конфигурацией валентных электронов (n-l)d5
ns2. Некоторые сведения об этих элементах приведены в табл. 8.1.
Таблица 8.1 Свойства элементов подгруппы VIIБ
|
Свойства
|
Элементы
|
|
Mn
|
Tc
|
Re
|
|
Содержание
в земной коре, % (масс.)
|
3,2∙10-2%
|
следы
|
8,5∙10-9%
|
|
Валентные
электроны
|
3d54S2
|
4d55S2
|
5d56S2
|
|
Атомный
радиус, нм
|
0,130
|
0,136
|
0,137
|
|
Энергия
ионизации, эВ
|
7,44
|
7,28
|
7,88
|
|
Температура
плавления Тпл, оС
|
1245
|
2200
|
3180
|
|
Температура
кипения Ткип, °С
|
2120
|
4600
|
5640
|
|
Плотность,
г/см3
|
7,4
|
11,5
|
21,0
|
|
Стандартный
электродный потенциал Е0, В
|
-1,179 (Mn+2/Mn)
|
0,47
(TcO4-/Tc)
|
0,37 (ReO4-/Re)
|
|
Характерные
степени окисления
|
+2,+3,+4,+6,+7
|
+7
|
+7
|
Как видно, атомные радиусы технеция Тс и рения
Re близки (следствие лантаноидного сжатия), поэтому их свойства более сходны между
собой, чем марганца. Возрастание температур плавления и кипения в ряду Mn-Tc-Re
объясняется усилением доли ковалентной связи за счет электронов (n-1)
d орбитали. По
тугоплавкости рений уступает только вольфраму. Технеций Тс получен из молибдена
в небольших количествах в процессе ядерных реакций в 1937году и мало изучен.
Рений был получен в 1924 году и изучен довольно хорошо. Он похож на вольфрам и
платиновые металлы, пассивен в обычных условиях. Эти металлы тугоплавки, не
летучи.
Природные ресурсы. Важнейшее природное
соединение марганца - пиролюзит - МnО2.
Марганец в виде оксидов содержится в железных рудах.Рений содержится в виде
примеси в диоксиде молибдена MoO2.
Чистый марганец получают восстановлением его
оксидов углеродом и кремнием:
MnO2
+ 2C →Mn
+ 2CO.
Сплав марганца с железом - ферромарганец
получают аналогично из смеси пиролюзита с оксидами железа.
Марганец получают электролизом водного раствора
MnSO4. Небольшое количество марганца в лаборатории легко получить,
используя алюмотермический метод:
ЗМn3О4+8А1
→ 9Мn + 4А12О3;
МnО∙Мn2О3.
Рений выделяют из отходов переработки руд
молибдена и других металлов, предварительно его концентрируя. Чистый рений
получают восстановлением перрената калия:
KReO4+7H2
→ 2KOH+2Re+6H2O
Рений получают в виде полиморфного порошка.
Технеций, был получен искусственным путем бомбордировкой ядер атомов молибдена
ядрами тяжелого изотопа водорода - дейтронами.
Свойства. Марганец, технеций, рений -
серебристо-белые, твердые, тугоплавкие металлы. При переходе от марганца к
рению увеличивается устойчивость соединений с высшей степенью окисления
элементов и усиливается тенденция к образованию кислотных оксидов и кислот.
Марганец сохраняет устойчивость при нагревании на воздухе благодаря образованию
защитной пленки Мn2О3.
При нагревании технеция и рения в присутствии кислорода образуются летучие
оксиды Tc2O7
и Re2O7, которые не защищают металл от дальнейшего
окисления. Марганец при нагревании разлагает воду, вытесняя водород,
образующийся при этом гидроксид Мn(ОН)2
замедляет реакцию разложения воды Мn
и Re поглощают водород. При 1200°С марганец и рений взаимодействуя с азотом,
образуют различные по составу нитриды. Марганец образует силициды, бориды,
фосфиды. Марганец взаимодействует с кислотами с образованием соответствующих солей.
Мn
+ 2НСℓ = МnСℓ2+Н2↑;
Мn
+ Н2SО4(разб.)
= MnSO4+H2↑;
Мn
+ 2Н2SО4(конц.)
= МnSО4 + SО2↑
+ 2Н2О;
Mn + 8HNO3(paзб.)
= 3Mn(NO3)2 + 2NO↑
+4H2O;
Re + 7HNO3 = 3HReO4
+ 7NO+2H2O.
В табл. 8.2 приведены кислородные соединения
марганца, рения и технеция.
Таблица 8.2 Кислородосодержащие соединения
элементов подгруппы VIIB
|
Название элемента
|
Степень
окисления
|
Оксиды
|
Гидроксиды
|
Соли
|
|
|
Формула
|
Характер
|
Формула
|
Название
|
Формула иона
|
Название
|
|
Марганец,
Mn
|
+2
|
MnO
|
Основной
|
Mn(OH)2
|
Гидроксид
марганца (II)
|
Mn2+
|
Соли
марганца (II)
|
|
+3
|
Mn2O3
|
Основной
|
Mn(OH)3
|
Гидроксид
марганца (III)
|
Mn3+
|
Соли
марганца (III)
|
|
+4
|
MnO2
|
Амфотерный
|
Mn(OH)4
|
Гидроксид
марганца (IV)
|
Mn4+
|
Соли
марганца (IV)
|
|
|
|
|
H2MnO3
|
Оксоманганат
(IV) водорода
|
MnО32-
|
Оксоманганат
(IV)
|
|
|
|
|
|
Марганцеватистая
кислота
|
MnО32-
|
|
|
+6
|
MnO3
|
Кислотный
|
H2MnO4
|
Оксоманганат
(VI) водорода или
марганцовистая кислота
|
MnО42-
|
Оксаманганаты
(VI), манганаты
|
|
+7
|
Mn2O7
|
Кислотный
|
HMnO4
|
Оксоманганат
(VII) водорода или
марганцевая кислота
|
MnО4-
|
Перманганаты,
оксоманганаты (VII)
|
|
Рений,
Re
|
+6
|
ReO3
|
Кислотный
|
Н2ReO4
|
Оксоренат
(VI) водорода
|
ReО42-
|
Oксоренаты (VI)
|
|
+7
|
Re2O7
|
Кислотный
|
НReO4
|
Рениевая
кислота
|
ReО4-
|
Перренты
|
|
|
|
|
|
Тетраоксоренат
(VII) водорода
|
|
Oксоренаты (VII)
|
|
Технеций,
Tc
|
+6
|
Тс2O7
|
Кислотный
|
НТсO4
|
Тетраоксотехнат
(VII) водорода или
технециевая кислота
|
ТсО4-
|
Пертехнататы
|
Оксиды марганца получают термическим разложением
оксидов, солей:
МnСО3
→ МnО+СО2;
МnО2
→ 2Мn2О3+О2.
Оксид марганца МnО
с водой не взаимодействует, но легко реагирует с кислотами: МnО+2НСℓ
= МnСℓ2+Н2О.
Гидроксид Мn(ОН)2
(белого цвета) получают косвенным путем - действием щелочи на раствор соли Мn
(II):
MnSO4+2KOH = Mn(OH)2+K2SO4.
При действии окислителей производные Мn
(II) проявляют восстановительные свойства. Например, на воздухе Мn(ОН)2
окисляется превращаясь в гидроксид марганца (IV)
бурого цвета.
2Мn(ОН)2+О2+2Н2О
= 2Мn(ОН)4;
MnSO4+2KCℓO3+12KOH
= K2Mn+6O4+2KCℓ+3K2SO4+6H2O.
Сильные окислители, такие как диоксид свинца PbO2,
переводят соединения Mn
(II) в оксоманганаты (VII):
2MnSO4 + 5PbO2
+ 6HNO3 = 2HMnO4 + 3Pb(NO3)2 + 2
PbSO4 + 2H2O.
Соли марганца (II)
часто образуют кристаллогидраты, например К2Mn(SO4)2∙4H2O.
Диоксид марганца МnО2
по его физической природе амфотерен и при высоких температурах взаимодействует
с основными оксидами с образованием оксаманганатов:
MnO2
+ CaO = CaMnO3
кислотный основной манганит (IV)
кальция
Соединения Мn
(IV) - сильные окислители:
МnО2
+ 4Н+ +2е = Mn2+
+
2H2O;
Е0 = 1,23 В;
МnО2+НСℓ
= МnСℓ2+Сℓ2+2Н2О;
В качестве дешевого окислителя МnО2
широко используется в технике и лабораторной практике, а также в
стекольной промышленности (обесцвечивание стекла) и в спичечном производстве.
Оксидам Мn(VI)
и Мn(VII)
соответствуют нестойкие кислоты Н2МnО4
и НМnО4,
которые мгновенно разлагаются:
Н2МnО4
→ 2НМnО4+ МnО2
+ 2Н2О;
НМnО4→Мn2О7+Н2О.
Соли марганцовистой кислоты - манганаты (VI) -
получают сплавлением МnО2
со щелочью в присутствии окислителя:
МnО2+4КОН+О2
→ 2К2МnО4+2Н2О.
Манганаты (VI) - соединения ярко-зеленого цвета,
устойчивы в щелочной среде, в нейтральных и кислых растворах они
диспропорционируют:
K2MnO4+2H2O
→
MnO2+2KMnO4+4KOH.
Соединения Mn(VI)
- сильные окислители, особенно в кислой среде:
МnО42-
+ 4Н++2е = МnО2
+ 2Н2О; 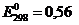 В.
В.
При действии сильных окислителей манганаты (VI)
превращаются в перманганаты:
KMnO4(зеленый
цвет) + Cℓ2
→2KMnO4
(фиолетовый)+ 2KCℓ.
При нагревании оксоманганаты (VI)
диспропорционируют с выделнием кислорода:
K2MnO4
→ 2KMnO4
+ MnO2
+ 2Н2О.
Марганцовая кислота (HMnO4)
является сильной кислотой, но существует только в водных растворах (в свободном
состоянии она не выделена). Растворы перманганатов окрашены в
малиново-фиолетовый цвет (цвет перманганат - иона MnO4‒).
При прокаливании в сухом виде перманганаты уже
при температуре 200оС разлагаются с образованием диоксида марганца,
манганата и кислорода:
KMnO4
= K2MnO4
+ МnО2 + О2↑.
В лабораторных условиях разложением перманганата
калия получают чистый кислород.
При действии концентрированной серной кислоты на
перманганат калия образуется марганцевый ангидрид Мn2О7:
КМnО4
+ Н2SO4
= K2SO4
+ Мn2О7
+ Н2О
Марганцовый ангидрид - тяжелая маслообразная
жидкость зеленовато-бурого цвета. Оксид Mn2O7
очень
неустойчив и при нагревании разлагается со взрывом:
Мn2О7
= 4 МnО2 + 3О2
При взаимодействии Mn2O7
с водой образуется марганцовая кислота (HMnO4):
Мn2О7
+ Н2О = 2НМnО4.
Так как марганец в своих соединениях имеет
разную степень окисления (от +II дo
+VII), то те соединения
или ионы, в которых марганец имеет низшую степень окисления будут
восстановителями, т.е. сами будут окислятся. Соединения или ионы с
промежуточной степенью окисления (МnО2,
Н2МnО3, K2MnO4)
будут либо восстановителями, либо окислителями - все зависит от условий протекания
реакции и веществ, с которыми они взаимодействуют.
Например:
) MnO2
как восстановитель:
MnO2
+3PbO2
+6 HNO3
= 2HMnO4
+3Pb(NO3)2
+ 2H2O;
) MnO2
как окислитель:
FeSO4
+ MnO2
+2H2SO4
= Fe2(SO4)3
+ MnSO4
+ 2H2O;
) K2MnO4
как восстановитель:
K2MnO4
+ KClO3
+6HCl = 6KMnO4+
7KCl + 3H2O;
4) K2MnO4как
окислитель:2MnO4
+ 2NaSO4 +2H2SO4 = MnSO4 + 2Na2SO4
+ K2SO4 + 2H2O.
Соединения марганца VII - безусловные
окислители. Перманганат калия сильнейший окислитель, окислитель, в зависимости
от рН среды образуются различные продукты его восстановления.
При взаимодействии Мn2О7
с водой образуется марганцовая кислота:
Оксиды Tc2O7
и Re2O7
-
устойчивые соединения желтого цвета, их получают непосредственным окислением
простых веществ; при растворении
В ряду кислот HMnO4
- HTcO4
- HReO4
сила кислот и их окислительная активность уменьшается. Ионы этих кислот
окрашены: MnO4-
- фиолетовый, TcO4-
- розовый, ReO4-
- бесцветный.
Изменение кислотно-основных и
окислительно-восстановительных свойств соединений марганца можно выразить
следующей схемой:
Применение марганца, технеция и рения. Марганец
применяют в качестве добавки к стали для улучшения её свойств. При добавлении
феррамарганца к расплавленной стали растворенная в ней сера связывается в
сульфид MnS, который не растворяется
в металле и уходит в шлак. Непрореагировавший с серой марганец остается в
стали, что еще более улучшает её свойства: повышается твердость, прочность и
износоустойчивость. Из марганцовистых сталей изготавливают железнодорожные
рельсы, скаты и стрелки, рабочие части дробильных машин, шаровых мельниц и т.п.
Марганец входит в состав сплавов, обладающих
ценными свойствами. Так, манганин (сплав марганца с медью и никелем) обладает
ничтожно малым температурным коэффициентом электросопротивления и другими свойствами,
ценными для электроизмерительной аппаратуры. Из сплавов Гейслера (Aℓ-Mn)
изготовляют сильные постоянные магниты.
Диоксид марганца широко используют в качестве
окислителя (деполяризатора) в химических источниках тока. Перманганат калия
применяют как окислитель во многих органических синтезах, в аналитической
химии, в медицине. Соединения марганца входят в состав многих катализаторов, в
том числе ускорителей «высыхания» масляной краски (масло, входящее в состав
краски, окисляется кислородов воздуха, образуя при этом полимер).
Технеций, вследствие его радиоактивности и
трудности выделения, не получил пока большого применения. Наиболее важным
соединением технеция является пертехнетат натрия NaTcO4
- очень эффективный ингибитор коррозии металлов, применяющийся для защиты от
коррозии важнейших узлов ядерных реакторов, точных приборов и т.д.
Рений - металл, обладающий исключительно ценными
свойствами (тугоплавкость, механическая прочность, хорошая электропроводность),
устойчивость к действию химических реагентов и др.). Рений используют в
вакуумной электротехнике; добавка его к вольфраму делает нить для ламп
накаливания более долговечной. Из железных листов с электролитическим рениевым
покрытием изготовляют цистерны и баки для перевозки соляной кислоты. Рений и
его соединения используют в химической промышленности в качестве катализаторов.
Сплавы рения с W, Mo, Ta, Ir, Pt,
Os, Ni тугоплавки,
нелетучи, механически прочны, трудно окисляются, устойчивы к действию различных
химических реагентов, поэтому их широко применяют для изготовления термопар,
ювелирных изделий сверхзвуковых с самолетов, ракет и точных приборов, для
антикоррозийных покрытий и др.
.1. Биологическая роль соединений марганца
Марганец является биогенным элементом,
необходимым для нормального протекания процессов в живых организмах.
В теле взрослого человека содержится 12 мг (1,6∙10-5%).
Марганец концентрируется в костях (43%), остальное - в мягких тканях, в том
числе и мозге.
В организме марганец образует металлокомплексы с
белками, нуклеиновыми кислотами, АТФ, АДФ, отдельными аминокислотами.
Содержащие марганец металлоферменты аргиназа, холинэстераза,
фосфоглюклюкомутаза.
Связывание аммиака - токсичного продукта
превращения аминокислот в организме млекопитающих осуществляется через
аминокислоту аргинин. Аргиназа - фермент, катализирующий в печени гидролиз
аргинина. В результате аргинин расщепляется на мочевину и циклическую
аминокислоту орнитин:
Аргинин + Н2О Н2N‒C‒NH2
+ Орнитин
О
(мочевина)
Мочевина - нетоксичное, растворимое в воде
вещество. Оно потоком крови доставляется в почки и выводится с мочой.
Атомный радиус марганца 128 пм. Это объясняет то
обстоятельство, может замещать магний (атомный радиус 160 пм) в его соединении
с АТФ, существенно влияя на перенос энергии в организме.
Марганец может входить и в состав неорганических
соединений организма. Это, например, малорастворимый марганец магний пирофосфат
MnMgP2O7.
Кристаллы этой соли локализуются на внутренней поверхности мембраны везикул.
Почти одинаковое значение атомного радиуса марганца
(128 пм) и железа (126 пм) объясняет способность марганца замещать железо в
порфириновом комплексе эритроцита. По той же причине марганец может замещать и
цинк (атомный радиус127 пм) в цинкзависимых ферментах, изменяя при этом их
каталитические свойства.
Перманганат калия KMnO4 - наиболее
известное соединение марганца, применяемое в медицине. Используют водные
растворы с содержанием KMnO4 от 0,01 до 5%. В качестве
кровоостанавливающего средства применяют 5% раствор. Растворы перманганата
калия обладают антисептическими свойствами, которые определяются его высокой
окислительной способностью.
Из других соединений марганца следует отметить
сульфат марганца (II)
и хлорид марганеца (II),
которые используют при лечении малокровия.
О наличии технеция в живых организмах данных
нет. Однако соединения технеция с бисфосфонатами используют для радиоизотопного
метода диагностики.
Метастабильный изотоп технеция 99Тс
является излучателем лучей. В первые минуты после внутривенного введения
препарата «Технефор», содержащего 99Тс можно исследовать состояние
мягких тканей, через 2-3 ч после введения - костных.
9. Элементы
подгруппы VIIIБ
.1 Общая
характеристика свойств элементов подгруппы
VIIIБ
Побочная подгруппа восьмой группы периодической
системы охватывает три триады d-элементов
и три искусственно полученных и мало изученных элемента: гассий, Hs,
мейтнерий, Mt,
дармштадтий Ds. Первую
триаду образуют элементы: железо, Fe, еобальт Со, никель Ni; вторую триаду -
рутений Ru, радий Ro, палладий Pd и третью триаду - осмий Os, иридий Ir
и платина Pt. Искусственно полученные гассий, мейтрений, дармштадтий с малым
временем жизни замыкают известный на сегодня ряд самых тяжелых элементов.
Большенство рассматриваемых элементов VIIБ
группы имеют два валентных электрона на внешней электронной оболочке атома; все
они представляют собой металлы. Кроме внешних ns-электронов в образовании
связей принимают участие электроны предпоследней электронной оболочки (n-1)d.
Из-за увеличения заряда ядра последний элемент
каждой триады имеет характерную степень окисления, ниже чем первый элемент. В
тоже время увеличение номера периода, в котором располагается элемент,
сопровождается увеличением характерной степени октсления (табл. 9.1)
Таблица 9.1 Характерные степени окисления
элементов восьмой побочной подгруппы
|
Fe +2, +3, +6
|
Co +2, +3
|
Ni +2, +3
|
|
Ru +4, +6, +8
|
Rh +2, +3
|
Pd +2, +4
|
Ir +3, +4
|
Pt +2, +4
|
Наиболее часто встречающиеся степени окисления
элементов в их соединениях выделены в табл. 41 жирным шрифтом.
Данные элементы иногда делят на три подгрурппы:
подгруппу железа (Fe,
Ru, Os),
подгруппу кобальта (Co,
Rh, Ir)
и подгруппу никеля (Ni,
Pd, Pt).
В пользу такого деления говорят характерные степени окисления элементов (табл.
42) и некоторые другие свойства. Например, все элементы подгруппы железа -
активные катализаторы синтеза аммиака, а подгруппа никеля - реакций
гидрирования органических соединений. Для элементов подгруппы кобальта
характерно образование комплексных соединений [Э(NH3)6]Г3,
где Г- галоген ион
Окислительно-восстановительные свойства
элементов группы VIIIВ
определяются следующей схемой:
Усиление окислительных свойств ионов металлов
Все металлы группы VIIIБ
каталитически активны. Все в большей или меньшей мере способны поглощать
водород и активизировать его; все они образуют окрашенные ионы (соединения).
Все металлы склонны к комплексообразованию. Сравнение физических и химических
свойств элементов подгруппы VIII-Б,
показывает, что Fe, Ni, Co очень сходны между собой и в то же время сильно
отличаются от элементов двух других триад, поэтому их выделяют в семейство
железа. Остальные шесть стабильных элеменетов объединяются под общим названием
- семейство платиновых металлов.
9.2 Металлы семейства железа
В триаде железа наиболее ярко проявляется
горизонтальная аналогия, характерная для d-элементов в целом. Свойства
элементов триады железа приведены в табл. 42.
Таблица 9.2 Свойства элементов триады железа
|
Свойства
элементов
|
Fe
|
Co
|
Ni
|
|
Содержание
в земной коре, масс. Моли %
|
5,1
|
3
∙10-3
|
8
∙10-3
|
|
Валентные
электроны
|
3d64s2
|
3d74s2
|
3d84s2
|
|
Атомный
радиус, нм
|
0,126
|
0,125
|
0,124
|
|
Ионный
радиус Э2+, нм
|
0,080
|
0,078
|
0,074
|
|
Ионный
радиус Э3+, нм
|
0,067
|
0,064
|
0,062
|
|
Потенциал
ионизации, I1, В: Э Э+
+ е-
|
7,89
|
7,87
|
7,63
|
|
О
ЭО
|
1,7
|
1,8
|
1,8
|
|
Температура
плавления, 0С
|
1536
|
1493
|
1453
|
|
Температура
кипения, 0С
|
2870
|
2960
|
2900
|
|
Плотность,
г/см3
|
7,87
|
8,84
|
8,91
|
|
 ,
В ,
В
|
-0,44
|
-0,277
|
-0,25
|
|
 ,
В ,
В
|
-0,036
|
|
|
Природные ресурсы. Железо - четвертый (после O2,
Si, Al)
по распространенности в земной коре элемент. Может встречаться в природе в
свободном состоянии: это железо метеоритного происхождения. Железные метеориты
содержат в среднем 90% Fe,
8,5% Ni, 0,5% Co.
На двадцать каменных метеоритов в среднем приходится один железный. Иногда встречается
самородное железо, вынесенное из недр земли расплавленной магмой.
Для получения железа используют магнитный
железняк Fe3O4
(минерал магнетит), красный железняк Fe2O3
(гематит) и бурый железняк Fe2O3
х
H2O
(лимонит), FeS2 - пирит. В организме человека железо присутствует в
составе гемоглобина.
Кобальт и никель в металлическом состоянии
встречаются в метеоритах. Важнейшие минералы: кобальтин CoAsS
(кобальтовый блеск), железоникелевый колчедан (Fe,Ni)9S8.
Эти минералы встречаются в полиметаллических рудах.
Свойства. Железо, кобальт, никель представляют
собой серебристо-белые металлы с сероватым (Fe),
розоватым (Co) и
желтоватым (Ni) отливом.
Чистые металлы прочны, пластичны. Все три металла ферромагнитные. При
нагревании до определенной температуры (точка Кюри) ферромагнитные свойства
исчезают и металлы становятся парамагнитными.
Для железа и кобальта характерен полиморфизм, в
то время как никель мономорфен и вплоть до температуры плавления обладает
ГЦК-структурой.
Наличие примесей сильно снижает устойчивость
этих металлов, к агрессивной атмосфере в присутствии влаги. Это приводит к
развитию коррозии (ржавление железа) за счет образования на поверхности рыхлого
слоя смеси оксидов и гидроксидов переменного состава, не предохраняющих
поверхность от дальнейшего разрушения.
Сопоставление электродных потенциалов систем Э2+/Э
для железа (-0,441 В), никеля (- 0,277 В) и кобальта (- 0,25 В), и электродного
потенциала системы Fe3+/Fe
(-0,036 В), показывает, что самым активным элементом этой триады является
железо. Разбавленные соляная, серная и азотная кислоты растворяют эти металлы с
образованием ионов Э2+:
Fe + 2HCℓ
= FeCℓ2
+H2;
разб.
Ni + H2SO4 =
NiSO4 + H2;
разб.
3Co + 8HNO3 = 3Co(NO3)2
+ 2NO + 4H2O;
разб.
Fe + 10HNO3 = 3Fe(NO3)2
+ NH4No3 +
3H2O.
разб.
Более концентрированная азотная кислота и
горячая концентрированная серная кислота (меньше 70%) окисляют железо до Fe
(III) с образованием NO
и SO2,
например:
Fe + 4HNO3 = Fe(NO3)3
+ No + 2H2O;
2Fe
+ 6H2SO4
 Fe2(SO4)3
+ 3SO2
+6H2O.
Fe2(SO4)3
+ 3SO2
+6H2O.
Очень концентрированная азотная кислота (уд.в.
1,4) пассивирует железо, кобальт, никель, образуя на их поверхности оксидные
пленки.
По отношению к растворам щелочей Fe,
Co, Ni
устойчивы, но с расплавами реагируют при высоких температурах. С водой все три
металла не реагируют при обычных условиях, но при температуре красного каления
железо вступает во взаимодействие с парами воды:
Fe + 4H2o  Fe3O4
+ 4H2.
Fe3O4
+ 4H2.
Кобальт и никель в коррозийном отношении заметно
устойчивее железа, что согласуется с их положением в ряду стандартных
электродных потенциалов.
Мелкодисперсное железо в кислороде сгорает при
нагревании до образования Fe3O4, который является самым
устойчивым оксидом железа и такой же оксид образует кобальт. Эти оксиды
являются производными элементов в степенях окисления +2, +3 (ЭО∙Э2О3).
Термическое окисление кобальта и никеля протекает при более высоких
температурах, при этом образуются NiO
и CoO, обладающие
переменным составом, зависящим от условий окисления.
Для железа, никеля, кобальта известны оксиды ЭО
и Э2О3 (табл. 9.3)
Таблица 9.3 Кислородосодержащие соединения
элементов подгруппы VIIIБ
|
Название элемента
|
Степень
окисления
|
Оксиды
|
Гидрооксиды
|
Соли
|
|
|
Формула
|
Характер
|
Формула
|
Название
|
Формула иона
|
Название
|
|
Железо
(Fe)
|
+2
|
FeO
|
Основной
|
Fe(OH)2
|
Гидроксид
железа (II)
|
Fe2+
|
Соли
железа (II)
|
|
+3
|
Fe2O3
|
Амфотерный
с преобладанием основного
|
Fe(OH)3
|
Гидроксид
железа (III)
|
Fe3+
|
Соли
железа (III)
|
|
|
|
|
НFeO2
|
Железистая
кислота
|
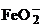
|
Ферриты
|
|
+6
|
FeO3
|
Кислотный
|
Н2FeO4
|
Железная
кислота
|
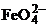
|
Ферраты
|
|
Кобальт
(Co)
|
+2
|
CoO
|
Основной
|
Со(OH)2
|
Гидроксид
кобальта (II)
|
Со2+
|
Соли
кобальта (II)
|
|
+3
|
Co2O3
|
Основной
|
Со(OH)3
|
Гидроксид
кобальта (III)
|
Со3+
|
Соли
кобальта (III)
|
|
Никель
(Ni)
|
+2
|
NiO
|
Основной
|
Ni(OH)2
|
Гидроксид
никеля (II)
|
Ni2+
|
Соли
никеля (II)
|
|
+3
|
Ni2O3
|
Основной
|
Ni(OH)3
|
Гидроксид
никеля (III)
|
Ni3+
|
Соли
никеля (III)
|
Оксиды ЭО и Э2О3 нельзя
получить в чистом виде прямым синтезом, поскольку при этом образуется набор
оксидов, каждый из которых является фазой переменного состава. Их получают
косвенным путем - разложением некоторых солей и гидроксидов. Оксид Э2О3
устойчив только для железа и получается при обезвоживании гидроксида.
Оксиды ЭО нерастворимы в воде и не
взаимодействуют с ней и с растворами щелочей. Это же характерно и для
соответствующих гидроксидов Э(ОН)2. С кислотами гидроксиды Э(ОН)2
легко взаимодействуют с образованием солей. Кислотоосновные свойства
гидроксидов элементов триады железа приведены в табл. 42.
Гидроксид железа (III)
Fe(OH)3
образуется при окислении Fe(OH)2
кислородом воздуха:
4 Fe(OH)2 + O2
+2H2O = 4Fe(OH)3.
Аналогичная реакция характерна для кобальта.
Гидроксид никеля (II)
по отношению к кислороду воздуха устойчив. Вследствие этого гидроксиды Э(ОН)3
различным образом ведут себя при взаимодействии с кислотами. Если Fe(OH)3
образует соли железа (III),
то реакция Co(OH)3
и Ni(OH)3
с кислотами сопровождается их восстановлением до Э(+2):
Fe(OH)3 + 3HCℓ =
FeCℓ3 + 3H2O;
Ni(OH)3 + 6HCℓ =
2NiCℓ2 + Cℓ2 + 6H2O.
Гидроксид Fe(OH)3
проявляет и кислотную функцию, реагируя с горячими концентрированными
растворами щелочей с образованием гидроксокомплексов, например, Na3[Fe(OH)6].
Производные железистой кислоты HFeO2
(ферриты) получают при сплавлении щелочей или карбонатов с Fe2O3:
2NaOH + Fe2O3  2NaFeO2
+ H2O;3 + Fe2O3
2NaFeO2
+ H2O;3 + Fe2O3  MgFe2O4
+ CO2.
MgFe2O4
+ CO2.
Ферриты MeIIFe2O4
относятся к классу шпинелей. Рассмотренные выше оксиды Fe3O4
и Co3О4
формально представляют собой шпинели FeFe2O4
и CoCo2O4.
В отличие от кобальта и никеля
известны соединения железа, в которых его степень окисления равна + 6. Ферраты
образуются при окислении Fe(OH)3 в горячей концентрированной щелочи
в присутствии окислителя:
2Fe+3(OH)3 +
10KOH + 3Br2 = 2K2Fe+6O4 + 6KBr +
2H2O.
Ферраты термически нестабильны и при небольшом
нагревании (100-2000С) превращаются в ферриты:
K2FeO4
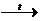 4KfeO2
+ 2K2O
+ 3O2.
4KfeO2
+ 2K2O
+ 3O2.
В свободном состоянии железная кислота и
соответствующий ей оксид FeO3
не выделены. По растворимости и в структурном отношении ферраты близки к
соответствующим хроматам и сульфатам. Феррат калия образуется при сплавлении Fe2O3
с KNO3
и KOH:
Fe2O3 + 3KNO3
+ 4KOH =2K2feO4
+3KNO2 + 2H2O.
Ферраты - это красно-фиолетовые кристаллические
вещества. При нагревании они разлагаются. Кислота H2FeO4
не может быть выделена, она мгновенно разлагается на Fe2O3,
H2O
и O2.
Ферраты сильные окислители. В кислой и нейтральных средах ферраты разлагаются,
окисляя воду:
2Nа2FeO4 + 10
H2O 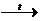 4Fe(OH)3
+ 4NaOH + O2.
4Fe(OH)3
+ 4NaOH + O2.
Соединения с неметаллами. Галогениды Fe,
Ni, Co
сравнительно немногочисленны и отвечают наиболее характерным степеням окисления
+2 и +3. Для железа известны галогениды FeГ2
и FeГ3 со
фтором, хлором и бромом. При непосредственном взаимодействии образуются FeF3,
FeCℓ3,
FeBr3.
Дигалогениды получают косвенным путем - растворением металла (или его оксида) в
соответствующей галогеноводородной кислоте. Для кобальта получены трифторид CoF3
и трихлорид CoCℓ3.
Никель не образует тригалогенидов. Все дигалогениды триады железа являются
типичными солеобразными соединениями с заметным ионным вкладом в химическую
связь.
Железо, кобальт, никель энергично
взаимодействуют с халькогенами и образуют халькогениды: ЭХ и ЭХ2.
Монохалькогениды можно получить взаимодействием соответствующих компонентов в
растворах:
CoCℓ2
+ (NH4)2S
= CoS + 2NH4Cℓ.
Все халькогениды являются фазами переменного
состава.
Соединения металлов триады железа с остальными
неметаллами (пниктогены, углерод, кремний, бор) заметно отличаются от
рассмотренных выше. Все они не подчиняются правилам формальной валентности и в
большинстве своем обладают металлическими свойствами.
Железо, кобальт, никель поглощают водород, но
определенных соединений с ним не дают. При нагревании растворимость водорода в
металлах растет. Растворенный в них водород находится в атомарном состоянии.
Соли кислородосодержащих кислот и комплексные
соединения. Все соли соляной, серной и азотной кислот растворимы в воде.
Соли никеля (II)
имеют зеленый цвет, кобальта (II)
- синий, а их растворы и кристаллогидраты - розовый (например, [CoCℓ2∙Н2О]),
соли железа (II) -
зеленоватый цвет, а железа (III)
- бурый. Наиболее важными солями являются: FeCℓ3
∙ 6H2O;
FeSO4
∙7H2O
- железный купорос, (NH4)2
SO4
∙ FeSO4
∙6H2O
- соль Мора; NH4Fe(SO4)2
∙ 12H2O
- железоаммонийные квасцы; NiSO4
∙
6H2O
и др.
Способность солей железа, кобальта и никеля к
образованию кристаллогидратов свидетельствует о склонности этих элементов к
комплексообразованию. Кристаллогидраты представляют собой типичный пример
аквакомплексов:
[Э(H2O)6](ClO4)2;
[Э(H2O)6](NO3)2.
Многочисленны для элементов триады железа
анионные комплексы: галогенидные (MeI(ЭF3),
Me2I[ЭГ4],
Me3[ЭГ4]
и т.п.), роданидные (Me2I[Э(CNS)4],
Me4I[Э(CNS)6],
Me3I[Э(CNS)6]),
оксолатные (Me2I[Э(C2О4)2],
Me3[Э(C2О4)3]).
Особенно характерны и устойчивы цианидные комплексы: K4[Fe(CN)6]
- гексацианоферрат (II)
калия (желтая кровяная соль) и K3[Fe(CN)6]
- гексацианоферрат (III)
калия (красная кровяная соль). Эти соли являются хорошими реактивами для
обнаружения ионов Fe+3
(желтая соль) и ионов Fe2+
(красная соль) при pH
7:
Fe3+
+ [Fe(CN)6]4-
= Fe4[Fe(CN)6]3;
берлинская
лазурь
3Fe2+
+ 2[Fe(CN)6]3-
= Fe3[Fe(CN)6]2.
турнбулева
синь
Берлинская лазурь используется как синяя краска.
При добавлении к раствору, содержащему ионы Fe3+,
роданистых солей KCNS
раствор окрашивается в кроваво-красный цвет из-за образования роданида железа:
FeCℓ3
+ 3KCNS = Fe(CNS)3
+ 3KCℓ.
Эта реакция очень чувствительна и используется
для открытия иона Fe3+.
Для кобальта (II)
характерны устойчивые простые соли и неустойчивые комплексные соединения K2[Co(CNS)4],
K4[Co(CN)6],
которые переходят в соединения кобальта (III):
K3[Co(CN)6],
[Co(NH3)6]Cℓ3.
Характерными комплексными соединениями железа,
железа, кобальта и никеля являются карбонилы. Подобные соединения рассмотрены
ранее для элементов подгрупп хрома и марганца. Однако, наиболее типичными среди
карбонилов являются: [Fe(CO)5],
[Co2(CO)8],
[Ni(CO)4].
Карбонилы железа и никеля получают в виде жидкостей при обычном давлении и
20-60оС при пропускании потока СО над порошками металлов. Карбонил
кобальта получают при 150-200оС и давлением (2-3) ∙ 107
Па. Это оранжевые кристаллы. Помимо [Fe(CO)5]существуют
карбонилы более сложного состава: Fe(CO)9
и трехядерные карбонилы [Fe2(CO)12],
представляющие собой соединения кластерного типа.
Все карбонилы диамагнитны, поскольку лиганды СО
(как и CN‒) создают сильное поле, в
результате чего валентные d-электроны комплексообразователя образуют р-связи с
молекулами СО по донорно-акцепторному механизму. у-Связи образуются за счет
неподеленных электронных пар молекул СО и оставшихся вакантных орбиталей
комплексообразователя:
Рис. 9.1
Никель (II),
наоборот, образует много устойчивых комплексных соединений: [Ni(NH3)6](OH)2,
K2[Ni(CN)4];
ион [Ni(NH3)6]2+
имеет темно-синий цвет.
Этой реакцией широко пользуются при качественном
и количественном анализе для определения никеля. Соединения никеля и особенно
кобальта ядовиты.
Применение. Железо и его сплавы составляют
основу современной техники. Никель и кобальт - важные легирующие добавки в
сталях. Широко применяются жаростойкие сплавы на основе никеля (нихром,
содержащий Ni и Cr,
и др.). Из медно-никелевых сплавов (мельхиор и др.) изготавливают монеты,
украшения, предметы домашнего обихода. Большое практическое значение имеют
многие другие никель- и кобальтсодержащие сплавы. В частности, кобальт
используется как вязкая составная часть материалов из которых изготовляют
металлорежущий инструмент, в которую вкраплены частицы исключительно твердых
карбидов MoC и WC.
Гальванические никелевые покрытия металлов предохраняют последние от коррозии и
придают им красивый внешний вид.
Металлы семейства железа и их соединения широко
используются в качестве катализаторов. Губчатое железо с добавками -
катализатор синтеза аммиака. Высокодисперсный никель (никель Ренея) - очень
активный катализатор гидрирования органических соединений, в частности жиров.
Никель Ренея получают, действуя раствором щелочи на интерметаллид NiAℓ,
при этом алюминий образует растворимый алюминат, а никель остается в виде
мельчайших частиц. Этот катализатор хранят под слоем органической жидкости, так
как в сухом состоянии он мгновенно окисляется кислородом воздуха. Кобальт и
марганец входят в состав катализатора, добавляемого к масляным краскам для
ускорения их "высыхания".
Оксид Fe2O3
и его производные (ферриты) широко используются в радиоэлектронике как
магнитные материалы.
.3 Металлы семейства платины
Характерные степени окисления и важнейшие
соединения. Из платиновых металлов наибольшее практическое значение имеют
палладий и платина, в меньшей степени используется осмий.
В распространенных соединениях платиновые
металлы проявляют следующие степени окисления: рутений и осмий +4 и +8 (RuO2,
RuO4,
OsO2,
OsO4),
родий и иридий +3 и +4 (Rh2O3,
RоO2,
Ir2O3,
IrO2),
палладий +2 (PdCℓ2,
комплексы Pd+2),
платина +2 (комплексы Pt+2)
и +4 (PtCℓ4,
H2[PtCℓ6],
(NH4)2[PtCℓ6]).
Природные ресурсы. Платиновые металлы в природ6е
всегда встречаются вместе. Это очень редкие элементы, их общее содержание в
земной коре составляет приблизительно 10-6%. Платиновые металлы встречаются
и в свободном состоянии. Так называемая самородная платина содержит примерно
80% Pt, 10% других
платиновых металлов, приблизительно 10 % Fe,
Аu, Сu
и других примесей. В небольших количествах платина и ее аналоги сопутствуют
меди и никелю. При электролитической очистке этих металлов образуется шлам,
содержащий платиновые металлы (и золото).
Наиболее редким среди платиновых металлов
является рутений. Он открыт в 1844 г. К. К. Клаусом (Казань). Это был первый
элемент, названный в честь России - родной страны ученого (Ruthenia
- средневековое латинское название России).
Получение. Основной источник извлечения
платиновых металлов - это самородная платина, а также шлам электролитического
производства меди и никеля. Переработка самородной платины и содержащих
платиновые металлы шламов состоит из многих химических операций. Это
обусловлено близостью свойств платиновых металлов и трудностью их разделения.
Применяются различные методы переработки
самородной платины. Все они начинаются с обработки ее царской водкой, при этом
платиновые металлы (осмий и иридий частично остаются в виде осадка осмиридия)
переходят в раствор, окисляясь до Н2[Э+4Сℓ6].
Реакция с участием платины протекает следующим образом:
Pt + 4HNO3+
18HCℓ = 3H2[PtCℓ6]
+ 4NO + 8Н2О.
Затем обработкой слабыми восстановителями всех
элементов семейства платины, кроме платины, переводят их в соединения с низкой
степенью окисления, а платину осаждают в виде малорастворимого комплекса -
хлороплатината (IV)
аммония (NН4)2[РtСl6]
(другие металлы остаются в растворе). При нагревании этот комплекс разлагается
с выделением порошкообразного металла:
(NН4)2[РtСℓ6]
®
Pt + 2NH3
+ 2HCℓ + 2Cℓ2.
Сплавлением или спеканием этого порошка получают
компактную платину, обычно она содержит 99,7 - 99,8% Pt.
Для получения металла высокой чистоты полученную платину снова растворяют в
царской водке и повторно осаждают (NН4)2[РtСℓ6].
Так получают металл, содержащий 99,94% Pt.
Особо чистую платину готовят методом зонной плавки переосажденного металла. Из
осмиридия и раствора, оставшегося после выделения (NH4)2[PtCℓ6],
получают другие платиновые металлы.
Свойства. Элементы подгруппы платины - белые
блестящие металлы. По механическим свойствам платиновые металлы заметно
различаются. Платина очень мягкая, легко вытягивается в тончайшую проволоку и
прокатывается в фольгу. Почти такой же мягкий палладий. Иридий - твердый и
прочный. Осмий и рутений - хрупкие. Осмий можно раздробить в ступке в порошок.
Платиновые металлы относят к благородным
металлам. При комнатной температуре они не подвергаются коррозии, в компактном
состоянии не реагируют с большинством кислот (или реагируют очень медленно) и
растворяются только в царской водке (за исключением Ir),
что обусловлено образованием прочных комплексов Н2[ЭCℓ6].
Наибольшей химической стойкостью обладает платина. Как в компактном состоянии,
так и в виде порошка она не реагирует с кислородом даже при очень сильном
нагревании.
Все платиновые металлы поглощают в больших
количествах водород, который образует с ними металлические твердые растворы. Исключителен
в этом отношении палладий. При слабом нагревании он интенсивно поглощает
водород с образованием металлической фазы, состав которой при избытке водорода
и высоком его давлении приближается к PdH;
при атмосферном давлении, а также при электрохимическом насыщении палладия
водородом образуется фаза, близкая по составу к Pd2H.
Нагретая выше 250°С палладиевая мембрана легко пропускает водород, другие газы
через нее не проходят.
Платиновые металлы обладают исключительно
высокой каталитической активностью. Обычно их используют в высокодисперсном
состоянии, а платину - в виде так называемой платиновой черни, которую получают
химическим или электрохимическим восстановлением хлороплатината. В качестве
катализаторов чаще всего применяют платину и палладий, последний, в частности,
является мощнейшим катализатором гидрирования. Особенно активен коллоидный
палладий. Некоторые свойства платиновых металлов указаны в табл. 9.5.
Таблица 9.5 Свойства элементов семейства платины
|
Свойства
|
Элементы
|
|
Ru
|
Rh
|
Pd
|
Os
|
Ir
|
Pt
|
|
Содержание
в земной коре, масс. доли, %
|
5
10-7
|
1
10-7
|
1
10-6
|
5
10-6
|
1
10-7
|
5
10-7
|
|
Атомный
радиус, нм
|
0,133
|
0,134
|
0,137
|
0,135
|
0,136
|
0,138
|
|
Ионный
радиус, нм
|
0,062
|
0,065
|
0,064
|
0,065
|
0,065
|
0,064
|
|
Потенциал
ионизации I1Э Э+ + е,
В
|
7,366
|
7,46
|
8,336
|
8,5
|
9,1
|
9,0
|
|
ОЭО
|
2,0
|
2,1
|
2,1
|
2,1
|
2,1
|
2,2
|
|
Температура
плавления, 0С
|
2334
|
1960
|
1552
|
3050
|
2443
|
1769
|
|
Плотность,
г/см3
|
12,45
|
12,41
|
12,02
|
22,61
|
22,50
|
21,45
|
|
 ,
В ,
В
|
+0,45
|
+0,6
|
+0,987
|
+0,7
|
+1,0
|
+1,2
|
Строение внешних электронных оболочек атомов: Ru
4d75s1,
Rh 4d85s1,
Pd 4d105s0,
Os 4f145d66s2,
Ir 4f145d76s2,
Pt 4f145d96s1.
Проявляемая Ru и Os
высшая степень окисления +8 соответствует вовлечению в образование связи всех s-
и d-электронов этих
атомов. В атомах элементов, следующих за Ru
и Os, благодаря
увеличению заряда ядра связь электронов с ядром упрочняется, и поэтому для этих
элементов более устойчивы низкие степени окисления.
При нагревании рутений и осмий в порошкообразном
состоянии взаимодействуют с кислородом, образуя оксиды RuO2
и OsO4;
с компактными металлами реакция идет медленно. Своеобразно ведут себя по
отношению к кислороду Rh,
Ir и Pd;
при температуре красного каления они окисляются (быстрее в порошкообразном
состоянии) до оксидов Rh2O3,
IгО2, PdO2,
однако выше температуры красного каления эти оксиды становятся термодинамически
неустойчивыми, и металлы перестают реагировать с кислородом.
Наиболее стабильными являются оксиды RuO2,
Rh2O3,
PdО, OsO2,
IrO2;
оксиды OsO2,
RhO2
нерастворимы в воде и кислотах. Соответствующие гидроксиды могут быть получены
гидролизом тетрахлоридов:
OsCℓ4
+ 2Н2О = Os(OH)4
+ 4HCℓ;
RuCℓ4 + 2H2O
= Ru(OH)4 + 4HCℓ.
Полученные гидроксиды обладают амфотерными
свойствами. Диоксид осмия OsO2
диспропорционирует: 2OsO2
= Os + OsO4.
Платиновые металлы разрушаются при нагревании со
щелочами в присутствии кислорода, поскольку их оксиды амфотерны. Поэтому в
платиновой посуде нельзя плавить щелочи, для этого используют железную,
никелевую или серебряную посуду. Платиновые изделия нельзя нагревать во
внутреннем конусе пламени газовой горелки и в коптящем пламени, так как с
углеродом платина легко образует карбид и разрушается.
Только платина и иридий вполне стойки к действию
HNO3
и концентрированной H2SO4,
остальные платиновые металлы медленно реагируют с этими кислотами (в виде
порошка быстрее).
Элементы платиновой группы находятся в ряду
напряжений после водорода и характеризуются устойчивостью по отношению к кислотам,
щелочам, активным неметаллам. Однако при определенных условиях они способны
растворяться в кислотах, взаимодействовать с щелочами, кислородом, хлором.
Компактные Ru,
Os, Rh,
Ir устойчивы к
кислотам и их смесям. Ru
и Os взаимодействуют с
растворами гипохлоритов и со щелочами при сплавлении:
Ru + ЗКCℓО
+ 2NaOH = Na2RuO4
+ ЗКСℓ + Н2О.
Pt и Os
растворяются в царской водке с образованием комплексных соединений:
3Pt + 4NHO3 + 18HCℓ
= 3H2[PtCl6] + 4NO + 8H2O.
и Ir
можно перевести в растворимые соединения при температуре красного каления,
действуя сильным окислителем:
Ir + 2Cℓ2
+ 2NaCℓ = Na2[IrCℓ6].
Все платиновые металлы при нагревании реагируют
с хлором. Жидкий бром медленно взаимодействует с платиной уже при комнатной
температуре. При нагревании платиновые металлы реагируют с серой, фосфором,
кремнием и другими простыми веществами.
Для платиновых металлов характерны различные
степени окисления, особенно много их у рутения. (все степени окисления от 0 до
8), причем окислительно-восстановительные реакции с участием Ru
происходят сравнительно легко. Поэтому простые (некомплексные) соединения
рутения обычно трудно получить в чистом виде. Известно очень много комплексов
рассматриваемых элементов. Связь металл-лиганд в них обычно прочнее, чем в
комплексных соединениях Fe,
Co, Ni.
Это обусловлено большим зарядом ядер атомов платиновых элементов и уменьшенными
в результате d- и f-сжатия
радиусами ионов. Простых соединений рассматриваемых элементов известны десятки,
а комплексных - тысячи. В растворах существуют только комплексные ионы
платиновых металлов. Большой вклад в химию комплексных соединений платиновых
металлов внесли paботы
отечественных ученых К.К. Клауса, Л.А. Чугаева, И.И. Черняева, А.А. Гринберга и
др.
Соединения. Из огромного числа известных соединений
платиновых металлов ниже рассмотрены лишь немногие, а именно те которые широко
используют в химической практике.
Исходным веществом для получения соединений
палладия обычно служит хлорид PdCl2,
имеющий гигроскопичные кристаллы и температуру плавления 680 0С
(часто используют кристаллогидрат PdCℓ2
· 2H2O).
Кристаллическая решетка PdCl2
состоит из лент, образованных соединенными друг с другом квадратами PdCl4.
Получают PdCl2
действием хлора на палладиевую чернь при температуре красного каления или растворением
гидроксида палладия (II)
в хлороводородной кислоте.
Ион Pd2+
имеет конфигурацию 4d85s0.
Как указывалось при рассмотрении соединений Ni2+,
такая конфигурация обусловливает плоское квадратное строение комплексов. В
соединениях Pd+2
действие данного фактора проявляется сильнее, чем для в соединениях Ni+2.
Замечательной особенностью PdCℓ2
является его способность реагировать в водном растворе с монооксидом углерода:
PdCℓ2
+ СО + Н2О - Pd
+ СО2 + 2HCℓ.
Только Pd2+
восстанавливается оксидом углерода до металла при комнатной температуре. Данную
реакцию используют для обнаружения СО.
Поскольку комплексы Pd+2
плоские и квадратные, для них возможна цис-, транс-изомерия. Например, для [Pd(NH3)2Cℓ2]
известны желто-коричневый цис-изомер и оранжевый транс-изомер. Существует и
координационный изомер того же состава: [Pd(NH3)4]
· [PdCℓ4]
(соль Вокелена).
Для платины наиболее устойчива степень окисления
+4. Из ее соединений часто используют гексахлороплатиновую (IV)
кислоту H2[PtCℓ6]
· 6Н2О, которую получают растворением платины в царской водке с
последующим упариванием полученного раствора. Это желтое гигроскопичное
вещество. При 3600С оно теряет воду и НСℓ и превращается в PtCℓ4
(красно-коричневые кристаллы).
Н2[РtСℓ6]
- сильная кислота. Получено много ее солей; соли К+, Rb+,
Cs+,
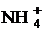 мало растворимы в
воде. При действии щелочи на раствор Н2[РtСℓ6]
происходит последовательное замещение ионов Cℓ-
в анионе [PtCℓ6]2-
на ионы ОН-. Если для реакции щелочь взята в избытке, то образуются
светло-желтые соли М2[Pt(ОН)6)].
При кипячении раствора, содержащего Н2[РtСℓ6]
и Na2CO3,
выпадает осадок амфотерного гидратированного оксида PtO2
· nH2O.
мало растворимы в
воде. При действии щелочи на раствор Н2[РtСℓ6]
происходит последовательное замещение ионов Cℓ-
в анионе [PtCℓ6]2-
на ионы ОН-. Если для реакции щелочь взята в избытке, то образуются
светло-желтые соли М2[Pt(ОН)6)].
При кипячении раствора, содержащего Н2[РtСℓ6]
и Na2CO3,
выпадает осадок амфотерного гидратированного оксида PtO2
· nH2O.
Известно много комплексов Pt+4.
Координационное число Pt+4
, как правило, равно 6, комплексы имеют октаэдрическое строение.
Pt+4
легко восстанавливается до Pt+2,
например:
(NH4)2[PtCℓ6]
+ (NH4)2С2O4
- (NH4)2[PtCℓ4]
+ 2NH4Сℓ
+ 2СO2.
При действии на полученный комплекс аммиака
происходит частичное замещение лиганда Сl-
на NH3:
(NH4)2[PtCℓ4]
+ 2NH3
® [Pt(NH3)2Cℓ2]
+ 2NH4Cℓ.
Комплексное соединение [Pt(NH3)2Cℓ2]
(неэлектролит) существует в виде двух изомеров. Растворимость одного из них в
воде растет с повышением температуры, другого - уменьшается. Выяснить, какой из
этих изомеров цис-, а какой транс-, удалось в 1936 г., спустя много десятилетий
после их получения (строение установлено путем измерения дипольных моментов).
Цис-изомер носит название «соль Пейроне».
В чистом виде выделена тетрациано-платиновая (II)
кислота H2[Pt(CN)4]
(красная окраска). Это устойчивая сильная кислота; получены многие ее соли. Все
комплексы Pt имеют
плоскую квадратную структуру, что связано с электронной конфигурацией d8
(для Pt+2
еще более сильно действуют факторы, обусловливающие квадратное строение
комплексов Ni+5
и Pd+2).
Несмотря на то, что платиновые металлы очень
дороги (это драгоценные металлы, более дорогие, чем золото), они имеют широкое
применение. В любой современной химической лаборатории имеется значительный
запас изделий из платины - тигли, чашки, проволока, фольга и др. Многие
аналитические операции проводят, используя платиновую посуду. Так, химический
анализ силикатов обычно начинается с растворения их во фотороводородной
кислоте, для этого необходимы платиновые тигли и чашки.
Платино-платинородиевая термопара Pt-(Pt+10%
Rh) применяется для
измерения температур до 1400 0С, другими способами точно измерить
температуру выше 1100 0С трудно. Исследования при высоких
температурах, установление диаграмм состояния металлических и других систем
проводятся также с использованием платина-платинородиевой термопары. Широко
используют и платиновые термометры сопротивления. Платинородиевый сплав
применяют в качестве катализатора окисления аммиака в производстве HNO3.
Платина легко впаивается в стекло, это очень
удобно при проведении многих научных исследований, особенно при разработке
электровакуумных приборов и материалов. Платиновые и платинированные электроды
широко применяют в электрохимических производствах и научной работе. Платина -
единственный материал, совершенно не взаимодействующий с расплавленным стеклом.
Стеклянные нити в производстве стекловолокна вытягивают из платинородиевых
лодочек (93% Pt), каждая
массой 2 - 3 кг.
При изготовлении в СССР зеркала самого большого
в мире телескопа диаметром 6 м несколько сотен тонн расплавленного стекла было
вылито по платиновой трубе в платиновую ванну и остывало там два года.
Платину и ее сплавы используют для изготовления
ряда хирургических инструментов.
Из платины можно вытягивать тончайшую проволоку
(толщиной около одного микрометра и тоньше), необходимую для различных
физико-химических измерений. Из 1 г платины можно получить 500 км такой
проволоки.
Платиноиридиевый сплав (90% Pt)
исключительно химически стоек и очень тверд. Из этого сплава, в частности,
изготавливают тигли для выращивания монокристаллов лазерных материалов. Для
повышения твердости платиновых сплавов в них добавляют осмий. Из сплавов Ir-W
изготавливают термопары, предназначенные для измерения температур до 2000 -
2300 0С.
Все платиновые металлы, их сплавы и соединения
используют в качестве катализаторов во многих органических синтезах.
Палладиевая мембрана, пропускающая только водород - незаменимое приспособление
в ряде физико-химических измерений.
гидроксид медь железо валентный
Библиографический список
1. Карапетьянц М.Х., Дракин С.И.
Общая и неорганическая химия. - М.: Химия, 1993. - 590 с.
. Ахметов Н.С. Общая и
неорганическая химия. Учебник для вузов. - М.: Высш. шк., 2001. -679 с.
. Угай Я.А. Общая и неорганическая
химия. - М.: Высш. шк., 1997. 527 с.
. Дроздов Д.А, Зломанов В.П., Мазо
Г.Н., Спиридонов Ф.М. Неорганическая химия. В 3-х томах. Т.2. Химия
непереходных элементов. / Под ред. Ю.Д. Третьякова -М.: Изд. «Академия», 2004,
368с.
. Тамм И.Е., Третьяков Ю.Д. Неорганическая
химия: В 3-х томах, Т.1. Физико-химические основы неорганической химии. Учебник
для студентов ВУЗв / Под ред. Ю.Д. Третьякова -М.: Изд. «Академия», 2004, 240с.
. Коржуков Н.Г. Общая и
неорганическая химия. Учеб. Пособие. /Под ред В.И. Деляна-М.: Изд. МИСИС:
ИНФРА-М, 2004, 512с.
. Ершов Ю.А., Попков В.А., Берлянд
А.С., Книжник А.З. Общая химия. Биофизичческая химия. Химия биогенных
элементов. Учебник для ВУЗов. /Под ред. Ю.А. Ершова. 3-е изд., -М.:
Интеграл-Прес, 2007. 728 с.
. Глинка Н.Л. Общая химия. Учебное
пособие для ВУЗов. Изд. 30-е исправленное./ Под ред. А.И. Ермакова. -М.:
Интеграл-Пресс, 2007, 728 с.
. Черных, М.М. Овчаренко. Тяжелые
металлы и радионуклиды в биогеоцинозах. -М.: Агроконсалт, , 2004.
. Н.В. Гусакова Химия окружающей
среды. -Ростов-на-Дону, Феникс, 2004.
. Балецкая Л.Г. Неорганическая
химия. -Ростов-на-Дону, Феникс, 2005.
. М. Хенце, П. Армоэс, Й.
Ля-кур-янсен, Э. Арван. Очистка сточных вод. -М.: Мир, 2006.
. Коровин Н.В. Общая химия. - М.:
Высш. шк., 1998. -558 с.
. Петрова В.В. и др. Обзор свойств
химических элементов и их соединений. Учебное пособие по курсу “Химия в
микроэлектронике”. - М.: Изд-во МИЭТ, 1993. -108 с.
. Харин А.Н., Катаева Н.А., Харина
Л.Т. Курс химии. - М.: Высш. шк., 1983. -511 с.