Изучение кристаллизации N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил) цитизина в различных средах
МИНИСТЕРСТВО
ВЫСШЕГО И СРЕДНЕ СПЕЦИАЛЬНОГО ОБРАЗОВАНИЯ РЕСПУБЛИКИ УЗБЕКМСТАН
ФЕРГАНСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКУЛЬТЕТ
ЕСТЕСТВОЗНАНИЯ-ГЕОГРАФИИ
КАФЕДРА
«ХИМИИ»
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ РАБОТА
По
теме «Изучение кристаллизации N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)
цитизина в различных средах»
Выполнила:
студентка 4 го курса Халилова Д.
НАУЧНЫЙ
РУКОВОДИТЕЛЬ:
Ст.преп. Махмудов
У.С.
ФЕРГАНА
- 2013г
ВВЕДЕНИЕ
Главной целью и движущей силой реализуемых в
республике преобразований является человек, его гармоничное развитие и
благосостояние, создание условий и действенных механизмов реализации интересов
личности, стереотипов мышления и социального поведения. Важным условием
развития Узбекистана является формирование совершенной системы подготовки
кадров на основе богатого интеллектуального наследия народа и общечеловеческих
ценностей, достижений современной культуры, экономики, науки, техники и
технологий.
Национальная программа по подготовке кадров,
соответствует положениям Закона Республики Узбекистан “Об образовании”,
разработана на основе анализа национального опыта. Исходя, из мировых
достижений в системе образования и ориентирована на формирование нового
поколения кадров с высокой общей и профессиональной культурой, творческой и
социальной активностью, умением самостоятельно ориентироваться в
общественно-политической жизни, способных ставить и решать задачи на
перспективу.
Программа предусматривает реализацию
национальной модели подготовки кадров, создание социально-экономических,
правовых, психолого-педагогических и иных условий для формирования всесторонне
развитой личности, адаптации к жизни в современном изменяющемся обществе,
осознанного выбора и последующего освоения образовательных и профессиональных
программ, воспитание граждан, сознающих свою ответственность перед обществом,
государством и семьей.
Предусматривается всемерное развитие химической
промышленности, полное использование во всех отраслях народного хозяйства
достижений современной химии, в огромной степени расширяющей возможности роста
народного богатства, выпуска новых, более совершенных и дешевых средств
производство и предметов народного потребления.
Базовой современной химии является учение о
строении веществ, без знания которого невозможно объяснить их свойства и понять
причины протекание химических процессов, заключающихся в превращении одних
веществ в другие. Изучение химии начинается с рассмотрения структуры атомов,
объясняющей периодичность в изменении свойств элементов, т.е. суть
периодического закона химических элементов, открытого Д.И.Менделеевым (1869).
Без знания строения атомов невозможно понять причины возникновение между ними
химических связей, приводящих к образованию многоатомных частиц: молекул и
кристаллов, составляющих веществ. Изучение же химических связей, в свою
очередь, позволяет объяснить многие свойства веществ, их поведение по отношению
друг к другу.
Актуальность работы. Алкалоид цитизин и его
производные являются биоактивными соединениями и считаются перспективным
классом в практическом отношении. Наличие хирального
3,7-диазобицикло[3,3,1]нонанового скелета в его структуре представляет интерес
для введения дополнительных фармакофоров, что может способствовать усилению
известной активности или появлению новых фармакологических свойств. Поэтому в
последнее время увеличивается число публикаций, посвященных исследованию
структурных особенностей замещенных цитизинов и взаимосвязи «структура -
активность». Наряду с синтезом новых производных цитизина, немаловажно изучение
процессов их кристаллизации и изучение на наличие явлений сольватообразования и
полиморфизма, в связи широким использованием этого явления в разработке
технологий и промышленности лекарственных веществ, красителей, пигментов и в
др. отраслях.
Из вышесказанного следует, что исследование
пространственного строения новых синтезированных производных цитизина методом
рентгеноструктурного анализа и выяснение особенностей формирования сольватов и
полиморфов в их кристаллах
является актуальной задачей.
Степень изученности проблемы.
По данным Кембриджской базы структурных данных изучено 31
структур различных кристаллических модификаций производных цитизина. Это
свидетельствует о том, что несмотря на бурные темпы работ по изучению
химической модификации цитизина, его кристаллохимические аспекты все еще
являются мало изученными. Еще в меньшей степени изучены сольваты и полиморфы
этих веществ. Анализ вышеупомянутых исследований показывает, что многие из этих
структур являются сопутствующими данными других исследований и в мировом
научном сообществе практически отсутствуют независимые кристаллохимические
исследования систематического характера, посвященные различным аспектам
структурообразования производных цитизина, выполненные методом РСА.
Цель исследования. Исследование N12-производных
цитизина на предмет сольватообразования. Определение их кристаллической
структуры, выяснение особенностей формирования супрамолекулярной структуры в
этих кристаллах.
Задачи исследования:
· изучение влияния температуры и
эффекта среды на формирование кристаллосольватов;
· определение пространственного
строения кристаллосольватов N12-производных
цитизина;
· исследование кристаллоструктурных
особенностей и характера межмолекулярных взаимодействий;
Объект и предмет исследования. Объектами
исследования являются N12-производные
цитизина. Предметом исследования являются 6 кристаллических структур различных
производных цитизина.
Методы исследований. Рентгеноструктурное
исследование позволяет выявить
различные стереохимические особенности молекул, природу
внутри- и межмолекулярных взаимодействий,
что определяет
их физико-химические свойства, такие как растворимость, гигроскопичность и
позволяет уточнить природу некоторых аномалий в ИК-, УФ-, ЯМР-спектрах. кристаллизация цитизин сольват клатратообразование
Гипотеза исследования. Предполагается выявление
закономерностей образования солватов и полиморфов на основе изучения
межмолекулярных взаимодействий в кристаллических структурах N12-производных
цитизина.
Основные положения, выносимые на защиту:
· строение 6 новых кристаллических
структур N12-производных
цитизина;
· особенности кристаллических
структур, характер межмолекулярных взаимодействий;
· стереохимические аспекты строения
молекул 1,2,4-тиадиазолилпроизводных цитизина;
Научная новизна. Впервые получены и установлены
6 кристаллических структур N12-производных
цитизина. Изучено влияние температуры и эффекта среды на формирование
сольватов. Определен характер межмолекулярных взаимодействий в кристаллах.
Получено 6 сольватов N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизина.
Научная и практическая значимость результатов
исследования. Полученные результаты РСА о строении молекул имеют существенное
значение для понимания и объяснения многих физико-химических свойств и
спектральных характеристик (ИК-, УФ-, ЯМР-спектров) молекул изученного класса
соединений, позволяют провести дальнейшие углубленные теоретико-неэмпирические
квантово-химические расчёты. Сделанные выводы расширяют представления о
пространственном строении молекул производных цитизина, о процессах
формирования сольватов и полиморфов и могут быть рекомендованы как материал для
спецкурсов по строению и стереохимии органических соединений.
Реализация результатов. Результаты проведенных
структурных исследований включены (депонированы) в Кембриджский банк
кристаллоструктурных данных и были использованы в целенаправленном синтезе
новых биоактивных производных цитизина в Отделе органического синтеза ИХРВ АН
РУз.
ГЛАВА 1. ЛИТЕРАТУРНЫЙ ОБЗОР
В последнее время бурными темпами развивается
химия клатратных соединений. Клатраты используются в химическом анализе, для
препаративного получения многих чистых веществ и даже для разделения рацематов.
Большое значение клатраты имеют в процессах, происходящих, в биологических
объектах.
В 1973 году французский химик Жан-Мари Лен,
подчеркивая важную роль, которую играют невалентные взаимодействия в
формировании подобных соединений, и обсуждая их свойства, ввел термин
"супрамолекулярная (надмолекулярная) химия", а в 1987 году ему,
американцам Чарльзу Педерсену и Дональду Краму была вручена Нобелевская премия
по химии за достигнутые успехи в этой области знаний.
Тоже самое можно сказать и о бурном развитии
знаний о полиморфизме. На сегодняшний день полиморфизм играет важную роль в
решении большого числа коммерческих и промышленных задач. Полиморфизм
применяется в фотографической промышленности, при производстве пищевых добавок,
в промышленности лекарственных препаратов и инертных наполнителей, при
производстве красителей и пигментов, а также при производстве
высокоэнергетических, пиротехнических, горючих, инициирующих и высоковзрывчатых
веществ.
Изучение этих явлений - клатратообразования и
полиморфизма в кристаллохимии биоактивных органических молекулах важно,
поскольку они могут выявить новые свойства молекулы в аспекте лекарственных и
других биологических проявлениях.
Основная часть данной работы посвящается
изучению кристаллохимических аспектов структуры производных биоактивного
алкалоида цитизина, которые проявляют клатратогенные свойства при получении
кристаллов из различных растворителей. Также получаются их различные
полиморфные модификации.
Именно исходя из вышеперечисленных факторов,
нами решено более детально (обзорно) рассмотреть явления клатратообразования и
полиморфизма органических соединений.
.1 КЛАТРАТООБРАЗОВАНИЕ
.1.1 ОБЩИЕ ПРЕДСТАВЛЕНИЯ О СТРОЕНИИ КЛАТРАТНЫХ
СОЕДИНЕНИЙ
Слово “клатрат” - взято из латинского “clathratus”
и означает “закрытую со всех сторон клетку”. 1947 году Г. Пауэлл при изучении
строения соединения гидрохинона с SO2
c помощью
рентгеновских лучей впервые показал, что между этими молекулами отсутствует
химическая связь и дал обоснование новому принципу строения химической материи,
назвав такие соединения - клатратными. Такие соединения (иногда в литературе
можно встретить и названия “хозяин-гость комплексы”, “окклюзированные
соединения”, “аддукты”, “сольваты”) образуются без образования каких-либо
специфических химических связей, при этом одна молекула (“гость”) входит в
каркас, образованный другой молекулой (“хозяином”).
Термодинамическая устойчивость таких соединений
определяется геометрически выгодным расположением молекулы “гостья” в каркасе
молекулы “хозяина”, так как в этом случае образуются слабые межмолекулярные
взаимодействия, обусловливающие энергетическую выгодность такого расположения.
Нужно подчеркнуть, что в структуре кристалла не находится готовая пустота,
подходящая для данной конформации молекулы “гостья”. Она является результатом
взаимодействия обеих молекул.
Клатраты, образованные лишь ван-дер-ваальсовым
взаимодействием, называются - “истинными клатратами”. Если составляющие
клатрата взаимодействуют между собой водородными связями, то такие клатраты
называются - “H-клатратами”. Также
существует понятие “специфический клатрат”. Оно в свою очередь делится на два:
) “клатрат на основе смешанной матрицы хозяина”
- где структура кристалла состоит из химически различных молекул;
) “автоклатрат” - где молекулы хозяина и гостья
химически тождественны.
С увеличением числа клатратообразующих веществ
(клатратогенов) исследователи пытались их классифицировать по тому или иному
принципу. Но ни одна из этих классификаций не претендует на всеобщность. Так,
если одна классификация основывается на каком-либо признаке клатрата, то другая
распределяет по различиям в строении.
Например Л. Б. Клапп разделяет клатратные соединения
на четыре типа, при этом он исходит из типа межмолекулярных взаимодействий
молекул хозяина и гостья. Классификация Ж. А. Кетелара тоже близка к
классификации Л. Б. Клаппа. Классификация Ф. Крамера построена следующим
образом:
) полимолекулярные соединения;
) молекулярные соединения и
) соединения, образованные из высокомолекулярных
веществ.
Классификация М. Барона и Г. Франклара
основывается на топологии образованных пустот для включения гостевых молекул в
кристалле молекул хозяина и делит клатратные соединения на:
) слоистые (интеркалат, layer);
) канальные (тубулат, chain)
и
) клеточные (криптат, framework).
Такую же классификацию предлагает и Ж. К.
Халеблян.
1.1.2 ОБЪЕКТЫ КЛАТРАТНОЙ ХИМИИ
Круг объектов исследования клатратной химии
очень широк. Здесь мы приведем только некоторые примеры и отметим важные факты.
Межмолекулярные взаимодействия определяют
структуру молекулярных кристаллов - огромного класса органических веществ,
молекулы которых образованы с помощью ковалентных связей. Для молекулярных
кристаллов А.И. Китайгородским был выведен так называемый принцип “плотнейшей
упаковки”, определяющий закономерности их образования. В основе этого принципа
лежит стремление молекул в кристалле наиболее эффективно заполнить
пространство, что обеспечивает наибольшее количество энергетически выгодных
межмолекулярных ван-дер-ваальсовых контактов. Принцип предполагает такой подход
молекул друг к другу, чтобы ″выступ″ одной молекулы приходился на ″впадину″
другой. Необходимо отметить, что в 1984 г. Э. Фишером для высокоспецифичных
ферментативных реакций был введен аналогичный принцип ″ключ к замку″,
означающий геометрическую комплементарность рецептора и субстрата. Принцип
плотной упаковки очень важен для молекулярной биологии, поскольку он хорошо
объясняет структуру биоорганических молекулярных комплексов. В мономолекулярных
соединениях включениях полость образована одной молекулой хозяина, тогда как в
классических клатратах полость образуется в кристаллической структуре
коллективом молекул хозяина. В любом случае между молекулами гостья и хозяина
нет химических связей, а роль «химической реакционной способности» играет
пространственная комплементарность гостевой и хозяйской подсистем. С позиций
принципа плотнейшей упаковки образование соединений включения характерно для
молекул-хозяев, которые не могут быть плотно упакованы в собственной фазе.
Плотная упаковка достигается заполнением молекулами-гостями полостей рыхлого
каркаса, образованного молекулами-хозяевами (клатраты гидрохинона, клатратные
гидраты, соединения включения мочевины, клатраты три-о-тимотида, гекса-хозяева
и др.). Движущей силой процесса включения является большая термодинамическая
устойчивость упорядоченной фазы соединения включения по сравнению с
механической смесью исходных компонентов. Природа соединений включения долгое
время оставалась загадкой. Определяющая роль ван-дер-ваальсовых взаимодействий
при образовании ″смешанных кристаллов″ была отмечена русским
химиком Б.А. Никитиным в 1936-1938 гг. при исследовании соединений благородных
газов с водой и фенолом. Понимание соединений включения как нового типа
организации химической материи стало возможно только благодаря
рентгеноструктурным исследованиям. В 1947-1948 гг. Г. Пауэлл определил
структуры соединений включения гидрохинона с SO2 и другими газами. В
1948 г. Пауэлл опубликовал основополагающую работу, в которой впервые ввел
термин ″клатрат″ и сформулировал новый принцип образования
соединения между двумя компонентами - не за счет химических связей, а за счет
их пространственной комплементарности. Работы Пауэлла и сформулированные им
концепции клатратной химии дали начало осознанным исследованиям надмолекулярных
образований и в конечном итоге привели к возникновению клатратной химии как
новой области знаний. Представление об огромном экспериментальном материале,
наработанном во второй половине XX века в области исследования клатратных
соединений, дают обзоры по полигидратам, соединениям включения графита,
цеолитов, гидрохинона, мочевины и тиомочевины, циклодекстринов и амилозы,
комплексов металлов и работы, посвященные общим вопросам, таким как природа,
структура, стехиометрия и систематизация соединений включения. Особое развитие
получила химия соединений включения макроциклических молекул. В 1967 г. Ч.
Педерсен выделил и описал первый циклический полиэфир, или краун-эфир.
Краун-эфиры стали первыми молекулами-лигандами, образующими координационные
соединения с катионами щелочных металлов. Такие соединения получили название
клатрато-комплексов, поскольку в этом случае структура и стабильность ассоциата
определяются как химическим взаимодействием (координацией), так и
пространственной комплементарностью гостя и хозяина. Позднее Лен и Д. Крам
развили идею полициклического лиганда, создав криптанды (молекулы, с трех
сторон ограничивающие координационную полость) и сферанды (молекулы с жесткой
геометрией координационной полости). Важность этих открытий была подтверждена
присуждением Педерсену, Лену и Краму Нобелевской премии по химии в 1987 г.
Создание макроциклических молекул-рецепторов дало толчок к синтезу и изучению
свойств сложных лигандов, способных к селективному улавливанию (распознаванию)
молекул и ионов. Среди других видов макроциклических молекул-хозяев особое
развитие получили исследования циклодекстринов и каликсаренов, связанные с возможностью
их использования в качестве рецепторов и переносчиков органических молекул и
ионов. Циклодекстрины нашли широкое применение в медицине, косметике, пищевой и
других отраслях. В 1960-х гг. Г. Шиллом был осуществлен направленный синтез
молекулярных соединений, молекулы-компоненты которых связаны без химической
связи: это катенаны (механически связанные макроциклические молекулы),
ротаксаны (механически связанные макроциклическая и продетая в нее линейная
молекула с объемными концевыми группами) и узлы (макроциклическая молекула в
форме узла).
.1.3 ПСЕВДОПОЛИМОРФИЗМ, СОЛЬВАТЫ И ГИДРАТЫ
МакКрон, Галеблян и МакКрон отмечали, что
понятие “псевдополиморфизм” использовали для описания ряда явлений, относящихся
к полиморфизму, среди которых: десольватация, фазовые переходы второго рода,
динамическая изомерия, мезоморфизм, рост зерен, миграция их границ,
рекристаллизация в твердом состоянии и эффекты напряжения кристаллической
решетки.
Вероятно, наиболее общее использование этого
термина, в особенности принятое в фармацевтической промышленности, отражает
противоречие между сольватами (включая гидраты) и кристаллическими материалами,
которые не содержат растворителя (безводные в случае воды). Как указали Бирн и
Бирн с соавт., поведение солватных кристаллов меняется в широком диапазоне. В
одном случае растворитель прочно входит в решетку, и для десольватации
необходимы жесткие условия. Во многих таких случаях сольват является
интегральной частью самого кристалла, и его удаление приводит к разрушению
кристалла и образованию новой структуры. В другом предельном случае
растворитель слабо связан в кристалле и десольватация не приводит к его
разрушению. В принципе, возможен любой промежуточный случай между этими
предельными ситуациями. Отмечено, что поскольку сольватная и несольватная
кристаллические структуры принципиально различны, они не могут быть
охарактеризованы как полиморфы ни по какому из определений.
Термин “псевдополиморфизм” приобрел общее
признание для описания сольватных структур в особенности в фармацевтической
промышленности как для характеристики образцов, так и в производственных
аспектах.
Учитывая разнообразие поведения сольватных
кристаллов, Бирн предложил систему классификации, основанную на их поведении в
большей степени, чем на стабильности. Он предложил рассматривать сольватные
кристаллы, в которых растворитель может быть удален из кристалла и снова введен
в кристалл обратимо “без значительного изменения дифракционной картины,
полученной методом порошка”, как - псевдополиморфные сольваты. Если данные
метода порошка обнаруживают изменения в структуре, то такие системы должны
описываться как полиморфные сольваты. Данное определение, однако, не было
воспринято большинством авторов.
МакКрон также отмечал, что фазовые переходы
второго рода называли псевдополиморфными. Такие переходы достаточно трудно
регистрировать оптическими методами, поскольку изменения в структуре слишком
малы. Поэтому приставка “псевдо” иногда используется для описания подобных
случаев.
Третье явление, которое было описано как псевдополиморфизм,
- динамическая изомерия. Динамические изомеры (включая таутомеры и
геометрические изомеры) обычно рассматриваются как химически различные. Однако
не всегда просто провести границу между геометрическими изомерами и
конформационно различными молекулами. Динамические изомеры существуют и в
твердом состоянии, и в расплаве, и находятся в равновесии в широком диапазоне
температур, где оба изомера стабильны; при этом их относительное содержание
изменяется в зависимости от температуры, а в растворе - и в зависимости от
природы растворителя. Равновесие между двумя полиморфами, напротив, может
обнаруживаться в твердом состоянии, а при плавлении различие между ними
исчезает. При любой температуре только один полиморф термодинамически стабилен,
за исключением точки перехода, где оба полиморфа находятся в равновесии. Но
иногда встречаются и системы находящиеся где-то на границе, отделяющей
полиморфизм от динамической изомерии. Однако МакКрон и Трелфол считают, что
такие явления не следует рассматривать как псевдополиморфизм.
МакКрон отметил, что полиморфы, существующие
только в твердом состоянии, могут претерпевать переход по крайней мере в одном
направлении, минуя стадию расплава. С другой стороны, Кертин и Эйнджельмен
отметили, что равновесие в расплаве или растворе между двумя конфигурационными
изомерами может быть смещено кристаллизацией или химической реакцией с
образованием производного одного из изомеров.
.1.4 ВЛИЯНИЕ ФАКТОРА РАСТВОРИТЕЛЯ НА ПРИРОДУ
СТРОЕНИЯ СОЛЬВАТОВ

Рис.1.1. Молекула госсипола
Характер растворителя предопределяет
формирование полости, образованной подвижным каркасом госсипола. Из нескольких
растворителей госсипол может образовывать клатраты одной изоструктурной группы.
Так госсипол образует истинные
криптаты (т.е. клатраты клеточного типа без присутствия водородных связей между
молекулами хозяина и гостя) с неполярными молекулами. Две группы изоструктурных
криптатов госсипол образует с бензолом, бромбензолом, изопропилбензолом,
трихлорэтиленом и с орто-, мета-, параксилолом, этилбензолом, парахлортолуолом,
хлористым метиленом, диизопропиловым спиртом, паральдегидом соответственно. С
полярными молекулами госсипол образует уже три группы изоструктурных H-криптатов:
первая - с ацетилацетоном, этиловым и метиловым эфирами уксусной кислоты и
некоторыми другими кислородосодержащими веществами; вторая группа - это H-криптаты
госсипола с амиловым эфиром уксусной кислоты и амиловым эфиром акриловой
кислоты; и наконец третья группа - это H-криптаты
госсипола с бензальдегидом и нитробензолом.
Клатраты госсипола канального типа
строения (тубулаты) представлены тремя группами изоструктурных собственно
тубулатов и таким же количеством H-тубулатов. С диэтиловым эфиром
госсипол может образовывать тубулаты относящиеся к двум изоструктурным группам:
нестабильный клатрат состава h:g=1:1 (где h-число
молекул хозяев, g-число молекул гостей на элементарную
ячейку), при частичной десольватации которого образуется тубулат состава 1:0,5.
С дихлорметаном и дибромметаном госсипол образует тубулаты третьей группы. Три
изоструктурных группы H-тубулатов госсипола образуются с
включением следующих растворителей. Первая группа - это клатраты госсипола с
некоторыми представителями кетонов, спиртов, карбоновых кислот, циклических
эфиров. Вторую группу H-тубулатов образуют комплексы
госсипола с низшими гомологами ряда сложных эфиров, ДМСО, спиртов (метанол,
этанол) и некоторыми карбоновыми кислотами. Третью группу H-тубулатов
образует комплекс госсипола с пиридином.
Клатраты госсипола слоевого типа
строения - интеркалаты, представлены единственной группой, образованной
молекулярными комплексами госсипола с хлороформом, бромоформом, изовалерьяновой
кислотой, 1,2-дихлорэтаном и дийодметаном.
Из всего сказанного видно как сильно
влияет тот или иной растворитель на формирование клатратной структуры
госсипола.
1.1.5 ПРАКТИЧЕСКИЕ АСПЕКТЫ ИЗУЧЕНИЯ
КЛАТРАТООБРАЗОВАНИЯ
В последнее время все большее число
клатратных соединений получают применение в различных отраслях промышленности и
народного хозяйства. День за днем все большее внимание уделяется изучению
клатратов и клатратообразования. Клатратные соединения широко используют при
хранении опасных, взрывчатых, химически нестабильных, токсичных и
высокоактивных радикалов; при высокоэффективном разделении смесей химически
близких соединений; в сверхчувствительных сенсорных датчиках. Помимо этого на
примере клатратных соединений имеется возможность изучения природы слабых
межмолекулярных взаимодействий. С помощью клатратных соединений удается
высокоэффективное разделение смесей химически близких соединений, проведение
сверхтонкой очистки, разделение оптически активных веществ, проведение
полимеризации для получения стереорегулярных продуктов. Например, нитроглицерин
находящийся в полостях кристаллической структуры β-циклодекстрина
полностью теряет свои бризантные свойства. А очень токсичную и летучую
диметилртуть можно долго и безопасно хранить, если она находится в качестве
гостевой молекулы в структуре кристалла дианина. В клатратах с мочевиной можно
полностью защитить от окисления такие соединения, как непредельные жирные
кислоты, эфиры, кислоты и другие соединения. Таким же образом можно защитить
стеркулиновую кислоту от самополимеризации. Для использования клатратных
соединений в качестве контейнера для хранения инертных газов часто используют
матрицу гидрохинона, поскольку для хранения свободного инертного газа в таком
же количестве требуется давление в 90 атм.
Соединения Гоффмана используют при
очистке бензола от всегда ему сопутствующего тиофена. Основания Шиффа
используют при разделении изомеров ксилола. Гидрохинон используют при
разделении аргона от неона. Оптические изомеры же легко разделяются клатратами
мочевины, три-о-тимотида и β-циклодекстрина. Хроматографический
анализ смесей, разделенных посредством оснований Шиффа, соединений Гоффмана и
циклодекстрина, показывает что, разделение привело к ожидаемым результатам.
Канальные клатратные соединения
используют при разделении разветвленных углеводородов, спиртов, кислот и других
соединений. Тубулаты используют при получении несимметричных производных
госсипола.
Клатратные соединения используют в
приборах, регистрирующих радиоактивное загрязнение среды, в биологии и
медицине.
.2 ПОЛИМОРФИЗМ
.2.1 ОПРЕДЕЛЕНИЯ ПОЛИМОРФИЗМА
Полиморфизм (от греческого poly - много, morph - форма),
означающий разнообразие в природе, является термином многих дисциплин.
В поиске по Интернету на термин “полиморфизм”
Трелфол обнаружил 1500000 ссылок, из которых 90 % связаны с видеоиграми, в
которых существа меняют форму, 90% оставшегося относятся к генетическому
полиморфизму, т.е. небольшому изменению ДНК, что может приводить, например, к
особой чувствительности к лекарствам. Из оставшихся ссылок на
кристаллографический полиморфизм 90% посвящены неорганическим структурам и
только остаток (0.1% от найденных 1500000 ссылок) относится к молекулярным
кристаллам.
В соответствии с Оксфордским
английским словарем, этот термин впервые появился в 1656 году в связи с
разнообразием моды. Считается, что первое его использование в контексте
кристаллографии связано с работой Митчерлиха, который выявил различные
кристаллические структуры одного и того же соединения в ряду арсенатов и
фосфатов.
Как и для ряда других терминов в
химии, для полиморфизма нет четкого однозначного определения. Эта проблема
обсуждалась МакКроном, чьи определения и толкование полиморфизма сохраняют свою
значимость и в настоящее время. МакКрон определил полиморф как “кристаллическую
фазу данного соединения, возникающую при возможности существования по крайней
мере двух различных способов взаимного расположения молекул этого соединения в
твердом состоянии”.
Для гибких молекул МакКрон должен
был бы использовать термин “конформационный полиморфизм”, когда молекула может
принимать различные конформации в различных кристаллических структурах. Но при
таком определении динамическая изомерия или таутомерия должны быть исключены,
поскольку мы имеем дело с различными молекулами. Более гибким критерием для
отнесения системы к полиморфной можно считать ситуацию, когда кристаллические
структуры различны, но приводят к образованию одной и той же жидкой или
газообразной фазы. Для динамических изомеров такой критерий включает также
фактор времени. Как и полиморфы, динамические изомеры плавятся при различных
температурах. Однако составы расплавов будут различаться со временем до момента
достижения равновесия, и равновесный состав будет зависеть от температуры.
Используя эти критерии, система, в которой изомеры (или в предельном случае
конформеры) быстро переходят друг в друга, может рассматриваться как
полиморфная, в то время как относительно медленный переход между изомерами не
характеризует кристаллическую систему как полиморфную. Как показал Даниц, такое
определение приводит к ситуации, в которой рацематы и конгломераты будут
определены как полиморфные системы, если скорость перехода между изомерами в
расплаве или в растворе высокая, и будут являться тремя различными соединениями,
если переход достаточно медленный. Поскольку нет четкого определения “быстрый и
медленный переход”, граница достаточно размыта. Даниц также отметил, что такое
разграничение имеет дальнейшее разветвление при рассмотрении правила фаз, так
как должно быть определено число компонентов. МакКрон отметил, что “основное
различие между двумя полиморфами может иметь место в твердом состоянии, и это
различие исчезает в расплаве”.
Бюргер и Блум, дали следующее
описание полиморфизму: - “Если член изоморфного ряда построен из строительных
блоков, чьи размер и поляризационные свойства находятся в предельной области,
возможной для данной структуры, то изменения термодинамических условий могут
выйти за границы этого предела, и образуется новая структура. Это и есть
полиморфизм.” С другой стороны, определение МакКрона представили в упрощенной
форме Розенштейн и Лэми: - “Если вещество может существовать в более чем одном
кристаллическом состоянии, то говорят, что оно полиморфно”. Эта же упрощенная
форма была высказана и Бюргером: - “Если они (твердые вещества, состоящие
только из одного компонента) могут существовать в различных кристаллических
решетках, то мы говорим о полиморфизме”. К сожалению это приводит к путанице
понятий кристаллической решетки и кристаллической структуры. Некоторые из этих
ошибочных высказываний попали и более поздние публикации.
Ведутся также дискуссии о
неправильном использовании терминов “аллотропия” и “полиморфизм”. Первый был
введен Берцелиусом для описания существования различных кристаллических
структур элементов в противоположность различным кристаллическим структурам
соединений. Финдлэй противопоставил использование двух терминов для одного и
того же явления и даже предложил отбросить полиморфизм и сохранить аллотропию в
качестве общего описания этого явления. Различие между двумя терминами
обсуждалось Шармой и Рейнке с соавторами. Шарма предложил обозначать полиморфы
как “различные кристаллические формы, принадлежащие одним и тем же или разным
кристаллическим системам, в которых одинаковые фрагменты одного и того же
элемента или соединения, или соединения с одинаковыми химическими формулами,
или одинаковыми повторяющимися фрагментами упакованы по разному”. Рейнке с
соавторами использовали современный язык супрамолекулярной химии, предложив
“расширенное и модифицированное определение” полиморфизма как “явления, при
котором супермолекулярные структуры с различными хорошо определенными
физическими свойствами могут быть образованы химически одинаковыми объектами
как в жидком, так и в твердом состоянии”. Это привело к описанию кристалла
Даницем как “супермолекулы” и на той основе, что “если кристалл -
супермолекула, то полиморфные модификации являются суперизомерами, а
полиморфизм - это тип суперизомерии”.
Хотя язык в химии постоянно
развивается, рабочее определение МакКрона прошло проверку временем и является
наиболее общепринятым и используемым большинством в настоящее время.
.2.2 НОМЕНКЛАТУРА ПОЛИМОРФОВ
Отчасти трудности, встречающиеся при
поиске и интерпретации литературных данных о полиморфном поведении материалов,
состоят в несогласованности обозначений полиморфов. Во многих случаях такая
несогласованность вызвана отсутствием принятых стандартов. Однако чаще, и
вероятно, это еще более важно, несогласованность возникает из-за отсутствия у авторов
информации о предшествующих работах или отсутствия попыток сопоставить свои
данные с результатами, полученными ранее. В то время как много полиморфных
минералов и неорганических соединений имеют различные названия (например,
кальцит, арагонит и ватерит для карбоната кальция, или рутил, брукит и анатаз
для диоксида титана), для молекулярных кристаллов это не так, и они
обозначаются арабскими (1, 2, 3,…) или римскими (I, II, III,…) цифрами,
строчными и заглавными латинскими буквами (a, b, c,… или A, B, C,…) или
строчными греческими буквами (α, β, γ,…), или именами
характеризующими их свойства (красная модификация, низкотемпературный полиморф,
метастабильная модификация и т.д.).
Как указывали Трелфол и Витейкер,
необходимо отказаться от произвольной системы обозначения полиморфов во
избежание путаницы в определении количества и подлинности полиморфов.
Относительная стабильность и значение температуры плавления, также как и
определение монотропной или энантиотропной природы полиморфной формы,
предлагались в качестве основы для обозначения, но это не дает возможности
обнаружения промежуточных форм, к тому же небольшое различие в стабильности или
температуре плавления может приводить к различному порядку и различным
обозначениям форм разными авторами. МакКрон предложил использовать римские
цифры для полиморфов в последовательности их открытия, обозначая наиболее
стабильную при комнатной температуре форму как I. По правилу
Оствальда порядок открытия должен в принципе следовать порядку стабильности,
так что наиболее стабильный полиморф идет первым. МакКрон также поддержал
предложение Кофлеров о том, чтобы римские цифры писались в скобках и стояли
после температуры плавления. В действительности, последователи Кофлера в
Инсбрукской школе во многом следовали этой практике, хотя в общем это не было
воспринято. Использование температур плавления неоднозначно, поскольку если эти
данные и имеют четкое термодинамическое определение, в результате использования
ряда разных методик для определения температуры плавления (или ее диапазона во
многих случаях) могут возникнуть несоответствия в отнесении температуры
плавления к той или иной форме.
В свете уже опубликованных
литературных данных и вопросов, связанных с проблемой определения полиморфов,
оказывается, что использование простого и вместе тем однозначного правила для
обозначения полиморфов не является общепринятой практикой. Метод Кофлера имеет
бесспорные преимущества, поскольку обозначение с учетом температуры плавления
может исключить некоторые вопросы идентификации и поэтому имеет смысл его
использовать. Для таких исследований (и обозначений) полиморфных систем во
избежание путаницы в номенклатуре очень важно иметь полную информацию о
предыдущих работах, чтобы попытаться установить соответствие между полученным
полиморфом и тем, что был изучен ранее.
.2.3 РАСПРОСТРАНЕННОСТЬ ПОЛИМОРФИЗМА
Наиболее широко известное
утверждение о существовании полиморфизма, возможно, было дано МакКроном: -
“Автор по крайней мере полагает, что каждое соединение существует в различных
полиморфных формах и что в общем, число форм, известных для данного соединения,
пропорционально времени и средствам, затраченным на его исследование”. Как
вывод из этого утверждения МакКрон отметил, что “все известные соединения (и
элементы) обладают полиморфизмом”, и привел множество примеров органических и
неорганических соединений.
Отмеченное выше отражает утверждения
Финдлэя: - “полиморфизм теперь действительно признан как частное явление”,
Бюргера и Блума: - “полиморфизм - неотъемлемое свойство твердых тел, которое
нельзя обнаружить только при особых условиях”, и Сироты: - “теперь считается,
что полиморфизм является характеристикой всех соединений, а его отсутствие
связано с тем, что полиморфный переход лежит выше температуры плавления или в
области значений внешних равновесных факторов или других условий, необходимых
для перехода, которых пока не удается достичь”.
Эти утверждения подчеркивают, что
полиморфизм - скорее правило, чем исключение. Литературные данные
свидетельствуют, что к таким выводам нужно подходить осторожно. Справедливо,
что примеры полиморфизма оказываются общим явлением в тех областях
промышленности, где получение и характеризация материалов в твердом состоянии
являются интегральными аспектами разработки и производства продукции (т.е.
когда большое внимание уделяется материальным затратам и затратам времени):
кварца, железа, силиката кальция, серы, мыла, фармацевтической продукции,
красителей и взрывчатых веществ. Такие материалы, в противоположность
большинству получаемых соединений, производят не один раз, а многократно при
условиях, которые время от времени могут немного изменяться (даже не
преднамеренно). Аналогично, при выращивании кристаллов биомолекулярных
соединений, в частности протеинов, много времени и усилий тратится на поиск
оптимальных условий кристаллизации, которые могут несколько изменяться, и при
этом полиморфизм наблюдается достаточно часто. Даже с ростом наших знаний и
важности полиморфизма в прикладном аспекте, наиболее известные случаи
полиморфизма были открыты скорее случайно, чем путем систематического поиска.
Для некоторых широко известных веществ, таких как сахароза, нафталин, которые
определенно кристаллизовались многократно, полиморфизм не был обнаружен.
Возможность полиморфизма существует для любого соединения, но условия получения
пока неизвестного полиморфа отнюдь не очевидны. К настоящему моменту не
существует систематического подхода для надежного определения этих условий.
Более того, мы практически не имеем представления о свойствах, которые можно
ожидать от новых полиморфов. Предсказание существования какой-либо полиморфной
формы для данного соединения, условия и методы, необходимые для его получения,
а также его свойства остаются нерешенной проблемой для ученых уже много лет.
.2.4 ПОЛИМОРФНЫЕ СОЕДИНЕНИЯ В КБСД
Кембриджская база структурных данных
(КБСД) - это архив результатов рентгеноструктурного исследования кристаллов
органических и металлорганических соединений. Текущая версия КБСД (V5.32 от мая
2011 года) содержит 562000 записей. А недавно было сообщено о 500000 ной
опубликованной структуре. Сегодня КБСД используется так же и как депозитарий
кристаллографических данных, которые могут нигде больше не публиковаться. За
последние десятилетия база данных оказала сильное влияние на характер работы
химиков-структурщиков. За короткое время сейчас можно получить доступ к
огромному объему структурной информации для проведения различных поисков:
установления корреляций, поиска модельных соединений, мотивов упаковок,
направлений реакций, типов водородных связей и.т.д. Быстрое увеличение
количества доступных данных, сопровождающееся все более совершенным программным
обеспечением, открыло такие возможности, которые нельзя было вообразить еще
четверть века назад.
Как архив всех органических и
металлорганических кристаллических структур КБСД содержит данные о полиморфных
соединениях. В версии КБСД V5.32 от мая 2011 года приблизительно
17000 соединений можно классифицировать как полиморфные, около 95000 как
сольваты, около 66000 как гидраты. Однако надо сказать несколько слов предостережения
перед использованием этих данных. Каждая запись в КБСД содержит одномерную (1D), двумерную
(2D) и
трехмерную (3D)
информацию. 2D информация
используется для отображения структурной химической формулы и связей в ней,
которые, очевидно, будут одинаковыми для полиморфов. 3D информация
содержит результаты рентгеноструктурного исследования молекулы: параметры
ячейки, пространственную группу, координаты атомов и параметры атомов,
требующиеся для создания трехмерных молекулярных и кристаллических структур. 1D информация
содержит библиографическую и химическую информацию (название соединения и
эмпирическую формулу), включая некоторые пометки, такие как: “данные
нейтронографии”, “абсолютная конфигурация” и др. Здесь же в КБСД находятся
пометки о том, что соединение имеет полиморфы: “кристаллы данной фазы имеют
красный цвет” или “метастабильный полиморф”, “Форма II” (если
авторы первой публикации заметили это свойство, или если при реферировании было
выявлено, что структура имеет полиморфы). Во многих случаях замечание о том,
что это особая кристаллическая форма, делается лишь когда публикуется второе,
третье и последующие соединения из серии полиморфов. Запись первого соединения
может не содержать такого указания, поскольку авторам могло быть не известно о
существовании полиморфов. Это может быть и в случае установления последующих
структур. В начале существования КБСД записи полиморфных структур получали
разные идентификаторы (Refcode) -
уникальный идентификатор для каждого химического соединения. Усложненное
программное обеспечение, использующееся сегодня для архивирования данных,
предотвращает дублирование и устраняет многих из ранее появившихся “сирот”,
хотя некоторые могут существовать и до сих пор. Как только один представитель
из серии полиморфных соединений установлен, надо позаботиться о том, чтобы
устранить все записи, относяшиеся к тому же соединению, включая те, которые не
отмечены соответствующими дескрипторами. Резюмируя, можно сказать, что
отсутствие дескриптора, свидетельствующего, что соединение относится к серии
полиморфов, не является достаточным доказательством этого. Чтобы удостовериться
в этом, необходимо обратиться к прочим литературным данным.
Пример осторожности, которую следует
проявить при проведении подобных поисков и анализе полученных результатов, был
показан Гавеззотти и Филиппини. Поиск был проведен для органических соединений,
которые содержали только атомы C, H, N, O, F, Cl и S, и для
которых были известны структурные данные более чем для одного полиморфа. Всего
было найдено 163 кластера (под кластером понимается группа полиморфных
кристаллических структур одного итого же соединения). Из них 147 содержали две
структуры, 13 - три, 4 - четыре структуры. Авторы отмечают, что эти цифры -
“первые свидетельства большой распространенности полиморфизма в органических
соединениях”, хотя число кластеров составляет сравнительно небольшой процент
всех записей в базе данных. Число этих кластеров скорее отражает интерес
авторов к конкретной серии полиморфов. Мерой, отражающей реальную ситуацию
того, как часто встречается полиморфизм в этих соединениях, является количество
соединений в базе данных, для которых известно образование полиморфных
модификаций, без учета того, определено ли более одной структуры или нет.
.2.5 МЕТОДЫ И УСЛОВИЯ КРИСТАЛЛИЗАЦИИ
ПОЛИМОРФОВ
Поведение при кристаллизации медного
комплекса 1 демонстрирует эффект изменения концентрации при одновременном
возникновении полиморфов, а также роль концентрации в соотношении модификаций.
Келли с соавторами получил голубые кристаллы соединения 1, которые выпадали из
“достаточно концентрированного раствора в ацетонитриле”, где атом меди
находиться псевдотетраэдрическом координационном окружении.
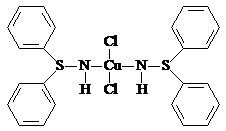
Рис. 1.2. Соединение 1
Это простейший пример истинного полиморфизма.
Синие кристаллы с плоскокоординированной медью при рекристаллизации приводят к
смеси двух типов кристаллов. На самом деле авторы утверждали, что две формы
срастались и вырастали, по-видимому, случайно. Зеленая форма получается только
из разбавленного раствора, и как только она получается, синяя форма уже не
может быт образована. Последовательность событий и экспериментальные условия
согласуются с правилом Оствальда о стадиях (термодинамическая стабильность
зеленой формы немного больше таковой синей формы) и явлением исчезновения
полиморфов. Как только зародыш более устойчивой зеленой формы присутствует в
среде, синяя форма уже не может быть получена.
Влияние температурного фактора на
поведение полиморфов может быть продемонстрировано на примере дифенил карбамида
2 - одной из систем, которую изначально цитировал Грот, и позднее исследовали
Эттер и Хунг.

Рис. 1.3. Соединение 2
Данное соединение кристаллизуется в
трех формах: α
- желтые
призматические иглы; β
- белые
иглы; γ
- плоские
призмы. При кристаллизации из 95% ного этанола в диапазоне температур 30-75 ºC формы α и β всегда
кристаллизуются совместно, даже в присутствии зародышей той или иной формы.
Соотношения полиморфов можно регулировать посредством температуры, так как
форма α
предпочтительно
кристаллизуется при более высоких температурах. При упаривании маточного
раствора при обычной “лабораторной” температуре (13ºC)
кристаллизуется только γ-полиморф,
нагревание того же раствора приводит также к образованию β-формы. При
40ºC γ-полиморф
больше не кристаллизуется, тогда как в незначительных количествах появляется α-форма. На
основании экспериментов с использованием 95% ного спиртового раствора γ-формы авторы
предполагают, что данный полиморф является стабильным при комнатной
температуре. По мере повышения температуры сначала кристаллы β, а потом и α-формы
являются стабильными. Тем не менее подобное поведение может также определяться
влиянием растворителя. Данная система достаточно сложная, в ней присутствует
особый баланс между относительными устойчивостями трех форм, а также
кинетическими факторами, определяющими их появление.
Кристаллизация сопутствующих
полиморфов (В ситуации, когда наблюдается перекрывание областей возникновения,
две или более полиморфные модификации могут возникать одновременно или
поочередно, что приводит к формированию нескольких модификаций при одинаковых
условиях. Данное явление носит название - сопутствующих полиморфов.),
безусловно, ограничена кристаллизацией из раствора, а не сохранением неизменной
конформации молекулы.
При заданной температуре можно
ожидать, что каждый из полиморфов будет обладать различными значениями давления
насыщенного пара. Это на самом деле является основой метода очистки
сублимацией. Тем не менее существуют примеры, когда две формы обладают близкими
значениями давления насыщенного пара при заданной температуре. В таких случаях
возможна одновременная сублимация двух полиморфов. Это явление может
наблюдаться вблизи точки фазового перехода или вследствие сближения двух кривых
на большом температурном интервале, либо при их сближенности в области
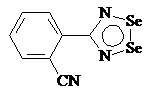
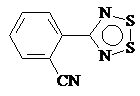
температур, где происходит сублимация. Например, соединения 3 и 4 образуют две
фазы при сублимации тогда как 5 существует в трех модификациях, обладающих
разным цветом:

4
5
Рис. 1.4. Соединения 3, 4, 5
Соединение 3 при медленной
сублимации при 140ºC и 0,1 Тор
привело к образованию нескольких игольчатых кристаллов (Tпл=192-193ºC),
покрывающих основную массу “блестящих призм медного цвета” (Tпл=220-223ºC), которые
можно механически отделить для дальнейшего анализа. Соединение 4 также получали
очисткой путем сублимации в вакууме (120ºC/10-2Тор),
что привело к разделению игольчатых кристаллов насыщенного красного цвета (α-фаза, Tпл=157-160ºC) и призм (β-фаза, Tпл=165-168ºC).
Определение кристаллической структуры 4 показало значительную разницу в
молекулярной геометрии: цис-димеры в α-форме и транс-димеры в β-форме.
Другим примером совместного
образования полиморфов при сублимации является соединение 6, для которого
условия сублимации систематически изменяли с целью получения второго полиморфа.
Форма α
изначально
была получена в виде игольчатых монокристаллов золотистого цвета при очень
медленной сублимации в течении нескольких недель при 10-6Тор, при
этом образец нагревался до 180ºC, а охлаждающий элемент имел
температуру 100ºC. Повышение
давления до 10-1-10-2Тор и нагрев образца до 220ºC, а
охлаждающего элемента до 120-140ºC также
привели к образованию α-формы, но с
небольшим количеством β-формы.
Электрокристаллизация, особенно для
комплексов, состоящих из двух компонентов, - метод, предоставляющий
допольнительные степени свободы, помимо остальных условий обычной кристаллизации:
напряжение, сила тока, противоионы, природа электролита, материал электродов и
т.д. изменяя силу тока и напряжение, можно добиться реализации различных
условий кристаллизации: от термодинамического до кинетического контроля. Таким
образом, предпринимаются попытки кристаллизации в различных условиях, и
множество индивидуальных кристаллов, полученных в результате одного и того же
эксперимента могут быть подвергнуты последующим структурным и физическим
исследованиям. Это наиболее предпочтительные подходы для получения и
распознавания полиморфизма и сопутствующих полиморфов.
Взаимная диффузия насыщенных
растворов является другим методом приводящим к образованию нескольких
полиморфов, которые включают в себя различные модификации, обладающие очень близкой
растворимостью в исходных растворителях.
.2.6 ПОЛИМОРФИЗМ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ
Возрастание осведомленности о
полиморфизме и его важности, возможно, нигде так не очевидно, как в области
лекарственных препаратов. Основополагающие работы Бюргера и Блума и МакКрона не
делали какой-либо особый акцент на лекарственные препараты. Одним заметным
исключением была книга Кофлер и Кофлер, авторы которой были членами
академического департамента фармакагнозии. Конструктивной статьей в области
полиморфизма лекарственных препаратов был обзор Хэлиблаена и МакКрона,
установивший границы и стандарты для многих последующих работ. Литература по
полиморфизму фармацевтических препаратов на данный момент представлена в
большом количестве. Появились монографии, охватывающие различные аспекты этой
проблемы, и постоянно увеличивается число обзоров, рассматривающие различные
аспекты полиморфизма в приложении к проблемам фармацевтики и лекарственных
соединений, включая права экономической и интеллектуальной собственности. Появляются
все большее число исследований, посвященных обнаружению и описанию различных
кристаллических модификаций фармацевтических соединений. Изучаются сложные
зависимости энергии от температуры, явления необычной химии кристаллов, влияния
состава лекарственного вещества на химическую реакционную способность.
Также возникают различные проблемы и
при производственных процессах. Замена оборудования, различия между чистотой
лабораторных и промышленных реагентов, колебания в скорости нагрева-охлаждения,
процедурах перемешивания, использование затравок и т.д., все это может повлиять
на результат кристаллизации и форму получаемого вещества. Лишь немногое из этой
информации описано в литературе, поскольку это часто является предметом
экспериментальных разработок и хранится как секрет фирмы или как информация,
доступная только промышленному концерну, хотя упоминание о ней может быть
найдено в литературе. Увеличение масштабов производства и последующий подбор
состава также содержат большое число сложных процедур процесса производства, на
который оказывают влияние физические и механические свойства твердых веществ
как функции от получающейся кристаллической модификации. Некоторые из процедур
были описаны Хуллигером, включая силу растяжения, сжатия, реологические свойства,
параметры фильтрации и сушки.
Органы государственного
регулирования уделяют все возрастающее внимание получению, определению,
описанию, чистоте и свойствам кристаллической формы, используемой в
фармацевтических продуктах. Бирн представил набор решений для представления
данных по различным кристаллическим формам (полиморфам, сольватам,
десольватированным сольватам и аморфным формам) в органы регулирования.
Международный комитет по регулированию создал руководство (Q6A) для
описания случаев полиморфизма в лекарственных препаратах.
1.3 КРАТКОЕ ОБОБЩЕНИЕ ПРЕДСТАВЛЕНИЙ
О КЛАТРАТООБРАЗОВАНИИ И ПОЛИМОРФИЗМЕ
Таким образом, изучение явлений
клатратообразования, начатое в 1947 году Г. Пауэллом, и полиморфизма является
на сегодняшний день весьма актуальным. Об этом можно судить из современных
многочисленных и разнообразных исследований в этих областях. Исходя из
обсужденных нами выше данных, можно сделать следующие выводы:
1. Объекты клатратной химии разнообразны, от
молекулярных комплексов неорганических соединений до биоорганических
полимолекулярных комплексов.
2. Псевдополиморфы, сольваты и гидраты тоже
являются клатратными соединениями.
. На формирование клатратов влияет фактор
растворителя.
. Полиморфные модификации пока не имеют
однозначно общепринятой номенклатуры, хотя инициативы в направлении унификации
имеются.
. В КБСД содержатся примерно 3 %
полиморфов, 16% сольватов и 10% гидратов.
. Клатратные и полиморфные соединения
широко используются на практике и в промышленности.
ГЛАВА 2. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
.1 ХАРАКТЕРИСТИКА
ОБЪЕКТОВ ИССЛЕДОВАНИЯ
Хинолизидиновый алкалоид цитизин
выделен из семян растения ракитника (Cytisus laburnum L.) и
термопсиса ланцетолистного (Thermopsis lanceolata R. Br.) - оба из
семейства бобовых (Leguminosae). Алкалоид относится к веществам
“ганглионарного” действия и в связи с возбуждающим действием на дыхательный
центр рассматривается как дыхательный аналептик (выпускается препарат под
названием “Цититон”). В последние годы обнаружены новые биоактивные свойства, в
частности, цитизином стали пользоваться как средством для отвыкания от курения
(таблетки “Лобесил”
<#"876019.files/image007.gif">
R = (CH2)n-CH3,
где
n=0 - 5
При исследовании рентгеноструктурным
анализом кристаллов N-(3-метил- и
-этилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизинов, полученных из различных
растворителей, обнаружили, что N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизин
может формировать кристаллосольваты 1 - 6.
В данной работе в
кристаллохимическом аспекте представляло интерес изучение влияния температуры и
эффекта среды на формирование кристаллов, изучение стереохимии и
конформационных особенностей пространственного строения молекул в кристалле,
изучение на наличие явлений сольватообразования.
2.2 КРИСТАЛЛОСОЛЬВАТЫ N-(3-МЕТИЛТИО-5-АЦЕТАМИДО-1,2,4-ТИАДИАЗОЛИЛ)ЦИТИЗИНА
Результаты РСА показали, что в кристаллах 1, 2,
3, 4, 5 и 6 содержатся молекулы кристаллизационной воды, хлороформа, метанола,
бензола, пиридина и диоксана соответственно, т.е. при кристаллизации происходит
явление включения. Если, в кристаллах 1, 2 и 3 сольватные (гостевые) молекулы
включаются в соотношении 1:1, то в 4, 5 и 6 молекулы растворителя содержатся в
соотношении 2:1 (в независимой части элементарной ячейки имеются две молекулы N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизина
(4а и 4b; 5а и 5b;
6а и 6b;) и одна молекула
сольвата). Хотя, кристаллы, выращенные из водных метанола, этанола и ацетона
растут в виде гидратов (1), которые устойчивы в атмосфере.
|
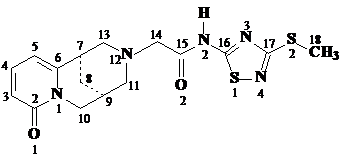 • H2O • H2O
|
(1)
|
|
|
•
СНСl3
|
(2)
|
|
•
СН3OH
|
(3)
|
|
•
0.5С6Н6
|
(4)
|
|
•
0.5С5Н5N
|
(5)
|
|
•
0.5С4Н8O2
|
(6)
|
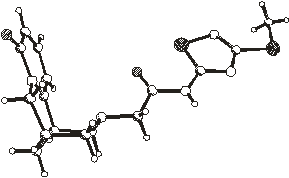
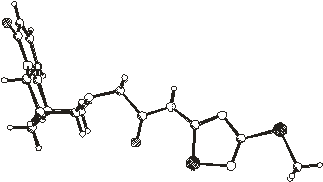
Строение молекулы N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизина
в кристаллах 1 - 6 приблизительно в одинаковой проекции (перпендикулярной
плоскости четырех атомов С7, С9, С11, С13) показано на рис.2.1. Относительно
жесткое цитизиновое ядро в этих 1 - 6 структурах конформационно не
различается
и
практически не отличается от найденного для самого цитизина и в его разных
производных по атому N12.
, 3 2
а, 5a, 6a 4b, 5b, 6b
Рис.2.1. Пространственное строение
молекул в кристаллах 1 - 6
Громоздкий N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)ный
фрагмент (атомы N12-…-С18) во всех (1 - 6) независимо
найденных молекулах практически плоский с точностью ±0.016 (1), ±0.013 (2), ±0.058 (3), ±0.054 (4а), ±0.095 (4b) Å, ±0.106 (5а), ±0.139 (5b), ±0.096 (6а), ±0.137 (6b) Å. В этом
фрагменте (син-, анти-) расположение карбонильной и S-CH3 групп
относительно пятичленного кольца в молекулах 1, 3, 4а, 4b, 5a, 5b, 6a и 6b идентичны,
а в 2 S-CH3 группа
перевернута приблизительно на 180º относительно тиазолильного
кольца по сравнению предыдущими структурами, хотя лежит в плоскости этого
кольца (табл.2.1). В этом фрагменте карбонильная группа и атом S1
тиазолильного кольца взаимно син-расположены. В этих структурах не
зафиксировано образование инвертомеров (рассматриваемые как Z и
Е-изомеры), которые могут возникать из-за заторможенного вращения вокруг C15-N2 связи.
Таблица 2.1.
Торсионные углы вокруг связей -N12-C14-, -C14-C15- и -C17-S2-,
характеризующие конформацию молекул в структурах 1 - 6
|
Структура
|
С11-N12-C14-C15
|
N12-C14-C15-N2
|
N4-C17-S2-C18
|
|
1
|
-171.5
|
-167.6
|
3.7
|
|
2
|
-141.5
|
-0.7
|
178.1
|
|
3
|
-160.9
|
-174.6
|
0.8
|
|
4a
|
64.9
|
176.2
|
-0.4
|
|
4b
|
-161.7
|
44.8
|
-4.5
|
|
5a
|
64.6
|
177.3
|
-1.2
|
|
5b
|
-161.3
|
43.6
|
-4.9
|
|
6a
|
69.4
|
168.0
|
-3.3
|
|
6b
|
-162.9
|
34.1
|
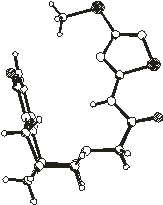
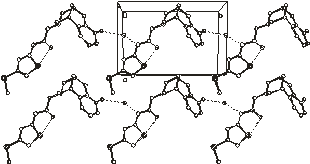
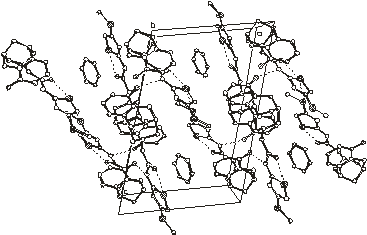
Упаковка молекул в кристаллосольватах 1 - 6
показана на рис.2.2.
В кристалле 1 обнаруживается межмолекулярная
Н-связь с участием молекулы воды по схеме: >N2-H…Ow-H…O1=.
Молекулы N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизина,
преобразованные винтовыми осями 21 посредством кристаллизационной
молекулы воды, образуют бесконечную цепь вдоль оси b.
Параметры Н-связи N2-H…Ow
следующие: расстояния N2…Ow
2.780 Å и Н…Оw
2.02 Å, а угол N2-H…Ow
равен 147º. Для следующей
Н-связи (Ow-H…O1)
эти параметры соответственно равны: расстояния Ow…O1
2.720 Å и H…O1
1.87 Å, а угол Ow-H…O1
равен 162º. Также в
кристаллической структуре 1 наблюдается внутримолекулярное короткое
взаимодействие между карбонильным кислородом (О2) и серой (S1)
тиазолильного кольца (2.570 Å).

1
2
2
3 4
Рис.2.2. Упаковка молекул в
кристаллических структурах 1 - 4
В кристалле 2 сольватная молекула
хлороформа располагается в пустотах упаковки молекулы «хозяина» и также
находится на расстоянии Ван-дер-ваальсовых взаимодействий от окружающих ее
молекул (рис.2.2). Причиной этому возможно является более «складывающаяся»
конформация молекулы. Также в кристаллической структуре 2 наблюдается
внутримолекулярное короткое взаимодействие между карбонильным кислородом (О2) и
серой (S1)
тиазолильного кольца (2.661 Å).
Аналогичную с структурой 1,
водородную связь образует в кристалле 3 сольватная молекула метанола, где также
обнаруживается межмолекулярная Н-связь с участием молекулы метанола по схеме: >N2-H…Oм-Н…О1=. В
кристалле молекулы N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизина,
транслированные вдоль оси b через сольватную молекулу
метанола, образуют бесконечную цепь (рис.2.2). Параметры Н-связи N2-H…Oм следующие:
расстояния N2…Oм 2.720 Å и Н…Ом 1.97 Å, а угол N2-H…Oм равен 167º. Для другой
Oм-H…O1 Н-связи
эти параметры соответственно равны 2.690, 1.96 и 167º. Также в
кристаллической структуре 3 наблюдается внутримолекулярное короткое
взаимодействие между карбонильным кислородом (О2) и серой (S1)
тиазолильного кольца (2.603 Å).
В кристалле 4, как и в 1, 3 атомы N2 и О1 двух
независимых молекул участвуют в образовании межмолекулярной Н-связи. Кроме
того, наблюдается межмолекулярное короткое взаимодействие S…S (расстояние
S1b…S2b (1-x, -0.5+y, 1-z) 3.650 Å короче суммы
Ван-дер-ваальсовых радиусов). Две независимо найденные молекулы производного
цитизина связаны Н-связью N2b-H2b…О1a и N2a-H2a…O1b при
преобразовании симметрией трансляции. Параметры этой связи соответственно
следующие: 2.830, 2.10, 143º и 2.730, 1.89 164º. Также в
кристаллической структуре 4 наблюдается внутримолекулярное короткое
взаимодействие между карбонильным кислородом (О2) и серой (S1)
тиазолильного кольца (2.704
Å и
2.641 Å
для
O2a-S1a и O2b-S1b
соответственно). Эти межмолекулярные контакты в кристалле образуют трехмерный
каркас. Сольватная молекула бензола в кристалле расположена в пустотах этого
каркаса (упаковки) и находится на расстоянии Ван-дер-ваальсовых взаимодействий
окружающих его молекул.
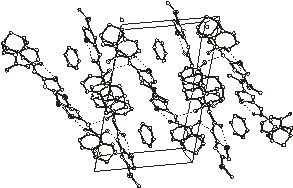
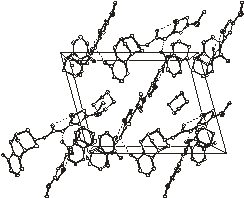
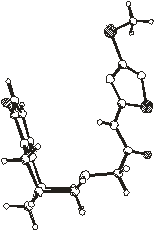
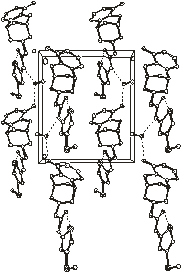
6
Рис.2.3. Упаковка молекул в кристаллических
структурах 5 и 6
Упаковка молекул в
кристаллосольватах 5 и 6 показана на рис.2.3. В асимметрической части
кристаллических упаковок 5 и 6 находятся две молекулы N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизина
(хозяина) и одна молекула растворителя (гостя).
В кристалле 5 анализ упаковки
показывает наличие межмолекулярных взаимодействий между конформационно
различными молекулами хозяина по схеме N-H…O=С,
благодаря которым образуется бесконечная лента вдоль оси b, состоящая
из последовательно расположенных молекул a и b. Параметры
этих взаимодействий следующие: расстояния N2a…O1b 2.710 Å и H2a…O1b 1.93 Å, угол N2a-H2a…O1b равен 171º, а также
расстояния N2b…O1a 2.830 и H2b…O1a 2.10 Å, угол N2b-H2b…O1a равен 143º. Также в
кристаллической структуре 5 наблюдается внутримолекулярное короткое
взаимодействие между карбонильным кислородом (О2) и серой (S1)
тиазолильного кольца (2.693 Å и 2.625 Å для O2a-S1a и O2b-S1b
соответственно).
В структуре 6 анализ упаковки также
показывает наличие межмолекулярных взаимодействий между конформационно
различными молекулами хозяина по аналогичной схеме, наблюдаемой в 5. Параметры
этих взаимодействий следующие: расстояния N2a…O1b 2.720 Å и H2a…O1b 1.71 Å, угол N2a-H2a…O1b равен 165º, а также
расстояния N2b…O1a 2.850 и H2b…O1a 2.20 Å, угол N2b-H2b…O1a равен 142º. Также в
кристаллической структуре 6 наблюдается внутримолекулярное короткое
взаимодействие между карбонильным кислородом (О2) и серой (S1)
тиазолильного кольца (2.713 Å и 2.615 Å для O2a-S1a и O2b-S1b соответственно).
Сравнение вышеуказанных параметров
для кристаллических структур 4, 5 и 6 подтверждает их изоструктурность.
В этих структурах не зафиксировано
образование инвертомеров, которые могут возникать из-за заторможенного вращения
вокруг -N2-C15-связи.
Таким образом, анализ
пространственного строения N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизина
в структурах 1 - 6 показывает, что в кристалле наблюдается 4 конформера,
различающихся расположением тиадиазолилного фрагмента относительно цитизинового
ядра. Следовательно, конформерия
вокруг N12-C14 и C14-C15 связей N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)ного
заместителя возможно способствует образованию разных кристаллосольватов N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизина
в зависимости условий кристаллизации (от среды).
ГЛАВА 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1 ПОЛУЧЕНИЕ МОНОКРИСТАЛЛОВ
ИЗУЧЕННЫХ ВЕЩЕСТВ
Монокристаллы сольватов N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизина,
подходящие для РСА были выращены из водного раствора этанола, предварительно
абсолютизированных растворов хлороформа, метанола, бензола, пиридина и диоксана
путем медленного испарения при комнатной температуре (исключения составляют
только монокристаллы сольвата N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)
цитизина с пиридином, выращенные в холодильнике (-3ºC)). При этом
было замечено, что при использовании водного раствора метанола или других
водных органических растворов также предпочтительно включались молекулы воды и
образовывались гидраты.
.2 ОПРЕДЕЛЕНИЕ КРИСТАЛЛОГРАФИЧЕСКИХ
ПАРАМЕТРОВ И СБОР ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ
Монокристаллы для проведения РСА
предварительно отбирались с помощью микроскопа МБС-9, нестабильные были покрыты
оболочкой эпоксидной смолы. Далее трехмерный набор отражений отобранного
монокристалла получен на соответствующем дифрактометре.
Дифракционные данные соединений были
получены на дифрактометре Stoe Stadi-4
(графитовый монохроматор). Трехмерный набор отражений для этих кристаллов
получен на том же дифрактометре w/2q-методом сканирования, для
монокристаллов с использованием MoKα-излучения.
Сбор данных дифрактометром STOE
осуществляется под управлением программы STADI-4,
работающей в среде операционной системы WINDOWS. Для
повышения точности эксперимента проведенном на дифрактометре Stoe Stadi-4
вводилась поправка на поглощение методом Psi scan. Далее полученные наборы
отражений обрабатывались с помощью программы XRED. Она
применяет следующую корректуру на измеренную интенсивность: фактор поляризации
Лоренца, масштабирование относительно стандартных отражений, сферическая,
эмпирическая или числовая корректировка на поглощения.
Стандартные стадии типичного
рентгеноструктурного эксперимента, проведенные нами на дифрактометре Stoe Stadi-4,
заключались в следующем:
установление гониометрической
головки и центрирование кристалла в четырёхкружном дифрактометре.
определение параметров элементарной
ячейки и типа решетки Браве.
уточнение и центрирование матрицы
ориентации - расположения осей кристалла по отношению гониометра
четырехкружного дифрактометра.
ввод стандартных отражений (обычно
используются 3 осевых отражения) и сбор данных - интенсивностей отражений с H K L.
Сбор данных осуществляется
автоматически, дифрактометр ежечасно проверяет контрольные отражения. В случае
изменения их интенсивности более чем на 10% или после 8 часов сбора данных
дифрактометр автоматически заново уточняет матрицу ориентации.
.3 РАСШИФРОВКА И УТОЧНЕНИЕ СТРУКТУР
В настоящее время используется
большое количество программ для расшифровки и уточнения кристаллической структуры.
Нами использованы для расшифровки структур широко распространенная программа
SHELXS-97 и модели
структур уточнялись методом наименьших квадратов (МНК) по программе SHELXL-97.
Комплексная программа SHELX была создана 1970 году в
Кембриджском Университете, для расшифровки и уточнения низкомолекулярных
структур и была распространена в марте 1972 года. После компиляции программы
для IBM 370 было
создана версия SHELX-76. В связи с появлением все более
мощных компьютеров и совершенствованием техники эксперимента,
совершенствовалась, и программа SHELX и стало возможным применение
этой программы даже для уточнения макромолекул (белковых молекул). Программа
применяет прямой расчет структурных факторов, не обращаясь к суммированию на
основе алгоритма быстрого преобразования Фурье, и поэтому работает гораздо
медленнее, чем специально разработанные для уточнения макромолекул программы.
Но это компенсируется более высокой точностью и универсальностью и в некоторой
степени лучшей сходимостью, что в конечном счете уменьшает объем необходимого
ручного вмешательства в процесс построения модели. Большим достоинством
программы является простота ее использования, интуитивный интерфейс и
возможность применения практически на любых типах компьютеров. На сегодняшний
день программа SHELX распространяется бесплатно для
академических институтов и университетов в версиях для различных популярных
операционных систем.
Исследованные нами кристаллические
структуры определены прямыми методами по программе SHELXS-97 и
уточнялись МНК в последовательно полноматричном изотропно-анизотропном
приближении по программе SHELXL-97 для неводородных атомов. Атомы, не найденные
в исходном Фурье-синтезе, были локализованы из серии последовательных
разностных синтезов электронной плотности. После локализации всех неводородных
атомов проведены уточнения структуры МНК. Стандартным показателем точности
определения структуры служил R-фактор:
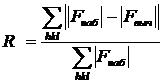 (3.1)
(3.1)
гдеR
- фактор расходимости;
Fнаб -
наблюдаемые амплитуды структурных факторов, т.е. таких факторов, которые
получаются на основе экспериментальных измерений интенсивности дифрагированного
пучка;
Fвыч -
амплитуды, рассчитанные на основе постулированной пробной структуры;
hkl - индексы
отражения от ряда параллельных плоскостей, а также
координаты точки обратной решетки.
Все атомы водорода в структурах были выявлены
объективно из разностного синтеза электронной плотности и включены в уточнение
с изотропными тепловыми параметрами.
Материалы рентгеноструктурного
анализа (параметры ячеек, координаты атомов, длины связи и валентные углы) в
виде CIF файла депонированы в КБСД (табл.3.1), которые можно получить по
веб-линку: www.ccdc.cam.ac.uk/data_request/cif.
Таблица 3.1.
Основные кристаллографические параметры
рентгеноструктурного эксперимента исследованного структуры.
|
Структура
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Молекулярная
формула
|
C16H19N5O2S2 ·H2O
|
C16H19N5O2S2 ·СHCl3
|
C16H19N5O2S2 ·СH3OН
|
2(C16H19N5O2S2)·C6H6
|
2(C16H19N5O2S2)·C5H5N
|
2(C16H19N5O2S2)·C4H8O2
|
|
Mr/гмол-1
|
395.50
|
496.85
|
409.52
|
833.11
|
834.06
|
843.07
|
|
Сингония
|
Моноклинная
|
Ромбическая
|
Моноклинная
|
Моноклинная
|
Моноклинная
|
|
Пространственная
группа
|
P 21
|
P212121
|
P21
|
P 21
|
P 21
|
P 21
|
|
Z
|
2
|
4
|
2
|
2
|
2
|
2
|
|
a, Å
|
8.003(5)
|
7.25(2)
|
8.211(2)
|
11.130(7)
|
11.060(6)
|
11.978(10)
|
|
b, Å
|
11.847(7)
|
9.51(1)
|
11.994(7)
|
11.448(9)
|
11.427(7)
|
11.389(9)
|
|
c, Å
|
9.867(5)
|
32.28(5)
|
10.272(6)
|
16.747(9)
|
16.581(7)
|
16.025(7)
|
|
β
|
99.52(5)
|
|
92.64(4)
|
105.30(5)
|
105.61(3)
|
105.59(5)
|
|
V, Å3
|
921.9(9)
|
2227.5(8)
|
1010.6(8)
|
2058(2)
|
2018.3(19)
|
2105.7(3)
|
|
r,
г/см3
|
1.425
|
1.482
|
1.345
|
1.344
|
1.372
|
1.330
|
|
Размеры
кристалла (мм)
|
1.00х0.75x0.75
|
0.80х0.30x0.15
|
1.00х0.75x0.72
|
1.00х0.50x0.30
|
0.50х0.25х0.25
|
0.50х0.25x0.10
|
|
Область
сканирования 2q
|
2.0£q£25º
|
2.23£q£25º
|
1.50£q£27.5º
|
1.50£q£26.00º
|
1.77£q£26º
|
|
mexp
(см-1)
|
0.32
|
0.62
|
0.29
|
0.28
|
0.29
|
0.28
|
|
Число
отражений
|
1672
|
2220
|
2438
|
4259
|
4195
|
4365
|
|
Число
отражений с I>2s(I)
|
1568
|
1297
|
2212
|
3478
|
2536
|
2155
|
|
R1 (I>2s(I)
и общее)
|
0.0301 (0.0343)
|
0.0977 (0.1692)
|
0.0315 (0.0377)
|
0.0449
(0.0635)
|
0.0777 (0.1489)
|
0.0967(0.2109)
|
|
wR2
|
0.0657 (0.0685)
|
0.2264 (0.2810)
|
0.0766 (0.0818)
|
0.0896
(0.1040)
|
0.1005 (0.1256)
|
0.1080(0.1410)
|
|
S
|
1.14
|
1.10
|
1.12
|
1.16
|
1.22
|
1.23
|
|
Разностные
пики элек-тронной плотности (e.Å-3)
|
0.17 и -0.15
|
0.35 и -0.34
|
0.17 и -0.15
|
0.18 и
-0.21
|
0.23 и
-0.23
|
0.26 и
-0.22
|
|
CCDC
|
652423
|
652422
|
652424
|
652425
|
706492
|
706491
|
|
REFCODE
|
IFILIT
|
IFILEP
|
IFILOZ
|
IFILUF
|
LAJDAD
|
LAJCUW
|
ЗАКЛЮЧЕНИЕ
1. Определены методом РСА 6 новых
кристаллических структур N12
производных цитизина. В исследованных структурах выявлены геометрические
характеристики молекул и природа внутри- и межмолекулярных взаимодействий.
2. Установлено, что N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизины
могут образовывать различные сольваты в зависимости от среды кристаллизации -
являются клатратогенами.
. Установлено, что в исследованных
кристаллосольватах N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизинов
молекулы растворителя расположены в замкнутых пустотах «криптатного» типа.
. Выявлено, что в изученных
кристаллических структурах сольватов N-(3-метилтио-5-ацетамидо-1,2,4-тиадиазолил)цитизинов
молекула хозяина принимает только четыре конформации, различающиеся
расположением тиадиазолильного фрагмента относительно цитизинового ядра.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
. Хакимова
Т.В., Пухлякова О.А., Шавалеева Г.А., Фатыхов А.А., Васильева Е.В., Спирихин
Л.В.. Синтез и стереохимия новых N-замещенных
производных цитизина // Хим. природ. соедин. -Ташкент, 2001. -№ 4. -С. 301-305.
. Краснов
K.A.,
Карцев В.Г., Горовой A.С.,
Хрусталев В.Н. Химическая модификация растительных алкалоидов III.
Исследование пространственного строения
1,3-диметил-5-арилметил-5-цитизилметилбарбитуровых кислот методами РСА и ЯМР //
Хим. природ. соедин. -Ташкент, 2002. -№ 5. -С. 367-373.
. Palin
D.E., Powell H.M. The structure of molecular compounds. Part III. Crystal
structure of addition complexes of quinol with certain volatile compounds // J.
Chem. Soc. -Cambridge, 1947. -P. 208-221.
5. Powell
H.M. The structure of molecular compounds. Part IV. Crystal structure of
addition complexes of quinon with certain volatile compounds // J. Chem. Soc.
-Cambridge, 1948. -P. 61-69.
6. Schlenk
H., Holman R.T. Urea and thiourea adductions of C5-C42-hydrocarbins // J. Amer.
Chem. Soc. -Washington, 1952. -V.
74. -P.
1720-1723.
7. Schlenk
H., Holman R.T. The urea complexes of unsaturated fat acids // Science.
-Washington, 1950. -V. 112. -P. 19-20.
8. Clapp
L.B. The chemistry of the coordination compounds. -New York: Reinhold
Publishing Corp., 1956. -35 p.
9. Ketelaar
J.A. Chemical constitution. -New York: Elsevier Pub. Co., 1958, -363 p.
10. Cramer
F., Dietche W. Ocdusion compounds. XV. Resolution of racemates with
cyclodextrins // Ber. -Weinheim, 1959. -V.92. -P.378-384.
11. Haleblian
J.K. Characterization of habits and crystalline modification of solids and
their pharmaceutical applications // J. Pharm. Sci. -Malden,
1975. -V.64.
-P.
1269-1288.
12. Китайгородский
А.И. Молекулярные кристаллы. -М.: Наука, 1971. -424 с.
. Китайгородский
А.И. Смешанные кристаллы. -М.: Наука, 1983. -277 с.
14. Belosludov
V.R., Lavrentiev M.Yu., Dyadin Yu.A. Theory of Clathrates
<http://www.springerlink.com/content/n04222wk1687w60k/?p=ea3c21635af4457fb826419091a4b6a3&pi=0>
// J. Inclus. Phenom. -Amsterdam,
1991. -V.
10. -P.
399-422.
15. Никитин
Б.А. Избранные труды. Исследования по химии благородных газов. -М.:
Издательство АН СССР, 1956. -104 с.
. Powell
H.M. The structure of molecular compounds. Part IV. Clathrate compounds // J.
Chem. Soc. -Cambridge, 1948. -P. 61-73.
17. Дядин
Ю.А., Терехова И.С., Родионова Т.В., Солдатов Д.В. Полвека клатратной химии //
Журн. структур. химии. -Новосибирск, 1999. -Т. 40, -№ 5. -С. 797-808.
. Breck
D.H. Zeolite Molecular Sieves: Structure, Chemistry and Use. -New York: Wiley,
1974. -771 p.
19. MacNicol
D.D., McKendrick J.J., Wilson D.R. Clathrates and molecular inclusion phenomena
// Chem. Soc. Rev. -Cambridge,
1978. -V.
7. -P.
65-87.
20. Гойхман
А.Ш., Соломко В.П. Высокомолекулярные соединения включения. -Киев: Наукова
думка, 1982. -531 с.
. Davies
J.E.D., Kemula W., Powell H.M., Smith N.O. Inclusion compounds -Past, present,
and future
<http://www.springerlink.com/content/t356272wt8110x71/?p=6ecd1adf64b14604991d852f5b21d95f&pi=1>
// J. Inclus. Phenom.
-Amsterdam,
1983. -V.
1. -P. 3-44.
22. Weber
E., Josel H.-P. A proposal for the classification and nomenclature of
host-guest-type compounds // J. Inclus. Phenom. -Amsterdam,
1983. -V.
1. -P.
79-85.
23. Дядин
Ю.А., Удачин К.А., Бондарюк И.В. Соединения включения. -Новосибирск: НГУ, 1988.
-92 с.
. Georges
Tsoucaris, Jerry L. Atwood and Janusz Lipkowsky. Crystallography of
Supramolecular Compounds. NATO ASI Series, Series C: Mathematical and Physical
Sciences. -Dordrecht, Kluwer Academic Publishers, 1996. -520 p.
25. Pedersen
C.J. Cyclic polyethers and their complexes with metal salts
<http://pubs.acs.org/doi/abs/10.1021/ja00986a052> // J. Amer. Chem. Soc. -Washington,
1967. -V.
89. -P.
2495-2496.
26. Pedersen
C.J. Cyclic polyethers and their complexes with metal salts
<http://pubs.acs.org/doi/abs/10.1021/ja01002a035> // J.
Amer. Chem.
Soc. -Washington,
1967. -V.
89. -P.
7017-7036.
27. Pedersen
C.J. The discovery of crown ethers
<http://www.springerlink.com/content/p8k87751712jl727/?p=89a1e60ab9454899aa5a032c50c331e3&pi=0>
// J. Inclus. Phenom. -Amsterdam,
1988. -V.
6. -P.
337-350.
28. Lehn
J.-M. Cryptates: inclusion complexes of macropolycyclic receptor molecules //
Pure Appl. Chem. -Research
Triangle Park, 1978. -V.
50. -P.
871-892.
29. Lehn
J.-M. Supramolecular chemistry - Scope and perspectives: Molecules -
Supermolecules - Molecular devices // J. Inclus. Phenom. -Amsterdam,
1988. -V.
6. -P.
351-396.
30. Cram
D.J. The design of molecular hosts, guests, and their complexes
<http://www.springerlink.com/content/nh0512537010u206/?p=904d9f07d2c449749aca49f9265f026a&pi=2>
// J. Inclus. Phenom. -Amsterdam, 1988. -V. 6. -P. 397-413.
31. Lehn
J.-M. Supramolecular Chemistry: Concepts and Perspectives. -Weinheim: VCH,
1995. -340 p.
32. Лен
Ж.-М. Супрамолекулярная химия: Концепции и перспективы. -Новосибирск: Наука,
1998. -334 с.
. Lindoy
L.F. The Chemistry of Macrocyclic Ligand Complexes. -Cambridge: Cambridge
University Press, 1989. -288 p.
34. Костромина
Н.А., Волошин Я.З., Назаренко А.Ю. Клатрохелаты: синтез, строение, свойства.
-Киев: Наукова думка, 1992. -233 с.
. Gerbeleu
N.V., Arion V.B., Burgess J. Template Synthesis of Macrocyclic Compounds.
-Weinheim: Wiley-VCH, 1999. -576 p.
36. Vicens
J., Böhmer V. Calixarenes: A Versatile Class of Macrocyclic
Compounds. -Dordrecht: Kluwer Academic Publishers, 1991. -263 p.
37. Szejtli
J. Cyclodextrin Technology. -Dordrecht: Kluwer Academic Publishers, 1988. -450
p.
38. Hedges
A.R. Industrial Applications of Cyclodextrins
<http://pubs.acs.org/doi/abs/10.1021/cr970014w> // Chem. Rev. -Washington,
1998. -V.
98. -P.
2035-2044.
39. Uekama
K., Hirayama F., Irie T. Cyclodextrin Drug Carrier Systems
<http://pubs.acs.org/doi/abs/10.1021/cr970025p> // Chem. Rev. -Washington,
1998. -V.
98. -P.
2045-2076.
40. Hashimoto
H. Present Status of Industrial Application of Cyclodextrins in Japan
<http://www.springerlink.com/content/j768830x6335gnp2/?p=dca1d7b0ae404bbc87a660d366ebfdf5&pi=11>
// J. Inclus. Phenom. -Amsterdam,
2002. -V.
44. -P.
57-62.
41. McCrone
W.C. Polymorphism. In Physics and chemistry of the organic solid state. In 2
volumes. -New
York: Wiley Interscience, 1965. -V. 2. -P.
725-767.
42. Haleblian
J., McCrone W.C. Pharmaceutical applications of polymorphism // J. Pharm. Sci. -Malden,
1969. -V.
58. -P.
911-929.
43. David
R., Giron D. Crystallization / Handbook of Powder Technology. -Amsterdam, 1994.
-V. 9. -P. 193-241.
44. Henck
J.-O., Griesser U.J., Burger A. Polymorphism of drug substances. An economic
challenge? // Die Pharmazeutische Industrie. -Aulendorf,
1997. -V.
59. -P.
165-169.
45. Byrn
S.R. Solid state chemistry of drugs. -New York: Academic Press, 1982. -pp.
7-10.
46. Byrn
S.R., Pfeiffer R.R., Stowell J.G. Solid state chemistry of drugs. -West
Lafayette: SSCI, Inc, 1999. -pp. 17-41.
47. Van
Der Sluis P., Kroon J. Solvents and X-ray crystallography // J. Cryst. Growth.
-Amsterdam, 1989. -V. 97. -P. 645-656.
48. Threlfall
T. Analysis of organic polymorphs // Analyst. -Cambridge, 1995. -V. 120. -P.
2435-2460.
49. Kitamura
S., Chang L.C., Guillory J.K. Polymorphism of mefloquine hydrochloride // Int.
J. Pharm. -Amsterdam, 1994. -V. 101. -P. 127-144.
50. Nguyen
N.A.T., Ghosh S., Gatlin D.J.W. Physicochemical characterization of the various
solid forms of carbovir, an antiviral nucleoside // J. Pharm. Sci. -Malden,
1994. -V. 83. -P. 1116-1123.
51. Kiaoka
H., Ohya K. Pseudopolymorphism and phase stability of
7-piperidino-1,2,3,5-tetrahydroimidazo-[2,1-b]quinazoline-2-one
(DN-9693) // J. Therm. Anal. Calorim. -Amsterdam, 1995. -V. 44. -P. 1047-1056.
52. Brittain
H.G., Ranadive S.A., Serajuddin A.T.M. Effect of humidity-dependent changes in
crystal structure on the solid-state fluorescene properties of a new HMG-COA
reductase inhibitor // Pharm. Res. -Amsterdam, 1995. -V. 12. -P. 556-559.
53. Kitaoka
H., Wada C., Moroi R., Hakusui H. Effects of dehydration on the formation of
levofloxacin pseudopolymorphs // Chem. Pharm. Bull. -Tokyo, 1995. -V. 43. -P.
649-653.
54. Caira
M. R., Peinaar E.W., Lotter A.P. Polimorphism and pseudopolymorphism of the
antibacterial snitrofurantoin // Mol. Cryst. Liq. Cryst., Sci. Technol. A.
-Philadelphia, 1996. -V. 278. -P. 241-264.