Хромосомы эукариот
Контрольная
работа
Хромосомы
эукариот
Содержание
1. Химический состав хроматина
. Уровни организации
хроматина. Гетерохроматин и эухроматин
. Строение хромосом эукариот
. Половые хромосомы
. Эволюция хромосом
млекопитающих
. Номенклатура хромосом
человека
Литература
1. Химический состав хроматина
Главная количественная особенность генетического
материала эукариот - наличие избыточной ДНК. Этот факт легко выявляется при
анализе отношения числа генов к количеству ДНК в геноме бактерий и млекопитающих.
Около 95% генома бактерий состоит из кодирующих последовательностей. Остальные
5%, по-видимому, заняты регуляторными элементами. Иная картина наблюдается у
эукариотических организмов. Например, у человека насчитывают приблизительно 50
тысяч генов (имеется в виду только суммарная длина кодирующих участков ДНК - экзонов).
В то же время размер генома человека 3×109 (три
миллиарда) п.н. Это означает, что кодирующая часть его генома составляет всего
15 - 20 % от тотальной ДНК. Существует значительное число видов, геном которых
в десятки раз больше генома человека, например некоторые рыбы, хвостатые
амфибии, лилейные. Избыточная ДНК характерна для всех эукариот.
По химическому составу хроматин представляет
собой комплекс ДНК и белков. В ДНК эукариот выделяют 3 фракции:
уникальные последовательности
- у животных составляют 40-90% от всей ядерной ДНК; у растений - 12-60%. У
человека около 50% ядерной ДНК представлено уникальными последовательностями
длиной 1-2 тпн. Эти фрагменты разделены между собой умеренно повторяющимися
последовательностями длиной 0,1-0,3 тпн. Большая часть уникальной ДНК является
«некодирующей», так, например, в геноме человека из 50% уникальной ДНК на
кодирующие участки приходится только 5%.
Умеренно повторяющиеся
последовательности ДНК кодируют, как правило, тРНК,
рРНК, гистоны. Пример, гены 18S
и 28S рРНК образуют
тандемные пары (мономерные единицы расположены по типу «голова к хвосту»).
Спейсер тоже транскрибируется, в его состав входит ген 5,8S
рРНК. У человека и мыши гены рРНК располагаются в нескольких кластерах в
акроцентрических хромосомах. Каждый кластер генов рРНК соответствует
ядрышковому организатору. Гены ранних гистонов у морского ежа входят в состав
одной единицы, в результате повторения которой образуется кластер тандемных
генов, разделяемых спейсерами - Н1 Н4 Н2В Н3 Н2А. У дрозофилы порядок
расположения гистоновых генов иной - Н1 Н3 Н4 Н2А Н2В. У некоторых
млекопитающих гены гистонов располагаются по отдельности.
Сателлитная ДНК -
высокоповторяющиеся последовательности ДНК. Располагаются в центромерных,
теломерных районах и в участках интеркалярного гетерохроматина. У разных видов
на долю сателлитной ДНК приходится от 0,3% до 28% от всей ядерной ДНК. Близкие
виды, например мышь и крыса, имеют совершенно различные высокочастотные
последовательности, у крысы их нуклеотидный состав не отличается от основной
ДНК, тогда как геном мыши содержит четкий АТ-богатый сателлит. Это означает,
что высокочастотная ДНК способна к быстрым изменениям в ходе видообразования.
Последовательности сателлитной ДНК - это
короткие тандемные повторы. У человека сателлитная ДНК делится на I,
II, III
классы (с длиной повторяющейся последовательности 1-20 п.н.). Также выделяют
альфа, бета и гамма типы (с длиной повтора 170 п.н., 68 п.н. и 220 п.н. соответственно).
Сателлитные повторы имеют различную степень обогащенности АТ- и ГЦ -пар (тип 1
обогащен парами АТ). Сателлитная ДНК специфично распределена по разным
хромосома. Так, в прицентромерном гетерохроматине хромосом 3 и 4 представлен
сат ДНК 1. В прицентромерном гетерохроматине хромосом групп Д и G
локализованы сатДНК1 и 3 классов. Распределение альфа, бета и гамма сателлитных
ДНК также хромосом специфично. Альфа сателлитные повторы располагаются в
основном в центромерных участках хромосом. Имеют элементапрную единицу повтора
около 170 п.н. и могут присутствовать в тандеме, достигающем длины до 1
млн.п.н.
В сателлитной ДНК выделяют 2 типа
последовательностей:
микросателлиты - единица
повтора состоит из 1-5 нуклеотидов. Общая длина кластера - несколько десятков
нуклеотидов. Пример: (АТ)n;
(A)n;
(AC)n.
В кодирующей части генов чаще встречаются тринуклеотидные повторы. Ди-, тетра-
и пентануклеотидные повторы редки в кодирующей части генома, так как увеличение
их числа обязательно приведет к сдвигу рамки считывания. Микросателлитные
последовательности обнаружены в геноме как прокариот, так и эукариот. Из-за
высокой скорости мутирования микросателлиты обеспечивают генетическое
разнообразие геномов.
минисателлиты - единица
повтора состоит из 10-100 пн. Общий размер кластера 0,5-100 тпн.
Общий размер кластера 0,5-100 тпн. Их еще
называют VNTR
- вариабельные по числу тандемные повторы. Они могут
находиться внутри или между генами. Число копий каждой специфической
последовательности в разных локусах варьирует от 1000 до 5000 п.н. Вариации
длин таких областей лежат в основе метода ДНК-фингерпринтинга (метод
отпечатков).
По локализации выделяют:
сателлитные повторы в области промотора -
(А)n - стимулирует
экспрессию гена, т.к. обуславливает жесткую структуру двойной спирали - на этом
участке не образуются нуклеосомы, что облегчает доступ ДНК-полимераз и факторов
транскрипции к промотору. Длина полипролиновых, полиаланиновых и
полиглутаминовых участков, кодируемых микросателлитными тринуклеотидными
повторами, влияет на белок-белковые взаимодействия, в том числе и с факторами
активации транскрипции.
сателлитные повторы в интронах - часто
ингибируют экспрессию гена. (АС)21 в интроне гена рецептора эпидермального
фактора роста снижает транскрипцию гена на 80%.
сателлитные повторы в нетранслируемой
5-области гена (между промотором и геном) - (С)n,
(AC)n,
(GC)n,
(AT)n
- ингибируют экспрессию гена.
повторы в транслируемой области гена. Пример -
хорея Гентингтона - увеличение длины повтора (CAG)n
в первом экзоне гена белка гентингтина приводит к удлинению полиглутаминового
участка в белке. Синтезируется токсичная форма белка, что приводит к гибели
нейронов. Это пример динамических мутаций или экспансии тринуклеотидных
повторов - связаны с изменением длины тринуклеотидных повторов. Скорость
мутирования связана с числом копий триплета. После превышения определенного
порога длины эти повторы становятся нестабильными и их длина увеличивается в
последующих поколениях. У здоровых людей число повторов колеблется от 6 до 39.
У больных - 36-180. У взрослых болезнь проявляется при 40-55 повторах, при
числе повторов больше 70 заболевание проявляется уже у детей. То есть для
данных мутаций характерно явление антиципации - возрастание
пенетрантности заболевания в ряду поколений, более раннее начало заболевания.
Впервые динамические мутации описаны в 1991
году. Известны они только у людей. Всего пока описано 16 наследственных
заболеваний (табл. 1). Все они связаны с поражением головного мозга и
подкорковых структур. Экспансия происходит как в мейозе, так и в митозе,
затрагивает чаще аллели с изначально большим числом повторов.
Динамические мутации являются причиной развития
синдрома фрагильной Х-хромосомы или синдрома Мартина-Белл. Синдром Мартина-Белл
- одна из наиболее частых наследственных форм умственной отсталости (частота
заболевания составляет 1 случай на 4000 мужчин и 1 случай на 8000 женщин).
Синдром связан с образованием ломкого сайта в Х-хромосоме из-за увеличения
повторов (CGG) в
5-нетранслируемой области гена FMR1,
который экспрессируется в мозге и семенниках. Ген кодирует РНК-связывающий
белок, циркулирующий в клетке между ядром и цитоплазмой. У здоровых людей ген
содержит 2-54 триплета (CGG).
Увеличение длины до 200 триплетов - это предмутационное состояние, не
изменяющее фенотип человека. Увеличение числа копий свыше 200 триплетов -
полная мутация и проявление синдрома. Увеличение числа копий триплета приводит
к гиперметилированию регуляторной зоны гена (промотора), в результате резко
снижается или полностью ингибируется транскрипция ген.
Таблица 1
Болезни экспансии повторяющихся
последовательностей
|
Заболевание
|
Ген
|
Локус
|
Тип
повтора
|
|
Болезни
экспансии некодирующих повторов
|
|
Синдром
Мартина-Белл
|
FMR1
|
Xq27.3
|
CGG
|
|
Атаксия
Фридрейха
|
X25
|
Xq13-21.1
|
GAA
|
|
Миотоническая
дистрофия, тип 1
|
DMPK
|
19q13.3
|
CTG
|
|
Спиноцеребеллярная
атаксия, тип 8
|
SCA8
|
13q21
|
CTG
|
|
Спиноцеребеллярная
атаксия, тип 12
|
SCA12
|
5q31-33
|
CAG
|
|
Спиноцеребеллярная
атаксия, тип 10
|
SCA10
|
22q13
|
ATTCT
|
|
Миотоническая
дистрофия, тип 2
|
ZNF9
|
3q21
|
CCTG
|
|
Болезни
экспансии кодирующих повторов
|
|
Спинобульбарная
мышечная атрофия (болезнь Кеннеди)
|
AR
|
Xq13-21
|
CAG
|
|
Хорея
Гентингтона
|
HD
|
CAG
|
|
Дентато-рубро-паллидо-льюисова
атрофия
|
DRPLA
|
12p13.31
|
CAG
|
|
Спиноцеребеллярная
атаксия, тип 1
|
SCA1
|
6p23
|
CAG
|
|
Спиноцеребеллярная
атаксия, тип 2
|
SCA2
|
12q24.1
|
CAG
|
|
Спиноцеребеллярная
атаксия, тип 3
|
SCA3
|
14q32.1
|
CAG
|
|
Спиноцеребеллярная
атаксия, тип 6
|
CACNL1A4
|
19p13
|
CAG
|
|
Спиноцеребеллярная
атаксия, тип 7
|
SCA7
|
13p12-13
|
CAG
|
|
Спиноцеребеллярная
атаксия, тип 17
|
TBP
|
6q27
|
CAG
|
Другими наследственными заболеваниями,
обусловленными динамическими мутациями, являются атаксия Фридрейха,
миотоническая дистрофия первого и второго типа, болезнь Кеннеди,
спиноцеребеллярная атаксия, прогрессирующая миоклонус-эпилепсия.
Еще одна категория повторов в геноме эукариот -
короткие и длинные разбросанные по геному ДНК-повторы (не тандемные).
Короткие рассеянные по геному элементы - SINE
- последовательности длиной менее 500 п.н. Их копийность в геноме человека
составляет не менее 500 000. К этой группе повторов относится семейство Alu-повторов
(они содержат сайты рестрикции для эндонуклеазы AluI).
Alu-повторы в геноме
человека составляют более 5% от суммарного количества ДНК. Функция их не ясна.
Другая группа рассеянных повторов - LINE.
У человека обнаружено одно семейство этих повторов - L1-повторы.
Длина повтора около 6400 п.н., суммарно представлены в геноме до 100000 раз.
Проявляет свойства ретротранспозонов (транскрипция последовательности, синтез
на мРНК с помощью обратной транскриптазы новой копии ДНК повтора, новая копия
интегрирует в хромососму на новом месте).
Эухроматическая часть генома построена по
принципу чередования (интерсперсии) уникальных и повторяющихся
последовательностей. Условно выделяют два основных типа интерсперсии,
получивших названия по тем видам, у которых они впервые были описаны:
интерсперсия типа «ксенопус» и типа «дрозофила».
Примерно в 50 % генома Xenopus
laevis
уникальные последовательности из 800-1200 п.н. чередуются с повторяющимися,
средний размер которых 300 п.н. В остальной части геномов типа «ксенопус»
расстояния между соседними повторами значительно превышают 1-2 п.н. Структура
генома типа «ксенопус» широко распространена, особенно среди животных.
Млекопитающие и человек также относятся к этому типу организации генома.
Особенность генома человека и других приматов составляют интерсперсные
высокочастотные повторы длиной около 300 п.н. У человека эти повторы содержат
сайт, разрезаемый ферментом рестрикции Alu
I.
У D.
melanogaster
параметры интерсперсии резко отличаются от видов с типом генома «ксенопус»:
повторяющиеся последовательности длиной 5600 п.н. чередуются с уникальными,
длина которых не менее 13000 п.н. Интересно отметить, что у домашней мухи геном
устроен по типу «ксенопус». Этот факт прямо указывает на то, что в ходе
эволюции возможны очень быстрые преобразования характера чередования
последовательностей и в эухроматической части генома. Птицы по параметрам
интерсперсии занимают промежуточное положение между типом «ксенопус» и типом
«дрозофила».
Как показывают результаты исследований последних
лет, многие виды животных и растений по организации генома не могут быть строго
отнесены ни к тому, ни к другому типу. Так, в геномах млекопитающих встречаются
длинные повторы - в несколько тысяч пар нуклеотидов, в геномах лилейных до 90%
ДНК может быть представлено повторяющимися последовательностями. Например,
геном гороха не содержит уникальных последовательностей, превышающих по длине
300 п.н.
2. Уровни организации хроматина.
Гетерохроматин и эухроматин
В ядре ДНК всегда находится в комплексе с
белками и упакована в той или иной степени в нуклеопротеиновые структуры.
В хромосомах ДНК (около 40% от всего хроматина)
находится в комплексе с основными и кислыми белками, что обеспечивает
многоступенчатую компактизацию молекулы ДНК. Первые уровни компактизации
осуществляются при взаимодействии ДНК с основными белками - гистонами. Гистоны
имеют повышенное содержание основных аминокислот - лизина и аргинина. Пять
типов гистонов отличаются друг от друга относительным содержанием этих двух
аминокислот. Гистоны Н3 и Н4 очень консервативны. Секвенирование гена гистона
Н4 показало, что у теленка и гороха этот белок отличается всего двумя
аминокислотами. Наиболее изменчивы гистоны Н2А и Н2В. Комплекс между ДНК и
гистонами формирует нуклеосомную структуру хроматина. Пары молекул
гистонов Н2А, Н2В, Н3 и Н4 формируют гистоновый октамер клиновидной формы (рис.
1). Узкая часть образована тетрамером Н3-Н4, а широкая состоит из Н2А-Н2В. N-концевые
части гистонов свободно расходятся в стороны. Участок ДНК в 146 пн связывается
с октамером, делая 1,75 оборота вокруг него. Комплекс данного участка ДНК с
гистоновым октамером называют нуклеосомой. Участок ДНК между соседними
нуклеосомами называют линкерным (около 60 пн). Более 90% ДНК в клетке
присутствует в виде нуклеосом, при этом длина нити ДНК уменьшается в 7 раз, а
толщина сформированной нуклеопротеиновой нити составляет 10 нм.
Гистоны контактируют с фосфодиэфирным остовом
молекулы ДНК. Существуют и гидрофобные взаимодействия с остатками рибозы.
Азотистые основания во взаимодействии с гистонами не участвуют. Поэтому
связывание ДНК с нуклеосомной глобулой не является специфичным в отношении
нуклеотидной последовательности.
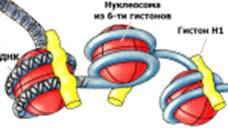
Рисунок 1. Строение нуклеосом
Гистон Н1 взаимодействует с обоими концами ДНК,
входящей в состав нуклеосомы, в районе тетрамера Н3-Н4, т.е. Н1 как бы
обозначает границы линкерной ДНК. В молекуле гистона Н1 можно выделить
глобулярную сердцевину, N-конец
и С-конец. Взаимодействие между N-
и С-концами соседних молекул гистона Н1 обеспечивает сближение нуклеосом. При
этом нуклеосомная нить сворачивается в спираль или образует зигзагообразную
нить толщиной 30 нм, состоящую из сближенных нуклеосом - нуклеомеров.
Каждая нуклеомера состоит из 8-10 нуклеосом.
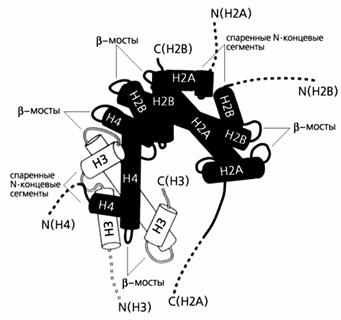
Рисунок 2. Взаимодействие гистонов в составе
нуклеосом
Исследования последних лет подтверждают
зигзагообразную модель организации 30 нм фибриллы. В стабилизации этой фибриллы
большую роль играют взаимодействия N-концевых
доменов гистонов соседних нуклеосом. Архитектура фибриллы может существенно
меняться при модификации N-концевых
доменов гистонов, что может стимулировать либо дальнейшую конденсацию, либо
деконденсацию фибриллы. Есть данные о том, что ацетилирование гистонов
способствует разворачиванию компактной 30 нм хроматиновой фибриллы до
нуклеосомной нити.
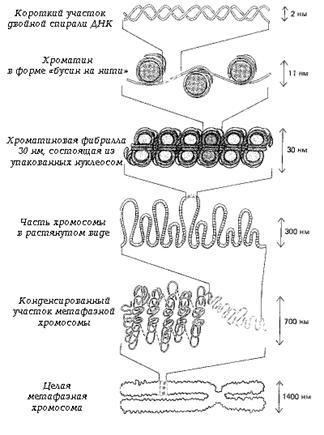
Рисунок 3. Уровни компактизации хроматина
У ксенопуса выделены белки, контролирующие
взаимодействие ДНК с гистоновыми белками. Например, белок нуклеоплазмин
- состоит из 5 идентичных субъединиц, контролирует образование нуклеосом. Этот
белок кислый, он не связывается со свободной ДНК, связывается только с
гистонами.
Экспрессия генов основных гистонов происходит
только в S -фазу чтобы
обеспечить упаковку вновь синтезированной ДНК. Но ограничение синтеза гистонов
может грозить нарушением целостности хромосом, например, при репарации
поврежденной ДНК. Поэтому многие организмы имеют альтернативные копии
гистоновых генов, которые кодируют варианты гистонов и экспрессируются
конститутивно на низком уровне в течение всего клеточного цикла.
Описаны вариантные формы гистонов (табл. 2),
которые кодируются отдельными генами. Включение в нуклеосомную частицу
вариантных форм гистонов может существенно изменять структуру гистонового
октамера. Существует четкая корреляция между присутствием в нуклеосомах
вариантных форм гистонов и осуществлением тех или иных функциональных
процессов. Например, ряд вариантных форм гистона Н3 (CENP-A)
участвует в формировании центромер. Некоторые варианты обмениваются с уже
существующими гистонами в ходе развития и дифференцировки - их называют
замещающими гистонами. Такое замещение часто приводит к тому, что варианты
становятся доминируюшщими в дифференцированной клетке. Предположение - варианты
гистонов выполняют спец. функции в клетках.
Имеется много вариантов гистона Н1, например,
Н10, Н5, варианты, специфичные для сперматозоидов (SpH1)
и яичек (H1t).
Наибольшее число вариантов описано для гистона Н2А. Варианты гистона Н2А отличаются
по размеру и последовательности хвоста, а также по характеру распределения в
геноме. Например, H2A-Bbd
локализуется в активной Х-хромосоме и аутосомах, а Macro
Н2А находится в основном в Xi.
У гистона Н3 есть два основных варианта - Н3ю3 и центромерный Н3 (СеnH3),
а также тканеспецифичный вариант Н3.4 (яички млекопитающих). Гистон СеnH3
способствует образованию белковой структуры кинетохоров. Гистон Н3.3 служит
меткой активного хроматина, азмещение Н3 на Н3.3 это динамичный механизм
быстрой активации хроматина. Вариантов гистона Н4 пока не известно.
Таблица 2
Основные варианты гистонов и их действие на
хроматин
|
Вариант
|
Основной
гистон
|
Действие
на хроматин
|
|
Н1о
|
Н1
|
Конденсация
хроматина
|
|
Н5
|
Н1
|
Конденсация
хроматина
|
|
SpH1
|
Н1
|
Конденсация
хроматина
|
|
H1t
|
Н1
|
Открытая
структура хроматина
|
Н2А
|
Конденсация
хроматина
|
|
H2ABbd
|
Н2А
|
Открытая
структура хроматина
|
|
H2AvD
|
Н2А
|
|
|
H2A.X
|
Н2А
|
Конденсация
хроматина
|
|
H2A.Z
|
Н2А
|
Открытая/закрытая
структура хроматина
|
|
SpH2B
|
Н2В
|
Конденсация
хроматина
|
|
CenH3
|
Н3
|
|
|
H3.3
|
Н3
|
Открытая
структура хроматина
|
|
H3.4
|
Н3
|
|
Дальнейшая упаковка хроматина достигается за
счет взаимодействия ДНК с негистоновыми белками. Они разнообразны - более 500,
составляют до 2/3 всех белков хроматина. Многие из этих белков участвуют в
репликации, репарации ДНК, транскрипции. Часть из них выполняет структурную
функцию - образуют ядерную мембрану, поровые комплексы. Часть белков формирует
белковый каркас хромосом. На белках ядерной мембраны в интерфазу закреплены
расположенные розетками петли 30-нм фибриллы. Это третий уровень компактизации
хроматина - хромомерный. Средний размер розеток достигает 120-150 нм.
Каждый хромомер состоит из нескольких, содержащих нуклеомеры петель, которые
связаны в одном центре. Хромомеры связаны друг с другом участками нуклеосомного
хроматина. Размер отдельной петли совпадает с размером среднего репликона и
может соответствовать одному или нескольким генам (50-100 тпн). На хромосому в
среднем приходится более 2000 таких петельных доменов ДНК. Петельно-доменная
структура хроматина организует функциональные единицы хромосом - репликоны и
транскрибируемые гены. Наряду с участками начала репликации в области
прикрепления ДНК к ядерному матриксу часто локализуются и другие регуляторные
элементы - энхансеры, сайленсеры, промоторы и т.д. Помещение того или иного
промотора, гена или генного домена на ядерный матрикс способствует его
активации. Далее - хромонемный уровень компактизации - нитчатая
структура толщиной 0,1-0,2 мкм. Полагают, что отрезок примерно с 18-20
петлевыми доменами образует вокруг осевого элемента хромосомы один виток.
Компактизация метафазных хромосом оценивается
как 10000-кратная. К стадии зиготены мейоза наружная поверхность хроматиновой
нити содержит всего около 1% ДНК. Механизм не известен. Доказано, что укладка ДНК
в митотическую хромосому осуществляется комплексом белков, называемым 13S-конденсином.
Комплекс обладает АТФ-азной активностью, способен связываться с ДНК и,
вероятно, наматывает ее на себя. 13S-конденсин
лягушки состоит из двух структурных субъединиц - ассоциированных с хромосомами
белков ХСАР-С и ХСАР-Е и трех регуляторных субъединиц. Вне комплекса ни одна из
субъединиц не индуцирует конденсацию хромосом. Мутации в генах, кодирующих
белки конденсинового комплекса, нарушают конденсацию и сегрегацию хромосом,
блокируют клетки в митозе. В процессе упаковки хромосом конденсин локализуется
в районах, где гистон Н3 фосфорилирован. По мере фосфорилирования гистона Н3
ДНК становится более доступной для связывания с конденсином. Конденсация
хромосом и фосфорилирование гистона Н3 начинается с центромерных областей и
распространяется к теломерным.
К стадии зиготены мейоза на наружней поверхности
хроматиновой нити остается всего около 1% ДНК.
Степень деконденсации хроматина в интерфазном
ядре отражает его функциональную нагрузку. Чем более диффузен хроматин, тем он
активнее. В составе хромосом выделяют участки гетерохроматина и эухроматина.
Эухроматин в интерфазе находится в деспирализованном состоянии, в нем находятся
структурные активные гены. В эухроматиновых участках, помимо элементарных
дезоксирибонуклеопротеидных нитей, имеются рибонуклеопротеидные частицы
диаметром 200-500 анстрем, называемые РНП-гранулами. Эти частицы представляют
собой форму упаковки молекул РНК, синтезированных на ДНК и соединённых с белком,
и служат для завершения образования информационной РНК и переноса её в
цитоплазму
Термин «гетерохроматин» был предложен Хейцом в
1928 году. Гетерохроматин расположен в районе центромеры, теломер и внутри плеч
хромосом - интеркалярный гетерохроматин. Гетерохроматиновые участки
значительно дольше представлены в клеточном цикле в виде плотно спирализованных
фрагментов. Они деспирализуются значительно позже, чем эухроматин или совсем не
деспирализуются, сохраняясь в интерфазном ядре в виде плотно окрашенных глыбок
- хромоцентров. Гетерохроматиновые районы хромосом могут
ассоциироваться друг с другом - эктопическая конъюгация. В результате
здесь возможна повышенная частота хромосомных перестроек. Еще одной
особенностью гетерохроматина является варьирование его количества в геноме.
Гетерохроматиновые участки ДНК содержат
долгоживущие разрывы, тогда как в эухроматине разрывы возникают редко и быстро
репарируются. Ядра лимфоцитов периферической крови почти полностью состоят из
гетерохроматина и неактивны в транскрипции. В них обнаружено около 3000
разрывов на диплоидный геном мыши. Установлено, что после активации лимфоцитов
разрывы репарируются. Очень плотно упакованная ДНК сперматозоидов содержит 107
разрывов на геном. Таким образом, наличие разрывов ДНК позволяет плотную
упаковку, но несовместимо с транскрипцией.
Стабильно выявляемые гетерохроматиновые районы
называют конститутивным гетерохроматином. Эти районы, как правило,
генетически не активны. Пример - сателлитная ДНК прицентромерного
гетерохроматина. Конститутивный гетерохроматин располагается в одних и тех же
положениях на обеих хромосомах из пары гомологов. Гены в гетерохроматине
все-таки есть, но их гораздо меньше, чем в эухроматине. Пример - гены рРНК.
Факультативный
гетерохроматин формируется при конденсации хроматина на определенных стадиях
жизненного цикла и обычно присутствует лишь в одной хромосоме из пары
гомологов. Яркий пример - мучнистый червец. У самок этого вида нет
факультативного гетерохроматина. У самцов весь отцовский гаплоидный набор хромосом
целиком становится гетерохроматиновым. В итоге самец имеет эухроматиновые
хромосомы, полученные от матери, и гетерохроматиновые, полученные от отца. В
ходе мейоза у самцов гетерохроматиновые хромосомы деспирализуются, в спермии
попадает уже эухроматиновый материал. Если потомок окажется самцом, то эти
хромосомы конденсируются. Таким образом, у самцов экспрессируются только
материнские гены.
У млекопитающих факультативный хроматин
проявляется при инактивации Х-хромосомы. В 1949 г Барр и Бертрам обнаружили в
ядрах нейронов кошки интенсивно окрашенные тельца, названные тельцами Барра.
Они представляют собой неактивную Х-хромосому. Различают три возможных
расположения полового хроматина в ядре: тесное соприкосновение его с ядрышком;
свободное расположение в кариоплазме и контакт с ядерной ембраной.
Таким образом, у самок млекопитающих
транскрипционно активна только одна Х-хромосома - это феномен компенсации
дозы гена. Факультативный гетерохроматин обогащен повторами типа LINE,
которые способствуют конденсации хроматина.
В ходе раннего развития самок млекопитающих обе
Х-хромосомы активны. На предимплантационных стадиях развития эмбриона
происходит инактивация Х-хромосомы, унаследованной от отца. Во время
имплантации зародыша происходит реактивация и последующая инактивация случайно
либо отцовской, либо материнской Х-хромосомы. Иногда наблюдается
предпочтительная инактивация отцовской Х-хромосомы (у сумчатых). Процесс
инактивации контролируется сложным локусом Х-хромосомы - центром инактивации Xiс.
Данный локус содержит ген Xist
(Х inactive
specific
transcript). Продуктом этого
гена является некодирующая ядерная РНК размером 16 тн.
Ген Xist
имеет 3 промотора - Р0, Р1 и Р2. Если транскрипция идет с прототоров Р1 или Р2
- образуется стабильный продукт размером 15 т.п.н., если с промотора Р0 -
возникает нестабильный продукт. Переключение транскрипции с Ро на Р1/Р2
коррелирует с началом инактивации Х-хромосомы. В функционально активной
Х-хромосоме ген Xist
инактивирован за счет метилирования ЦГ-динуклеотидов в промоторе гена.
РНК гена Xist не способна переходить с одной
Х-хромосомы на другую. РНК Xist присоединяет различные белки, образуя
комплексы, которые распределяются вдоль всей Х-хромосомы, запуская ее
инактивацию. Они, несомненно, принимают участие в установлении неактивного
состояния, так как Х-хромосома, у которой отсутствует район гена Xist,
никогда не инактивируется. Если же ген Xist
искусственно перенести на аутосому, то она инактивируется.
В период инициации инактивации продукт гена Xist
становится стабильным и распространяется вдоль по всей длине Х-хромосомы. Это
подавляет транскрипцию генов и приводит к модификации гистонов. После отделения
линии герминальных клеток в соматических клетках происходит гиперметилирование
инактивируемой хромосомы; неактивное состояние становится необратимым и
наследуется в ряду клеточных поколений. В линии герминальных клеток самок ДНК
инактивированной Х-хромосомы остается неметилированной и впоследствии хромосома
реактивируется незадолго до вхождения клеток в мейоз. В зрелых ооцитах обе
Х-хромосомы активны.
Выбор того, какая Х-хромосома инактивируется,
случаен, но это может регулироваться аллелями Xce (X-linced X controlling
element). На линиях мышей было обнаружено три аллеля Хсе - «слабый» Xcea,
«промежуточный» Xceb и «сильный» Xcec. В гетерозиготах наиболее часто
инактивируются те Х-хромосомы, которые несут более слабый аллель. У гомозигот
выбор происходит случайно. Xce локус расположен вблизи Xic. Предполагается, что
Xce связывают транс-факторы, регулирующие работу генов в Xic, предопределяя
выбор между Х-хромосомами.
Ряд генов неактивной Х-хромосомы ускользает от
инактивации. Например, избегает инактивации район спаривания с Y-хромосомой. В
данном локусе находятся гены, присутствующие и на Х- и на Y-хромосомах: то есть
и у XY-самцов таких генов по паре, и у XX-самок их столько же - этим генам не
нужна компенсация дозы.
Формирование гетерохроматина строго
детерминировано и происходит на определенной стадии эмбрионального развития,
когда начинается транскрипция на хромосомах развивающегося эмбриона.
Формирование гетерохроматиновых доменов надежно защищает организм от экспрессии
генетического материала, которая не нужна в соматических клетках.
Образование факультативного гетерохроматина -
механизм регуляции активности генов. Пример - мозаичное проявление признаков,
контролируемых сцепленными с полом генами у самок млекопитающих - кошки с
черепаховой окраской (пятна черной и желтой шерсти); женщины, гетерозиготные по
сцепленной с полом мутации эктодермальной дисплазии (на некоторых участках
челюсти нет зубов; на теле чередуются участки кожи с наличием и отсутствием
потовых желез).
Эпигенетика занимается
изучением механизмов наследственности, которые модифицируют работу генов без
изменения их структуры. Причем эти модификации сохраняются при митотическом
делении клеток. Наиболее часто эпигенетические механизмы обеспечивают
долговременную репрессию значительной части генома в специализированных клетках
многоклеточного организма. Эпигенетические механизмы обеспечивают и импринтинг
- инактивацию ряда генов в одной из родительских хромосом. Наиболее изученным
механизмом является метилирование ДНК. В последние годы показана роль модификации
гистонов, их ацетилирования (лизина) и метилирования (лизина и аргинина), а
также включения в нуклеосомы неканонических форм гистонов. Модифицируются в
основном свободные N-концы
гистонов. Добавление ацетильных групп нейтрализует положительный заряд молекулы
гистона, это изменяет конформацию нуклеосомы и изменяет доступность ДНК для
различных белков. Другой вариант - с модифицированными остатками аминокислот
гистонов могут специфически связываться определенные белки, запуская цепочку
реакций. Метилирование лизина и аргинина участвует в образовании
гетерохроматина, репарации и регуляции транскрипции. Причем разное число
метильных групп у одного остатка выполняет разные биологические функции.
Метилирование осуществляется ферментами гистон-метилтрансферазами, а
удаление метильных групп обеспечивают гистон-деметилазы. В отличие от
метилирования ацетильная группа на остатке лизина может быть только
одна. Ее присоединение осуществляют гистон-ацетилтрансферазы, а удаление
- гистон-деацетилазы. Эухроматиновые домены характеризуются
гиперацетилированной формой гистонов; в гетерохроматине гистоны
гипоацетилированы.
Ацетилирование гистонов ослабляет
межнуклеосомное взаимодействие, а также взаимодействие хвостов нуклеосомы с
линкерной ДНК. Доступность ДНК при этом увеличивается, то есть ацетилирование
гистонов связано с активацией транскрипции.
Активный промотор гена должен быть свободен от
нуклеосом. Важную роль в этом играет ацетилирование гистонов, в том числе
гистона H2A.Z
в промоторной области. Гистон H2A.Z
присутствует как в активных, так и в неактивных промоторах и именно его
ацетилирование существенно для активации промотора.
Метилирование гистонов не изменяет суммарный
заряд нуклеосомы. Но ковалентно модифицированные гистоны служат «метками» для
связывания белковых факторов, которые стимулируют определенные события.
Наиболее распространенный вариант метилирования гистонов - это метилирование
лизина.
Образование прицентромерного гетерохроматина
является результатом модификации гистонов и прежде всего метилированием лизина
в молекуле гистонов Н3 и Н4. Метилированные остаток лизина узнают различные
белки, которые запускают процессы, связанные с «молчанием». Например, у
инфузории с метилированным лизином связываются белки Pddq,
Pdd3,
что вызывает диминуцию хроматина. У млекопитающих и дрозофилы модифицированный
гистон Н3 может взаимодействовать с белком НР1 (Heterochromatin
protein
1),
который в свою очередь может привлекать множество других белков. Полагают, что
связь НР1 с модифицированным гистоном Н3 необходима для стабилизации
репрессированного состояния гетерохроматина.
Инактивация Х-хромосомы млекопитающих сопровождается
гипоацетилированием гистонов Н2А, Н3 и Н4 и метилированием гистона Н3.
Другим вариантом модификации гистонов является
их фосфорилирование - дефосфорилирование, что обеспечивает декомпактизацию
хроматина при активации транскрипции и конденсацию хромосом во время деления
клетки или апоптоза. Баланс фосфатных групп поддерживают киназы и фосфотазы.
Образец модификаций молекул гистонов называют «гистоновым
кодом». Гипотеза «гистонового кода» предполагает, что эти модификации
являются предпосылкой для последующего изменения структуры хроматина и
стабильно поддерживают характер экспрессии генов в ходе клеточных делений.
Посттрансляционные модификации гистонов (ацетилирование, метилирование,
фосфорилирование и др.) создают специфические сайты связывания для регуляторных
белков хроматина.
Формирование гетерохроматина строго
детерминировано и происходит на определенной стадии эмбрионального развития,
когда начинается транскрипция на хромосомах развивающегося эмбриона.
Формирование гетерохроматиновых доменов надежно защищает организм от экспрессии
генетического материала, которая не нужна в соматических клетках.
Помимо образования гетерохроматина другим
механизмом «выключения» некодирующих последовательностей является диминуция
хроматина. Это программируемая элиминация части генетического материала из
генома презумптивных соматических клеток.
У циклопов в 3-7 делениях дробления
элиминируется от 10 до 94% генома germ
line. Цитологическая
картина диминуции хроматина видоспецифична. Доля элиминируемой ДНК не зависит
от исходного размера генома. Например, 2 вида циклопов Cyclops
kolensis, Cyclops
insignis обитают в
одинаковых условиях, количество ДНК в диплоидных клетках примерно одинаково -
4,6 пг и 4,3 пг. У C. kolensis
после диминуции остается лишь 6% генома. Однако при этом количество хромосом не
изменяется (22), хотя размеры их становятся существенно меньше. У C.
insignis диминуции
хроматина не происходит.
У циклопов перед диминуцией хроматина происходит
удлинение интерфазы в 8-9 раз. В конце этой интерфазы появляются плотные
гранулы хроматина (до 600). Далее они сливаются, вокруг них формируется плотная
однослойная без пор мембрана, непрницаемая для факторов декомпактизации. Внутри
этих гранул происходит лизис ДНК.
Генетический аппарат ресничных инфузорий
отличается ядерным диморфизмом. Он проявляется в наличии в клетке двух типов
ядер: микронуклеуса (Ми) и макронуклеуса (Ма). Ми служит генеративным ядром,
используемым для передачи наследственной информации в ряду поколений. В
вегетативно растущих клетках гены Ми не транскрибируются. Зато активно
транскрибируются гены Ма, выполняющего роль рабочего ядра и контролирующего
процессы жизнедеятельности.
При конъюгации у инфузорий две клетки
прикладываются друг к другу и плавают вместе 10-12 часов, а затем расходятся.
За время конъюгации их Ма начали разрушаться, а Ми поделились путем мейоза на
четыре гаплоидных ядра каждое. Ход последующих событий варьирует в деталях у
разных видов инфузорий, но принципиальная схема общая: клетки партнеров
обмениваются гаплоидными ядрами, по одному от каждой клетки, затем каждое
сливается с местным (стационарным) гаплоидным ядром, то есть происходит
оплодотворение. К этому моменту все лишние ядра дегенерируют, и в каждой клетке
остается по одному диплоидному ядру - продукту оплодотворения. После
расхождения партнеров ядро делится митотически на два. Одно из дочерних ядер
останется Ми, другое превратится в Ма. Развитие Ма занимает несколько дней и
сопровождается полной реорганизацией генома Ми-предшественника.
ДНК хромосом Ми имеет большие размеры,
характерные для эукариотических хромосом. Гены в них собраны в группы с
длинными промежутками между ними, заполненными разнообразными уникальными и
повторяющимися последовательностями ДНК. Важная особенность генов Ми
заключается в том, что все они прерваны особыми элементами, называемым IES
(internal eliminated sequences). Кодирующие участки генов, разделенные IES,
называют MDS
<#"870758.files/image004.gif">
Рисунок 4. Дифференцировка Ма у
брюхоресничных инфузорий: а - общая схема дифференцировки ядер из
оплодотворенного ядра; б - схема превращения микроядерного гена в ген Ма
Перестройка генетического материала
происходит при развитии Ма из Ми. Она начинается сразу после конъюгации с
множественных раундов репликации хромосом в исходном Ми без его деления. Это
приводит к образованию политенных хромосом. Политенизация хромосом увеличивает
их размеры.
Во время политенизации происходит
важное для реорганизации генома Ми удаление всех IES. Оно осуществляется путем
множественных событий рекомбинации по прямым повторам ДНК, имеющимся на концах
каждого IES. У E. crassus IES несут концевые повторы от 2 до 4 п.н. и всегда
содержат димер 5'-TA, у O. nova - от 2 до 19 п.н. и не содержат 5'-TA.
Поскольку IES прерывают кодирующие участки генов (MDS), состыковка последних
при вырезании IES (в виде колец) происходит с точностью до нуклеотида по той же
схеме, что и аналогичная рекомбинация у бактерий. Помимо коротких IES ДНК Ми E.
crassus содержит два родственных элемента размером около 5,3 т.п.н., называемых
TEC1 и TEC2. Эти элементы принадлежат к подвижным генетическим элементам.
TEC-элементы представлены в Ми примерно 30 тыс. копиями и все вырезаются в виде
колец.
После политенизации и удаления IES и
подвижных элементов происходит разрезание политенных хромосом на фрагменты,
соответствующие отдельным генам. Механизм фрагментации хромосом пока невыяснен.
У равноресничных инфузорий, к которым принадлежит всем известная
инфузория-туфелька, обнаружены особые участки, в которых происходят разрывы
хромосом. Их называют CBS <#"870758.files/image005.jpg">
Рисунок 5. Диминуция хроматина у
Parascaris univalens: а - цитологическая картина диминуции хроматина
На левой схеме изображены анафазы
второго деления дробления на стадии двух клеток. Диминуция происходит в верхней
клетке С1. В нижней клетке Г1 идет нормальный митоз. Справа представлена стадия
четырех клеток после завершения второго деления дробления; б - схема
дифференцировки клеток зародышевого пути и соматических клеток на ранних
стадиях эмбрионального развития аскариды. Пресоматические клетки С1, С2, С3 и
С4, подвергшиеся диминуции, изображены кружками, окруженными четырьмя точками.
У P. univalens при диминуции
удаляется около 85% хроматина. Основная часть удаляемого материала состоит из
сателлитной ДНК. Однако при диминуции удаляются и некоторые уникальные гены,
например ген ALEP1, который кодирует определенный рибосомный белок. Этот
белок синтезируется только в генеративных клетках и отсутствует в соматических.
Таким образом, элиминируемый хроматин содержит не просто ненужную ДНК, но
необходим для клеток зародышевого пути. Предполагается, что элиминация гена
ALEP1 вызывает структурные различия между рибосомами зародышевых и соматических
клеток, которые могут обусловливать дифференциальную трансляцию специфических
мРНК в двух типах клеток.
Эффект диминуции хроматина указывает
на то, что большая часть избыточной ДНК не несет ни кодирующих, ни регуляторных
функций. Функции избыточной ДНК как-то связаны с клетками germ line. Возможно,
что некодирующая часть генома играет важную роль в изоляции видов,
осуществляемой в мейозе при конъюгации хромосом.
При случайном скрещивании видов с
диминуцией хроматина и без диминуции: В яйцеклетке в ее цитоплазме у видов с
диминуцией хроматина есть ферменты, участвующие в диминуции хроматина. В
результате диминуции хроматина могут подвергнуться структурные гены отцовского
происхождения. Потеря структурных генов - гибель гибридного зародыша.
При обратном направлении скрещивания
отцовские хромосомы не пройдут через цикл диминуции хроматина, так как в
яйцеклетке не будет нужных ферментов. В результате отцовские структурные гены
останутся в неактивной форме. Зародыш тоже погибнет.
. Строение хромосом эукариот
Хромосома - это
самовоспроизводящийся структурный элемент ядра клетки. Число, размер и форма
хромосом строго определены и специфичны для каждого вида. Термин «хромосома»
был предложен в 1888 W. Waldeyer. Каждая хромосома состоит из одной или
нескольких пар хроматиновых нитей. Морфологию хромосом эукариот определяют на
стадии метафазы митоза. Характерные для вида особенности хромосом (то есть их количество,
размеры, форма, наличие спутников и т.д.) называют кариотипом.

Рисунок 6. Примеры кариотипов
Рисунок 7. Идиограмма хромосом
человека
В объеме интерфазного ядра каждое
плечо хромосомы располагается в определенной зоне, объем которой не перекрывает
объем соседних хромосом, хотя они примыкают друг к другу. Каждая из хромосом в
нескольких местах связана с ядерной оболочкой. Все теломерные участки
фиксированы на ядерной мембране на одном полюсе интерфазного ядра; на
противоположном полюсе ядра располагаются (тоже фиксированные на мембране)
центромерные районы хромосом. В последнее время показано, что в нормальных
клетках богатые генами хромосомы располагаются ближе к центру ядра, а бедные
генами хромосомы - на периферии ядра. Например, хромосом 18 и 19. Материал
хромосомы 19, богатой генами, тяготеет к внутреннему компартменту ядра, тогда
как территория хромосомы 18, бедной генами, находится на его периферии.
Область, прилежащая к ядерной оболочке, и области, прилежащие к конститутивному
(н-р, прицентромерному) гетерохроматину, являются в ядре неактивными
компартментами. Простое перемещение генов в эти компартменты приводит к их
долговременной инактивации. Пример: в эритроидных клетках глобиновые гены
располагаются далеко от конститутивного гетерохроматина, тогда как в
неэритроидных клетках они практически контактируют с конститутивным
гетерохроматином.
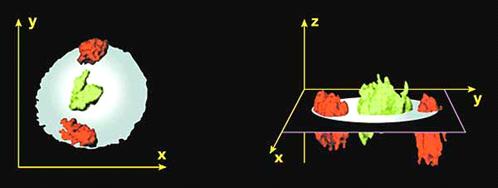
Рисунок 8. Пространственное
расположение хромосом в объеме ядра
Каждая хромосома имеет первичную
перетяжку или центромеру, которая делит хромосому на два плеча. Участок
центромеры ответственен за контакт с микротрубочками веретена деления и
перемещения хромосомы при клеточном делении. К центромерной ДНК присоединяются
центромерные белки, образующие кинетохор. Это справедливо для хромосом с
локализованной центромерой.
У некоторых растений, грибов и
членистоногих (скорпионы) хромосомы имеют диффузную центромеру. Это означает,
что контакт с микротрубочками веретена осуществляется по всей длине хромосомы.
Такие хромосомы называют голоцентрическими.
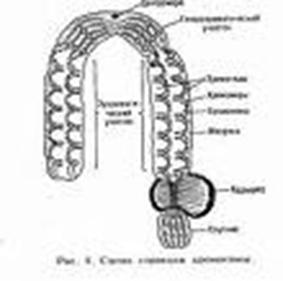
Рисунок 9. Строение хромосом
Описан и третий тип хромосом у
некоторых видов аскарид. В эмбриогенезе у Ascaris megalocephala в первых двух
делениях дробления выявляются крупные хромосомы с нормально функционирующей
локализованной центромерой. Однако при третьем делении в трёх бластомерах из
четырёх хромосомы распадаются на мелкие фрагменты, каждый из которых ведёт себя
как обычная хромосома; т.е. расщепляется на хроматиды, расходящиеся к полюсам.
Часть хромосомного материала при этом разрушается. Каждая из мелких хромосом
обладает собственной центромерой. Таким образом, исходные крупные хромосомы
аскариды, сохраняющиеся в четвёртом бластомере, из которого развиваются клетки
зародышевого пути, являются потенциально полицентрическими хромосомами.
Однако, в первых двух митозах дробления и в клетках зародышевого пути эти
многочисленные центромеры не активны.
В центромерных районах хромосом локализована
сателлитная ДНК, т.е. высоко повторяющиеся последовательности ДНК. Центромерная
ДНК S. cerevisiae состоит из
повторяющихся участков по 110 п.н. Она имеет по 2 консервативных участка (1 и
3) и центральный элемент (2), обогащённый АТ. У мыши - основной класс стДНК -
повтор последовательности в 234 п.н.
ДНК центромерного участка хромосом
человека представлена блоком тандемно организованных повторяющихся единиц
размером 171 пн. Тяжи мономеров включают до 3 млн. пн. В середине тяжа
идентичность копий мономеров составляет 99%, а на концах тяжа единицы мономеров
более дивергированы. Характер организации центромер человека и арабидопсиса
сходен, хотя первичные последовательности их мономеров совершенно различны.
Центромера Х-хромосомы дрозофилы
состоит в основном из двух типов очень коротких простых сателлитов, ААТАТ и
ААГАГ, прерываемых ретротранспозонами.
В центромерном хроматине эукариот
обнаружены видоспецифические варианты гистона Н3 - CENP-A у человека
и CENH3 у растений.
Предполагается, что именно CENH3, взаимодействуя другими
гистонами Н2А, Н2В, Н4 формирует и определяет специфический тип нуклеосом,
которые присутствуют только в функционирующих центромерах. Возможно, что такие
нуклеосомы являются «якорями» для образования кинетохора.
В организации центромерного
хроматина определенную роль могут играть малые РНК. Показано, что пул
специфических для центромер малых РНК (40-200 пн) транскрибируется с
центромерного ретротранспозона и сателлитной ДНК, связан с центромерным
гистоном Н3 в пределах комплекса кинетохора кукурузы.
Уникальные данные получены о
центромере риса. Центромеры хромосом риса содержат сателлитные повторы с
размером мономера 155 пн. В хромосоме 8 длина этого тяжа наименьшая среди 12
хромосом риса - около 64 тпн. Общая длина центромерного участка хромосомы 8
составляет 2 млн. пн. Внутри этого района есть участок непосредственного
формирования кинетохора (около 750 тпн). Но самое интересное - в составе
центромеры кроме ретротранспозонов обнаружены активно транскрибируемые гены, 48
из которых имеют последовательности высоко гомологичные известным белкам или
кДНК-клонам. Более того, 14 предполагаемых генов обнаружены в области
кинетохора. Это опровергает мнение, что центромеры не содержат активно
транскрибируемых генов.
Сформированный кинетохор
представляет собой трехслойную структуру: внутренний слой (40-60нм),
светлоокрашенный средний слой (25-30 нм) и внешний слой (40-60 нм). Внутренняя
поверхность кинетохора взаимодействует с центромерным хроматином.
Микротрубочки, связанные с кинетохором, контактируют с его внешним слоем.
В зависимости от расположения
центромеры выделяют метацентрические, субметацентрические и акроцентрические
хромосомы. Для акроцентрических хромосом характерно наличие вторичной
перетяжки, отделяющей спутники. Данный участок хромосомы содержит большое
количество генов рРНК. Гены рРНК часто образуют тандемные пары, которые
организованы в кластеры. Каждый кластер тандемно повторяющихся генов рРНК
соответствует ядрышковому организатору.
Теломеры - концевые
структуры линейных хромосом, состоящие из повторяющихся последовательностей
ДНК. У человека теломерные участки хромосом образованы тысячами повторов
последовательности TTAGGG. Среди растений наиболее часто в
теломерах повторяется последовательность TTTAGGG. Известно,
что растения семейства луковичных имеют иные теломерные последовательности.
Теломерные последовательности у Sacharomyces cerevisia
представляют собой вариабельные повторы TG. У дрожжей
теломера находится в ненуклеосомном хроматине, защищённом от действия нуклеаз,
и называется телосомой.
Рисунок 10. Теломеры хромосомы
Теломерные районы хромосом имеют
общие с гетерохроматином свойства, в том числе: наличие высокоповторяющихся
последовательностей, способность образовывать ассоциаты, инактивация генов,
попавших в зону гетерохроматина или теломерного хроматина.
Теломеры хромосом собраны в
несколько кластеров, которые располагаются по периферии ядра. Предполагают, что
теломерные последовательности заякориваются на ядерной оболочке с помощью
ДНК-белковых взаимодействий. Кроме того, теломеры взаимодействуют друг с
другом. При этом плечи хромосом никогда не переплетаются. Ещё в 30-е годы
Барбара Мак-Клинток показала, что теломеры защищают хромосомы от деградации и
препятствуют слипанию хромосом.
Сейчас известно, что в результате
«концевой недорепликации» в 3-нити молекулы ДНК образуется одноцепочечный
конец, который специфическим образом сворачивается и взаимодействует с
двунитевым районом теломеры, образую Т-петлю. Т-петля стабилизируется белковыми
факторами. Этот процесс обеспечивает защиту молекулы ДНК от экзонуклеаз и
называется кэппингом. Нарушение кэппинга может приводить к теломерным
слияниям плеч хромосом. Нарушение кэппинга теломер распознается как разрыв,
который должен репарироваться. Это приводит к теломера-теломерному слипанию
хромосом с образованием дицентриков.
Специфические элементы теломер
необходимы для расхождения сестринских хроматид в митозе. На Tetrachymena показано,
что введение мутации в последовательность теломерного повтора блокирует
расхождение хроматид в анафазе митоза. Предполагают, что теломеры сестринских
хроматид соединены друг с другом на протяжении G2 - фазы
клеточного цикла и в митозе до метафазы включительно. Ассоциаты теломер
создаются с помощью теломерсвязывающих белков. В норме ассоциаты теломер должны
распадаться перед расхождением хроматид в анафазе. Возможно, что при мутации в
теломерной ДНК изменяется узнавание теломерного комплекса топоизомеразой 2.
Этот фермент необходим для разделения хромосом в анафазе.
У дрожжей выделен мейоз -
специфический, теломерсвязывающий белок NDS1/TAM1. Мутация
гена данного белка приводит к тому, что каждая теломера оказывается
неспаренной, в первом делении мейоза возрастает число случаев нерасхождения и
преждевременного разделения сестринских хроматид.
Теломеры необходимы для начала
репликации ДНК: к ним прикрепляется РНК-затравка, с которой на каждой из нитей
двойной спирали ДНК начинается синтез нити, комплементарной первой. После
каждого деления клетки часть концевых нуклеотидов на каждой из вновь
образованных хромосом безвозвратно теряется вместе с РНК-затравкой. При каждом
цикле репликации дочерняя цепь ДНК теряет часть повторов теломеры -8-16
нуклеотидов. Предполагают, что как только теломеры укорачиваются ниже некой критической
длины, происходит остановка клеточного цикла и старение клетки. Предложена
модель старения, которая основывается на том, что гены, расположенные рядом с
теломерой, подвергаются нестабильной транскрипционной репрессии. Предполагают,
что транскрипция локуса «AGE» также подавлена благодаря
теломерному эффекту положения. По мере старения клеток и укорочения теломер эта
репрессия снимается и данный локус становится транскрипционно активным.
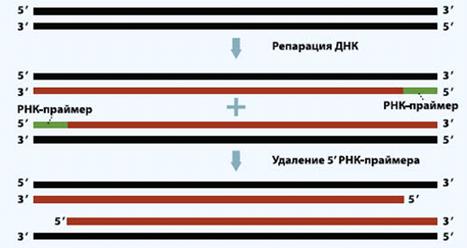
Рисунок 11. Процесс укорочения длины
теломер после цикла репликации ДНК
Наличие постоянно делящихся клеток у
животных, тотипотентность растительных клеток предполагает, что они должны либо
поддерживать, либо синтезировать полный комплемент теломерных повторов. В 1971
году Оловников предположил существование особого механизма, предотвращающего
недорепликацию линейных молекул ДНК прежде всего в половых и раковых клетках, в
тоже время данный механизм не действует в большинстве соматических клетках.
Грэйдер и Блэкберн на Tetrachymena впервые в
1985 году обнаружили рибонуклеопротеидный фермент, названный теломеразой.
Фермент достраивает 3-конец теломер, т.е. удлиняет их. В состав фермента входит
РНК - субъединица, содержащая короткую матричную последовательность РНК,
комплементарную теломерной ДНК. Длина теломеразной РНК колеблется от 150
нуклеотидов у простейших до 1400 у дрожжей и 450 у человека.
На последних этапах удвоения
хромосом теломераза присоединяется к началу обреченного на гибель участка ДНК,
достраивает небольшой отрезок из комплементарных ему нуклеотидов, передвигается
на шаг к концу хромосомы - и так до тех пор, пока не восстановит исходную длину
теломеры. Таким образом, теломераза - это обратная транскриптаза.
Вторую, комплементарную нить
концевого участка ДНК достраивают ДНК-полимераза и остальной комплекс
ферментов, за счет которых происходит удвоение нитей ДНК при делении клетки.
Теломеразная активность необходима для поддержания теломер в пролиферирующих
клетках. У человека это клетки плода, стволовые клетки костного мозга, клетки
семенников, эпидермиса кожи. У растений теломеразная активность обнаружена в
клетках корневой меристемы, сосудистом камбии, в бутонах, т.е. в клетках с
высоким темпом обновления или находящихся в постоянно размножающемся пуле
дифференцирующихся клеток.
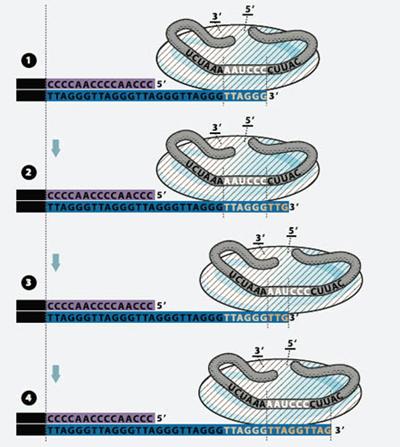
Рисунок 12. Схема работы теломеразы
Клетки имеют систему гомеостаза
теломерной длины, которая включает работу теломеразы и механизм проверки
теломерной длины. В контроле длины теломер участвует белок Rap 1 (у
млекопитающих - TRF1), который специфически
связывается с теломерными повторами. Число молекул данного белка на теломере
является сигналом аппарату регуляции длины теломер. Например, у дрожжей в
теломерах в среднем на каждые 20 оснований TG-последовательности
встречается Rap1 -
связывающий мотив. Rap1, связываясь с крайним повтором,
ограничивает доступ теломеразы к концу хромосомы, следовательно не происходит
удлинения теломерной ДНК. Согласно другому предположению Rap1-белок
прямо взаимодействует с теломеразой и негативно регулирует работу фермента.
Длина теломер является величиной,
характерной для вида. У млекопитающих она колеблется от 5 до нескольких
десятков тпн. Но в некоторых случаях (инбридинг, опухолевая трансформация)
размер теломер может резко изменяться (как увеличиваться, так и уменьшаться).
Длина теломер может изменяться в зависимости от стадии развития. На ячмене
показано, что в процессе развития зародыша теломеры укорачиваются с 75 т.п.н.
до 25 т.п.н.
У дрозофилы и растений семейства
луковичных фермент теломераза отсутствует. У луковичных клетки поддерживают
длину хромосом с помощью механизма рекомбинации. Предполагают, что при этом
используются внутренние TG-участки.
В клетках дрозофилы для удлинения
концов хромосом используется теломерспецифическая транспозиция двух семейств
ретротранспозонов.
Теломеры дрозофилы. В 80-е гг.
было установлено, что в теломерных участках хромосом дрозофилы локализовано
семейство повторов HeT-A. Теломерных
повторов типа TG у дрозофилы
нет. НеТ-А - повторы являются ретротранспозонами типа LINE, которые не
содержат длинных концевых повторов и заканчиваются на 3-конце poly-A-последовательностью.
Концы хромосом представляют собой цепочку мигрирующих элементов, присоединённых
друг к другу с помощью поли-А.
В объеме интерфазного ядра каждое
плечо хромосомы располагается в определенной зоне, объем которой не перекрывает
объем соседних хромосом, хотя они примыкают друг к другу. Каждая из хромосом в
нескольких местах связана с ядерной оболочкой. Все теломерные участки фиксированы
на ядерной мембране на одном полюсе интерфазного ядра; на противоположном
полюсе ядра располагаются (тоже фиксированные на мембране) центромерные районы
хромосом. В последнее время показано, что в нормальных клетках богатые генами
хромосомы располагаются ближе к центру ядра, а бедные генами хромосомы - на
периферии ядра. Область, прилежащая к ядерной оболочке, и области, прилежащие к
конститутивному (н-р, прицентромерному) гетерохроматину, являются в ядре
неактивными компартментами. Простое перемещение генов в эти компартменты
приводит к их долговременной инактивации. Пример: в эритроидных клетках
глобиновые гены располагаются далеко от конститутивного гетерохроматина, тогда
как в неэритроидных клетках они практически контактируют с конститутивным гетерохроматином.
4. Половые хромосомы
Половые хромосомы, в отличие от
аутосом
<#"870758.files/image012.jpg">
Рисунок 13. Карта Х-хромосомы
человека
На стрекозах показано, что форма XY эволюционно
более поздняя, чем ХО. Другая точка зрения - половые хромосомы произошли от
обычной пары аутосом, несущей гены, определяющие пол. Поэтому у одних видов
(более примитивных) Y-хромосома такая же по размерам, как
и Х-хромосома, конъюгирует с ней полностью или частично, участвует в
кроссинговере. А у других видов - она маленькая, с Х-хромосомой соединяется
конец в конец, без кроссинговера. В процессе эволюции Y- хромосома
почему-то теряет активные гены, деградирует и исчезает, потому форма XY
предшествует ХО.
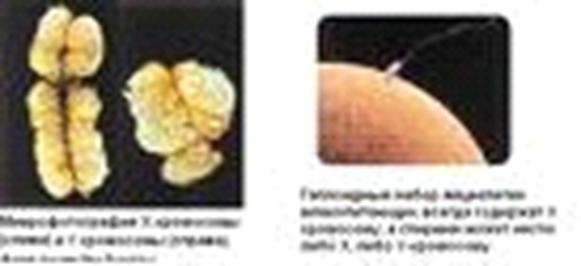
Рисунок 14. Половые хромосомы (Х и Y)
Y-хромосома
Y-хромосома -
самая вариабельная хромосома генома. У человека она генетически почти пустая
(ген волосатости ушей и перепонок между пальцами ног). У других видов может
содержать много активных генов - у гуппи - около 30 Y-генов
окраски самцов (и только 1 аутосомный ген).
Y-хромосома Drosophila. Содержит 9
генов: 6 определяют фертильность самцов, 3 bobbed кластер
генов рРНК. Активность bb генов приводит к
формированию ядрышка. Ядрышкообразующий bb ген есть и
в Х-хромосоме - сайт спаривания Х и Y хромосом -
сайт collohaes.
Ответственными за конъюгацию являются короткие последовательности нуклеотидов
(240 п.н.), расположенные между генами рРНК в Х и Y -
хромосомах. Удаление bb локуса - нет конъюгации
половых хромосом. Ещё один ген - crystal - влияет на
поведение хромосом в мейозе. Его делеция - нарушается расщепление хромосом в
мейозе.
У дрозофилы 6 факторов фертильности
самцов. Из них 3 очень большие - занимают по 10% Y- хромосомы
каждый, т.е. по 4000 т.п.н.
В составе ДНК Y-хромосомы 2
типа последовательностей:
Y -
специфичные - семейства из 200-2000 копий, организованы в кластеры тандемно
повторенных единиц длиной 200-400 п.н. Расположены, вероятно, в петлях.
Y-ассоциированные
(встречаются в других хромосомах).
Y-хромосома человекахромосома
является наименьшей по размеру из 24 хромосом у человека и содержит около 2-3%
ДНК гаплоидного генома, составляя приблизительно 51 Mb. Из всего объема ДНК
Y-хромосомы на данный момент секвенировано 21.8 Mb. Короткое плечо Y-хромосомы
(Yp) содержит примерно 11 Mb, а длинное плечо (Yq) - 40 Mb ДНК, из которых
около 7 Mb приходятся на эухроматиновую часть Yq и около 3 Mb ДНК на
центромерную область хромосомы. Большая часть (~60%) длинного плеча Y-хромосомы
представляет собой функционально неактивный гетерохроматин, имеющий размер
около 24 Mb. В Y-хромосоме выделяют несколько областей: псевдоаутосомные
области (PARs); - эухроматиновую область короткого плеча (Yp11); -
эухроматиновую область проксимальной части длинного плеча (Yq11); -
гетерохроматиновую область дистальной части длинного плеча (Yq12); - область
прицентромерного гетерохроматина.хромосома содержит около 100 функциональных
генов. Из-за наличия на Х и Y-хромосомах (на теломерах)
гомологичных PAR-регионов, половые хромосомы регулярно конъюгируют и
рекомбинируют участками этих регионов в зиготене и пахитене профазы I мейоза.
Однако большая часть (~95%) Y-хромосомы не принимает участия в рекомбинации, и
поэтому называется нерекомбинирующей областью Y-хромосомы (NRY - Non
Recombinant Region Y chromosome).
Гетерохроматиновая область длинного
плеча Y-хромосомы является генетически инертной и содержит различные типы
повторов, в том числе высокоповторяющиеся последовательности двух семейств DYZ1
и DYZ2, каждый из которых представлен приблизительно 5000 и 2000 копиями
соответственно.
На основе сравнительного анализа
генов гоносом X и Y в Y-хромосоме выделяют три группы генов:
1. PAR-гены (PAR - Pseudoautosomal Region;
гены псевдоаутосомных областей PAR1 и PAR2), локализованные в теломерных
областях Y-хромосомы;
2. X-Y гомологичные гены, локализованные в
нерекомбинирующих областях Yp и Yq;
. 3. Y-специфичные гены, расположенные в
нерекомбинирующих областях Yp и Yq.
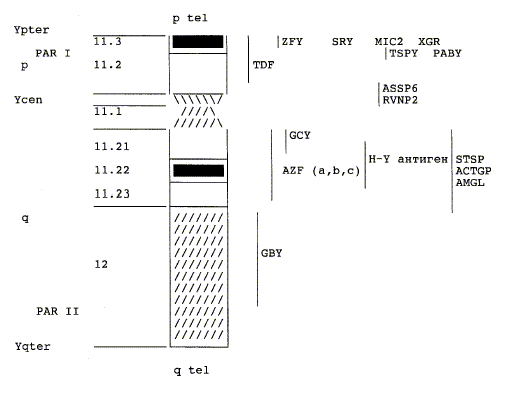
Рисунок 15. Y-хромосома
Первая группа представлена генами
псевдоаутосомных областей (регионов). Они являются идентичными для X- и
Y-хромосом и наследуются как аутосомные гены. PAR1-регион расположен на конце
короткого плеча Y-хромосомы, он больше по размеру, чем PAR2-регион,
локализованный на конце длинного плеча Y-хромосомы, и его размер приблизительно
оценивается в 2,6 Mb. Так как делеции PAR1 приводят к нарушениям конъюгации
гоносом во время мейоза у мужчин и могут привести к мужскому бесплодию,
предполагается, что PAR-регионы имеют существенное значение для нормального
протекания сперматогенеза у мужчин.
Вторая группа генов содержит X-Y-гомологичные,
но не идентичные гены, которые локализованы в нерекомбинирующих районах
Y-хромосомы (на Yp и Yq). В нее включены 10 генов, представленных на
Y-хромосоме одной копией, большинство из них экспрессируются у человека во
многих тканях и органах, включая яички и предстательную железу. До сих пор
неизвестно, являются ли эти X-Y-гомологичные гены функционально
взаимозаменяемыми.
Третью группу генов составляют 11 генов, которые
расположены в нерекомбинирующем районе Y-гоносомы (NRY). Все эти гены, за
исключением гена SRY (Sex-Determining Region Y Chromosome, пол-детерминирующий
регион Y-хромосомы), представленного одной копией, являются мультикопийными, и
их копии расположены на обоих плечах Y-хромосомы. Некоторые из них являются
генами-кандидатами на AZF-фактор (Azoospermia factor, или фактор азооспермии).
О точных функциях большинства этих генов
известно мало. Продукты, кодируемые генами нерекомбинирующего региона
Y-хромосомы, выполняют различные функции, например, среди них имеются факторы
транскрипции, цитокиновые рецепторы, протеинкиназы и фосфатазы, которые могут
влиять на клеточную пролиферацию и/или передачу сигналов в клетке.
На длинном плече Y-хромосомы
расположен AZF (Azoospermia
Factor) локус - содержит
гены, контролирующие процесс дифференцировки половых клеток, т.е.
сперматогенез. В данном локусе выделяют 3 региона - a
(800 т.п.н.), b (3,2 млн пн), c
(3,5 млн. пн). Микроделеции участков данного локуса являются одной из основных
генетических причин мужского бесплодия. Микроделеции длинного плеча Y-хромосомы
обнаруживаются у 11% мужчин с азооспермией и у 8% мужчин с олигозооспермией
тяжелой степени. При делеции всего с-региона AZF
локуса возможно возникновение блока в митозе и мейозе при сперматогенезе; на
гистологических препаратах у таких больных в большинстве семенных канальцев
отсутствуют половые клетки.
Для Y-хромосомы характерны специфические черты,
резко отличающие ее от других хромосом человека: 1) обедненность генами;
) обогащенность повторяющимися блоками
нуклеотидов. Присутствие значительных гетерохроматиновых районов;
) наличие области гомологии с Х-хромосомой - псевдоаутосомальной
области (PAR) (Черных, Курило, 2001).хромосома, как правило, не велика - 2-3%
гаплоидного генома. Тем не менее, кодирующей способности ее ДНК у Homo sapiens
достаточно по крайней мере для нескольких тысяч генов. Однако у этого объекта в
Y-хромосоме выявляется всего около 40 обогащенных ГЦ-парами так называемых
ЦрГ-островков, обычно фланкирующих большинство генов. Реальный же список
генетических функций, связанных с этой хромосомой, вдвое меньше. Фенотипическое
влияние этой хромосомы у мышей ограничено весом тестисов, уровнем тестостерона,
серологического HY-антигена, чувствительностью органов к андрогенам и
сексуальным поведением. Большая часть генов этой хромосомы имеет X-хромосомные
аналоги. Большинство Y-хромосомных последовательностей гомологичны ДНК
Х-хромосомы или аутосом и лишь часть из них строго уникальна.
Наличие псевдоаутосомальных областей,
обеспечивающих мейотическое спаривание и рекомбинацию, обычно рассматривается
как необходимое условие фертильности. Интересно, что размер участка
мейотического спаривания существенно длиннее PAR. У человека имеются два
псевдоаутосомальных района на вершине короткого и длинного плеч Х-хромосомы.
Однако, только для первого из них установлены облигатный обмен в мейозе,
наличие хиазм, влияние на фертильность.
Таким образом, Y-хромосома, единственная в
геноме млекопитающих, не работает непосредственно на реализацию фенотипа. Ее
генетическая значимость связана с преемственностью между поколениями, в
частности с контролем гаметогенеза, первичной детерминацией пола. Жесткий отбор
действует только на немногие ее гены, остальная ДНК более пластична.
5. Эволюция хромосом млекопитающих
Эволюция хромосом осуществляется путем разрыва и
последующего объединения хромосомных фрагментов. Для нормального
функционирования клетки, прохождения клеточных делений на концах хромосом
должны находиться теломерные участки ДНК. Сравнение позиций теломер у разных
видов млекопитающих показало, что позиции теломер чрезвычайно консервативны.
Так, 70% позиций всех теломер, включенных в анализ, консервативны как минимум у
двух видов, а 34 % теломер у мыши и крысы совпадают только у этих двух видов и
не представлены у других животных. С другой стороны, более длительный
эволюционный период, разделяющий собаку и кошку, является причиной того, что
менее 5% теломер сохраняют одинаковые позиции только у этих двух видов. Однако
около 50% всех теломер у хищных и парнокопытных совпадают с позициями теломер у
представителей других отрядов. Данные литературы показывают, что случаи
объединения хромосом путем слияния двух предковых теломер чрезвычайно редки.
Так, единственным случаем подобного объединения у человека является
формирование HSA2 путем теломерного слияния двух предковых хромосом приматов,
соответствующих хромосомам 12 и 13 у шимпанзе. В противоположность теломерам
центромеры оказались динамично меняющимися структурами даже в пределах одного
отряда. 39 % всех центромер уникальны для одного вида млекопитающих. Таким
образом, теломеры хромосом оказались чрезвычайно консервативными формированиями
по сравнению с позициями центромер, которые эволюционируют чрезвычайно
динамично.
Позиции предковых центромер использовались
многократно и независимо при возникновении хромосомных перестроек в разных
геномах. При этом новые центромеры формировались либо в местах обрыва старой,
либо разрыв происходил не по центромере, а сразу после нее и тогда предковая
центромера сохранялась на конце одного из вновь образовавшихся фрагментов.
Цитогенетический анализ хромосомной эволюции
показал, что дивергенция кариотипов животных происходит в основном за счет пара-
и перицентрических инверсий, изменяющих порядок генов в группах сцепления.
Например, геномы таких далеких видов, как человек, мышь, дрозофила, малярийный
комар, различаются прежде всего изменением порядка генов в группах сцепления, а
не числом и спектром генов.
Одной из интереснейших проблем современной
геномики млекопитающих является вопрос о том, насколько случайны места
хромосомных разрывов, происходящих в эволюции хромосом млекопитающих. Начиная с
1984 г. общепризнанной считалась гипотеза, выдвинутая Нодье и Тэйлором, о том,
что разрывы в хромосомах располагаются случайным образом. Подобное положение
вещей сохранялось до 2002 г., когда был полностью расшифрован второй геном
млекопитающих - геном мыши. Было проведено полное сравнение геномов двух млекопитающих
- человека и мыши и была поставлена под сомнение теория случайности положения
хромосомных разрывов. Певзнер и Теслер объяснили полученный феномен
присутствием в хромосомах млекопитающих «ломких» мест (fragile sites), которые
могут многократно вовлекаться в негомологичные хромосомные обмены и
формирование новых хромосом в ходе эволюции. При этом, каждый раз повторяясь,
хромосомный разрыв происходит в одном и том же районе хромосомы, но не
обязательно после одного и того же нуклеотида.
Геномные карты 7 видов млекопитающих,
представляющих 5 отрядов плацентарных млекопитающих, были выбраны для
сравнительного исследования геномов. Три из этих геномов, а именно: геномы
человека, мыши и крысы - были полностью расшифрованы и могли быть
проанализированы с наибольшей степенью разрешения. При анализе использовали
эволюционные взаимоотношения видов млекопитающих. Так, корова и свинья -
представители одного отряда Cetartiodactyla - дивергировали около 60 млн лет
назад, кошка и собака - представители отряда Carnivora - разделились около 55
млн лет назад. Отряды Cetartiodactyla и Carnivora вместе с отрядом
Perissodactyla формируют надотряд Ferungulata, разделившийся на 3 отряда около
85 млн лет на зад. Согласно этому эволюционному дереву, хромосомная
перестройка, которая отличает только один вид млекопитающих от всех других
видов, произошла после отделения этого вида от общего предка с другим самым
близким в эволюционном плане видом и может считаться видоспецифичной. Например,
хромосомная перестройка, обнаруженная в геноме коровы, но не найденная в геноме
свиньи, произошла после разделения Suidae и Bovidae. С другой стороны,
перестройка, обнаруженная у всех представителей одного и того же отряда,
произошла до их разделения и может быть классифицирована как отрядоспецифичная.
Таким образом, могут быть классифицированы хромосомные перестройки,
обнаруженные у всех представителей отрядов, объединенных недавним общим
предком. Такие перестройки были классифицированы как надотрядные. Вместе с тем
был обнаружен класс видо- и отрядоспецифичных хромосомных разрывов, которые
были представлены у двух и более видов млекопитающих из разных групп, которые
не имели недавнего общего предка.
Кариотипы разных видов в пределах одного отряда
перестраиваются с разной скоростью. Так, геномы коровы и собаки перестроены
значительно сильнее, чем геномы свиньи и кошки. В то же время геном мышевидных
грызунов содержит в 15 раз больше хромосомных перестроек, чем геномы остальных
млекопитающих. Причем 150 из этих разрывов отрядоспецифичны, и только 30-35
были найдены в одном из геномов и не найдены во втором. Геном человека содержит
умеренное количество хромосомных разрывов, показывая его близость к предковому
геному плацентарных млекопитающих. До 20% эволюционных хромосомных разрывов
происходит независимо в одних и тех же районах предковых хромосом
млекопитающих.
Анализ скорости эволюции хромосом млекопитающих
показал увеличение скорости хромосомных перестроек в геномах млекопитающих
около 65 млн лет назад. Этот период совпадает с вымиранием динозавров. Можно
предположить, что для освоения новых экологических ниш, прежде занятых
рептилиями, млекопитающие адаптировали геномы, и, по-видимому, эта адаптация
связана с реорганизацией хромосом. С одной стороны, дупликации генов приводили
к формированию новых функциональных генов. С другой стороны, хромосомные
перестройки могли служить средством изоляции недавно разошедшихся видов и в
конечном итоге закрепляли результаты видообразования. Таким образом, ряд
хромосомных перестроек мог иметь адаптационное значение для приспосабливания
генома к новым условиям среды обитания, в то время как другие перестройки могли
быть функционально нейтральными, но при этом способствовать закреплению
изоляции нового вида животных.
6. Номенклатура хромосом человека
Согласно последней номенклатуре такие
морфологические признаки хромосомы, как теломера и центромера, специфические
полосы, используются в качестве сравнительных знаков. В хромосоме выделяют
короткое и длинное плечо, которые обозначаются буквами “р” и “q”, соответственно,
а в каждом плече выделяют районы, которые пронумерованы последовательно от
центромеры к теломере. В каждом районе хромосом полосы и сегменты нумерованы
также последовательно в таком же направлении - от центромеры к теломере. Когда
исследователям необходимо обозначить какой-либо участок при описании аномалии
хромосом, то вначале пишут номер хромосомы, затем символ плеча (р или q), номер
района и номер полосы (или сегмента) хромосомы. Например, запись - 6q 23
указывает на то, что это хромосома 6, длинное плечо, район 2, полоса (или
сегмент) 3. В ряде случаев при особом способе окрашивания хромосом
(высокоразрешающем методе) исследователи могут наблюдать и разделение сегмента
на подсегменты, которые также необходимо указывать при описании кариотипа
больного. Например, запись - 16q11.2 говорит о том, что аномалия затрагивает
хромосому 16, длинное плечо, район 1, сегмент 1, подсегмент 2. Районы и
сегменты на хромосомах проявляются после дифференциального окрашивания хромосом
различными методами, которые также следует указывать при описании хромосомных
аномалий.
Кроме того, в номенклатуре существует
определенная символика для описания всех типов хромосомных аномалий. Так
структурные аномалии типа делеций, дупликаций, инверсий, инсерций и
транслокаций обозначаются как del, dup, inv, ins и t, соответственно. Ломкость
и маркерные хромосомы в кариотипе обозначаются как fra и mar, соответственно, а
кольцевая хромосома - r. При рассуждении о происхождении различных аномалий
хромосом, в том числе и маркерных, применяют обозначение der (derivate -
происхождение). Численные аномалии обозначаются измененным числом хромосом в
кариотипе и указанием (+) или (-) той или иной присутствующей или отсутствующей
хромосомы (исключением являются половые хромосомы, при количественных аномалиях
которых (+) или (-) никогда не ставится). Так например, синдром Дауна в
цитогенетической номенклатуре записывается как 47,ХХ,+21 (девочка) и 47,ХУ,+21
(мальчик), а синдром Клайнфельтера 47,ХХУ. Причем, отсутствие одного из
гомологов хромосом или его части в кариотипе, несмотря на тип аберрации
(численной или структурной), носит название моносомии (полной или частичной), а
присутствие - трисомии (полной или частичной). Полиплоидии отражаются только
числом хромосом. При мозаицизме обозначают каждый аномальный и нормальный клон
клеток, после которого записывают число метафазных пластинок с данным
кариотипом. Так например, запись кариотипа 47,ХХ,+21[60]/46,ХХ[40] говорит о
том, что у девочки с мозаичной формой синдрома Дауна при анализе 100 клеток
обнаружено 40 клеток с нормальным женским кариотипом и 60 клеток с регулярной
трисомией по хромосоме 21.
хромосома теломераза кариотип
Литература
1. Айала Ф., Кайгер Дж.
Современная генетика: В 3 т. - М.: Мир, 2006 - 2007.
. Биология: В 2 кн. / В.Н.
Ярыгин, В.И. Васильева, И.Н. Волков, В.В. Синельщикова. - М.: Высш. шк., 2011.
. Бочков И.П. Клиническая
генетика. - М.: Изд. дом "ГЭОТАР-МЕД", 2011.
. Генетика в акушерстве и
гинекологии / Дж. Симпсон, М. Голбус, Э. Мартин, Г. Сарто. - М.: Медицина,
2005.
. Льюин Б. Гены. - М.: Мир,
2007.
. Молекулярная биология
клетки: В 5 т. / Б. Альберте, Д. Брей, Дж.Льюис. - М.: Мир, 1986, 2007.
. Мутовин Г. Р. Основы
клинической генетики. - М.: Высш. шк., 2011.
. Наследственная патология
человека: В 2 т. / Под ред. Ю.Е. Вельтищева, Н.П. Бочкова. - М.: Медицина,
2012.
. Наследственные синдромы и
медико-генетическое консультирование / С.И. Козлова, Н.С. Демикова, Е.
Семанова, О.Е. Блинникова. - М.: Практика, 2006.
. Пехов А.П. Биология с
основами экологии. - СПб.: Лань, 2011.
. Смирнов В.Г. Цитогенетика:
Учебник для вузов. - М.: Высш. шк., 2011.
. Уотсон Дж., Туз Дж., Курц
Д. Рекомбинантные ДНК. - М.: Мир, 2006.
. Фогель Ф., Мотульски А.
Генетика человека: В 3 т. - М.: Мир, 2009